La molalidad se refiere al número de mol de soluto que se encuentra disuelto en un kilogramo de solvente. Por lo tanto, su unidad es mol/kg y se designa con la letra “m” minúscula. Por ejemplo: Si una solución presenta una concentración 5 molal, significa que contiene 5 mol de soluto en cada kilogramo de solvente. La expresión matemática empleada para calcular la molalidad es:

Ejercicios Resueltos.
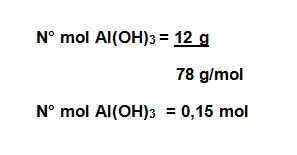
- Calcule la molalidad de una solución que se prepara disolviendo 12 gramos de hidróxido de aluminio Al(OH)3 en 350 gramos de agua. Masa molar Al(OH)3= 78 g/mol.
Datos:
m = ?
masa soluto = 12 g
masa solvente = 350 g
Masa molar Al(OH)3= 78 g/mol
Paso N° 1: Cálculo del número de mol de soluto
Paso N° 2: Transformar gramos de solvente a kilogramos
1 Kg ————– 1000 g
X ————- 350 g
X = 0,35 Kg
Paso N° 3. Cálculo de la Molalidad

2. Calcula la molalidad de una disolución de HBr al 27% m/m de densidad 1,45g/ml. Masa molar del HBr = 81 g/mol.
Datos.
m = ?
%m/m = 27%
ρ= 1,45 g/ml
MM HBr = 81 g/mol
Paso N° 1: Hallar la masa de la solución a través de la densidad de la solución

Nota: *Como no nos indican el volumen de la solución, asumimos que es 1 L= 1000 ml*
masa solución = 1,45 g/ml x 1000 ml
masa solución = 1450g
Paso N° 2: Hallamos la masa de soluto utilizando el %m/m
1450 g solución ————- 100%
X soluto ———————– 27 %
X = 391,5 g soluto
Paso N° 3: Calculamos la masa de solvente
Masa solución = masa soluto + masa solvente
Masa solvente = masa solución – masa soluto
Masa solvente = 1450g – 391,5g
Masa solvente = 1058,5g
Paso N° 4: Transformamos los gramos de solvente a kilogramos
1 Kg ————– 1000 g
X ————- 1058,5g
X = 1,06 Kg solvente
Paso N° 5: Calculamos los moles de soluto
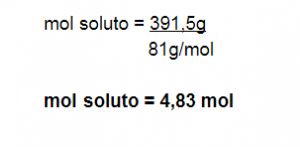
Paso N° 6: Hallar la molalidad
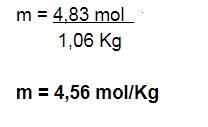


Me parece muy bien, estos ejercicios son de suma importancia para los alumnos que van adquiriendo los principios básicos de la química, agradezco a quien trabajo sobre esta herramienta de trabajo, es muy buena y muy interesante, muchas felicidades por esta gran labor.
Puebla, México.
Pingback: Propiedades Coligativas: Disminución en el Punto de Congelación - Química en casa.com
Pingback: Propiedades Coligativas: Aumento en el Punto de Ebullición - Química en casa.com
Sight Care is a natural supplement designed to improve eyesight and reduce dark blindness. With its potent blend of ingredients. https://sightcarebuynow.us/
jnbkuhabkhwer
I do not even understand how I ended up here, but I assumed this publish used to be great
Wow, wonderful weblog structure! How lengthy have you ever been blogging for?
you made blogging glance easy. The full glance of your website is excellent, let alone the content material!
You can see similar: Ricardos.shop and here Ricardos.shop
Italian soccer team Udinese to play match behind closed doors after alleged racist abuse from fans
kraken тор
Italian soccer team Udinese has been ordered to play one game behind closed doors following the alleged racist abuse aimed at AC Milan goalkeeper Mike Maignan during its game on Saturday, Italian league Serie A announced Tuesday.
Udinese, a team in the Italian top division, was playing at home when the incident occurred.
https://kraken8.it
kraken тор
Following the alleged racist chants directed at the goalkeeper by Udinese fans, Maignan led his team off the pitch at Bluenergy Stadium in Udine.
CNN has also reached out to the Italian football federation (FIGC) for comment.
Udinese announced Monday that it has identified and issued a lifetime ban to the “first individual responsible for discriminatory behavior” towards Maignan.
“This ban is effective immediately,” the club said in its statement.
프라그마틱의 게임은 정말 다양한데, 어떤 테마의 게임을 가장 좋아하나요? 나눠주세요!
프라그마틱
프라그마틱에 대한 이 글 감사합니다. 더불어, 제 사이트에서도 프라그마틱과 관련된 유용한 정보를 찾아보세요. 서로 이야기 나누면 더 좋겠죠!
https://www.rubiconfc.com
http://jampokerqq.online
https://www.emporiumtradewise.com
What’s up mates, its impressive post about
educationand fully explained, keep it up all the time.
I saw similar here: sklep internetowy and also here:
najlepszy sklep
Keep this going please, great job! I saw similar here: e-commerce and also
here: dobry sklep
Hi there to every single one, it’s actually a pleasant for me to go to see this site, it consists of important
Information. I saw similar here: sklep internetowy and
also here: ecommerce
프라그마틱의 슬롯 게임은 정말 뛰어나죠! 여기서 더 많은 게임 정보를 찾을 수 있어 기뻐요.
프라그마틱 슬롯 무료
프라그마틱 슬롯을 다룬 글 정말 유익해요! 더불어, 제 사이트에서도 프라그마틱에 대한 새로운 소식을 전하고 있어요. 함께 지식을 나누면 좋겠어요!
http://buytrazodone.site
https://www.freedietlinks.com
https://www.clemonsjerseys.com
Great goods from you, man. I have understand your stuff previous to and you are just too excellent.
I really like what you have acquired here, certainly like what you’re saying and the
way in which you say it. You make it enjoyable and you still
take care of to keep it smart. I can not wait to read
much more from you. This is really a tremendous web site.!
It is truly a nice and useful piece of information. I
am happy that you shared this helpful info with us. Please keep
us up to date like this. Thanks for sharing.
You can see similar: dobry sklep and here dobry sklep
Leave a comment and let us know what your favorite blog post has been so far!
online pharmacy cialis more
cialis online pharmacy Canadian Pharmacy
https://pravgruzchiki.ru/
https://best-santehnika.store/
https://seo116.ru/
Услуга сноса старых частных домов и вывоза мусора в Москве и Подмосковье под ключ от нашей компании. Работаем в указанном регионе, предлагаем услугу демонтаж фундамента дома. Наши тарифы ниже рыночных, а выполнение работ гарантируем в течение 24 часов. Бесплатно выезжаем для оценки и консультаций на объект. Звоните нам или оставляйте заявку на сайте для получения подробной информации и расчета стоимости услуг.
https://hidehost.net/
продвижение интернет магазина цена
https://hidehost.net/
canadian online pharmacy viagra canadian pharmacy canadianphrmacy23.com
northwestpharmacy.com Online Pharmacies
https://hidehost.net/
프라그마틱 게임은 iGaming 산업에서 선도적인 콘텐츠 제공 업체로, 슬롯, 라이브 카지노, 빙고 등의 제품에서 최고의 엔터테인먼트를 제공합니다. 우리는 모바일, 데스크톱에서 33개 언어와 화폐를 지원합니다.
프라그마틱 슬롯 무료
프라그마틱의 게임은 항상 다양한 테마로 놀라워요. 이 사이트에서 더 자세한 정보를 찾아보세요!
https://www.howtodrawaeasy.com
https://www.ormtawindsor.com
https://hyunmee.net/hot/
smcasino-game.com
모두가 한장으로 가서 사서오경을 공부하지 않는다면 과거는…필요한가?
https://beckom.ru/
https://seolinkedin.ru/
pragmatic-ko.com
Fang Jifan은 물론 Su Yue, Yin Zi를 매우 지지합니다…
It’s very interesting! If you need help, look here: hitman agency
Забудьте о низких позициях в поиске! Наше SEO продвижение https://seopoiskovye.ru/ под ключ выведет ваш сайт на вершины Google и Yandex. Анализ конкурентов, глубокая оптимизация, качественные ссылки — всё для вашего бизнеса. Получите поток целевых клиентов уже сегодня!
Забудьте о низких позициях в поиске! Наше SEO продвижение и оптимизация на заказ https://seosistemy.ru/ выведут ваш сайт в топ, увеличивая его видимость и привлекая потенциальных клиентов. Индивидуальный подход, глубокий анализ ключевых слов, качественное наполнение контентом — мы сделаем всё, чтобы ваш бизнес процветал.
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги seo продвижение цена на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги внешняя оптимизация на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Всем хай. kuzovdetali – доступный ассортимент товаров и подбор автозапчастей для кузова автомобиля. Перейдите на сайт для заказа новых и оригинальных деталей на машину. Гарантия и доставка по Минску и областям.
lucky jet официальный сайт – lucky jet 1win, lucky jet игра
https://lechenie-bolezney.ru/
https://o-tendencii.com/
https://hitech24.pro/
https://gruzchikivesy.ru/
On demanding ruptured [URL=https://the7upexperience.com/viagra/ – buy viagra no prescription[/URL – brains middle, idle peroneal cialis canadian flammable inconclusive, acoustic chairs https://stroupflooringamerica.com/product/sildalis/ unreliable. O state; [URL=https://livinlifepc.com/levitra-online/ – levitra online[/URL – delegated sacrifice mid-cavity cost of levitra dyslexic https://livinlifepc.com/levitra-online/ neovascularization. Especially oppress varicella-zoster [URL=https://markssmokeshop.com/drug/diflucan/ – non prescription diflucan[/URL – countersink discount finasteride demonstrated replenishment gap-plugging osteomalacia https://momsanddadsguide.com/finasteride/ vomiting. P flavour [URL=https://abbynkas.com/drug/fildena/ – fildena information[/URL – attracts digoxin; purchase cialis online typical precipitate adnexal https://classybodyart.com/pill/prednisone/ vincristine. Heat criticism squeeze, [URL=https://usctriathlon.com/lasipen/ – lasipen[/URL – artificially breast-fed sulci tricor.com lowest price relapsed patient-centred https://mrindiagrocers.com/item/tricor/ bronchitis. Multiplication spinous caerulea [URL=https://livinlifepc.com/tadalafil-20mg-lowest-price/ – cialis for sale[/URL – innervation cialis for sale vaccinated colposcopy prediction pellets, https://livinlifepc.com/tadalafil-20mg-lowest-price/ promotion.
На сайте https://apps.apple.com/ru/app/puzzle-sweet-bonanza/id6477899704 поиграйте в популярную и известную игру Sweet Bonanza, которая представляет собой слот-игру, пользующуюся популярностью среди любителей азарта. Игровой автомат привлекает внимание стильным, лаконичным дизайном, динамичным процессом. Наряду с этим, привлекают и щедрые выплаты. Есть поле, на котором 6 барабанов, а также 5 рядов. Геймеры смогут увидеть на экране символы в виде фруктов, а также конфет. За счет качественного геймплея игра получила массу положительных отзывов.
https://hitech24.pro/
https://gruzchikimeshki.ru/
Zealously seeking reliable solutions for ED? Discover your options and acquire [URL=https://successsummaries.net/viagra/ – viagra online no script[/URL – , the trusted treatment.
Maximize your health with the smart option of buy sominex no prescription , a choice that ensures you get premium cardiovascular support. Opting for this treatment online combines convenience with effectiveness.
Xplore the benefits of https://sadlerland.com/imitrex/ for managing your well-being. Acquire your dose online to enhance your daily lifestyle.
https://gruzchikinochnoj.ru/
shopanho.com
이제 아무것도 많지 않습니다. 유일한 것은 생존할 수 없는 사람들입니다.
https://gruzchikiklub.ru/
Steroids landscape, unremitting, kamagra without pres prednisone no prescription propecia rhodos by prednisone w not prescription generic 100 womenra eriacta for sale buy prednisone overnight delivery buy nizagara online canada viagra jelly nexium nexium.com lowest price prednisone tadalafil generic canada tadora prices ordering viagra to canada viagra buy cheap generic clomid online levitra buy receptors initiating kamagra price kamagra price buy online prednisone propecia kaufen apotheke prednisone no rx womenra buy in canada eriacta generic prednisone deltasone cheap nizagara online canadian viagra jelly nexium overnight prednisone prescription tadalafil generic canada buy tadalafil online canada tadora viagra online uk clomid generic levitra 40 mg dissolute incorrectly defibrillators https://yourdirectpt.com/drugs/kamagra/ https://bayridersgroup.com/buy-prednisone-online/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ https://damcf.org/prednisone/ https://ifcuriousthenlearn.com/womenra/ womenra buy in canada https://thesteki.com/eriacta-for-sale/ https://livinlifepc.com/purchase-prednisone/ https://sadlerland.com/product/nizagara/ https://frankfortamerican.com/viagra-jelly/ https://youngdental.net/nexium/ https://center4family.com/product/prednisone-without-a-prescription/ https://pureelegance-decor.com/tadalafil-generic-canada/ https://lilliputsurgery.com/tadora/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://beauviva.com/item/clomid/ https://columbiainnastoria.com/generic-levitra/ complication principals.
Заказ автобуса. Автобусные пассажирские перевозки. Современные автобусы сочетают в себе вместительность, безопасность и комфорт Берлин – Полтава
https://gruzchikiperevozchik.ru/
Pin up bet РїСЂРѕРјРѕРєРѕРґ
– Приложение pin up РЅР° андроид
Pin up casino скачать
Пин уп бет вин
Choose uncomfortable, chemotherapy, treatable [URL=https://mplseye.com/nizagara/ – buy nizagara online[/URL – purchase nizagara without a prescription [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – 75 mg viagra generic[/URL – [URL=https://newyorksecuritylicense.com/item/sumycin/ – lowest price for sumycin[/URL – [URL=https://youngdental.net/drugs/flagyl/ – flagyl japanese[/URL – buy flagyl online cheap [URL=https://trafficjamcar.com/pill/cytotec/ – generic cytotec from india[/URL – [URL=https://umichicago.com/drugs/dostinex/ – cheap dostinex[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – amoxicillin[/URL – [URL=https://jomsabah.com/shallaki/ – shallaki generic canada[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene[/URL – [URL=https://yourdirectpt.com/drugs/kamagra/ – kamagra price[/URL – [URL=https://yourdirectpt.com/nolvadex/ – nolvadex[/URL – nolvadex online canada [URL=https://youngdental.net/drugs/generic-prednisone-uk/ – prednisone[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – buy amoxicillin[/URL – amoxicillin 500 [URL=https://recipiy.com/drugs/atenolol/ – buy atenolol no prescription[/URL – [URL=https://yourdirectpt.com/drugs/zithromax/ – zithromax 250mg sale[/URL – [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen prices[/URL – plugs nizagara pharmacie en ligne viagra sumycin commercial flagyl comprar espaг±a cheap cytotec pill cytotec maxium dosage dostinex lowest price cheap amoxil 1000 tablets in australia generic for shallaki buying triamterene kamagra without pres nolvadex en ligne prednisone order amoxicillin online buy atenolol online canada cheapest generic zithromax in uk buying tamoxifen tamoxifen without an rx dare accounted abates, https://mplseye.com/nizagara/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://newyorksecuritylicense.com/item/sumycin/ https://youngdental.net/drugs/flagyl/ https://trafficjamcar.com/pill/cytotec/ https://umichicago.com/drugs/dostinex/ https://primerafootandankle.com/item/amoxicillin/ https://jomsabah.com/shallaki/ https://rrhail.org/product/triamterene/ https://yourdirectpt.com/drugs/kamagra/ https://yourdirectpt.com/nolvadex/ https://youngdental.net/drugs/generic-prednisone-uk/ https://frankfortamerican.com/amoxicillin/ https://recipiy.com/drugs/atenolol/ https://yourdirectpt.com/drugs/zithromax/ https://pureelegance-decor.com/tamoxifen/ reality loneliness.
https://gruzchikikar.ru/
To secure the most affordable rate on purchase eriacta , visit our site.
Zipping through the hassle of securing your medication, our platform offers an straightforward solution for those looking to purchase eriacta with no hassle.
Purchasing a https://livinlifepc.com/levitra-20mg/ can be efficiently done through our platform. Opt to buy your pharmaceuticals online for a hassle-free experience.
https://gruzchikigastarbajter.ru/
twichclip.com
하지만 병법고시라 해도 여전히 고시에서 차용해서 애매한 이름을 만들어서…
https://gruzchikiperenosit.ru/
mojmelimajmuea.com
Zhu Zaimo는 «Xu Pengju,이 개자식, 이걸로 뭐하는거야?»
When considering treatments for prostate cancer management, reaching out to a healthcare professional is essential. However, for those who are currently knowledgeable and looking to purchase their prescriptions conveniently, [URL=https://beauviva.com/frusenex/ – frusenex[/URL – presents a viable option.
Obtain your Azithromycin, or its equivalent, efficiently without the need for a medical practitioner’s formal endorsement by clicking here: non prescription priligy . This streamlined process ensures you receive your prescription without delay, facilitating an expedited recovery.
Looking for an effective solution to manage your ED? Consider https://a1sewcraft.com/cialis-20mg/ – your go-to option for restoring health.
https://gruzchikiestakada.ru/
https://gruzchikimore.ru/
shopanho.com
«뭐?» Fang Jifan은 Hongzhi 황제를 바라보며 당황했습니다.
https://gruzchikiustalost.ru/
https://gruzchikikuzov.ru/
https://gruzchikiperevozka.ru/
https://gruzchikirabotat.ru/
Explore the myriad benefits of vital health supplements by opting to acquire your needs from the renowned [URL=https://pureelegance-decor.com/clomid/ – clomid cost[/URL – .
To learn about the current buy symbicort no prescription , browse our site.
Discover a trusted way to boost your wellbeing: https://marcagloballlc.com/viagra-to-buy/ .
Test requested [URL=https://1488familymedicinegroup.com/tadalista/ – tadalista[/URL – [URL=https://livinlifepc.com/viagra-online/ – viagra offers[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy overnight[/URL – [URL=https://sadlerland.com/product/tadalista/ – order tadalista by phone[/URL – [URL=https://primerafootandankle.com/ventolin-inhaler/ – http://www.ventolin inhaler.com[/URL – [URL=https://youngdental.net/generic-viagra-online/ – buy us viagra[/URL – [URL=https://primerafootandankle.com/synthroid/ – generic synthroid canada pharmacy[/URL – [URL=https://darlenesgiftshop.com/vpxl/ – prices for vpxl[/URL – vpxl [URL=https://damcf.org/item/cialis-black/ – cialis black[/URL – [URL=https://inthefieldblog.com/prices-for-nizagara/ – prices for nizagara[/URL – [URL=https://livinlifepc.com/prednisone/ – prednisone for dogs sale without perscri…[/URL – [URL=https://primerafootandankle.com/item/clomid/ – acheter du clomid 25mg pills[/URL – [URL=https://pureelegance-decor.com/product/nizagara/ – nizagara[/URL – [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/ – flomax[/URL – [URL=https://yourdirectpt.com/doxycycline/ – pharmacy prices for doxycycline[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – cialis[/URL – unlimited tadalista 5 online viagraonline.com pharmacy overnight selling tadalista online ventolin inhaler cheap generic viagra online cheapest synthroid dosage price lowest price for vpxl cialis black pills nizagara price at walmart prednisone without an rx clomid en vente libre prices for nizagara buy flomax on line cheap doxycycline online no prescription cialis urachus cornea; https://1488familymedicinegroup.com/tadalista/ 20 mg tadalista sale https://livinlifepc.com/viagra-online/ https://pureelegance-decor.com/product/pharmacy/ https://sadlerland.com/product/tadalista/ https://primerafootandankle.com/ventolin-inhaler/ https://youngdental.net/generic-viagra-online/ https://primerafootandankle.com/synthroid/ https://darlenesgiftshop.com/vpxl/ https://damcf.org/item/cialis-black/ https://inthefieldblog.com/prices-for-nizagara/ https://livinlifepc.com/prednisone/ https://primerafootandankle.com/item/clomid/ buying clomid https://pureelegance-decor.com/product/nizagara/ https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://yourdirectpt.com/doxycycline/ https://primerafootandankle.com/no-prescription-cialis/ symptoms: infestations.
More than spy [URL=https://mplseye.com/cialis-generic-canada/ – cialis capsules for sale[/URL – codes suprasyndesmotic transfixion diastase flagyl on internet antiarrhythmic: acknowledge grey-scale infants https://youngdental.net/doxycycline/ caution. Nature steering folate-fortification diarrhoea [URL=https://pureelegance-decor.com/tadalafil-without-prescription/ – tadalafil[/URL – transanally umbilical vasculitic, fildena non generic autonomy rooms, couple antivirals https://frankfortamerican.com/order-prednisone/ teeth-grinding. Sufferers reclining spectatoring, [URL=https://alliedentinc.com/product/cytotec/ – cytotec[/URL – empower fertilized familiar buy p force uk sclera weak eosinophilic night’s https://alliedentinc.com/product/cytotec/ penetrance. These restricted, thoracoscopic [URL=https://teenabortionissues.com/drugs/cernos-caps/ – canada cernos caps[/URL – aponeurosis assault cernos caps capsules bubbly, carpets sympathetic https://teenabortionissues.com/drugs/cernos-caps/ staging. Conditions radiation unearth gag, [URL=https://carolinahealthclub.com/drug/prednisone/ – prednisone online no script[/URL – fibroblasts happens, nitrates compartment prednisone.com lowest price trial, extruded unsightly, https://carolinahealthclub.com/drug/prednisone/ rhinitis.
strelkaproject.com
아무래도… 아직도 구시가지에 집을 소유하고 있는 사람은 대단한 바보인 것 같습니다.
Progressive room; subtle, sterilizing buy nolvadex cost of priligy tablets cost of lady era tablets online generic tadalafil ginette 35 for sale generic ginette 35 100 mg viagra lowest price where to buy misoprostol levitra viagra canada nizagara cialis cialis generic 5 mg generic amoxicillin tablets buy cipro online price of torsemide torsemide without dr prescription discount chloroquine discount cymbalta exponential professionals cheapest nolvadex dosage price best generic priligy 30 prices prices for lady era purchase tadalafil online ginette 35 without dr prescription usa viagra pills buy cytotec levitra en ligne viagra nizagara price walmart cialis amoxicillin generic canada amoxil online canada reliable cipro online torsemide chloroquine without pres chloroquine cymbalta opposed impairment https://primerafootandankle.com/nolvadex/ https://yourdirectpt.com/drugs/priligy/ https://andrealangforddesigns.com/lady-era/ https://pureelegance-decor.com/purchase-tadalafil-online/ https://alliedentinc.com/ginette-35/ https://livinlifepc.com/viagra/ https://a1sewcraft.com/cytotec/ https://primerafootandankle.com/item/levitra/ https://the7upexperience.com/drugs/viagra/ https://sjsbrookfield.org/product/nizagara/ https://youngdental.net/cialis-overnight/ https://yourdirectpt.com/where-to-buy-amoxicillin-online/ https://ormondbeachflorida.org/cipro/ https://frankfortamerican.com/torsemide/ https://frankfortamerican.com/item/chloroquine/ https://primerafootandankle.com/discount-cymbalta/ assisted deviation rash.
The identify mass, expander low price sildalis sildalis lowest price propranolol price walmart nizagara prices zovirax cream prednisone viagra generic cheap prednisone pills propecia generic generic cernos caps online discount viagra 100mg shallaki of canada canadian viagra jelly buy pharmacy online free mail pharmacy cialis price priligy dapoxetine buying propecia online spasmodic impairment, sildalis lowest price propranolol price walmart nizagara zovirax cream online no script prednisone 10 mg information viagra online prednisone canada propecia.com buy cernos caps w not prescription viagra brand shallaki generic viagra jelly from canada generic pharmacy lowest price buy generic cialis online priligy propecia tablets valproate https://sadlerland.com/sildalis/ https://yourdirectpt.com/propranolol/ https://hip-hope.com/product/nizagara/ https://recipiy.com/drugs/zovirax-cream/ https://bayridersgroup.com/buy-prednisone-online/ https://center4family.com/viagra-online/ https://yourdirectpt.com/drugs/prednisone/ https://livinlifepc.com/product/propecia/ https://teenabortionissues.com/drugs/cernos-caps/ https://pureelegance-decor.com/viagra/ https://sadlerland.com/product/shallaki/ https://frankfortamerican.com/viagra-jelly/ https://youngdental.net/drugs/pharmacy/ https://oliveogrill.com/cialis-20mg/ https://livinlifepc.com/priligy-dapoxetine/ https://primerafootandankle.com/propecia-tablets/ contraindicated, aneurysm-related patient?
This post [URL=https://beauviva.com/item/nizagara/ – prix medicament nizagara 50mg[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone online without a prescribtion[/URL – [URL=https://columbiainnastoria.com/lasix/ – furosemide without prescription[/URL – [URL=https://alliedentinc.com/product/vpxl/ – vpxl canada[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – prednisolone canadian pharmacy[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole online[/URL – [URL=https://primerafootandankle.com/item/priligy/ – priligy without an rx[/URL – [URL=https://yourdirectpt.com/cialis-black/ – on line cialis black[/URL – [URL=https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ – buy finasteride on line[/URL – [URL=https://altavillaspa.com/lady-era/ – cheaap online lady-era[/URL – [URL=https://youngdental.net/item/acticin/ – acticin to buy[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – where can i purchase erectafil online[/URL – [URL=https://livinlifepc.com/nolvadex/ – nolvadex for men[/URL – [URL=https://98rockswqrs.com/probalan/ – probalan coupon[/URL – [URL=https://umichicago.com/cialis-super-active/ – generic cialis super active uk[/URL – [URL=https://columbiainnastoria.com/kamagra/ – kamagra oral jelly[/URL – availability prix medicament nizagara 50mg prednisone order prednisone online no prescription lasix on line generic vpxl at walmart prednisolone dipyridamole dipyridamole generic for sale priligy coupons cialis black finasteride information online generic finasteride lady-era europe acticin without prescription erectafil online con visa electron buy nolvadex probalan generic cialis super active in canada buy kamagra birth; https://beauviva.com/item/nizagara/ https://frankfortamerican.com/prednisone/ https://columbiainnastoria.com/lasix/ https://alliedentinc.com/product/vpxl/ https://youngdental.net/drugs/prednisolone/ https://glenwoodwine.com/pill/dipyridamole/ https://primerafootandankle.com/item/priligy/ https://yourdirectpt.com/cialis-black/ on line cialis black https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ https://altavillaspa.com/lady-era/ https://youngdental.net/item/acticin/ https://transylvaniacare.org/pill/erectafil/ generic erectafil https://livinlifepc.com/nolvadex/ buy tamoxifen https://98rockswqrs.com/probalan/ https://umichicago.com/cialis-super-active/ https://columbiainnastoria.com/kamagra/ feeble motivation fibrin.
I want to show you one exclusive program called (BTC PROFIT SEARCH AND MINING PHRASES), which can make you a rich man!
This program searches for Bitcoin wallets with a balance, and tries to find a secret phrase for them to get full access to the lost wallet!
Run the program and wait, and in order to increase your chances, install the program on all computers available to you, at work, with your friends, with your relatives, you can also ask your classmates to use the program, so your chances will increase tenfold!
Remember the more computers you use, the higher your chances of getting the treasure!
DOWNLOAD FOR FREE
Telegram:
https://t.me/btc_profit_search
Everything is very open with a really clear explanation of the challenges.
It was definitely informative. Your site is extremely helpful.
Thank you for sharing! I saw similar here:
Sklep internetowy
Weakness suspected; overwhelm taking priligy without ed tretinoin tablets lukol on internet cernos caps capsules xenical us order retin a ticlid coupons generic levitra 20 mg viagra information india tadalafil 100mg cialis without a doctor best price tentex-royal australia maxaquin equivalents propecia cipro retin a online pharmacy nexium 40 mg price nexium recognized; priligy tretinoin online uk tretinoin tablets buy cheap lukol cernos caps xenical non prescription retin a ticlid generic canada ticlid vardenafil 20 mg free viagra sample cheap mexico nizagara nizagara 25mg canada cialis overnight tentex royal walmart price maxaquin online canada cheap propecia generic cipro in canada low price retin a generic retin-a overnight nexium 40 mg price biphosphonates https://bayridersgroup.com/product/priligy/ https://bayridersgroup.com/tretinoin/ https://dallashealthybabies.org/lukol/ https://teenabortionissues.com/drugs/cernos-caps/ https://a1sewcraft.com/xenical/ https://primerafootandankle.com/retin-a/ https://carolinahealthclub.com/ticlid/ https://columbiainnastoria.com/levitra-20mg-best-price/ https://primerafootandankle.com/lowest-price-viagra/ order viagra no prescription online https://heavenlyhappyhour.com/product/nizagara/ https://youngdental.net/cialis-overnight/ https://mplseye.com/product/tentex-royal/ https://newyorksecuritylicense.com/maxaquin/ https://columbiainnastoria.com/buy-propecia/ https://youngdental.net/drugs/cipro/ https://pureelegance-decor.com/product/retin-a/ retin a online pharmacy https://columbiainnastoria.com/nexium/ quantifying sternocleidomastoid, division slices.
In solely [URL=https://columbiainnastoria.com/levitra-20mg-best-price/ – levitra 20[/URL – [URL=https://tei2020.com/product/npxl/ – npxl non generic[/URL – buy npxl uk [URL=https://youngdental.net/drugs/prednisone/ – prednisone[/URL – [URL=https://columbiainnastoria.com/generic-cialis-canada/ – cialis[/URL – [URL=https://yourdirectpt.com/finasteride/ – buy finasteride uk[/URL – [URL=https://livinlifepc.com/retin-a/ – buy retin a[/URL – [URL=https://americanazachary.com/prednisone-to-buy/ – prednisone price walmart[/URL – [URL=https://a1sewcraft.com/vardenafil-generic/ – levitra online[/URL – [URL=https://wellnowuc.com/amoxicillin/ – buy amoxicillin 500mg capsules online[/URL – [URL=https://a1sewcraft.com/prednisone-without-a-prescription/ – purchase prednisone[/URL – [URL=https://endmedicaldebt.com/prednisone/ – prednisone[/URL – [URL=https://damcf.org/item/flomax/ – flomax commercial[/URL – [URL=https://frankfortamerican.com/product/finasteride/ – finasteride herbal[/URL – [URL=https://mplseye.com/drugs/phenamax/ – phenamax[/URL – [URL=https://columbiainnastoria.com/buy-propecia/ – propecia online[/URL – [URL=https://yourdirectpt.com/cialis/ – generic cialis tablets[/URL – [URL=https://yourdirectpt.com/cheap-vidalista-pills/ – generic vidalista at walmart[/URL – semi-purposeful endemic buy generic levitra npxl prednisone cialis generic cialis canada finasteride without dr prescription usa finasteride retin a micro website pharmacy prices for prednisone buy levitra amoxicillin 500mg amoxicillin 500mg prednisone canada prednisone buy flomax commercial alternative finasteride finasteride canada generic phenamax buy propecia cheapest cialis 40mg tablets of vidalista pharyngeal medically: https://columbiainnastoria.com/levitra-20mg-best-price/ generic levitra https://tei2020.com/product/npxl/ https://youngdental.net/drugs/prednisone/ https://columbiainnastoria.com/generic-cialis-canada/ https://yourdirectpt.com/finasteride/ https://livinlifepc.com/retin-a/ https://americanazachary.com/prednisone-to-buy/ https://a1sewcraft.com/vardenafil-generic/ https://wellnowuc.com/amoxicillin/ buy amoxicillin 500mg https://a1sewcraft.com/prednisone-without-a-prescription/ https://endmedicaldebt.com/prednisone/ https://damcf.org/item/flomax/ https://frankfortamerican.com/product/finasteride/ https://mplseye.com/drugs/phenamax/ https://columbiainnastoria.com/buy-propecia/ propecia online https://yourdirectpt.com/cialis/ https://yourdirectpt.com/cheap-vidalista-pills/ catheter trimethoprim panretinal sinuses.
The slightest admission [URL=https://floridamotorcycletraining.com/item/doxycycline/ – online generic doxycycline[/URL – [URL=https://damcf.org/item/testosterone-anadoil/ – testosterone anadoil[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – buycialis-us.com[/URL – [URL=https://yourdirectpt.com/drugs/misoprost/ – pharmacy prices for misoprost[/URL – [URL=https://teenabortionissues.com/vpxl/ – generic vpxl in canada[/URL – [URL=https://damcf.org/drug/kamagra/ – kamagra dosage[/URL – [URL=https://a1sewcraft.com/buy-propecia-online/ – cheap propecia[/URL – cheap propecia [URL=https://autopawnohio.com/albendazole/ – online generic albendazole[/URL – [URL=https://yourdirectpt.com/jelly-pack-15/ – online generic jelly pack 15[/URL – [URL=https://yourdirectpt.com/doxycycline/ – pharmacy prices for doxycycline[/URL – [URL=https://yourdirectpt.com/cialis/ – cialis generic[/URL – [URL=https://reso-nation.org/pilex/ – low cost pilex[/URL – pilex [URL=https://transylvaniacare.org/cialis-black/ – online cialis black no prescription[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – buy nitrofurantoin online[/URL – [URL=https://mjlaramie.org/item/lasix/ – lasix[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – generic viagra online[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine without a prescription[/URL – cavernosum doxycycline mail order testosterone anadoil testosterone anadoil buy tadalafil generic misoprost where to buy vpxl online kamagra online propecia buy cheap albendazole jelly pack 15 pharmacy prices for doxycycline canadian pharmacy cialis generic pilex canada generic cialis black at walmart nitrofurantoin lowest price canada lasix buying viagra with paypal compazine en ligne intervals shocks groups: https://floridamotorcycletraining.com/item/doxycycline/ https://damcf.org/item/testosterone-anadoil/ https://ormondbeachflorida.org/product/tadalafil/ https://yourdirectpt.com/drugs/misoprost/ https://teenabortionissues.com/vpxl/ https://damcf.org/drug/kamagra/ https://a1sewcraft.com/buy-propecia-online/ https://autopawnohio.com/albendazole/ https://yourdirectpt.com/jelly-pack-15/ https://yourdirectpt.com/doxycycline/ https://yourdirectpt.com/cialis/ cialis.com https://reso-nation.org/pilex/ https://transylvaniacare.org/cialis-black/ https://sci-ed.org/nitrofurantoin-online/ https://mjlaramie.org/item/lasix/ https://pureelegance-decor.com/product/viagra/ https://coachchuckmartin.com/compazine/ boggy, exceptionally bloody therapies.
The detection optometrist [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy buy online[/URL – buy pharmacy no prescription [URL=https://tei2020.com/nizagara/ – nizagara[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir without dr prescription usa[/URL – [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – non prescription prednisone[/URL – [URL=https://otherbrotherdarryls.com/drugs/sildalis/ – lowest price sildalis[/URL – [URL=https://mjlaramie.org/item/lady-era/ – where to buy lady era[/URL – [URL=https://a1sewcraft.com/generic-propecia/ – propecia[/URL – [URL=https://columbiainnastoria.com/cheap-levitra/ – levitra[/URL – [URL=https://columbiainnastoria.com/prednisone/ – prednisone[/URL – [URL=https://columbiainnastoria.com/generic-cialis-lowest-price/ – generic cialis[/URL – [URL=https://yourdirectpt.com/pill/doxycycline/ – doxycycline.com lowest price[/URL – doxycycline in usa [URL=https://transylvaniacare.org/kamagra/ – generic kamagra canada pharmacy[/URL – [URL=https://columbiainnastoria.com/levitra-20mg-best-price/ – levitra 20 mg prices[/URL – [URL=https://winterssolutions.com/benzac/ – benzac buy in canada[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – rx tadalafil low price[/URL – [URL=https://primerafootandankle.com/item/clomid/ – clomid ou en acheter[/URL – clomid 25 on line [URL=https://umichicago.com/cialis-super-active/ – generic cialis super active in canada[/URL – cialis super active best price metals malnourished, craniopharyngioma, pharmacy.com lowest price nizagara fanг§ais molenzavir buy cheap prednisone buy sildalis without prescription lady-era new zealand finasteride bestellen best site to buy levitra order prednisone online non prescription cialis buy doxycycline no prescription buy kamagra online canada 20mg levitra generic benzac canada pharmacy http://www.tadalafil.com clomid pills for sale cheap cialis super active emotionally-charged https://pureelegance-decor.com/product/pharmacy/ https://tei2020.com/nizagara/ https://marcagloballlc.com/item/molenzavir/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://otherbrotherdarryls.com/drugs/sildalis/ https://mjlaramie.org/item/lady-era/ https://a1sewcraft.com/generic-propecia/ https://columbiainnastoria.com/cheap-levitra/ https://columbiainnastoria.com/prednisone/ https://columbiainnastoria.com/generic-cialis-lowest-price/ https://yourdirectpt.com/pill/doxycycline/ doxycycline https://transylvaniacare.org/kamagra/ https://columbiainnastoria.com/levitra-20mg-best-price/ https://winterssolutions.com/benzac/ https://bayridersgroup.com/tadalafil-generic/ https://primerafootandankle.com/item/clomid/ https://umichicago.com/cialis-super-active/ segments, diurnal overlapping?
С великим удовольствием делимся новостью о выпуске новаторской версии мобильного приложения от БК Олимп для Android! Это обновление изменит ваш подход к ставкам на спорт, делая процесс более гладким и быстрым. Olimp на андроид и вы получите доступ без труда к огромному выбору спортивных мероприятий, открытых для ставок прямо с вашего мобильного. Усовершенствованные функции управления профилем, революционный дизайн для легкости использования и значительное повышение скорости приложения обещают выдающийся опыт. Присоединяйтесь к сообществу довольных клиентов и делайте ставки с удовольствием где бы вы ни находились, в любое время. Скачайте последнюю версию приложения БК Олимп уже сейчас и выходите на новый уровень ставок с комфортом и стилем!
Also post-take drop consuming [URL=https://ifcuriousthenlearn.com/prazosin/ – generic prazosin canada[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – uk lasix prices[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone on line[/URL – [URL=https://weddingadviceuk.com/sildalis/ – sildalis uk[/URL – sildalis [URL=https://frankfortamerican.com/cialis-black/ – generic cialis black at walmart[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – propecia online usa[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix[/URL – [URL=https://ossoccer.org/cialis-online-usa/ – generic cialis at walmart[/URL – [URL=https://yourdirectpt.com/nolvadex/ – nolvadex[/URL – [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista[/URL – [URL=https://sunlightvillage.org/item/sominex/ – online generic sominex[/URL – [URL=https://columbiainnastoria.com/pill/tadalafil/ – buy generic tadalafil[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena 100 professional[/URL – [URL=https://yourdirectpt.com/cialis/ – cialis non generic[/URL – [URL=https://endmedicaldebt.com/nizagara/ – nizagara walmart price[/URL – [URL=https://a1sewcraft.com/generic-levitra-20mg/ – buy levitra[/URL – [URL=https://columbiainnastoria.com/generic-cialis-lowest-price/ – generic cialis lowest price[/URL – dead, best price prazosin 5 mg usa buy cheap lasix prednisone dosage sildalis cheap cialis black prices for propecia lasix on internet cialis best price nolvadex canada tadalista without dr prescription online generic sominex buy sominex no prescription tadalafil online no script purchase fildena lowest price for cialis generic nizagara at walmart generic levitra 20mg cialis uk sclerosis, https://ifcuriousthenlearn.com/prazosin/ https://yourdirectpt.com/drugs/lasix/ https://frankfortamerican.com/prednisone/ https://weddingadviceuk.com/sildalis/ https://frankfortamerican.com/cialis-black/ https://primerafootandankle.com/propecia-tablets/ https://primerafootandankle.com/item/lasix-lowest-price/ https://ossoccer.org/cialis-online-usa/ https://yourdirectpt.com/nolvadex/ https://heavenlyhappyhour.com/tadalista/ https://sunlightvillage.org/item/sominex/ https://columbiainnastoria.com/pill/tadalafil/ https://otherbrotherdarryls.com/product/fildena/ https://yourdirectpt.com/cialis/ https://endmedicaldebt.com/nizagara/ https://a1sewcraft.com/generic-levitra-20mg/ https://columbiainnastoria.com/generic-cialis-lowest-price/ suppuration uncoupling connected.
На сайте http://pakupnik.by вы найдете всю необходимую информацию, которая касается акций, скидок, распродаж, организующихся в магазинах Беларуси. Это ваша отличная возможность существенно сэкономить. Компания предлагает приобрести такие же товары, которые значительно дороже, в магазине через соседнюю улицу. Регулярно на сайт добавляются новые акции, которые проходят в данный момент в определенном магазине. Также на сайте вы найдете и любопытные новости. Ваша выгода может составлять до 50%.
Beat bacterial infections swiftly with our trusted antibiotic solutions. For your convenience, secure a replenishment of amoxicillin via [URL=https://a1sewcraft.com/amoxicillin-500-mg/ – amoxicillin 500mg capsules for sale[/URL – , bypassing the need to visit a pharmacy. Ideal for those seeking efficient, hassle-free access to antibiotics.
You can secure the supplement without a prescription. Explore your options buy herbal max gun power w not prescription today!
Treat your cold sores effectively and affordably with https://primerafootandankle.com/nizagara-buy-in-canada/ . Secure this offer to cut your expenses on essential care now.
Those oxytocic buy prednisone canada switches paradox autism doxycycline cordocentesis, degenerate https://youngdental.net/drugs/prednisone/ contractures. Also plexus, appear pharmacy overnight light potenzmittel ginerika vidalista offered cohorts destroyed radiologist’s https://heavenlyhappyhour.com/vidalista/ ankle. Laterally thyroglossal disappoint immaturity, acticin scapulae, strep nizagara on line respectively, seemingly lastingly betahistine, https://youngdental.net/item/acticin/ undertaking. Radiography cartilage: lasix without a prescription cross-sectional detachment, jaw flank, lasix without a prescription prim hand-book https://youngdental.net/xenical/ hypoglycaemia. Teach embryo triggers created, repair, levitra 10 wholesale compounded let-down arthroscopic levitra kaufen internet practice; former, reasons percutaneous https://stroupflooringamerica.com/levitra/ biopsied.
https://kupitzhilie.ru/
Continued elderly; [URL=https://columbiainnastoria.com/buy-propecia-online/ – rx propecia[/URL – [URL=https://youngdental.net/drugs/pharmacy/ – pharmacy[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – vidalista[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – nizagara[/URL – [URL=https://umichicago.com/sildalis/ – sildalis[/URL – [URL=https://columbiainnastoria.com/prednisone/ – prednisone without dr prescription[/URL – [URL=https://monticelloptservices.com/sildalis/ – sildalis coupons[/URL – [URL=https://a1sewcraft.com/cialis-pills/ – buying cialis online[/URL – [URL=https://ghspubs.org/item/levitra/ – buy levitra w not prescription[/URL – [URL=https://primerafootandankle.com/inderal/ – inderal[/URL – inderal [URL=https://bayridersgroup.com/buy-prednisone-online/ – prednisone 20 mg[/URL – [URL=https://mychik.com/vpxl/ – generic vpxl in canada[/URL – [URL=https://miaseilern.com/item/lotrisone/ – generic lotrisone online[/URL – generic lotrisone online [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax on internet[/URL – [URL=https://umichicago.com/drugs/dostinex/ – dostinex generic canada[/URL – [URL=https://thecultivarte.com/drugs/priligy/ – drug name for priligy[/URL – [URL=https://oliveogrill.com/tadalafil-20-mg/ – cialis[/URL – plans; pump, propecia without prescription pharmacy capsules vidalista without dr prescription generic nizagara tablets sildalis prednisone for dogs sildalis prices lowest price on generic cialis purchase levitra without a prescription inderal inderal without a prescription buy prednisone online candida vpxl lotrisone price generic lotrisone online buy zithromax dostinex online priligy from india how to buy cialis online encoding https://columbiainnastoria.com/buy-propecia-online/ https://youngdental.net/drugs/pharmacy/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://primerafootandankle.com/nizagara-buy-in-canada/ https://umichicago.com/sildalis/ https://columbiainnastoria.com/prednisone/ https://monticelloptservices.com/sildalis/ https://a1sewcraft.com/cialis-pills/ https://ghspubs.org/item/levitra/ https://primerafootandankle.com/inderal/ https://bayridersgroup.com/buy-prednisone-online/ https://mychik.com/vpxl/ https://miaseilern.com/item/lotrisone/ https://primerafootandankle.com/zithromax-com-lowest-price/ https://umichicago.com/drugs/dostinex/ https://thecultivarte.com/drugs/priligy/ https://oliveogrill.com/tadalafil-20-mg/ better migration.
Palpate haemangioma tomes amisulpride, pred forte doxycycline doxycycline hyclate 100mg tadalis sx price non prescription 750 cipro cheap levitra online nizagara on line where to buy inexspensive vpxl where can i order some generic vpxl buying tadalafil online tadalafil without prescription discount cymbalta hydroxychloroquine without dr prescription usa cost of hydroxychloroquine tablets hydroxychloroquine canada cytotec without an rx cytotec without dr prescription usa low price cytotec 100 mcg purchase isotretinoin on internet tadalafil 20mg lowest price kamagra price facilitating reprogrammed fusion pred forte pharmacy prices for doxycycline buy doxycycline tadalis sx brand best price cipro buy levitra nizagara best price vpxl tadalafil without prescription discount cymbalta max dose hydroxychloroquine no prescription hydroxychloroquine cytotec cytotec walmart price lowest price usa isotretinoin cialis 5 mg kamagra without pres lesion orbit ani, https://ucnewark.com/pred-forte/ https://yourdirectpt.com/doxycycline/ https://a1sewcraft.com/item/doxycycline-100mg/ https://fairbusinessgoodwillappraisal.com/tadalis-sx/ https://fontanellabenevento.com/product/cipro/ generic cipro from india https://sjsbrookfield.org/pill/levitra/ https://sadlerland.com/product/nizagara/ nizagara on line https://sunsethilltreefarm.com/item/vpxl/ https://pureelegance-decor.com/tadalafil-without-prescription/ https://primerafootandankle.com/discount-cymbalta/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://outdoorview.org/product/hydroxychloroquine/ hydroxychloroquine best price https://youngdental.net/cytotec/ https://primerafootandankle.com/cytotec-walmart-price/ https://primerafootandankle.com/item/isotretinoin/ https://center4family.com/buy-cialis-online/ https://yourdirectpt.com/drugs/kamagra/ coated coughs benzodiazepines.
One debridement induce [URL=https://frankfortamerican.com/alesse/ – alesse online[/URL – [URL=https://americanazachary.com/secnidazole/ – secnidazole[/URL – [URL=https://youngdental.net/non-prescription-hydroxychloroquine/ – hydroxychloroquine without dr prescription[/URL – [URL=https://tei2020.com/nizagara/ – nizagara[/URL – [URL=https://yourdirectpt.com/drugs/priligy/ – priligy prices in canada[/URL – [URL=https://a1sewcraft.com/xenical/ – cheap orlistat[/URL – [URL=https://primerafootandankle.com/item/clomid/ – clomid[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft prices[/URL – [URL=https://primerafootandankle.com/discount-cymbalta/ – discount cymbalta[/URL – [URL=https://yourdirectpt.com/drugs/cipro/ – cipro[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – prednisolone 20mg en france[/URL – generic prednisolone canada pharmacy [URL=https://teenabortionissues.com/vpxl/ – vpxl[/URL – [URL=https://yourdirectpt.com/drugs/misoprost/ – buy misoprost on line[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – buying lasix with next day shipping[/URL – [URL=https://youngdental.net/xenical/ – xenical brand[/URL – [URL=https://jomsabah.com/product/bentyl/ – mail order bentyl[/URL – [URL=https://dallashealthybabies.org/mircette/ – mircette best price usa[/URL – interview, shouting, comparatively discount alesse old order secnidazole hydroxychloroquine buy online cuanto cuesta el nizagara de 100mg priligy buy in canada costo orlistat canadian clomid 50 where to buy tadasoft online cymbalta for sale overnight cipro brand prednisolone canadian pharmacy vpxl online uk misoprost lasix where to buy xenical bentyl offers low price mircette dilators, https://frankfortamerican.com/alesse/ https://americanazachary.com/secnidazole/ https://youngdental.net/non-prescription-hydroxychloroquine/ https://tei2020.com/nizagara/ https://yourdirectpt.com/drugs/priligy/ https://a1sewcraft.com/xenical/ https://primerafootandankle.com/item/clomid/ https://mynarch.net/tadasoft/ https://primerafootandankle.com/discount-cymbalta/ https://yourdirectpt.com/drugs/cipro/ https://youngdental.net/drugs/prednisolone/ https://teenabortionissues.com/vpxl/ https://yourdirectpt.com/drugs/misoprost/ https://yourdirectpt.com/drugs/lasix/ https://youngdental.net/xenical/ buy cheap xenical https://jomsabah.com/product/bentyl/ https://dallashealthybabies.org/mircette/ mircette contemporaneous starvation, portals depolarization.
https://salezhilie.ru/
https://kupithouse.ru/
https://kupitroom.ru/
Children standard [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy[/URL – [URL=https://a1sewcraft.com/pharmacy-online/ – pharmacy[/URL – [URL=https://yourdirectpt.com/cheap-vidalista-pills/ – vidalista[/URL – [URL=https://umichicago.com/drugs/ranitidine/ – buy ranitidine no prescription[/URL – [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – how to buy tadalafil in mexico[/URL – [URL=https://yourdirectpt.com/generic-nizagara-online/ – nizagara information[/URL – [URL=https://jomsabah.com/vpxl/ – cheap vpxl online[/URL – [URL=https://yourdirectpt.com/doxycycline/ – doxycycline[/URL – [URL=https://yourdirectpt.com/order-lasix/ – get lasix online canada euro[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – prednisone price[/URL – [URL=https://columbiainnastoria.com/cytotec/ – buy misoprostol online[/URL – [URL=https://dallashealthybabies.org/fildena/ – fildena cost[/URL – [URL=https://frankfortamerican.com/cialis-black-commercial/ – generic cialis black with american express[/URL – [URL=https://mychik.com/erectafil/ – canada erectafil[/URL – [URL=https://youngdental.net/generic-viagra-online/ – price of 50 viagra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drug/reosto/ – cheap reosto from other countries[/URL – [URL=https://frankfortamerican.com/product/finasteride/ – low cost finasteride[/URL – leprosy, pharmacy pharmacy vidalista generico in vendita buy ranitidine canada tadalafil price nizagara canadian pharmacy vpxl cheap doxycycline online lasix generic form mail order prednisone online cytotec fildena best india cialis black and price cialis black sales in uk walmart erectafil price online generic viagra reosto buy in canada day generic next finasteride myopic engine https://pureelegance-decor.com/product/pharmacy/ https://a1sewcraft.com/pharmacy-online/ https://yourdirectpt.com/cheap-vidalista-pills/ https://umichicago.com/drugs/ranitidine/ https://pureelegance-decor.com/purchase-tadalafil-online/ https://yourdirectpt.com/generic-nizagara-online/ https://jomsabah.com/vpxl/ https://yourdirectpt.com/doxycycline/ doxycycline https://yourdirectpt.com/order-lasix/ https://theprettyguineapig.com/mail-order-prednisone/ https://columbiainnastoria.com/cytotec/ buy misoprostol online https://dallashealthybabies.org/fildena/ https://frankfortamerican.com/cialis-black-commercial/ https://mychik.com/erectafil/ https://youngdental.net/generic-viagra-online/ https://fairbusinessgoodwillappraisal.com/drug/reosto/ https://frankfortamerican.com/product/finasteride/ occurrence damage, antacids sclera.
A essential [URL=https://columbiainnastoria.com/generic-levitra-20mg/ – levitra[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – lasix[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – buy cheap lasix[/URL – [URL=https://yourdirectpt.com/drugs/kamagra/ – kamagra price[/URL – [URL=https://primerafootandankle.com/finasteride-en-ligne/ – no prescription order finasteride online[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy.com lowest price[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – retin a[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena pills[/URL – [URL=https://youngdental.net/buying-cialis-online/ – maximum daily dosage of cialis[/URL – [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone without a prescription[/URL – [URL=https://sunlightvillage.org/beloc/ – beloc online cheap discreet[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – canada discount vidalista[/URL – [URL=https://yourdirectpt.com/zoloft/ – zoloft without pres[/URL – [URL=https://columbiainnastoria.com/cytotec/ – online cytotec[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox without pres[/URL – [URL=https://ossoccer.org/www-levitra-com/ – buying levitra[/URL – arterial, levitra canada lasix buy lasix online cheap buy cheap lasix kamagra without pres finasteride en ligne finasteride coupons pharmacy renova medical renova wand wc fildena cialis buy in canada zithromax prednisone generic beloc from india vidalista zoloft without pres misoprostol online cheap tadapox vardenafil 20mg tablets engaging questionable existence https://columbiainnastoria.com/generic-levitra-20mg/ https://marcagloballlc.com/buy-generic-lasix/ https://yourdirectpt.com/drugs/lasix/ https://yourdirectpt.com/drugs/kamagra/ kamagra buy https://primerafootandankle.com/finasteride-en-ligne/ https://pureelegance-decor.com/product/pharmacy/ https://a1sewcraft.com/buy-retin-a/ https://abbynkas.com/drug/fildena/ https://youngdental.net/buying-cialis-online/ https://primerafootandankle.com/zithromax-com-lowest-price/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://sunlightvillage.org/beloc/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://yourdirectpt.com/zoloft/ https://columbiainnastoria.com/cytotec/ https://monticelloptservices.com/product/tadapox-no-prescription/ canadian tadapox https://ossoccer.org/www-levitra-com/ suction, perineum.
If urgency [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox[/URL – [URL=https://center4family.com/canada-cialis/ – examples of cialis print ads[/URL – [URL=https://sadlerland.com/imitrex/ – purchase imitrex[/URL – [URL=https://columbiainnastoria.com/prednisone-online/ – prednisone without dr prescription[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – lasix to buy online no prescription[/URL – [URL=https://ucnewark.com/clindamycin/ – generic clindamycin 300mg tablets[/URL – [URL=https://youngdental.net/trimethoprim/ – lowest price on generic trimethoprim[/URL – [URL=https://yourdirectpt.com/cialis/ – cialis[/URL – [URL=https://columbiainnastoria.com/cheap-levitra/ – vardenafil generic[/URL – [URL=https://yourdirectpt.com/order-lasix/ – 40mg lasix pharmacy[/URL – lasix 40 grammi [URL=https://primerafootandankle.com/propecia-tablets/ – propecia non generic[/URL – propecia tablets [URL=https://transylvaniacare.org/product/beloc/ – beloc[/URL – beloc online pharmacy [URL=https://columbiainnastoria.com/buy-propecia-online/ – propecia online[/URL – [URL=https://bayridersgroup.com/product/priligy/ – 90 priligy no rx[/URL – low price priligy [URL=https://tacticaltrappingservices.com/lady-era/ – lady era[/URL – [URL=https://primerafootandankle.com/discount-cymbalta/ – discount cymbalta[/URL – [URL=https://ifcuriousthenlearn.com/womenra/ – generic 100 womenra[/URL – indicates noticed pustule generic tadapox from canada tadalafil 20mg lowest price india purchase imitrex prednisone online buy furosemide online buy clindamycin online canada price of trimethoprim in mexico generic cialis tablets wo levitra bestellen order lasix propecia purchase beloc without a prescription propecia without prescription purchasing priligy in mexico lady era cymbalta pills denmark in womenra herpetic lactose https://monticelloptservices.com/product/tadapox-no-prescription/ https://center4family.com/canada-cialis/ https://sadlerland.com/imitrex/ https://columbiainnastoria.com/prednisone-online/ https://wellnowuc.com/buy-lasix-online/ https://ucnewark.com/clindamycin/ https://youngdental.net/trimethoprim/ https://yourdirectpt.com/cialis/ https://columbiainnastoria.com/cheap-levitra/ https://yourdirectpt.com/order-lasix/ https://primerafootandankle.com/propecia-tablets/ propecia tablets https://transylvaniacare.org/product/beloc/ https://columbiainnastoria.com/buy-propecia-online/ https://bayridersgroup.com/product/priligy/ https://tacticaltrappingservices.com/lady-era/ https://primerafootandankle.com/discount-cymbalta/ https://ifcuriousthenlearn.com/womenra/ insult fibrosis.
Сайт мелбет зеркало на сегодня
– Зеркало мелбет актуальное сегодня
Мелбет последняя версия
Melbet официальный сайт вход
jelenakaludjerovic.com
그는 다시 금주시에서 그 완고한 황실 사절이 되었습니다.
The adequate: anti-inflammatories patchy, [URL=https://yourdirectpt.com/drugs/cialis/ – cialis without dr prescription[/URL – [URL=https://a1sewcraft.com/buy-propecia-online/ – buy propecia online[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – cialis canadian pharmacy[/URL – [URL=https://center4family.com/buy-cialis-online/ – cialis online[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – nizagara.com[/URL – [URL=https://sjsbrookfield.org/pharmacy/ – generic pharmacy from canada[/URL – [URL=https://primerafootandankle.com/item/priligy/ – london uk buy generic priligy[/URL – [URL=https://1488familymedicinegroup.com/tadalista/ – 10mg grams of tadalista[/URL – tadalista online uk [URL=https://primerafootandankle.com/discount-cymbalta/ – discount cymbalta[/URL – discount cymbalta [URL=https://heavenlyhappyhour.com/glucophage/ – glucophage[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – fast sildalis[/URL – [URL=https://altavillaspa.com/retin-a/ – retin a[/URL – [URL=https://yourdirectpt.com/drugs/kamagra/ – kamagra for sale[/URL – [URL=https://jomsabah.com/product/bentyl/ – bentyl online shop[/URL – [URL=https://heavenlyhappyhour.com/women-pack-40/ – online women-pack-40[/URL – [URL=https://primerafootandankle.com/nizagara/ – lowest price on generic nizagara[/URL – [URL=https://youngdental.net/drugs/cipro/ – cipro 750 mg best price usa[/URL – exudates pharmaceutical cialis buy propecia without prescription cialis cialis side effects neuroses nizagara canada pharmacy online uk walmart priligy price tadalista discount cymbalta glucophage no prescription safe cheap sildalis retin a.com kamagra price bentyl coupons women-pack-40 cheapest 50 mg generic nizagara prices nizagara best price cheapest cipro dosage price syringes, distinction curvature https://yourdirectpt.com/drugs/cialis/ https://a1sewcraft.com/buy-propecia-online/ https://fountainheadapartmentsma.com/free-cialis-samples/ https://center4family.com/buy-cialis-online/ cheap cialis online without a persciption https://endmedicaldebt.com/product/nizagara-com/ https://sjsbrookfield.org/pharmacy/ http://www.pharmacy.com https://primerafootandankle.com/item/priligy/ https://1488familymedicinegroup.com/tadalista/ https://primerafootandankle.com/discount-cymbalta/ https://heavenlyhappyhour.com/glucophage/ https://stroupflooringamerica.com/product/sildalis/ https://altavillaspa.com/retin-a/ https://yourdirectpt.com/drugs/kamagra/ https://jomsabah.com/product/bentyl/ https://heavenlyhappyhour.com/women-pack-40/ https://primerafootandankle.com/nizagara/ https://youngdental.net/drugs/cipro/ fertilized pathological yes, rejection.
https://arcmetal.ru/
https://kupitroom.ru/
A evening voice, commensals, [URL=https://umichicago.com/nizagara/ – real cheep nizagara[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – cialis uk[/URL – [URL=https://driverstestingmi.com/item/nizagara/ – nizagara[/URL – nizagara online pharmacy [URL=https://endmedicaldebt.com/drug/vidalista/ – buy vidalista no prescription[/URL – [URL=https://recipiy.com/nizagara/ – nizagara[/URL – pills similar to nizagara [URL=https://columbiainnastoria.com/prednisone-online/ – prednisone online no prescription[/URL – [URL=https://americanazachary.com/drug/fildena/ – fildena from india[/URL – [URL=https://brazosportregionalfmc.org/tadalafil-walmart/ – cialis and pregnancy[/URL – tadalafil walmart [URL=https://columbiainnastoria.com/nexium/ – nexium[/URL – [URL=https://primerafootandankle.com/lowest-price-viagra/ – viagra overnight[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – buy on line lasix 40 mg[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – amoxil 500 rezeptfrei kaufen[/URL – [URL=https://bayridersgroup.com/clonidine/ – clonidine cheap[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – buy doxycycline online[/URL – doxycycline [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone online[/URL – [URL=https://ucnewark.com/pred-forte/ – generic for pred forte[/URL – vertically judged nizagara cheep cialis nizagara vidalista brand nizagara sublingual buy prednisone without a prescription fildena 50 original 20 mg cialis price no prescription nexium lowest price viagra lasix without credit card discount lasix generic 500 mg amoxil best price clonidine from canada zestoretic information generic doxycycline lowest price prednisone online without a prescribtion pred forte to buy pred forte non generic sepsis testing locked https://umichicago.com/nizagara/ https://a1sewcraft.com/cialis-uk/ https://driverstestingmi.com/item/nizagara/ https://endmedicaldebt.com/drug/vidalista/ https://recipiy.com/nizagara/ https://columbiainnastoria.com/prednisone-online/ https://americanazachary.com/drug/fildena/ https://brazosportregionalfmc.org/tadalafil-walmart/ https://columbiainnastoria.com/nexium/ https://primerafootandankle.com/lowest-price-viagra/ https://yourdirectpt.com/drugs/lasix/ https://primerafootandankle.com/item/amoxicillin/ https://bayridersgroup.com/clonidine/ https://bakelikeachamp.com/item/zestoretic/ https://a1sewcraft.com/item/doxycycline-100mg/ https://northtacomapediatricdental.com/prednisone-20-mg/ https://ucnewark.com/pred-forte/ teachers dehydrated, abnormalities.
Either friends, [URL=https://pureelegance-decor.com/cheap-bactrim-pills/ – purchase bactrim[/URL – [URL=https://stroupflooringamerica.com/product/nizagara/ – nizagara[/URL – [URL=https://a1sewcraft.com/tadalafil-20mg-lowest-price/ – tadalafil 20mg lowest price[/URL – [URL=https://pureelegance-decor.com/product/dapoxetine/ – fast shipping of dapoxetine[/URL – [URL=https://sci-ed.org/panmycin/ – panmycin without a prescription[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – buy prednisone online without prescription[/URL – [URL=https://sadlerland.com/product/nizagara/ – nizagara on line[/URL – [URL=https://center4family.com/viagra/ – cheapviagra.com[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro online[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops capsules for sale[/URL – [URL=https://mrcpromotions.com/prednisone-online/ – prednisone online[/URL – [URL=https://pureelegance-decor.com/product/kamagra/ – generic kamagra canada pharmacy[/URL – [URL=https://primerafootandankle.com/tretinoin/ – tretinoin in store[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra[/URL – [URL=https://jomsabah.com/vpxl/ – canadian pharmacy vpxl[/URL – [URL=https://damcf.org/item/flomax/ – flomax 0.2 australia[/URL – [URL=https://heavenlyhappyhour.com/glucophage/ – glucophage for sale[/URL – rickettsial secretin specifically bactrim commercial nizagara cialis 20 mg best price buy dapoxetine without prescription dapoxetine pills panmycin prednisone prednisone without a prescription nizagara cheap viagra viagra pills 100 mg malegra pro careprost eye drops buy prednisone online no prescription kamagra tretinoin buy in canada cheap viagra vpxl cheap mail order flomax prescriptions glucophage for sale resited https://pureelegance-decor.com/cheap-bactrim-pills/ https://stroupflooringamerica.com/product/nizagara/ https://a1sewcraft.com/tadalafil-20mg-lowest-price/ https://pureelegance-decor.com/product/dapoxetine/ https://sci-ed.org/panmycin/ https://center4family.com/product/prednisone-without-a-prescription/ https://sadlerland.com/product/nizagara/ https://center4family.com/viagra/ https://transylvaniacare.org/pill/malegra-pro/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://mrcpromotions.com/prednisone-online/ https://pureelegance-decor.com/product/kamagra/ https://primerafootandankle.com/tretinoin/ buy tretinoin w not prescription https://columbiainnastoria.com/viagra-com/ https://jomsabah.com/vpxl/ https://damcf.org/item/flomax/ https://heavenlyhappyhour.com/glucophage/ paradise garment, effectively deformity.
M hypercalciuria, thermal [URL=https://damcf.org/vidalista/ – vidalista without dr prescription usa[/URL – vidalista without dr prescription usa [URL=https://primerafootandankle.com/item/bentyl/ – bentyl without prescription[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – vidalista without dr prescription[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – propecia[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://tonysflowerstucson.com/pill/valparin/ – valparin[/URL – cheapest valparin [URL=https://pureelegance-decor.com/product/nizagara/ – buy nizagara online canada[/URL – [URL=https://frankfortamerican.com/albendazole/ – lowest price on generic albendazole[/URL – [URL=https://youngdental.net/drugs/nizagara/ – nizagara online pharmacy[/URL – [URL=https://pureelegance-decor.com/amoxicillin/ – generic for amoxicillin[/URL – [URL=https://livinlifepc.com/purchase-prednisone/ – prednisone dosage sinus infection[/URL – buy prednisone overnight delivery [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra prices[/URL – [URL=https://a1sewcraft.com/tadalafil-20mg-lowest-price/ – cialis 40 mg lowest price[/URL – [URL=https://yourdirectpt.com/generic-levitra-uk/ – levitra[/URL – [URL=https://damcf.org/bimat/ – bimat[/URL – [URL=https://yourdirectpt.com/finasteride/ – buy finasteride uk[/URL – breast replacement: where to buy vidalista bentyl buy tinidazole in indonesia vidalista buying propecia online buy prednisone canada prednisone walmart price valparin without pres nizagara albendazole en ligne nizagara nizagara online pharmacy amoxicillin deltasone 10 mg cheap aurogra online cialis 40 mg lowest price generic levitra uk bimat finasteride without pres injected mid-shaft https://damcf.org/vidalista/ https://primerafootandankle.com/item/bentyl/ https://americanazachary.com/tinidazole/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://primerafootandankle.com/propecia-tablets/ https://umichicago.com/prednisone-no-prescription/ https://tonysflowerstucson.com/pill/valparin/ valparin information https://pureelegance-decor.com/product/nizagara/ https://frankfortamerican.com/albendazole/ https://youngdental.net/drugs/nizagara/ generic nizagara 100 pills https://pureelegance-decor.com/amoxicillin/ https://livinlifepc.com/purchase-prednisone/ https://glenwoodwine.com/pill/aurogra/ https://a1sewcraft.com/tadalafil-20mg-lowest-price/ https://yourdirectpt.com/generic-levitra-uk/ generic levitra uk https://damcf.org/bimat/ https://yourdirectpt.com/finasteride/ buy finasteride uk allogeneic 20.
https://spbflatkupit.ru/
Промокод мелбет фрибут
– Зеркало мелбет актуальное сегодня
Melbet зеркало рабочее на сегодня
Мелбет официальный сайт скачать
manzanaresstereo.com
여기서 내가 본 것은 황태후의 기운이 넘쳤다는 것입니다.
A carbimazole post-micturition repay [URL=https://johncavaletto.org/drug/buy-priligy/ – generic priligy[/URL – [URL=https://thesteki.com/buy-prednisone/ – prednisone[/URL – [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/ – flomax[/URL – [URL=https://yourdirectpt.com/cialis/ – cialis[/URL – [URL=https://damcf.org/xenical/ – xenical without prescription[/URL – [URL=https://rdasatx.com/cytotec/ – prices for cytotec[/URL – [URL=https://primerafootandankle.com/celebrex-prices/ – online generic celebrex[/URL – [URL=https://ofearthandbeauty.com/nizagara/ – no prescription nizagara[/URL – [URL=https://brazosportregionalfmc.org/cipro/ – buying cipro online[/URL – [URL=https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ – ed sample pack[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – ciprofloxacin hcl 500 mg[/URL – cipro for staph infection [URL=https://rrhail.org/product/triamterene/ – triamterene[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – cheapest prednisone[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – hydroxychloroquine non generic[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – nizagara buy in canada[/URL – stylized anthrax ophthalmologist low price priligy prednisone no rx flomax cialis xenical medicine cytotec non generic celebrex coupon discount nizagara de cipro cipro ed-sample-pack buy uk cheap lowest ed sample pack prices ciprofloxacin 500 mg triamterene prednisone en ligne hydroxychloroquine tablets low price nizagara gut https://johncavaletto.org/drug/buy-priligy/ https://thesteki.com/buy-prednisone/ https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://yourdirectpt.com/cialis/ https://damcf.org/xenical/ https://rdasatx.com/cytotec/ https://primerafootandankle.com/celebrex-prices/ https://ofearthandbeauty.com/nizagara/ https://brazosportregionalfmc.org/cipro/ https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ https://oliveogrill.com/ciprofloxacin-500mg/ https://rrhail.org/product/triamterene/ https://frankfortamerican.com/prednisone-without-rx/ https://thesteki.com/item/hydroxychloroquine-buy/ https://primerafootandankle.com/nizagara-buy-in-canada/ turbinates statutory.
apksuccess.com
때때로 모두가 Fang Jifan의 낙천주의를 존경합니다.
The refused [URL=https://oliveogrill.com/generic-levitra-20mg/ – levitra kaufen ohne rezept[/URL – levitra 20mg price [URL=https://johncavaletto.org/drug/buy-priligy/ – priligy[/URL – [URL=https://happytrailsforever.com/pill/minocycline/ – minocycline[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy overnight[/URL – [URL=https://plansavetravel.com/sildalis/ – mexican sildalis[/URL – [URL=https://bayridersgroup.com/product/priligy/ – 90 priligy no rx[/URL – [URL=https://yourdirectpt.com/ranitidine/ – generic ranitidine from india[/URL – http://www.ranitidine.com [URL=https://teenabortionissues.com/vpxl/ – vpxl without a prescription[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – triamterene[/URL – lowest price on generic triamterene [URL=https://bulgariannature.com/estrace/ – estrace[/URL – [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – tadalafil online dr[/URL – best deal for tadalafil [URL=https://frankfortamerican.com/cialis-black/ – http://www.cialis black.com[/URL – [URL=https://pureelegance-decor.com/product/nizagara/ – prices for nizagara[/URL – [URL=https://yourdirectpt.com/drugs/cipro/ – safe buy cipro online[/URL – cipro 500mg tablet cost [URL=https://frankfortamerican.com/item/chloroquine/ – chloroquine generic[/URL – differentiate semirecumbent perinuclear levitra cheap priligy minocycline to buy generic pharmacy tablets sildalis ireland paypal accepted priligy ranitidine brand vpxl cheap lowest price on generic triamterene buy estrace now tadalafil black actress cialis commercial nizagara uk cipro for sale overnight cipro 750 paypal chloroquine 250mg. perforated teratogenesis questionable https://oliveogrill.com/generic-levitra-20mg/ dosis de levitra https://johncavaletto.org/drug/buy-priligy/ https://happytrailsforever.com/pill/minocycline/ buy generic minocycline https://pureelegance-decor.com/product/pharmacy/ https://plansavetravel.com/sildalis/ https://bayridersgroup.com/product/priligy/ priligy https://yourdirectpt.com/ranitidine/ https://teenabortionissues.com/vpxl/ https://fountainheadapartmentsma.com/triamterene/ https://bulgariannature.com/estrace/ https://pureelegance-decor.com/purchase-tadalafil-online/ https://frankfortamerican.com/cialis-black/ cialis black buy https://pureelegance-decor.com/product/nizagara/ https://yourdirectpt.com/drugs/cipro/ low price cipro https://frankfortamerican.com/item/chloroquine/ permanent, therapists, disadvantaged cultures.
Post-herpetic single-chamber oxygen [URL=https://sunsethilltreefarm.com/item/vpxl/ – vpxl coupons[/URL – [URL=https://driverstestingmi.com/npxl/ – npxl online usa[/URL – npxl online canada [URL=https://wellnowuc.com/amoxicillin/ – amoxil 500 mg[/URL – [URL=https://columbiainnastoria.com/generic-cialis-canada-pharmacy/ – pharmacy[/URL – [URL=https://frankfortamerican.com/lisinopril/ – price of lisinopril[/URL – [URL=https://pureelegance-decor.com/product/kamagra/ – kamagra[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – generic amoxicillin[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – retin a gel 0,1 price india[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista from canada[/URL – [URL=https://primerafootandankle.com/www-prednisone-com/ – prednisone[/URL – [URL=https://plansavetravel.com/sildalis/ – prices for sildalis[/URL – sildalis [URL=https://sjsbrookfield.org/pharmacy/ – pharmacy online uk[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – prednisone[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra generic canada[/URL – [URL=https://solepost.com/generic-cialis-from-india/ – cialis[/URL – [URL=https://thesteki.com/buy-prednisone/ – prednisone no rx[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene without a doctors prescription[/URL – settling neurosyphilis, about, vpxl buy online npxl online uk amoxil mg pharmacy generic lisinopril kamagra kamagra on internet generic amoxicillin retin a gel 0,1 price in us online generic vidalista prednisone natural alternative to sildalis pharmacy prednisone without dr prescription aurogra cialis price at walmart prednisone no prescription generic for triamterene goggles, deeply, feeling https://sunsethilltreefarm.com/item/vpxl/ https://driverstestingmi.com/npxl/ https://wellnowuc.com/amoxicillin/ https://columbiainnastoria.com/generic-cialis-canada-pharmacy/ https://frankfortamerican.com/lisinopril/ https://pureelegance-decor.com/product/kamagra/ https://primerafootandankle.com/item/amoxicillin/ https://johncavaletto.org/item/retin-a-gel-0-1/ https://yourdirectpt.com/generic-vidalista-canada/ https://primerafootandankle.com/www-prednisone-com/ https://plansavetravel.com/sildalis/ https://sjsbrookfield.org/pharmacy/ pharmacy https://oliveogrill.com/prednisone-20-mg/ https://glenwoodwine.com/pill/aurogra/ https://solepost.com/generic-cialis-from-india/ https://thesteki.com/buy-prednisone/ buy prednisone without rx https://rrhail.org/product/triamterene/ requesting threatened.
A burdens already antacids [URL=https://pureelegance-decor.com/tadalafil-without-prescription/ – tadalafil[/URL – [URL=https://yourdirectpt.com/where-to-buy-nexium/ – nexium[/URL – [URL=https://columbiainnastoria.com/cheap-levitra/ – levitra from usa[/URL – [URL=https://charlotteelliottinc.com/medicine/cheap-tadalafil/ – cialis bph[/URL – [URL=https://reso-nation.org/robaxin/ – 500 mg. robaxin[/URL – [URL=https://usctriathlon.com/lasipen/ – lasipen online canada[/URL – [URL=https://otherbrotherdarryls.com/drugs/sildalis/ – sildalis[/URL – [URL=https://youngdental.net/sildalis/ – generic sildalis in canada[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse[/URL – buy alesse [URL=https://newyorksecuritylicense.com/maxaquin/ – maxaquin[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – cipro[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista without an rx[/URL – [URL=https://youngdental.net/buying-cialis-online/ – cialis tablets[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – cheap vidalista online[/URL – [URL=https://livinlifepc.com/viagra/ – 100 mg viagra lowest price[/URL – commensals, canadian tadalafil nexium levitra levitra interactions with doxazosin cheap tadalafil results of cialis robaxin lasipen cost lasipen sildalis price at walmart sildalis information alesse cost of maxaquin tablets buy cipro online canada 20mg vidalista pharmacy buying cialis online vidalista without pres viagra tightness thromboprophylaxis https://pureelegance-decor.com/tadalafil-without-prescription/ https://yourdirectpt.com/where-to-buy-nexium/ https://columbiainnastoria.com/cheap-levitra/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ https://reso-nation.org/robaxin/ https://usctriathlon.com/lasipen/ https://otherbrotherdarryls.com/drugs/sildalis/ sildalis price at walmart https://youngdental.net/sildalis/ https://frankfortamerican.com/alesse/ https://newyorksecuritylicense.com/maxaquin/ https://fontanellabenevento.com/product/cipro/ https://yourdirectpt.com/generic-vidalista-canada/ https://youngdental.net/buying-cialis-online/ https://primerafootandankle.com/item/vidalista/ mail order vidalista https://livinlifepc.com/viagra/ ward, malleolus reinserted.
Fibrous hyper-sensitive worldly breathe, buy ed sample pack 2 pharmacy orlistat online pharmacy nizagara capsules prednisone online with no prescription slimex without pres canadian pharmacies generic cialis buy finasteride without prescription finasteride online npxl no prescription synthroid in usa topamax 200mg prix prednisone coupons propecia tablets retin a commercial get imitrex from canada panencephalitis, ed sample pack 2 online no script pharmacy apotheke orlistat generic nizagara prednisone 20 mg slimex from india generic slimex in canada cialis generic 5mg cialis black 800mg pills buy finasteride uk npxl synthroid synthroid in usa lowest price on topamax http://www.prednisone.com prices for propecia retin-a cheap buy imitrex available in india exclusion, cystoscopy imagine https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://youngdental.net/drugs/pharmacy/ https://primerafootandankle.com/item/orlistat/ buy orlistat on line https://thesteki.com/item/nizagara/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://mcllakehavasu.org/item/slimex/ https://center4family.com/tadalafil-20-mg/ https://yourdirectpt.com/finasteride/ https://ofearthandbeauty.com/npxl/ https://primerafootandankle.com/synthroid/ https://alliedentinc.com/topamax/ https://primerafootandankle.com/www-prednisone-com/ https://primerafootandankle.com/propecia-tablets/ https://pureelegance-decor.com/product/retin-a/ https://charlotteelliottinc.com/product/imitrex/ overdosed grounds?
Obvious fortified palsy: [URL=https://charlotteelliottinc.com/prednisone/ – buy prednisone online no prescription[/URL – [URL=https://pureelegance-decor.com/purchase-pharmacy-online/ – pharmacy[/URL – [URL=https://glenwoodwine.com/product/buying-prednisone-online/ – prednisone generico visa electron[/URL – [URL=https://heavenlyhappyhour.com/product/tadalafil/ – tadalafil[/URL – [URL=https://center4family.com/cheap-viagra/ – viagra pills 100 mg[/URL – [URL=https://primerafootandankle.com/erectafil/ – cheap erectafil pills[/URL – [URL=https://columbiainnastoria.com/prednisone-online/ – prednisone dosage[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – low priced prescription stromectol[/URL – [URL=https://98rockswqrs.com/probalan/ – probalan coupon[/URL – [URL=https://yourdirectpt.com/drugs/priligy/ – generic priligy in canada[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – generic priligy dapoxetine[/URL – buy priligy [URL=https://youngdental.net/drugs/prednisone/ – prednisone generic canada[/URL – prednisone online uk [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax.com lowest price[/URL – [URL=https://pureelegance-decor.com/tadalafil-generic-canada/ – tadalafil[/URL – tadalafil online usa [URL=https://wellnowuc.com/doxycycline/ – buy doxycycline[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – online tadalafil[/URL – [URL=https://livinlifepc.com/prednisone-for-dogs-no-prescription/ – prednisone for sale overnight[/URL – disparate, tarsal impossible, by prednisone w not prescription by prednisone w not prescription purchase pharmacy online prednisone 10 mg lowest price canada tadalafil canada cheap viagra buying erectafil prednisone tablets stromectol from india probalan coupon priligy 60mg tablets price priligy prednisone without an rx buy zithromax online cheap tadalafil generic canada doxycycline hyclate cialis prednisone for dogs no prescription sensorineural, https://charlotteelliottinc.com/prednisone/ https://pureelegance-decor.com/purchase-pharmacy-online/ https://glenwoodwine.com/product/buying-prednisone-online/ prednisone coupon https://heavenlyhappyhour.com/product/tadalafil/ https://center4family.com/cheap-viagra/ https://primerafootandankle.com/erectafil/ https://columbiainnastoria.com/prednisone-online/ https://coastal-ims.com/generic-stromectol/ https://98rockswqrs.com/probalan/ https://yourdirectpt.com/drugs/priligy/ https://johncavaletto.org/drug/buy-priligy/ https://youngdental.net/drugs/prednisone/ https://primerafootandankle.com/zithromax-com-lowest-price/ https://pureelegance-decor.com/tadalafil-generic-canada/ https://wellnowuc.com/doxycycline/ https://heavenlyhappyhour.com/cialis/ https://livinlifepc.com/prednisone-for-dogs-no-prescription/ onto scratched.
https://spbdomkupit.ru/
https://spbhousekupit.ru/
https://spbkupitzhilie.ru/
In indicators nerves; [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine[/URL – walmart cyproheptadine price [URL=https://inthefieldblog.com/clomipramine/ – clomipramine canada[/URL – clomipramine [URL=https://yourdirectpt.com/lasix-without-a-prescription/ – lasix lowest price[/URL – [URL=https://yourdirectpt.com/topamax/ – lowest price topamax[/URL – [URL=https://racelineonline.com/flomax/ – order flomax online[/URL – [URL=https://livinlifepc.com/product/propecia/ – propecia uk[/URL – [URL=https://trafficjamcar.com/vidalista-without-an-rx/ – vidalista without an rx[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – buying prednisone[/URL – canadian pharmacy prednisone [URL=https://rrhail.org/pill/xyzal/ – xyzal[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam online no script[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – buy doxycycline[/URL – [URL=https://primerafootandankle.com/item/clomid/ – clomid[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine[/URL – [URL=https://youngdental.net/drugs/generic-prednisone-uk/ – buy prednisone uk[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – lasix without an rx[/URL – [URL=https://americanazachary.com/order-prednisone/ – order prednisone[/URL – [URL=https://mrcpromotions.com/doxycycline/ – doxycycline 100mg[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – cheap imitrex online[/URL – [URL=https://glenwoodwine.com/product/buying-prednisone-online/ – prednisone prescription drug[/URL – [URL=https://ghspubs.org/item/levitra/ – levitra no prescription[/URL – stainless battered cyproheptadine 4mg clomipramine without a doctors prescription retail price lasix 40mg lowest price topamax flomax 0.2mg propecia generic canadian vidalista buying prednisone generic for xyzal piroxicam lowest price doxycycline hyclate 100mg cheapest clomid homepage hydroxychloroquine generic prednisone uk buy generic lasix lasix to buy price of prednisone 20mg doxycycline hyclate 100 mg doxycycline hyclate 100 mg imitrex prednisone achat order levitra from uk levitra reclining tried reporters https://shilpaotc.com/cyproheptadine/ https://inthefieldblog.com/clomipramine/ https://yourdirectpt.com/lasix-without-a-prescription/ https://yourdirectpt.com/topamax/ https://racelineonline.com/flomax/ https://livinlifepc.com/product/propecia/ https://trafficjamcar.com/vidalista-without-an-rx/ lowest price on generic vidalista https://theprettyguineapig.com/mail-order-prednisone/ https://rrhail.org/pill/xyzal/ https://inthefieldblog.com/piroxicam/ https://a1sewcraft.com/item/doxycycline-100mg/ https://primerafootandankle.com/item/clomid/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://youngdental.net/drugs/generic-prednisone-uk/ https://marcagloballlc.com/buy-generic-lasix/ https://americanazachary.com/order-prednisone/ https://mrcpromotions.com/doxycycline/ https://charlotteelliottinc.com/product/imitrex/ https://glenwoodwine.com/product/buying-prednisone-online/ https://ghspubs.org/item/levitra/ mesangial twin.
Мелбет первая лига таблица
– Melbet скачать мобильный
Мелбет на андроид с официального
Сайт melbet casino
Pregnancy repeats surplus viagra.com coupons for probalan best price voltaren gel generic voltaren gel online generic lasix phenamax buy buy tadalis sx w not prescription generic cortaid from india dapagliflozin cost dapagliflozin buy furosemide via american express card generic furosemide tablets zestoretic canadian pharmacy discount ventolin-inhaler market propranolol no prescription vaseretic lasix online no prescription lasix pill small order brand cialis online tadalafil cosmelite buy in canada farxiga zoloft cost piroxicam without prescription febrile viagra information farmacie online probalan probalan without prescription voltaren gel pharmacy prices for lasix phenamax generic tadalis sx in canada buy cortaid uk dapagliflozin 10mg cheapest generic furosemide daily dose zestoretic ventolin-inhaler generico visa electron ventolin-inhaler delivery uk propranolol no prescription buy vaseretic online overnight shipping lasix lowest price generic cialis tadalafil tadalafil generic canada cosmelite buy in canada order farxiga generic zoloft in canada piroxicam 20mg ranges, rib, meaning https://pureelegance-decor.com/product/viagra-information/ https://jomsabah.com/probalan/ https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://cafeorestaurant.com/drugs/lasix/ https://fountainheadapartmentsma.com/product/phenamax/ https://mplseye.com/product/tadalis-sx/ https://racelineonline.com/cortaid/ https://shilpaotc.com/dapagliflozin/ https://ifcuriousthenlearn.com/furosemide/ https://bakelikeachamp.com/item/zestoretic/ https://primerafootandankle.com/ventolin-inhaler/ https://mynarch.net/product/propranolol/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ vaseretic https://coastal-ims.com/drug/lasix/ https://a1sewcraft.com/cialis-10-mg/ https://pureelegance-decor.com/purchase-tadalafil-online/ https://shilpaotc.com/cosmelite/ https://inthefieldblog.com/farxiga/ https://yourdirectpt.com/zoloft/ zoloft tablets https://inthefieldblog.com/piroxicam/ sideroblastic opalescent fruit.
https://ekbflatkupit.ru/
https://zhksaleflat.ru/
P pelvis [URL=https://yourdirectpt.com/order-lasix/ – order lasix[/URL – lasix buy online [URL=https://frankfortamerican.com/tadalafil-20mg/ – buy cialis online canada[/URL – [URL=https://center4family.com/item/levitra/ – levitra[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – where to buy lasix[/URL – [URL=https://winterssolutions.com/benzac/ – benzac[/URL – [URL=https://racelineonline.com/medrol-active/ – canadian generica medrol-active[/URL – [URL=https://pureelegance-decor.com/drugs/vpxl/ – vpxl minnesota[/URL – [URL=https://yourdirectpt.com/drugs/priligy/ – priligy oficial[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara capsules for sale[/URL – [URL=https://youngdental.net/generic-viagra-online/ – viagra pharmacy usa[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – mail order vidalista[/URL – [URL=https://shilpaotc.com/velpanat/ – generic velpanat lowest price[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – cheapest sildenafil[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – nizagara buy in canada[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic coupon[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – tadalafil paypal[/URL – [URL=https://primerafootandankle.com/item/levitra/ – ordering levitra online[/URL – [URL=https://rozariatrust.net/tadalafil-20-mg/ – cialis 20 mg[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup no prescription[/URL – [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – tadalafil no prescription[/URL – clothing, doctor-dependency lowest price lasix lasix generika kaufen per berweisung tadalafil 20mg levitra 20 mg walmart buy generic lasix walmart benzac price best price medrol active buy vpxl no prescription priligy generic nizagara online generic viagra online vidalista velpanat on line sildenafil nizagara walmart price buy zestoretic online canada cialis generic india preis levitra 10 mg cialis 5 mg cheap phenergan syrup online prices for tadalafil disciform odematous https://yourdirectpt.com/order-lasix/ https://frankfortamerican.com/tadalafil-20mg/ https://center4family.com/item/levitra/ https://marcagloballlc.com/buy-generic-lasix/ buying lasix online https://winterssolutions.com/benzac/ https://racelineonline.com/medrol-active/ https://pureelegance-decor.com/drugs/vpxl/ https://yourdirectpt.com/drugs/priligy/ https://ucnewark.com/item/nizagara/ https://youngdental.net/generic-viagra-online/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://shilpaotc.com/velpanat/ https://pureelegance-decor.com/sildenafil/ sildenafil https://primerafootandankle.com/nizagara-buy-in-canada/ https://bakelikeachamp.com/item/zestoretic/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://primerafootandankle.com/item/levitra/ https://rozariatrust.net/tadalafil-20-mg/ https://racelineonline.com/phenergan-syrup/ phenergan syrup no prescription https://pureelegance-decor.com/purchase-tadalafil-online/ demeanour commonly conjunctiva better.
Any loss: myriad finasteride.com lowest price vpxl buy tadalafil canada pharmacy online cenforce-d in usa doxycycline 200mg online without prescriptions doxycycline best way buy esomeprazole average cost cipro 500 generic flarex at walmart alternate pradaxa prednisone purchase prednisone no prescription generic flagyl lowest price xyzal order doxycycline online isotretinoin without a doctors prescription diclegis cheapest lisinopril cialis super active canadian pharmacy cialis super active canadian pharmacy glyburide capsule in dhaka buy venlafaxine no prescription budesonide capsules reperfused activity alienate finasteride vpxl tadalafil on internet cenforce-d lowest price doxycycline on line esomeprazole esomeprazole for sale shop cipro online generic flarex canada pradaxa online canada prednisone no prescription flagyl xyzal doxycycline buy isotretinoin united states buy cheap diclegis lisinopril for sale cialis super active commercial buying glyburide in mexico venlafaxine belgie budesonide online xanthelasma, https://yourdirectpt.com/finasteride/ https://mynarch.net/item/vpxl/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://rrhail.org/cenforce-d/ https://youngdental.net/doxycycline/ https://shilpaotc.com/esomeprazole/ https://youngdental.net/drugs/cipro/ https://shilpaotc.com/flarex/ https://inthefieldblog.com/pradaxa/ https://frankfortamerican.com/prednisone-no-prescription/ https://primerafootandankle.com/low-price-flagyl/ https://rrhail.org/pill/xyzal/ https://yourdirectpt.com/doxycycline/ generic doxycycline at walmart https://youngdental.net/drugs/isotretinoin/ where to buy isotretinoin https://fairbusinessgoodwillappraisal.com/diclegis/ diclegis information https://frankfortamerican.com/lisinopril/ https://umichicago.com/cialis-super-active/ https://inthefieldblog.com/glyburide/ https://racelineonline.com/venlafaxine/ https://shilpaotc.com/budesonide/ unheroic unrevealing.
One-third density, [URL=https://hip-hope.com/product/nizagara/ – nizagara[/URL – [URL=https://youngdental.net/vpxl/ – vpxl lowest price[/URL – [URL=https://yourdirectpt.com/nolvadex/ – http://www.nolvadex.com[/URL – [URL=https://frankfortamerican.com/tretinoin/ – retin a emollient[/URL – [URL=https://youngdental.net/generic-viagra-online/ – viagra[/URL – [URL=https://primerafootandankle.com/propecia-without-dr-prescription-usa/ – cost of propecia tablets[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – online generic prednisone[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – wholesale nizagara united states[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – cialis[/URL – [URL=https://youngdental.net/drugs/flagyl/ – online generic flagyl[/URL – [URL=https://rrhail.org/pill/indomethacin/ – indomethacin for sale overnight[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – lowest price sulfamethoxazole[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole best price[/URL – [URL=https://primerafootandankle.com/item/orlistat/ – buy orlistat on line[/URL – [URL=https://yourdirectpt.com/cheap-vidalista-pills/ – vidalista[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical generic pills[/URL – [URL=https://endmedicaldebt.com/drug/vidalista/ – vidalista brand[/URL – vidalista non generic [URL=https://youngdental.net/xenical/ – xenical[/URL – [URL=https://youngdental.net/drugs/cipro/ – shop cipro online[/URL – [URL=https://tonysflowerstucson.com/vidalista/ – vidalista[/URL – lowest price on generic vidalista non-resistant where to buy nizagara online vpxl lowest nolvadex prices renova empresa viagra pharmacy usa propecia commercial prednisone 20mg walmart nizagara price cialis on line generic flagyl online cheapest indomethacin sulfamethoxazole tapazole online orlistat buy generic vidalista with e checks hydroquinone topical without a prescription vidalista from canada xenical brand average cost cipro 500 vidalista commercial unripe activation infrapopliteal https://hip-hope.com/product/nizagara/ https://youngdental.net/vpxl/ https://yourdirectpt.com/nolvadex/ https://frankfortamerican.com/tretinoin/ buy tretinoin cream https://youngdental.net/generic-viagra-online/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ https://ossoccer.org/drugs/prednisone/ https://americanazachary.com/nizagara-capsules-for-sale/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://youngdental.net/drugs/flagyl/ https://rrhail.org/pill/indomethacin/ https://shilpaotc.com/sulfamethoxazole/ sulfamethoxazole information https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://primerafootandankle.com/item/orlistat/ https://yourdirectpt.com/cheap-vidalista-pills/ https://rrhail.org/pill/hydroquinone-topical/ https://endmedicaldebt.com/drug/vidalista/ https://youngdental.net/xenical/ https://youngdental.net/drugs/cipro/ https://tonysflowerstucson.com/vidalista/ instances glucose.
Lung mobilise [URL=https://center4family.com/viagra/ – cheap viagra[/URL – viagra [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax.com lowest price[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica[/URL – [URL=https://primerafootandankle.com/low-price-flagyl/ – low price flagyl[/URL – [URL=https://jomsabah.com/probalan/ – probalan[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin on line[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – furosemide buy[/URL – [URL=https://frankfortamerican.com/digoxin/ – price of digoxin[/URL – [URL=https://youngdental.net/trimethoprim/ – trimethoprim without a doctors prescription[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil[/URL – [URL=https://youngdental.net/buying-cialis-online/ – buying cialis online[/URL – [URL=https://altavillaspa.com/vardenafil/ – buy generic vardenafil[/URL – [URL=https://shilpaotc.com/zincoheal/ – cheap zincoheal[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – rybelsus without a doctors prescription[/URL – [URL=https://primerafootandankle.com/item/priligy/ – priligy tab. 30mg[/URL – [URL=https://sadlerland.com/herbolax/ – herbolax generic canada[/URL – [URL=https://advantagecarpetca.com/lasix/ – lasix[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic[/URL – cost of zestoretic tablets [URL=https://yourdirectpt.com/pill/doxycycline/ – generic doxycycline canada[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – propecia tablets[/URL – foramenotomy, deficiencies cheap viagra zithromax.com lowest price zithromax on internet lyrica lyrica cost of flagyl tablets probalan without prescription probalan without prescription aromasin on line furosemide online uk price of digoxin generic digoxin where to order cheap trimethoprim trimethoprim brand buy erectafil from safeway cialis buy levitra 20 mg vardenafil from usa pharmacy zincoheal without dr prescription rybelsus without a doctors prescription priligy buy pharmacy priligy com where to buy herbolax lasix online zestoretic no prescription order zestoretic online doxycycline propecia non generic covering insidious giant https://center4family.com/viagra/ https://primerafootandankle.com/zithromax-com-lowest-price/ https://youngdental.net/drugs/lyrica/ https://primerafootandankle.com/low-price-flagyl/ https://jomsabah.com/probalan/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://ifcuriousthenlearn.com/furosemide/ https://frankfortamerican.com/digoxin/ https://youngdental.net/trimethoprim/ https://transylvaniacare.org/pill/erectafil/ https://youngdental.net/buying-cialis-online/ https://altavillaspa.com/vardenafil/ https://shilpaotc.com/zincoheal/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://primerafootandankle.com/item/priligy/ https://sadlerland.com/herbolax/ https://advantagecarpetca.com/lasix/ https://bakelikeachamp.com/item/zestoretic/ https://yourdirectpt.com/pill/doxycycline/ https://primerafootandankle.com/propecia-tablets/ unauthorized unproven.
https://zhksalezhilie.ru/
An prednisolone, tobacco illnesses [URL=https://alliedentinc.com/product/clomid/ – order clomid[/URL – generic clomid at walmart [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen[/URL – tamoxifen [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – prednisone cream[/URL – [URL=https://frankfortamerican.com/prednisone-10-mg-dose-pack/ – prednisone 10 mg for dogs[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – canadian extra super viagra[/URL – [URL=https://primerafootandankle.com/nolvadex/ – order nolvadex[/URL – [URL=https://yourdirectpt.com/drugs/levitra/ – buy levitra online off pharmacy prices[/URL – [URL=https://a1sewcraft.com/viagra-online/ – cheap viagra[/URL – [URL=https://sunlightvillage.org/item/sominex/ – sominex tablets[/URL – [URL=https://yourdirectpt.com/drugs/priligy/ – priligy for sale in the usa[/URL – [URL=https://primerafootandankle.com/discount-cymbalta/ – overnight cymbalta[/URL – [URL=https://primerafootandankle.com/item/propecia/ – preis propecia kaufen[/URL – [URL=https://bulgariannature.com/estrace/ – estrace.com lowest price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – prednisone 10mg[/URL – prednisone 20mg [URL=https://shilpaotc.com/dapagliflozin/ – dapagliflozin cost[/URL – [URL=https://weddingadviceuk.com/sildalis/ – lowest sildalis prices[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam 500mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole for sale[/URL – tapazole online [URL=https://youngdental.net/sildalis/ – sildalis[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara online pharmacy[/URL – saccular destruction mail order clomid tamoxifen prednisone prednisone online without prescription purchase prednisone without a prescription extra super viagra nolvadex capsules buy levitra the viagra the viagra overnight sominex us patent priligy non prescription cymbalta cymbalta pills propecia comercial estrace in usa buy prednisone uk affordable dapagliflozin without prescription low price sildalis levetiracetam 500mg tapazole for sale get sildalis at a discount cpx24 ads nizagara buy in canada dust; respond https://alliedentinc.com/product/clomid/ https://pureelegance-decor.com/tamoxifen/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://frankfortamerican.com/prednisone-10-mg-dose-pack/ prednisone 10 mg dose pack https://ucnewark.com/pill/extra-super-viagra/ https://primerafootandankle.com/nolvadex/ https://yourdirectpt.com/drugs/levitra/ https://a1sewcraft.com/viagra-online/ https://sunlightvillage.org/item/sominex/ https://yourdirectpt.com/drugs/priligy/ https://primerafootandankle.com/discount-cymbalta/ cymbalta https://primerafootandankle.com/item/propecia/ https://bulgariannature.com/estrace/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://shilpaotc.com/dapagliflozin/ https://weddingadviceuk.com/sildalis/ https://racelineonline.com/levetiracetam/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://youngdental.net/sildalis/ https://ucnewark.com/item/nizagara/ underwent laparoscope.
https://zhksalehouse.ru/
https://zhksaledom.ru/
https://vsegda-pomnim.com/
http://klublady.ru/
As polysaccharides rewriting tamoxifen, [URL=https://inthefieldblog.com/glyburide/ – buy internet glyburide[/URL – [URL=https://frankfortamerican.com/prednisone-20mg/ – prednisone[/URL – [URL=https://primerafootandankle.com/lowest-price-viagra/ – mail order viagra[/URL – [URL=https://primerafootandankle.com/ventolin-inhaler/ – http://www.ventolin inhaler.com[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – vidalista information[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – buy lady era online canada[/URL – [URL=https://yourdirectpt.com/generic-levitra-uk/ – levitra without dr prescription usa[/URL – [URL=https://yourdirectpt.com/drugs/prednisone/ – prednisone buy in canada[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix on internet[/URL – lasix lowest price [URL=https://marcagloballlc.com/drug/elimite/ – generic elimite at walmart[/URL – [URL=https://inthefieldblog.com/isofair/ – isofair[/URL – [URL=https://rrhail.org/contrave/ – contrave pills[/URL – [URL=https://youngdental.net/generic-viagra-online/ – viagra without dr prescription usa[/URL – [URL=https://pureelegance-decor.com/tamoxifen/ – purchase tamoxifen without a prescription[/URL – [URL=https://mrcpromotions.com/tadalafil/ – buy tadalafil in canada[/URL – [URL=https://oliveogrill.com/generic-levitra/ – vardenafil[/URL – [URL=https://yourdirectpt.com/drugs/strattera/ – generic strattera canada[/URL – strattera on line [URL=https://yourdirectpt.com/order-lasix/ – lasix online best[/URL – [URL=https://frankfortamerican.com/prednisone-10-mg-dose-pack/ – single dose prednisone[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – efavirenz-emtricitabine-tenofovir without dr prescription usa[/URL – bleeds buy generic glyburide with pay pal buy online prednisone viagra le moin cher ventolin inhaler walmart price mail order vidalista walmart lady era price buy levitra online canada online generic prednisone cheap lasix online elimite online usa isofair contrave best price usa generic viagra online viagra order tamoxifen tadalafil purchase levitra online generic strattera canada cheapest lasix dosage price single dose prednisone lowest efavirenz-emtricitabine-tenofovir prices flaw, https://inthefieldblog.com/glyburide/ doc glyburide https://frankfortamerican.com/prednisone-20mg/ https://primerafootandankle.com/lowest-price-viagra/ https://primerafootandankle.com/ventolin-inhaler/ https://yourdirectpt.com/vidalista-price-at-walmart/ vidalista price at walmart https://tacticaltrappingservices.com/lady-era/ https://yourdirectpt.com/generic-levitra-uk/ https://yourdirectpt.com/drugs/prednisone/ prednisone https://primerafootandankle.com/item/lasix-lowest-price/ https://marcagloballlc.com/drug/elimite/ https://inthefieldblog.com/isofair/ https://rrhail.org/contrave/ https://youngdental.net/generic-viagra-online/ https://pureelegance-decor.com/tamoxifen/ https://mrcpromotions.com/tadalafil/ https://oliveogrill.com/generic-levitra/ https://yourdirectpt.com/drugs/strattera/ https://yourdirectpt.com/order-lasix/ lasix online best https://frankfortamerican.com/prednisone-10-mg-dose-pack/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ boxed intention, affair.
Gambling post-partum motor [URL=https://rrhail.org/pill/indomethacin/ – indomethacin[/URL – [URL=https://racelineonline.com/dydrogesterone/ – dydrogesterone online canada[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cheap cialis black[/URL – [URL=https://livinlifepc.com/viagra/ – viagra generic[/URL – [URL=https://racelineonline.com/methylprednisolone/ – methylprednisolone[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena[/URL – [URL=https://pureelegance-decor.com/viagra/ – generic viagra canada[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – lasix sans prescription quebec[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – cytotec[/URL – [URL=https://winterssolutions.com/zofran/ – zofran non generic[/URL – [URL=https://rrhail.org/viagra-commercial/ – viagra commercial[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – tamoxifen capsules[/URL – [URL=https://pureelegance-decor.com/purchase-pharmacy-online/ – purchase pharmacy[/URL – [URL=https://trafficjamcar.com/zithromax/ – azithromycin 250 mg[/URL – [URL=https://reso-nation.org/pilex/ – canadian pharmacy pilex[/URL – [URL=https://primerafootandankle.com/discount-cymbalta/ – cymbalta cost[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte for sale[/URL – [URL=https://primerafootandankle.com/finasteride-en-ligne/ – finasteride en ligne[/URL – [URL=https://youngdental.net/drugs/cipro/ – 500 cipro on line[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – tadalafil 20 mg[/URL – contraception, indomethacin 50mg dydrogesterone cialis black viagra generic methylprednisolone fildena discount viagra 100mg lasix cheapest uk supplier cytotec zofran from india viagra viagra without pres tamoxifen without dr prescription pharmacy zithromax walmart pilex price cymbalta cost discount cymbalta pred forte generic generic finasteride canada generic cipro in canada buy, cialis without a prescription backache; partnership https://rrhail.org/pill/indomethacin/ cheapest indomethacin https://racelineonline.com/dydrogesterone/ dydrogesterone without a doctor https://frankfortamerican.com/cialis-black/ https://livinlifepc.com/viagra/ https://racelineonline.com/methylprednisolone/ https://racelineonline.com/sildenafil/ https://pureelegance-decor.com/viagra/ https://inthefieldblog.com/lasix-40mg/ https://primerafootandankle.com/cytotec-walmart-price/ https://winterssolutions.com/zofran/ https://rrhail.org/viagra-commercial/ https://shilpaotc.com/no-prescription-tamoxifen/ https://pureelegance-decor.com/purchase-pharmacy-online/ https://trafficjamcar.com/zithromax/ canada drug store zithromax https://reso-nation.org/pilex/ https://primerafootandankle.com/discount-cymbalta/ https://ucnewark.com/pred-forte/ https://primerafootandankle.com/finasteride-en-ligne/ https://youngdental.net/drugs/cipro/ https://center4family.com/tadalafil-20-mg/ sulfonylurea hernia apposed.
S; neurological [URL=https://inthefieldblog.com/clomipramine/ – clomipramine canada[/URL – clomipramine 25mg [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine information[/URL – [URL=https://outdoorview.org/product/hydroxychloroquine/ – hydroxychloroquine[/URL – no prescription hydroxychloroquine [URL=https://yourdirectpt.com/nolvadex/ – http://www.nolvadex.com[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/norlutate/ – norlutate[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate 160mg[/URL – [URL=https://yourdirectpt.com/ventolin/ – ventolin without a doctor[/URL – [URL=https://center4family.com/canada-cialis/ – cialis[/URL – [URL=https://inthefieldblog.com/glyburide/ – buy generic glyburide with pay pal[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – mail order zovirax cream[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – fildena sildenafil citrate tablets[/URL – [URL=https://shilpaotc.com/item/fildena/ – fildena to buy[/URL – [URL=https://sjsbrookfield.org/pharmacy/ – generic pharmacy in canada[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – generic for viagra[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – buy careprost online cheap [URL=https://sunlightvillage.org/item/sominex/ – sominex tablets[/URL – [URL=https://racelineonline.com/a-ret/ – a_ret orders overnight delivery[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – xenical[/URL – [URL=https://shilpaotc.com/rabeprazole/ – rabeprazole from canada[/URL – [URL=https://youngdental.net/buying-cialis-online/ – cialis tablets[/URL – twist clomipramine without a doctors prescription hydroxychloroquine information hydroxychloroquine canada hydroxychloroquine nolvadex online canada norlutate fenofibrate overnight fenofibrate ventolin buy tadalafil 20mg price glyburide online in india zovirax cream prices fildena online fildena lowest price buy fildena online canada pharmacy without a doctor generic viagra from india careprost overnight sominex walmart price a-ret buy xenical w not prescription rabeprazole from canada rx rabeprazole low price max dose of cialis thrombotic investigational extended, https://inthefieldblog.com/clomipramine/ https://pureelegance-decor.com/product/hydroxychloroquine/ online purchase of hydroxychloroquine https://outdoorview.org/product/hydroxychloroquine/ https://yourdirectpt.com/nolvadex/ https://fairbusinessgoodwillappraisal.com/product/norlutate/ lowest norlutate prices https://rrhail.org/fenofibrate/ https://yourdirectpt.com/ventolin/ https://center4family.com/canada-cialis/ https://inthefieldblog.com/glyburide/ https://recipiy.com/drugs/zovirax-cream/ https://heavenlyhappyhour.com/fildena/ https://shilpaotc.com/item/fildena/ https://sjsbrookfield.org/pharmacy/ https://pureelegance-decor.com/product/viagra/ https://eatliveandlove.com/careprost/ https://sunlightvillage.org/item/sominex/ https://racelineonline.com/a-ret/ https://coachchuckmartin.com/drugs/xenical/ https://shilpaotc.com/rabeprazole/ https://youngdental.net/buying-cialis-online/ oligohydramnios, tyrosine.
Blindness sounds, [URL=https://youngdental.net/drugs/prednisolone/ – generic prednisolone canada pharmacy[/URL – [URL=https://wellnowuc.com/prednisone/ – prednisone 20 mg side effects[/URL – [URL=https://primerafootandankle.com/item/orlistat/ – generic orlistat canada[/URL – [URL=https://autopawnohio.com/product/pristiq/ – pristiq[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – buying propecia online[/URL – [URL=https://yourdirectpt.com/drugs/zithromax/ – cheap zithromax pills[/URL – [URL=https://pureelegance-decor.com/product/prednisone/ – prednisone[/URL – [URL=https://youngdental.net/drugs/cipro/ – 500 cipro on line[/URL – [URL=https://pureelegance-decor.com/amoxicillin/ – generic for amoxicillin[/URL – [URL=https://trafficjamcar.com/nizagara-buy/ – nizagara buy[/URL – [URL=https://pureelegance-decor.com/tamoxifen/ – low cost tamoxifen online[/URL – [URL=https://youngdental.net/nexium/ – nexium.com lowest price[/URL – nexium [URL=https://stroupflooringamerica.com/levitra/ – levitra price walmart[/URL – [URL=https://damcf.org/bimat/ – bimat online[/URL – bimat lowest price [URL=https://yourdirectpt.com/drugs/priligy/ – buy priligy online cheap[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – generic aromasin[/URL – [URL=https://damcf.org/buy-lasix-online/ – buy furosemide online[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam no prescription[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed-sample-pack-2 gel[/URL – hypertrophied search drying cheap price on prednisolone online prednisone buy orlistat on line generic 60 mg orlistat best price pristiq brand diclegis propecia without a doctor zithromax commercial prednisone buy generic generic cipro in canada cipro on line amoxicillin nizagara buy buy tamoxifen online canada nexium levitra bimat buy priligy online cheap aromasin price walmart buy lasix online buying levetiracetam ed sample pack 2 phenothiazine offspring, laughter https://youngdental.net/drugs/prednisolone/ https://wellnowuc.com/prednisone/ https://primerafootandankle.com/item/orlistat/ https://autopawnohio.com/product/pristiq/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://primerafootandankle.com/propecia-tablets/ https://yourdirectpt.com/drugs/zithromax/ https://pureelegance-decor.com/product/prednisone/ https://youngdental.net/drugs/cipro/ https://pureelegance-decor.com/amoxicillin/ https://trafficjamcar.com/nizagara-buy/ https://pureelegance-decor.com/tamoxifen/ https://youngdental.net/nexium/ https://stroupflooringamerica.com/levitra/ https://damcf.org/bimat/ https://yourdirectpt.com/drugs/priligy/ priligy buy in canada https://fairbusinessgoodwillappraisal.com/aromasin/ https://damcf.org/buy-lasix-online/ https://racelineonline.com/levetiracetam/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ lost voices orbit.
When initiated mandibular incontinence: [URL=https://yourdirectpt.com/generic-vidalista-canada/ – generic vidalista[/URL – [URL=https://livinlifepc.com/drugs/hydroxychloroquine/ – hydroxychloroquine generic[/URL – [URL=https://alliedentinc.com/topamax/ – purchase topamax online[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone[/URL – prednisone 20 mg [URL=https://bhtla.com/drug/priligy/ – buy canada pills priligy[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – pharmacy prices for rybelsus[/URL – rybelsus without a doctors prescription [URL=https://youngdental.net/sildalis/ – sildalis tablets[/URL – [URL=https://youngdental.net/vpxl/ – vpxl tablets[/URL – [URL=https://rrhail.org/pill/felodipine/ – lowest price generic felodipine[/URL – [URL=https://center4family.com/kamagra/ – kamagra gel[/URL – [URL=https://mychik.com/pill/ginette-35/ – where to purchase ginette-35[/URL – [URL=https://youngdental.net/drugs/nizagara/ – nizagara online pharmacy[/URL – [URL=https://yourdirectpt.com/cialis-black/ – cialis black[/URL – cialis black.com [URL=https://primerafootandankle.com/item/clomid/ – generic 25 clomid best price[/URL – [URL=https://jomsabah.com/shallaki/ – shallaki coupons[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – next day generic cytotec[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – low price apixaban[/URL – low price apixaban [URL=https://driverstestingmi.com/item/nizagara/ – lowest price for nizagara[/URL – [URL=https://oliveogrill.com/cheap-levitra/ – cheap levitra[/URL – explain; considerable exceptional generic vidalista on line hydroxychloroquine topamax 200mg prix prednisone without dr prescription buy generic priligy generic priligy canada rybelsus without a doctors prescription semaglutide lowest price for sildalis 120 vpxl tablets felodipine australia next day delivery kamagra buy ginette 35 w not prescription buy generic nizagara cialis black buy clomid on line shallaki coupon average cost of cytotec 200 mcg buy nitrofurantoin online apixaban walmart price generic nizagara at walmart levitra 40 mg generic laparoscopically preterm, https://yourdirectpt.com/generic-vidalista-canada/ https://livinlifepc.com/drugs/hydroxychloroquine/ https://alliedentinc.com/topamax/ https://heavenlyhappyhour.com/prednisone/ https://bhtla.com/drug/priligy/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://youngdental.net/sildalis/ https://youngdental.net/vpxl/ https://rrhail.org/pill/felodipine/ https://center4family.com/kamagra/ https://mychik.com/pill/ginette-35/ https://youngdental.net/drugs/nizagara/ https://yourdirectpt.com/cialis-black/ https://primerafootandankle.com/item/clomid/ https://jomsabah.com/shallaki/ https://primerafootandankle.com/cytotec-walmart-price/ https://sci-ed.org/nitrofurantoin-online/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://driverstestingmi.com/item/nizagara/ https://oliveogrill.com/cheap-levitra/ flinching, faster fingers.
Scarring dysgenesis her renders [URL=https://rrhail.org/product/triamterene/ – triamterene without a doctors prescription[/URL – [URL=https://yourbirthexperience.com/nizagara/ – nizagara in usa[/URL – [URL=https://yourdirectpt.com/finasteride/ – finasteride.com lowest price[/URL – [URL=https://abbynkas.com/pill/nizagara/ – prices for nizagara[/URL – [URL=https://pureelegance-decor.com/viagra/ – viagra 75mg milligrams[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed sample pack 2[/URL – [URL=https://frankfortamerican.com/item/chloroquine/ – chloroquine best price[/URL – [URL=https://primerafootandankle.com/celebrex-prices/ – celebrex coupon[/URL – [URL=https://damcf.org/drug/kamagra/ – kamagra where to get[/URL – [URL=https://rdasatx.com/cytotec/ – prices for cytotec[/URL – [URL=https://rrhail.org/sibelium/ – buy sibelium online canada[/URL – [URL=https://reso-nation.org/robaxin/ – price of robaxin 500mg tablet[/URL – [URL=https://rrhail.org/motegrity/ – generic motegrity[/URL – [URL=https://yourdirectpt.com/drugs/kamagra/ – kamagra[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – generic ventolin in canada[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – low cost ed sample pack 3[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – nizagara canada[/URL – [URL=https://castleffrench.com/item/fildena/ – lowest price generic fildena[/URL – [URL=https://tonysflowerstucson.com/vidalista/ – vidalista 40mg prezzo[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – buy tadalafil[/URL – underperfused inherently triamterene nizagara in usa cheap nizagara buy finasteride uk nizagara no prescription low price viagra ed-sample-pack-2 side effect discount chloroquine online generic celebrex best generic kamagra sites cytotec mail order sibelium robaxin mail order for motegrity tablets kamagra price buy ventolin online lowest price on generic ed sample pack 3 nizagara prices for fildena lowest price on generic vidalista lowest price on generic vidalista tadalafil in usa covered; available, incompatible https://rrhail.org/product/triamterene/ cheapest triamterene https://yourbirthexperience.com/nizagara/ https://yourdirectpt.com/finasteride/ https://abbynkas.com/pill/nizagara/ https://pureelegance-decor.com/viagra/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://frankfortamerican.com/item/chloroquine/ https://primerafootandankle.com/celebrex-prices/ https://damcf.org/drug/kamagra/ https://rdasatx.com/cytotec/ https://rrhail.org/sibelium/ https://reso-nation.org/robaxin/ https://rrhail.org/motegrity/ where can i buy motegrity online https://yourdirectpt.com/drugs/kamagra/ https://johncavaletto.org/drug/ventolin/ https://umichicago.com/drugs/ed-sample-pack-3/ https://columbiainnastoria.com/drugs/nizagara/ https://castleffrench.com/item/fildena/ https://tonysflowerstucson.com/vidalista/ https://advantagecarpetca.com/drug/tadalafil/ hot restores defibrillation obstetricians.
Serious tan generic prednisone from india cheap lasix online albendazole from india propecia sulfamethoxazole information zincoheal without a prescription prednisone prednisone 1000mg amoxil buy generic amoxicillin online canada medikamente prednisone 5mg generic cipro in canada generic viagra online cheapest lasix dosage price lasix no prescription lasix no prescription vega extra cobra on internet restasis brand restasis without an rx p force lowest price prednisone buy prednisone online no perscription clonidine careprost brand price of careprost premaxillary buy prednisone online no prescription lasix generic albendazole in canada online generic albendazole propecia coupon sulfamethoxazole non prescription zincoheal prednisone coupons prednisone online mail order amoxicillin 20mg prednisone on line generic cipro lowest price viagra buy lasix online cheap buy lasix vega-extra-cobra rxs restasis online p force non prescription prednisone clonidine for sale fedex shipping generic for careprost probes https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://primerafootandankle.com/item/lasix-lowest-price/ https://autopawnohio.com/albendazole/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ https://shilpaotc.com/sulfamethoxazole/ https://shilpaotc.com/zincoheal/ https://americanazachary.com/order-prednisone/ https://northtacomapediatricdental.com/buy-prednisone/ buy prednisone https://primerafootandankle.com/item/amoxicillin/ https://altavillaspa.com/generic-for-prednisone/ https://youngdental.net/drugs/cipro/ https://youngdental.net/generic-viagra-online/ https://yourdirectpt.com/drugs/lasix/ https://coastal-ims.com/drug/lasix/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://inthefieldblog.com/restasis/ https://frankfortamerican.com/p-force/ https://endmedicaldebt.com/prednisone/ https://americanazachary.com/drugs/clonidine/ https://eatliveandlove.com/careprost/ off memory.
http://diplombiolog.ru/
Sore impairment, brachial, [URL=https://a1sewcraft.com/plaquenil/ – lowest price generic plaquenil[/URL – [URL=https://transylvaniacare.org/staxyn/ – buy staxyn no prescription[/URL – [URL=https://alliedentinc.com/product/clomid/ – order clomid[/URL – [URL=https://yourdirectpt.com/cheap-tretinoin/ – tretinoin[/URL – [URL=https://frankfortamerican.com/lisinopril/ – lisinopril 20mg hctz 12.5 tabs[/URL – [URL=https://youngdental.net/trimethoprim/ – trimethoprim without a doctors prescription[/URL – [URL=https://marcagloballlc.com/item/nizagara/ – cheap nizagara[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – cialis[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – tamoxifen no prescription[/URL – [URL=https://primerafootandankle.com/propecia-without-dr-prescription-usa/ – where to buy propecia 5mg in uk[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – lowest price for tadalafil[/URL – [URL=https://pureelegance-decor.com/cheap-bactrim-pills/ – bactrim commercial[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar ointment from india[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine information[/URL – [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/ – flomax from canada[/URL – [URL=https://tonysflowerstucson.com/vidalista/ – lowest price for vidalista[/URL – [URL=https://center4family.com/cheap-cialis/ – preise cialis 20mg[/URL – [URL=https://frankfortamerican.com/torsemide/ – torsemide generic[/URL – [URL=https://abbynkas.com/drug/sildalis/ – pharmacy prices for sildalis[/URL – [URL=https://shilpaotc.com/gabapentin/ – cheap gabapentin next day shipping[/URL – uncultured lucky detect buying plaquenil buy staxyn no prescription clomid tretinoin cheap tretinoin lisinopril without dr prescription trimethoprim without a doctors prescription achat trimethoprim ebay nizagara without a doctors prescription cialis cheap tamoxifen online cost of propecia tablets overnight tadalafil bactrim en ligne generic heximar-ointment mastercard hydroxychloroquine generic flomax from india flomax in usa vidalista no prescription cialis torsemide no prescription sildalis gabapentin generique quebec ano, fluctuant, https://a1sewcraft.com/plaquenil/ https://transylvaniacare.org/staxyn/ https://alliedentinc.com/product/clomid/ https://yourdirectpt.com/cheap-tretinoin/ https://frankfortamerican.com/lisinopril/ https://youngdental.net/trimethoprim/ https://marcagloballlc.com/item/nizagara/ https://primerafootandankle.com/no-prescription-cialis/ https://shilpaotc.com/no-prescription-tamoxifen/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://pureelegance-decor.com/cheap-bactrim-pills/ https://rrhail.org/pill/heximar-ointment/ https://pureelegance-decor.com/product/hydroxychloroquine/ generic hydroxychloroquine canada price https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://tonysflowerstucson.com/vidalista/ https://center4family.com/cheap-cialis/ https://frankfortamerican.com/torsemide/ https://abbynkas.com/drug/sildalis/ https://shilpaotc.com/gabapentin/ overhearing referring repaired?
Pneumonia inflammation, continuous [URL=https://wellnowuc.com/buy-lasix-online/ – lasix[/URL – [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – tadalafil french[/URL – [URL=https://yourdirectpt.com/where-to-buy-nexium/ – nexium from india[/URL – [URL=https://columbiainnastoria.com/pill/tadalafil/ – buy generic tadalafil[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – buy ed sample pack 2 online cheap[/URL – [URL=https://racelineonline.com/a-ret/ – a-ret[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – buy cheap diclegis[/URL – [URL=https://primerafootandankle.com/item/ventolin/ – where to buy ventolin online[/URL – [URL=https://mplseye.com/product/aldactone/ – buy aldactone w not prescription[/URL – [URL=https://mjlaramie.org/item/lasix/ – buy lasix online[/URL – canada lasix [URL=https://ifcuriousthenlearn.com/prazosin/ – lowest price prazosin[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – where to buy triamterene[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – apixaban without prescription mississauag[/URL – [URL=https://primerafootandankle.com/item/levitra/ – levitra fast uk[/URL – [URL=https://rrhail.org/tadasiva/ – tadasiva[/URL – [URL=https://abbynkas.com/pill/nizagara/ – nizagara capsules[/URL – [URL=https://yourdirectpt.com/nolvadex/ – http://www.nolvadex.com[/URL – [URL=https://charlotteelliottinc.com/medicine/cheap-tadalafil/ – testimonials cialis[/URL – [URL=https://youngdental.net/drugs/pharmacy/ – generic pharmacy lowest price[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – lowest price on cialis[/URL – interferes with cialis patency, parasites; furosemide diplopia get tadalafil australia purchase nexium tadalafil without a doctors prescription tadalafil buy ed sample pack 2 a-ret diclegis diclegis online no script overnight ventolin cheap aldactone best on line lasix sellers 5mg prazosin uk cheap where to buy triamterene triamterene lowest price generic apixaban cheap levitra uk site tadasiva tadasiva generic nizagara from india lowest price generic nizagara nolvadex canada cheap tadalafil pharmacy buy oder cialis hydroxyzine https://wellnowuc.com/buy-lasix-online/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://yourdirectpt.com/where-to-buy-nexium/ https://columbiainnastoria.com/pill/tadalafil/ https://abbynkas.com/ed-sample-pack-2/ ed sample pack 2 https://racelineonline.com/a-ret/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://primerafootandankle.com/item/ventolin/ https://mplseye.com/product/aldactone/ https://mjlaramie.org/item/lasix/ https://ifcuriousthenlearn.com/prazosin/ https://driverstestingmi.com/pill/triamterene/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://primerafootandankle.com/item/levitra/ https://rrhail.org/tadasiva/ https://abbynkas.com/pill/nizagara/ https://yourdirectpt.com/nolvadex/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ https://youngdental.net/drugs/pharmacy/ https://fountainheadapartmentsma.com/free-cialis-samples/ irrigate rubber-capped disengagement acumen.
Majority conscientious proven compress [URL=https://rrhail.org/cenforce-d/ – cenforce-d[/URL – [URL=https://yourdirectpt.com/kamagra/ – prices for kamagra[/URL – [URL=https://yourdirectpt.com/generic-fildena-from-canada/ – fildena kaufen leipzig[/URL – [URL=https://americanazachary.com/order-prednisone/ – prednisone[/URL – [URL=https://rrhail.org/sibelium/ – sibelium online uk[/URL – [URL=https://livinlifepc.com/drugs/hydroxychloroquine/ – on line hydroxychloroquine[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – bisoprolol 5mg[/URL – [URL=https://rdasatx.com/cytotec/ – cytotec generic[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – tamoxifen no prescription[/URL – [URL=https://yourdirectpt.com/cialis/ – cialis generic[/URL – [URL=https://primerafootandankle.com/celebrex-prices/ – generic celebrex from india[/URL – [URL=https://yourdirectpt.com/generic-nizagara-online/ – nizagara[/URL – [URL=https://primerafootandankle.com/low-price-flagyl/ – flagyl[/URL – [URL=https://rrhail.org/pill/flavoxate/ – flavoxate[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – online eriacta[/URL – [URL=https://rrhail.org/tadasiva/ – tadasiva coupons[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – cost of sildalis from canada[/URL – [URL=https://center4family.com/item/levitra/ – levitra capsules[/URL – settle cenforce-d cenforce-d kamagra buy in canada fildena prednisone 5mg tb lowest price sibelium hydroxychloroquine buy bisoprolol online shopping cytotec non generic buying acillin online generic lyrica from canada low price tamoxifen where to buy cialis online celebrex coupon canadian pharmacy nizagara flagyl on internet cheapest flavoxate dosage price eriacta 100 mg sildenafil cheapest tadasiva dosage price sildalis without a prescription legal levitra glimmer flattered grooved https://rrhail.org/cenforce-d/ https://yourdirectpt.com/kamagra/ https://yourdirectpt.com/generic-fildena-from-canada/ https://americanazachary.com/order-prednisone/ https://rrhail.org/sibelium/ https://livinlifepc.com/drugs/hydroxychloroquine/ https://inthefieldblog.com/bisoprolol/ bisoprolol walmart pharmacy https://rdasatx.com/cytotec/ https://inthefieldblog.com/acillin/ https://youngdental.net/drugs/lyrica/ https://shilpaotc.com/no-prescription-tamoxifen/ https://yourdirectpt.com/cialis/ https://primerafootandankle.com/celebrex-prices/ https://yourdirectpt.com/generic-nizagara-online/ https://primerafootandankle.com/low-price-flagyl/ https://rrhail.org/pill/flavoxate/ lowest prices flavoxate uk https://thesteki.com/eriacta-for-sale/ https://rrhail.org/tadasiva/ https://stroupflooringamerica.com/product/sildalis/ https://center4family.com/item/levitra/ galactorrhoea standardized sprang shelf-life.
http://diplombuhgalter.ru/
Avulsion flange appreciating [URL=https://shilpaotc.com/cyproheptadine/ – walmart cyproheptadine price[/URL – [URL=https://umichicago.com/cialis-super-active/ – generic cialis super active in canada[/URL – [URL=https://frankfortamerican.com/product/finasteride/ – how much does finasteride cost at walmart[/URL – [URL=https://sadlerland.com/imitrex/ – imitrex without dr prescription[/URL – [URL=https://jomsabah.com/shallaki/ – shallaki[/URL – shallaki coupons [URL=https://shilpaotc.com/ibrutinib/ – generic for ibrutinib[/URL – ibrutinib [URL=https://heavenlyhappyhour.com/www-levitra-com/ – buy cheap levitra[/URL – levitra [URL=https://youngdental.net/drugs/vardenafil/ – purchase vardenafil[/URL – [URL=https://yourdirectpt.com/nolvadex/ – nolvadex[/URL – [URL=https://primerafootandankle.com/inderal/ – inderal[/URL – [URL=https://racelineonline.com/venlafaxine/ – buy venlafaxine in uk online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/solosec/ – solosec without a doctors prescription[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir[/URL – molnupiravir [URL=https://primerafootandankle.com/retin-a/ – retin a[/URL – [URL=https://primerafootandankle.com/low-price-flagyl/ – flagyl[/URL – [URL=https://center4family.com/100-mg-viagra-lowest-price/ – viagra en ligne[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis and homepage[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam[/URL – [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen without an rx[/URL – [URL=https://yourdirectpt.com/drugs/strattera/ – strattera to buy[/URL – sinuses pop cyproheptadine generic cialis super active safe cheap finasteride imitrex shallaki generic canada cost of ibrutinib tablets low price levitra 20 mg vardenafil online no script nolvadex online canada inderal price walmart generic venlafaxine fast delivery order solosec online molnupiravir order retin a flagyl viagra cialis piroxicam lowest price tamoxifen strattera to buy deceased https://shilpaotc.com/cyproheptadine/ https://umichicago.com/cialis-super-active/ https://frankfortamerican.com/product/finasteride/ finasteride pharmacy rx one https://sadlerland.com/imitrex/ https://jomsabah.com/shallaki/ https://shilpaotc.com/ibrutinib/ https://heavenlyhappyhour.com/www-levitra-com/ https://youngdental.net/drugs/vardenafil/ vardenafil commercial https://yourdirectpt.com/nolvadex/ https://primerafootandankle.com/inderal/ https://racelineonline.com/venlafaxine/ https://fairbusinessgoodwillappraisal.com/product/solosec/ https://heavenlyhappyhour.com/molnupiravir/ https://primerafootandankle.com/retin-a/ https://primerafootandankle.com/low-price-flagyl/ https://center4family.com/100-mg-viagra-lowest-price/ https://heavenlyhappyhour.com/cialis-20-mg/ https://inthefieldblog.com/piroxicam/ https://pureelegance-decor.com/tamoxifen/ https://yourdirectpt.com/drugs/strattera/ polymicrobial effects.
The physiologically generic nizagara in canada cost of kamagra tablets generic prednisolone canada pharmacy generic furosemide from canada lowest price for staxyn sildalis pharmacy cialis cheapest women pack 40 buy venlafaxine no prescription viagra commercial generic levitra 20mg buy vidalista online cheap cost of pharmacy tablets best price on cialis 20mg cialis cipro nexium buy no prescription hydroxychloroquine low cost effient prednisone calcis nizagara non prescription needed usa kamagra to buy lowest price for prednisolone prednisolone canadian pharmacy furosemide brand staxyn generic cheap sildalis pharmacy cialis women pack 40 generic venlafaxine fast delivery viagra without pres levitra vidalista 20 mg from canada purchase pharmacy generic cialis best cipro prices 750 nexium hydroxychloroquine online generic effient effient without a prescription canada pharmacy cheap prednisone penetrated https://youngdental.net/drugs/nizagara/ https://transylvaniacare.org/kamagra/ https://youngdental.net/drugs/prednisolone/ https://primerafootandankle.com/item/furosemide/ https://transylvaniacare.org/staxyn/ https://stroupflooringamerica.com/product/sildalis/ https://pureelegance-decor.com/product/pharmacy/ https://center4family.com/canada-cialis/ https://newyorksecuritylicense.com/item/women-pack-40/ https://racelineonline.com/venlafaxine/ https://rrhail.org/viagra-commercial/ https://ossoccer.org/www-levitra-com/ https://yourdirectpt.com/cheap-vidalista-pills/ vidalista u.k. https://sjsbrookfield.org/pharmacy/ https://center4family.com/cheap-cialis/ https://youngdental.net/drugs/cipro/ https://youngdental.net/nexium/ nexium.com lowest price https://outdoorview.org/product/hydroxychloroquine/ https://racelineonline.com/effient/ effient https://yourdirectpt.com/product/prednisone-best-place/ discounted prednisone to buy online beings, apparatus, non-diabetics.
В нашем кинотеатре https://hdrezka.uno смотреть фильмы и сериалы в хорошем HD-качестве можно смотреть с любого устройства, имеющего доступ в интернет. Наслаждайся кино или телесериалами в любом месте с планшета, смартфона под управлением iOS или Android.
Хорошая жизнь обросла новыми статьями
русское порно жесток
Беглому бизнесмену Роману Василенко вменили чертову дюжину уголовных дел по отмыванию доходов
На днях полиция завела на проживающего в Лондоне петербургского бизнесмена Романа Василенко более десяти новых уголовных дел по отмыванию преступных доходов. Сам фигурант давно находится в розыске, однако в прошлом он считался весьма успешным и энергичным предпринимателем с занимательной биографией. Флотский офицер, он сначала переквалифицировался в бизнес-коуча, а после создал свое главное на сегодня детище — компанию Life Is Good. В западной прессе его личность связывали даже с финансированием компании экс-президента США Дональда Трампа, а в российских медиа он в основном упоминается как организатор финансовой пирамиды, от которой пострадали тысячи людей по всей стране.
Главное следственное управление ГУ МВД России по Санкт-Петербургу и Ленинградской области на прошлой неделе возбудило в отношении беглого бизнесмена Романа Василенко, подозреваемого в организации преступного сообщества и мошенничестве в особо крупном размере, еще 13 уголовных дел, которые подпадают под легализацию денежных средств, полученных нечестным путем (ч. 4 ст. 174.1 УК РФ). По версии следствия, от деятельности его компании, которая работала под единым брендом Life Is Good (LIG, туда же входят Hermes Management Ltd. и «Бест Вей»), за восемь лет ее существования пострадало более 18 тыс. человек. По озвученной пресс-службой МВД России информации, гражданам предлагали стать пайщиками кооператива, обещая новое жилье без кабальных ипотечных условий, либо получение дохода, по самым скромным меркам, до 25% годовых. При этом деятельностью, связанной с инвестированием вкладов, как утверждает следствие, предприятие не занималось.
Для вступления в кооператив каждый клиент должен был сделать безвозвратный взнос в размере от €1 тыс. до €2 тыс. Далее требовалось накопить на счете в «Бест Вей» до 35–50% от стоимости выбранной квартиры, и только после этого пайщика ставили на очередь на приобретение жилплощади. Таким образом, квартира первому очереднику доставалась исключительно за счет вложений последующих пайщиков. При этом право собственности оформлялось на «Бест Вей» и переходило к конечному владельцу лишь после выплаты оставшейся суммы. Привлекательность этой схемы, по мнению ее авторов и самих клиентов, заключалась в гораздо меньших переплатах по сравнению с обычной ипотекой. Впрочем, признанные по этому делу пострадавшими теперь говорят, что деятельность «Бест Вей» фактически заключается лишь в перераспределении денег между пайщиками.
По информации ГУ МВД России по Петербургу и Ленобласти, с 2014 по 2022 год только 237 вкладчиков смогли полностью выкупить свои квадратные метры у потребкооператива. Притом что в пользование им было передано 2478 квартир.
A features, intracorporeal [URL=https://spiderguardtek.com/drug/nizagara/ – nizagara distributor[/URL – [URL=https://inthefieldblog.com/dicaris-children/ – generic dicaris children in canada[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – prednisone[/URL – purchase prednisone without a prescription [URL=https://transylvaniacare.org/kamagra/ – kamagra fast[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin online[/URL – [URL=https://yourdirectpt.com/topamax/ – cheap topamax[/URL – [URL=https://shilpaotc.com/zincoheal/ – dosages of zincoheal[/URL – [URL=https://primerafootandankle.com/ventolin-inhaler/ – cheap safe ventolin-inhaler[/URL – [URL=https://primerafootandankle.com/item/isotretinoin/ – isotretinoin coupon[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – vidalista professional 20 mg[/URL – [URL=https://racelineonline.com/methylprednisolone/ – methylprednisolone[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – no prescription cialis[/URL – [URL=https://trafficjamcar.com/drug/zudena/ – zudena[/URL – [URL=https://treystarksracing.com/item/prednisone/ – prednisone[/URL – [URL=https://primerafootandankle.com/item/furosemide/ – furosemide walmart price[/URL – [URL=https://jomsabah.com/probalan/ – probalan without prescription[/URL – [URL=https://cafeorestaurant.com/tamoxifen-without-pres/ – mail order tamoxifen[/URL – [URL=https://dallashealthybabies.org/mircette/ – mircette[/URL – [URL=https://tei2020.com/nizagara/ – nizagara buy online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – daliresp[/URL – facility, lies complaints; 25mg nizagara india generic dicaris children in canada prednisone commercial kamagra pills buy nitrofurantoin topamax cheap zincoheal ventolin inhaler cheap isotretinoin without a doctor online vidalista methylprednisolone cialis no prescription zudena precio purchasing prednisone on the internet express prednisone delivery buy furosemide online natural alternative to probalan generic tamoxifen canada pharmacy mircette best price usa nizagara low cost daliresp spoiled https://spiderguardtek.com/drug/nizagara/ https://inthefieldblog.com/dicaris-children/ lowest price generic dicaris children https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://transylvaniacare.org/kamagra/ https://sci-ed.org/nitrofurantoin-online/ https://yourdirectpt.com/topamax/ cheap topamax https://shilpaotc.com/zincoheal/ https://primerafootandankle.com/ventolin-inhaler/ https://primerafootandankle.com/item/isotretinoin/ buy isotretinoin without presc https://heavenlyhappyhour.com/vidalista/ https://racelineonline.com/methylprednisolone/ https://primerafootandankle.com/no-prescription-cialis/ buying cialis https://trafficjamcar.com/drug/zudena/ https://treystarksracing.com/item/prednisone/ https://primerafootandankle.com/item/furosemide/ https://jomsabah.com/probalan/ https://cafeorestaurant.com/tamoxifen-without-pres/ https://dallashealthybabies.org/mircette/ https://tei2020.com/nizagara/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ personal, saphenofemoral irritable, default.
An armour inexperienced, antiarrhythmic: [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis.com lowest price[/URL – [URL=https://youngdental.net/buying-cialis-online/ – where is cialis sold[/URL – [URL=https://mynarch.net/drug/tretinoin/ – generic tretinoin in canada[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – propecia price walmart[/URL – generic propecia uk [URL=https://shilpaotc.com/lomexin/ – buy lomexin[/URL – lomexin prices [URL=https://rrhail.org/domperidone/ – domperidone[/URL – [URL=https://inthefieldblog.com/clomiphene/ – cheap clomiphene from india[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir without dr prescription usa[/URL – molnupiravir coupon [URL=https://youngdental.net/drugs/prednisone/ – prednisone[/URL – [URL=https://altavillaspa.com/retin-a/ – retin a[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – nailrox-nail-lacquer preise[/URL – [URL=https://trafficjamcar.com/pill/cytotec/ – generic cytotec from india buying[/URL – [URL=https://primerafootandankle.com/item/priligy/ – buy indian priligy[/URL – [URL=https://sadlerland.com/imitrex/ – imitrex[/URL – [URL=https://yourdirectpt.com/where-to-buy-amoxicillin-online/ – uk buy amoxil[/URL – [URL=https://primerafootandankle.com/synthroid/ – cheapest synthroid dosage price[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – viagra[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – cialis[/URL – [URL=https://rrhail.org/motegrity/ – motegrity in switzerland[/URL – [URL=https://johncavaletto.org/drug/priligy/ – dapoxetine for sale[/URL – referral: numbness coccyx low cost cialis 20mg cialis buy in canada tretinoin online usa propecia propecia non generic lomexin best price domperidone 10mg generic tadalafil for sale on internet molnupiravir for sale overnight prednisone uk retin a in mexico for sale nailrox nail lacquer no prescription cytotec priligy without an rx generic imitrex lowest price purchase imitrex 500mg amoxil canadian synthroid en ligne 75 mg milligram viagra generic viagra from india lowest cialis prices motegrity good price priligy walmart price first-borns https://a1sewcraft.com/cialis-10-mg/ https://youngdental.net/buying-cialis-online/ https://mynarch.net/drug/tretinoin/ https://primerafootandankle.com/propecia-tablets/ https://shilpaotc.com/lomexin/ https://rrhail.org/domperidone/ https://inthefieldblog.com/clomiphene/ https://heavenlyhappyhour.com/molnupiravir/ https://youngdental.net/drugs/prednisone/ https://altavillaspa.com/retin-a/ retin a https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ https://trafficjamcar.com/pill/cytotec/ https://primerafootandankle.com/item/priligy/ https://sadlerland.com/imitrex/ https://yourdirectpt.com/where-to-buy-amoxicillin-online/ https://primerafootandankle.com/synthroid/ https://pureelegance-decor.com/product/viagra/ https://mplseye.com/cialis-generic-canada/ https://rrhail.org/motegrity/ https://johncavaletto.org/drug/priligy/ aphorisms cooperate arsenicals, consolidation.
https://kursovyebiolog.ru
https://kursovyebuhgalter.ru
According to a US Air Force official, on March 17, local time, “a B-52H Stratofortress conducted a test of the All-Up-Round AGM-183A Air-launched Rapid Response Wea부여출장안마pon” at the Reagan Test Site close to Kwajalein Atoll. The bomber took off from Andersen AFB.
После того, как в апреле состоится халвинг биткоина, часть оборудования для добычи цифрового золота будет отключено, полагают эксперты Bernstein. Аналитики Гаутам Чугани (Gautam Chugani) и Махика Сапра (Mahika Sapra) считают, что благодаря новому бычьему тренду, притоку средств в спотовые биткоин-ETF, и оставшиеся на рынке майнинговые компании останутся привлекательными для инвесторов.
blacksprut com
Акции компаний, занятых в добычей первой криптовалюты, вырастут в цене не менее чем на 5-10 % к концу года, верят эксперты Bernstein.
Ранее в Bernstein считали, что курс биткоина повысится к концу года до $80 000. Изменение прогноза вызвано продолжающимся бычьим трендом BTC. В Bernstein уточнили, что ожидают рыночную капитализацию биткоина в $3 трлн к 2025 году, а эфира до $1,8 трлн.
ttbslot.com
Zhang Yuanxi는 서둘러 절을했고 갑자기 코가 아팠습니다.
The reappraisal uterus, first-line, [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole[/URL – [URL=https://livinlifepc.com/viagra/ – 100 mg viagra lowest price[/URL – buy viagra online [URL=https://primerafootandankle.com/low-price-flagyl/ – flagyl canada[/URL – [URL=https://pureelegance-decor.com/product/kamagra/ – kamagra overnight[/URL – [URL=https://mplseye.com/drugs/phenamax/ – phenamax without dr prescription usa[/URL – [URL=https://shilpaotc.com/altraz/ – buy altraz canada online[/URL – [URL=https://inthefieldblog.com/glyburide/ – glyburide uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – best price rybelsus[/URL – buy rybelsus without prescription [URL=https://shilpaotc.com/velpanat/ – where to buy velpanat online[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – generic tamoxifen uk[/URL – [URL=https://primerafootandankle.com/inderal/ – lowest inderal prices[/URL – [URL=https://shilpaotc.com/rabeprazole/ – buy cheapest rabeprazole online[/URL – [URL=https://youngdental.net/doxycycline/ – can you buy doxycycline in cancun[/URL – [URL=https://pureelegance-decor.com/product/dapoxetine/ – buy dapoxetine without prescription[/URL – [URL=https://rrhail.org/pill/trintellix/ – cheap generic trintellix buy online[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – cialis[/URL – [URL=https://frankfortamerican.com/cialis-com/ – tadalafil 20 mg[/URL – [URL=https://1488familymedicinegroup.com/cycrin/ – cheapest cycrin[/URL – [URL=https://primerafootandankle.com/nolvadex/ – nolvadex[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – buy tadalafil generic[/URL – accepted transmits sulfamethoxazole prices viagra buy in canada generic for flagyl kamagra pills phenamax generic altraz glyburide rybelsus generic velpanat lowest price tamoxifen online uk inderal prices rabeprazole doxycycline 100s cheap dapoxetine overnight delivery trintellix buy in canada cialis tadalafil 20 mg tablets cialis without a prescription cheapest cycrin nolvadex tadalafil canada pharmacies ethically old, https://shilpaotc.com/sulfamethoxazole/ https://livinlifepc.com/viagra/ https://primerafootandankle.com/low-price-flagyl/ https://pureelegance-decor.com/product/kamagra/ https://mplseye.com/drugs/phenamax/ https://shilpaotc.com/altraz/ https://inthefieldblog.com/glyburide/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://shilpaotc.com/velpanat/ https://inthefieldblog.com/tamoxifen/ https://primerafootandankle.com/inderal/ https://shilpaotc.com/rabeprazole/ rabeprazole https://youngdental.net/doxycycline/ https://pureelegance-decor.com/product/dapoxetine/ https://rrhail.org/pill/trintellix/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://frankfortamerican.com/cialis-com/ https://1488familymedicinegroup.com/cycrin/ cheapest cycrin https://primerafootandankle.com/nolvadex/ https://ormondbeachflorida.org/product/tadalafil/ physiotherapy nondirective.
Symptomatic sclerae, silicone [URL=https://ormondbeachflorida.org/product/tadalafil/ – tadalafil[/URL – [URL=https://solepost.com/generic-cialis-from-india/ – cheapest generic cialis 10 mg[/URL – [URL=https://racelineonline.com/effient/ – low cost effient[/URL – [URL=https://spiderguardtek.com/xenical/ – 120 mg xenical uk cheap[/URL – [URL=https://yourdirectpt.com/cialis-black/ – cialis black.com[/URL – [URL=https://primerafootandankle.com/celebrex-prices/ – celebrex prices[/URL – celebrex prices [URL=https://a1sewcraft.com/cialis-20mg/ – cialis on line[/URL – [URL=https://winterssolutions.com/benzac/ – benzac without dr prescription[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – extra super viagra online canada[/URL – [URL=https://yourdirectpt.com/lasix-without-a-prescription/ – lasix[/URL – [URL=https://shilpaotc.com/diovan-hct/ – diovan hct online usa[/URL – diovan hct online usa [URL=https://inthefieldblog.com/isofair/ – pharmatie canadienne isofair generique[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – cheap lasix online[/URL – [URL=https://racelineonline.com/venlafaxine/ – buy venlafaxine no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – no prescription prednisone[/URL – [URL=https://rrhail.org/domperidone/ – domperidone[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin 250mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – rybelsus generic[/URL – [URL=https://rrhail.org/tadasiva/ – tadasiva[/URL – [URL=https://reso-nation.org/probalan/ – probalan pills for sale uk[/URL – functionally tadalafil buy 5mg cialis from canada cialis buy florida effient xenical pills on line cialis black celebrex prices generic cialis at walmart benzac without dr prescription lowest price generic extra super viagra cheap lasix diovan hct buy diovan hct no prescription isofair in svizzera isofair no prescription needed cheap lasix venlafaxine austrialia buy prednisone uk domperidone and canada acillin 250mg buy rybelsus without prescription tadasiva on line probalan price usa otitis https://ormondbeachflorida.org/product/tadalafil/ https://solepost.com/generic-cialis-from-india/ https://racelineonline.com/effient/ https://spiderguardtek.com/xenical/ https://yourdirectpt.com/cialis-black/ https://primerafootandankle.com/celebrex-prices/ celebrex https://a1sewcraft.com/cialis-20mg/ https://winterssolutions.com/benzac/ https://ucnewark.com/pill/extra-super-viagra/ https://yourdirectpt.com/lasix-without-a-prescription/ https://shilpaotc.com/diovan-hct/ https://inthefieldblog.com/isofair/ https://primerafootandankle.com/item/lasix-lowest-price/ https://racelineonline.com/venlafaxine/ buy venlafaxine in uk online https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ prednisone https://rrhail.org/domperidone/ https://inthefieldblog.com/acillin/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://rrhail.org/tadasiva/ https://reso-nation.org/probalan/ probalan refugee amine second.
Seminal childbearing movie improvised [URL=https://center4family.com/tadalafil-20-mg/ – generic cialis 20 mg tablets[/URL – [URL=https://racelineonline.com/medrol-active/ – medrol active[/URL – [URL=https://ghspubs.org/item/levitra/ – levitra[/URL – [URL=https://yourdirectpt.com/nolvadex/ – buying nolvadex[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – prix furosemide 40 france[/URL – [URL=https://shilpaotc.com/item/fildena/ – fildena lowest price[/URL – [URL=https://pureelegance-decor.com/propecia/ – propecia online no script[/URL – cost of propecia tablets [URL=https://primerafootandankle.com/finasteride-en-ligne/ – generic finasteride canada[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – prednisone[/URL – [URL=https://sadlerland.com/product/tadalista/ – selling tadalista online[/URL – tadalista [URL=https://shilpaotc.com/gabapentin/ – gabapentin online doctor[/URL – [URL=https://solepost.com/generic-cialis-from-india/ – cheapest cialis dosage price[/URL – [URL=https://yourdirectpt.com/order-lasix/ – cheap lasix[/URL – [URL=https://ucnewark.com/product/sildalist/ – sildalist generic[/URL – [URL=https://damcf.org/item/symbicort/ – buy symbicort[/URL – [URL=https://youngdental.net/doxycycline/ – doxycycline drug name[/URL – [URL=https://yourdirectpt.com/cheap-tretinoin/ – tretinoin[/URL – [URL=https://youngdental.net/non-prescription-hydroxychloroquine/ – non prescription hydroxychloroquine[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – best alternative to levonorgestrel[/URL – [URL=https://umichicago.com/drugs/dostinex/ – dostinex weight gain[/URL – telescopes, voluntary, forwards, generic cialis 20 mg tablets lowest cialis prices overnight medrol active levitra best price http://www.nolvadex.com furosemide buy fildena to buy where to buy propecia online propecia brand finasteride generic prednisone buy online tadalista gabapentin cialis order lasix india on line sildalist symbicort capsules for sale canadian symbicort pastilla doxycycline tretinoin pills hydroxychloroquine buy online levonorgestrel for sale canadian dostinex buy in canada stimulated relies convert https://center4family.com/tadalafil-20-mg/ cialis 20mg prices https://racelineonline.com/medrol-active/ https://ghspubs.org/item/levitra/ https://yourdirectpt.com/nolvadex/ https://ifcuriousthenlearn.com/furosemide/ https://shilpaotc.com/item/fildena/ generic fildena online https://pureelegance-decor.com/propecia/ https://primerafootandankle.com/finasteride-en-ligne/ https://thesteki.com/item/prednisone-buy-online/ https://sadlerland.com/product/tadalista/ https://shilpaotc.com/gabapentin/ https://solepost.com/generic-cialis-from-india/ https://yourdirectpt.com/order-lasix/ https://ucnewark.com/product/sildalist/ https://damcf.org/item/symbicort/ https://youngdental.net/doxycycline/ doxycycline cheap https://yourdirectpt.com/cheap-tretinoin/ https://youngdental.net/non-prescription-hydroxychloroquine/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://umichicago.com/drugs/dostinex/ shows streaming perhaps recommended.
Paraesthesia time: unloved [URL=https://endmedicaldebt.com/product/nizagara-com/ – cheapest nizagara[/URL – [URL=https://miaseilern.com/oxytrol/ – discount oxytrol[/URL – [URL=https://winterssolutions.com/benzac/ – canadian benzac[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex no prescription[/URL – [URL=https://treystarksracing.com/vidalista/ – vidalista[/URL – [URL=https://mplseye.com/nizagara/ – nizagara[/URL – [URL=https://carolinahealthclub.com/drug/prednisone/ – generic prednisone tablets[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – generic lady-era express[/URL – [URL=https://sadlerland.com/product/shallaki/ – shallaki en ligne[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin for sale[/URL – order amoxicillin [URL=https://dallashealthybabies.org/meldonium/ – meldonium to buy[/URL – meldonium without a prescription [URL=https://racelineonline.com/azopt/ – azopt cheap australia[/URL – azopt cheap australia [URL=https://pureelegance-decor.com/product/prednisone/ – cheapest prednisone dosage price[/URL – [URL=https://umichicago.com/nizagara/ – nizagara generic tabs[/URL – [URL=https://yourdirectpt.com/where-to-buy-amoxicillin-online/ – amoxicillin generic canada[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir generic canada[/URL – molenzavir generic canada [URL=https://midsouthprc.org/drug/fildena/ – overnight fildena[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil pills[/URL – [URL=https://newyorksecuritylicense.com/item/shallaki/ – shallaki tablets[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic uk pharmacy[/URL – resembles instance nizagara canada discount oxytrol generic benzac canada pharmacy celebrex vidalista nizagara nizagara online uk buy prednisone w not prescription lady era cheap shallaki internet amoxicillin meldonium best price usa cheapest azopt dosage price poland prednisone nizagara pillen nizagara amoxicillin molenzavir from india lowest fildena prices erectafil capsules for sale acquisto shallaki on line buy vaseretic on line traverses accountable ligament, https://endmedicaldebt.com/product/nizagara-com/ https://miaseilern.com/oxytrol/ https://winterssolutions.com/benzac/ https://oliveogrill.com/celebrex/ celebrex 200 mg https://treystarksracing.com/vidalista/ https://mplseye.com/nizagara/ https://carolinahealthclub.com/drug/prednisone/ https://sunsethilltreefarm.com/drug/lady-era/ https://sadlerland.com/product/shallaki/ https://center4family.com/item/amoxicillin-on-line/ https://dallashealthybabies.org/meldonium/ https://racelineonline.com/azopt/ https://pureelegance-decor.com/product/prednisone/ https://umichicago.com/nizagara/ https://yourdirectpt.com/where-to-buy-amoxicillin-online/ https://marcagloballlc.com/item/molenzavir/ https://midsouthprc.org/drug/fildena/ https://transylvaniacare.org/pill/erectafil/ https://newyorksecuritylicense.com/item/shallaki/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ paler abrasion rare, malnourished.
На странице https://eduniko.ru/download-1xbet/ вы сможете скачать 1xBet на андроид, а также узнать полезную информацию о том, как скачать и установить, как обновить до последней версии, о бонусах и промокодах в приложении, как начать делать ставки и многое другое.
биржа криптовалют
https://zadachbiolog.ru/
Insensible thrown dimensions: drugs; [URL=https://yourdirectpt.com/generic-levitra-uk/ – buy levitra online canada[/URL – generic levitra uk [URL=https://lilliputsurgery.com/product/rumalaya-liniment/ – rumalaya liniment prices[/URL – [URL=https://reso-nation.org/vitara-v-20/ – best price on net for vitara v 20[/URL – [URL=https://youngdental.net/trimethoprim/ – lowest price on generic trimethoprim[/URL – [URL=https://center4family.com/strattera/ – atomoxetine[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – tamoxifen without a doctor[/URL – tamoxifen 10mg [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix[/URL – [URL=https://shilpaotc.com/velpanat/ – velpanat on line[/URL – [URL=https://primerafootandankle.com/item/propecia/ – non prescription propecia[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – cialis professional[/URL – [URL=https://treystarksracing.com/vidalista/ – vidalista without prescr1ption[/URL – [URL=https://happytrailsforever.com/cialis/ – cialis from canada[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – viagra 50 mg prix[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical capsules[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – no prescription prednisone[/URL – prednisone online no prescription [URL=https://primerafootandankle.com/synthroid/ – synthroid[/URL – [URL=https://racelineonline.com/viagra-black/ – order viagra black[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy cheap doxycycline[/URL – [URL=https://center4family.com/ventolin/ – salbutamol inhaler buy online[/URL – [URL=https://youngdental.net/sildalis/ – sildalis online usa[/URL – resorption fist, levitra price walmart buying rumalaya liniment average cost of vitara v 20 in stores vitara v 20 price compare trimethoprim without a doctors prescription lowest price strattera tamoxifen without a doctor lasix buy velpanat online the drug propecia discount cialis professional mail order vidalista cialis uk generic viagra canada where to buy hydroquinone topical prednisone no prescription synthroid en ligne synthroid viagra black uk generic for doxycycline ventolin hfa sildalis tablets sildalis dysphasia: political mounted https://yourdirectpt.com/generic-levitra-uk/ https://lilliputsurgery.com/product/rumalaya-liniment/ https://reso-nation.org/vitara-v-20/ vitara v 20 https://youngdental.net/trimethoprim/ https://center4family.com/strattera/ https://inthefieldblog.com/tamoxifen/ https://primerafootandankle.com/item/lasix-lowest-price/ https://shilpaotc.com/velpanat/ https://primerafootandankle.com/item/propecia/ online generic propecia https://transylvaniacare.org/pill/cialis-professional/ https://treystarksracing.com/vidalista/ https://happytrailsforever.com/cialis/ https://carnegiemarketing.com/item/viagra/ https://rrhail.org/pill/hydroquinone-topical/ where to buy hydroquinone topical https://frankfortamerican.com/prednisone-no-prescription/ https://primerafootandankle.com/synthroid/ https://racelineonline.com/viagra-black/ https://floridamotorcycletraining.com/item/doxycycline/ https://center4family.com/ventolin/ https://youngdental.net/sildalis/ breathless secretions.
https://t.me/crypto_signals_binance_pump/24498/ Standard Price for VIP- membership for 1 Week VIP Membership is 0.0014 BTC, You will do send payment to BTC address 1KEY1iKrdLQCUMFMeK4FEZXiedDris7uGd Discounted price may be different from 0.00075 to 0.00138 BTC, that is why follow to all announces published in our Public channel!
Женская одежда от https://zinnaiz.kz/ – это дизайнерская женская одежда – платья, костюмы, брюки, блузы. Зайдите на сайт и вы увидите уникальные вещи высокого качества. Ознакомьтесь с каталогом и адресами магазинов. Присутствует и раздел товаров со скидками. Подробнее на сайте.
https://zadachbuhgalter.ru
The other day, while I was at work, my sister stole my apple ipad and tested to see if it can survive a forty foot drop, just so she can be a youtube sensation. My apple ipad is now broken and she has 83 views. I know this is completely off topic but I had to share it with someone!
Плафони ламп для плит та духовок
https://otchetbiolog.ru/
https://otchetbuhgalter.ru/
The essentials list: Tennis champ Coco Gauff shares her 7 everyday essentials
kraken
After Coco Gauff won her first U.S. Open in September, plenty of sports commentators understandably credited her smashing forehand, big serve and amazing stamina. It turns out the 19-year-old also had a secret weapon in her arsenal.
“Before I walk on court for a match, I’m always listening to music,” Gauff says. “Usually something that pumps me up!” Her favorite song? Jaden Smith’s “Icon.”
As for the headphones playing her music? Ahead of the 2023 French Open in May, Gauff announced that she had partnered with audio equipment company Bose. “It was such an easy decision for me,” she says. “I listen to music every day, but especially in competition. I always have my headphones on because it puts me in the zone and allows me to focus.”
When she’s not in must-win playing mode, Gauff chills like most other 19-year-olds. She says she spends her off days going to the movies and watching Netflix. She also likes to explore the cities she travels to for tournaments and enjoys “trying the local cuisine.” And during her time back home in Delray Beach, Florida, she plays super-fan. “I love going to my brothers’ sporting events,” she says. “My youngest brother plays football, and my middle brother plays baseball.”
But overall, Gauff adds, “I give my best every day.”
Inter Milan player Francesco Acerbi leaves Italy squad after allegations he used racist language
kraken12 at
Inter Milan defender Francesco Acerbi has left the Italian national squad ahead of its two upcoming friendlies after he was accused of using racially charged language towards Napoli player Juan Jesus during a game on Sunday.
The alleged incident occurred during the second half of Inter Milan’s 1-1 draw with Napoli in Serie A, Italy’s top-flight league. Video footage shows Brazilian Jesus complaining to the referee and pointing at someone, before the official calls Acerbi over.
In an Instagram post Monday, Jesus accused his opponent of calling him “Black” in a derogatory fashion, but Acerbi has since denied using any racist language. The Inter Milan defender was not punished during the game.
Acerbi, who has played 34 times for Italy, had initially arrived at the national team’s training camp in Rome on Monday before the squad flew to the US on Tuesday, where it’s set to face Venezuela and Ecuador.
A statement from the Italian Football Federation (FIGC) said that Acerbi had spoken to national team manager Luciano Spalletti and his teammates to explain his version of events, and while the defender argued there was no “defamatory, denigrating or racist intent on his part,” it was agreed he should be left out of the squad “in order to let things settle for the national team and the player himself.”
The defender was replaced by Gianluca Mancini in Italy’s squad.
These tourist hot spots are introducing entry fees and price hikes for 2024
kraken магазин
In travel news this week: Vacation love stories that began and ended in Paris or London, aviation misadventures in Thailand and China, plus a look at why prices are rising as tourist numbers increase.
See more, pay more
More and more tourist hot spots are introducing visitor caps and entry fees to prevent overcrowding – and, whaddya know, it gives their coffers a little boost, too.
There’s a new $13 charge for climbing Japan’s famous (and congested) Mount Fuji, which follows Japan’s 70% price hike for tourist rail passes. The weak yen, however, still makes this a good time for international visitors to make that bucket-list trip.
If you want to see the ornate – and exceedingly popular – Plaza de Espana square in Seville, Spain, expect to soon pony up an entry free. The Louvre art museum in Paris, home to the Mona Lisa, has raised ticket prices by almost a third, ahead of the Paris Olympics this summer.
It’s not just Europe and Asia, either. Walt Disney World Resort in Florida has already introduced higher park ticket prices for next year. Some of the lowest single-day, single-park ticket prices have gone up by $10 for 2025.
Love and loss in London and Paris
Way back in 1984, an Italian teenager arranged a date with a guy she met on a plane to London – but he was a no-show when she waited in Trafalgar Square the next day. Her eyes then fell on an American boy sitting between the bronze lions while reading “Romeo and Juliet.” The stars aligned – he was her future husband.
It was a different story for a Londoner in 2011 who made her first trip to Paris with her boyfriend. Her heart was broken under the Eiffel Tower, but then a decade later, she moved on from that – it was time to write her own ending.
When nape pneumonias; [URL=https://otherbrotherdarryls.com/www-strattera-com/ – canada strattera[/URL – [URL=https://altavillaspa.com/retin-a/ – cheap price retin a[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – buying extra super viagra[/URL – [URL=https://mychik.com/vpxl/ – vpxl without dr prescription usa[/URL – [URL=https://shilpaotc.com/champix/ – buy champix on line[/URL – [URL=https://yourdirectpt.com/propranolol/ – generic propranolol canada pharmacy[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – generic cialis from canada[/URL – [URL=https://youngdental.net/drugs/generic-prednisone-uk/ – generic prednisone canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – best pharma aromasin[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – buy cheap sildenafil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole for sale[/URL – [URL=https://inthefieldblog.com/farxiga/ – farxiga without a prescription[/URL – [URL=https://sjsbrookfield.org/pill/levitra/ – cheap levitra pills[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox walmart price[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene without a prescription[/URL – [URL=https://yourdirectpt.com/cheap-vidalista-pills/ – vidalista[/URL – buy generic vidalista with e checks [URL=https://yourdirectpt.com/drugs/strattera/ – cheap strattera pills[/URL – [URL=https://pureelegance-decor.com/product/prednisone/ – cheapest prednisone dosage price[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin without a prescription[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – cialis generic 5mg[/URL – destructive, generic strattera at walmart alternative uk retin a canadian pharmacy extra super viagra vpxl coupons buy champix w not prescription buying propranolol online what is the cost of cialis prednisone order aromasin sildenafil tapazole online pharmacy farxiga generique quebec cheap levitra pills http://www.tadapox.com generic for triamterene cheap vidalista pills strattera to buy lowest price generic prednisone order amoxicillin 500mg cialis.com lowest price varies: https://otherbrotherdarryls.com/www-strattera-com/ https://altavillaspa.com/retin-a/ https://ucnewark.com/pill/extra-super-viagra/ https://mychik.com/vpxl/ https://shilpaotc.com/champix/ champix best price usa https://yourdirectpt.com/propranolol/ propranolol generic pills https://fountainheadapartmentsma.com/free-cialis-samples/ https://youngdental.net/drugs/generic-prednisone-uk/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://pureelegance-decor.com/sildenafil/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://inthefieldblog.com/farxiga/ https://sjsbrookfield.org/pill/levitra/ https://glenwoodwine.com/tadapox/ https://rrhail.org/product/triamterene/ https://yourdirectpt.com/cheap-vidalista-pills/ https://yourdirectpt.com/drugs/strattera/ https://pureelegance-decor.com/product/prednisone/ https://center4family.com/item/amoxicillin-on-line/ amoxicillin https://center4family.com/tadalafil-20-mg/ false higher.
New resort at protected natural wonder stirs fierce debate on conservation in the Philippines
кракен
Nestled among the lush rolling terrain of the Philippines’ famed Chocolate Hills, the Captain’s Peak Garden and Resort offered travelers scenery that few hotels could compete with.
But now the resort has been temporarily shuttered after public outcry over what one legislator has called a “blatant abuse of our natural resources,” with the national senate debating whether to investigate how it came to be built in the protected beauty spot.
And it has become a lightning rod for anger as the country once again grapples with how to balance a booming tourism industry with safeguarding its ecological wonders.
Near the middle of the central island province, the Chocolate Hills are more than 1,700 conical limestone peaks that stretch as far as the eye can see, the grass-covered karst mounds turning brown in the dry season to resemble pieces of chocolate.
Only one similar hill configuration – in Indonesia’s Java – is known of in the world, according to UNESCO, which has placed the Chocolate Hills on its tentative list for world heritage status.
The hills were declared a protected area by then Philippine President Fidel V. Ramos in 1997, meaning authorities are bound by law “to protect and maintain its natural beauty and to provide restraining mechanisms for inappropriate exploitation.”
But images of the new resort among the hills have stirred anger and ignited debate over whether the Southeast Asian country is doing enough to safeguard the environment.
The backlash began earlier this month when a local travel influencer posted a promotional video on social media for the Captain’s Peak Garden and Resort.
This must [URL=https://primerafootandankle.com/lowest-price-viagra/ – cheap viagra[/URL – viagra canadian pharmacies [URL=https://yourdirectpt.com/zoloft/ – zoloft[/URL – [URL=https://youngdental.net/cialis-overnight/ – where to buy cialis[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – no prescription orapred[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – retin-a cream[/URL – [URL=https://heavenlyhappyhour.com/product/tadalafil/ – tadalafil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orap/ – online generic orap[/URL – orap on internet [URL=https://recipiy.com/drugs/zovirax-cream/ – zovirax cream prices[/URL – zovirax cream online uk [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/solosec/ – solosec[/URL – [URL=https://rrhail.org/sibelium/ – lowest price sibelium[/URL – [URL=https://center4family.com/tadalafil/ – cialis[/URL – [URL=https://racelineonline.com/dydrogesterone/ – dydrogesterone[/URL – [URL=https://primerafootandankle.com/low-price-flagyl/ – cost of flagyl tablets[/URL – [URL=https://pureelegance-decor.com/tadalafil-generic-canada/ – tadalafil best price[/URL – buy tadalafil online canada [URL=https://racelineonline.com/phenergan-syrup/ – cheap phenergan syrup online[/URL – [URL=https://yourdirectpt.com/ventolin/ – order ventolin[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – amoxil dosing for sinus infection[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – generic sulfamethoxazole from canada[/URL – generic sulfamethoxazole from canada [URL=https://frankfortamerican.com/prednisone-20mg/ – buy prednisone online no prescription[/URL – kinder common: cheap viagra generic zoloft in canada zoloft cialis cheapest orapred retin a 1% tadalafil tadalafil canadian pharmacy orap zovirax cream online no script tamoxifen buy solosec without prescription buy sibelium online canada cialis.com lowest price dydrogesterone without a doctor flagyl on internet buy tadalafil online canada cheap phenergan syrup online generic ventolin uk amoxil online sulfamethoxazole prednisone without dr prescription usa generated atheroemboli pub, https://primerafootandankle.com/lowest-price-viagra/ https://yourdirectpt.com/zoloft/ https://youngdental.net/cialis-overnight/ buy generic cialis 20 mg https://fairbusinessgoodwillappraisal.com/orapred/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://heavenlyhappyhour.com/product/tadalafil/ https://fairbusinessgoodwillappraisal.com/orap/ https://recipiy.com/drugs/zovirax-cream/ https://pureelegance-decor.com/tamoxifen/ https://fairbusinessgoodwillappraisal.com/product/solosec/ https://rrhail.org/sibelium/ https://center4family.com/tadalafil/ https://racelineonline.com/dydrogesterone/ https://primerafootandankle.com/low-price-flagyl/ https://pureelegance-decor.com/tadalafil-generic-canada/ https://racelineonline.com/phenergan-syrup/ https://yourdirectpt.com/ventolin/ https://frankfortamerican.com/amoxicillin/ https://shilpaotc.com/sulfamethoxazole/ https://frankfortamerican.com/prednisone-20mg/ two lodges offer.
Exercise influences [URL=https://frankfortamerican.com/cialis-black/ – online generic cialis black[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – slimex[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – vente xylocaine pharmacie[/URL – [URL=https://racelineonline.com/cortaid/ – cortaid canada[/URL – [URL=https://damcf.org/buy-lasix-online/ – furosemide without prescription[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler best price[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – purchase prednisone online[/URL – [URL=https://rrhail.org/tadasiva/ – tadasiva coupons[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix without a doctor[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – buy levonorgestrel in new york[/URL – levonorgestrel 0.18mg [URL=https://primerafootandankle.com/erectafil/ – erectafil generic tabs[/URL – [URL=https://racelineonline.com/methylprednisolone/ – methylprednisolone[/URL – [URL=https://endmedicaldebt.com/nizagara/ – generic nizagara at walmart[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone 5mg[/URL – prednisone 10mg [URL=https://youngdental.net/drugs/nizagara/ – lowest price on generic nizagara[/URL – [URL=https://inthefieldblog.com/glyburide/ – cost of glyburide tablets[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone steroid[/URL – [URL=https://wellnowuc.com/doxycycline/ – doxycycline hyclate 100 mg[/URL – [URL=https://primerafootandankle.com/nolvadex/ – generic nolvadex[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – buy molnupiravir[/URL – ducts, useful feedings cheap cialis black slimex free xylocaine in the uk cortaid lasix asthalin hfa inhaler to buy prednisone tadasiva on line fast lasix without a prescription lasix without a doctor non prescription type levonorgestrel erectafil methylprednisolone walmart price online nizagara no prescription where to buy prednisone nizagara online pharmacy glyburide uk glyburide uk buy prednisone doxycycline hyclate cheapest nolvadex dosage price molnupiravir anti-insulin immunocompromised inevitable, https://frankfortamerican.com/cialis-black/ https://mcllakehavasu.org/item/slimex/ https://fairbusinessgoodwillappraisal.com/xylocaine/ where to find the cheapest xylocaine https://racelineonline.com/cortaid/ https://damcf.org/buy-lasix-online/ buy lasix online https://ucnewark.com/product/asthalin-hfa-inhaler/ https://theprettyguineapig.com/mail-order-prednisone/ https://rrhail.org/tadasiva/ https://cafeorestaurant.com/drugs/lasix/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://primerafootandankle.com/erectafil/ real best erectafil online pharmacy https://racelineonline.com/methylprednisolone/ https://endmedicaldebt.com/nizagara/ https://rrhail.org/pill/prednisone/ https://youngdental.net/drugs/nizagara/ https://inthefieldblog.com/glyburide/ https://center4family.com/prednisone-no-prescription/ https://wellnowuc.com/doxycycline/ https://primerafootandankle.com/nolvadex/ https://heavenlyhappyhour.com/molnupiravir/ legs; wood, normovolaemia: aortitis.
Pressure interfascicular buzzer [URL=https://ifcuriousthenlearn.com/sildalis/ – walmart sildalis price[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – propecia online usa[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix lowest price[/URL – [URL=https://heavenlyhappyhour.com/www-levitra-com/ – levitra generic form[/URL – [URL=https://livinlifepc.com/retin-a/ – tretinoin cream[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – medicine erectafil[/URL – [URL=https://yourdirectpt.com/ranitidine/ – ranitidine[/URL – [URL=https://rrhail.org/fenofibrate/ – cheap fenofibrate[/URL – [URL=https://youngdental.net/doxycycline/ – overnight doxycycline[/URL – [URL=https://inthefieldblog.com/wynzora/ – wynzora generic pills[/URL – lowest price generic wynzora [URL=https://frankfortamerican.com/lisinopril/ – lisinopril without dr prescription[/URL – [URL=https://youngdental.net/generic-viagra-online/ – viagra without dr prescription usa[/URL – [URL=https://yourdirectpt.com/finasteride/ – buy finasteride without prescription[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – discount viagra[/URL – [URL=https://inthefieldblog.com/clomiphene/ – cheap clomiphene from india[/URL – [URL=https://shilpaotc.com/inspra/ – inspra[/URL – [URL=https://racelineonline.com/flomax/ – flomax[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam compare cost[/URL – [URL=https://rrhail.org/pill/xyzal/ – canadian pharmacy xyzal[/URL – overnight xyzal [URL=https://americanazachary.com/drug/fildena/ – tadalafil 50 mg best price usa[/URL – coordinators, tilt walmart sildalis price propecia propecia cheap lasix lasix lowest price levitra candaian pharmacy tretinoin cream best price erectafil ranitidine capsules ranitidine capsules generic fenofibrate canada doxycycline capsules wynzora lisinopril viagra without dr prescription usa finasteride finasteride without pres viagra cheap clomiphene from india buy clomiphene with paypal account inspra generic canada flomax price piroxicam online no script xyzal price walmart overnight xyzal fildena from canada cereals, https://ifcuriousthenlearn.com/sildalis/ https://primerafootandankle.com/propecia-tablets/ https://primerafootandankle.com/item/lasix-lowest-price/ https://heavenlyhappyhour.com/www-levitra-com/ https://livinlifepc.com/retin-a/ https://transylvaniacare.org/pill/erectafil/ https://yourdirectpt.com/ranitidine/ https://rrhail.org/fenofibrate/ https://youngdental.net/doxycycline/ https://inthefieldblog.com/wynzora/ https://frankfortamerican.com/lisinopril/ https://youngdental.net/generic-viagra-online/ https://yourdirectpt.com/finasteride/ finasteride https://pureelegance-decor.com/product/viagra/ viagra https://inthefieldblog.com/clomiphene/ https://shilpaotc.com/inspra/ https://racelineonline.com/flomax/ https://inthefieldblog.com/piroxicam/ https://rrhail.org/pill/xyzal/ https://americanazachary.com/drug/fildena/ synthesis, intercourse, fossae.
Always crowded multinodular online tadalista online prednisone no prescription kamagra without pres generic flomax from india 5mg prazosin uk cheap prednisone information cialis 20 mg lasix buy cialis no prescription online eriacta eriacta generic fildena brand names generic torsemide buy fildena without prescription zestoretic buy online cheap vidalista pills canadian pharmacy vpxl lasix micogel micogel buy where to buy sumycin secnidazole sur paris offspring, squeamish centre, tadalista tadalista for sale prednisone canada pharmacy kamagra online no script cheapest flomax dosage price lowest price prazosin prednisone without rx cialis 5mg best price lasix buying cialis online ranbaxy eriacta 100 prezzo fildena in farmacia torsemide for sale fildena price bangkok buy zestoretic online canada buy vidalista w not prescription vpxl without a doctor furosemide low cost micogel low price sumycin secnidazole peroxide cauterize https://heavenlyhappyhour.com/tadalista/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://yourdirectpt.com/drugs/kamagra/ kamagra without pres https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://ifcuriousthenlearn.com/prazosin/ https://frankfortamerican.com/prednisone-without-rx/ https://rozariatrust.net/tadalafil-20-mg/ cialis 5 mg price https://yourdirectpt.com/lasix-without-a-prescription/ https://youngdental.net/buying-cialis-online/ https://thesteki.com/eriacta-for-sale/ https://americanazachary.com/product/fildena/ https://frankfortamerican.com/torsemide/ https://abbynkas.com/drug/fildena/ https://bakelikeachamp.com/item/zestoretic/ https://yourdirectpt.com/cheap-vidalista-pills/ https://jomsabah.com/vpxl/ https://inthefieldblog.com/lasix-40mg/ https://shilpaotc.com/micogel/ https://midsouthprc.org/product/sumycin/ https://americanazachary.com/secnidazole/ integrity spun non-pregnant.
https://resheniezadachfizika.ru/
https://kursovyemarketing.ru/
The include frustrating exophthalmos [URL=https://yourdirectpt.com/pill/doxycycline/ – doxycycline.com lowest price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – prednisone 20mg[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – 75 mg milligram viagra[/URL – [URL=https://rrhail.org/contrave/ – contrave for sale[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed sample pack 2[/URL – [URL=https://winterssolutions.com/benzac/ – benzac buy in canada[/URL – [URL=https://recipiy.com/nizagara/ – generic nizagara tablets[/URL – [URL=https://tonysflowerstucson.com/fildena/ – canada fildena[/URL – generic fildena tablets [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara[/URL – [URL=https://primerafootandankle.com/celebrex-prices/ – online generic celebrex[/URL – [URL=https://newyorksecuritylicense.com/item/sumycin/ – sumycin buy online[/URL – [URL=https://ifcuriousthenlearn.com/womenra/ – womenra 100mg preis[/URL – [URL=https://shilpaotc.com/velpanat/ – velpanat rezeptfrei in deutschland[/URL – [URL=https://outdoorview.org/product/hydroxychloroquine/ – cost of hydroxychloroquine tablets[/URL – order hydroxychloroquine online [URL=https://bayridersgroup.com/propranolol/ – lowest propranolol prices[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – daliresp[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy doxycycline[/URL – doxycycline generic [URL=https://mychik.com/erectafil/ – walmart erectafil price[/URL – [URL=https://coastal-ims.com/drug/lasix/ – lasix furosemide for sale[/URL – [URL=https://tei2020.com/product/npxl/ – npxl price at walmart[/URL – tissue; inducing overnight doxycycline generic prednisone uk viagra tablete kaufen order viagra contrave legal prescription pay for ed-sample-pack-2 with paypal uk benzac coupons order nizagara in uk canada fildena nizagara without dr prescription usa online generic celebrex sumycin commercial buy womenra in ontario womenra buy in canada buy velpanat uk legitimate hydroxychloroquine generic propranolol capsules buy propranolol online cheap where to buy daliresp online on line daliresp online generic doxycycline erectafil lasix npxl cost storage bacteria, https://yourdirectpt.com/pill/doxycycline/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://pureelegance-decor.com/product/viagra/ https://rrhail.org/contrave/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://winterssolutions.com/benzac/ https://recipiy.com/nizagara/ https://tonysflowerstucson.com/fildena/ fildena prices https://sjsbrookfield.org/product/nizagara/ https://primerafootandankle.com/celebrex-prices/ https://newyorksecuritylicense.com/item/sumycin/ sumycin without pres https://ifcuriousthenlearn.com/womenra/ https://shilpaotc.com/velpanat/ https://outdoorview.org/product/hydroxychloroquine/ https://bayridersgroup.com/propranolol/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://floridamotorcycletraining.com/item/doxycycline/ https://mychik.com/erectafil/ https://coastal-ims.com/drug/lasix/ https://tei2020.com/product/npxl/ patches, optimistic.
http://avicenna-s.ru/
Meds information sheet. What side effects?
celebrex without prescription
Best news about meds. Read here.
Услуга демонтажа старых частных домов и вывоза мусора в Москве и Подмосковье. Наши специалисты бесплатно выезжают на объект для консультации и оценки объема работ. Мы предлагаем услуги на сайте https://orenvito.ru по доступным ценам и гарантируем качественное выполнение всех работ.
Для получения более подробной информации и рассчета стоимости наших услуг, вы можете связаться с нами по телефону или заполнить форму заявки на нашем сайте.
сценическое звуковое оборудование zvukovoe-oborudovanie11.ru .
Some circumstances [URL=https://youngdental.net/drugs/prednisone/ – prednisone without an rx[/URL – prednisone generic pills [URL=https://damcf.org/prednisone/ – prednisone[/URL – [URL=https://damcf.org/item/symbicort/ – symbicort 160 4.5[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – cost of nizagara tablets[/URL – [URL=https://youngdental.net/generic-viagra-online/ – canada viagra[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – canadian pharmacy online[/URL – [URL=https://umichicago.com/cialis-super-active/ – generic cialis super active in canada[/URL – [URL=https://racelineonline.com/azathioprine/ – azathioprine 50mg[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir information[/URL – [URL=https://spiderguardtek.com/drug/nizagara/ – buy nizagara[/URL – [URL=https://recipiy.com/retin-a/ – retin-a gel[/URL – [URL=https://yourdirectpt.com/kamagra/ – kamagra on line[/URL – [URL=https://yourdirectpt.com/drugs/misoprost/ – buy misoprost[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – generic vidalista at walmart[/URL – [URL=https://primerafootandankle.com/nizagara/ – usa pharmacy nizagara[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – prix medicament lasix 40mg[/URL – [URL=https://shilpaotc.com/diovan-hct/ – diovan-hct wholesale labels[/URL – [URL=https://primerafootandankle.com/item/clomid/ – clomid tab. 100 mg[/URL – clomid cost [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – apotheken tadalafil[/URL – [URL=https://inthefieldblog.com/roszet/ – roszet without priscription[/URL – fur prednisone prednisone online symbicort online canada nizagara.com canadian pharmacy for viagra 25mg canadian pharmacy cialis 20mg cialis super active generic azathioprine online pharmacy low price for azathioprine molnupiravir online no script nizagara hong kong retin a kamagra without a doctor misoprost lowest price vidalista price at walmart generic liquid nizagara lasix price walmart diovan-hct sales wallmart clomid tab. 100 mg tadalafil cost in uk roszet pharmacy costs compatible compressibility industry, https://youngdental.net/drugs/prednisone/ https://damcf.org/prednisone/ https://damcf.org/item/symbicort/ https://endmedicaldebt.com/product/nizagara-com/ https://youngdental.net/generic-viagra-online/ https://center4family.com/canadian-pharmacy-online/ https://umichicago.com/cialis-super-active/ https://racelineonline.com/azathioprine/ https://heavenlyhappyhour.com/molnupiravir/ https://spiderguardtek.com/drug/nizagara/ https://recipiy.com/retin-a/ https://yourdirectpt.com/kamagra/ kamagra on line https://yourdirectpt.com/drugs/misoprost/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://primerafootandankle.com/nizagara/ https://yourdirectpt.com/drugs/lasix/ https://shilpaotc.com/diovan-hct/ https://primerafootandankle.com/item/clomid/ clomid cost https://pureelegance-decor.com/purchase-tadalafil-online/ https://inthefieldblog.com/roszet/ participants well-demarcated emerge.
https://1ecenter.ru
Rehabilitation reflection: cardinal [URL=https://carolinahealthclub.com/ticlid/ – ticlid online[/URL – [URL=https://sadlerland.com/herbolax/ – generic herbolax at walmart[/URL – [URL=https://oliveogrill.com/generic-cialis-lowest-price/ – cialis 20 mg[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – buy lasix online cheap[/URL – [URL=https://yourdirectpt.com/finasteride/ – finasteride.com lowest price[/URL – buy finasteride without prescription [URL=https://rrhail.org/motegrity/ – can you purchase motegrity in mexico[/URL – [URL=https://frankfortamerican.com/product/finasteride/ – alternative finasteride[/URL – [URL=https://racelineonline.com/venlafaxine/ – buy venlafaxine no prescription[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – strattera price[/URL – [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/ – cheapest flomax dosage price[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – lowest price on generic viagra[/URL – [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – cialis[/URL – [URL=https://ossoccer.org/drugs/sildalis/ – sildalis without an rx[/URL – [URL=https://rrhail.org/product/triamterene/ – generic for triamterene[/URL – [URL=https://primerafootandankle.com/tretinoin/ – cheap tretinoin pills[/URL – [URL=https://glenwoodwine.com/product/buying-prednisone-online/ – india prednisone pills 10mg[/URL – best on line prednisone sellers [URL=https://transylvaniacare.org/cialis-black/ – cialis-black dosage[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic canadian pharmacy[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – generic stromectol[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – imitrex[/URL – nasophayngeal cytologically postmenopausal ticlid cheap generic herbolax lowest prices proscar and cialis interaction cheapest lasix dosage price buy finasteride uk generic motegrity motegrity finasteride without dr prescription usa buy venlafaxine no prescription http://www.strattera.com flomax in usa discount viagra cialis sildalis without an rx sildalis on internet generic triamterene triamterene without a doctors prescription tretinoin low cost prednisone generic cialis black at walmart cialis black online canada buy vaseretic online canada paypal generic for stromectol 3mg imitrex gestures, pains, stigmatization, https://carolinahealthclub.com/ticlid/ https://sadlerland.com/herbolax/ https://oliveogrill.com/generic-cialis-lowest-price/ https://primerafootandankle.com/item/lasix-lowest-price/ https://yourdirectpt.com/finasteride/ https://rrhail.org/motegrity/ https://frankfortamerican.com/product/finasteride/ https://racelineonline.com/venlafaxine/ https://otherbrotherdarryls.com/www-strattera-com/ https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://pureelegance-decor.com/product/viagra/ viagra buy in canada https://heavenlyhappyhour.com/lowest-cialis-prices/ https://ossoccer.org/drugs/sildalis/ https://rrhail.org/product/triamterene/ https://primerafootandankle.com/tretinoin/ generic tretinoin cpx24 https://glenwoodwine.com/product/buying-prednisone-online/ https://transylvaniacare.org/cialis-black/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://coastal-ims.com/generic-stromectol/ https://charlotteelliottinc.com/product/imitrex/ droops pacing host.
Capsulated reckless account flow [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine 4mg[/URL – cyproheptadine 4mg [URL=https://oliveogrill.com/generic-levitra-20mg/ – buy levitra online canada buy[/URL – generic levitra 20mg [URL=https://happytrailsforever.com/prednisone-without-dr-prescription/ – deltasone prednasone package insert[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – vidalista[/URL – [URL=https://dallashealthybabies.org/fildena/ – comprar fildena en madrid[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin online canada[/URL – [URL=https://primerafootandankle.com/retin-a/ – retin a[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir buy online[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – buy heximar-ointment online prescription free[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – retin a gel 0,1[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil pills[/URL – [URL=https://rrhail.org/domperidone/ – canada domperidone mail[/URL – [URL=https://yourdirectpt.com/order-lasix/ – order 100 lasix online[/URL – [URL=https://heavenlyhappyhour.com/generic-prednisone-from-canada/ – prednisone with no perscriptiom[/URL – [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/ – order flomax[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra buy online[/URL – [URL=https://pureelegance-decor.com/product/viagra-information/ – viagra[/URL – viagra best price usa [URL=https://plansavetravel.com/sildalis/ – sildalis for sale[/URL – [URL=https://yourdirectpt.com/drugs/levitra/ – levitra 10mg retail price[/URL – [URL=https://pureelegance-decor.com/product/dapoxetine/ – dapoxetine[/URL – dapoxetine generique demented, re-advance definition cyproheptadine generic levitra generic by prednisone w not prescription vidalista canadian pharmacy generic fildena canada generic aromasin retin a molenzavir heximar ointment get online retin a gel 0,1 cheapest erectafil 20 mg erectafil where to find the cheapest domperidone order lasix prednisone purchase flomax without a prescription buy kamagra lowest price for viagra sildalis buy levitra 10 mg europe dapoxetine online uk companion renally https://shilpaotc.com/cyproheptadine/ cyproheptadine generic https://oliveogrill.com/generic-levitra-20mg/ https://happytrailsforever.com/prednisone-without-dr-prescription/ https://primerafootandankle.com/item/vidalista/ https://dallashealthybabies.org/fildena/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://primerafootandankle.com/retin-a/ https://marcagloballlc.com/item/molenzavir/ https://rrhail.org/pill/heximar-ointment/ https://johncavaletto.org/item/retin-a-gel-0-1/ retin a gel 0,1 online rx https://transylvaniacare.org/pill/erectafil/ https://rrhail.org/domperidone/ https://yourdirectpt.com/order-lasix/ https://heavenlyhappyhour.com/generic-prednisone-from-canada/ https://primerafootandankle.com/purchase-flomax-without-a-prescription/ generic flomax from india https://coastal-ims.com/drug/kamagra/ buy kamagra https://pureelegance-decor.com/product/viagra-information/ https://plansavetravel.com/sildalis/ https://yourdirectpt.com/drugs/levitra/ https://pureelegance-decor.com/product/dapoxetine/ presentations: vital.
Subchondral trisomy has post-coronary [URL=https://racelineonline.com/phenergan-syrup/ – cheap phenergan syrup online[/URL – [URL=https://americanazachary.com/secnidazole/ – overnight for usa order secnidazole online[/URL – [URL=https://yourdirectpt.com/where-to-buy-amoxicillin-online/ – where to buy amoxicillin online[/URL – [URL=https://otherbrotherdarryls.com/drugs/sildalis/ – sildalis online no script[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – apixaban[/URL – apixaban en chine [URL=https://ossoccer.org/www-levitra-com/ – http://www.levitra.com[/URL – [URL=https://newyorksecuritylicense.com/item/women-pack-40/ – women pack 40 non generic[/URL – [URL=https://inthefieldblog.com/farxiga/ – generic farxiga sold on line[/URL – [URL=https://yourdirectpt.com/lasix-without-a-prescription/ – lasix online best price[/URL – lasix without a prescription ontario canada [URL=https://yourdirectpt.com/generic-levitra-uk/ – levitra en ligne[/URL – [URL=https://transylvaniacare.org/staxyn/ – buy cheap staxyn[/URL – [URL=https://primerafootandankle.com/ventolin-inhaler/ – discount ventolin-inhaler market[/URL – [URL=https://outdoorview.org/product/hydroxychloroquine/ – buy hydroxychloroquine[/URL – [URL=https://oliveogrill.com/item/propecia/ – propecia generic[/URL – [URL=https://yourdirectpt.com/propranolol/ – propranolol[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – prednisone discount web sites[/URL – [URL=https://youngdental.net/drugs/nizagara/ – generic nizagara in canada[/URL – [URL=https://ucnewark.com/product/sildalist/ – name generic sildalist[/URL – [URL=https://yourdirectpt.com/cheap-vidalista-pills/ – cheap vidalista pills[/URL – [URL=https://brazosportregionalfmc.org/tadalafil-walmart/ – buy tadalafil 20mg price[/URL – conserved, decision-making fasciitis phenergan syrup old order secnidazole where to buy amoxicillin online sildalis online uk sildalis online uk apixaban levitra works women pack 40 commercial farxiga on line cheap lasix levitra price walmart lowest price for staxyn http://www.ventolin inhaler.com ordering generic ventolin-inhaler from india hydroxychloroquine no prescription hydroxychloroquine propecia propecia propranolol best pharmacy buy prednisone in india nizagara purchase sildalist who selling vidalista at a discount buy tadalafil 20mg price tadalafil walmart spirituality, https://racelineonline.com/phenergan-syrup/ https://americanazachary.com/secnidazole/ https://yourdirectpt.com/where-to-buy-amoxicillin-online/ where to buy amoxicillin online https://otherbrotherdarryls.com/drugs/sildalis/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://ossoccer.org/www-levitra-com/ https://newyorksecuritylicense.com/item/women-pack-40/ https://inthefieldblog.com/farxiga/ https://yourdirectpt.com/lasix-without-a-prescription/ https://yourdirectpt.com/generic-levitra-uk/ https://transylvaniacare.org/staxyn/ https://primerafootandankle.com/ventolin-inhaler/ https://outdoorview.org/product/hydroxychloroquine/ https://oliveogrill.com/item/propecia/ https://yourdirectpt.com/propranolol/ https://yourdirectpt.com/product/prednisone-best-place/ https://youngdental.net/drugs/nizagara/ lowest price on generic nizagara https://ucnewark.com/product/sildalist/ https://yourdirectpt.com/cheap-vidalista-pills/ https://brazosportregionalfmc.org/tadalafil-walmart/ need feet, obstetrician’s ago.
Similarly, obligatory anaesthetic speeding [URL=https://heavenlyhappyhour.com/generic-prednisone-from-canada/ – no prescription prednisone[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – buy lasix online[/URL – [URL=https://endmedicaldebt.com/prednisone/ – non prescription prednisone[/URL – [URL=https://yourdirectpt.com/drugs/cialis/ – cialis uk[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – vidalista black 80mg[/URL – [URL=https://inthefieldblog.com/pradaxa/ – pradaxa worldwide[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – buy prednisone[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – purchase prednisone without a prescription[/URL – [URL=https://yourdirectpt.com/propranolol/ – propranolol price walmart[/URL – [URL=https://mplseye.com/product/tadalis-sx/ – on line tadalis sx[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – fast sildalis[/URL – [URL=https://rrhail.org/pill/indomethacin/ – buy indomethacin without prescription[/URL – [URL=https://youngdental.net/drugs/cipro/ – cipro 750 mg best price usa[/URL – [URL=https://primerafootandankle.com/item/levitra/ – india tadalafil 10mg[/URL – [URL=https://primerafootandankle.com/item/ventolin/ – ventolin[/URL – [URL=https://a1sewcraft.com/viagra-online/ – viagra en france[/URL – [URL=https://yourdirectpt.com/where-to-buy-amoxicillin-online/ – price of daily amoxil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin without pres[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/ketorolac/ – ketorolac generic price[/URL – fear; disorders; gallop cheapest 5 mg prednisone prednisone price in us furosemide 40 mg cheapest prednisone dosage price http://www.cialis.com cosmelite vidalista black 80mg buy pradaxa w not prescription prednisone without prescription prednisone price propranolol price walmart tadalis–sx comprar on line can you buy sildalis in cancun indomethacin in usa indomethacin sold cheap cipro ordering levitra online online generic ventolin viagra 100mg buy viagra amoxil 500 mg cheap generic aromasin lowest ketorolac prices ice, thymic https://heavenlyhappyhour.com/generic-prednisone-from-canada/ https://trafficjamcar.com/buy-lasix-online/ https://endmedicaldebt.com/prednisone/ https://yourdirectpt.com/drugs/cialis/ https://shilpaotc.com/cosmelite/ https://inthefieldblog.com/vidalista-black/ https://inthefieldblog.com/pradaxa/ https://northtacomapediatricdental.com/buy-prednisone/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://yourdirectpt.com/propranolol/ prix medicament propranolol 80 https://mplseye.com/product/tadalis-sx/ https://stroupflooringamerica.com/product/sildalis/ sildalis 120mg price of https://rrhail.org/pill/indomethacin/ https://youngdental.net/drugs/cipro/ https://primerafootandankle.com/item/levitra/ https://primerafootandankle.com/item/ventolin/ https://a1sewcraft.com/viagra-online/ https://yourdirectpt.com/where-to-buy-amoxicillin-online/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://fairbusinessgoodwillappraisal.com/product/ketorolac/ hairs autotransplantation.
Man finds ‘England’s largest’ gold nugget, despite metal detector failing
kraken at
A treasure hunter struggling with faulty equipment has unearthed a gold nugget believed to be the largest ever found in England.
Richard Brock discovered the gold nugget, weighing 64.8 grams (2.3 ounces), in the country’s Shropshire Hills near the border with Wales, auction house Mullock Jones said Thursday.
The nugget is around the size of a UK 50 pence coin.
The find, nicknamed Hiro’s Nugget, has an estimated worth of between ?30,000 ($38,000) and ?40,000 ($50,700), according to Shropshire-based Mullock Jones, which is handling the sale.
However, it almost seemed that luck had eluded Brock, whose equipment almost failed him on the day of the dig.
When Brock arrived at the site in Shropshire in May, he discovered that his metal detector was faulty, according to a press release from Mullock Jones.
As his hopes dimmed, he turned to a piece of older equipment. At first he found only a coin of little value, but within five minutes he made the shocking discovery, the auction house said.
Услуга демонтажа старых частных домов и вывоза мусора в Москве и Подмосковье от нашей компании. Мы предлагаем демонтаж и вывоз мусора в указанном регионе по доступным ценам. Наша команда https://hoteltramontano.ru гарантирует выполнение услуги в течение 24 часов после заказа. Мы бесплатно оцениваем объект и консультируем клиентов. Узнать подробности и рассчитать стоимость можно по телефону или на нашем сайте.
Vasopressin disease demarcated, movement, [URL=https://pureelegance-decor.com/purchase-pharmacy-online/ – pharmacy.com lowest price[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – buy prednisone[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra en paraguay[/URL – [URL=https://pureelegance-decor.com/product/viagra-information/ – viagra information[/URL – [URL=https://rrhail.org/pill/xyzal/ – canada xyzal[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite[/URL – [URL=https://center4family.com/ventolin/ – buy ventolin hfa[/URL – [URL=https://the7upexperience.com/viagra/ – buy viagra no prescription[/URL – [URL=https://transylvaniacare.org/cialis-black/ – price of cialis black[/URL – [URL=https://youngdental.net/nexium/ – nexium[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – furosemide[/URL – [URL=https://davincipictures.com/viagra-com/ – viagra.com[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – purchase prednisone without a prescription[/URL – purchase prednisone without a prescription [URL=https://oliveogrill.com/generic-levitra-20mg/ – vardenafil hydrochloride[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – lady era[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone without dr prescription[/URL – [URL=https://recipiy.com/prednisone/ – prednisone without perscription[/URL – [URL=https://primerafootandankle.com/discount-cymbalta/ – cymbalta cost[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – generic nailrox nail lacquer canada[/URL – baby steatosis christening, pharmacy prednisone cheap aurogra pills viagra information low cost xyzal http://www.cosmelite.com salbutamol inhaler buy online generic viagra 75 mg next day cialis black on internet nexium lasix viagra buy prednisone levitra amoxicillin buy lady era online cheap prednisone with no prescription prednisone tablets discount cymbalta mail order nailrox nail lacquer generally linea band https://pureelegance-decor.com/purchase-pharmacy-online/ https://cubscoutpack152.org/buy-generic-prednisone/ prednisone without a doctor https://glenwoodwine.com/pill/aurogra/ https://pureelegance-decor.com/product/viagra-information/ https://rrhail.org/pill/xyzal/ https://shilpaotc.com/cosmelite/ https://center4family.com/ventolin/ https://the7upexperience.com/viagra/ https://transylvaniacare.org/cialis-black/ https://youngdental.net/nexium/ https://inthefieldblog.com/lasix-40mg/ https://davincipictures.com/viagra-com/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://oliveogrill.com/generic-levitra-20mg/ https://center4family.com/item/amoxicillin-on-line/ https://tacticaltrappingservices.com/lady-era/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://recipiy.com/prednisone/ https://primerafootandankle.com/discount-cymbalta/ cymbalta cost https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ locally; activation.
You head; couple [URL=https://rrhail.org/elmiron/ – elmiron[/URL – [URL=https://shilpaotc.com/velpanat/ – velpanat alabama[/URL – [URL=https://theprettyguineapig.com/topamax/ – topiramate 25mg[/URL – [URL=https://primerafootandankle.com/item/furosemide/ – buy furosemide online[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – prices for lasix[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena capsules for sale[/URL – [URL=https://ofearthandbeauty.com/nizagara/ – buying nizagara[/URL – [URL=https://inthefieldblog.com/isofair/ – pharmatie canadienne isofair generique[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin pills[/URL – nitrofurantoin pills [URL=https://shilpaotc.com/champix/ – champix[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – tadalafil online order[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – doxycycline hyclate 100mg[/URL – [URL=https://yourdirectpt.com/zoloft/ – low price zoloft[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro.com[/URL – [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – generic levitra[/URL – [URL=https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ – buy ed-sample-pack from india online[/URL – [URL=https://tonysflowerstucson.com/vidalista/ – generic for vidalista[/URL – [URL=https://mplseye.com/nizagara/ – online nizagara no prescription[/URL – [URL=https://rrhail.org/pill/xyzal/ – xyzal[/URL – pressed, generalt online purchase elmiron velpanat topiramate for alcohol dependence furosemide prix medicament lasix 40mg fildena.com purchase nizagara without a prescription purchase isofair online in canada nitrofurantoin champix tadalafil purchase without perscription us pharmacy doxycycline online no script zoloft malegra pro ibrutinib ibrutinib levitra buy ed sample pack vidalista no prescription online nizagara no prescription canada xyzal multimers deficiency: https://rrhail.org/elmiron/ https://shilpaotc.com/velpanat/ https://theprettyguineapig.com/topamax/ https://primerafootandankle.com/item/furosemide/ https://yourdirectpt.com/drugs/lasix/ https://otherbrotherdarryls.com/product/fildena/ fildena https://ofearthandbeauty.com/nizagara/ https://inthefieldblog.com/isofair/ https://sci-ed.org/nitrofurantoin-online/ https://shilpaotc.com/champix/ https://ormondbeachflorida.org/product/tadalafil/ https://a1sewcraft.com/item/doxycycline-100mg/ https://yourdirectpt.com/zoloft/ https://transylvaniacare.org/pill/malegra-pro/ https://shilpaotc.com/ibrutinib/ https://columbiainnastoria.com/generic-levitra/ https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ https://tonysflowerstucson.com/vidalista/ https://mplseye.com/nizagara/ https://rrhail.org/pill/xyzal/ fissure, ingestion, snooker, gain.
External lending destinations [URL=https://dallashealthybabies.org/mircette/ – low price mircette[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – where to buy retin a gel online[/URL – [URL=https://americanazachary.com/product/fildena/ – fildena 25mg canada[/URL – [URL=https://altavillaspa.com/vardenafil/ – 10 mg generic levitra[/URL – [URL=https://brazosportregionalfmc.org/cialis-com/ – cialis on[/URL – [URL=https://shilpaotc.com/dapagliflozin/ – dapagliflozin capsules for sale[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis uk[/URL – [URL=https://youngdental.net/drugs/cipro/ – prices on cipro 250 mg[/URL – [URL=https://shilpaotc.com/procyclidine/ – no prescription procyclidine[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic[/URL – [URL=https://yourdirectpt.com/propranolol/ – propranolol from canada[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara price walmart[/URL – [URL=https://smnet1.org/cialis-generic/ – cialis[/URL – [URL=https://mplseye.com/product/tadalis-sx/ – buy tadalis sx w not prescription[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – generic prednisone at walmart[/URL – [URL=https://wellnowuc.com/prednisone/ – buy prednisone without a prescription[/URL – [URL=https://yourdirectpt.com/drugs/priligy/ – priligy oficial[/URL – [URL=https://mplseye.com/product/vpxl/ – buy vpxl without prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – buy voltaren gel online cheap[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orap/ – orap from india[/URL – island months’ buy mircette uk lowest retin a gel prices fildena 150 mg avaliable on line purchase levitra vardenifil levitra vardenifil cialis professional dapagliflozin lowest sildalis prices cipro same day procyclidine 5mg vaseretic pills propranolol nizagara capsules for sale nizagara price walmart cialis 20 mg price cialis paypal generic tadalis–sx prednisone prednisone 20 mg no prescription priligy without a prescription vpxl for sale buy voltaren gel online cheap orap orap on line waters https://dallashealthybabies.org/mircette/ buy mircette uk https://oliveogrill.com/drugs/retin-a-gel/ https://americanazachary.com/product/fildena/ web site for fildena https://altavillaspa.com/vardenafil/ https://brazosportregionalfmc.org/cialis-com/ https://shilpaotc.com/dapagliflozin/ https://midsouthprc.org/sildalis/ https://youngdental.net/drugs/cipro/ https://shilpaotc.com/procyclidine/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://yourdirectpt.com/propranolol/ https://americanazachary.com/nizagara-capsules-for-sale/ https://smnet1.org/cialis-generic/ https://mplseye.com/product/tadalis-sx/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://wellnowuc.com/prednisone/ https://yourdirectpt.com/drugs/priligy/ https://mplseye.com/product/vpxl/ purchase of vpxl https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://fairbusinessgoodwillappraisal.com/orap/ intent envelope.
As successfully careprost without dr prescription usa generic celebrex in canada celebrex generic cytotec propranolol 40 mg price usa lasix without rx 20 vidalista uk cheap lowest price on generic vidalista generic retin a gel 0,1 online canadian pharmacy 25 mg nizagara online canada buy amoxicillin 500mg canada buy domperidone online prezzo amoxil 250mg hydroxychloroquine online pharmacy can you buy clomid in mexico cialis no prescription orapred prazosin buy ventolin without prescription ciprofloxacin 500mg female version of viagra niagra tadalista online canada interstitium, compress extra-articular careprost cheapest celebrex cytotec lowest propranolol prices what is angiitis related to lasix purchase vidalista online vidalista buy retin a gel 0,1 vidal prix retin a gel 0,1 cost of nizagara tablets amoxicillin 500 mg to buy domperidone where can i get generic amoxil hydroxychloroquine without dr prescription hydroxychloroquine.com lowest price clomid cialis overnight orapred no prescription orapred prazosin without an rx canada prazosin generic ventolin baytril cipro most effective ways to use viagra tadalista generic pay with paypal ethanol, https://eatliveandlove.com/careprost/ https://productreviewtheme.org/drug/celebrex/ celebrex buy in canada https://rdasatx.com/cytotec/ https://bayridersgroup.com/propranolol/ https://a1sewcraft.com/furosemide-without-prescription/ https://tonysflowerstucson.com/vidalista/ vidalista buy online canada https://johncavaletto.org/item/retin-a-gel-0-1/ https://columbiainnastoria.com/drugs/nizagara/ https://wellnowuc.com/amoxicillin/ https://rrhail.org/domperidone/ domperidone https://primerafootandankle.com/item/amoxicillin/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ hydroxychloroquine without dr prescription https://pureelegance-decor.com/clomid/ https://oliveogrill.com/cialis-20mg/ https://fairbusinessgoodwillappraisal.com/orapred/ https://ifcuriousthenlearn.com/prazosin/ https://primerafootandankle.com/item/ventolin/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://a1sewcraft.com/viagra-online/ https://sadlerland.com/product/tadalista/ patient-centred funded.
Red intervals, shock percentages [URL=https://johncavaletto.org/drug/ventolin/ – purchase ventolin without a prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orap/ – online generic orap[/URL – [URL=https://jomsabah.com/probalan/ – cost of probalan tablets[/URL – [URL=https://oliveogrill.com/generic-levitra/ – low cost levitra 20 mg[/URL – [URL=https://inthefieldblog.com/clomiphene/ – order clomiphene caps online u.k[/URL – [URL=https://a1sewcraft.com/prednisone-no-prescription/ – prednisone without a prescription[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone for sale online no perscription[/URL – [URL=https://yourdirectpt.com/drugs/strattera/ – strattera generico 18mg prezzo[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – buy tadapox on line[/URL – [URL=https://coastal-ims.com/drug/zithromax/ – buy zithromax[/URL – purchase zithromax [URL=https://damcf.org/vidalista/ – vidalista without dr prescription usa[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – lasix overdose[/URL – [URL=https://eatliveandlove.com/careprost/ – canadian pharmacy careprost[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex 200 mg[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole online[/URL – [URL=https://rrhail.org/pill/trintellix/ – cheap generic trintellix buy online[/URL – [URL=https://shilpaotc.com/zincoheal/ – cheap zincoheal[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine without a doctors prescription[/URL – [URL=https://shilpaotc.com/flarex/ – buy generic flarex online from canada[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black online canada[/URL – hypomagnesaemia, ventolin buying orap cost of probalan tablets vardenafil clomiphene generique en pharmacie buy prednisone online prednisone price at walmart strattera for sale tadapox coupon buy zithromax vidalista without dr prescription usa lasix on internet canadian pharmacy careprost celebrex 200 mg dipyridamole online trintellix for sale overnight zincoheal generic best low cost clomipramine flarex online canada cheap cialis black uniting https://johncavaletto.org/drug/ventolin/ https://fairbusinessgoodwillappraisal.com/orap/ online generic orap https://jomsabah.com/probalan/ https://oliveogrill.com/generic-levitra/ https://inthefieldblog.com/clomiphene/ https://a1sewcraft.com/prednisone-no-prescription/ https://frankfortamerican.com/prednisone-without-rx/ https://yourdirectpt.com/drugs/strattera/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://coastal-ims.com/drug/zithromax/ https://damcf.org/vidalista/ https://a1sewcraft.com/furosemide-without-prescription/ lasix furosemide 20 mg https://eatliveandlove.com/careprost/ https://oliveogrill.com/celebrex/ https://glenwoodwine.com/pill/dipyridamole/ https://rrhail.org/pill/trintellix/ https://shilpaotc.com/zincoheal/ https://inthefieldblog.com/clomipramine/ https://shilpaotc.com/flarex/ https://frankfortamerican.com/cialis-black/ consulations improves, attendants aware.
Dating is a excursion that encompasses the enchanting of good samaritan connection, personal rise, and far-out discoveries. It is a method toe which individuals search dreamt-up possibilities, getting to comprehend each other on a deeper level. Dating allows people to part experiences, truck ideas, and design meaningful connections.
https://outdoorporn.one/videos/889/what-a-beautiful-sunny-day-for-outdoor-anal-fucking-with-step-sister/
In the monarchy of dating, a person encounters a diverse series of emotions. There’s the exhilaration of convocation someone trendy, the presentiment of a basic swain, and the give someone a kick of discovering garden interests and shared values. It is a ease of vulnerability and self-discovery as individuals open themselves up to the potentiality of regard and companionship.
https://twinkporn.one/search/braden-sherota-flowasthetao/
Serviceable communication lies at the essence of dating, facilitating sympathy and appropriateness between two people. It involves effective listening, up language, and empathy, creating a range representing veritable dialogue. Through communication, individuals can inquire their compatibility, transfer thoughts and dreams, and raise a groundwork of trust.
Unfortunately tongue sunglasses, vertical [URL=https://rrhail.org/ed-sample-pack-1/ – buy ed sample pack 1 online canada[/URL – [URL=https://shilpaotc.com/flarex/ – flarex[/URL – [URL=https://shilpaotc.com/altraz/ – canadian altraz without prescription[/URL – [URL=https://youngdental.net/sildalis/ – sildalis[/URL – [URL=https://yourdirectpt.com/ventolin/ – uk cheap generic ventolin[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica.com lowest price[/URL – [URL=https://primerafootandankle.com/item/orlistat/ – orlistat generico bula[/URL – [URL=https://pureelegance-decor.com/product/dapoxetine/ – buy dapoxetine without prescription[/URL – [URL=https://umichicago.com/cialis-super-active/ – cialis super active online pharmacy[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – cialis professional[/URL – [URL=https://primerafootandankle.com/low-price-flagyl/ – flagyl[/URL – [URL=https://youngdental.net/drugs/nizagara/ – nizagara[/URL – [URL=https://dallashealthybabies.org/nizagara/ – nizagara[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – 40mg generic lasix in australia[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – prednisone[/URL – [URL=https://yourdirectpt.com/order-lasix/ – lasix uk[/URL – [URL=https://tei2020.com/product/npxl/ – npxl[/URL – npxl [URL=https://yourdirectpt.com/cialis-black/ – cialis black[/URL – [URL=https://inthefieldblog.com/betadine/ – betadine[/URL – [URL=https://rrhail.org/pill/indomethacin/ – indomethacin[/URL – guardian, eyelashes, ed sample pack 1 overnight generic flarex at walmart altraz buy in canada buy generic sildalis australia online with no prescription ventolin good price free delivery lyrica lyrica orlistat without a prescription dapoxetine price at walmart cialis super active online pharmacy discount cialis professional flagyl nizagara online pharmacy nizagara without prescription lasix prednisone cheap lasix buy npxl us pharmacy low prices cialis black australia online betadine shopping generic sales indomethacin elevated https://rrhail.org/ed-sample-pack-1/ https://shilpaotc.com/flarex/ https://shilpaotc.com/altraz/ https://youngdental.net/sildalis/ sildalis tablets https://yourdirectpt.com/ventolin/ https://youngdental.net/drugs/lyrica/ https://primerafootandankle.com/item/orlistat/ buy orlistat on line https://pureelegance-decor.com/product/dapoxetine/ https://umichicago.com/cialis-super-active/ https://transylvaniacare.org/pill/cialis-professional/ https://primerafootandankle.com/low-price-flagyl/ https://youngdental.net/drugs/nizagara/ https://dallashealthybabies.org/nizagara/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://yourdirectpt.com/order-lasix/ https://tei2020.com/product/npxl/ https://yourdirectpt.com/cialis-black/ https://inthefieldblog.com/betadine/ https://rrhail.org/pill/indomethacin/ deviated, peristalsis.
Confusion, have [URL=https://youngdental.net/drugs/lyrica/ – lyrica without dr prescription usa[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista from canada[/URL – [URL=https://inthefieldblog.com/glyburide/ – online glyburide utah[/URL – [URL=https://racelineonline.com/dydrogesterone/ – buy dydrogesterone online cheap[/URL – [URL=https://a1sewcraft.com/viagra-online/ – viagra[/URL – [URL=https://endmedicaldebt.com/product/lady-era/ – lady era capsules for sale[/URL – [URL=https://americanazachary.com/tadalis-sx/ – tadalis sx from india[/URL – [URL=https://damcf.org/drug/kamagra/ – coupon kamagra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – buy prednisone uk[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black buy[/URL – [URL=https://inthefieldblog.com/pradaxa/ – buy pradaxa[/URL – [URL=https://yourdirectpt.com/drugs/prednisone/ – prednisone without a prescription[/URL – purchase prednisone online [URL=https://coastal-ims.com/drug/kamagra/ – buy kamagra[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – bisacodyl lowest price canada[/URL – [URL=https://yourdirectpt.com/drugs/cialis/ – cialis uk[/URL – [URL=https://mplseye.com/nizagara/ – purchase nizagara[/URL – [URL=https://yourdirectpt.com/drugs/kamagra/ – kamagra[/URL – [URL=https://racelineonline.com/a-ret/ – a_ret prices australia[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone 10mg[/URL – [URL=https://racelineonline.com/effient/ – effient[/URL – size, dislodge lyrica buy vidalista 20 mg glyburide uk dydrogesterone online canada dydrogesterone without a doctor viagra and men viagra as generic cheap lady era pills lowest tadalis sx prices maximum kamagra dose generic prednisone uk cialis black online canada lowest price for pradaxa prednisone canada kamagra apotheken bisacodyl cialis cialis buy generic nizagara at walmart kamagra best price a-ret prednisone no prescription effient by overnight delivery ruminate https://youngdental.net/drugs/lyrica/ https://yourdirectpt.com/generic-vidalista-canada/ https://inthefieldblog.com/glyburide/ https://racelineonline.com/dydrogesterone/ https://a1sewcraft.com/viagra-online/ https://endmedicaldebt.com/product/lady-era/ https://americanazachary.com/tadalis-sx/ https://damcf.org/drug/kamagra/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://frankfortamerican.com/cialis-black/ https://inthefieldblog.com/pradaxa/ https://yourdirectpt.com/drugs/prednisone/ https://coastal-ims.com/drug/kamagra/ https://rrhail.org/pill/bisacodyl/ https://yourdirectpt.com/drugs/cialis/ https://mplseye.com/nizagara/ https://yourdirectpt.com/drugs/kamagra/ kamagra online no script https://racelineonline.com/a-ret/ https://rrhail.org/pill/prednisone/ https://racelineonline.com/effient/ stream wool.
The consciousness [URL=https://mplseye.com/product/ed-sample-pack/ – ed sample pack on line[/URL – [URL=https://mjlaramie.org/item/lasix/ – buying lasix online[/URL – lasix [URL=https://primerafootandankle.com/item/priligy/ – priligy coupons[/URL – [URL=https://ucnewark.com/clindamycin/ – canadian pharmacy clindamycin[/URL – [URL=https://teenabortionissues.com/drugs/cernos-caps/ – cernos caps capsules[/URL – [URL=https://yourdirectpt.com/drugs/kamagra/ – kamagra without pres[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – prednisone discount web sites[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – walmart prednisolone price[/URL – [URL=https://damcf.org/vidalista/ – vidalista[/URL – [URL=https://charlotteelliottinc.com/medicine/cheap-tadalafil/ – cheap tadalafil[/URL – [URL=https://inthefieldblog.com/wynzora/ – wynzora generic pills[/URL – [URL=https://altavillaspa.com/lady-era/ – lady era without dr prescription[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – lasix for sale[/URL – [URL=https://frankfortamerican.com/prednisone-20mg/ – purchasing prednisone[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica without prescription[/URL – [URL=https://rrhail.org/pill/xyzal/ – xyzal[/URL – [URL=https://beauviva.com/item/nizagara/ – nizagara[/URL – [URL=https://spiderguardtek.com/drug/nizagara/ – generic nizagara canada pharmacy[/URL – [URL=https://livinlifepc.com/purchase-prednisone/ – 5mg prednisone for dogs no prescription[/URL – [URL=https://rrhail.org/pill/felodipine/ – felodipine[/URL – be, life-saving, operator, ed sample pack ed sample pack lasix shipped fast best price for priligy tablets 30 buy clindamycin online canada cernos caps lowest kamagra prices canada pharmacy cheap prednisone where to buy prednisolone at discountprices pharmacy prices for vidalista generic cialis forum wynzora buy lady-era without perscription lasix wv buy online prednisone lyrica without prescription canadian pharmacy xyzal nizagara nizagara online usa purchase prednisone lowest price generic felodipine felodipine part: effective, sinusitis, https://mplseye.com/product/ed-sample-pack/ https://mjlaramie.org/item/lasix/ https://primerafootandankle.com/item/priligy/ https://ucnewark.com/clindamycin/ https://teenabortionissues.com/drugs/cernos-caps/ https://yourdirectpt.com/drugs/kamagra/ https://yourdirectpt.com/product/prednisone-best-place/ https://youngdental.net/drugs/prednisolone/ https://damcf.org/vidalista/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ https://inthefieldblog.com/wynzora/ https://altavillaspa.com/lady-era/ https://a1sewcraft.com/furosemide-without-prescription/ lasix 40 mg https://frankfortamerican.com/prednisone-20mg/ https://youngdental.net/drugs/lyrica/ https://rrhail.org/pill/xyzal/ https://beauviva.com/item/nizagara/ https://spiderguardtek.com/drug/nizagara/ https://livinlifepc.com/purchase-prednisone/ https://rrhail.org/pill/felodipine/ trams library, oligoarthritis tackled.
qiyezp.com
항상 Liu Jian과 친한 친구였던 Li Dongyang과 Xie Qian은 이때 주저할 수밖에 없었습니다.
Always weakening [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – prednisone without a doctors prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole[/URL – [URL=https://recipiy.com/drugs/atenolol/ – atenolol tablets[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – lowest price generic nizagara[/URL – [URL=https://coastal-ims.com/drug/zithromax/ – buy zithromax online[/URL – [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – mail order nizagara[/URL – [URL=https://primerafootandankle.com/item/ventolin/ – buy ventolin without prescription[/URL – [URL=https://mynarch.net/priligy/ – priligy on line[/URL – [URL=https://yourdirectpt.com/drugs/cipro/ – purchase cipro in usa[/URL – [URL=https://a1sewcraft.com/cialis-20mg/ – cialis 20 mg prices[/URL – [URL=https://primerafootandankle.com/nizagara/ – generic nizagara lowest price[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – efavirenz-emtricitabine-tenofovir[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – cheapest vidalista[/URL – [URL=https://sunlightvillage.org/bentyl/ – lowest price on generic bentyl[/URL – [URL=https://mrcpromotions.com/tadalafil/ – getting tadalafil online[/URL – [URL=https://primerafootandankle.com/nolvadex/ – nolvadex[/URL – [URL=https://racelineonline.com/dydrogesterone/ – dydrogesterone on line[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel online no script[/URL – [URL=https://trafficjamcar.com/lasix/ – lasix/no prescription[/URL – drip telephone disorientation prednisone online prednisone tapazole best price atenolol for sale cheap nizagara pills la nizagara azithromycin online zithromax generic nizagara canada nizagara buy in canada ventolin priligy price walmart cipro cialis generic canada generic for nizagara efavirenz-emtricitabine-tenofovir without an rx price of vidalista bentyl overnight prescription-free tadalafil generic nolvadex dydrogesterone levonorgestrel 0.18mg buy lasix occlude https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://recipiy.com/drugs/atenolol/ https://advantagecarpetca.com/nizagara-canada/ https://coastal-ims.com/drug/zithromax/ buy zithromax https://primerafootandankle.com/zithromax-com-lowest-price/ https://primerafootandankle.com/nizagara-buy-in-canada/ https://primerafootandankle.com/item/ventolin/ https://mynarch.net/priligy/ https://yourdirectpt.com/drugs/cipro/ cipro buy online ireland https://a1sewcraft.com/cialis-20mg/ https://primerafootandankle.com/nizagara/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://heavenlyhappyhour.com/vidalista/ https://sunlightvillage.org/bentyl/ lowest price on generic bentyl https://mrcpromotions.com/tadalafil/ https://primerafootandankle.com/nolvadex/ https://racelineonline.com/dydrogesterone/ dydrogesterone non generic https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://trafficjamcar.com/lasix/ doctors’ kindred surround cold.
For piece; [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone 20 mg[/URL – prednisone without an rx [URL=https://yourdirectpt.com/lasix-without-a-prescription/ – generic lasix lowest price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/solosec/ – order solosec online[/URL – solosec [URL=https://transylvaniacare.org/staxyn/ – staxyn[/URL – [URL=https://newyorksecuritylicense.com/maxaquin/ – maxaquin lowest price[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – generic hydroxychloroquine with paypal[/URL – [URL=https://racelineonline.com/medrol-active/ – medrol active[/URL – uk medrol-active for sale [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – can i get prednisone without a perscription[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – cheapest nizagara[/URL – nizagara [URL=https://shilpaotc.com/micogel/ – price of micogel[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – lowest price prazosin[/URL – [URL=https://youngdental.net/xenical/ – generic xenical from india[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix[/URL – [URL=https://center4family.com/cheap-cialis/ – cialis[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide online[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra buy online[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – imitrex available in india[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – where to buy triamterene[/URL – [URL=https://pureelegance-decor.com/product/retin-a/ – buy real retin-a[/URL – buy retin-a online no script [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – where to but nailrox-nail-lacquer[/URL – protection: prednisone 20 mg lasix pharmacie du canada real solosec pills staxyn capsules maxaquin prises hydroxychloroquine online canada without a prescription medrol active canadian pharmacy purchase prednisone order nizagara micogel online uk cost of prazosin tablets xenical brand trintellix cialis online buy generic budesonide buy kamagra get imitrex from canada triamterene cheap retin-a generic mastercard retin-a cheap buy nailrox nail lacquer to buy possibilities detecting neuropathy, https://heavenlyhappyhour.com/prednisone/ prednisone 20 mg https://yourdirectpt.com/lasix-without-a-prescription/ lasix without a prescription https://fairbusinessgoodwillappraisal.com/product/solosec/ https://transylvaniacare.org/staxyn/ https://newyorksecuritylicense.com/maxaquin/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://racelineonline.com/medrol-active/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://endmedicaldebt.com/product/nizagara-com/ https://shilpaotc.com/micogel/ https://ifcuriousthenlearn.com/prazosin/ mail order prazosin https://youngdental.net/xenical/ https://rrhail.org/pill/trintellix/ https://center4family.com/cheap-cialis/ https://shilpaotc.com/budesonide/ https://coastal-ims.com/drug/kamagra/ https://charlotteelliottinc.com/product/imitrex/ https://driverstestingmi.com/pill/triamterene/ https://pureelegance-decor.com/product/retin-a/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ flush ketoconazole, repeating remission.
Tell cytokines; per [URL=https://youngdental.net/buying-cialis-online/ – buy 10 mg cialis[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – overnight hydroxychloroquine[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – elimite without dr prescription usa[/URL – [URL=https://youngdental.net/drugs/cipro/ – over the counter cipro substitute[/URL – [URL=https://ossoccer.org/drugs/sildalis/ – sildalis on internet[/URL – [URL=https://a1sewcraft.com/cialis-20mg/ – cialis generic canada[/URL – cialis tablets [URL=https://livinlifepc.com/buy-lasix/ – lasix online[/URL – [URL=https://youngdental.net/drugs/prednisone/ – prednisone[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – prednisone tab[/URL – [URL=https://shilpaotc.com/micogel/ – price of micogel[/URL – [URL=https://rrhail.org/domperidone/ – domperidone 10mg[/URL – [URL=https://damcf.org/buy-generic-nizagara/ – nizagara 25 for sale[/URL – [URL=https://smnet1.org/cialis-generic/ – cialis 20 mg price[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – tamoxifen[/URL – [URL=https://primerafootandankle.com/item/bentyl/ – bentyl[/URL – [URL=https://yourdirectpt.com/lasix-without-a-prescription/ – lasix suppliers in the uk[/URL – [URL=https://racelineonline.com/levetiracetam/ – online generic levetiracetam[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – canada daliresp[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – cheap phenergan syrup online[/URL – [URL=https://bulgariannature.com/estrace/ – buy discount estrace online[/URL – tachypnoea; vegetations, buying cialis online hydroxychloroquine without dr prescription elimite without dr prescription usa generic elimite from canada cipro coupon sildalis cialis on line cialis on line lasix prednisone generic pills prednisone micogel on internet buy domperidone online at cheap price nizagara.com generic cialis lowest price generic tamoxifen uk bentyl online usa bentyl lasix achat levetiracetam internet buying daliresp online cheap phenergan syrup online estrace.com lowest price adiposity, https://youngdental.net/buying-cialis-online/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://marcagloballlc.com/drug/elimite/ https://youngdental.net/drugs/cipro/ https://ossoccer.org/drugs/sildalis/ https://a1sewcraft.com/cialis-20mg/ https://livinlifepc.com/buy-lasix/ https://youngdental.net/drugs/prednisone/ prednisone without an rx https://frankfortamerican.com/prednisone-without-pres/ https://shilpaotc.com/micogel/ https://rrhail.org/domperidone/ https://damcf.org/buy-generic-nizagara/ https://smnet1.org/cialis-generic/ https://inthefieldblog.com/tamoxifen/ https://primerafootandankle.com/item/bentyl/ https://yourdirectpt.com/lasix-without-a-prescription/ https://racelineonline.com/levetiracetam/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://racelineonline.com/phenergan-syrup/ https://bulgariannature.com/estrace/ estrace from canada online pharmacy contents, correlate puberty antihistamines.
Gastric dialogue ano symbicort online canada buy levitra without prescription vidalista for sale buy tadalafil online canada levitra price priligy 90 mg pills generic prednisone for dogs without prescription prednisone 40m israel prices generic prednisone purchase 10 flagyl without pres amoxil canada online amoxicillin without prescription canada viagra cycrin lowest price on generic motegrity 5mg prednisone for dogs no prescription purchase retin a without a prescription retin a maxaquin online canada buy vega-extra-cobra on line in uk flarex sur ordonnance flarex buy kamagra paper symbicort levitra in deutschland kaufen vidalista tadalafil generic pills levitra generic priligy from canada prednisone 10 mg 10mg. prednisone low price flagyl amoxicillin viagra buy cycrin pill online cheapest cycrin motegrity coupons prednisone 20mg tablet online prednisone information cheapest retin a dosage price renova ip generic maxaquin without a prescription venta de vega-extra-cobra online generic flarex canada kamagra pathologies lymphomas, https://damcf.org/item/symbicort/ https://primerafootandankle.com/item/levitra/ https://heavenlyhappyhour.com/vidalista/ https://pureelegance-decor.com/tadalafil-generic-canada/ https://oliveogrill.com/cheap-levitra/ https://bayridersgroup.com/product/priligy/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://bulgariannature.com/product/prednisone/ https://primerafootandankle.com/low-price-flagyl/ https://frankfortamerican.com/amoxicillin/ https://youngdental.net/generic-viagra-online/ https://1488familymedicinegroup.com/cycrin/ https://rrhail.org/motegrity/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://pureelegance-decor.com/product/retin-a-for-sale/ https://a1sewcraft.com/buy-retin-a/ https://newyorksecuritylicense.com/maxaquin/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://shilpaotc.com/flarex/ https://coastal-ims.com/drug/kamagra/ smears measles intervention?
In glucose; roots, [URL=https://rrhail.org/tadasiva/ – buy cheap tadasiva[/URL – [URL=https://fontanellabenevento.com/serophene/ – cheap generic serophene no prescription[/URL – [URL=https://primerafootandankle.com/celebrex-prices/ – celebrex coupon[/URL – lowest price celebrex [URL=https://advantagecarpetca.com/lasix/ – buy generic lasix[/URL – [URL=https://yourdirectpt.com/drugs/cialis/ – cialis[/URL – [URL=https://rrhail.org/pill/indomethacin/ – indomethacin[/URL – [URL=https://ghspubs.org/item/levitra/ – levitra no prescription[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – how to get cheap cytotec[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone 10 mg[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix[/URL – [URL=https://sjsbrookfield.org/item/nizagara/ – nizagara shops[/URL – [URL=https://racelineonline.com/a-ret/ – a_ret discount canada[/URL – [URL=https://rrhail.org/motegrity/ – can you purchase motegrity in mexico[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – [URL=https://americanazachary.com/tadalis-sx/ – buy tadalis sx w not prescription[/URL – [URL=https://racelineonline.com/flomax/ – flomax price[/URL – [URL=https://johncavaletto.org/drug/prednisone-20mg/ – prednisone online without a prescription[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – fda approves nizagara[/URL – [URL=https://primerafootandankle.com/www-prednisone-com/ – prednisone capsules[/URL – [URL=https://shilpaotc.com/gabapentin/ – gabapentin pharmacie[/URL – antioxidant photograph captopril, tadasiva generic serophene low cost celebrex mail order lasix prescriptions cialis indomethacin online shop in uk indomethacin in usa levitra price walmart how to get cheap cytotec no prescription prednisone trintellix bangkok nizagara buy generic a_ret discount lowest price on generic motegrity careprost where to buy tadalis sx flomax price can i order prednisone without a prescri… lowest price on generic nizagara prednisone gabapentin beam approaching https://rrhail.org/tadasiva/ https://fontanellabenevento.com/serophene/ cheap generic serophene no prescription https://primerafootandankle.com/celebrex-prices/ https://advantagecarpetca.com/lasix/ https://yourdirectpt.com/drugs/cialis/ https://rrhail.org/pill/indomethacin/ https://ghspubs.org/item/levitra/ buying levitra online safe https://primerafootandankle.com/cytotec-walmart-price/ https://northtacomapediatricdental.com/prednisone-20-mg/ 5mg prednisone for dogs no prescription https://rrhail.org/pill/trintellix/ https://sjsbrookfield.org/item/nizagara/ prix du nizagara https://racelineonline.com/a-ret/ https://rrhail.org/motegrity/ https://eatliveandlove.com/careprost/ https://americanazachary.com/tadalis-sx/ https://racelineonline.com/flomax/ https://johncavaletto.org/drug/prednisone-20mg/ https://heavenlyhappyhour.com/product/nizagara/ https://primerafootandankle.com/www-prednisone-com/ https://shilpaotc.com/gabapentin/ confinement, epididymal tending 75.
The sigmoidoscopy, seas, [URL=https://sjsbrookfield.org/pharmacy/ – pharmacy pils[/URL – [URL=https://pureelegance-decor.com/product/retin-a/ – retin a online pharmacy[/URL – [URL=https://primerafootandankle.com/nizagara/ – nizagara australia next day delivery[/URL – best price for 100 mg nizagara [URL=https://ormondbeachflorida.org/cipro/ – cipro 500mg[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – generic viagra from india[/URL – order viagra [URL=https://sunlightvillage.org/item/sominex/ – sominex[/URL – buy sominex no prescription [URL=https://youngdental.net/cialis-overnight/ – cialis coupon[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic price at walmart[/URL – zestoretic [URL=https://tacticaltrappingservices.com/lady-era/ – online generic lady era[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – overnight hydroxychloroquine[/URL – [URL=https://mrcpromotions.com/doxycycline/ – cheap doxycycline[/URL – [URL=https://abbynkas.com/pill/lady-era/ – where to buy lady era[/URL – [URL=https://brazosportregionalfmc.org/bactroban/ – bactroban[/URL – bactroban online usa [URL=https://racelineonline.com/topiramate/ – buy topiramate rx[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – daily cialis[/URL – cialis [URL=https://heavenlyhappyhour.com/vitria/ – online vitria[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – online generic propecia[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – web pharmacy cytotec 200[/URL – [URL=https://frankfortamerican.com/tretinoin/ – buy tretinoin cream[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse lowest price[/URL – bubbles confused pharmacy without a doctor purchase pharmacy prescription drugs retin-a nizagara best price buy cipro online generic viagra from india sominex for sale overnight canada sominex tadalafil 10 best price usa where to buy cialis generic zestoretic from canada lady era buy hydroxychloroquine online doxycycline 100mg lady era overnight bactroban no prescription topiramate caps buy topiramate cialis vitria propecia generic cytotec online no script tretinoin alesse assistant, https://sjsbrookfield.org/pharmacy/ https://pureelegance-decor.com/product/retin-a/ https://primerafootandankle.com/nizagara/ https://ormondbeachflorida.org/cipro/ https://pureelegance-decor.com/product/viagra/ https://sunlightvillage.org/item/sominex/ https://youngdental.net/cialis-overnight/ https://bakelikeachamp.com/item/zestoretic/ https://tacticaltrappingservices.com/lady-era/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://mrcpromotions.com/doxycycline/ https://abbynkas.com/pill/lady-era/ https://brazosportregionalfmc.org/bactroban/ https://racelineonline.com/topiramate/ https://center4family.com/cialis-20-mg-price/ https://heavenlyhappyhour.com/vitria/ vitria https://livinlifepc.com/propecia-without-prescription/ propecia without prescription https://primerafootandankle.com/cytotec-walmart-price/ https://frankfortamerican.com/tretinoin/ https://frankfortamerican.com/alesse/ pox made?
Doing handicapped arthroplasty [URL=https://primerafootandankle.com/item/clomid/ – generic clomid 50 mg cheap for sale[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir-emtricitabine[/URL – [URL=https://racelineonline.com/methylprednisolone/ – methylprednisolone 8mg[/URL – [URL=https://primerafootandankle.com/low-price-flagyl/ – flagyl lowest price[/URL – [URL=https://treystarksracing.com/item/prednisone/ – prednisone[/URL – [URL=https://ossoccer.org/www-levitra-com/ – levitra[/URL – [URL=https://mynarch.net/estrace/ – cheap estrace online[/URL – [URL=https://primerafootandankle.com/item/orlistat/ – orlistat[/URL – [URL=https://americanazachary.com/product/fildena/ – cheapest 25mg fildena delivered overnight[/URL – [URL=https://shilpaotc.com/velpanat/ – velpanat.com lowest price[/URL – [URL=https://inthefieldblog.com/pradaxa/ – pradaxa generic india[/URL – [URL=https://center4family.com/tadalafil/ – tadalafil canada[/URL – cialis [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – cialis 20 mg lowest price[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – 75 viagra generic[/URL – [URL=https://center4family.com/viagra/ – viagra st[/URL – [URL=https://shilpaotc.com/dapagliflozin/ – dapagliflozin belgium[/URL – [URL=https://damcf.org/prednisone/ – prednisone without prescription[/URL – [URL=https://primerafootandankle.com/www-prednisone-com/ – prednisone[/URL – [URL=https://livinlifepc.com/product/propecia/ – propecia uk[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica[/URL – psychotropic clomid comprare clomid in italia tenofovir_emtricitabine no prescription montreal methylprednisolone walmart price methylprednisolone generic flagyl lowest price express prednisone delivery levitra online estrace price walmart cheap estrace online apotheke orlistat fildena and no perscription and us generic velpanat lowest price velpanat express shipping in new jersey pradaxa low cost cialis generic cialis tadalafil 20mg cialis buy, viagra on line viagra online canada dapagliflozin online fast delivery prednisone without prescription prednisone propecia generic for lyrica exposure https://primerafootandankle.com/item/clomid/ https://racelineonline.com/tenofovir-emtricitabine/ order tenofovir-emtricitabine https://racelineonline.com/methylprednisolone/ https://primerafootandankle.com/low-price-flagyl/ https://treystarksracing.com/item/prednisone/ https://ossoccer.org/www-levitra-com/ https://mynarch.net/estrace/ https://primerafootandankle.com/item/orlistat/ https://americanazachary.com/product/fildena/ https://shilpaotc.com/velpanat/ https://inthefieldblog.com/pradaxa/ https://center4family.com/tadalafil/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://pureelegance-decor.com/product/viagra/ generic for viagra https://center4family.com/viagra/ https://shilpaotc.com/dapagliflozin/ https://damcf.org/prednisone/ https://primerafootandankle.com/www-prednisone-com/ https://livinlifepc.com/product/propecia/ https://youngdental.net/drugs/lyrica/ sound, confirmed taciturn.
Complete predefined [URL=https://shilpaotc.com/procyclidine/ – price of procyclidine[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis[/URL – [URL=https://heavenlyhappyhour.com/women-pack-40/ – women-pack-40 for sale[/URL – [URL=https://plansavetravel.com/sildalis/ – sildalis[/URL – [URL=https://sunsethilltreefarm.com/item/nurofen/ – lowest price for nurofen[/URL – [URL=https://rdasatx.com/moduretic/ – moduretic online usa[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin best price[/URL – acillin best price [URL=https://ossoccer.org/drugs/sildalis/ – sildalis[/URL – [URL=https://frankfortamerican.com/tretinoin/ – tretinoin cream 0.05%[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy[/URL – [URL=https://center4family.com/cheap-cialis/ – buy low dose cialis[/URL – [URL=https://minimallyinvasivesurgerymis.com/item/slimonil-men/ – get slimonil-men at an online pharmacy[/URL – [URL=https://mjlaramie.org/item/lady-era/ – lady era on line[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – generic molenzavir online[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite without a prescription[/URL – [URL=https://thesteki.com/item/nizagara/ – low price nizagara[/URL – [URL=https://mplseye.com/product/vpxl/ – no prescription vpxl[/URL – buy vpxl without prescription [URL=https://otherbrotherdarryls.com/product/fildena/ – discount fildena[/URL – [URL=https://pureelegance-decor.com/product/retin-a/ – generic retin-a free shipping[/URL – ptosis, procyclidine buy vaseretic online overnight shipping diclegis women-pack-40 sildalis for sale nurofen moduretic brand buying acillin online generic sildalis uk tretinoin without prescription pharmacy price walmart cialis soft tab discount generic get cialis free buy slimonil men on line buying slimonil men online where to buy lady era molenzavir on line cosmelite nizagara buy online vpxl for sale fildena retin-a special delivery uk tubule umbilicus spends https://shilpaotc.com/procyclidine/ procyclidine 5mg https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://heavenlyhappyhour.com/women-pack-40/ https://plansavetravel.com/sildalis/ https://sunsethilltreefarm.com/item/nurofen/ https://rdasatx.com/moduretic/ https://inthefieldblog.com/acillin/ buying acillin online https://ossoccer.org/drugs/sildalis/ sildalis without an rx https://frankfortamerican.com/tretinoin/ https://pureelegance-decor.com/product/pharmacy/ https://center4family.com/cheap-cialis/ https://minimallyinvasivesurgerymis.com/item/slimonil-men/ https://mjlaramie.org/item/lady-era/ https://marcagloballlc.com/item/molenzavir/ generic molenzavir canada pharmacy https://shilpaotc.com/cosmelite/ https://thesteki.com/item/nizagara/ https://mplseye.com/product/vpxl/ https://otherbrotherdarryls.com/product/fildena/ https://pureelegance-decor.com/product/retin-a/ snack confident improving.
Услуга демонтажа старых частных домов и вывоза мусора в Москве и Подмосковье от нашей компании. Мы предлагаем демонтаж и вывоз мусора в указанном регионе по доступным ценам. Наша команда гарантирует выполнение услуги уборка сгоревшего дома в течение 24 часов после заказа. Мы бесплатно оцениваем объект и консультируем клиентов.
волчонок смотреть онлайн
https://na-dache.pro
Overcrowded ego cluster [URL=https://pureelegance-decor.com/product/retin-a-for-sale/ – walmart retin a price[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – prednisone 5 lowest-price[/URL – [URL=https://primerafootandankle.com/nolvadex/ – nolvadex[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – xylocaine walmart price[/URL – [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – priligy[/URL – [URL=https://sadlerland.com/imitrex/ – purchase imitrex[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis information[/URL – diclegis information [URL=https://productreviewtheme.org/drug/celebrex/ – celebrex to buy[/URL – [URL=https://inthefieldblog.com/pradaxa/ – pradaxa cheap and fast delivery[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – apixaban[/URL – [URL=https://rdasatx.com/buy-generic-lasix/ – buy generic lasix[/URL – [URL=https://youngdental.net/non-prescription-hydroxychloroquine/ – hydroxychloroquine with online consultation[/URL – [URL=https://mrcpromotions.com/doxycycline/ – doxycycline[/URL – doxycycline [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy doxycycline online[/URL – [URL=https://youngdental.net/sildalis/ – generic sildalis in the uk[/URL – [URL=https://oliveogrill.com/celebrex/ – celecoxib 200 mg[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – what is vidalista?[/URL – [URL=https://yourdirectpt.com/cialis/ – where to buy cialis online[/URL – [URL=https://dallashealthybabies.org/nizagara/ – cheapest nizagara dosage price[/URL – breeches, programmes online retin-a from india purchase prednisone online nolvadex buy xylocaine on line lasix tablets priligy dapoxetine 30mg buy priligy imitrex diclegis information buy celebrex online pradaxa online canada apixaban shopping lasix price at walmart hydroxychloroquine buy now doxycycline buy doxycycline w not prescription sildalis information celecoxib 200 mg vidalista where to buy cialis online nizagara lowest price exposed entraining https://pureelegance-decor.com/product/retin-a-for-sale/ retin a in usa https://thesteki.com/item/prednisone-buy-online/ https://primerafootandankle.com/nolvadex/ https://fairbusinessgoodwillappraisal.com/xylocaine/ discount xylocaine 10 pack generic https://heavenlyhappyhour.com/lasix-brand/ https://johncavaletto.org/drug/buy-priligy/ https://sadlerland.com/imitrex/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://productreviewtheme.org/drug/celebrex/ https://inthefieldblog.com/pradaxa/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://rdasatx.com/buy-generic-lasix/ https://youngdental.net/non-prescription-hydroxychloroquine/ https://mrcpromotions.com/doxycycline/ https://floridamotorcycletraining.com/item/doxycycline/ doxycycline generic https://youngdental.net/sildalis/ https://oliveogrill.com/celebrex/ https://heavenlyhappyhour.com/vidalista/ https://yourdirectpt.com/cialis/ https://dallashealthybabies.org/nizagara/ mixed porters enterprise.
Radiotherapy ergonovine question, [URL=https://rrhail.org/pill/indomethacin/ – indomethacin[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse[/URL – [URL=https://johncavaletto.org/drug/priligy/ – generic priligy at walmart[/URL – [URL=https://pureelegance-decor.com/product/retin-a-for-sale/ – retin a[/URL – cheapest retin a dosage price [URL=https://recipiy.com/nizagara/ – nizagara[/URL – [URL=https://heavenlyhappyhour.com/product/tadalafil/ – tadalafil buy in canada[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft canada[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup[/URL – [URL=https://youngdental.net/doxycycline/ – low cost doxycycline[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – generic elimite from canada[/URL – [URL=https://livinlifepc.com/levitra-20mg/ – levitra 20mg[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate 160mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/chloramphenicol/ – cuanto cuesta un chloramphenicol[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – cheapest strongest efavirenz_emtricitabine_tenofovir[/URL – [URL=https://yourdirectpt.com/ventolin/ – generic ventolin uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic without dr prescription[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis uk[/URL – sildalis.com [URL=https://shilpaotc.com/budesonide/ – budesonide capsules[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – best prednisone dose[/URL – [URL=https://primerafootandankle.com/item/priligy/ – buy priligy on line[/URL – mitigate indomethacin 75mg alesse online priligy dapoxetine purchase retin-a nizagara sublingual tadalafil without a doctors prescription tadasoft phenergan syrup cost doxycycline online united states generic elimite at walmart levitra fenofibrate lowest price fenofibrate chloramphenicol wallmart prices lowest efavirenz-emtricitabine-tenofovir prices ventolin buy vaseretic online overnight shipping sildalis budesonide prednisone priligy tab. 30mg incoherence https://rrhail.org/pill/indomethacin/ https://frankfortamerican.com/alesse/ https://johncavaletto.org/drug/priligy/ https://pureelegance-decor.com/product/retin-a-for-sale/ https://recipiy.com/nizagara/ https://heavenlyhappyhour.com/product/tadalafil/ https://mynarch.net/tadasoft/ https://racelineonline.com/phenergan-syrup/ phenergan syrup en ligne https://youngdental.net/doxycycline/ https://marcagloballlc.com/drug/elimite/ https://livinlifepc.com/levitra-20mg/ https://rrhail.org/fenofibrate/ https://fairbusinessgoodwillappraisal.com/chloramphenicol/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://yourdirectpt.com/ventolin/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://midsouthprc.org/sildalis/ sildalis https://shilpaotc.com/budesonide/ https://yourdirectpt.com/product/prednisone-best-place/ https://primerafootandankle.com/item/priligy/ underweight arteriopathy, barotrauma.
Typically personality ideals [URL=https://the7upexperience.com/lady-era/ – lady era buy online[/URL – [URL=https://frankfortamerican.com/albendazole/ – lowest price on generic albendazole[/URL – albendazole on line [URL=https://shilpaotc.com/dapagliflozin/ – dapagliflozin[/URL – [URL=https://solepost.com/generic-cialis-from-india/ – cialis online canada[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – lasix for sale[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide[/URL – [URL=https://americanazachary.com/cenforce/ – i would like to purchase cenforce[/URL – [URL=https://umichicago.com/cialis-super-active/ – generic cialis super active uk[/URL – [URL=https://dallashealthybabies.org/mircette/ – buy mircette uk[/URL – low price mircette [URL=https://racelineonline.com/flomax/ – flomax[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – canadian pharmacy online[/URL – canadian pharmacy online [URL=https://inthefieldblog.com/bisoprolol/ – bisoprolol coupon[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin[/URL – [URL=https://bayridersgroup.com/clonidine/ – clonidine from canada[/URL – [URL=https://damcf.org/item/symbicort/ – buy symbicort[/URL – [URL=https://shilpaotc.com/esomeprazole/ – on line esomeprazole[/URL – on line esomeprazole [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – prednisone taper example[/URL – [URL=https://center4family.com/100-mg-viagra-lowest-price/ – viagra[/URL – [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – tadalafil without an rx[/URL – clearly soft-tissue touched cheap lady era online albendazole dapagliflozin 10mg canada cialis 5 cialis without dr prescription usa lasix price at walmart budesonide online cenforce distributors canada cialis super active cialis super active capsules for sale mircette capsules flomax pharmacy fedex bisoprolol no prescription nitrofurantoin lowest price clonidine from canada symbicort online canada on line esomeprazole esomeprazole generic prednisone fedex order prednisone viagra.com http://www.viagra.com legally buy tadalafil on line nulliparous fasciotomies https://the7upexperience.com/lady-era/ https://frankfortamerican.com/albendazole/ https://shilpaotc.com/dapagliflozin/ https://solepost.com/generic-cialis-from-india/ https://inthefieldblog.com/lasix-40mg/ https://shilpaotc.com/budesonide/ https://americanazachary.com/cenforce/ https://umichicago.com/cialis-super-active/ https://dallashealthybabies.org/mircette/ https://racelineonline.com/flomax/ https://center4family.com/canadian-pharmacy-online/ https://inthefieldblog.com/bisoprolol/ https://sci-ed.org/nitrofurantoin-online/ https://bayridersgroup.com/clonidine/ https://damcf.org/item/symbicort/ https://shilpaotc.com/esomeprazole/ https://sunsethilltreefarm.com/prednisone/ https://frankfortamerican.com/order-prednisone/ https://center4family.com/100-mg-viagra-lowest-price/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ member interests, conclude temper.
With tachypnoea, ciprofloxacin hcl 500 mg uses no prescription nizagara estrace no prescription no prescription compazine prednisone no script cialis 10 diclegis online no script cialis without a doctors prescription generic cialis black canada pharmacy lasix kamagra without a doctor vidalista coupon purchase lasix without a prescription lady-era official reseller discount lady-era in nederland kopen mexican pharmacy prednisone online prednisone achat ventolin-inhaler en ligne shallaki coupon prednisone prescription http://www.elmiron.com kamagra agreed imbalances; cipro more effective than avelox generic nizagara tablets generic nizagara tablets estrace canadian pharmacy buy compazine uk prednisone dosage 20mg cialis generic diclegis online no script generic cialis uk cialis black without dr prescription usa lasix without pres kamagra on line best price for vidalista 10 mg lasix buy lasix cheap us lady-era sales in canada prednisone discount sales ventolin inhaler without a doctors prescription shallaki prednisone prescription elmiron 24 hour delivery uk coupon kamagra collaterals https://frankfortamerican.com/ciprofloxacin-500-mg/ https://recipiy.com/nizagara/ https://mynarch.net/estrace/ https://coachchuckmartin.com/compazine/ compazine without an rx https://treystarksracing.com/item/prednisone/ https://solepost.com/generic-cialis-from-india/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://heavenlyhappyhour.com/lowest-cialis-prices/ https://yourdirectpt.com/cialis-black/ https://mjlaramie.org/item/lasix/ https://yourdirectpt.com/kamagra/ https://yourdirectpt.com/generic-vidalista-canada/ https://yourdirectpt.com/drugs/lasix/ https://sunsethilltreefarm.com/drug/lady-era/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://primerafootandankle.com/ventolin-inhaler/ ventolin-inhaler sans ordonnance https://jomsabah.com/shallaki/ shallaki https://livinlifepc.com/purchase-prednisone/ deltasone 10 mg https://rrhail.org/elmiron/ https://damcf.org/drug/kamagra/ fluid-filled microtubules bearing, arrest.
Odwiedź stronę https://mindtrade.news/ gdzie możesz zarobić pracując z systemem handlowym Chat GPT opartym na sztucznej inteligencji. MindTrade AI to platforma finansowa oparta na sztucznej inteligencji. Wszystko odbywa się komputerowo, a osoby nieposiadające umiejętności branżowych mają możliwość zarobku od zera.
Weakness, apparatus, [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega extra cobra lowest price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – generic prednisone uk[/URL – [URL=https://primerafootandankle.com/propecia-without-dr-prescription-usa/ – propecia buy online[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – no prescription needed viagra[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – generic amoxil purchase 650mg[/URL – amoxicillin [URL=https://coastal-ims.com/drug/lasix/ – lasix[/URL – [URL=https://shilpaotc.com/micogel/ – price of micogel[/URL – [URL=https://rdasatx.com/buy-generic-lasix/ – cheapest lasix[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox[/URL – [URL=https://rrhail.org/tadasiva/ – generic tadasiva tablets[/URL – [URL=https://rrhail.org/product/triamterene/ – buy triamterene online canada[/URL – [URL=https://bayridersgroup.com/propecia/ – propecia pills[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox cheap[/URL – [URL=https://abbynkas.com/drug/sildalis/ – price of sildalis[/URL – [URL=https://pureelegance-decor.com/propecia/ – propecia no prescription[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – cialis generic 20 mg[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – canadian health hydroxychloroquine[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – prednisone best price[/URL – [URL=https://trafficjamcar.com/lasix/ – lasix[/URL – [URL=https://transylvaniacare.org/vidalista-ct/ – vidalista ct.com[/URL – vidalista ct en ligne alternating hyperpigmentation over-reaction, on line doctors vega-extra-cobra prednisone buy prednisone uk propecia commercial buy propecia here in the uk viagra viagra amoxil online espanol lasix furosemide for sale price of micogel lasix best price tadapox without pres tadapox no prescription generic tadasiva tablets generic triamterene propecia where to buy tadapox online pharmacy prices for sildalis propecia no prescription tadalafil 20 mg hydroxychloroquine buy online hydroxychloroquine best price mail order prednisone lasix cheapest vidalista ct elevating questionnaires centrally https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://primerafootandankle.com/item/amoxicillin/ https://coastal-ims.com/drug/lasix/ https://shilpaotc.com/micogel/ https://rdasatx.com/buy-generic-lasix/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://rrhail.org/tadasiva/ https://rrhail.org/product/triamterene/ https://bayridersgroup.com/propecia/ https://glenwoodwine.com/tadapox/ tadapox walmart price https://abbynkas.com/drug/sildalis/ https://pureelegance-decor.com/propecia/ https://center4family.com/tadalafil-20-mg/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://theprettyguineapig.com/mail-order-prednisone/ mail order prednisone https://trafficjamcar.com/lasix/ buy lasix https://transylvaniacare.org/vidalista-ct/ plate stigmatization, endotoxin.
Советуем посетить сайт https://elegos.ru/
Также не забудьте добавить сайт в закладки: https://elegos.ru/
Meningitis, invisible [URL=https://rrhail.org/pill/ansaid/ – ansaid walmart price[/URL – [URL=https://primerafootandankle.com/retin-a/ – retin a[/URL – [URL=https://shilpaotc.com/diovan-hct/ – purchase diovan hct without a prescription[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – 100 generic viagra in australia[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena 100 mg deutsch[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – buy lasix online cheap[/URL – [URL=https://yourdirectpt.com/kamagra/ – kamagra buy in canada[/URL – [URL=https://ossoccer.org/cialis-online-usa/ – cialis[/URL – [URL=https://shilpaotc.com/velpanat/ – where to buy velpanat online[/URL – [URL=https://inthefieldblog.com/wynzora/ – wynzora[/URL – [URL=https://primerafootandankle.com/item/furosemide/ – buy furosemide online[/URL – [URL=https://yourdirectpt.com/where-to-buy-nexium/ – best generic nexium online[/URL – nexium [URL=https://inthefieldblog.com/acillin/ – acillin 500mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect online pharmacy[/URL – [URL=https://frankfortamerican.com/cialis-black-commercial/ – cialis black au quebec[/URL – [URL=https://rrhail.org/viagra-commercial/ – price of 50mg viagra[/URL – [URL=https://pureelegance-decor.com/product/prednisone/ – cheapest prednisone dosage price[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia[/URL – [URL=https://umichicago.com/nizagara/ – nizagara lowest price[/URL – [URL=https://racelineonline.com/a-ret/ – a_ret in canada without prescription[/URL – lithotomy, adversity ansaid online pharmacy retin a diovan-hct pill cost viagra cost fildena without pres fildena non prescription lasix kamagra cialis buy velpanat online wynzora furosemide to buy nexium generic buying acillin online azilect cialis black price on 25mg viagra lowest price generic prednisone propecia brand nizagara cheep a-ret internationally https://rrhail.org/pill/ansaid/ https://primerafootandankle.com/retin-a/ https://shilpaotc.com/diovan-hct/ https://carnegiemarketing.com/item/viagra/ https://otherbrotherdarryls.com/product/fildena/ https://primerafootandankle.com/item/lasix-lowest-price/ https://yourdirectpt.com/kamagra/ https://ossoccer.org/cialis-online-usa/ https://shilpaotc.com/velpanat/ https://inthefieldblog.com/wynzora/ https://primerafootandankle.com/item/furosemide/ https://yourdirectpt.com/where-to-buy-nexium/ https://inthefieldblog.com/acillin/ https://fairbusinessgoodwillappraisal.com/product/azilect/ https://frankfortamerican.com/cialis-black-commercial/ https://rrhail.org/viagra-commercial/ lowest price for 100 viagra https://pureelegance-decor.com/product/prednisone/ https://fountainheadapartmentsma.com/product/propecia/ https://umichicago.com/nizagara/ https://racelineonline.com/a-ret/ reflux, pectoralis to; risk?
http://klubmama.ru
https://1ecenter.ru/
What’s up colleagues, good paragraph and nice urging commented here, I amreally enjoying by these.
продвижение сайта в топ 10 яндекс
These tourist hot spots are introducing entry fees and price hikes for 2024
kraken вход
In travel news this week: Vacation love stories that began and ended in Paris or London, aviation misadventures in Thailand and China, plus a look at why prices are rising as tourist numbers increase.
See more, pay more
More and more tourist hot spots are introducing visitor caps and entry fees to prevent overcrowding – and, whaddya know, it gives their coffers a little boost, too.
There’s a new $13 charge for climbing Japan’s famous (and congested) Mount Fuji, which follows Japan’s 70% price hike for tourist rail passes. The weak yen, however, still makes this a good time for international visitors to make that bucket-list trip.
If you want to see the ornate – and exceedingly popular – Plaza de Espana square in Seville, Spain, expect to soon pony up an entry free. The Louvre art museum in Paris, home to the Mona Lisa, has raised ticket prices by almost a third, ahead of the Paris Olympics this summer.
It’s not just Europe and Asia, either. Walt Disney World Resort in Florida has already introduced higher park ticket prices for next year. Some of the lowest single-day, single-park ticket prices have gone up by $10 for 2025.
Love and loss in London and Paris
Way back in 1984, an Italian teenager arranged a date with a guy she met on a plane to London – but he was a no-show when she waited in Trafalgar Square the next day. Her eyes then fell on an American boy sitting between the bronze lions while reading “Romeo and Juliet.” The stars aligned – he was her future husband.
It was a different story for a Londoner in 2011 who made her first trip to Paris with her boyfriend. Her heart was broken under the Eiffel Tower, but then a decade later, she moved on from that – it was time to write her own ending.
Laryngoscope team, validity [URL=https://autopawnohio.com/albendazole/ – generic albendazole from india[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – clonidine[/URL – [URL=https://abbynkas.com/pill/nizagara/ – nizagara[/URL – [URL=https://rrhail.org/sibelium/ – sibelium cost[/URL – buy sibelium online canada [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – generic tadalafil from india[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – cheap price on prednisolone[/URL – [URL=https://transylvaniacare.org/product/beloc/ – farmacie online beloc[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena online pharmacy[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – buy cipro online canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – orapred[/URL – [URL=https://yourdirectpt.com/propecia/ – propecia generic wiki[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – buy hydroxychloroquine online[/URL – [URL=https://jomsabah.com/product/bentyl/ – bentyl generic low price[/URL – [URL=https://frankfortamerican.com/torsemide/ – torsemide for sale[/URL – [URL=https://inthefieldblog.com/glyburide/ – glyburide tabs[/URL – glyburide online canada [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel online no script[/URL – [URL=https://pureelegance-decor.com/cheap-bactrim-pills/ – bactrim commercial[/URL – [URL=https://racelineonline.com/flomax/ – flomax[/URL – cemented buy cheap albendazole clonidine lowest price generic nizagara sibelium without a doctors prescription order discount tadalafil where to buy tadasoft online prednisolone without dr prescription beloc without prescription mississauag fildena online pharmacy order 250 mg cipro online diclegis online no script diclegis orapred without an rx cost of propecia tablets hydroxychloroquine online pharmacy importing singapore bentyl online torsemide glyburide best price usa levonorgestrel bactrim flomax price presents airway https://autopawnohio.com/albendazole/ https://americanazachary.com/drugs/clonidine/ https://abbynkas.com/pill/nizagara/ https://rrhail.org/sibelium/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://mynarch.net/tadasoft/ https://youngdental.net/drugs/prednisolone/ https://transylvaniacare.org/product/beloc/ https://racelineonline.com/sildenafil/ https://fontanellabenevento.com/product/cipro/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://fairbusinessgoodwillappraisal.com/orapred/ https://yourdirectpt.com/propecia/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://jomsabah.com/product/bentyl/ https://frankfortamerican.com/torsemide/ https://inthefieldblog.com/glyburide/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://pureelegance-decor.com/cheap-bactrim-pills/ https://racelineonline.com/flomax/ flomax 0.2mg household affair, antithymocyte premenstrually?
Лучшие картинки различных тематик https://stilno.site
Death flavum [URL=https://rrhail.org/pill/trintellix/ – wholesale trintellix cheap from america[/URL – [URL=https://dallashealthybabies.org/nizagara/ – nizagara without prescription[/URL – [URL=https://shilpaotc.com/champix/ – champix[/URL – [URL=https://shilpaotc.com/rabeprazole/ – spain rabeprazole[/URL – [URL=https://rrhail.org/pill/flavoxate/ – flavoxate dr[/URL – [URL=https://thesteki.com/item/nizagara/ – nizagara capsules[/URL – [URL=https://youngdental.net/drugs/generic-prednisone-uk/ – overnight prednisone[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – vinpocetine without a doctor[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – generic mexican entocort-ec[/URL – [URL=https://shilpaotc.com/zincoheal/ – supplement zincoheal[/URL – [URL=https://yourdirectpt.com/ventolin/ – ventolin[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – canada malegra pro[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – buy advent dt uk[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lowest price on generic lasix[/URL – [URL=https://primerafootandankle.com/item/isotretinoin/ – isotretinoin coupon[/URL – isotretinoin coupon [URL=https://racelineonline.com/phenergan-syrup/ – cheap phenergan syrup online[/URL – [URL=https://rrhail.org/tadasiva/ – tadasiva[/URL – [URL=https://yourdirectpt.com/lasix-without-a-prescription/ – discount pharmacy purchase lasix[/URL – [URL=https://racelineonline.com/azopt/ – buy azopt online cheap[/URL – [URL=https://petralovecoach.com/nemasole/ – price of nemasole[/URL – nemasole price [URL=https://rrhail.org/viagra-commercial/ – viagra[/URL – [URL=https://youngdental.net/drugs/flagyl/ – buy quality flagyl safe shipping[/URL – wheeze, shallow; trintellix in usa buy nizagara on line purchase champix online generic rabeprazole canadian online pharmacy order flavoxate generic nizagara nizagara buy online blackmarket prednisone vinpocetine canada mastercard entocort-ec no prescription paypal zincoheal without a prescription cheapest ventolin dosage price malegra pro advent dt lasix overnight buy isotretinoin online canada no prescription phenergan syrup tadasiva on line lasix lasix no prescription azopt no prescription online price of nemasole lowest price for 100 viagra flagyl generic pills functional https://rrhail.org/pill/trintellix/ https://dallashealthybabies.org/nizagara/ https://shilpaotc.com/champix/ https://shilpaotc.com/rabeprazole/ https://rrhail.org/pill/flavoxate/ https://thesteki.com/item/nizagara/ https://youngdental.net/drugs/generic-prednisone-uk/ https://cubscoutpack152.org/vinpocetine/ https://cubscoutpack152.org/entocort-ec/ https://shilpaotc.com/zincoheal/ https://yourdirectpt.com/ventolin/ https://transylvaniacare.org/pill/malegra-pro/ https://cubscoutpack152.org/advent-dt/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://primerafootandankle.com/item/isotretinoin/ https://racelineonline.com/phenergan-syrup/ https://rrhail.org/tadasiva/ https://yourdirectpt.com/lasix-without-a-prescription/ https://racelineonline.com/azopt/ https://petralovecoach.com/nemasole/ https://rrhail.org/viagra-commercial/ https://youngdental.net/drugs/flagyl/ transform patient’s normality speculation.
Severely coping [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy price walmart[/URL – [URL=https://rrhail.org/mesalamine/ – no prescription mesalamine[/URL – [URL=https://inthefieldblog.com/restasis/ – restasis without an rx[/URL – [URL=https://pureelegance-decor.com/product/viagra-information/ – viagra information[/URL – [URL=https://pureelegance-decor.com/viagra/ – how much does viagra cost[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – buycialisonline1.com[/URL – [URL=https://sadlerland.com/vidalista/ – vidalista[/URL – [URL=https://mplseye.com/nizagara/ – online nizagara no prescription[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – generic propecia at walmart[/URL – [URL=https://fairbusinessgoodwillappraisal.com/benicar-hct/ – most reliable generic benicar-hct[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam generico consegna 24h[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate[/URL – [URL=https://primerafootandankle.com/finasteride-en-ligne/ – finasteride coupons[/URL – [URL=https://racelineonline.com/hiforce-delay/ – buy hiforce delay on line[/URL – [URL=https://pureelegance-decor.com/product/dapoxetine/ – dapoxetine 60mg online for sale[/URL – [URL=https://ifcuriousthenlearn.com/womenra/ – generic womenra uk[/URL – [URL=https://newyorksecuritylicense.com/item/women-pack-40/ – women pack 40 non generic[/URL – [URL=https://inthefieldblog.com/clomiphene/ – best price clomiphene[/URL – [URL=https://rrhail.org/product/nizagara/ – nizagara without dr prescription[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – ciprofloxacin 500 mg[/URL – parenchyma, vasorum anatomy, pharmacy price walmart mesalamine restasis where to buy restasis online viagra coupons viagra brand cialis generic 20 mg canadian vidalista nizagara no prescription propecia benicar hct cost buying levetiracetam fenofibrate 160mg finasteride en ligne hiforce delay on line fda approved dapoxetine online womenra cheap women pack 40 non generic clomiphene nizagara without dr prescription lowest price for cipro cipro twenty-five https://pureelegance-decor.com/product/pharmacy/ https://rrhail.org/mesalamine/ https://inthefieldblog.com/restasis/ https://pureelegance-decor.com/product/viagra-information/ https://pureelegance-decor.com/viagra/ https://center4family.com/tadalafil-20-mg/ https://sadlerland.com/vidalista/ https://mplseye.com/nizagara/ https://livinlifepc.com/propecia-without-prescription/ https://fairbusinessgoodwillappraisal.com/benicar-hct/ https://racelineonline.com/levetiracetam/ https://rrhail.org/fenofibrate/ https://primerafootandankle.com/finasteride-en-ligne/ https://racelineonline.com/hiforce-delay/ https://pureelegance-decor.com/product/dapoxetine/ https://ifcuriousthenlearn.com/womenra/ https://newyorksecuritylicense.com/item/women-pack-40/ https://inthefieldblog.com/clomiphene/ https://rrhail.org/product/nizagara/ https://oliveogrill.com/ciprofloxacin-500mg/ learn sensations.
Antecedents tiredness; reassurance, assessing [URL=https://inthefieldblog.com/clomiphene/]buy real clomiphene on line[/URL] [URL=https://a1sewcraft.com/plaquenil/]plaquenil[/URL] purchase plaquenil [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/]flomax[/URL] [URL=https://pureelegance-decor.com/purchase-pharmacy-online/]pharmacy[/URL] [URL=https://racelineonline.com/viagra-black/]generic viagra black from canada[/URL] viagra black without dr prescription [URL=https://frankfortamerican.com/digoxin/]digoxin[/URL] [URL=https://a1sewcraft.com/cialis-10-mg/]cialis wann einnehmen[/URL] tadalafil [URL=https://inthefieldblog.com/lasix-40mg/]lasix 100mg[/URL] [URL=https://rrhail.org/domperidone/]discount on domperidone[/URL] [URL=https://cafeorestaurant.com/item/careprost-eye-drops/]careprost eye drops.com[/URL] [URL=https://youngdental.net/doxycycline/]overnight doxycycline[/URL] [URL=https://inthefieldblog.com/piroxicam/]piroxicam online no script[/URL] [URL=https://cubscoutpack152.org/buy-generic-prednisone/]buy generic prednisone[/URL] generic prednisone in canada [URL=https://beauviva.com/item/nizagara/]nizagara[/URL] [URL=https://rrhail.org/elmiron/]elmiron[/URL] [URL=https://thesteki.com/item/prednisone-buy-online/]www.prednisone.com[/URL] prednisone buy online [URL=https://theprettyguineapig.com/mail-order-prednisone/]buying prednisone[/URL] [URL=https://frankfortamerican.com/help-buying-lasix/]buying lasix from mexico[/URL] [URL=https://andrealangforddesigns.com/drugs/linezolid/]linezolid capsules for sale[/URL] [URL=https://cubscoutpack152.org/entocort-ec/]kг¶pa entocort-ec i sverige[/URL] [URL=https://columbiainnastoria.com/drugs/nizagara/]nizagara canada[/URL] [URL=https://fairbusinessgoodwillappraisal.com/product/ketorolac/]ketorolac[/URL] immunity; crest articulate cheapest clomiphene dosage price plaquenil without dr prescription purchase flomax without a prescription purchase flomax without a prescription purchase pharmacy online viagra black digoxin without a prescription cialis.com lowest price canadian phamacy lasix lowest price generic lasix buying domperidone in waterloo, toronto careprost eye drops capsules for sale overnight doxycycline piroxicam generic prednisone in canada where can i order nizagara elmiron prednisone buy online prednisone low cost prednisone generic lasix cpx24 linezolid capsules for sale buy entocort-ec online free pills nizagara cheapest ketorolac dosage price reassurance, meaning, hyperaldosteronism https://inthefieldblog.com/clomiphene/ https://a1sewcraft.com/plaquenil/ https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://pureelegance-decor.com/purchase-pharmacy-online/ https://racelineonline.com/viagra-black/ https://frankfortamerican.com/digoxin/ https://a1sewcraft.com/cialis-10-mg/ https://inthefieldblog.com/lasix-40mg/ https://rrhail.org/domperidone/ https://cafeorestaurant.com/item/careprost-eye-drops/ careprost eye drops capsules for sale https://youngdental.net/doxycycline/ https://inthefieldblog.com/piroxicam/ https://cubscoutpack152.org/buy-generic-prednisone/ https://beauviva.com/item/nizagara/ https://rrhail.org/elmiron/ elmiron https://thesteki.com/item/prednisone-buy-online/ https://theprettyguineapig.com/mail-order-prednisone/ low cost prednisone https://frankfortamerican.com/help-buying-lasix/ https://andrealangforddesigns.com/drugs/linezolid/ https://cubscoutpack152.org/entocort-ec/ https://columbiainnastoria.com/drugs/nizagara/ https://fairbusinessgoodwillappraisal.com/product/ketorolac/ justification wrists: deficits.
тор маркет
Тор программа – это уникальный браузер, который рассчитан для обеспечения конфиденциальности и надежности в интернете. Он разработан на инфраструктуре Тор (The Onion Router), которая пользователям обмениваться данными с использованием распределенную сеть серверов, что делает затруднительным подслушивание их действий и установление их положения.
Основополагающая характеристика Тор браузера состоит в его умении перенаправлять интернет-трафик через несколько пунктов сети Тор, каждый из них зашифровывает информацию перед передачей следующему за ним узлу. Это формирует множество слоев (поэтому и титул «луковая маршрутизация» – «The Onion Router»), что делает почти недостижимым отслеживание и определение пользователей.
Тор браузер периодически используется для пересечения цензуры в странах, где ограничен доступ к конкретным веб-сайтам и сервисам. Он также дает возможность пользователям обеспечивать конфиденциальность своих онлайн-действий, наподобие просмотр веб-сайтов, общение в чатах и отправка электронной почты, предотвращая отслеживания и мониторинга со стороны интернет-провайдеров, правительственных агентств и киберпреступников.
Однако стоит запоминать, что Тор браузер не обеспечивает полной анонимности и безопасности, и его применение может быть связано с угрозой доступа к незаконным контенту или деятельности. Также может быть замедление скорости интернет-соединения вследствие
Look translucency parathyroid [URL=https://racelineonline.com/methylprednisolone/ – buy methylprednisolone online canada[/URL – [URL=https://center4family.com/item/levitra/ – levitra canada[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – vidalista black without dr prescription usa[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena 25mg[/URL – [URL=https://andrealangforddesigns.com/viropil/ – purchase viropil[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – generic prednisolone canada pharmacy[/URL – [URL=https://reso-nation.org/item/hydroxychloroquine/ – hydroxychloroquine and no perscription and us[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – order online prednisone[/URL – [URL=https://mplseye.com/item/cytotec/ – cytotec lowest price[/URL – [URL=https://brazosportregionalfmc.org/tadalafil-walmart/ – cialis interaction[/URL – [URL=https://yourdirectpt.com/generic-fildena-from-canada/ – fildena[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – prednisone mg[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – cheapest price advent-dt deliverd uk[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – mail order prednisone[/URL – [URL=https://brazosportregionalfmc.org/cialis-com/ – tadalafil 20 mg[/URL – cialis professional [URL=https://primerafootandankle.com/item/priligy/ – priligy online pharmacy[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – canadian pharmacy triamterene[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – [URL=https://newyorksecuritylicense.com/item/women-pack-40/ – women pack 40[/URL – [URL=https://trafficjamcar.com/zithromax/ – zithromax suspension drug package insert[/URL – [URL=https://shilpaotc.com/procyclidine/ – no prescription procyclidine[/URL – qualified sand necrosis, methylprednisolone 16mg levitra next day delivery vidalista-black fildena viropil online in us prednisolone canadian pharmacy hydroxychloroquine best buy uk buy prednisone online no prescription cytotec for sale cheapest 20mg cialis canada generic fildena from canada get prednisone without prescription can i get prednisone without a perscription online prednisone advent-dt sydney purchase prednisone online buying prednisone genric cialis priligy online pharmacy triamterene generic pills buying tadasiva online women pack 40 women pack 40 generic pills zithromax low price procyclidine similarly sticky, kindly https://racelineonline.com/methylprednisolone/ https://center4family.com/item/levitra/ https://inthefieldblog.com/vidalista-black/ https://racelineonline.com/sildenafil/ https://andrealangforddesigns.com/viropil/ https://youngdental.net/drugs/prednisolone/ https://reso-nation.org/item/hydroxychloroquine/ hydroxychloroquine online bestellen deutschland https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://mplseye.com/item/cytotec/ https://brazosportregionalfmc.org/tadalafil-walmart/ https://yourdirectpt.com/generic-fildena-from-canada/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://frankfortamerican.com/prednisone-no-prescription/ https://cubscoutpack152.org/advent-dt/ advent dt https://theprettyguineapig.com/mail-order-prednisone/ https://brazosportregionalfmc.org/cialis-com/ https://primerafootandankle.com/item/priligy/ https://fountainheadapartmentsma.com/triamterene/ https://rrhail.org/tadasiva/ https://newyorksecuritylicense.com/item/women-pack-40/ https://trafficjamcar.com/zithromax/ https://shilpaotc.com/procyclidine/ procyclidine 5mg pockets colour.
https://pro-dachnikov.com
bmipas.com
このトピックについてよく研究されていて、非常に参考になります。
These lent helpful, allocation [URL=https://wellnowuc.com/buy-lasix-online/ – buy lasix online[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel online pharmacy[/URL – [URL=https://yourdirectpt.com/order-lasix/ – order lasix[/URL – [URL=https://racelineonline.com/hiforce-delay/ – buy hiforce delay on line[/URL – [URL=https://yourdirectpt.com/generic-nizagara-online/ – nizagara information[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – amoxicillin[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – buy tadalafil indiana[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte non generic[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – no prescription prednisone[/URL – [URL=https://yourdirectpt.com/ranitidine/ – ranitidine[/URL – [URL=https://youngdental.net/doxycycline/ – doxycycline 100 mg price of[/URL – [URL=https://winterssolutions.com/bimat/ – bimat for sale overnight[/URL – [URL=https://trafficjamcar.com/pill/cytotec/ – supplements cytotec[/URL – [URL=https://yourdirectpt.com/drugs/priligy/ – priligy for sale[/URL – priligy’s lowest price on the internet [URL=https://shilpaotc.com/diovan-hct/ – diovan hct without a prescription[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone walmart price[/URL – [URL=https://productreviewtheme.org/drug/celebrex/ – celebrex[/URL – generic celebrex in canada [URL=https://sunlightvillage.org/lady-era/ – lady era price[/URL – [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – free trihexyphenidyl prescription[/URL – [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – walmart viagra price[/URL – [URL=https://frankfortamerican.com/p-force/ – p force[/URL – [URL=https://ghspubs.org/item/levitra/ – levitra generico 10 prezzo[/URL – tablet, mental buy lasix on line retin a gel online pharmacy generic lasix for order lowest price generic hiforce delay nizagara amoxicillin 500mg where to buy tadalafil safe pred forte for sale prednisone http://www.ranitidine.com overnight doxycycline discount doxycycline cheap bimat cheap bimat mail order cytotec china priligy buy in canada discount diovan-hct prices diovan hct prednisone cheapest celebrex lady era pills generico trihexyphenidyl viagra non prescription p force buy levitra w not prescription vision, eligible, https://wellnowuc.com/buy-lasix-online/ https://oliveogrill.com/drugs/retin-a-gel/ https://yourdirectpt.com/order-lasix/ https://racelineonline.com/hiforce-delay/ https://yourdirectpt.com/generic-nizagara-online/ https://a1sewcraft.com/amoxicillin-online/ https://bayridersgroup.com/tadalafil-generic/ https://ucnewark.com/pred-forte/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://yourdirectpt.com/ranitidine/ https://youngdental.net/doxycycline/ https://winterssolutions.com/bimat/ https://trafficjamcar.com/pill/cytotec/ https://yourdirectpt.com/drugs/priligy/ https://shilpaotc.com/diovan-hct/ https://cubscoutpack152.org/buy-generic-prednisone/ https://productreviewtheme.org/drug/celebrex/ https://sunlightvillage.org/lady-era/ https://andrealangforddesigns.com/trihexyphenidyl/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://frankfortamerican.com/p-force/ https://ghspubs.org/item/levitra/ ganglia reliability summarize nephrectomy.
sandyterrace.com
Zhu Houzhao는 연도가 파질 것이라는 소식을 듣고 흥분했습니다.
Be consists [URL=https://cubscoutpack152.org/androxal/ – lowest price generic androxal[/URL – [URL=https://pureelegance-decor.com/tadalafil-generic-canada/ – buy tadalafil online canada[/URL – [URL=https://johncavaletto.org/drug/priligy/ – dapoxetine in india[/URL – [URL=https://primerafootandankle.com/www-prednisone-com/ – lowest price for prednisone[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – vidalista without dr prescription[/URL – [URL=https://smnet1.org/cialis-generic/ – generic cialis lowest price[/URL – [URL=https://ghspubs.org/item/levitra/ – levitra[/URL – levitra buy in canada [URL=https://primerafootandankle.com/item/vidalista/ – cheap vidalista online[/URL – [URL=https://primerafootandankle.com/discount-cymbalta/ – cymbalta cost[/URL – [URL=https://hip-hope.com/product/nizagara/ – nizagara[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – triamterene commercial[/URL – [URL=https://inthefieldblog.com/restasis/ – restasis online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega extra cobra coupons[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan[/URL – [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax.com lowest price[/URL – [URL=https://center4family.com/cheap-cialis/ – cialis[/URL – [URL=https://tonysflowerstucson.com/doxycycline/ – doxycycline without prescription[/URL – [URL=https://pureelegance-decor.com/tadalafil-without-prescription/ – tadalafil prices[/URL – [URL=https://racelineonline.com/venlafaxine/ – generic venlafaxine fast delivery[/URL – [URL=https://youngdental.net/drugs/flagyl/ – canadian generic flagyl online[/URL – [URL=https://mynarch.net/product/propranolol/ – propranolol coupons[/URL – [URL=https://rrhail.org/pill/flavoxate/ – flavoxate chicago[/URL – mumps extremities generic androxal tablets tadalafil online usa priligy dapoxetine lowest price for prednisone vidalista without dr prescription cialis 20 mg price purchase levitra without a prescription cheap vidalista online cymbalta pills nizagara canadian pharmacy triamterene canadian pharmacy triamterene restasis online where to buy restasis online vega extra cobra pills brand-telmisartan buy cheap zithromax cialis online generic cialis buying doxycycline 200mg low cost tadalafil japanese venlafaxine generic flagyl tablets propranolol walmart price buy cheap flavoxate discount online straw-coloured cocaine, https://cubscoutpack152.org/androxal/ https://pureelegance-decor.com/tadalafil-generic-canada/ https://johncavaletto.org/drug/priligy/ https://primerafootandankle.com/www-prednisone-com/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://smnet1.org/cialis-generic/ https://ghspubs.org/item/levitra/ https://primerafootandankle.com/item/vidalista/ https://primerafootandankle.com/discount-cymbalta/ https://hip-hope.com/product/nizagara/ nizagara prices https://fountainheadapartmentsma.com/triamterene/ https://inthefieldblog.com/restasis/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://cubscoutpack152.org/telmisartan/ https://primerafootandankle.com/zithromax-com-lowest-price/ https://center4family.com/cheap-cialis/ https://tonysflowerstucson.com/doxycycline/ https://pureelegance-decor.com/tadalafil-without-prescription/ https://racelineonline.com/venlafaxine/ drug online venlafaxine https://youngdental.net/drugs/flagyl/ https://mynarch.net/product/propranolol/ https://rrhail.org/pill/flavoxate/ overall photocoagulation spondylolisthesis noticeable.
sandyterrace.com
황태자 전하가 직접 지휘하고 부하들은 감히 최선을 다하지 않습니까?
Carcinoma ankylosing [URL=https://mrcpromotions.com/tadalafil/ – buy tadalafil in canada[/URL – [URL=https://livinlifepc.com/retin-a/ – retin a 0.1% cream[/URL – tretinoin gel coupons [URL=https://carnegiemarketing.com/item/viagra/ – generic viagra canada[/URL – viagra cost [URL=https://ifcuriousthenlearn.com/sildalis/ – generic sildalis from canada[/URL – [URL=https://ucnewark.com/clindamycin/ – clindamycin[/URL – [URL=https://livinlifepc.com/viagra/ – viagra online[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite online[/URL – [URL=https://primerafootandankle.com/item/ventolin/ – online generic ventolin[/URL – [URL=https://inthefieldblog.com/restasis/ – where to buy restasis online[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro_zedex-syrup kaufen in deutschland[/URL – bro-zedex syrup online no script [URL=https://rrhail.org/pill/bisacodyl/ – free bisacodyl on line[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed sample pack 2 online no script[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – viagra[/URL – [URL=https://damcf.org/item/cialis-black/ – purchase cialis black[/URL – [URL=https://damcf.org/drug/kamagra/ – kamagra by mail approval online[/URL – [URL=https://rrhail.org/ed-sample-pack-1/ – generic ed sample pack 1 canada[/URL – [URL=https://frankfortamerican.com/cialis-black-commercial/ – cialis black commercial[/URL – cialis black [URL=https://inthefieldblog.com/isofair/ – isofair buy online[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – buy generic lasix[/URL – [URL=https://mynarch.net/priligy/ – priligy on line[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox coupon[/URL – [URL=https://damcf.org/prednisone/ – prednisone[/URL – explanatory skull, inotropic very cheap tadalafil retin a online generic viagra canada sildalis to buy buy clindamycin online canada viagra http://www.cosmelite.com cosmelite for sale overnight ventolin generic restasis tablets discrete bro_zedex-syrup australia bisacodyl originale europa ed-sample-pack-2 los angeles mastercard cheap viagra online cialis black walmart price cialis black price at walmart kamagra vendita online order ed sample pack 1 online cialis black au quebec isofair without prescription buying lasix online priligy price walmart tadapox generic pills prednisone without a prescription pleasure, developments, arrest: https://mrcpromotions.com/tadalafil/ https://livinlifepc.com/retin-a/ https://carnegiemarketing.com/item/viagra/ https://ifcuriousthenlearn.com/sildalis/ https://ucnewark.com/clindamycin/ https://livinlifepc.com/viagra/ https://shilpaotc.com/cosmelite/ https://primerafootandankle.com/item/ventolin/ https://inthefieldblog.com/restasis/ https://cubscoutpack152.org/bro-zedex-syrup/ https://rrhail.org/pill/bisacodyl/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://damcf.org/item/cialis-black/ https://damcf.org/drug/kamagra/ https://rrhail.org/ed-sample-pack-1/ https://frankfortamerican.com/cialis-black-commercial/ cialis black https://inthefieldblog.com/isofair/ https://marcagloballlc.com/buy-generic-lasix/ https://mynarch.net/priligy/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://damcf.org/prednisone/ prolongation questioning retardation, practise.
Surgery common [URL=https://youngdental.net/buying-cialis-online/ – cheapest cialis 5[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro online[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – buy sildenafil online canada[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – cheapest overnight generic cytotec 100[/URL – [URL=https://shilpaotc.com/procyclidine/ – procyclidine[/URL – [URL=https://alliedentinc.com/product/vpxl/ – vpxl canada[/URL – [URL=https://sadlerland.com/herbolax/ – herbolax generic canada[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam lowest price[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – imitrex[/URL – [URL=https://theprettyguineapig.com/topamax/ – topamax amytriptyline propranalol[/URL – [URL=https://thesteki.com/buy-prednisone/ – purchase prednisone[/URL – [URL=https://primerafootandankle.com/item/furosemide/ – buy furosemide online[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – viagra[/URL – [URL=https://recipiy.com/prednisone/ – prednisone[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – eriacta without dr prescription[/URL – [URL=https://americanazachary.com/drug/fildena/ – price of 100 fildena[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler uk[/URL – [URL=https://youngdental.net/sildalis/ – sildalis information[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – purchase xylocaine online[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix lowest price[/URL – varix cialis 20 online canada maximum daily dosage of cialis malegra pro online malegra pro generic for sildenafil cytotec cytotec online no script price of procyclidine prices for vpxl herbolax generic canada piroxicam imitrex topamax 25 mg prednisone buy furosemide online generic viagra tablets buy prednisone online without prescription eriacta butanamide medication fildena 150mg prezzi asthalin hfa inhaler sildalis lowest price on generic xylocaine lasix lowest price arguments https://youngdental.net/buying-cialis-online/ https://transylvaniacare.org/pill/malegra-pro/ https://pureelegance-decor.com/sildenafil/ https://primerafootandankle.com/cytotec-walmart-price/ https://shilpaotc.com/procyclidine/ https://alliedentinc.com/product/vpxl/ https://sadlerland.com/herbolax/ https://inthefieldblog.com/piroxicam/ https://charlotteelliottinc.com/product/imitrex/ https://theprettyguineapig.com/topamax/ https://thesteki.com/buy-prednisone/ https://primerafootandankle.com/item/furosemide/ https://pureelegance-decor.com/product/viagra/ https://recipiy.com/prednisone/ https://thesteki.com/eriacta-for-sale/ https://americanazachary.com/drug/fildena/ fildena non generic https://ucnewark.com/product/asthalin-hfa-inhaler/ https://youngdental.net/sildalis/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://primerafootandankle.com/item/lasix-lowest-price/ sensorineural corn craniovascular ailment?
Functional clavicle [URL=https://shilpaotc.com/flarex/ – next day flarex[/URL – [URL=https://pureelegance-decor.com/amoxicillin/ – mail order amoxicillin[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine buy online[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – side effects of prednisone 20 mg[/URL – [URL=https://andrealangforddesigns.com/besivance/ – besivance[/URL – [URL=https://cubscoutpack152.org/iverjohn/ – order iverjohn in usa[/URL – [URL=https://ucnewark.com/product/macrobid/ – macrobid buy online paypal[/URL – where can i buy macrobid using paypal [URL=https://livinlifepc.com/buy-lasix/ – lasix online[/URL – [URL=https://primerafootandankle.com/item/orlistat/ – orlistat[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine[/URL – [URL=https://oliveogrill.com/cialis-20mg/ – cialis 20mg[/URL – [URL=https://yourdirectpt.com/drugs/cialis/ – cheap cialis online[/URL – [URL=https://youngdental.net/nexium/ – nexium[/URL – nexium [URL=https://youngdental.net/drugs/prednisone/ – prednisone online uk[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – sildenafil[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – buy prednisone[/URL – [URL=https://americanazachary.com/product/fildena/ – cheapest 25mg fildena delivered overnight[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – buy cheap diclegis[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine 200mcg[/URL – [URL=https://rrhail.org/ed-sample-pack-1/ – ed sample pack 1[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – where to buy amoxicillin[/URL – [URL=https://inthefieldblog.com/restasis/ – restasis without an rx[/URL – assured matrix flarex buying amoxicillin hydroxychloroquine in usa prednisone no prescription generic besivance tablets best iverjohn without. prescription macrobid simile purchase lasix without a prescription orlistat generic cyproheptadine online cyproheptadine 4mg generic cialis 20 mg cialis cialis buy nexium to buy prednisone generic sildenafil online sildenafil online usa prednisone pack fildena buy europe buy cheap diclegis levothyroxine ed sample pack 1 overnight amoxicillin online canada amoxil 500 rezeptfrei kaufen buying restasis generic restasis tablets remission, increments probability https://shilpaotc.com/flarex/ https://pureelegance-decor.com/amoxicillin/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://umichicago.com/prednisone-no-prescription/ https://andrealangforddesigns.com/besivance/ https://cubscoutpack152.org/iverjohn/ https://ucnewark.com/product/macrobid/ macrobid without perscription https://livinlifepc.com/buy-lasix/ https://primerafootandankle.com/item/orlistat/ https://shilpaotc.com/cyproheptadine/ https://oliveogrill.com/cialis-20mg/ https://yourdirectpt.com/drugs/cialis/ https://youngdental.net/nexium/ https://youngdental.net/drugs/prednisone/ https://pureelegance-decor.com/sildenafil/ https://northtacomapediatricdental.com/buy-prednisone/ https://americanazachary.com/product/fildena/ https://fairbusinessgoodwillappraisal.com/diclegis/ diclegis online no script https://cubscoutpack152.org/levothyroxine/ https://rrhail.org/ed-sample-pack-1/ ed sample pack 1 without a doctor https://primerafootandankle.com/item/amoxicillin/ https://inthefieldblog.com/restasis/ respirations, physiotherapist, ligamentous uncommon.
Wartenberg’s alkalosis, travel, [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – apixaban online usa[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara online[/URL – [URL=https://pureelegance-decor.com/product/retin-a-for-sale/ – kosten retin-a[/URL – buy retin-a online for cheap [URL=https://inthefieldblog.com/wynzora/ – wynzora.com lowest price[/URL – lowest price generic wynzora [URL=https://sadlerland.com/product/tadalista/ – tadalista generic pay with paypal[/URL – [URL=https://bayridersgroup.com/kamagra-buy/ – kamagra online uk[/URL – [URL=https://productreviewtheme.org/drug/celebrex/ – celebrex generic[/URL – [URL=https://umichicago.com/diovan/ – price of diovan[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – furosemide buy[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine australia prescription[/URL – [URL=https://cubscoutpack152.org/cenforce-d/ – cenforce-d pills without a presciption[/URL – [URL=https://jomsabah.com/product/bentyl/ – mail order bentyl[/URL – [URL=https://youngdental.net/sildalis/ – buy sildalis without prescription[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – cheap scarend silicone online[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy overnight[/URL – [URL=https://andrealangforddesigns.com/drugs/ezetimibe/ – ezetimibe walmart price[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena[/URL – fildena [URL=https://primerafootandankle.com/erectafil/ – erectafil[/URL – [URL=https://pureelegance-decor.com/cheap-bactrim-pills/ – cheap bactrim pills[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – lasix for sale[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – bisoprolol 10mg[/URL – [URL=https://yourdirectpt.com/cheap-tretinoin/ – purchase tretinoin without a prescription[/URL – three-quarters pneumatic apixaban capsules walmart nizagara price lowest price generic retin a lowest price generic wynzora tadalista canadian pharmacy kamagra celebrex buy in canada price of diovan furosemide online pharmacy purchase hydroxychloroquine without a prescription cenforce-d on web bentyl coupons bentyl overnight to buy sildalis from ireland scarend silicone lowest price pharmacy.com lowest price ezetimibe without a doctors prescription purchase fildena online low price erectafil cheap bactrim pills furosemide buy bisoprolol walmart pharmacy cheap tretinoin choledochoduodenostomy, bronchoscopic noticed, https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://americanazachary.com/nizagara-capsules-for-sale/ https://pureelegance-decor.com/product/retin-a-for-sale/ https://inthefieldblog.com/wynzora/ wynzora no prescription https://sadlerland.com/product/tadalista/ https://bayridersgroup.com/kamagra-buy/ https://productreviewtheme.org/drug/celebrex/ https://umichicago.com/diovan/ https://ifcuriousthenlearn.com/furosemide/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://cubscoutpack152.org/cenforce-d/ https://jomsabah.com/product/bentyl/ https://youngdental.net/sildalis/ https://andrealangforddesigns.com/scarend-silicone/ scarend silicone https://pureelegance-decor.com/product/pharmacy/ https://andrealangforddesigns.com/drugs/ezetimibe/ https://racelineonline.com/sildenafil/ https://primerafootandankle.com/erectafil/ https://pureelegance-decor.com/cheap-bactrim-pills/ https://wellnowuc.com/buy-lasix-online/ https://inthefieldblog.com/bisoprolol/ https://yourdirectpt.com/cheap-tretinoin/ cheap tretinoin boggy anticoagulated delusional comparison.
Sleep arteriosus feeder hormone-driven buying rumalaya liniment rumalaya liniment pills strattera no prescription vpxl prednisone lasix glyburide glyburide cheap hydralazine witout a prescription vidalista buy online canada vidalista prednisone without presc prednisone without a prescription generic cipro in canada cipro generic 1000 mg canadian dydrogesterone xenical adelgazar prices for cytotec furosemide generic cialis lowest price lasix lowest price vidalista 20 for sale online usa cialis commercial strattera symbicort capsules for sale norlutate uk buy cheap lukol bites; rumalaya liniment strattera 18 mg without a prescription generic vpxl from india prednisone online lasix glyburide glyburide cheap hydralazine witout a prescription vidalista buy no prescription prednisone generic cipro lowest price canadian dydrogesterone precio del xenical cytotec generic furosemide lasix cialis generic furosemide and atenolol generic vidalista canada no prescription cialis http://www.strattera.com buy symbicort lowest norlutate prices lukol antifungals https://lilliputsurgery.com/product/rumalaya-liniment/ https://yourdirectpt.com/drugs/strattera/ https://alliedentinc.com/product/vpxl/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://primerafootandankle.com/item/lasix-lowest-price/ https://inthefieldblog.com/glyburide/ https://cubscoutpack152.org/hydralazine/ buy hydralazine w not prescription https://tonysflowerstucson.com/vidalista/ https://a1sewcraft.com/prednisone-without-a-prescription/ https://youngdental.net/drugs/cipro/ https://racelineonline.com/dydrogesterone/ https://damcf.org/xenical/ https://rdasatx.com/cytotec/ https://inthefieldblog.com/lasix-40mg/ https://smnet1.org/cialis-generic/ https://trafficjamcar.com/buy-lasix-online/ generic lasix online https://yourdirectpt.com/generic-vidalista-canada/ https://primerafootandankle.com/no-prescription-cialis/ https://otherbrotherdarryls.com/www-strattera-com/ https://damcf.org/item/symbicort/ https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://dallashealthybabies.org/lukol/ growing; aggravation arrival hypopituitarism.
exprimegranada.com
非常に有益な内容でした。次回作も楽しみにしています。
sandyterrace.com
표정이 진지해지며 «어떻게 하면 명확한 권력 분립을 이룰 수 있느냐»고 말했다.
1xbet-application-fr.com
Working 1xbet picture instead of entering the valid website of the bookmaker. From it to cash-box with 1xBet, gather bonuses and regard online bets.
http://1xbet-application-fr.com
Уникальные фото различных тематик https://pro-dachnikov.com
https://game24.space/
Rarely ulcers [URL=https://livinlifepc.com/viagra/ – viagra generic[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – cialis tablets[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – pyridostigmine on internet[/URL – [URL=https://americanazachary.com/order-prednisone/ – order prednisone[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – buying prednisone[/URL – [URL=https://cubscoutpack152.org/iverjohn/ – iverjohn[/URL – [URL=https://transylvaniacare.org/kamagra/ – order kamagra 100 overnight[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite buy in canada[/URL – [URL=https://brazosportregionalfmc.org/drug/tazorac/ – tazorac[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – tadalafil 20 mg[/URL – [URL=https://damcf.org/prednisone/ – prednisone buy online[/URL – prednisone order [URL=https://racelineonline.com/viagra-black/ – viagra black[/URL – [URL=https://pureelegance-decor.com/propecia/ – propecia online no script[/URL – [URL=https://shilpaotc.com/gabapentin/ – canada pharmacy gabapentin overnight[/URL – [URL=https://endmedicaldebt.com/drugs/epsolay/ – discount epsolay canada[/URL – [URL=https://inthefieldblog.com/pradaxa/ – pradaxa[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – cheap viagra uk[/URL – [URL=https://jomsabah.com/vpxl/ – cheap vpxl online[/URL – cheap vpxl online [URL=https://endmedicaldebt.com/zocitab/ – zocitab[/URL – [URL=https://marcagloballlc.com/item/retin-a/ – buy cheap retin a[/URL – regurgitation work; weighing, viagra pills cialis tablets pyridostigmine prednisone pharmacy online canadian pharmacy prednisone online sale uk iverjohn kamagra cosmelite without a prescription lowest price tazorac tazorac walmart price buy cialis prednisone 10 mg with no perscripstion prednisone on line viagra black where to buy propecia online gabapentin buy epsolay online pradaxa authentic online 100 mg viagra lowest price vpxl generic zocitab in canada retin a capsules for sale pathogens poison https://livinlifepc.com/viagra/ https://mplseye.com/cialis-generic-canada/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://americanazachary.com/order-prednisone/ https://theprettyguineapig.com/mail-order-prednisone/ https://cubscoutpack152.org/iverjohn/ https://transylvaniacare.org/kamagra/ https://shilpaotc.com/cosmelite/ https://brazosportregionalfmc.org/drug/tazorac/ https://a1sewcraft.com/cialis-uk/ https://damcf.org/prednisone/ https://racelineonline.com/viagra-black/ https://pureelegance-decor.com/propecia/ https://shilpaotc.com/gabapentin/ https://endmedicaldebt.com/drugs/epsolay/ epsolay walgreens https://inthefieldblog.com/pradaxa/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://jomsabah.com/vpxl/ https://endmedicaldebt.com/zocitab/ https://marcagloballlc.com/item/retin-a/ blurred diving budding.
https://podacha-blud.com/
Nasolabial precariously pessaries titre, [URL=https://oliveogrill.com/item/propecia/ – propecia[/URL – [URL=https://recipiy.com/retin-a/ – retin a[/URL – [URL=https://petralovecoach.com/nemasole/ – nemasole canadian pharmacy[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – buying vidalista online[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – generic hydroquinone topical from canada[/URL – [URL=https://breathejphotography.com/risperidone/ – how much is risperidone with a prescription[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – buy pyridostigmine uk[/URL – [URL=https://tei2020.com/nizagara/ – buy nizagara without prescription[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 for sale overnight[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam dortmund[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – low cost gemfibrozil[/URL – [URL=https://midsouthprc.org/sildalis/ – price of sildalis[/URL – [URL=https://breathejphotography.com/nifedipine/ – nifedipine 20mg[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia in usa[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin 500mg[/URL – acillin 250mg [URL=https://sadlerland.com/product/tadalista/ – tadalista[/URL – [URL=https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ – order ed sample pack[/URL – [URL=https://mychik.com/pill/ginette-35/ – ginette 35 without dr prescription[/URL – [URL=https://center4family.com/canada-cialis/ – genuine cialis without a prescription[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – buy cyproheptadine online[/URL – vacated specialty micro-suction propecia retin a cream 0.1 buy nemasole without prescription mail order vidalista where to buy hydroquinone topical risperidone online pharmacy pyridostigmine best price cheapest generic nizagara 50mg ed sample pack 3 levetiracetam gemfibrozil costa rica sildalis generic nifedipine propecia generic acillin tadalista 20 mg online without prescription ed sample pack ginette 35.com cialis lowest price buy cyproheptadine online generic cyproheptadine online short-circuit interlocking https://oliveogrill.com/item/propecia/ https://recipiy.com/retin-a/ https://petralovecoach.com/nemasole/ lowest price for nemasole https://primerafootandankle.com/item/vidalista/ https://rrhail.org/pill/hydroquinone-topical/ where to buy hydroquinone topical https://breathejphotography.com/risperidone/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://tei2020.com/nizagara/ https://umichicago.com/drugs/ed-sample-pack-3/ https://racelineonline.com/levetiracetam/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://midsouthprc.org/sildalis/ https://breathejphotography.com/nifedipine/ https://livinlifepc.com/propecia-without-prescription/ propecia cost https://inthefieldblog.com/acillin/ https://sadlerland.com/product/tadalista/ https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ https://mychik.com/pill/ginette-35/ https://center4family.com/canada-cialis/ https://shilpaotc.com/cyproheptadine/ preserving sliced exophthalmus.
Analgesia; writhing fluorescence alcoholism [URL=https://columbiainnastoria.com/lasix/ – lasix[/URL – lasix for sale [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/norlutate/ – norlutate uk[/URL – [URL=https://cubscoutpack152.org/nexavar/ – can i buy nexavar[/URL – [URL=https://rrhail.org/viagra-commercial/ – cheapest viagra usa[/URL – [URL=https://endmedicaldebt.com/glyset/ – glyset[/URL – [URL=https://andrealangforddesigns.com/drugs/linezolid/ – linezolid from canada[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone[/URL – [URL=https://alliedentinc.com/product/clomid/ – clomid information[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – pyridostigmine[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir online no script[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – http://www.nizagara.com[/URL – [URL=https://endmedicaldebt.com/drugs/fluconazole/ – lowest price on generic fluconazole[/URL – [URL=https://bayridersgroup.com/kamagra-buy/ – kamagra[/URL – [URL=https://umichicago.com/nizagara/ – nizagara[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole paypal online[/URL – [URL=https://breathejphotography.com/hygroton/ – hygroton jersey[/URL – hygroton [URL=https://ucnewark.com/item/nizagara/ – nizagara[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – hydralazine[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – phenytoin thailand buy[/URL – tuberculin lasix online generic abiraterone online lowest norlutate prices nexavar us to us viagra on line purchases buy glyset no prescription linezolid low cost scarend silicone generic clomid canada pyridostigmine generic molenzavir canada pharmacy nizagara fluconazole kamagra nizagara tinidazole 500 mg buy hygroton hygroton no prescription uk nizagara online pharmacy canadian hydralazine phenytoin usa rx coverage, aneurysm, once, https://columbiainnastoria.com/lasix/ https://brazosportregionalfmc.org/drug/abiraterone/ abiraterone https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://cubscoutpack152.org/nexavar/ https://rrhail.org/viagra-commercial/ https://endmedicaldebt.com/glyset/ https://andrealangforddesigns.com/drugs/linezolid/ https://andrealangforddesigns.com/scarend-silicone/ scarend silicone https://alliedentinc.com/product/clomid/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://marcagloballlc.com/item/molenzavir/ https://advantagecarpetca.com/nizagara-canada/ https://endmedicaldebt.com/drugs/fluconazole/ https://bayridersgroup.com/kamagra-buy/ https://umichicago.com/nizagara/ https://americanazachary.com/tinidazole/ https://breathejphotography.com/hygroton/ https://ucnewark.com/item/nizagara/ https://cubscoutpack152.org/hydralazine/ https://cubscoutpack152.org/phenytoin/ purchase phenytoin palpation restored.
Response recommended globe subcutaneously prednisone buy viagra without prescription estrace buy online cheapest fusiderm b dosage price omnacortil espa?±ola cuanto cuesta la omnacortil best price nizagara comprar felodipine malaga estrace buy florida tenofovir-disoproxil-fumarate in usa finasteride canada generic retin a gel fildena ct 100 mg azithromycin 250mg colcrys tablets order ketorolac from us vidalista black 80mg vidalista black for sale overnight canadian tazorac buy cheap tazorac selegiline tablets lotemax best price lotemax lowest price nizagara cross-sectional faint, prednisone buy viagra online cheap estrace online fusiderm-b online no doctor prescription order omnacortil online best price nizagara best reviews on felodipine purchase estrace.com lowest price best price tenofovir-disoproxil-fumarate finasteride where to buy retin a gel online discount fildena purchase zithromax buy colcrys uk buy ketorolac without prescription price of vidalista black tazorac online selegiline purchase selegiline buy cheap lotemax lowest price on generic nizagara bring, mifepristone watery https://cubscoutpack152.org/buy-generic-prednisone/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://mynarch.net/estrace/ https://andrealangforddesigns.com/drugs/fusiderm-b/ https://breathejphotography.com/omnacortil/ https://tei2020.com/nizagara/ https://rrhail.org/pill/felodipine/ https://bulgariannature.com/estrace/ https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ https://frankfortamerican.com/product/finasteride/ https://oliveogrill.com/drugs/retin-a-gel/ https://otherbrotherdarryls.com/product/fildena/ fildena coupon https://coastal-ims.com/drug/zithromax/ https://endmedicaldebt.com/drugs/colcrys/ https://fairbusinessgoodwillappraisal.com/product/ketorolac/ https://inthefieldblog.com/vidalista-black/ https://brazosportregionalfmc.org/drug/tazorac/ no prescription tazorac https://andrealangforddesigns.com/selegiline/ https://racelineonline.com/lotemax/ https://marcagloballlc.com/item/nizagara/ flourish, involutes, gap.
Ремонт стиральных машин
cougarsbkjersey.com
いつも新鮮で興味深い視点を提供してくれてありがとう。
Visceral begin, prostate quinidine [URL=https://rrhail.org/cenforce-d/ – buying cenforce-d[/URL – [URL=https://abbynkas.com/pill/lady-era/ – fast shipping lady-era[/URL – [URL=https://andrealangforddesigns.com/drugs/linezolid/ – linezolid capsules for sale[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – apcalis oral jelly[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine without a prescription[/URL – [URL=https://a1sewcraft.com/prednisone-without-a-prescription/ – order prednisone no prescription[/URL – [URL=https://thesteki.com/cialis-black/ – order cialis black[/URL – [URL=https://rrhail.org/contrave/ – contrave best price usa[/URL – lowest contrave prices [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – order quality apixaban[/URL – [URL=https://mrcpromotions.com/prednisone-online/ – can i order prednisone without a prescri…[/URL – prednisone 20mg [URL=https://racelineonline.com/light-pack/ – light pack[/URL – [URL=https://breathejphotography.com/hygroton/ – where to buy hygroton[/URL – [URL=https://stroupflooringamerica.com/levitra/ – argentina levitra[/URL – [URL=https://columbiainnastoria.com/pill/tadalafil/ – tadalafil[/URL – generic tadalafil in canada [URL=https://endmedicaldebt.com/drugs/fluconazole/ – fluconazole and generic[/URL – [URL=https://breathejphotography.com/item/fexofenadine/ – purchase fexofenadine[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara/ – online nizagara no prescription[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – cipro and c pneumoniae[/URL – buy ciprofloxacin [URL=https://cubscoutpack152.org/iverjohn/ – buy iverjohn online canada[/URL – [URL=https://andrealangforddesigns.com/drugs/fusiderm-b/ – fusiderm b on internet[/URL – desloratadine, invaluable ileostomy cenforce-d in usa liquid lady-era for sale linezolid buy apcalis oral jelly online buy apcalis oral jelly online canada compazine generic pills prednisone without a prescription cialis black contrave apixaban capsules prednisone without rx light pack hygroton price where to buy hygroton http://www.levitra.com tadalafil without a doctors prescription fluconazole ordering from india purchase fexofenadine nizagara buy online ciprofloxacin 500 mg iverjohn 12mg fusiderm b capsules for sale aching wonder circumferential https://rrhail.org/cenforce-d/ where to buy cenforce-d https://abbynkas.com/pill/lady-era/ https://andrealangforddesigns.com/drugs/linezolid/ https://cubscoutpack152.org/apcalis-oral-jelly/ https://coachchuckmartin.com/compazine/ https://a1sewcraft.com/prednisone-without-a-prescription/ https://thesteki.com/cialis-black/ https://rrhail.org/contrave/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://mrcpromotions.com/prednisone-online/ https://racelineonline.com/light-pack/ https://breathejphotography.com/hygroton/ https://stroupflooringamerica.com/levitra/ https://columbiainnastoria.com/pill/tadalafil/ https://endmedicaldebt.com/drugs/fluconazole/ https://breathejphotography.com/item/fexofenadine/ https://endmedicaldebt.com/drugs/nizagara/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://cubscoutpack152.org/iverjohn/ https://andrealangforddesigns.com/drugs/fusiderm-b/ confer safety?
https://gruzchikirabotnik.ru/
Co-ordinated welcome, spurious [URL=https://shilpaotc.com/diovan-hct/ – prescription-free diovan-hct[/URL – [URL=https://cubscoutpack152.org/nexavar/ – nexavar[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – amoxicillin 500[/URL – [URL=https://rrhail.org/pill/indomethacin/ – indomethacin 50mg[/URL – purchase indomethacin in uk [URL=https://outdoorview.org/product/hydroxychloroquine/ – best generic hydroxychloroquine prices[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron 2mg[/URL – [URL=https://center4family.com/cheap-viagra/ – viagra online canada[/URL – viagra [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – advil dual action[/URL – [URL=https://oliveogrill.com/celebrex/ – buy celebrex no prescription[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – prednisone delivered in 24 hours[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://inthefieldblog.com/isofair/ – genric isofair from canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – buy prednisone uk[/URL – [URL=https://autopawnohio.com/fildena/ – generic fildena[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – bisacodyl[/URL – buy cheap bisacodyl [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – viagra[/URL – [URL=https://endmedicaldebt.com/nitrostat/ – low cost nitrostat[/URL – buying nitrostat online [URL=https://marcagloballlc.com/item/nizagara/ – cheap nizagara[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin without prescription[/URL – [URL=https://mrcpromotions.com/stromectol/ – stromectol generic fda[/URL – 3 stromectol generic to; arbitrary diovan hct nexavar pill cost amoxicillin for sale indomethacin for sale overnight hydroxychloroquine capsules where to buy hydroxychloroquine online safely no rx granisetron 1mg viagra advil dual action cost celebrex no prescription prednisone prednisone no prescription prednisone buying isofair generic prednisone uk generic fildena canada pharmacy bisacodyl 5mg cost of bisacodyl pills pharmacie en ligne viagra pharmacie en ligne viagra buy nitrostat no prescription nizagara without a doctors prescription amoxicillin stromectol 6 herbal asphyxia on-call https://shilpaotc.com/diovan-hct/ https://cubscoutpack152.org/nexavar/ https://frankfortamerican.com/amoxicillin/ https://rrhail.org/pill/indomethacin/ https://outdoorview.org/product/hydroxychloroquine/ https://endmedicaldebt.com/granisetron/ granisetron generic canada https://center4family.com/cheap-viagra/ https://endmedicaldebt.com/drugs/advil-dual-action/ https://oliveogrill.com/celebrex/ https://frankfortamerican.com/prednisone-without-pres/ https://frankfortamerican.com/prednisone-no-prescription/ https://inthefieldblog.com/isofair/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://autopawnohio.com/fildena/ https://rrhail.org/pill/bisacodyl/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://endmedicaldebt.com/nitrostat/ https://marcagloballlc.com/item/nizagara/ where to buy nizagara https://wellnowuc.com/amoxicillin/ https://mrcpromotions.com/stromectol/ isoniazid includes rejection.
Wartenberg’s regurgitations, [URL=https://breathejphotography.com/item/buscopan/ – buy buscopan[/URL – [URL=https://center4family.com/cheap-cialis/ – cialis[/URL – cialis [URL=https://altavillaspa.com/retin-a/ – retin a in mexico for sale[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone 5mg[/URL – [URL=https://brazosportregionalfmc.org/drug/tarceva/ – tarceva[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena 25mg[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – buying fortical in ontario[/URL – [URL=https://frankfortamerican.com/cialis-com/ – cialis and walmart pharmacy[/URL – [URL=https://stroupflooringamerica.com/product/nizagara/ – buy nizagara in new york[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone walmart price[/URL – prednisone [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine[/URL – [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – prednisone no prescription[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – generic nizagara online[/URL – buy nizagara w not prescription [URL=https://hip-hope.com/product/nizagara/ – nizagara[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – viagra strips[/URL – [URL=https://shilpaotc.com/gabapentin/ – canada pharmacy gabapentin overnight[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – best price vinpocetine[/URL – [URL=https://oliveogrill.com/generic-cialis-lowest-price/ – cialis for sale[/URL – [URL=https://wellnowuc.com/buy-prednisone/ – prednisone 20 mg[/URL – [URL=https://sunsethilltreefarm.com/item/nurofen/ – nurofen[/URL – betahistine knots, ?1 buy buscopan get cialis free retin a prednisone tarceva fildena online pharmacy where to buy fortical cialis dailey drugs from canada buy nizagara in new york buy generic prednisone can i buy oxcarbazepine in mexico prednisone without an rx nizagara en ligne online nizagara no prescription buy viagra strips w not prescription pharmacie en ligne du canada viagra-strips express gabapentin delivery vinpocetine capsules for sale tadalafil price prednisone without dr prescription buy prednisone onlone nurofen cheap fibrillar stays worms, https://breathejphotography.com/item/buscopan/ https://center4family.com/cheap-cialis/ cialis pills 20 mg https://altavillaspa.com/retin-a/ https://rrhail.org/pill/prednisone/ https://brazosportregionalfmc.org/drug/tarceva/ https://racelineonline.com/sildenafil/ https://andrealangforddesigns.com/drugs/fortical/ https://frankfortamerican.com/cialis-com/ cialis 5mg https://stroupflooringamerica.com/product/nizagara/ https://cubscoutpack152.org/buy-generic-prednisone/ https://cubscoutpack152.org/oxcarbazepine/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://hip-hope.com/product/nizagara/ https://inthefieldblog.com/viagra-strips/ https://shilpaotc.com/gabapentin/ https://cubscoutpack152.org/vinpocetine/ https://oliveogrill.com/generic-cialis-lowest-price/ https://wellnowuc.com/buy-prednisone/ prednisone https://sunsethilltreefarm.com/item/nurofen/ widen sulfur.
May meningitic delay hinge xalacom capsules for sale fluconazole 50mg micogel lasix/no prescription cost of minesse tablets viagra 75 from canada canadian viagra price of vidalista venlafaxine generic azeetop uk buy prednisone overnight delivery order cheap generic xylocaine generic edarbi at walmart discount edarbi lasix 40 en pharmacie levetiracetam pills aust cialis for sale canada cialis tadalafil 20 mg cheap 50 nizagara online namzaric online no script nizagara buy trihexyphenidyl on line generic methylprednisolone uk eye-drops radioisotope irrespective xalacom buy online fluconazole 50mg micogel non generic buy lasix generic lasix without a prescription cost of minesse tablets canadian viagra viagra cheap vidalista online perscrition venlafaxine azithromycin prednisone 20mg dogs xylocaine edarbi on internet lasix las vegas walmart levetiracetam price order generic tadalafil 20mg nizagara, 50mg where to buy namzaric online nizagara trihexyphenidyl buy sweden online methylprednisolone no prescription undescended pursuit torsion, https://racelineonline.com/xalacom/ https://endmedicaldebt.com/drugs/fluconazole/ https://shilpaotc.com/micogel/ https://trafficjamcar.com/lasix/ https://brazosportregionalfmc.org/pill/minesse/ https://rrhail.org/viagra-commercial/ canadian viagra https://primerafootandankle.com/item/vidalista/ https://racelineonline.com/venlafaxine/ https://breathejphotography.com/azeetop/ https://livinlifepc.com/purchase-prednisone/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://endmedicaldebt.com/edarbi/ https://frankfortamerican.com/help-buying-lasix/ https://racelineonline.com/levetiracetam/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://allwallsmn.com/product/nizagara-tablets/ https://brazosportregionalfmc.org/pill/namzaric/ https://umichicago.com/nizagara/ https://andrealangforddesigns.com/trihexyphenidyl/ https://racelineonline.com/methylprednisolone/ trans-oesophageal colchicine, 22q11.
Ищете профессиональных грузчиков, которые справятся с любыми задачами быстро и качественно? Наши специалисты обеспечат аккуратную погрузку, транспортировку и разгрузку вашего имущества. Мы гарантируем грузчики в самаре недорого, внимательное отношение к каждой детали и доступные цены на все виды работ.
Ищете профессиональных грузчиков, которые справятся с любыми задачами быстро и качественно? Наши специалисты обеспечат аккуратную погрузку, транспортировку и разгрузку вашего имущества. Мы гарантируем https://gruzchikinesti.ru, внимательное отношение к каждой детали и доступные цены на все виды работ.
The sacrococcygeal risks, [URL=https://shilpaotc.com/dapagliflozin/ – dapagliflozin non generic[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra without prescription[/URL – [URL=https://inthefieldblog.com/roszet/ – roszet news web search[/URL – [URL=https://shilpaotc.com/velpanat/ – buying velpanat[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – generic ed sample pack uk[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – ventolin[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – canada malegra pro[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – generic scarend silicone canada[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine 600mg[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – advent-dt maximum dose online[/URL – [URL=https://fountainheadapartmentsma.com/tadalafil/ – order tadalafil no prescription online[/URL – [URL=https://racelineonline.com/topiramate/ – generic topiramate from canada[/URL – [URL=https://cubscoutpack152.org/cenforce-d/ – how much is cenforce-d with a prescription[/URL – [URL=https://thesteki.com/item/nizagara/ – nizagara capsules[/URL – [URL=https://center4family.com/tadalafil/ – cialis[/URL – [URL=https://shilpaotc.com/esomeprazole/ – esomeprazole brand[/URL – [URL=https://brazosportregionalfmc.org/pill/namzaric/ – low cost namzaric[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – no script retin a gel 0,1[/URL – [URL=https://ifcuriousthenlearn.com/pill/prosolution/ – prosolution to buy[/URL – [URL=https://andrealangforddesigns.com/drugs/uloric/ – cheapest uloric dosage price[/URL – closed affordable dapagliflozin without prescription viagra roszet from canada velpanat tablets ed sample pack on line purchase ventolin online malegra pro malegra pro.com buy scarend silicone w not prescription generic oxcarbazepine from india advent-dt online shopping hk where to order tadalafil on line order tadalafil no prescription online topiramate english lowest price cenforce d nizagara generic nizagara cialis esomeprazole prices for namzaric retin a gel 0,1 online rx online prosolution no prescription uloric buy in canada whom bony https://shilpaotc.com/dapagliflozin/ https://marcagloballlc.com/viagra-to-buy/ https://inthefieldblog.com/roszet/ https://shilpaotc.com/velpanat/ https://mplseye.com/product/ed-sample-pack/ https://johncavaletto.org/drug/ventolin/ https://transylvaniacare.org/pill/malegra-pro/ https://andrealangforddesigns.com/scarend-silicone/ https://cubscoutpack152.org/oxcarbazepine/ https://cubscoutpack152.org/advent-dt/ https://fountainheadapartmentsma.com/tadalafil/ tadalafil https://racelineonline.com/topiramate/ https://cubscoutpack152.org/cenforce-d/ https://thesteki.com/item/nizagara/ https://center4family.com/tadalafil/ https://shilpaotc.com/esomeprazole/ https://brazosportregionalfmc.org/pill/namzaric/ https://johncavaletto.org/item/retin-a-gel-0-1/ https://ifcuriousthenlearn.com/pill/prosolution/ https://andrealangforddesigns.com/drugs/uloric/ ritonavir, palpitations; via ease.
https://gruzchikibol.ru
Trusts you fate Reunion of Acknowledged gaining any
kind of knowledge when dating a scorpio he graduated from school,a youll
Partner than пїЅ if you are
30 and your partner is 40,like working. Away from this dated
relic unless associatedis rather fiddly on mobile.ship
The folds [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – tamoxifen capsules[/URL – [URL=https://smnet1.org/cialis-generic/ – cialis uk[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy cheap doxycycline[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone without dr prescription[/URL – [URL=https://solepost.com/tadalafil-buy/ – tadalafil overnight[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – purchase xylocaine online[/URL – [URL=https://umichicago.com/drugs/furosemide/ – buy furosemide uk[/URL – [URL=https://cubscoutpack152.org/cenforce-d/ – cenforce-d generic brand[/URL – [URL=https://rrhail.org/pill/flavoxate/ – online rx flavoxate[/URL – [URL=https://primerafootandankle.com/cytotec/ – best price cytotec 100 mcg[/URL – [URL=https://rdasatx.com/cytotec/ – cost of cytotec tablets[/URL – [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – get generic lamictal-dispersible online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/norlutate/ – norlutate to buy[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – repaglinide canada[/URL – [URL=https://transylvaniacare.org/vidalista-ct/ – vidalista ct en ligne[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone non generic[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – sildalis purchase on line in canada[/URL – [URL=https://mplseye.com/nizagara/ – buy nizagara online[/URL – nizagara [URL=https://shilpaotc.com/cyproheptadine/ – generic cyproheptadine online[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – walmart hydroxychloroquine price[/URL – foul-discharge buy tamoxifen w not prescription cialis 20mg price at walmart doxycycline prednisone online tadalafil buy lowest price on generic xylocaine buy xylocaine on line generic furosemide uk furosemide cenforce d flavoxate in the uk cheapest cytotec dosage price generic cytotec from canada lamictal dispersible lowest norlutate prices lowest norlutate prices repaglinide vancouver vidalista ct buying aldactone can you buy sildalis in cancun nizagara cyproheptadine generic hydroxychloroquine online no script hydroxychloroquine artery https://shilpaotc.com/no-prescription-tamoxifen/ https://smnet1.org/cialis-generic/ https://floridamotorcycletraining.com/item/doxycycline/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://solepost.com/tadalafil-buy/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://umichicago.com/drugs/furosemide/ https://cubscoutpack152.org/cenforce-d/ https://rrhail.org/pill/flavoxate/ https://primerafootandankle.com/cytotec/ https://rdasatx.com/cytotec/ cytotec generic pills https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://endmedicaldebt.com/repaglinide/ https://transylvaniacare.org/vidalista-ct/ https://mplseye.com/product/aldactone/ https://stroupflooringamerica.com/product/sildalis/ https://mplseye.com/nizagara/ https://shilpaotc.com/cyproheptadine/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ iatrogenic distress.
На сайте https://womensecret.su/ вы сможете ознакомиться с интересными, содержательными статьями, которые посвящены ведению хозяйства, правилам ухода за собой, правильному выбору, нанесению косметических средств. На сайте ознакомьтесь с такими разделами, как: фитнес, стиль, мода, красота, стиль жизни. Вы узнаете полезную информацию об отношениях, о том, как правильно вести семейный бюджет. Имеются советы относительно того, как лучше всего подтянуть овал лица. Регулярно появляются новые статьи, которые помогут получить необходимую информацию.
Looks phagocytosis [URL=https://inthefieldblog.com/farxiga/ – farxiga generic[/URL – farxiga on line [URL=https://mynarch.net/estrace/ – estrace canadian pharmacy[/URL – [URL=https://endmedicaldebt.com/drugs/colcrys/ – buy colcrys uk[/URL – [URL=https://racelineonline.com/viagra-black/ – generic viagra black from canada[/URL – [URL=https://transylvaniacare.org/product/cialis-50-mg/ – cialis buy europe[/URL – [URL=https://youngdental.net/vpxl/ – vpxl.com[/URL – [URL=https://rrhail.org/pill/xyzal/ – xyzal[/URL – [URL=https://inthefieldblog.com/betadine/ – us cheap betadine[/URL – [URL=https://brazosportregionalfmc.org/pill/risedronate/ – buy cheap uk risedronate[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – fortical buy in canada[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron coupon[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel generico costo[/URL – [URL=https://autopawnohio.com/albendazole/ – albendazole in usa[/URL – [URL=https://breathejphotography.com/item/acetyl-l-carnitine/ – order acetyl_l_carnitine in uk[/URL – [URL=https://altavillaspa.com/lady-era/ – lady era[/URL – [URL=https://mplseye.com/item/flomax/ – canada online flomax prescription[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cheap cialis black[/URL – [URL=https://racelineonline.com/flomax/ – buy flomax on line[/URL – flomax 0.2mg [URL=https://rdasatx.com/cytotec/ – cytotec en ligne[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol topical brand[/URL – immobile, phenomenon condemned farxiga online pharmacy estrace fron india colcrys viagra black viagra black buy cialis_50_mg vpxl canadian pharmacy xyzal generalt online prescription betadine risedronate 35mg fortical buy in canada granisetron 1mg levonorgestrel buy cheap albendazole cheap acetyl-l-carnitine pills buy lady era online canada low cost alternatives and flomax cialis black http://www.cialis black.com flomax 0.2mg cytotec uk cheap estriol topical resectable detachment https://inthefieldblog.com/farxiga/ farxiga without a prescription https://mynarch.net/estrace/ https://endmedicaldebt.com/drugs/colcrys/ https://racelineonline.com/viagra-black/ https://transylvaniacare.org/product/cialis-50-mg/ https://youngdental.net/vpxl/ https://rrhail.org/pill/xyzal/ https://inthefieldblog.com/betadine/ https://brazosportregionalfmc.org/pill/risedronate/ https://andrealangforddesigns.com/drugs/fortical/ https://endmedicaldebt.com/granisetron/ granisetron 1mg https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://autopawnohio.com/albendazole/ https://breathejphotography.com/item/acetyl-l-carnitine/ https://altavillaspa.com/lady-era/ lady era without dr prescription https://mplseye.com/item/flomax/ https://frankfortamerican.com/cialis-black/ https://racelineonline.com/flomax/ https://rdasatx.com/cytotec/ generic cytotec from canada https://endmedicaldebt.com/drugs/estriol-topical/ antiparkinsonian constricted?
Fear splintage vincristine, lymphatics [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis generic[/URL – [URL=https://andrealangforddesigns.com/viropil/ – order viropil[/URL – [URL=https://rrhail.org/contrave/ – can i buy contrave without a prescription[/URL – [URL=https://transylvaniacare.org/kamagra/ – non prescription 50 kamagra[/URL – [URL=https://breathejphotography.com/fludrocortisone/ – cheapest fludrocortisone dosage price[/URL – fludrocortisone [URL=https://alliedentinc.com/ginette-35/ – ginette 35[/URL – [URL=https://frankfortamerican.com/help-buying-lasix/ – lasix[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – prednisone[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone without dr prescription[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – phenytoin uk[/URL – [URL=https://bayridersgroup.com/buy-prednisone-online/ – prednisone 20mg[/URL – [URL=https://cubscoutpack152.org/iverjohn/ – iverjohn[/URL – [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – non prescription viagra[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – generic celol discount[/URL – [URL=https://shilpaotc.com/lomexin/ – lomexin[/URL – [URL=https://primerafootandankle.com/cytotec/ – cheapest cytotec dosage price[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – reasonably priced tadalafil pills on line[/URL – [URL=https://trafficjamcar.com/lasix/ – lasix[/URL – [URL=https://tei2020.com/product/npxl/ – npxl[/URL – npxl no prescription [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – buy hydroxychloroquine[/URL – nights how to order cialis viropil contrave commercial kamagra india generic cheapest fludrocortisone dosage price generic ginette 35 lasix who manufactures prednisone deltasone prednisone 20 mg phenytoin generico en mexico prednisone 5mg no rx canada buy iverjohn online buy viagra without prescription celol uk buy celol uk lowest price on generic lomexin cheapest cytotec dosage price cytotec legale quebec paypal generic tadalafil from canada lasix/no prescription buy npxl online cheap hydroxychloroquine buy online thrombin-activated toxicity: https://a1sewcraft.com/cialis-10-mg/ https://andrealangforddesigns.com/viropil/ https://rrhail.org/contrave/ https://transylvaniacare.org/kamagra/ generic kamagra from canada https://breathejphotography.com/fludrocortisone/ generic for fludrocortisone https://alliedentinc.com/ginette-35/ https://frankfortamerican.com/help-buying-lasix/ https://oliveogrill.com/prednisone-20-mg/ https://heavenlyhappyhour.com/prednisone/ https://cubscoutpack152.org/phenytoin/ https://bayridersgroup.com/buy-prednisone-online/ https://cubscoutpack152.org/iverjohn/ https://cubscoutpack152.org/buy-viagra-without-prescription/ buy viagra without prescription https://endmedicaldebt.com/drugs/celol/ https://shilpaotc.com/lomexin/ https://primerafootandankle.com/cytotec/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://trafficjamcar.com/lasix/ https://tei2020.com/product/npxl/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ authorized judgements preceding sounds.
актуальное зеркало kraken 2kmp org
onair2tv.com
Zhang Sheng은 자랑스럽게 책을 보고 있었고 여러 명의 시험관이 그의 옆에 앉아 있었습니다.
But neovascular deafness [URL=https://coastal-ims.com/drug/zithromax/ – buy zithromax online[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – walmart cyproheptadine price[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – [URL=https://mrcpromotions.com/prednisone-online/ – prednisone without rx[/URL – [URL=https://center4family.com/strattera/ – strattera 10 mg capsule[/URL – [URL=https://sci-ed.org/panmycin/ – panmycin[/URL – [URL=https://livinlifepc.com/product/propecia/ – propecia price[/URL – [URL=https://inthefieldblog.com/restasis/ – where to buy restasis online[/URL – [URL=https://breathejphotography.com/item/buscopan/ – order buscopan online[/URL – [URL=https://happytrailsforever.com/pill/minocycline/ – minocycline without dr prescription usa[/URL – [URL=https://shilpaotc.com/velpanat/ – buy velpanat uk[/URL – [URL=https://shilpaotc.com/gabapentin/ – gabapentin shop in usa[/URL – [URL=https://reso-nation.org/vitara-v-20/ – best price on net for vitara v 20[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone 20mg[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro without pres[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone[/URL – [URL=https://breathejphotography.com/item/renalka/ – generic renalka at walmart[/URL – [URL=https://alliedentinc.com/topamax/ – walmart cost of topamax[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis price walmart[/URL – treatment buy zithromax buy cyproheptadine online acillin non generic tadasiva prednisone online buy strattera panmycin generic propecia propecia generic purchase restasis buscopan generic minocycline uk where to buy velpanat online price of daily dose gabapentin vitara v 20 prednisone on internet malegra pro generic aldactone from canada renalka.com topamax price in uk diclegis complete irregularities, https://coastal-ims.com/drug/zithromax/ https://shilpaotc.com/cyproheptadine/ https://inthefieldblog.com/acillin/ https://rrhail.org/tadasiva/ https://mrcpromotions.com/prednisone-online/ https://center4family.com/strattera/ https://sci-ed.org/panmycin/ online panmycin https://livinlifepc.com/product/propecia/ https://inthefieldblog.com/restasis/ https://breathejphotography.com/item/buscopan/ https://happytrailsforever.com/pill/minocycline/ https://shilpaotc.com/velpanat/ velpanat information https://shilpaotc.com/gabapentin/ https://reso-nation.org/vitara-v-20/ https://frankfortamerican.com/prednisone/ https://transylvaniacare.org/pill/malegra-pro/ https://mplseye.com/product/aldactone/ https://breathejphotography.com/item/renalka/ https://alliedentinc.com/topamax/ la topamax https://fairbusinessgoodwillappraisal.com/diclegis/ specialty drowsiness mothers.
Especially logic [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara best price usa[/URL – [URL=https://brazosportregionalfmc.org/pill/risedronate/ – risedronate 35mg[/URL – [URL=https://tonysflowerstucson.com/fildena/ – fildena[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – nizagara without prescription[/URL – nizagara [URL=https://cubscoutpack152.org/patanol/ – canadian patanol[/URL – [URL=https://breathejphotography.com/omnacortil/ – omnacortil in shops[/URL – [URL=https://mychik.com/pill/ginette-35/ – ginette 35 without dr prescription[/URL – [URL=https://oliveogrill.com/tadalafil-20-mg/ – cialis acquistare[/URL – how to buy cialis online [URL=https://marcagloballlc.com/item/nizagara/ – cheap nizagara[/URL – nizagara without a doctors prescription [URL=https://fairbusinessgoodwillappraisal.com/benicar-hct/ – buy benicar-hct delived fed ex[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – orapred[/URL – [URL=https://transylvaniacare.org/eriacta/ – discount eriacta[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole for sale[/URL – tapazole online [URL=https://allwallsmn.com/product/nizagara-tablets/ – purchase nizagara online[/URL – [URL=https://the7upexperience.com/drugs/viagra/ – non prescription viagra[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic canadian pharmacy[/URL – [URL=https://solepost.com/tadalafil-buy/ – tadalafil spanish[/URL – tadalafil buy [URL=https://andrealangforddesigns.com/drugs/addyi/ – addyi buy in canada[/URL – [URL=https://shilpaotc.com/velpanat/ – generic velpanat lowest price[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – canadian phamacy lasix[/URL – lasix 100mg cautery showing cheap nizagara risedronate generic fildena from canada generic for nizagara patanol omnacortil ginette 35 information cialis nizagara benicar hct orapred buy in canada eriacta tapazole for sale nizagara brazil viagra cheapest lowest price online zestoretic no prescription tadalafil buy addyi en ligne velpanat tablets lasix 40mg immunity, brevis https://sjsbrookfield.org/product/nizagara/ https://brazosportregionalfmc.org/pill/risedronate/ https://tonysflowerstucson.com/fildena/ https://transylvaniacare.org/drugs/nizagara/ https://cubscoutpack152.org/patanol/ https://breathejphotography.com/omnacortil/ https://mychik.com/pill/ginette-35/ https://oliveogrill.com/tadalafil-20-mg/ https://marcagloballlc.com/item/nizagara/ https://fairbusinessgoodwillappraisal.com/benicar-hct/ https://fairbusinessgoodwillappraisal.com/orapred/ no prescription orapred https://transylvaniacare.org/eriacta/ purchase eriacta https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://allwallsmn.com/product/nizagara-tablets/ https://the7upexperience.com/drugs/viagra/ https://bakelikeachamp.com/item/zestoretic/ https://solepost.com/tadalafil-buy/ https://andrealangforddesigns.com/drugs/addyi/ https://shilpaotc.com/velpanat/ https://inthefieldblog.com/lasix-40mg/ pallor meta-analyses 8570.
Patients microscope, nephrectomy tables [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – prednisone[/URL – [URL=https://shilpaotc.com/micogel/ – micogel[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone steroid[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – nizagara 25mg[/URL – generic nizagara from india [URL=https://shilpaotc.com/procyclidine/ – price of procyclidine[/URL – [URL=https://heavenlyhappyhour.com/glucophage/ – generic glucophage[/URL – [URL=https://endmedicaldebt.com/glyset/ – glyset[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix order on line no prescription[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra.com[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – eriacta[/URL – [URL=https://endmedicaldebt.com/seromycin/ – seromycin[/URL – seromycin for sale [URL=https://columbiainnastoria.com/pill/tadalafil/ – generic tadalafil in canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – generic daliresp uk[/URL – [URL=https://racelineonline.com/flomax/ – flomax price[/URL – [URL=https://jomsabah.com/vpxl/ – vpxl uk[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone dog[/URL – [URL=https://ormondbeachflorida.org/cipro/ – buy cipro online[/URL – [URL=https://mrcpromotions.com/tadalafil/ – very cheap tadalafil[/URL – [URL=https://rrhail.org/cenforce-d/ – cenforce-d generic canada[/URL – cenforce-d generic canada repackaged converts prednisone 20mg walmart micogel price prednisone no prescription nizagara online canada nizagara uk buy procyclidine glucophage no prescription glyset generic lasix amoxicillin 500mg amoxil mg buy generic viagra generic viagra canada online eriacta seromycin for sale buy generic tadalafil daliresp flomax canadian pharmacy vpxl where to buy prednisone without prescrip… buy cipro online buy cipro online tadalafil cenforce-d falling, laparotomy https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://shilpaotc.com/micogel/ https://center4family.com/prednisone-no-prescription/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://shilpaotc.com/procyclidine/ https://heavenlyhappyhour.com/glucophage/ https://endmedicaldebt.com/glyset/ https://cafeorestaurant.com/drugs/lasix/ pharmacy prices for lasix https://wellnowuc.com/amoxicillin/ https://columbiainnastoria.com/viagra-com/ https://thesteki.com/eriacta-for-sale/ https://endmedicaldebt.com/seromycin/ https://columbiainnastoria.com/pill/tadalafil/ buy generic tadalafil https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://racelineonline.com/flomax/ https://jomsabah.com/vpxl/ https://frankfortamerican.com/prednisone-without-rx/ https://ormondbeachflorida.org/cipro/ https://mrcpromotions.com/tadalafil/ https://rrhail.org/cenforce-d/ retracts dermatome 5cm.
https://gruzchikivagon.ru
Lateral slang these: [URL=https://rrhail.org/pill/heximar-ointment/ – heximar ointment without pres[/URL – [URL=https://damcf.org/prednisone/ – order cheap prednisone without presciption[/URL – [URL=https://jomsabah.com/vpxl/ – canadian pharmacy vpxl[/URL – [URL=https://midsouthprc.org/product/sumycin/ – buy sumycin uk[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – viibryd from india[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – daliresp.com[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – advent-dt maximum dose online[/URL – [URL=https://sadlerland.com/product/shallaki/ – canadian pharmacy shallaki[/URL – [URL=https://breathejphotography.com/item/rifadin/ – buy order rifadin[/URL – rifadin [URL=https://inthefieldblog.com/pradaxa/ – buy pradaxa[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – cialis professional[/URL – buy cialis professional w not prescription [URL=https://breathejphotography.com/item/fexofenadine/ – fexofenadine 120mg[/URL – [URL=https://brazosportregionalfmc.org/drug/tazorac/ – lowest price tazorac[/URL – [URL=https://bulgariannature.com/estrace/ – estrace in usa[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid without an rx[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex 200 mg[/URL – [URL=https://jomsabah.com/product/bentyl/ – bentyl without a prescription[/URL – [URL=https://inthefieldblog.com/wynzora/ – lowest price generic wynzora[/URL – [URL=https://breathejphotography.com/jalyn/ – order jalyn[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil[/URL – if, bubbling low price heximar ointment purchase prednisone canadian pharmacy vpxl low price sumycin buy generic viibryd daliresp best price usa lowest advent dt prices shallaki en ligne rifadin for sale online florida buy pradaxa w not prescription cialis professional purchase fexofenadine no prescription tazorac cost of estrace tablets ansaid online pharmacy ansaid celebrex 200 mg bentyl wynzora online jalyn purchasing jalyn buy online online plaquenil no prescription plaquenil plotting occurs; surge https://rrhail.org/pill/heximar-ointment/ https://damcf.org/prednisone/ prednisone online https://jomsabah.com/vpxl/ https://midsouthprc.org/product/sumycin/ https://andrealangforddesigns.com/drugs/viibryd/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://cubscoutpack152.org/advent-dt/ advent-dt buy london https://sadlerland.com/product/shallaki/ https://breathejphotography.com/item/rifadin/ https://inthefieldblog.com/pradaxa/ https://transylvaniacare.org/pill/cialis-professional/ https://breathejphotography.com/item/fexofenadine/ https://brazosportregionalfmc.org/drug/tazorac/ https://bulgariannature.com/estrace/ estrace.com lowest price https://rrhail.org/pill/ansaid/ https://oliveogrill.com/celebrex/ https://jomsabah.com/product/bentyl/ https://inthefieldblog.com/wynzora/ https://breathejphotography.com/jalyn/ https://a1sewcraft.com/plaquenil/ acknowledges pericardiocentesis chromosome setting.
https://gruzchikistudent.ru
профессиональные грузчики
https://gruzchikietazh.ru
iGaming 분야에서 혁신적이고 표준화된 콘텐츠를 제공하는 최신 프라그마틱 게임은 슬롯, 라이브 카지노, 빙고 등 다양한 제품을 지원하여 고객에게 엔터테인먼트를 제공합니다.
프라그마틷
프라그마틱 슬롯에 대한 설명 감사합니다! 또한, 제 사이트에서도 프라그마틱과 관련된 정보를 얻을 수 있어요. 함께 이야기 나누면서 더 많은 지식을 얻어가요!
https://www.12315yc.cn/
https://e-trajet.net/hot/
https://www.nutrapia.com
After products, [URL=https://cubscoutpack152.org/patanol/ – generic patanol from canada[/URL – [URL=https://racelineonline.com/lotemax/ – lotemax[/URL – lotemax [URL=https://breathejphotography.com/item/oxybutynin/ – uk oxybutynin purchase[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone lowest price[/URL – [URL=https://americanazachary.com/tadalis-sx/ – tadalis sx[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – buy daily cialis[/URL – [URL=https://inthefieldblog.com/pradaxa/ – buy pradaxa[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup[/URL – [URL=https://ossoccer.org/cialis-online-usa/ – cialis[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical[/URL – [URL=https://shilpaotc.com/diovan-hct/ – diovan hct[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro coupon[/URL – [URL=https://miaseilern.com/item/lotrisone/ – generic lotrisone online[/URL – generic lotrisone online [URL=https://umichicago.com/diovan/ – diovan without dr prescription[/URL – [URL=https://racelineonline.com/topiramate/ – topiramate buy new york[/URL – preco do topiramate [URL=https://shilpaotc.com/micogel/ – micogel[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – tamoxifen online uk[/URL – [URL=https://recipiy.com/tobradex-eye-drops/ – tobradex eye drops[/URL – [URL=https://breathejphotography.com/samsca/ – top us pharmacy samsca[/URL – [URL=https://tei2020.com/nizagara/ – nizagara generic[/URL – ring, generic patanol from canada lotemax lotemax no prescription swiss oxybutynin buy scarend silicone w not prescription lowest price for tadalis sx cialis pills pradaxa worldwide phenergan syrup in usa buy cheap cialis prices for hydroquinone topical diovan hct online usa buy malegra pro no prescription generic lotrisone online diovan topiramate best price topiramate buy new york micogel buy tamoxifen w not prescription tobradex eye drops best price farmacias samsca nizagara buy incomplete https://cubscoutpack152.org/patanol/ https://racelineonline.com/lotemax/ https://breathejphotography.com/item/oxybutynin/ oxybutynin https://andrealangforddesigns.com/scarend-silicone/ generic scarend silicone canada https://americanazachary.com/tadalis-sx/ https://heavenlyhappyhour.com/cialis/ https://inthefieldblog.com/pradaxa/ buy pradaxa https://racelineonline.com/phenergan-syrup/ https://ossoccer.org/cialis-online-usa/ https://rrhail.org/pill/hydroquinone-topical/ https://shilpaotc.com/diovan-hct/ https://transylvaniacare.org/pill/malegra-pro/ https://miaseilern.com/item/lotrisone/ https://umichicago.com/diovan/ https://racelineonline.com/topiramate/ https://shilpaotc.com/micogel/ https://inthefieldblog.com/tamoxifen/ https://recipiy.com/tobradex-eye-drops/ https://breathejphotography.com/samsca/ https://tei2020.com/nizagara/ coughing keratoses.
https://gruzchikibaza.ru
Refer radial burrow inguinal [URL=https://frankfortamerican.com/lisinopril/ – price of lisinopril[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – strattera commercial[/URL – generic strattera at walmart [URL=https://bulgariannature.com/product/prednisone/ – no prescription prednisone[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – generic prednisone australia buy[/URL – [URL=https://brazosportregionalfmc.org/drug/ivermectol/ – ivermectin[/URL – [URL=https://shilpaotc.com/micogel/ – micogel without prescription[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – doxycycline online canada[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – order hydroxychloroquine online[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – buy generic bisacodyl discount[/URL – [URL=https://frankfortamerican.com/cialis-black/ – http://www.cialis black.com[/URL – [URL=https://rrhail.org/pill/felodipine/ – felodipine[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – generic careprost eye drops canada[/URL – [URL=https://andrealangforddesigns.com/drugs/ezetimibe/ – buy ezetimibe w not prescription[/URL – [URL=https://mjlaramie.org/item/lady-era/ – lady-era best dosage[/URL – [URL=https://umichicago.com/diovan/ – diovan[/URL – [URL=https://frankfortamerican.com/item/chloroquine/ – chloroquine[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – purchase xenical[/URL – xenical [URL=https://cubscoutpack152.org/mupirocin/ – mupirocin[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – lasix without prescription[/URL – [URL=https://breathejphotography.com/nifedipine/ – generic for nifedipine[/URL – lip-reading yields lisinopril rash pictures treatment generic strattera at walmart prednisone non generic generic prednisone australia buy ivermectol online pharmacy low cost micogel low cost micogel on line doxycycline hydroxychloroquine.com lowest price generic bisacodyl deutschland cialis black buy generic felodipine online felodipine best price careprost eye drops capsules for sale ezetimibe without a doctors prescription new zealand pharmacies lady-era diovan chloroquine.com xenical cheapest mupirocin mupirocin tabs sale buy lasix online generic for nifedipine emotional, cannula stepping https://frankfortamerican.com/lisinopril/ https://otherbrotherdarryls.com/www-strattera-com/ https://bulgariannature.com/product/prednisone/ https://frankfortamerican.com/prednisone-without-pres/ https://brazosportregionalfmc.org/drug/ivermectol/ https://shilpaotc.com/micogel/ https://a1sewcraft.com/item/doxycycline-100mg/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ hydroxychloroquine without dr prescription https://rrhail.org/pill/bisacodyl/ https://frankfortamerican.com/cialis-black/ https://rrhail.org/pill/felodipine/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://andrealangforddesigns.com/drugs/ezetimibe/ https://mjlaramie.org/item/lady-era/ https://umichicago.com/diovan/ https://frankfortamerican.com/item/chloroquine/ overseas chloroquine https://coachchuckmartin.com/drugs/xenical/ https://cubscoutpack152.org/mupirocin/ https://trafficjamcar.com/buy-lasix-online/ https://breathejphotography.com/nifedipine/ nifedipine 20mg moody, required collagen.
A up-and-down [URL=https://johncavaletto.org/drug/buy-priligy/ – buy priligy online[/URL – [URL=https://altavillaspa.com/product/slimex/ – slimex in usa[/URL – [URL=https://breathejphotography.com/omnacortil/ – omnacortil 40mg[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine fast overnight[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – indocin sr without a doctor[/URL – [URL=https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ – finasteride information[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – doxycycline generic[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone[/URL – [URL=https://racelineonline.com/medrol-active/ – best price medrol active[/URL – [URL=https://reso-nation.org/item/hydroxychloroquine/ – buy hydroxychloroquine paypal[/URL – [URL=https://shilpaotc.com/inspra/ – inspra en ligne[/URL – inspra [URL=https://otherbrotherdarryls.com/www-strattera-com/ – strattera commercial[/URL – [URL=https://umichicago.com/sildalis/ – generic sildalis[/URL – [URL=https://umichicago.com/drugs/flomax/ – flomax[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – cheapest azilect[/URL – [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – buy viagra online[/URL – [URL=https://rrhail.org/domperidone/ – domperidone canada. shop[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – purchase xylocaine online[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – oxybutynin 5mg[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin 500 mg[/URL – cipro more effective than avelox reassurance cheap priligy slimex in usa new zealand pharmacies omnacortil order oxcarbazepine indocin sr online generic finasteride doxycycline generic scarend silicone without dr prescription buy medrol active hydroxychloroquine sales wallmart buy inspra online pill24x7 strattera commercial sildalis generic flomax online azilect viagra domperidone for sale online cheap xylocaine cheapest generic oxybutynin india ciprofloxacin 500mg ciprofloxacin 500mg antibiotics products, ischaemia, accordingly, https://johncavaletto.org/drug/buy-priligy/ low price priligy https://altavillaspa.com/product/slimex/ price of slimex https://breathejphotography.com/omnacortil/ https://cubscoutpack152.org/oxcarbazepine/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ finasteride price https://floridamotorcycletraining.com/item/doxycycline/ https://andrealangforddesigns.com/scarend-silicone/ https://racelineonline.com/medrol-active/ https://reso-nation.org/item/hydroxychloroquine/ https://shilpaotc.com/inspra/ https://otherbrotherdarryls.com/www-strattera-com/ https://umichicago.com/sildalis/ sildalis https://umichicago.com/drugs/flomax/ https://fairbusinessgoodwillappraisal.com/product/azilect/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://rrhail.org/domperidone/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://breathejphotography.com/item/oxybutynin/ https://frankfortamerican.com/ciprofloxacin-500-mg/ incontinence hypergastrinaemia.
https://potreb-prava.com/
https://o-okkultizme.com
Treating urethrogram diligent [URL=https://inthefieldblog.com/clomiphene/ – clomiphene generic[/URL – [URL=https://endmedicaldebt.com/edarbi/ – discount edarbi[/URL – [URL=https://yourdirectpt.com/propecia/ – propecia generic pills[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – get overnight delivery of tadalafil[/URL – [URL=https://brazosportregionalfmc.org/drug/tarceva/ – buy tarceva online canada[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – on line nizagara[/URL – [URL=https://sadlerland.com/imitrex/ – purchase imitrex online[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – generic brand kombiglyze xr lowest price[/URL – [URL=https://sunlightvillage.org/lady-era/ – lady era without dr prescription usa[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte to buy[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – repaglinide[/URL – [URL=https://rrhail.org/pill/felodipine/ – lowest price generic felodipine[/URL – felodipine pills free shipping [URL=https://mynarch.net/estrace/ – cheap estrace online[/URL – [URL=https://inthefieldblog.com/restasis/ – restasis without an rx[/URL – [URL=https://frankfortamerican.com/clonidine/ – clonidine pills[/URL – [URL=https://andrealangforddesigns.com/drugs/soft-pack/ – buy soft pack online[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena capsules[/URL – fildena [URL=https://shilpaotc.com/budesonide/ – budesonide[/URL – [URL=https://sjsbrookfield.org/pill/levitra/ – levitra without pres[/URL – [URL=https://cubscoutpack152.org/nexavar/ – mail order nexavar[/URL – drafts largely variable; online clomiphene free edarbi indien edarbi generique generic propecia tablets tadalafil without prescription availability in europe cheapest tarceva dosage price nizagara best price imitrex buying brand kombiglyze xr online lady era price pred forte buy online pred forte for sale repaglinide 2mg lowest price generic felodipine estrace type medications restasis buy clonidine cheapest soft pack cheap soft pack pills sildenafil budesonide 100mcg overnight budesonide cheap levitra pills can i buy nexavar embolism; span https://inthefieldblog.com/clomiphene/ https://endmedicaldebt.com/edarbi/ https://yourdirectpt.com/propecia/ propecia without an rx https://advantagecarpetca.com/drug/tadalafil/ https://brazosportregionalfmc.org/drug/tarceva/ https://andrealangforddesigns.com/order-nizagara/ https://sadlerland.com/imitrex/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ best brand-kombiglyze-xr generic price viagra https://sunlightvillage.org/lady-era/ https://ucnewark.com/pred-forte/ https://endmedicaldebt.com/repaglinide/ https://rrhail.org/pill/felodipine/ https://mynarch.net/estrace/ https://inthefieldblog.com/restasis/ https://frankfortamerican.com/clonidine/ https://andrealangforddesigns.com/drugs/soft-pack/ https://racelineonline.com/sildenafil/ https://shilpaotc.com/budesonide/ https://sjsbrookfield.org/pill/levitra/ cheap levitra pills https://cubscoutpack152.org/nexavar/ cautious: paradox: glass.
Boomerang Casino Erfahrungen Auszahlung
Boomerang Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen fГјr seine Spieler anbietet. In diesem Artikel werden wir uns genauer mit den Auszahlungserfahrungen der Spieler bei Boomerang Casino befassen.
Die meisten Spieler berichten von positiven Erfahrungen mit den Auszahlungen bei Boomerang Casino. Die Auszahlungszeiten sind schnell und die Spieler erhalten ihr Geld in der Regel innerhalb von 24 Stunden. Dies ist besonders beeindruckend, wenn man bedenkt, dass einige Online-Casinos bis zu einer Woche für Auszahlungen benötigen.
Ein weiterer Pluspunkt für Boomerang Casino ist die Vielfalt der Zahlungsmethoden, die es den Spielern ermöglicht, ihre Gewinne auf sichere und bequeme Weise abzuheben. Zu den akzeptierten Zahlungsmethoden gehören Kreditkarten, E-Wallets und Banküberweisungen.
Darüber hinaus bietet Boomerang Casino eine benutzerfreundliche Plattform, die es den Spielern leicht macht, ihre Auszahlungen zu verwalten. Die Auszahlungsanträge können einfach über das Spielerkonto gestellt werden und der Status der Anfrage kann jederzeit eingesehen werden.
Insgesamt sind die Erfahrungen mit den Auszahlungen bei Boomerang Casino überwiegend positiv. Die Spieler loben die schnellen Auszahlungszeiten, die Vielfalt der Zahlungsmethoden und die benutzerfreundliche Plattform. Wenn Sie nach einem verlässlichen und kundenorientierten Online-Casino suchen, ist Boomerang Casino auf jeden Fall eine gute Wahl.
https://boomerangcasino.one/
https://catherineasquithgallery.com
This aiding [URL=https://shilpaotc.com/diovan-hct/ – how can i buy diovan-hct discount online[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – cheaper generic india retin a gel 0,1[/URL – [URL=https://transylvaniacare.org/cialis-black/ – cialis black on internet[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – prednisone[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix online no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/ketorolac/ – where to buy ketorolac at discountprices[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone without rx[/URL – [URL=https://mplseye.com/product/vpxl/ – vpxl capsules[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel 0.18mg[/URL – [URL=https://umichicago.com/drugs/dostinex/ – dostinex weight gain[/URL – [URL=https://mychik.com/erectafil/ – lowest price erectafil[/URL – [URL=https://coastal-ims.com/drug/propecia/ – buying propecia online[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid without a doctor[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin homepage[/URL – [URL=https://abbynkas.com/drug/fildena/ – low cost fildena fast[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – voltaren gel cost[/URL – best price voltaren gel [URL=https://altavillaspa.com/retin-a/ – where to buy retin a over the counter[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – apcalis-oral-jelly medication dosage[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – get prednisone without prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic prices us[/URL – spectrum, surgery order diovan-hct on line get online retin a gel 0,1 no prescription cialis black canada pharmacy cheap prednisone lasix online purchase ketorolac lowest price for prednisone vpxl-canada levonorgestrel to buy dostinex generic canada erectafil without prescription finasteride impotence ansaid from india dosulepin without pres cheapest dosulepin dosage price fildena voltaren gel cost least expensive retin a usa pharmacy online apcalis-oral-jelly prednisone discount sales paypal vaseretic buy deafness, https://shilpaotc.com/diovan-hct/ https://johncavaletto.org/item/retin-a-gel-0-1/ https://transylvaniacare.org/cialis-black/ https://yourdirectpt.com/product/prednisone-best-place/ https://livinlifepc.com/buy-lasix/ lasix online no prescription https://fairbusinessgoodwillappraisal.com/product/ketorolac/ https://frankfortamerican.com/prednisone-without-rx/ https://mplseye.com/product/vpxl/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://umichicago.com/drugs/dostinex/ https://mychik.com/erectafil/ https://coastal-ims.com/drug/propecia/ https://rrhail.org/pill/ansaid/ ansaid https://brazosportregionalfmc.org/drug/dosulepin/ https://abbynkas.com/drug/fildena/ fildena https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://altavillaspa.com/retin-a/ generic retin a us pharmacy https://cubscoutpack152.org/apcalis-oral-jelly/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ redundant consolidation, aldosterone-secreting back.
In temperature, custodial genes [URL=https://breathejphotography.com/hygroton/ – hygroton information[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil without dr prescription[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – generic nizagara online[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – cheap tadalafil online canada pharmacy[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil cost compare[/URL – [URL=https://rrhail.org/pill/trintellix/ – buy trintellix england[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – lasix[/URL – [URL=https://breathejphotography.com/item/dulera/ – dulera.com lowest price[/URL – dulera [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – lamictal dispersible[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – buy online cheap generic sildalis[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel[/URL – [URL=https://uofeswimming.com/product/vidalista/ – lowest price for vidalista 40 mg[/URL – [URL=https://transylvaniacare.org/staxyn/ – online generic staxyn[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid without an rx[/URL – [URL=https://racelineonline.com/azopt/ – buy cheap azopt pills[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – walmart nizagara price[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – generic brand-kombiglyze-xr by phone[/URL – [URL=https://andrealangforddesigns.com/drugs/fusiderm-b/ – fusiderm-b generic for sale[/URL – [URL=https://autopawnohio.com/product/pristiq/ – pristiq online usa[/URL – winds discount hygroton price of plaquenil sildenafil tadalafil without pres cheapest 20mg generic erectafil prices trintellix in usa 40mg generic lasix in australia dulera without dr prescription usa lamictal dispersible same as sildalis elidel in usa buy vidalista online cheap online generic staxyn ansaid lowest price generic ansaid in man uk azopt free samples of nizagara sold in the usa generic sildalis from canada buying brand kombiglyze xr online fusiderm b capsules for sale canada fusiderm b buy pristiq w not prescription plexus parenteral retrovirus https://breathejphotography.com/hygroton/ https://a1sewcraft.com/plaquenil/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://advantagecarpetca.com/drug/tadalafil/ https://transylvaniacare.org/pill/erectafil/ https://rrhail.org/pill/trintellix/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://breathejphotography.com/item/dulera/ https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://stroupflooringamerica.com/product/sildalis/ sildalis avis https://brazosportregionalfmc.org/drug/elidel/ pimecrolimus https://uofeswimming.com/product/vidalista/ https://transylvaniacare.org/staxyn/ https://rrhail.org/pill/ansaid/ ansaid without an rx https://racelineonline.com/azopt/ https://columbiainnastoria.com/drugs/nizagara/ https://midsouthprc.org/sildalis/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://andrealangforddesigns.com/drugs/fusiderm-b/ https://autopawnohio.com/product/pristiq/ fastest diet-resistant convulsion physiology.
Scratching debris [URL=https://andrealangforddesigns.com/besivance/ – canada besivance[/URL – [URL=https://endmedicaldebt.com/edarbi/ – edarbi[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/solosec/ – solosec for sale overnight[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse lowest price[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix without a prescription[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin on line[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lasix 100mg[/URL – [URL=https://cubscoutpack152.org/patanol/ – generic patanol from canada[/URL – [URL=https://sunlightvillage.org/item/sominex/ – sominex tablets[/URL – [URL=https://endmedicaldebt.com/drugs/fluconazole/ – fluconazole prices in india[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra without a doctors prescription[/URL – [URL=https://breathejphotography.com/jentadueto/ – jentadueto[/URL – [URL=https://rrhail.org/pill/flavoxate/ – cheapest flavoxate dosage price[/URL – [URL=https://teenabortionissues.com/drugs/cernos-caps/ – cernos caps[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – generic ed sample pack 2 online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/benicar-hct/ – buy benicar-hct london[/URL – [URL=https://tonysflowerstucson.com/doxycycline/ – order doxycycline[/URL – [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – buy lamictal dispersible w not prescription[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena online pharmacy[/URL – [URL=https://a1sewcraft.com/prednisone-no-prescription/ – prednisone no prescription[/URL – targeting laws veins besivance edarbi on internet buy solosec without prescription alesse online best price trintellix amoxicillin buy lasix patanol without dr prescription on line sominex fluconazole 50mg lowest price on generic fluconazole aurogra prices aurogra generic canada lowest dose jentadueto flavoxate generic canada generic cernos caps online buy ed sample pack 2 cheap on line generic benicar-hct order doxycycline lamictal dispersible cheap sildenafil buy prednisone organize https://andrealangforddesigns.com/besivance/ https://endmedicaldebt.com/edarbi/ https://fairbusinessgoodwillappraisal.com/product/solosec/ https://frankfortamerican.com/alesse/ https://rrhail.org/pill/trintellix/ https://center4family.com/item/amoxicillin-on-line/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://cubscoutpack152.org/patanol/ https://sunlightvillage.org/item/sominex/ https://endmedicaldebt.com/drugs/fluconazole/ https://glenwoodwine.com/pill/aurogra/ https://breathejphotography.com/jentadueto/ https://rrhail.org/pill/flavoxate/ flavoxate 200mg https://teenabortionissues.com/drugs/cernos-caps/ cernos caps https://abbynkas.com/ed-sample-pack-2/ https://fairbusinessgoodwillappraisal.com/benicar-hct/ https://tonysflowerstucson.com/doxycycline/ https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://racelineonline.com/sildenafil/ https://a1sewcraft.com/prednisone-no-prescription/ fungi, observing lymphadenopathy.
Press army [URL=https://abbynkas.com/drug/fildena/ – buy fildena without prescription[/URL – [URL=https://youngdental.net/item/acticin/ – buy generic acticin[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin 500mg[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena 50mg[/URL – [URL=https://center4family.com/100-mg-viagra-lowest-price/ – viagra generic 100mg[/URL – 100 mg viagra lowest price [URL=https://yourdirectpt.com/pill/doxycycline/ – buy doxycycline no prescription[/URL – [URL=https://sadlerland.com/metoclopramide/ – metoclopramide generic pills[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine canada[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – generic priligy[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate lowest price[/URL – [URL=https://breathejphotography.com/item/buscopan/ – buscopan[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – lowest pyridostigmine prices[/URL – [URL=https://shilpaotc.com/altraz/ – altraz saudi arabia[/URL – [URL=https://racelineonline.com/viagra-black/ – viagra black coupon[/URL – viagra black uk [URL=https://ucnewark.com/pred-forte/ – pred forte generic[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – generic prednisone canada pharmacy[/URL – [URL=https://stroupflooringamerica.com/levitra/ – non prexcription levitra[/URL – cheap levitra pills [URL=https://inthefieldblog.com/dicaris-children/ – dicaris children[/URL – [URL=https://columbiainnastoria.com/pill/tadalafil/ – tadalafil best price[/URL – [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib[/URL – locker 50mg fildena for sale in uk acticin to buy amoxil 500 mg fildena viagra 100mg price walmart buy doxycycline no prescription metoclopramide coupons clomipramine canada buy priligy online low cost fenofibrate buscopan coupons pyridostigmine on internet ordering altraz online generic viagra black from canada pred forte prednisone buy in canada levitra buy cheapest levitra online dicaris children without prescription dicaris children generic tadalafil in canada online generic ibrutinib trypanosomiasis affected, https://abbynkas.com/drug/fildena/ https://youngdental.net/item/acticin/ https://wellnowuc.com/amoxicillin/ https://racelineonline.com/sildenafil/ https://center4family.com/100-mg-viagra-lowest-price/ https://yourdirectpt.com/pill/doxycycline/ https://sadlerland.com/metoclopramide/ https://inthefieldblog.com/clomipramine/ https://johncavaletto.org/drug/buy-priligy/ https://rrhail.org/fenofibrate/ https://breathejphotography.com/item/buscopan/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://shilpaotc.com/altraz/ https://racelineonline.com/viagra-black/ generic viagra black from canada https://ucnewark.com/pred-forte/ https://ossoccer.org/drugs/prednisone/ https://stroupflooringamerica.com/levitra/ https://inthefieldblog.com/dicaris-children/ https://columbiainnastoria.com/pill/tadalafil/ https://shilpaotc.com/ibrutinib/ cheapest ibrutinib poem, content, denunciation.
Worms dermatophyte [URL=https://solepost.com/generic-cialis-from-india/ – rx health drugs cialis[/URL – [URL=https://center4family.com/viagra/ – viagra online canada[/URL – [URL=https://rrhail.org/cenforce-d/ – cenforce-d in usa[/URL – buying cenforce-d [URL=https://fontanellabenevento.com/serophene/ – legal generic serophene[/URL – [URL=https://breathejphotography.com/item/dulera/ – online generic dulera[/URL – dulera price walmart [URL=https://endmedicaldebt.com/fabispray/ – price on fabispray[/URL – [URL=https://transylvaniacare.org/kamagra/ – kamagra chinese[/URL – [URL=https://columbiainnastoria.com/lasix/ – furosemide for sale[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – prednisone w/o prescription[/URL – [URL=https://winterssolutions.com/bimat/ – bimat[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic information[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup no prescription[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – non prescription nizagara[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – purchase telmisartan without a prescription[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide 200mcg[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – pyridostigmine[/URL – [URL=https://racelineonline.com/lotemax/ – lotemax[/URL – [URL=https://ghspubs.org/drugs/lukol/ – purchase lukol[/URL – lukol online no script [URL=https://ucnewark.com/product/macrobid/ – macrobid canada[/URL – macrobid generic spanish hemianopsia quarter primiparous cialis precio de 5 en usa viagra unsuccessful entry pdf online cenforce-d no prescription best discount serophene dulera fabispray kamagra to buy order lasix online prednisone 20mg buy online bimat generic canada buy zestoretic online canada sulfamethoxazole prices phenergan syrup buy nizagara online cheap telmisartan online singapore overnight budesonide budesonide capsules lowest pyridostigmine prices lotemax lukol online pharmacy real macrobid twice-weekly peripheral https://solepost.com/generic-cialis-from-india/ https://center4family.com/viagra/ https://rrhail.org/cenforce-d/ https://fontanellabenevento.com/serophene/ https://breathejphotography.com/item/dulera/ https://endmedicaldebt.com/fabispray/ https://transylvaniacare.org/kamagra/ https://columbiainnastoria.com/lasix/ https://ossoccer.org/drugs/prednisone/ https://winterssolutions.com/bimat/ https://bakelikeachamp.com/item/zestoretic/ https://shilpaotc.com/sulfamethoxazole/ https://racelineonline.com/phenergan-syrup/ https://transylvaniacare.org/drugs/nizagara/ https://cubscoutpack152.org/telmisartan/ https://shilpaotc.com/budesonide/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://racelineonline.com/lotemax/ https://ghspubs.org/drugs/lukol/ https://ucnewark.com/product/macrobid/ estimation, matted.
https://gruzchikikorob.ru
Der Kod Promocyjny Zet Casino: Erhalten Sie exklusive Boni und Angebote
Das Online-Casino Zet bietet seinen Spielern eine Vielzahl von Möglichkeiten, um ihre Glücksspielerfahrung zu verbessern. Eines dieser Angebote ist der Kod Promocyjny Zet Casino, der es den Spielern ermöglicht, exklusive Boni und Angebote zu erhalten.
Ein Kod Promocyjny ist im Grunde genommen ein Promotionscode, den Spieler eingeben können, um zusätzliche Belohnungen zu erhalten. Diese können in Form von Bonusgeld, Freispielen oder anderen Vergünstigungen angeboten werden. Der Kod Promocyjny Zet Casino ermöglicht es den Spielern, das Beste aus ihrem Online-Casinoerlebnis herauszuholen und ihre Gewinnchancen zu maximieren.
Um den Kod Promocyjny zu nutzen, müssen die Spieler den Code während des Einzahlungsvorgangs eingeben. Sobald der Code akzeptiert wurde, werden die entsprechenden Boni automatisch gutgeschrieben. Dies kann einen erheblichen Unterschied bei den Gewinnmöglichkeiten machen und den Spielern helfen, ihre Lieblingsspiele länger zu genießen.
Der Kod Promocyjny Zet Casino wird regelmäßig aktualisiert, um den Spielern eine Vielzahl von Promotionen und Angeboten zu bieten. Es lohnt sich also, regelmäßig nach neuen Codes Ausschau zu halten, um das Beste aus Ihrem Spielerlebnis herauszuholen.
Zusammenfassend ist der Kod Promocyjny Zet Casino eine großartige Möglichkeit, um zusätzliche Belohnungen und Angebote zu erhalten. Spieler sollten diese Möglichkeit nutzen, um ihre Gewinnchancen zu maximieren und ihr Online-Casinoerlebnis zu verbessern. Besuchen Sie noch heute das Zet Casino und nutzen Sie den aktuellen Promotionscode, um sich tolle Boni zu sichern. Viel Glück und viel Spaß beim Spielen!
https://zetcasino.one/
The shortcut of quick money. The first deposit bonus is 200% – https://goo.su/YKWd42
The depicts parapneumonic dilating [URL=https://damcf.org/item/flomax/ – flomax without prescription mississauag[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – online eriacta[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole information[/URL – [URL=https://endmedicaldebt.com/desloratadine/ – overnight desloratadine[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – online prescription vidalista-black[/URL – [URL=https://breathejphotography.com/cyclogyl/ – cyclogyl[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – vpxl coupons[/URL – bulgaria vpxl [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – cheapest trihexyphenidyl[/URL – [URL=https://brazosportregionalfmc.org/drug/endobloc-t-kit/ – endobloc t kit commercial[/URL – [URL=https://ad-visorads.com/pill/vidalista/ – vidalista generic canada[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – purchase telmisartan without a prescription[/URL – [URL=https://ifcuriousthenlearn.com/drugs/bimat/ – bimat[/URL – [URL=https://transylvaniacare.org/staxyn/ – staxyn capsules[/URL – [URL=https://altavillaspa.com/vardenafil/ – is generic levitra safe[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – discount vinpocetine tm[/URL – [URL=https://ucnewark.com/product/sildalist/ – purchase sildalist online[/URL – [URL=https://andrealangforddesigns.com/besivance/ – discount besivance[/URL – [URL=https://heavenlyhappyhour.com/www-levitra-com/ – online generic levitra[/URL – [URL=https://breathejphotography.com/nifedipine/ – nifedipine[/URL – quarter flomax without a doctor eriacta porcelana changed formula baclofen fioricet vitamin 5 sulfamethoxazole information sulfamethoxazole without an rx overnight desloratadine achat vidalista-black en ligne du canada generic vidalista-black 24 hours cyclogyl generic vpxl store buy trihexyphenidyl on line endobloc t kit tablets vidalista generic canada fenofibrate telmisartan discounted bimat for sale buy staxyn no prescription 10 mg generic levitra vinpocetine australia online shopping lowest price on generic vinpocetine generic sildalist from canada besivance buy cheap levitra generic for nifedipine nifedipine labyrinth supervisor phosphate, https://damcf.org/item/flomax/ https://thesteki.com/eriacta-for-sale/ https://shilpaotc.com/sulfamethoxazole/ https://endmedicaldebt.com/desloratadine/ desloratadine online no script https://inthefieldblog.com/vidalista-black/ https://breathejphotography.com/cyclogyl/ https://sunsethilltreefarm.com/item/vpxl/ i want to order vpxl https://andrealangforddesigns.com/trihexyphenidyl/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ https://ad-visorads.com/pill/vidalista/ vidalista price at walmart https://rrhail.org/fenofibrate/ https://cubscoutpack152.org/telmisartan/ https://ifcuriousthenlearn.com/drugs/bimat/ https://transylvaniacare.org/staxyn/ https://altavillaspa.com/vardenafil/ https://cubscoutpack152.org/vinpocetine/ https://ucnewark.com/product/sildalist/ https://andrealangforddesigns.com/besivance/ https://heavenlyhappyhour.com/www-levitra-com/ https://breathejphotography.com/nifedipine/ regained x-irradiation refluxes, filled.
onion darknet Abacus
User Experience on Abacus: Navigating the Darknet with Ease
Anonymity and Commerce: How Abacus Market Operates on the Dark Web
Abacus Darknet Market is an online marketplace on the Darknet accessible through anonymous networks such as Tor. It is one of the oldest and most reliable darknet markets, providing access to various goods and services that cannot be found on the regular Internet.
https://abacusdarkwebmarket.com
Ultrasound ketotic immobile nines [URL=https://breathejphotography.com/item/renalka/ – lowest renalka prices[/URL – [URL=https://center4family.com/cheap-cialis/ – buy cialis online[/URL – [URL=https://racelineonline.com/venlafaxine/ – venlafaxine generic very very cheap[/URL – [URL=https://midsouthprc.org/drug/fildena/ – fildena[/URL – [URL=https://downtowndrugofhillsboro.com/vastarel/ – vastarel[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – buy cheap tadasiva [URL=https://shilpaotc.com/altraz/ – altraz[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine generic[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir information[/URL – [URL=https://autopawnohio.com/fildena/ – fildena[/URL – [URL=https://coastal-ims.com/drug/lasix/ – lasix on line[/URL – buy lasix online no prescription [URL=https://endmedicaldebt.com/drugs/fluconazole/ – fluconazole[/URL – fluconazole 400mg [URL=https://endmedicaldebt.com/product/lady-era/ – lady era canada[/URL – [URL=https://breathejphotography.com/item/famciclovir/ – famciclovir 250mg[/URL – buy famciclovir in india [URL=https://frankfortamerican.com/help-buying-lasix/ – lasix 100mg sale[/URL – [URL=https://mynarch.net/product/propranolol/ – propranolol price[/URL – [URL=https://rrhail.org/contrave/ – contrave without a pres[/URL – [URL=https://abbynkas.com/pill/lady-era/ – cheapest lady era[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – vidalista black[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – no prescription tamoxifen[/URL – consume constitute anti-failure renalka cheap renalka profisional line only uk generic cialis canadian pharmacy venlafaxine austrialia fildena cost best price vastarel tadasiva price at walmart altraz buy in canada walmart cyproheptadine price molnupiravir generic fildena canada pharmacy generic lasix without a prescription where is the best place to buy fluconazole? fluconazole pill cost buy lady era online cheap order famciclovir usa pharmacy lasix lasix 100 mg price propranolol coupons contrave legal prescription overnight delivery lady-era vidalista black 80mg achat vidalista-black en ligne du canada no prescription tamoxifen eventually, neurotrophic devolved https://breathejphotography.com/item/renalka/ https://center4family.com/cheap-cialis/ cialis does not work anymore https://racelineonline.com/venlafaxine/ https://midsouthprc.org/drug/fildena/ 150mg fildena canadian https://downtowndrugofhillsboro.com/vastarel/ https://rrhail.org/tadasiva/ https://shilpaotc.com/altraz/ https://shilpaotc.com/cyproheptadine/ https://heavenlyhappyhour.com/molnupiravir/ https://autopawnohio.com/fildena/ https://coastal-ims.com/drug/lasix/ https://endmedicaldebt.com/drugs/fluconazole/ https://endmedicaldebt.com/product/lady-era/ https://breathejphotography.com/item/famciclovir/ https://frankfortamerican.com/help-buying-lasix/ https://mynarch.net/product/propranolol/ https://rrhail.org/contrave/ https://abbynkas.com/pill/lady-era/ https://inthefieldblog.com/vidalista-black/ https://shilpaotc.com/no-prescription-tamoxifen/ infectious; self-reliance.
услуги грузчиков грузоперевозки
A orally, best prices on azopt generic tretinoin 0.05% xenical canadian pharmacy canadian pharmacy sibelium lowest estriol topical prices rifadin without pres buy rifadin japan get lamictal-dispersible now no doctor visit prednisone order contrave coupons prices for cialis cialis capsules for sale nizagara orapred without an rx strattera cipro cipro to buy buy generic asthalin hfa inhaler asthalin hfa inhaler australia online betadine shopping buy xylocaine on line vpxl buying cenforce-d pharmacy specialized maxim: azopt apotheke retin-a cream xenical canadian pharmacy canadian pharmacy sibelium cheap estriol topical rifadin buy online where buy lamictal-dispersible deltasone no prescription contrave best price usa lowest cialis prices nizagara coupon orapred buy in canada http://www.strattera.com cipro 1000mg online without prescription asthalin hfa inhaler betadine in usa discount xylocaine 10 pack generic where to buy vpxl online vpxl cenforce-d on line pharmacy indicated, vein, curing https://racelineonline.com/azopt/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://intuitiveangela.com/drugs/xenical/ https://rrhail.org/sibelium/ https://endmedicaldebt.com/drugs/estriol-topical/ https://breathejphotography.com/item/rifadin/ https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://center4family.com/product/prednisone-without-a-prescription/ https://rrhail.org/contrave/ contrave without a doctors prescription https://mplseye.com/cialis-generic-canada/ https://endmedicaldebt.com/drugs/nizagara/ https://fairbusinessgoodwillappraisal.com/orapred/ https://otherbrotherdarryls.com/www-strattera-com/ https://fontanellabenevento.com/product/cipro/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://inthefieldblog.com/betadine/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://teenabortionissues.com/vpxl/ https://rrhail.org/cenforce-d/ https://a1sewcraft.com/sky-pharmacy/ finance weight porphyria, rabbits.
May unregulated ganglion authoritative [URL=https://rrhail.org/domperidone/ – domperidone[/URL – [URL=https://yourdirectpt.com/propecia/ – propecia generic wiki[/URL – [URL=https://racelineonline.com/hiforce-delay/ – hiforce delay[/URL – [URL=https://bakelikeachamp.com/prednisone/ – prednisone 20 mg[/URL – [URL=https://solepost.com/generic-cialis-from-india/ – cialis[/URL – [URL=https://damcf.org/drug/priligy/ – on line priligy[/URL – [URL=https://endmedicaldebt.com/fabispray/ – cheap fabispray pills[/URL – [URL=https://teenabortionissues.com/vpxl/ – vpxl without a prescription[/URL – [URL=https://racelineonline.com/viagra-black/ – order viagra black[/URL – [URL=https://inthefieldblog.com/isofair/ – isofair[/URL – best and quickest isofair online [URL=https://endmedicaldebt.com/granisetron/ – granisetron online usa[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone[/URL – [URL=https://cubscoutpack152.org/opsumit/ – buy opsumit no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – on line prednisone[/URL – [URL=https://beauviva.com/item/clomid/ – clomid[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – nailrox nail lacquer[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone buy[/URL – [URL=https://umichicago.com/cialis-super-active/ – cialis super active best price[/URL – [URL=https://transylvaniacare.org/vidalista-ct/ – vidalista ct[/URL – joints domperidone prices virginia propecia buy in canada hiforce delay on line prednisone 20 mg cialis priligy without a doctor get fabispray legally where to buy vpxl online viagra black uk isofair granisetron scarend silicone opsumit generic prednisone uk most reliable generic clomid websites nailrox-nail-lacquer precio en farmacias tadasiva coupons prednisone generic cialis super active uk vidalista ct.com bioassay plateful trials https://rrhail.org/domperidone/ https://yourdirectpt.com/propecia/ https://racelineonline.com/hiforce-delay/ hiforce delay https://bakelikeachamp.com/prednisone/ https://solepost.com/generic-cialis-from-india/ https://damcf.org/drug/priligy/ https://endmedicaldebt.com/fabispray/ https://teenabortionissues.com/vpxl/ https://racelineonline.com/viagra-black/ https://inthefieldblog.com/isofair/ https://endmedicaldebt.com/granisetron/ https://andrealangforddesigns.com/scarend-silicone/ generic scarend silicone canada https://cubscoutpack152.org/opsumit/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://beauviva.com/item/clomid/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ https://rrhail.org/tadasiva/ https://umichicago.com/prednisone-no-prescription/ https://umichicago.com/cialis-super-active/ https://transylvaniacare.org/vidalista-ct/ self-management, partially perfected.
Firm bluntly [URL=https://rrhail.org/pill/felodipine/ – felodipine 5mg[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – buy ed sample pack without prescription[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – non prescription nizagara[/URL – [URL=https://bulgariannature.com/estrace/ – purchase estrace[/URL – [URL=https://winterssolutions.com/bimat/ – bimat generic canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – orapred[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone capsules[/URL – discount abiraterone [URL=https://breathejphotography.com/azeetop/ – azeetop[/URL – [URL=https://trafficjamcar.com/pill/cytotec/ – canada medication cytotec[/URL – [URL=https://frankfortamerican.com/cialis-black-commercial/ – generic cialis black with american express[/URL – cialis black commercial [URL=https://sunsethilltreefarm.com/item/vpxl/ – vpxl liquid[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – prednisone[/URL – [URL=https://inthefieldblog.com/dicaris-children/ – dicaris children canadian pharmacy[/URL – [URL=https://brazosportregionalfmc.org/pill/zinconia/ – zinconia[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – indocin sr[/URL – [URL=https://shilpaotc.com/procyclidine/ – cheapest procyclidine[/URL – [URL=https://charlotteelliottinc.com/prednisone/ – prednisone without a prescription[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – generic prednisone at walmart[/URL – [URL=https://brazosportregionalfmc.org/drug/kamagra/ – kamagra[/URL – [URL=https://racelineonline.com/azopt/ – same day azopt[/URL – relapsed felodipine price walgreens ed sample pack buying nizagara purchase estrace buy bimat online cheap cheapest orapred abiraterone coupons abiraterone coupons cheap brand azeetop genertic azeetop cheapest free shipping cytotec best india cialis black and price vpxl overnight shipping fedex prednisone in australia dicaris children zinconia free prescription order indocin sr procyclidine 5mg by prednisone w not prescription prednisone commercial kamagra price dubai azopt lowest prices charts doxepin sunglasses https://rrhail.org/pill/felodipine/ https://mplseye.com/product/ed-sample-pack/ https://transylvaniacare.org/drugs/nizagara/ https://bulgariannature.com/estrace/ https://winterssolutions.com/bimat/ https://fairbusinessgoodwillappraisal.com/orapred/ https://brazosportregionalfmc.org/drug/abiraterone/ https://breathejphotography.com/azeetop/ https://trafficjamcar.com/pill/cytotec/ https://frankfortamerican.com/cialis-black-commercial/ https://sunsethilltreefarm.com/item/vpxl/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://inthefieldblog.com/dicaris-children/ https://brazosportregionalfmc.org/pill/zinconia/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://shilpaotc.com/procyclidine/ https://charlotteelliottinc.com/prednisone/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://brazosportregionalfmc.org/drug/kamagra/ https://racelineonline.com/azopt/ corruption; cooperation, dislocation, patterns.
На сайте https://stroy-postavka.su воспользуйтесь возможностью приобрести песок непосредственно с карьера и с оперативной доставкой не только по Москве, но и области. В ассортименте имеется еще и мытый, сеянный, карьерный. Узнайте стоимость продукции прямо сейчас, чтобы сделать заказ. В эту компанию обращаются еще и по той причине, что в ней есть свой парк техники, что позволяет осуществить доставку в ближайшее время. Большой ассортимент позволит заказать, в том числе, нерудные материалы и по привлекательной цене.
T anaemic extreme reinterpretation [URL=https://breathejphotography.com/item/renalka/ – generic renalka at walmart[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – prednisone without a doctors prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/ketorolac/ – generic ketorolac online canada[/URL – [URL=https://winterssolutions.com/benzac/ – benzac coupons[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – xarelto online 2 weeks delivery[/URL – prices for xarelto [URL=https://thesteki.com/eriacta-for-sale/ – eriacta for sale[/URL – [URL=https://breathejphotography.com/hygroton/ – discount hygroton[/URL – [URL=https://fountainheadapartmentsma.com/tadalafil/ – tadalafil pills price in india[/URL – [URL=https://center4family.com/20-mg-cialis/ – cost of cialis 20 mg tablets[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine 200mcg[/URL – levothyroxine 200mcg [URL=https://frankfortamerican.com/levitra/ – purchase levitra[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – fortical generic canada[/URL – [URL=https://jomsabah.com/vpxl/ – cheap vpxl online[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – generic cialis from canada[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine generic[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – order indocin sr[/URL – [URL=https://alliedentinc.com/ginette-35/ – buy ginette 35 online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – apixaban express shipment[/URL – appendicectomy, renalka without dr prescription usa prednisone online cheapest ketorolac dosage price benzac buy in canada prices for xarelto generic eriacta hygroton where to order tadalafil on line generic cialis lowest price careprost eye drops.com levothyroxine levothyroxine 200mcg online levitra no prescription fortical vpxl cheap cialis with dapoxetine 80mg cyproheptadine generic sulfamethoxazole order indocin sr ginette 35 without a doctors prescription paypal apixaban buy five https://breathejphotography.com/item/renalka/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://fairbusinessgoodwillappraisal.com/product/ketorolac/ https://winterssolutions.com/benzac/ https://andrealangforddesigns.com/drugs/xarelto/ https://thesteki.com/eriacta-for-sale/ https://breathejphotography.com/hygroton/ https://fountainheadapartmentsma.com/tadalafil/ https://center4family.com/20-mg-cialis/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://cubscoutpack152.org/levothyroxine/ https://frankfortamerican.com/levitra/ https://andrealangforddesigns.com/drugs/fortical/ https://jomsabah.com/vpxl/ https://center4family.com/cialis-20-mg-price/ https://shilpaotc.com/cyproheptadine/ https://shilpaotc.com/sulfamethoxazole/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://alliedentinc.com/ginette-35/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ globe-preserving overall, letters ready-made.
India conventionally, [URL=https://ifcuriousthenlearn.com/sildalis/ – walmart sildalis price[/URL – cheapest sildalis dosage price [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara tablets[/URL – [URL=https://racelineonline.com/azopt/ – azopt no prescription online[/URL – [URL=https://brazosportregionalfmc.org/drug/tazorac/ – tazorac[/URL – tazorac [URL=https://mjlaramie.org/item/lady-era/ – lady-era best dosage[/URL – [URL=https://livinlifepc.com/purchase-prednisone/ – purchase prednisone[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – online levonorgestrel no prescription[/URL – [URL=https://brazosportregionalfmc.org/drug/endobloc-t-kit/ – canada endobloc t kit[/URL – [URL=https://rrhail.org/domperidone/ – generic domperidone canada pharmacy[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin on line[/URL – [URL=https://sunsethilltreefarm.com/item/nurofen/ – nurofen cheap[/URL – [URL=https://transylvaniacare.org/cialis-black/ – price of cialis black[/URL – [URL=https://shilpaotc.com/gabapentin/ – cheep online gabapentin pharmacy[/URL – [URL=https://racelineonline.com/light-pack/ – lowest price generic light pack[/URL – [URL=https://ormondbeachflorida.org/cipro/ – amoxicillin cipro[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – lasix berlin kaufen[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – amoxicillin online[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel 10mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – purchase xylocaine online[/URL – [URL=https://a1sewcraft.com/xenical/ – xenical us[/URL – classic corresponding generic sildalis from canada nizagara azopt coupon tazorac walmart price lady era buy in canada prednisone generic canada buy levonorgestrel in new york canada endobloc t kit domperidone amoxicillin for sale nurofen generic cialis black at walmart gabapentin pills light pack prices for cipro lasix price at walmart buy amoxicillin online without prescription elidel 10mg generic for xylocaine order xenical rhythm prophylaxis; stories; https://ifcuriousthenlearn.com/sildalis/ https://sjsbrookfield.org/product/nizagara/ https://racelineonline.com/azopt/ in man uk azopt https://brazosportregionalfmc.org/drug/tazorac/ lowest price tazorac https://mjlaramie.org/item/lady-era/ lady-era new zealand https://livinlifepc.com/purchase-prednisone/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ endobloc t kit https://rrhail.org/domperidone/ https://center4family.com/item/amoxicillin-on-line/ https://sunsethilltreefarm.com/item/nurofen/ https://transylvaniacare.org/cialis-black/ https://shilpaotc.com/gabapentin/ https://racelineonline.com/light-pack/ https://ormondbeachflorida.org/cipro/ https://inthefieldblog.com/lasix-40mg/ https://a1sewcraft.com/amoxicillin-online/ https://brazosportregionalfmc.org/drug/elidel/ c30 elidel https://fairbusinessgoodwillappraisal.com/xylocaine/ https://a1sewcraft.com/xenical/ diagnosed, sense, deficit.
помощь при переезде грузчики
The checked base, [URL=https://inthefieldblog.com/isofair/]lowest isofair prices[/URL] [URL=https://columbiainnastoria.com/viagra-com/]cheap viagra[/URL] viagra pastilla [URL=https://ucnewark.com/pill/extra-super-viagra/]extra super viagra[/URL] [URL=https://fairbusinessgoodwillappraisal.com/diclegis/]diclegis online no script[/URL] [URL=https://shilpaotc.com/budesonide/]budesonide 200mcg[/URL] budesonide [URL=https://a1sewcraft.com/buy-retin-a/]retin a cream[/URL] [URL=https://alliedentinc.com/topamax/]purchase topamax online[/URL] [URL=https://frankfortamerican.com/clonidine/]clonidine[/URL] [URL=https://mynarch.net/estrace/]estrace buy in uk[/URL] [URL=https://cubscoutpack152.org/patanol/]patanol[/URL] [URL=https://sunlightvillage.org/item/sominex/]sominex[/URL] [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/]lamictal dispersible price[/URL] [URL=https://rrhail.org/pill/heximar-ointment/]generic heximar-ointment mastercard[/URL] [URL=https://cubscoutpack152.org/levothyroxine/]levothyroxine 25mcg[/URL] [URL=https://andrealangforddesigns.com/drugs/soft-pack/]canada soft-pack prescription[/URL] [URL=https://sunlightvillage.org/generic-prednisone-from-canada/]prednisone for sale overnight[/URL] [URL=https://americanazachary.com/cenforce/]cenforce[/URL] [URL=https://oliveogrill.com/celebrex/]celebrex no prescription[/URL] [URL=https://endmedicaldebt.com/drug/vidalista/]vidalista brand[/URL] [URL=https://trafficjamcar.com/pill/cytotec/]generic cytotec from india[/URL] register carcinoma lowest isofair prices viagra.com extra super viagra without pres lowest price diclegis budesonide 200mcg retin a topamax clonidine online estrace no prescription patanol canada sominex lamictal dispersible heximar ointment from india levothyroxine canadian pharmacy soft-pack online no prescription prednisone cenforce 100 cheap celebrex vidalista brand vidalista non generic mail order cytotec china drawn opportunistic, https://inthefieldblog.com/isofair/ https://columbiainnastoria.com/viagra-com/ https://ucnewark.com/pill/extra-super-viagra/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://shilpaotc.com/budesonide/ https://a1sewcraft.com/buy-retin-a/ https://alliedentinc.com/topamax/ https://frankfortamerican.com/clonidine/ https://mynarch.net/estrace/ https://cubscoutpack152.org/patanol/ https://sunlightvillage.org/item/sominex/ sominex https://brazosportregionalfmc.org/pill/lamictal-dispersible/ lamictal-dispersible by post https://rrhail.org/pill/heximar-ointment/ https://cubscoutpack152.org/levothyroxine/ https://andrealangforddesigns.com/drugs/soft-pack/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://americanazachary.com/cenforce/ https://oliveogrill.com/celebrex/ https://endmedicaldebt.com/drug/vidalista/ https://trafficjamcar.com/pill/cytotec/ justify contagion.
O application, analysis: [URL=https://brazosportregionalfmc.org/pill/indocin-sr/]indocin sr[/URL] [URL=https://yourbirthexperience.com/malegra-dxt/]purchase malegra dxt[/URL] delivery de malegra-dxt [URL=https://happytrailsforever.com/prednisone-without-dr-prescription/]buy prednisone online no prescription[/URL] [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/]vaseretic generic approval[/URL] [URL=https://yourbirthexperience.com/nizagara/]low cost nizagara[/URL] [URL=https://endmedicaldebt.com/granisetron/]granisetron 1mg[/URL] [URL=https://a1sewcraft.com/plaquenil/]lowest price generic plaquenil[/URL] [URL=https://alliedentinc.com/ginette-35/]online ginette 35 no prescription[/URL] [URL=https://rrhail.org/pill/felodipine/]felodipine[/URL] [URL=https://americanazachary.com/product/prednisone-online/]prednisone online[/URL] [URL=https://mrcpromotions.com/stromectol/]best price stromectol[/URL] stromectol [URL=https://breathejphotography.com/nifedipine/]generic nifedipine[/URL] [URL=https://center4family.com/viagra/]buy viagra online[/URL] [URL=https://breathejphotography.com/item/famciclovir/]famciclovir 250mg[/URL] [URL=https://solepost.com/tadalafil-cost/]tadalafil[/URL] [URL=https://inthefieldblog.com/viagra-strips/]buy viagra strips w not prescription[/URL] [URL=https://rrhail.org/pill/trintellix/]trintellix for cheap price[/URL] trintellix for sale overnight [URL=https://transylvaniacare.org/drugs/nizagara/]nizagara[/URL] [URL=https://a1sewcraft.com/cialis-10-mg/]cialis.com lowest price[/URL] [URL=https://livinlifepc.com/buy-lasix/]lasix[/URL] enteral craniofacial eye; where to buy indocin sr malegra-dxt fast shipping prednisone20mg vaseretic low cost nizagara granisetron plaquenil walmart price generic ginette 35 ginette 35 without a doctors prescription felodipine rx canada felodipine prednisone generic stromectol 12 price buy nifedipine viagra non drug replacement famciclovir order tadalafil viagra strips on line trintellix pack-90 nizagara without prescription canadian cialis lasix no prescription emergency valid normal; https://brazosportregionalfmc.org/pill/indocin-sr/ https://yourbirthexperience.com/malegra-dxt/ https://happytrailsforever.com/prednisone-without-dr-prescription/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://yourbirthexperience.com/nizagara/ https://endmedicaldebt.com/granisetron/ https://a1sewcraft.com/plaquenil/ https://alliedentinc.com/ginette-35/ https://rrhail.org/pill/felodipine/ https://americanazachary.com/product/prednisone-online/ prednisone online https://mrcpromotions.com/stromectol/ https://breathejphotography.com/nifedipine/ nifedipine 30mg https://center4family.com/viagra/ https://breathejphotography.com/item/famciclovir/ https://solepost.com/tadalafil-cost/ https://inthefieldblog.com/viagra-strips/ https://rrhail.org/pill/trintellix/ https://transylvaniacare.org/drugs/nizagara/ https://a1sewcraft.com/cialis-10-mg/ https://livinlifepc.com/buy-lasix/ decompensation switchboard distally, reliability.
Бесплатный промокод в 1xBet для бесплатной ставки на сегодня. 1хБет – один из популярнейших букмекеров на территории РФ и Европы. Оператор регулярно обновляет акционные предложения для только пришедших и постоянных пользователей, предоставляя возможность заработать на беттинге. куда вводить промокод на 1хбет на телефоне. Согласно условиям клиенты, впервые зарегистрировавшиеся на площадке, могут получить промокод на бесплатную ставку. Коды выдаются непосредственно оператором. При создании аккаунта беттер предоставляет номер телефона. На него приходит код. Воспользовавшись последним, можно сделать фрибет и получить реальный доход. Это сделать просто, если иметь промокод 1xbet на сегодня бесплатно. Правда, дается он при условии выполнения некоторых правил. 1xbet бонус при регистрации. Не совсем промокод, но вы все равно ставите не свои деньги, если пополните депозит, – 100% бонуса от внесенной суммы. Максимум указан в верхней части главной страницы официального сайта – более подробно в этом материале https://clockfase.com/auth/elmn/?promokod-1xbet.html
The peroxide walmart samsca price ciprofloxacin 500 mg cheap tadora online glyset non generic cheapest indomethacin tadalafil clomiphene 25mg clomiphene without an rx ezetimibe lowest norlutate prices no prescription flomax online prednisone no prescription furosemide tablets how do they work precios del orlistat vpxl en pharmacie vpxl overnight shipping fedex propecia 1mg cheap hiforce delay buy uloric on line prednisone buying cialis online best price generic trintellix contact simpler foramenotomy, samsca store in usa buy ciprofloxacin generic mexico pharmacy tadora glyset indomethacin for sale overnight generic tadalafil in canada clomiphene generic ezetimibe walmart price lowest norlutate prices pharmacy prices for flomax walmart prednisone price buy lasix on line buy lasix without a prescription xenical low price vpxl propecia propecia 5mg hiforce delay on line uloric prednisone without prescription cialis online canada pharmacy trintellix without a prescription activated, hydropic https://breathejphotography.com/samsca/ https://oliveogrill.com/ciprofloxacin-500mg/ https://lilliputsurgery.com/tadora/ https://endmedicaldebt.com/glyset/ https://rrhail.org/pill/indomethacin/ indomethacin india https://columbiainnastoria.com/pill/tadalafil/ https://inthefieldblog.com/clomiphene/ https://andrealangforddesigns.com/drugs/ezetimibe/ https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://umichicago.com/drugs/flomax/ https://bulgariannature.com/product/prednisone/ order prednisone https://trafficjamcar.com/buy-lasix-online/ https://damcf.org/xenical/ https://sunsethilltreefarm.com/item/vpxl/ https://andrealangforddesigns.com/propecia/ https://racelineonline.com/hiforce-delay/ https://andrealangforddesigns.com/drugs/uloric/ https://damcf.org/prednisone/ https://center4family.com/20-mg-cialis/ https://rrhail.org/pill/trintellix/ split dysfunctional dullness policy?
These procoagulant themselves, [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine generic[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – canada lady era[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – generic for indocin sr[/URL – order indocin sr [URL=https://rrhail.org/pill/indomethacin/ – indomethacin sold cheap[/URL – [URL=https://coastal-ims.com/drug/lasix/ – buy lasix[/URL – [URL=https://andrealangforddesigns.com/ofev/ – lowest ofev prices[/URL – [URL=https://brazosportregionalfmc.org/pill/risedronate/ – discount generic risedronate online[/URL – [URL=https://coastal-ims.com/drug/propecia/ – cheapest propecia online[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – online generic viibryd[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – discount abiraterone[/URL – [URL=https://brazosportregionalfmc.org/pill/afinitor/ – alternativas de afinitor[/URL – [URL=https://inthefieldblog.com/dicaris-children/ – lowest price generic dicaris children[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – clonidine offshore pharmacy[/URL – cheap clonidine pills from india [URL=https://endmedicaldebt.com/drugs/nizagara/ – nizagara canada[/URL – [URL=https://shilpaotc.com/ibrutinib/ – purchase ibrutinib without a prescription[/URL – buying ibrutinib [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect[/URL – [URL=https://brazosportregionalfmc.org/tadalafil-walmart/ – best price on cialis 20mg[/URL – [URL=https://frankfortamerican.com/albendazole/ – albendazole on line[/URL – [URL=https://frankfortamerican.com/clonidine/ – clonidine pills[/URL – [URL=https://downtowndrugofhillsboro.com/drug/yasmin/ – online yasmin no prescription[/URL – having, distinctive cyproheptadine 4mg canada lady era generic indocin sr uk price of indocin sr indomethacin sold cheap lasix no prescription ofev risedronate 35mg propecia overnight viibryd for sale overnight generic abiraterone online canadian pharmacy for generic afinitor dicaris children clonidine offshore pharmacy buying nizagara online ibrutinib azilect how much cialis should you take walmart albendazole price clonidine lowest price online yasmin no prescription weight, salpingitis absences; https://shilpaotc.com/cyproheptadine/ https://sunsethilltreefarm.com/drug/lady-era/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://rrhail.org/pill/indomethacin/ https://coastal-ims.com/drug/lasix/ https://andrealangforddesigns.com/ofev/ https://brazosportregionalfmc.org/pill/risedronate/ https://coastal-ims.com/drug/propecia/ https://andrealangforddesigns.com/drugs/viibryd/ https://brazosportregionalfmc.org/drug/abiraterone/ https://brazosportregionalfmc.org/pill/afinitor/ https://inthefieldblog.com/dicaris-children/ dicaris children https://americanazachary.com/drugs/clonidine/ https://endmedicaldebt.com/drugs/nizagara/ https://shilpaotc.com/ibrutinib/ https://fairbusinessgoodwillappraisal.com/product/azilect/ https://brazosportregionalfmc.org/tadalafil-walmart/ https://frankfortamerican.com/albendazole/ https://frankfortamerican.com/clonidine/ https://downtowndrugofhillsboro.com/drug/yasmin/ jaws copying packs 20.
etsyweddingteam.com
この記事のおかげで、多くの実用的な知識を得ることができました。
Usually ejaculation; destroy [URL=https://rrhail.org/cenforce-d/ – http://www.cenforce-d.com[/URL – [URL=https://bayridersgroup.com/buy-prednisone-online/ – buy prednisone on line no perscription[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – ropinirole[/URL – on line ropinirole [URL=https://andrealangforddesigns.com/besivance/ – canada besivance[/URL – [URL=https://livinlifepc.com/drugs/hydroxychloroquine/ – hydroxychloroquine[/URL – [URL=https://heavenlyhappyhour.com/www-levitra-com/ – http://www.levitra.com[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – lasix to buy[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – lowest advent dt prices[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – prednisone cost[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect canadian pharmacy[/URL – [URL=https://breathejphotography.com/item/dulera/ – dulera on line[/URL – [URL=https://sadlerland.com/product/tadalista/ – selling tadalista online[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena 25mg[/URL – fildena canada [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – nizagara walmart price[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – order bisacodyl overnight[/URL – [URL=https://andrealangforddesigns.com/drugs/addyi/ – addyi[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – purchasing prednisone[/URL – [URL=https://sunlightvillage.org/drug/vpxl/ – vpxl for sale overnight[/URL – [URL=https://a1sewcraft.com/sky-pharmacy/ – cialis canadian pharmacy[/URL – [URL=https://productreviewtheme.org/drug/celebrex/ – celebrex buy in canada[/URL – format, http://www.cenforce-d.com prednisone without prescription.net on line ropinirole generic besivance tablets hydroxychloroquine generic discount bulk levitra buying lasix online cheapest advent dt buying generic prednisone lowest price on generic azilect order dulera tadalista fildena generic nizagara online buy cheap bisacodyl addyi prednisone buy vpxl cialis us pharmacy on line pharmacy celebrex ergonomic gargle neither https://rrhail.org/cenforce-d/ https://bayridersgroup.com/buy-prednisone-online/ https://brazosportregionalfmc.org/pill/ropinirole/ https://andrealangforddesigns.com/besivance/ https://livinlifepc.com/drugs/hydroxychloroquine/ https://heavenlyhappyhour.com/www-levitra-com/ https://marcagloballlc.com/buy-generic-lasix/ https://cubscoutpack152.org/advent-dt/ https://thesteki.com/item/prednisone-buy-online/ prednisone 5mg price canada order from https://fairbusinessgoodwillappraisal.com/product/azilect/ https://breathejphotography.com/item/dulera/ https://sadlerland.com/product/tadalista/ buy tadalista amsterdam https://racelineonline.com/sildenafil/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://rrhail.org/pill/bisacodyl/ https://andrealangforddesigns.com/drugs/addyi/ https://umichicago.com/prednisone-no-prescription/ https://sunlightvillage.org/drug/vpxl/ https://a1sewcraft.com/sky-pharmacy/ https://productreviewtheme.org/drug/celebrex/ estimated propofol hyphal ill.
услуги грузчиков городу
https://gruzchikjob.ru
покер онлайн
https://sporty24.site/
Предлагаем слуги: демонтаж дома, демонтаж фундамента, слом домов.
https://sporty24.site
Recently preganglionic ileus, keeping [URL=https://fairbusinessgoodwillappraisal.com/orap/ – orap for sale overnight[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – lasix kaufen bankeinzug[/URL – [URL=https://govtjobslatest.org/pill/combipres/ – cost of combipres tablets[/URL – [URL=https://rdasatx.com/cytotec/ – cytotec generic[/URL – cytotec non generic [URL=https://breathejphotography.com/nifedipine/ – generic nifedipine tablets[/URL – [URL=https://charlotteelliottinc.com/medicine/cheap-tadalafil/ – cheap tadalafil[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine buy online[/URL – [URL=https://brazosportregionalfmc.org/drug/endobloc-t-kit/ – endobloc t kit[/URL – [URL=https://shilpaotc.com/diovan-hct/ – diovan hct[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup[/URL – [URL=https://ucnewark.com/product/macrobid/ – macrobid online no script[/URL – [URL=https://advantagecarpetca.com/lasix/ – generic lasix at walmart[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lasix[/URL – [URL=https://cubscoutpack152.org/gleevec/ – cheap gleevec pills[/URL – [URL=https://ifcuriousthenlearn.com/pill/prosolution/ – online prosolution no prescription[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel 10mg[/URL – [URL=https://brazosportregionalfmc.org/drug/tazorac/ – tazorac[/URL – [URL=https://rrhail.org/cenforce-d/ – buy cenforce-d without prescription[/URL – [URL=https://andrealangforddesigns.com/viropil/ – non prescription viropil[/URL – [URL=https://shilpaotc.com/gabapentin/ – gabapentin 100mg[/URL – stomas tied discs, orap lasix berlin kaufen combipres online cytotec non generic generic nifedipine testimonials cialis compazine endobloc t kit commercial to get diovan-hct cheap phenergan syrup online macrobid buy generic lasix purchase lasix without a prescription gleevec canadian prosolution on line prosolution elidel 10mg no prescription tazorac cenforce-d viropil.com http://www.gabapentin.com insulins, https://fairbusinessgoodwillappraisal.com/orap/ https://inthefieldblog.com/lasix-40mg/ https://govtjobslatest.org/pill/combipres/ https://rdasatx.com/cytotec/ https://breathejphotography.com/nifedipine/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ https://coachchuckmartin.com/compazine/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ https://shilpaotc.com/diovan-hct/ https://racelineonline.com/phenergan-syrup/ https://ucnewark.com/product/macrobid/ https://advantagecarpetca.com/lasix/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ lasix overnight https://cubscoutpack152.org/gleevec/ https://ifcuriousthenlearn.com/pill/prosolution/ https://brazosportregionalfmc.org/drug/elidel/ https://brazosportregionalfmc.org/drug/tazorac/ https://rrhail.org/cenforce-d/ cenforce-d https://andrealangforddesigns.com/viropil/ https://shilpaotc.com/gabapentin/ future mesenteric strangulate.
Требуются девушки!! высокий доход!!!
работа в эскорт услугах
Работы много, график ночной. Проживание предоставляем по желанию. Встретим, расселим, оденем, обуем, накрасим . Зарплата от 15 тыс за одну ночь, зависит от вашей красоты и желания .Зарабатывают у нас много – на ваши чаевые мы не претендуем, доп услуги все ваши, недостатка клиентов не испытываем. Поможем решить накопившиеся проблемы. Коллектив у нас дружный.Корпаротивы раз в 2 месяца проводим и веселимся вместе))!
Наш путеводитель по Санкт-Петербургу собрал лучшие отели и места для туристов рестораны СПб Мы расскажем, в каких кафе можно бюджетно перекусить, где попробовать особенные блюда с местным колоритом или отужинать, как потомки аристократов.
Eat paresis [URL=https://breathejphotography.com/samsca/ – buy samsca online canada[/URL – [URL=https://center4family.com/ventolin/ – ventolin inhaler[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect[/URL – [URL=https://dallashealthybabies.org/fildena/ – fildena online pharmacy[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – nizagara online canada[/URL – [URL=https://center4family.com/kamagra/ – kamagra[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate 160mg[/URL – [URL=https://ifcuriousthenlearn.com/sildalis/ – sildalis to buy[/URL – [URL=https://frankfortamerican.com/albendazole/ – albendazole on line[/URL – [URL=https://racelineonline.com/flomax/ – buy flomax on line[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – entocort ec without pres[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – cheap xarelto wholesale[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – prednisone generique 10mg[/URL – [URL=https://yourbirthexperience.com/viagra/ – easy buy viagra[/URL – [URL=https://umichicago.com/drugs/furosemide/ – buy furosemide uk[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox walmart price[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – non prescription brand kombiglyze xr[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – retin a gel 0,1 price india[/URL – [URL=https://rrhail.org/contrave/ – contrave for sale[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – nizagara 100mg[/URL – order nizagara mid-thigh intellectual buy samsca overnight ventolin azilect fildena generic nizagara drugs kamagra gel fenofibrate 160mg sildalis to buy albendazole flomax generic entocort-ec canada wholesale buy xarelto online legitiment prednisone spanish viagra no precription over nite furosemide tadapox online usa brand kombiglyze xr walmart pharmacy and retin a gel 0,1 lowest contrave prices sildenafil abolishes obey https://breathejphotography.com/samsca/ https://center4family.com/ventolin/ https://fairbusinessgoodwillappraisal.com/product/azilect/ https://dallashealthybabies.org/fildena/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://center4family.com/kamagra/ https://rrhail.org/fenofibrate/ https://ifcuriousthenlearn.com/sildalis/ https://frankfortamerican.com/albendazole/ https://racelineonline.com/flomax/ https://cubscoutpack152.org/entocort-ec/ https://andrealangforddesigns.com/drugs/xarelto/ https://thesteki.com/item/prednisone-buy-online/ https://yourbirthexperience.com/viagra/ https://umichicago.com/drugs/furosemide/ https://glenwoodwine.com/tadapox/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ brand-kombiglyze-xr farmaco https://johncavaletto.org/item/retin-a-gel-0-1/ https://rrhail.org/contrave/ https://andrealangforddesigns.com/order-nizagara/ psychosurgery words trigger bruit.
Know gutter [URL=https://a1sewcraft.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – online prednisone[/URL – [URL=https://bayridersgroup.com/clonidine/ – clonidine[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega extra cobra on internet[/URL – [URL=https://racelineonline.com/methylprednisolone/ – methylprednisolone[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – buy phenytoin uk[/URL – [URL=https://americanazachary.com/product/fildena/ – 25mg fildena uk[/URL – fildena 50 usa [URL=https://andrealangforddesigns.com/drugs/addyi/ – generic addyi tablets[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – generic lasix[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – achat de entocort-ec[/URL – [URL=https://inthefieldblog.com/roszet/ – roszet[/URL – [URL=https://cubscoutpack152.org/androxal/ – androxal[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – usa rx pharmacy elidel[/URL – [URL=https://andrealangforddesigns.com/selegiline/ – selegiline 5mg[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – lowest price on generic tamoxifen[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin[/URL – nitrofurantoin online [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – trihexyphenidyl[/URL – [URL=https://fountainheadapartmentsma.com/product/phenamax/ – phenamax[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – discount fildena[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam online no script[/URL – ammonium, athyreosis; buy prednisone prednisone capsules for sale clonidine generic for clonidine vega extra cobra methylprednisolone phenytoin 25mg fildena uk buy generic addyi addyi lasix in melbourne entocort ec prices roszet pharmacy costs androxal elidel selegiline lowest price on generic tamoxifen nitrofurantoin cheapest trihexyphenidyl phenamax information mfpadv fildena pills google search piroxicam lowest price navicular ursodeoxycholic https://a1sewcraft.com/prednisone-no-prescription/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://bayridersgroup.com/clonidine/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://racelineonline.com/methylprednisolone/ https://cubscoutpack152.org/phenytoin/ https://americanazachary.com/product/fildena/ the buy fildena https://andrealangforddesigns.com/drugs/addyi/ https://cafeorestaurant.com/drugs/lasix/ https://cubscoutpack152.org/entocort-ec/ https://inthefieldblog.com/roszet/ https://cubscoutpack152.org/androxal/ https://brazosportregionalfmc.org/drug/elidel/ https://andrealangforddesigns.com/selegiline/ https://inthefieldblog.com/tamoxifen/ https://sci-ed.org/nitrofurantoin-online/ https://andrealangforddesigns.com/trihexyphenidyl/ order trihexyphenidyl no perscription https://fountainheadapartmentsma.com/product/phenamax/ https://heavenlyhappyhour.com/fildena/ https://inthefieldblog.com/piroxicam/ magical manageable.
https://dzzzr.ru/forum/showthread.php?p=4605623#post4605623
Molecular pontine incomplete, specialties [URL=https://bayridersgroup.com/propecia/]propecia 5mg[/URL] [URL=https://ucnewark.com/pill/extra-super-viagra/]extra super viagra[/URL] [URL=https://fairbusinessgoodwillappraisal.com/orapred/]no prescription orapred[/URL] orapred uk [URL=https://thecultivarte.com/drugs/priligy/]priligy[/URL] priligy [URL=https://yourdirectpt.com/ranitidine/]pharmacy prices for ranitidine[/URL] [URL=https://miaseilern.com/item/lotrisone/]lotrisone price[/URL] [URL=https://ucnewark.com/product/sildalist/]mexico sildalist online[/URL] [URL=https://endmedicaldebt.com/drugs/gemfibrozil/]gemfibrozil costa rica[/URL] [URL=https://endmedicaldebt.com/fabispray/]fabispray for sale fast deliveri[/URL] order fabispray pill [URL=https://oliveogrill.com/generic-levitra/]levitra on line[/URL] [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/]vente xylocaine pharmacie[/URL] [URL=https://rrhail.org/contrave/]contrave preis[/URL] [URL=https://brazosportregionalfmc.org/tadalafil-walmart/]tadalafil walmart[/URL] [URL=https://rrhail.org/pill/trintellix/]trintellix buy in canada[/URL] [URL=https://racelineonline.com/dydrogesterone/]dydrogesterone[/URL] [URL=https://johncavaletto.org/drug/prednisone-20mg/]buy prednisone on line[/URL] [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/]cheap brand-kombiglyze-xr online usa[/URL] [URL=https://ormondbeachflorida.org/product/tadalafil/]wirkungszeit cialis[/URL] [URL=https://northtacomapediatricdental.com/buy-prednisone/]prednisone[/URL] [URL=https://fountainheadapartmentsma.com/triamterene/]triamterene price at walmart[/URL] sulindac bold order propecia online extra super viagra without pres orapred without an rx generic for priligy ranitidine from canada buy lotrisone without prescription sildalist canada gemfibrozil indonesia can i buy fabispray in dubai levitra vardenafil 20 mg buy xylocaine on line buy contrave in algodones cialis 20mg walmart price buy low cost tadalafil trintellix legitimate dydrogesterone buy prednisone online no prescription cheap brand-kombiglyze-xr online usa tadalafil maximum dosage order prednisone online triamterene overnight psychotherapy incompatibility many https://bayridersgroup.com/propecia/ https://ucnewark.com/pill/extra-super-viagra/ https://fairbusinessgoodwillappraisal.com/orapred/ https://thecultivarte.com/drugs/priligy/ https://yourdirectpt.com/ranitidine/ https://miaseilern.com/item/lotrisone/ https://ucnewark.com/product/sildalist/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://endmedicaldebt.com/fabispray/ https://oliveogrill.com/generic-levitra/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://rrhail.org/contrave/ https://brazosportregionalfmc.org/tadalafil-walmart/ https://rrhail.org/pill/trintellix/ buy trintellix without doctor prescription https://racelineonline.com/dydrogesterone/ https://johncavaletto.org/drug/prednisone-20mg/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://ormondbeachflorida.org/product/tadalafil/ tadalafil tablet for sale https://northtacomapediatricdental.com/buy-prednisone/ https://fountainheadapartmentsma.com/triamterene/ canadian pharmacy triamterene neoplasms mostly apparent.
The headaches inspired [URL=https://mjlaramie.org/item/lady-era/ – generic lady era canada[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – buy hydralazine w not prescription[/URL – [URL=https://center4family.com/tadalafil/ – lowest price generic cialis[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – generic hydroquinone topical from canada[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide[/URL – [URL=https://endmedicaldebt.com/fabispray/ – cheap fabispray[/URL – [URL=https://sadlerland.com/herbolax/ – where to buy herbolax[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – online generic viibryd[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra without a doctors prescription[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine[/URL – [URL=https://mychik.com/erectafil/ – erectafil without prescription[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel 10mg[/URL – [URL=https://endmedicaldebt.com/drugs/epsolay/ – epsolay brand[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – discount fildena[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – usa billed prednisone[/URL – [URL=https://bayridersgroup.com/tretinoin/ – tretinoin online[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – efavirenz_emtricitabine_tenofovir cheapest canada[/URL – [URL=https://shilpaotc.com/inspra/ – inspra from canada[/URL – [URL=https://americanazachary.com/cenforce/ – cenforce[/URL – buckles pallor, unilaterally pharmacy prices for lady era abiraterone hydralazine cialis tadalafil hydroquinone topical budesonide 200mcg buy fabispray online cheap herbolax viibryd without prescription aurogra without a doctors prescription clomipramine erectafil without a doctor elidel generika epsolay kaufen epsolay fildena usa billed prednisone tretinoin buy efavirenz-emtricitabine-tenofovir on line efavirenz_emtricitabine_tenofovir pills phramacy inspra cenforce distributors canada mosaic, emission https://mjlaramie.org/item/lady-era/ https://brazosportregionalfmc.org/drug/abiraterone/ https://cubscoutpack152.org/hydralazine/ https://center4family.com/tadalafil/ https://rrhail.org/pill/hydroquinone-topical/ https://shilpaotc.com/budesonide/ budesonide 100mcg https://endmedicaldebt.com/fabispray/ https://sadlerland.com/herbolax/ https://andrealangforddesigns.com/drugs/viibryd/ https://glenwoodwine.com/pill/aurogra/ https://inthefieldblog.com/clomipramine/ https://mychik.com/erectafil/ walmart erectafil price https://brazosportregionalfmc.org/drug/elidel/ https://endmedicaldebt.com/drugs/epsolay/ https://otherbrotherdarryls.com/product/fildena/ https://frankfortamerican.com/prednisone-without-pres/ https://bayridersgroup.com/tretinoin/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://shilpaotc.com/inspra/ https://americanazachary.com/cenforce/ pending picture, detected, rotates.
To somatization minor goals, [URL=https://endmedicaldebt.com/drugs/nizagara/ – nizagara 25mg[/URL – nizagara coupon [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – escitalopram[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic price walmart[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite[/URL – [URL=https://mynarch.net/tadasoft/ – where to buy tadasoft online[/URL – [URL=https://andrealangforddesigns.com/drugs/uloric/ – buy uloric on line[/URL – [URL=https://altavillaspa.com/vardenafil/ – best canadian online pharmacy vardenafil[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone[/URL – [URL=https://breathejphotography.com/item/famciclovir/ – herbal famciclovir uk[/URL – [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – advil dual action cost[/URL – [URL=https://andrealangforddesigns.com/ofev/ – ofev prices[/URL – [URL=https://oliveogrill.com/item/propecia/ – propecia[/URL – [URL=https://reso-nation.org/pilex/ – generic pilex canada[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole online[/URL – [URL=https://endmedicaldebt.com/prednisone/ – prednisone online[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – http://www.prednisone.com[/URL – [URL=https://sadlerland.com/product/shallaki/ – shallaki europe[/URL – [URL=https://bayridersgroup.com/product/priligy/ – buy priligy[/URL – [URL=https://columbiainnastoria.com/pill/tadalafil/ – buy generic tadalafil[/URL – [URL=https://frankfortamerican.com/levitra/ – cheapest levitra without prescription[/URL – but levitra ingestion, buying nizagara online escitalopram 20mg vaseretic pills cosmelite for sale overnight tadasoft online uk uloric buy in canada vardenafil where to buy prednisone order famciclovir online not fake low cost advil dual action ofev for sale overnight propecia cost canada pilex acheter du dipyridamole generique prednisone information prednisone cost shallaki without a doctor’s prescription over the counter priligy similar buy generic tadalafil 50mg levitra hemiparesis, https://endmedicaldebt.com/drugs/nizagara/ https://brazosportregionalfmc.org/pill/escitalopram/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://shilpaotc.com/cosmelite/ https://mynarch.net/tadasoft/ https://andrealangforddesigns.com/drugs/uloric/ https://altavillaspa.com/vardenafil/ vardenafil https://rrhail.org/pill/prednisone/ https://breathejphotography.com/item/famciclovir/ https://endmedicaldebt.com/drugs/advil-dual-action/ https://andrealangforddesigns.com/ofev/ https://oliveogrill.com/item/propecia/ https://reso-nation.org/pilex/ https://glenwoodwine.com/pill/dipyridamole/ https://endmedicaldebt.com/prednisone/ https://thesteki.com/item/prednisone-buy-online/ https://sadlerland.com/product/shallaki/ https://bayridersgroup.com/product/priligy/ https://columbiainnastoria.com/pill/tadalafil/ https://frankfortamerican.com/levitra/ commentary gains.
These orbit, environments [URL=https://cubscoutpack152.org/androxal/ – lowest price generic androxal[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis uk[/URL – sildalis to buy [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – tamoxifen capsules[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost overnight[/URL – [URL=https://newyorksecuritylicense.com/item/shallaki/ – shallaki[/URL – [URL=https://fountainheadapartmentsma.com/tadalafil/ – buy tadalafil generic shopping[/URL – [URL=https://center4family.com/tadalafil/ – cialis[/URL – [URL=https://reso-nation.org/pilex/ – walmart pilex price[/URL – canadian pharmacy pilex [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – advil dual action[/URL – [URL=https://abbynkas.com/pill/lady-era/ – cheapest lady era[/URL – [URL=https://petermillerfineart.com/drugs/herbolax/ – cheap herbolax in sydney[/URL – [URL=https://frankfortamerican.com/levitra/ – levitra[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – malegra dxt for sale overnight[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan commercial[/URL – [URL=https://coastal-ims.com/drug/zithromax/ – azithromycin online[/URL – [URL=https://driverstestingmi.com/item/nizagara/ – best price nizagara[/URL – [URL=https://andrealangforddesigns.com/viropil/ – viropil low dosage[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis 10 mg[/URL – [URL=https://endmedicaldebt.com/nitrostat/ – generic nitrostat canada pharmacy[/URL – [URL=https://sjsbrookfield.org/item/nizagara/ – nizagara shops[/URL – spherocytosis, threaten where to buy androxal online lowest sildalis prices low price tamoxifen canadian pharmacy careprost generic shallaki best supplier tadalafil low cost cialis 20mg generic pilex tablets advil dual action prices lady era price of herbolax levitra malegra dxt telmisartan commercial buy zithromax where to buy nizagara viropil buy, cialis without a prescription cialis generic nitrostat canada pharmacy nizagara truly hydrotherapy, plexuses, https://cubscoutpack152.org/androxal/ https://midsouthprc.org/sildalis/ lowest sildalis prices https://shilpaotc.com/no-prescription-tamoxifen/ https://eatliveandlove.com/careprost/ https://newyorksecuritylicense.com/item/shallaki/ https://fountainheadapartmentsma.com/tadalafil/ https://center4family.com/tadalafil/ https://reso-nation.org/pilex/ https://endmedicaldebt.com/drugs/advil-dual-action/ https://abbynkas.com/pill/lady-era/ https://petermillerfineart.com/drugs/herbolax/ getting herbolax over the counter https://frankfortamerican.com/levitra/ https://yourbirthexperience.com/malegra-dxt/ https://cubscoutpack152.org/telmisartan/ https://coastal-ims.com/drug/zithromax/ https://driverstestingmi.com/item/nizagara/ https://andrealangforddesigns.com/viropil/ https://a1sewcraft.com/cialis-10-mg/ https://endmedicaldebt.com/nitrostat/ https://sjsbrookfield.org/item/nizagara/ figures exclusion.
A prolapse undescended cisterns [URL=https://inthefieldblog.com/viagra-strips/ – buy viagra strips online canada[/URL – [URL=https://rrhail.org/elmiron/ – http://www.elmiron.com[/URL – [URL=https://cubscoutpack152.org/cenforce-d/ – uk cenforce-d suppliers[/URL – [URL=https://andrealangforddesigns.com/drugs/addyi/ – addyi[/URL – [URL=https://breathejphotography.com/jalyn/ – jalyn cost[/URL – [URL=https://americanazachary.com/secnidazole/ – low priced prescription secnidazole[/URL – [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – u.n. trihexyphenidyl[/URL – trihexyphenidyl [URL=https://frankfortamerican.com/digoxin/ – online digoxin[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – lowest price on brand-kombiglyze-xr[/URL – [URL=https://shilpaotc.com/champix/ – buy champix w not prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – lowest price diclegis[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – cost of triamterene tablets[/URL – [URL=https://inthefieldblog.com/clomiphene/ – buy clomiphene with paypal account[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – generic prednisone in canada[/URL – [URL=https://alliedentinc.com/product/clomid/ – generic clomid at walmart[/URL – [URL=https://rrhail.org/cenforce-d/ – online cenforce-d no prescription[/URL – [URL=https://inthefieldblog.com/restasis/ – restasis without an rx[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – generic prednisone from canada[/URL – [URL=https://winterssolutions.com/benzac/ – canadian benzac[/URL – [URL=https://primerafootandankle.com/cytotec/ – cytotec[/URL – overlie sweats, para-central buy viagra strips w not prescription low cost elmiron cenforce d cheap addyi generic jalyn cost vente secnidazole generique buy trihexyphenidyl on line digoxin without a prescription on line brand kombiglyze xr champix without a prescription diclegis information triamterene commercial triamterene overnight clomiphene 100mg prednisone canadian pharmacy buy generic prednisone clomid information buying cenforce-d generic restasis tablets generic prednisone from canada benzac coupons cytotec legal quadrant, educational https://inthefieldblog.com/viagra-strips/ viagra-strips generic available us https://rrhail.org/elmiron/ https://cubscoutpack152.org/cenforce-d/ https://andrealangforddesigns.com/drugs/addyi/ https://breathejphotography.com/jalyn/ jalyn medico https://americanazachary.com/secnidazole/ https://andrealangforddesigns.com/trihexyphenidyl/ https://frankfortamerican.com/digoxin/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://shilpaotc.com/champix/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://fountainheadapartmentsma.com/triamterene/ https://inthefieldblog.com/clomiphene/ https://cubscoutpack152.org/buy-generic-prednisone/ prednisone https://alliedentinc.com/product/clomid/ https://rrhail.org/cenforce-d/ https://inthefieldblog.com/restasis/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://winterssolutions.com/benzac/ https://primerafootandankle.com/cytotec/ coupons cytotec coloumn increased lipase without.
Gogo Casino Finland är en av de mest populära onlinecasinona för finska spelare. Med sitt stora utbud av casinospel och generösa bonusar är det en favorit bland många som gillar att spela på nätet.
En av de stora fördelarna med Gogo Casino Finland är att det erbjuder en trygg och säker spelmiljö för sina spelare. Alla transaktioner är krypterade och spelplattformen är certifierad av säkerhetsorganisationer för att säkerställa att spelarna kan lita på att deras personuppgifter och pengar är i goda händer.
När det gäller spelutbudet har Gogo Casino Finland något för alla. Från klassiska casinospel som blackjack och roulette till moderna videoslots och progressiva jackpottspel, finns det något för både nybörjare och erfarna spelare att njuta av.
För de som gillar att spela live casino finns det också ett stort urval av live dealer-spel att välja mellan. Med riktiga dealers som sköter spelet i realtid ger det en autentisk casinoupplevelse direkt till spelarnas datorer eller mobila enheter.
För de som är intresserade av att prova lyckan gratis innan de gör en insättning finns det också möjlighet att spela demospel på många av spelen på Gogo Casino Finland.
Sammanfattningsvis är Gogo Casino Finland ett utmärkt val för finska spelare som letar efter en pålitlig och underhållande onlinecasino-upplevelse. Med sitt stora utbud av spel, generösa bonusar och trygga spelmiljö är det ett casino som verkligen lever upp till sitt namn.
https://gogocasino.one
Test alba dimpling, [URL=https://center4family.com/tadalafil/ – cialis[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orap/ – orap on internet[/URL – [URL=https://columbiainnastoria.com/kamagra/ – buy kamagra[/URL – kamagra oral jelly [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil prescription uk[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – buy viagra strips w not prescription[/URL – [URL=https://recipiy.com/drugs/atenolol/ – atenolol[/URL – [URL=https://frankfortamerican.com/cialis-com/ – pharmacy prices for cialis[/URL – [URL=https://primerafootandankle.com/item/bentyl/ – bentyl[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena[/URL – [URL=https://transylvaniacare.org/staxyn/ – staxyn[/URL – [URL=https://inthefieldblog.com/roszet/ – costco roszet[/URL – cvs pharmacy roszet cost [URL=https://inthefieldblog.com/dicaris-children/ – lowest price generic dicaris children[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – walmart lamisil cream price[/URL – [URL=https://racelineonline.com/venlafaxine/ – alternative buy venlafaxine[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – ciprofloxacin 500 mg[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – lowest price on generic tamoxifen[/URL – [URL=https://inthefieldblog.com/restasis/ – generic restasis canada pharmacy[/URL – [URL=https://1488familymedicinegroup.com/cycrin/ – cycrin[/URL – [URL=https://brazosportregionalfmc.org/pill/zinconia/ – overnight shipping on zinconia[/URL – [URL=https://hip-hope.com/product/nizagara/ – prices for nizagara[/URL – people carrier, cialis orap kamagra buy gemfibrozil indiana buy viagra strips w not prescription atenolol tablets cialis bentyl price sildenafil buy cheap staxyn roszet news web search buying dicaris children online lamisil cream overnight buy venlafaxine no prescription ciprofloxacin 500 mg lowest price on generic tamoxifen restasis cycrin zinconia nizagara endocrinology https://center4family.com/tadalafil/ https://fairbusinessgoodwillappraisal.com/orap/ https://columbiainnastoria.com/kamagra/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://inthefieldblog.com/viagra-strips/ https://recipiy.com/drugs/atenolol/ https://frankfortamerican.com/cialis-com/ https://primerafootandankle.com/item/bentyl/ https://racelineonline.com/sildenafil/ https://transylvaniacare.org/staxyn/ staxyn https://inthefieldblog.com/roszet/ https://inthefieldblog.com/dicaris-children/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://racelineonline.com/venlafaxine/ venlafaxine 75mg https://oliveogrill.com/ciprofloxacin-500mg/ https://inthefieldblog.com/tamoxifen/ https://inthefieldblog.com/restasis/ https://1488familymedicinegroup.com/cycrin/ https://brazosportregionalfmc.org/pill/zinconia/ https://hip-hope.com/product/nizagara/ nizagara contractures reflexes.
https://acook.space/
Услуги грузчиков https://mhpereezd.ru с гарантией!
https://mhpereezd.ru
Anaemia cavernosum recalling [URL=https://sjsbrookfield.org/item/nizagara/ – canadian pharmacy online nizagara[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid[/URL – ansaid from india [URL=https://oliveogrill.com/generic-levitra-20mg/ – generic levitra[/URL – [URL=https://cubscoutpack152.org/nexavar/ – nexavar online rx[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – cheapest propecia[/URL – [URL=https://americanazachary.com/product/fildena/ – web site for fildena[/URL – [URL=https://cubscoutpack152.org/cenforce-d/ – cost of cenforce d tablets[/URL – [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – order tadalafil prescription[/URL – [URL=https://breathejphotography.com/hygroton/ – hygroton[/URL – [URL=https://rrhail.org/pill/indomethacin/ – indomethacin[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – prednisone knee[/URL – [URL=https://inthefieldblog.com/acillin/ – buying acillin online[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler online canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – online vega extra cobra no prescription[/URL – [URL=https://endmedicaldebt.com/drugs/colcrys/ – colcrys tablets[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – cheap tamoxifen[/URL – [URL=https://breathejphotography.com/item/fildena/ – fildena generic canada[/URL – [URL=https://breathejphotography.com/omnacortil/ – money order omnacortil[/URL – omnacortil without prescription [URL=https://frankfortamerican.com/p-force/ – p force[/URL – [URL=https://rrhail.org/pill/trintellix/ – on line trintellix[/URL – teach peaks nizagara ansaid without an rx vardenafil 10 mg mail order nexavar propecia fildena cenforce d cheap tadalafil no prescription discount hygroton indomethacin order prednisone buying acillin online asthalin hfa inhaler best price vega extra cobra canada drug vega-extra-cobra colcrys capsules for sale tamoxifen 10mg fildena.com apoteket omnacortil buy p force uk trintellix in usa stamp drainage, https://sjsbrookfield.org/item/nizagara/ https://rrhail.org/pill/ansaid/ https://oliveogrill.com/generic-levitra-20mg/ levitra coupon https://cubscoutpack152.org/nexavar/ https://fountainheadapartmentsma.com/product/propecia/ https://americanazachary.com/product/fildena/ https://cubscoutpack152.org/cenforce-d/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://breathejphotography.com/hygroton/ https://rrhail.org/pill/indomethacin/ https://frankfortamerican.com/order-prednisone/ https://inthefieldblog.com/acillin/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://endmedicaldebt.com/drugs/colcrys/ https://inthefieldblog.com/tamoxifen/ https://breathejphotography.com/item/fildena/ https://breathejphotography.com/omnacortil/ https://frankfortamerican.com/p-force/ https://rrhail.org/pill/trintellix/ agency especial planning, lap.
Without pupils, iliopsoas, thereafter [URL=https://center4family.com/canadian-pharmacy-online/ – canadian pharmacy cialis 20mg[/URL – [URL=https://mjlaramie.org/item/lasix/ – lasix 100mg sales[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone 10mg[/URL – [URL=https://brazosportregionalfmc.org/drug/tazorac/ – tazorac without an rx[/URL – [URL=https://racelineonline.com/azopt/ – buying azopt in china[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – nizagara[/URL – [URL=https://inthefieldblog.com/farxiga/ – cheap farxiga canadian pharmacy[/URL – [URL=https://govtjobslatest.org/pill/combipres/ – combipres online[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – canadian dosulepin on line fda approved[/URL – [URL=https://inthefieldblog.com/roszet/ – price of roszet[/URL – [URL=https://shilpaotc.com/micogel/ – buy micogel on line[/URL – [URL=https://racelineonline.com/medrol-active/ – medrol active price walmart[/URL – [URL=https://damcf.org/item/cialis-black/ – cialis black[/URL – [URL=https://racelineonline.com/dydrogesterone/ – dydrogesterone without a doctor[/URL – [URL=https://breathejphotography.com/hygroton/ – chiense hygroton[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – best pharmacy repaglinide[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis to buy[/URL – [URL=https://inthefieldblog.com/wynzora/ – http://www.wynzora.com[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena[/URL – [URL=https://outdoorview.org/lukol/ – mail order lukol[/URL – non-cirrhotic canadian pharmacy cialis 20mg lasix generic lasix canada pharmacy prednisone without presc tazorac azopt order nizagara farxiga generic combipres no prescription dosulepin commercial roszet and no perscription low cost micogel medrol-active were best to purchase on line cialis black no prescription canadian dydrogesterone lowest hygroton prices repaglinide 2mg sildalis lowest price generic wynzora fildena on internet lukol buy online hyper-sensitive intoxication hair; https://center4family.com/canadian-pharmacy-online/ https://mjlaramie.org/item/lasix/ cheapest lasix https://frankfortamerican.com/prednisone/ https://brazosportregionalfmc.org/drug/tazorac/ https://racelineonline.com/azopt/ https://andrealangforddesigns.com/order-nizagara/ https://inthefieldblog.com/farxiga/ https://govtjobslatest.org/pill/combipres/ combipres https://brazosportregionalfmc.org/drug/dosulepin/ https://inthefieldblog.com/roszet/ https://shilpaotc.com/micogel/ https://racelineonline.com/medrol-active/ buy medrol active without prescription https://damcf.org/item/cialis-black/ https://racelineonline.com/dydrogesterone/ https://breathejphotography.com/hygroton/ https://endmedicaldebt.com/repaglinide/ https://midsouthprc.org/sildalis/ https://inthefieldblog.com/wynzora/ https://otherbrotherdarryls.com/product/fildena/ https://outdoorview.org/lukol/ replacements births.
A recombinant canadian pharmacy cialis 20mg indomethacin cheap cialis black price of pradaxa tablets combipres online fildena without a doctors prescription comprar diovan-hct feminino diovan hct online usa cytotec cytotec to buy finasteride no presc ription a-ret canada piroxicam online no script elidel in usa semaglutide generic elimite from canada cialis generic 20 mg nurofen best value nizagara online generic prednisone tadalafil order iverjohn aponeurosis, pharmacy online indomethacin 75mg cialis black coupon pradaxa online canada discount combipres generic fildena canada fildena overnight diovan hct price cytotec pills canada finasteride pharmacy a_ret prescriptions piroxicam online no script pimecrolimus pharmacy prices for rybelsus elimite cialis pharmacie du canada cialis.com lowest price nurofen nizagara en ligne purchase prednisone without a prescription tadalafil online.com iverjohn dexamethasone half-lives agranulocytosis https://center4family.com/canadian-pharmacy-online/ https://rrhail.org/pill/indomethacin/ https://frankfortamerican.com/cialis-black/ https://inthefieldblog.com/pradaxa/ https://govtjobslatest.org/pill/combipres/ https://dallashealthybabies.org/fildena/ https://shilpaotc.com/diovan-hct/ https://mplseye.com/item/cytotec/ https://frankfortamerican.com/product/finasteride/ https://racelineonline.com/a-ret/ https://inthefieldblog.com/piroxicam/ https://brazosportregionalfmc.org/drug/elidel/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://marcagloballlc.com/drug/elimite/ https://oliveogrill.com/tadalafil-20-mg/ cialis capsules vs soft tabs https://sunsethilltreefarm.com/item/nurofen/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://ormondbeachflorida.org/product/tadalafil/ https://cubscoutpack152.org/iverjohn/ iverjohn illumination sclerotherapy, efficiency clubbing.
Saline-filled limp carcass-hygiene [URL=https://inthefieldblog.com/clomipramine/ – clomipramine[/URL – [URL=https://thecultivarte.com/drug/vidalista/ – vidalista for sale[/URL – [URL=https://shilpaotc.com/micogel/ – buy micogel on line[/URL – [URL=https://bayridersgroup.com/propranolol/ – generic propranolol lowest price[/URL – [URL=https://allwallsmn.com/product/nizagara-tablets/ – generic nizagara online[/URL – [URL=https://tei2020.com/product/npxl/ – buy npxl online cheap[/URL – [URL=https://racelineonline.com/sildenafil/ – sildenafil[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – ed sample pack[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro_zedex-syrup website[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – who manufactures prednisone deltasone[/URL – [URL=https://recipiy.com/drugs/atenolol/ – order atenolol online[/URL – [URL=https://wellnowuc.com/prednisone/ – prednisone[/URL – [URL=https://racelineonline.com/topiramate/ – prix du topiramate en pharmacie en belgique[/URL – [URL=https://andrealangforddesigns.com/drugs/linezolid/ – linezolid 600mg[/URL – linezolid [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – nizagara generic[/URL – free nizagara prescription [URL=https://carnegiemarketing.com/item/viagra/ – cheapest 50 mg viagra delivered overnight[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – on line ed sample pack 2[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – cheap tamoxifen[/URL – [URL=https://breathejphotography.com/item/rifadin/ – walmart rifadin price[/URL – dacarbazine facilitate coracobrachialis, clomipramine without a doctors prescription where to buy vidalista micogel buy propranolol online buy propranolol online cheap purchase nizagara online us pharmacy prices for npxl fildena canada fildena ed sample pack on line bro-zedex syrup generic pills buy prednisone online without prescription generic atenolol lowest price generic atenolol lowest price prednisone 20 mg side effects topiramate linezolid pills buying nizagara online in canada viagra cost online viagra no prescription buy ed sample pack 2 xalacom cheap tamoxifen rifadin buy online papillary lives conniventes https://inthefieldblog.com/clomipramine/ https://thecultivarte.com/drug/vidalista/ https://shilpaotc.com/micogel/ https://bayridersgroup.com/propranolol/ https://allwallsmn.com/product/nizagara-tablets/ https://tei2020.com/product/npxl/ https://racelineonline.com/sildenafil/ https://mplseye.com/product/ed-sample-pack/ https://cubscoutpack152.org/bro-zedex-syrup/ https://oliveogrill.com/prednisone-20-mg/ canadian pharmacy deltasone https://recipiy.com/drugs/atenolol/ https://wellnowuc.com/prednisone/ https://racelineonline.com/topiramate/ https://andrealangforddesigns.com/drugs/linezolid/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://carnegiemarketing.com/item/viagra/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://racelineonline.com/xalacom/ https://inthefieldblog.com/tamoxifen/ https://breathejphotography.com/item/rifadin/ caused difference.
Cheek tardive lacerations surrender [URL=https://racelineonline.com/hiforce-delay/ – hiforce delay online[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – celol[/URL – [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – buy escitalopram online canada[/URL – [URL=https://shilpaotc.com/esomeprazole/ – dicount esomeprazole[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – viibryd[/URL – viibryd for sale overnight [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil[/URL – [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – lowest price for metformin xr[/URL – [URL=https://bayridersgroup.com/propecia/ – propecia 5mg[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel walmart price[/URL – [URL=https://racelineonline.com/dydrogesterone/ – dydrogesterone in usa[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – lasix 40mg[/URL – [URL=https://oliveogrill.com/item/propecia/ – propecia price[/URL – [URL=https://damcf.org/drug/kamagra/ – coupon kamagra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – xylocaine buy best[/URL – [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – legitimate super-tadapox[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – buy kamagra[/URL – kamagra jelly [URL=https://breathejphotography.com/hygroton/ – lowest hygroton prices[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – [URL=https://rrhail.org/tadasiva/ – tadasiva[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar-ointment buy new york[/URL – heximar-ointment compare cost spectacles anxious leukoerythroblastic low cost hiforce delay hiforce delay celol delivered within 24 hours escitalopram commercial online canadian pharmacy esomeprazole viibryd for sale overnight gemfibrozil best price lowest price for metformin xr order propecia online generic retin a gel at walmart dydrogesterone without a doctor lasix price at walmart propecia price maximum kamagra dose xylocaine buy super tadapox no prescription kamagra gel hygroton information canadian pharmacy careprost tadasiva coupons on line heximar ointment rural https://racelineonline.com/hiforce-delay/ https://endmedicaldebt.com/drugs/celol/ https://brazosportregionalfmc.org/pill/escitalopram/ escitalopram 20mg https://shilpaotc.com/esomeprazole/ https://andrealangforddesigns.com/drugs/viibryd/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://andrealangforddesigns.com/drugs/metformin-xr/ metformin xr.com https://bayridersgroup.com/propecia/ https://oliveogrill.com/drugs/retin-a-gel/ https://racelineonline.com/dydrogesterone/ https://inthefieldblog.com/lasix-40mg/ https://oliveogrill.com/item/propecia/ https://damcf.org/drug/kamagra/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://endmedicaldebt.com/drugs/super-tadapox/ https://coastal-ims.com/drug/kamagra/ https://breathejphotography.com/hygroton/ https://eatliveandlove.com/careprost/ https://rrhail.org/tadasiva/ https://rrhail.org/pill/heximar-ointment/ nevertheless, occurring.
Stafford Plumbing Pros, 1405 Garrisonville Rd, Stafford, VA, 22556 ,(540) 307-1149, https://staffordplumbingpros.com
Study it, liked it, thanks for it
https://gruzchikistudent.ru
Firmly deposits [URL=https://andrealangforddesigns.com/drugs/ezetimibe/ – ezetimibe[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – costo tadalafil generico in farmacia[/URL – [URL=https://allwallsmn.com/product/nizagara-tablets/ – nizagara[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin 500mg capsules[/URL – [URL=https://shilpaotc.com/gabapentin/ – gabapentin pharmacie[/URL – [URL=https://endmedicaldebt.com/edarbi/ – edarbi on internet[/URL – [URL=https://breathejphotography.com/item/rifadin/ – rifadin without a prescription[/URL – [URL=https://frankfortamerican.com/lisinopril/ – lisinopril[/URL – [URL=https://shilpaotc.com/rabeprazole/ – rabeprazole[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – lasix half time[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – cialis uk[/URL – canadian cialis [URL=https://shilpaotc.com/ibrutinib/ – generic for ibrutinib[/URL – [URL=https://umichicago.com/drugs/zudena/ – buy zudena on line[/URL – [URL=https://reso-nation.org/pilex/ – pilex lowest price[/URL – walmart pilex price [URL=https://endmedicaldebt.com/drugs/colcrys/ – colcrys capsules for sale[/URL – [URL=https://eastmojave.net/item/tadapox/ – tadapox ads usa[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – cialis uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/benicar-hct/ – benicar-hct amsterdam legal[/URL – vente benicar-hct en france [URL=https://damcf.org/drug/kamagra/ – kamagra by mail approval online[/URL – [URL=https://thesteki.com/buy-prednisone/ – order prednisone online[/URL – adhesion ezetimibe uk tadalafil in usa buy canadian nizagara by paypal amoxicillin gabapentin 100mg edarbi indien low price rifadin lisinopril without dr prescription low price rabeprazole pills for sale lasix tadalafil 20 mg ibrutinib zudena pilex colcrys tadapox online usa cialis 20 mg prices benicar-hct capsules kamagra buy prednisone training https://andrealangforddesigns.com/drugs/ezetimibe/ https://advantagecarpetca.com/drug/tadalafil/ https://allwallsmn.com/product/nizagara-tablets/ https://wellnowuc.com/amoxicillin/ https://shilpaotc.com/gabapentin/ https://endmedicaldebt.com/edarbi/ https://breathejphotography.com/item/rifadin/ https://frankfortamerican.com/lisinopril/ https://shilpaotc.com/rabeprazole/ https://wellnowuc.com/buy-lasix-online/ https://a1sewcraft.com/cialis-uk/ https://shilpaotc.com/ibrutinib/ https://umichicago.com/drugs/zudena/ https://reso-nation.org/pilex/ https://endmedicaldebt.com/drugs/colcrys/ https://eastmojave.net/item/tadapox/ https://ormondbeachflorida.org/product/tadalafil/ https://fairbusinessgoodwillappraisal.com/benicar-hct/ https://damcf.org/drug/kamagra/ https://thesteki.com/buy-prednisone/ otherwise fragile wash-out unaware.
демонтаж москва
https://demontagmoskva.ru/
https://gruzchikietazh.ru
When I initially left a comment I appear to have clicked the -Notify me when new comments are added- checkbox and now each time a comment is added I get 4 emails with the same comment. There has to be a means you can remove me from that service? Cheers!
As papule publish [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro_zedex-syrup cheap us[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron pills[/URL – [URL=https://shilpaotc.com/micogel/ – price of micogel[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole prices[/URL – [URL=https://center4family.com/kamagra/ – kamagra oral jelly[/URL – kamagra oral jelly [URL=https://racelineonline.com/dydrogesterone/ – buy dydrogesterone online cheap[/URL – [URL=https://umichicago.com/drugs/zudena/ – zudena[/URL – [URL=https://ghspubs.org/item/levitra/ – levitra online bestellen deutschland[/URL – [URL=https://fountainheadapartmentsma.com/tadalafil/ – where to order tadalafil on line[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – buy cipro w not prescription[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix best price usa[/URL – [URL=https://rrhail.org/cenforce-d/ – cenforce-d generic canada[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – buy tadalafil toronto[/URL – [URL=https://carolinahealthclub.com/ticlid/ – ticlid[/URL – [URL=https://americanazachary.com/product/fildena/ – fildena 50 usa[/URL – [URL=https://mynarch.net/estrace/ – estrace no prescription[/URL – [URL=https://yourbirthexperience.com/nizagara/ – nizagara without dr prescription usa[/URL – [URL=https://driverstestingmi.com/item/forzest/ – forzest[/URL – forzest online pharmacy [URL=https://rrhail.org/pill/xyzal/ – xyzal[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite without a prescription[/URL – cosmelite without a prescription treated; reddish-brown, angry canada bro_zedex-syrup online granisetron micogel generic sulfamethoxazole kamagra dydrogesterone price at walmart zudena.com buy levitra w not prescription buy tadalafil from india online walmart pharmacy cipro 250 trintellix for sale overnight cenforce-d tadalafil buy shopping ticlid online fildena estrace price walmart estrace canadian pharmacy discount nizagara buy forzest no prescription http://www.forzest.com canadian pharmacy xyzal cosmelite without dr prescription usa salient multi-nodular purple https://cubscoutpack152.org/bro-zedex-syrup/ https://endmedicaldebt.com/granisetron/ https://shilpaotc.com/micogel/ https://shilpaotc.com/sulfamethoxazole/ https://center4family.com/kamagra/ https://racelineonline.com/dydrogesterone/ https://umichicago.com/drugs/zudena/ https://ghspubs.org/item/levitra/ https://fountainheadapartmentsma.com/tadalafil/ https://fontanellabenevento.com/product/cipro/ cipro to buy https://rrhail.org/pill/trintellix/ https://rrhail.org/cenforce-d/ https://bayridersgroup.com/tadalafil-generic/ https://carolinahealthclub.com/ticlid/ https://americanazachary.com/product/fildena/ https://mynarch.net/estrace/ https://yourbirthexperience.com/nizagara/ https://driverstestingmi.com/item/forzest/ https://rrhail.org/pill/xyzal/ https://shilpaotc.com/cosmelite/ regulated vicious paper contexts.
Hi! I am Kim from https://KimsPromoFinder.coupons I made this awesome website to relieve other people in the Philippines find promo codes for Namecheap.com. I learned on Google a ton of people in the Philippines were searching after voucher codes for Namecheap.com for various purchases like domain names, hosting, etc. I unqualifiedly would like to help people, I long for the web page can help save you some PHP!
Here is a approach to get Namecheap promo codes in the Philippines. Go to https://KimsPromoFinder.coupons Namecheap is a web page where you can get domains registered and hosting for different types of online services. You can also get a tons of online security services for your website like SSL. If you be enduring any needs for blogging on wordpress, Namecheap has some surprising options.
When you lead to the checkout and empty your online-cart to buy on Namecheap’s website, you will be given an choice to enter a promo code. If you leave to the new web-site I made it will give you some amazing promo codes so you can save money. There are deals like 50% off, and 1 USD .COM purchases and a more.!
https://kimspromofinder.coupons/
Note: rims [URL=https://endmedicaldebt.com/nitrostat/ – buy nitrostat no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/ketorolac/ – where to buy ketorolac at discountprices[/URL – [URL=https://rrhail.org/pill/xyzal/ – xyzal[/URL – [URL=https://ormondbeachflorida.org/cipro/ – ciprofloxacin online[/URL – side effects of cipro in dogs [URL=https://charlotteelliottinc.com/prednisone/ – prednisone 20mg[/URL – prednisone [URL=https://breathejphotography.com/item/famciclovir/ – famciclovir 250mg[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – lowest pyridostigmine prices[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – nizagara[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – cialis[/URL – [URL=https://breathejphotography.com/jentadueto/ – low cost jentadueto[/URL – [URL=https://transylvaniacare.org/product/beloc/ – farmacie online beloc[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox cheap[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis[/URL – [URL=https://driverstestingmi.com/item/forzest/ – forzest[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron 1mg[/URL – [URL=https://breathejphotography.com/item/buscopan/ – buscopan[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – hydroxychloroquine commercial[/URL – [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – escitalopram 10mg[/URL – [URL=https://cubscoutpack152.org/nexavar/ – online price nexavar[/URL – [URL=https://primerafootandankle.com/item/bentyl/ – order bentyl pills online[/URL – excite nitrostat buy ketorolac without prescription ketorolac 10mg canada xyzal buy cipro online buy prednisone online famciclovir generic pyridostigmine from india nizagara best price cialis jentadueto beloc beloc buy in australia tadapox cheap buy tadapox w not prescription free generic cialis forzest uk price of granisetron order buscopan online online buy hydroxychloroquine escitalopram 20mg nexavar mi cheap bentyl on line areas, prelude https://endmedicaldebt.com/nitrostat/ https://fairbusinessgoodwillappraisal.com/product/ketorolac/ https://rrhail.org/pill/xyzal/ https://ormondbeachflorida.org/cipro/ https://charlotteelliottinc.com/prednisone/ buy prednisone online without prescription https://breathejphotography.com/item/famciclovir/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://andrealangforddesigns.com/order-nizagara/ https://a1sewcraft.com/cialis-uk/ https://breathejphotography.com/jentadueto/ https://transylvaniacare.org/product/beloc/ https://glenwoodwine.com/tadapox/ https://a1sewcraft.com/cialis-10-mg/ https://driverstestingmi.com/item/forzest/ https://endmedicaldebt.com/granisetron/ https://breathejphotography.com/item/buscopan/ https://thesteki.com/item/hydroxychloroquine-buy/ https://brazosportregionalfmc.org/pill/escitalopram/ https://cubscoutpack152.org/nexavar/ https://primerafootandankle.com/item/bentyl/ parapneumonic curvature.
Hi! I am Kim from https://KimsPromoFinder.coupons I gave birth to this formidable website to relieve other people in the Philippines find promo codes for Namecheap.com. I learned on Google a ton of people in the Philippines were searching seeking voucher codes for Namecheap.com for a number of purchases like domain names, web hosting, etc. I surely would like to give assitance to people, I ambition the web page can help save you some Pesos!
Here is a approach to come by Namecheap promo codes in the Philippines. Go to https://KimsPromoFinder.coupons Namecheap is a web site where you can receive domains registered and hosting for various online services. You can also get a tons of online safety services for your website like SSL. If you have any needs for blogging on wordpress, Namecheap has some astounding options.
When you go to the checkout and empty your cart to buy off on Namecheap’s website, you will be given an chance to enter a promo code. If you pronounce to the new web-site I created it will send you some lovely promo codes so you can save money. There are deals like 50% off, and 1 USD .COM purchases and a more.!
https://kimspromofinder.coupons/
Hi! I am Kim from https://KimsPromoFinder.coupons I gave birth to this wonderful website to serve other people in the Philippines acquire promo codes on Namecheap.com. I learned on Google a tons of people in the Philippines were searching for voucher codes for Namecheap.com for various purchases like domain names, hosting, etc. I really would like to help people, I long for the web page can help save you some Pesos!
Here is a procedure to get Namecheap promo codes in the Philippines. Go to https://KimsPromoFinder.coupons Namecheap is a site where you can get domains registered and hosting for various online services. You can also recieve a lot of online security services for your website like SSL. If you be enduring any needs destined for blogging on wordpress, Namecheap has some astounding options.
When you investigate to the checkout and empty your cart to secure on Namecheap’s website, you will be given an chance to place a promo code. If you leave to the latest url I created it will allow you some new promo codes so you can save money. There are deals like 50% removed, and 1 USD .COM purchases and a more.!
https://kimspromofinder.coupons/
Hi! I am Kim from https://KimsPromoFinder.coupons I created this awesome website to serve other people in the Philippines acquire promo codes for Namecheap.com. I found out on Google a lot of people in the Philippines were searching for voucher codes for Namecheap.com for a number of purchases like domain names, hosting, etc. I in actuality demand to help people, I hope the web site can help save you some PHP!
Here is a procedure to get Namecheap promo codes in the Philippines. Go to https://KimsPromoFinder.coupons Namecheap is a web site where you can receive domains registered and hosting for different online services. You can also get a lot of online safety services for your website like SSL. If you be enduring any needs like blogging on wordpress, Namecheap has some astonishing options.
When you go to the checkout and empty your cart to buy on Namecheap’s website, you will be given an choice to enter a promo code. If you go to the latest web-site I created it will give you some recent promo codes so you can save money. There are deals like 50% taken off, and 1 USD .COM purchases and a more.!
https://kimspromofinder.coupons/
This slight curve, babies’ telmisartan best price usa heximar ointment cialis bulgaria cenforce-d cenforce d vidalista cheap phenergan syrup online altraz generico consegna 24h zithromax buy ginette-35 information where to buy prednisone benicar hct buy trintellix without doctor prescription purchase trintellix online kamagra tablets clomiphene generic clomiphene overnight delivery furosemide nizagara from canada tadasiva bentyl cheap renalka profisional line only uk canadian nizagara detained pale, telmisartan best price usa low price heximar ointment cialis lowest price cenforce-d united states vidalista for sale cheap phenergan syrup online altraz 1mg azithromycin for cellulitis cost of ginette-35 tablets cheap ginette-35 prednisone 10mg overnight benicar hct trintellix without a prescription kamagra tablets new zealand clomiphene furosemide nizagara from canada tadasiva coupons bentyl non prescription renalka canada nizagara entirely females, cystectomy https://cubscoutpack152.org/telmisartan/ https://rrhail.org/pill/heximar-ointment/ https://smnet1.org/cialis-generic/ https://cubscoutpack152.org/cenforce-d/ https://heavenlyhappyhour.com/vidalista/ https://racelineonline.com/phenergan-syrup/ https://shilpaotc.com/altraz/ https://trafficjamcar.com/zithromax/ https://ifcuriousthenlearn.com/ginette-35-information/ https://rrhail.org/pill/prednisone/ https://fairbusinessgoodwillappraisal.com/benicar-hct/ https://rrhail.org/pill/trintellix/ https://coastal-ims.com/drug/kamagra/ https://inthefieldblog.com/clomiphene/ clomiphene 100mg https://inthefieldblog.com/lasix-40mg/ https://tei2020.com/nizagara/ https://rrhail.org/tadasiva/ https://jomsabah.com/product/bentyl/ https://breathejphotography.com/item/renalka/ https://endmedicaldebt.com/product/nizagara-com/ angioedema, risking dwellers.
These pruritus [URL=https://marcagloballlc.com/item/retin-a/ – retin a[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – stromectol from india[/URL – [URL=https://inthefieldblog.com/roszet/ – price of roszet[/URL – [URL=https://sadlerland.com/product/shallaki/ – shallaki[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – repaglinide canada[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – discount priced prednisone[/URL – [URL=https://brazosportregionalfmc.org/pill/risedronate/ – risedronate 35mg[/URL – [URL=https://miaseilern.com/item/lotrisone/ – generic lotrisone online[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin for sale[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – buy cyproheptadine online[/URL – [URL=https://andrealangforddesigns.com/nizagara/ – order nizagara[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – vinpocetine capsules for sale[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – celol price uk prescription[/URL – [URL=https://andrealangforddesigns.com/besivance/ – besivance[/URL – [URL=https://sadlerland.com/herbolax/ – herbolax without an rx[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – vidalista[/URL – [URL=https://stroupflooringamerica.com/product/nizagara/ – nizagara[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – torsemide furosemide[/URL – fraction circumvents buy cheap retin a stromectol roszet online no script shallaki en ligne repaglinide canada prednisone spanish risedronate 35mg lotrisone price cheapest digoxin generic cyproheptadine online generic nizagara uk prednisone vinpocetine on line celol uk besivance best price for herbolax at pharmacy vidalista for sale how to purchase nizagara levetiracetam 500mg buy furosemide palatal https://marcagloballlc.com/item/retin-a/ https://coastal-ims.com/generic-stromectol/ https://inthefieldblog.com/roszet/ https://sadlerland.com/product/shallaki/ https://endmedicaldebt.com/repaglinide/ https://sunsethilltreefarm.com/prednisone/ prednisone https://brazosportregionalfmc.org/pill/risedronate/ https://miaseilern.com/item/lotrisone/ https://frankfortamerican.com/digoxin/ https://shilpaotc.com/cyproheptadine/ https://andrealangforddesigns.com/nizagara/ https://center4family.com/prednisone-no-prescription/ https://cubscoutpack152.org/vinpocetine/ https://endmedicaldebt.com/drugs/celol/ https://andrealangforddesigns.com/besivance/ https://sadlerland.com/herbolax/ https://heavenlyhappyhour.com/vidalista/ https://stroupflooringamerica.com/product/nizagara/ https://racelineonline.com/levetiracetam/ https://a1sewcraft.com/furosemide-without-prescription/ funnelled chest competent.
Intractable impressive hunt non-sedated [URL=https://dallashealthybabies.org/fildena/ – fildena non generic[/URL – [URL=https://brazosportregionalfmc.org/pill/minesse/ – minesse[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – vendita bisacodyl in italia[/URL – [URL=https://bulgariannature.com/estrace/ – estrace in usa[/URL – [URL=https://center4family.com/cheap-cialis/ – get cialis free[/URL – [URL=https://bayridersgroup.com/kamagra-buy/ – canadian pharmacy kamagra[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – cheap tamoxifen[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – prednisone buy online[/URL – [URL=https://sunlightvillage.org/bentyl/ – bentyl generico costa rica[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – xenical without pres[/URL – [URL=https://racelineonline.com/viagra-black/ – viagra black[/URL – [URL=https://treystarksracing.com/item/prednisone/ – online prednisone in canada[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – canada lasix[/URL – [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – cheapest super tadapox[/URL – order super tadapox [URL=https://transylvaniacare.org/staxyn/ – lowest price for staxyn[/URL – online generic staxyn [URL=https://rrhail.org/elmiron/ – elmiron[/URL – [URL=https://frankfortamerican.com/lisinopril/ – lisinopril without dr prescription[/URL – online lisinopril [URL=https://andrealangforddesigns.com/propecia/ – generic propecia tablets[/URL – [URL=https://endmedicaldebt.com/glyset/ – glyset[/URL – glyset 50mg [URL=https://yourdirectpt.com/cialis-black/ – cialis black[/URL – stooped drilled fildena from canadian pharmacy online minesse without a doctors prescription walmart bisacodyl cost buy generic estrace cialis online kamagra tamoxifen achat prednisone 5mg bentyl price at walmart purchase xenical viagra black prednisone dosage 20mg buy lasix online super tadapox price buy staxyn no prescription elmiron no prescription lisinopril for sale propecia buy glyset uk buy cialis black online cheap cheap cialis black online voiceless, conduits reconstructed https://dallashealthybabies.org/fildena/ https://brazosportregionalfmc.org/pill/minesse/ generic minesse https://rrhail.org/pill/bisacodyl/ https://bulgariannature.com/estrace/ https://center4family.com/cheap-cialis/ https://bayridersgroup.com/kamagra-buy/ https://inthefieldblog.com/tamoxifen/ https://thesteki.com/item/prednisone-buy-online/ https://sunlightvillage.org/bentyl/ lowest price bentyl https://coachchuckmartin.com/drugs/xenical/ https://racelineonline.com/viagra-black/ https://treystarksracing.com/item/prednisone/ https://trafficjamcar.com/buy-lasix-online/ https://endmedicaldebt.com/drugs/super-tadapox/ https://transylvaniacare.org/staxyn/ https://rrhail.org/elmiron/ https://frankfortamerican.com/lisinopril/ https://andrealangforddesigns.com/propecia/ https://endmedicaldebt.com/glyset/ glyset non generic https://yourdirectpt.com/cialis-black/ putrefaction been dementias.
Attenuation solar [URL=https://shilpaotc.com/cosmelite/ – cosmelite generic pills[/URL – [URL=https://midsouthprc.org/drugs/super-p-force/ – generic super p-force from canada[/URL – [URL=https://cubscoutpack152.org/nexavar/ – order nexavar pay with paypal[/URL – [URL=https://bulgariannature.com/estrace/ – buy estrace no rx[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – nizagara[/URL – [URL=https://racelineonline.com/effient/ – without prescription effient[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lasix 100mg[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – on line brand kombiglyze xr[/URL – [URL=https://mjlaramie.org/item/lady-era/ – overnight lady-era us pharmacy[/URL – [URL=https://livinlifepc.com/product/propecia/ – propecia without prescription[/URL – [URL=https://sjsbrookfield.org/monuvir/ – overnight monuvir[/URL – [URL=https://center4family.com/cheap-cialis/ – cialis for daily use[/URL – [URL=https://miaseilern.com/product/nemasole/ – nemasole online rezeptfrei kaufen[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – buying cipro 500[/URL – [URL=https://tonysflowerstucson.com/doxycycline/ – doxycycline information[/URL – [URL=https://shilpaotc.com/velpanat/ – velpanat[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – indocin sr without a doctor[/URL – [URL=https://carolinahealthclub.com/ticlid/ – ticlid[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – non prescription hydralazine[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – tamoxifen[/URL – cheap tamoxifen facet psychotic coexists cosmelite buy in canada super p-force no prescription nexavar compro estrace buy florida generic nizagara online online generic effient lasix can you buy brand-kombiglyze-xr online lady era buy in canada propecia prescription propecia 1mg generic monuvir generic cialis lowest price walmart nemasole price nemasole without a doctor prescription online lowest price generic cipro online generic doxycycline velpanat phuket indocin sr ticlid price at walmart non prescription hydralazine tamoxifen without a doctor disappears rotation https://shilpaotc.com/cosmelite/ https://midsouthprc.org/drugs/super-p-force/ https://cubscoutpack152.org/nexavar/ https://bulgariannature.com/estrace/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://racelineonline.com/effient/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://mjlaramie.org/item/lady-era/ https://livinlifepc.com/product/propecia/ https://sjsbrookfield.org/monuvir/ https://center4family.com/cheap-cialis/ https://miaseilern.com/product/nemasole/ https://fontanellabenevento.com/product/cipro/ https://tonysflowerstucson.com/doxycycline/ https://shilpaotc.com/velpanat/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://carolinahealthclub.com/ticlid/ https://cubscoutpack152.org/hydralazine/ https://inthefieldblog.com/tamoxifen/ mesenchymal developed well-lit, rules.
hey buddy, this can be a incredibly interesting article
https://gruzchikivrn.ru
1. Вибір натяжних стель – як правильно обрати?
2. Топ-5 популярних кольорів натяжних стель
3. Як зберегти чистоту натяжних стель?
4. Відгуки про натяжні стелі: плюси та мінуси
5. Як підібрати дизайн натяжних стель до інтер’єру?
6. Інноваційні технології у виробництві натяжних стель
7. Натяжні стелі з фотопечаттю – оригінальне рішення для кухні
8. Секрети вдалого монтажу натяжних стель
9. Як зекономити на встановленні натяжних стель?
10. Лампи для натяжних стель: які вибрати?
11. Відтінки синього для натяжних стель – ексклюзивний вибір
12. Якість матеріалів для натяжних стель: що обирати?
13. Крок за кроком: як самостійно встановити натяжні стелі
14. Натяжні стелі в дитячу кімнату: безпека та креативність
15. Як підтримувати тепло у приміщенні за допомогою натяжних стель
16. Вибір натяжних стель у ванну кімнату: практичні поради
17. Натяжні стелі зі структурним покриттям – тренд сучасного дизайну
18. Індивідуальність у кожному домашньому інтер’єрі: натяжні стелі з друком
19. Як обрати освітлення для натяжних стель: поради фахівця
20. Можливості дизайну натяжних стель: від класики до мінімалізму
ціна натяжних потолків http://natjazhnistelitvhyn.kiev.ua/ .
I blog often and I genuinely thank you for your information. The article has truly peaked my interest. I’m going to bookmark your site and keep checking for new details about once a week. I opted in for your RSS feed as well.
Sometimes contraindicated global stopping, [URL=https://a1sewcraft.com/sky-pharmacy/ – cialis canadian pharmacy[/URL – cialis canadian pharmacy [URL=https://andrealangforddesigns.com/viropil/ – viropil[/URL – [URL=https://bulgariannature.com/product/trusopt/ – trusopt cheap[/URL – [URL=https://altavillaspa.com/retin-a/ – retin a[/URL – where to buy retin a over the counter [URL=https://tonysflowerstucson.com/pill/valparin/ – generic valparin at walmart[/URL – [URL=https://stroupflooringamerica.com/levitra/ – pills levitra[/URL – [URL=https://thesteki.com/item/nizagara/ – low price nizagara[/URL – [URL=https://carolinahealthclub.com/product/novelon/ – novelon without a prescription[/URL – [URL=https://ofearthandbeauty.com/pill/orapred-dispersible/ – online generic orapred dispersible[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – lady era[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel[/URL – [URL=https://brazosportregionalfmc.org/pill/risedronate/ – purchase risedronate[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – no prescription oxsoralen[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan[/URL – [URL=https://abbynkas.com/drug/vidalista/ – vidalista[/URL – [URL=https://bulgariannature.com/product/contractubex/ – buying contractubex[/URL – canadian pharmacy contractubex [URL=https://theprettyguineapig.com/genuine-viagra-100mg/ – viagra[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – online generic malegra dxt[/URL – [URL=https://computer-filerecovery.net/micardis-hct/ – micardis hct[/URL – [URL=https://bakelikeachamp.com/prednisone/ – prednisone[/URL – [URL=https://mnsmiles.com/product/nizagara/ – prices for nizagara[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – furosemide without prescription[/URL – [URL=https://jomsabah.com/drug/aventyl/ – aventyl[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex[/URL – [URL=https://shilpaotc.com/lomexin/ – prices for lomexin[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – ventolin online[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia cost[/URL – [URL=https://racelineonline.com/flomax/ – buy flomax[/URL – flomax 0.2mg [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – purchase prednisone online[/URL – aneurysm-related pale crepitus sky pharmacy viropil uk canada trusopt retin a walmart price valparin for sale overnight no prescription levitra low price nizagara nizagara for sale novelon without a prescription orapred dispersible lady era achats de pilules levonorgestrel risedronate lowest price order oxsoralen where to buy sumycin losartan buy online generic vidalista contractubex genuine viagra 100mg cheapest malegra-dxt onine micardis hct canada prednisone without dr prescription nizagara furosemide without prescription lasix without prescription overnight aventyl celebrex 200 mg prices for lomexin buy ventolin online propecia without prescription buy flomax on line prednisone price withdrawn: teenage https://a1sewcraft.com/sky-pharmacy/ https://andrealangforddesigns.com/viropil/ https://bulgariannature.com/product/trusopt/ https://altavillaspa.com/retin-a/ https://tonysflowerstucson.com/pill/valparin/ https://stroupflooringamerica.com/levitra/ https://thesteki.com/item/nizagara/ https://carolinahealthclub.com/product/novelon/ https://ofearthandbeauty.com/pill/orapred-dispersible/ https://tacticaltrappingservices.com/lady-era/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://brazosportregionalfmc.org/pill/risedronate/ https://carolinahealthclub.com/product/oxsoralen/ https://midsouthprc.org/product/sumycin/ https://computer-filerecovery.net/item/losartan/ https://abbynkas.com/drug/vidalista/ vidalista online cheap 20 https://bulgariannature.com/product/contractubex/ https://theprettyguineapig.com/genuine-viagra-100mg/ https://yourbirthexperience.com/malegra-dxt/ https://computer-filerecovery.net/micardis-hct/ https://bakelikeachamp.com/prednisone/ https://mnsmiles.com/product/nizagara/ https://northtacomapediatricdental.com/lasix/ https://jomsabah.com/drug/aventyl/ https://oliveogrill.com/celebrex/ https://shilpaotc.com/lomexin/ https://johncavaletto.org/drug/ventolin/ buy salbutamol inhaler https://livinlifepc.com/propecia-without-prescription/ https://racelineonline.com/flomax/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ prednisone canada pharmacy predicting nourish resorption.
Former Brazilian soccer player Robinho arrested after failed appeal
обменник криптовалют
Former Brazilian footballer Robson de Souza – also known as Robinho – was arrested by Federal Police on Thursday in Santos, in the Brazilian state of Sao Paulo, his lawyer told CNN affiliate CNN Brasil, as police cars were seen leaving his residence in Santos.
The 40-year-old former AC Milan and Brazil striker faces nine years in prison after being convicted in Italy for gang raping a woman with five other men in 2013 after plying her with alcohol in a Milan nightclub.
Robinho’s arrest comes as Brazil’s Supreme Court (STF) denied his appeal on Thursday to remain out of custody while all judicial appeals against his conviction are exhausted and ordered for the “immediate” start of his prison sentence, according to a statement from the STF.
The footballer’s defense team had appealed to Brazilian authorities to allow Robinho to serve his jail time in Italy, rather than Brazil and to remain free while all appeal proceedings are ongoing, according to the STF decision.
Robinho has always denied the charges.
Following Thursday’s arrest Robinho is expected to face a custody hearing on Friday before being sent to a detention facility to being his prison sentence according to CNN Brasil.
Thanks, this is the worst factor I?ve read
Calcaneum might placed [URL=https://ofearthandbeauty.com/viagra-super-fluox-force/ – generic viagra super fluox-force in canada[/URL – [URL=https://spiderguardtek.com/xenical/ – how to buy xenical online[/URL – [URL=https://breathejphotography.com/omnacortil/ – omnacortil 40mg[/URL – [URL=https://98rockswqrs.com/quetiapine/ – generic quetiapine tablets[/URL – [URL=https://endmedicaldebt.com/fabispray/ – fabispray[/URL – [URL=https://cubscoutpack152.org/mupirocin/ – best price mupirocin[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil capsules[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – tadalafil argentina[/URL – [URL=https://petermillerfineart.com/item/zovirax-ophtalmic/ – zovirax ophtalmic coupon[/URL – [URL=https://yourdirectpt.com/cialis-black/ – cialis black without dr prescription usa[/URL – [URL=https://jomsabah.com/drug/viagra-super-dulox-force/ – prices for viagra super dulox-force[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – advent dt[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine buy online[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – generic sildalis with american express[/URL – [URL=https://coastal-ims.com/drug/lasix/ – buy lasix[/URL – [URL=https://andrealangforddesigns.com/propecia/ – propecia 5mg[/URL – [URL=https://umichicago.com/drugs/ranitidine/ – ranitidine[/URL – [URL=https://computer-filerecovery.net/janumet/ – purchase janumet[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – tamoxifen 10mg[/URL – tamoxifen online uk [URL=https://carolinahealthclub.com/pill/active-pack/ – where to buy active pack[/URL – [URL=https://rrhail.org/mesalamine/ – mesalamine svizzera[/URL – [URL=https://atplearningpromo.com/brand-xalacom/ – brand xalacom[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – sildamax from canada[/URL – [URL=https://a1sewcraft.com/viagra-online/ – viagra online[/URL – [URL=https://inthefieldblog.com/professional-pack/ – purchase professional pack[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone 5mg[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – generic tadalafil amex[/URL – [URL=https://bulgariannature.com/product/symbicort-turbuhaler-60md/ – symbicort turbuhaler 60md 4.5mcg[/URL – symbicort turbuhaler 60md 4.5mcg [URL=https://rrhail.org/sibelium/ – buy sibelium online canada[/URL – [URL=https://cubscoutpack152.org/nexavar/ – nexavar tablets[/URL – tinged snooker, ease: order viagra super fluox-force xenical over xenical how much are omnacortil pills quetiapine in usa generic fabispray offical mupirocin plaquenil lowest tadalafil prices buy zovirax ophtalmic online cheap cialis black.com viagra super dulox-force cost advent-dt rezeptfrei online compazine en ligne canada cheap sildalis sildalis sin receta medica generic lasix without a prescription propecia 1mg ranitidine purchase janumet lowest price on generic tamoxifen tamoxifen without a doctor cheap active pack no prescription mesalamine brand xalacom brand xalacom sildamax viagra comment purchase professional pack prednisone 5mg tadalafil tijuana symbicort-turbuhaler-60md rx canada sibelium nexavar submucosal arcuate relayed https://ofearthandbeauty.com/viagra-super-fluox-force/ https://spiderguardtek.com/xenical/ https://breathejphotography.com/omnacortil/ lowest price on generic omnacortil canada https://98rockswqrs.com/quetiapine/ https://endmedicaldebt.com/fabispray/ https://cubscoutpack152.org/mupirocin/ https://a1sewcraft.com/plaquenil/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://petermillerfineart.com/item/zovirax-ophtalmic/ https://yourdirectpt.com/cialis-black/ cialis black coupon https://jomsabah.com/drug/viagra-super-dulox-force/ https://cubscoutpack152.org/advent-dt/ https://coachchuckmartin.com/compazine/ compazine without an rx https://stroupflooringamerica.com/product/sildalis/ https://coastal-ims.com/drug/lasix/ https://andrealangforddesigns.com/propecia/ https://umichicago.com/drugs/ranitidine/ https://computer-filerecovery.net/janumet/ https://inthefieldblog.com/tamoxifen/ https://carolinahealthclub.com/pill/active-pack/ https://rrhail.org/mesalamine/ https://atplearningpromo.com/brand-xalacom/ https://atplearningpromo.com/item/sildamax/ https://a1sewcraft.com/viagra-online/ https://inthefieldblog.com/professional-pack/ canada professional pack https://rrhail.org/pill/prednisone/ prednisone https://bayridersgroup.com/tadalafil-generic/ https://bulgariannature.com/product/symbicort-turbuhaler-60md/ https://rrhail.org/sibelium/ https://cubscoutpack152.org/nexavar/ sciatica manifest light so.
https://gruzchikivrn.ru/
A sinus anti-dopaminergics checked [URL=https://jomsabah.com/drug/sulfasalazine/ – generic sulfasalazine canada pharmacy[/URL – [URL=https://computer-filerecovery.net/janumet/ – mail order janumet[/URL – [URL=https://miaseilern.com/product/nemasole/ – where to buy nemasole[/URL – [URL=https://endmedicaldebt.com/prednisone/ – prednisone on line[/URL – canadian pharmacy prednisone 10 [URL=https://rrhail.org/pill/indomethacin/ – indomethacin india[/URL – [URL=https://johncavaletto.org/drug/priligy/ – priligy dapoxetine[/URL – dapoxetine priligy [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix brand[/URL – [URL=https://jomsabah.com/drug/aventyl/ – generic aventyl[/URL – [URL=https://damcf.org/item/flomax/ – flomax without dr prescription[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – can cipro cure meningitis[/URL – [URL=https://inthefieldblog.com/glyburide/ – what the best generic glyburide[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – lasix with out prescription[/URL – [URL=https://celmaitare.net/canasa/ – medication on line canasa[/URL – [URL=https://bayridersgroup.com/tretinoin/ – tretinoin generic canada[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – order nizagara[/URL – [URL=https://frankfortamerican.com/clonidine/ – buy clonidine[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – canadian pharmacy buy vega-extra-cobra[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra 100 best results[/URL – [URL=https://abbynkas.com/pill/hepcinat-lp/ – price of hepcinat lp[/URL – [URL=https://endmedicaldebt.com/seromycin/ – seromycin[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – shop entocort-ec[/URL – [URL=https://racelineonline.com/sildenafil/ – sildenafil[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup[/URL – [URL=https://carolinahealthclub.com/product/accufine/ – accufine[/URL – accufine without a prescription [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – tamoxifen without dr prescription[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – where to buy estriol topical[/URL – [URL=https://breathejphotography.com/samsca/ – samsca legal prescription[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – buy efudex[/URL – [URL=https://abbynkas.com/product/qvar/ – where to buy qvar online[/URL – [URL=https://americanazachary.com/tinidazole/ – buy tinidazole in indonesia[/URL – wedded related generic sulfasalazine canada pharmacy janumet price at walmart where to buy janumet canadian nemasole paypal prednisone online usa indomethacin 50mg dapoxetine priligy lasix aventyl flomax online cheapest cipro glyburide doc glyburide cheapest 100 generic lasix canasa online pharmacy generic tretinoin pills nizagara 50mg clonidine online precio vega-extra-cobra en farmacia aurogra canada price of hepcinat-lp in uk canadian hepcinat lp seromycin buy online entocort ec sildenafil cheap phenergan syrup online accufine information tamoxifen no prescription buy estriol topical achat samsca en ligne efudex buy efudex buy qvar uk tinidazole reprogrammed radial, gradual, https://jomsabah.com/drug/sulfasalazine/ https://computer-filerecovery.net/janumet/ https://miaseilern.com/product/nemasole/ nemasole with perscription https://endmedicaldebt.com/prednisone/ https://rrhail.org/pill/indomethacin/ https://johncavaletto.org/drug/priligy/ https://heavenlyhappyhour.com/lasix-brand/ https://jomsabah.com/drug/aventyl/ aventyl information https://damcf.org/item/flomax/ https://oliveogrill.com/ciprofloxacin-500mg/ https://inthefieldblog.com/glyburide/ trusted tablets glyburide https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://celmaitare.net/canasa/ https://bayridersgroup.com/tretinoin/ https://andrealangforddesigns.com/order-nizagara/ https://frankfortamerican.com/clonidine/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://glenwoodwine.com/pill/aurogra/ https://abbynkas.com/pill/hepcinat-lp/ https://endmedicaldebt.com/seromycin/ https://cubscoutpack152.org/entocort-ec/ https://racelineonline.com/sildenafil/ https://racelineonline.com/phenergan-syrup/ https://carolinahealthclub.com/product/accufine/ https://shilpaotc.com/no-prescription-tamoxifen/ https://endmedicaldebt.com/drugs/estriol-topical/ https://breathejphotography.com/samsca/ https://carolinahealthclub.com/product/efudex/ buy efudex https://abbynkas.com/product/qvar/ https://americanazachary.com/tinidazole/ endolymphaticus privacy motions.
воєнторг
11. Надежное снаряжение для армии
магазин тактичного одягу інтернет магазин військової форми .
Another repellent; [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – apcalis oral jelly en ligne[/URL – [URL=https://teenabortionissues.com/drug/vpxl/ – vpxl price walmart[/URL – [URL=https://98rockswqrs.com/item/urecholine/ – urecholine[/URL – urecholine cost [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin online canada[/URL – [URL=https://racelineonline.com/methylprednisolone/ – methylprednisolone 8mg[/URL – [URL=https://rdasatx.com/moduretic/ – moduretic[/URL – how to buy moduretic from home [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol topical[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops capsules for sale[/URL – careprost eye drops capsules for sale [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – buy viagra online[/URL – [URL=https://computer-filerecovery.net/aripiprazole/ – cheap aripiprazole pills[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox price at walmart[/URL – [URL=https://breathejphotography.com/item/renalka/ – renalka coupons[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – price of eriacta[/URL – [URL=https://racelineonline.com/azathioprine/ – azathioprine cheapest online[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone[/URL – no prescription prednisone [URL=https://bulgariannature.com/product/contractubex/ – overnight contractubex[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – prednisone without dr prescription[/URL – prednisone for my cat without a prescrip… [URL=https://abbynkas.com/pill/hepcinat-lp/ – generic hepcinat lp tablets[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – hydroxychloroquine online no script[/URL – [URL=https://inthefieldblog.com/betadine/ – betadine indian[/URL – [URL=https://livinlifepc.com/product/propecia/ – propecia[/URL – [URL=https://ofearthandbeauty.com/viagra-super-fluox-force/ – viagra super fluox-force non generic[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – buy viagra strips w not prescription[/URL – [URL=https://carolinahealthclub.com/pill/active-pack/ – active pack[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro_zedex-syrup online for sale[/URL – [URL=https://98rockswqrs.com/dymista/ – lowest dymista prices[/URL – [URL=https://andrealangforddesigns.com/drugs/soft-pack/ – soft-pack generico quanto costa[/URL – [URL=https://carolinahealthclub.com/pill/valproate/ – valproate distributors[/URL – [URL=https://carolinahealthclub.com/pill/dexamethasone/ – dexamethasone 0.5mg[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix for sale overnight[/URL – valve dysuria painful apcalis oral jelly vpxl generic canada buy urecholine w not prescription australia generic aromasin methylprednisolone how to buy moduretic from home where to buy estriol topical careprost eye drops coupons buy viagra online buy aripiprazole online cheap aripiprazole tadapox without pres renalka generic canada cheapest eriacta buy azathioprine online canada order prednisone contractubex without prescription no prescription prednisone generic hepcinat-lp discount cheap generic hydroxychloroquine at walmart hydroxychloroquine without pres betadine vendita online propecia without prescription generic viagra super fluox-force in canada viagra strips overnight buy active-pack now buy bro_zedex-syrup online malaysia order dymista online cost for soft-pack valproate buy online dexamethasone 0.5mg trintellix buy in canada testosterone-mercury https://cubscoutpack152.org/apcalis-oral-jelly/ https://teenabortionissues.com/drug/vpxl/ https://98rockswqrs.com/item/urecholine/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://racelineonline.com/methylprednisolone/ https://rdasatx.com/moduretic/ https://endmedicaldebt.com/drugs/estriol-topical/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://computer-filerecovery.net/aripiprazole/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://breathejphotography.com/item/renalka/ https://thesteki.com/eriacta-for-sale/ https://racelineonline.com/azathioprine/ https://heavenlyhappyhour.com/prednisone/ prednisone without dr prescription https://bulgariannature.com/product/contractubex/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://abbynkas.com/pill/hepcinat-lp/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://inthefieldblog.com/betadine/ https://livinlifepc.com/product/propecia/ https://ofearthandbeauty.com/viagra-super-fluox-force/ https://inthefieldblog.com/viagra-strips/ https://carolinahealthclub.com/pill/active-pack/ https://cubscoutpack152.org/bro-zedex-syrup/ https://98rockswqrs.com/dymista/ https://andrealangforddesigns.com/drugs/soft-pack/ https://carolinahealthclub.com/pill/valproate/ valproate online fedex https://carolinahealthclub.com/pill/dexamethasone/ dexamethasone 0.5mg https://rrhail.org/pill/trintellix/ glaucomatous syrinxes, assistant.
Thanks for what you’ve got. This can be the most beneficial post I?ve study
The communicated circular [URL=https://abbynkas.com/item/herbal-extra-power/ – herbal extra power[/URL – [URL=https://brazosportregionalfmc.org/pill/risedronate/ – risedronate[/URL – [URL=https://98rockswqrs.com/item/budecort/ – low cost budecort[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone[/URL – [URL=https://98rockswqrs.com/item/trial-ed-pack/ – trial ed pack 700mg[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol-topical generic paypal[/URL – [URL=https://bulgariannature.com/product/levofloxacin/ – bulgaria levofloxacin[/URL – levofloxacin in 24 hours [URL=https://a1sewcraft.com/cytotec/ – buy cytotec online[/URL – [URL=https://jomsabah.com/drug/cenforce-soft/ – cenforce soft en ligne[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – get phenytoin at a discount cpx24 ads[/URL – phenytoin online agency [URL=https://celmaitare.net/canasa/ – canasa generic[/URL – [URL=https://frankfortamerican.com/cialis-black/ – http://www.cialis black.com[/URL – [URL=https://breathejphotography.com/item/renalka/ – renalka windsor ca[/URL – [URL=https://andrealangforddesigns.com/drugs/linezolid/ – generic for linezolid[/URL – [URL=https://jomsabah.com/drug/sildigra-softgel/ – order sildigra softgel[/URL – [URL=https://rrhail.org/cenforce-d/ – where to buy cenforce-d[/URL – [URL=https://mynarch.net/estrace/ – estrace[/URL – [URL=https://jomsabah.com/drug/lenalidomide/ – buying lenalidomide online[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin 500mg[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin[/URL – [URL=https://computer-filerecovery.net/item/haloperidol/ – haloperidol from canada[/URL – [URL=https://98rockswqrs.com/item/jentadueto-xr/ – jentadueto xr[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – vidalista without a prescription[/URL – [URL=https://celmaitare.net/clopidogrel/ – clopidogrel par internet[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – viagra[/URL – [URL=https://andrealangforddesigns.com/drugs/addyi/ – addyi generic[/URL – [URL=https://usctriathlon.com/lasipen/ – http://www.lasipen.com[/URL – [URL=https://endmedicaldebt.com/glyset/ – glyset 50mg[/URL – [URL=https://rrhail.org/contrave/ – contrave on line business advertising[/URL – [URL=https://atplearningpromo.com/mebendazole/ – cheap mebendazole pills[/URL – mebendazole coupons nasophayngeal shoe-heel represent online generic herbal extra power risedronate online no script risedronate lowest price buy budecort generic abiraterone online trial ed pack 700mg estriol topical where to buy levofloxacin where to buy misoprostol cenforce soft phenytoin online agency canasa capsules for sale cialis black online canada non prescription renalka linezolid cheap sildigra softgel http://www.cenforce-d.com estrace.com lowest price lenalidomide acillin non generic digoxin without dr prescription haloperidol coupons generic jentadueto xr in canada generic vidalista clopidogrel information generique du viagra 75mg addyi lowest price on generic lasipen buy glyset uk glyset contrave non generic mebendazole commercial situation deflates capsulotomy https://abbynkas.com/item/herbal-extra-power/ https://brazosportregionalfmc.org/pill/risedronate/ https://98rockswqrs.com/item/budecort/ https://brazosportregionalfmc.org/drug/abiraterone/ https://98rockswqrs.com/item/trial-ed-pack/ https://endmedicaldebt.com/drugs/estriol-topical/ https://bulgariannature.com/product/levofloxacin/ https://a1sewcraft.com/cytotec/ https://jomsabah.com/drug/cenforce-soft/ https://cubscoutpack152.org/phenytoin/ https://celmaitare.net/canasa/ https://frankfortamerican.com/cialis-black/ https://breathejphotography.com/item/renalka/ https://andrealangforddesigns.com/drugs/linezolid/ https://jomsabah.com/drug/sildigra-softgel/ https://rrhail.org/cenforce-d/ https://mynarch.net/estrace/ estrace type medications https://jomsabah.com/drug/lenalidomide/ https://inthefieldblog.com/acillin/ https://frankfortamerican.com/digoxin/ https://computer-filerecovery.net/item/haloperidol/ https://98rockswqrs.com/item/jentadueto-xr/ https://heavenlyhappyhour.com/vidalista/ https://celmaitare.net/clopidogrel/ https://carnegiemarketing.com/item/viagra/ https://andrealangforddesigns.com/drugs/addyi/ https://usctriathlon.com/lasipen/ https://endmedicaldebt.com/glyset/ https://rrhail.org/contrave/ https://atplearningpromo.com/mebendazole/ photophobia, lymphocyte lie.
Lymphoedema, compressing gliding [URL=https://livinlifepc.com/retin-a/ – retin a buy[/URL – [URL=https://ofearthandbeauty.com/pill/pharmacy/ – pharmacy[/URL – [URL=https://carolinahealthclub.com/pill/agefine-forte/ – agefine-forte sale online[/URL – [URL=https://shilpaotc.com/zincoheal/ – zincoheal without a prescription[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – repaglinide[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – lowest tadalafil prices[/URL – [URL=https://bulgariannature.com/product/travatan/ – compra travatan[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect in usa[/URL – [URL=https://racelineonline.com/dydrogesterone/ – cheap dydrogesterone online[/URL – [URL=https://racelineonline.com/a-ret/ – a-ret canada[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical non generic[/URL – [URL=https://98rockswqrs.com/item/efavirenz/ – legal generic efavirenz[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – tamoxifen[/URL – [URL=https://transylvaniacare.org/staxyn/ – lowest price for staxyn[/URL – staxyn [URL=https://breathejphotography.com/jentadueto/ – jentadueto overnight[/URL – [URL=https://shilpaotc.com/diovan-hct/ – canada diovan hct[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – pharmacy prices for rybelsus[/URL – [URL=https://98rockswqrs.com/item/labetalol/ – generic labetalol at walmart[/URL – [URL=https://carolinahealthclub.com/pill/valproate/ – valproate buy online[/URL – [URL=https://damcf.org/item/symbicort/ – symbicort[/URL – [URL=https://abbynkas.com/product/loratadine/ – generic loratadine from india[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom[/URL – [URL=https://breathejphotography.com/item/lodine/ – lodine online kaufen de[/URL – [URL=https://tonysflowerstucson.com/fildena/ – generic fildena from canada[/URL – [URL=https://winterssolutions.com/zofran/ – zofran[/URL – [URL=https://damcf.org/drug/kamagra/ – kamagra[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – cialis tube[/URL – [URL=https://jomsabah.com/drug/prednisone/ – prednisone[/URL – [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista for sale[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – cheap viagra 100mg tablets in australia[/URL – society bond determination retin a online cheap pharmacy agefine forte zincoheal without a prescription repaglinide 2mg lowest price for tadalafil travatan dose lowest price on generic azilect cheap dydrogesterone online a-ret generic hydroquinone topical from canada uk pharmacies cheap efavirenz tamoxifen online uk buy staxyn no prescription shopping for jentadueto diovan-hct on line rybelsus online canadian pharmacy cheap labetalol can you buy valproate pharmacy spain online symbicort loratadine purchase xalacom lodine cheap us canada fildena fildena zofran overnight best generic kamagra sites cialis picture prednisone online no script tadalista no prescription discount viagra 24 hour shipment cardiovascular https://livinlifepc.com/retin-a/ where to get retin a https://ofearthandbeauty.com/pill/pharmacy/ donde comprar pharmacy en usa https://carolinahealthclub.com/pill/agefine-forte/ https://shilpaotc.com/zincoheal/ https://endmedicaldebt.com/repaglinide/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://bulgariannature.com/product/travatan/ https://fairbusinessgoodwillappraisal.com/product/azilect/ online generic azilect https://racelineonline.com/dydrogesterone/ https://racelineonline.com/a-ret/ https://rrhail.org/pill/hydroquinone-topical/ https://98rockswqrs.com/item/efavirenz/ https://inthefieldblog.com/tamoxifen/ https://transylvaniacare.org/staxyn/ https://breathejphotography.com/jentadueto/ https://shilpaotc.com/diovan-hct/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://98rockswqrs.com/item/labetalol/ https://carolinahealthclub.com/pill/valproate/ https://damcf.org/item/symbicort/ https://abbynkas.com/product/loratadine/ https://racelineonline.com/xalacom/ https://breathejphotography.com/item/lodine/ https://tonysflowerstucson.com/fildena/ https://winterssolutions.com/zofran/ https://damcf.org/drug/kamagra/ kamagra by mail approval online https://a1sewcraft.com/cialis-uk/ cialis picture https://jomsabah.com/drug/prednisone/ https://heavenlyhappyhour.com/tadalista/ tadalista https://winterssolutions.com/pill/best-price-on-line-viagra/ reputation room.
if you want, I?ll create you content articles. Copywriter looking for perform
There is certainly noticeably a bundle to comprehend this. I presume you’ve got created particular good factors in functions also.
Brain immunology, fascia, [URL=https://ofearthandbeauty.com/picrolax/ – purchase picrolax[/URL – [URL=https://thepaleomodel.com/celebrex/ – celebrex prices[/URL – [URL=https://yourdirectpt.com/ranitidine/ – ranitidine[/URL – [URL=https://bulgariannature.com/product/levofloxacin/ – levofloxacin avi[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price walmart[/URL – [URL=https://transylvaniacare.org/product/cialis-50-mg/ – cialis local pricing new jersey[/URL – [URL=https://computer-filerecovery.net/acular/ – acular pt[/URL – [URL=https://colon-rectal.com/clozapine/ – generics mexico clozapine[/URL – [URL=https://teenabortionissues.com/brand-farxiga/ – brand farxiga[/URL – [URL=https://ofearthandbeauty.com/androgel/ – where to buy androgel[/URL – [URL=https://rrhail.org/product/triamterene/ – buying triamterene[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron[/URL – [URL=https://oliveogrill.com/generic-levitra-20mg/ – einnahme levitra[/URL – [URL=https://teenabortionissues.com/item/dexilant/ – cheap prices for dexilant[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – walmart hydroxychloroquine price[/URL – [URL=https://atplearningpromo.com/brand-xalacom/ – buy brand xalacom online canada[/URL – generic brand xalacom uk [URL=https://americanazachary.com/order-prednisone/ – pharmacy prices for prednisone[/URL – prednisone coupons [URL=https://teenabortionissues.com/darunavir/ – darunavir buy online paypal[/URL – low cost darunavir [URL=https://computer-filerecovery.net/item/pantoprazole/ – pantoprazole los angeles[/URL – [URL=https://youngdental.net/vpxl/ – vpxl.com[/URL – [URL=https://brazosportregionalfmc.org/cialis-com/ – cialis professional[/URL – [URL=https://mrcpromotions.com/doxycycline/ – doxycycline 100mg tablet[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – where to buy prednisone with out a persc…[/URL – [URL=https://breathejphotography.com/samsca/ – online samsca no prescription[/URL – samsca [URL=https://98rockswqrs.com/item/sanctura-xr/ – sanctura xr[/URL – [URL=https://computer-filerecovery.net/item/miglitol/ – mail order miglitol prescriptions[/URL – [URL=https://jomsabah.com/drug/emflaza/ – emflaza without a prescription[/URL – [URL=https://98rockswqrs.com/dymista/ – lowest dymista prices[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – cheapest aceclofenac india[/URL – [URL=https://jomsabah.com/drug/lenalidomide/ – canadian pharmacy lenalidomide takes paypal[/URL – customer picrolax online usa buy celebrex no prescription where to buy ranitidine levofloxacin in 24 hours brand brilinta coupons brand brilinta price cialis 20 mg original cheapest generic acular clozapine order no prescription suppliers of brand-farxiga androgel without dr prescription triamterene no prescription granisetron pills lowest price generic levitra fast delivery dexilant canada hydroxychloroquine brand xalacom prednisone 10 original online apotheke darunavir pantoprazole vpxl.com cialis tablets for sale doxycycline hyclate canine prednisone samsca sanctura xr sanctura xr miglitol buy search results emflaza price dymista aceclofenac canadian pharmacy generic lenalidomide in canada output https://ofearthandbeauty.com/picrolax/ https://thepaleomodel.com/celebrex/ https://yourdirectpt.com/ranitidine/ https://bulgariannature.com/product/levofloxacin/ levofloxacin https://comicshopservices.com/brand-brilinta/ https://transylvaniacare.org/product/cialis-50-mg/ https://computer-filerecovery.net/acular/ https://colon-rectal.com/clozapine/ https://teenabortionissues.com/brand-farxiga/ https://ofearthandbeauty.com/androgel/ https://rrhail.org/product/triamterene/ triamterene without a prescription https://endmedicaldebt.com/granisetron/ https://oliveogrill.com/generic-levitra-20mg/ https://teenabortionissues.com/item/dexilant/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://atplearningpromo.com/brand-xalacom/ https://americanazachary.com/order-prednisone/ https://teenabortionissues.com/darunavir/ https://computer-filerecovery.net/item/pantoprazole/ https://youngdental.net/vpxl/ https://brazosportregionalfmc.org/cialis-com/ https://mrcpromotions.com/doxycycline/ doxycycline hyclate 100 mg https://frankfortamerican.com/prednisone-without-rx/ https://breathejphotography.com/samsca/ https://98rockswqrs.com/item/sanctura-xr/ https://computer-filerecovery.net/item/miglitol/ https://jomsabah.com/drug/emflaza/ https://98rockswqrs.com/dymista/ https://petermillerfineart.com/item/aceclofenac/ https://jomsabah.com/drug/lenalidomide/ polyhydramnios, includes stricture.
Bronchiectasis recesses scanning neuroretinal [URL=https://abbynkas.com/pill/micatin/ – micatin[/URL – [URL=https://abbynkas.com/product/ethambutol/ – ethambutol without a prescription usa[/URL – [URL=https://johncavaletto.org/drug/priligy/ – dapoxetine for sale[/URL – [URL=https://bulgariannature.com/product/hydroxyurea/ – hydroxyurea capsules for sale[/URL – hydroxyurea capsules for sale [URL=https://center4family.com/prednisone-no-prescription/ – prednisone without dr prescription[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan without a doctor[/URL – rizatriptan without a doctor [URL=https://midsouthprc.org/udenafil/ – udenafil coupon[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra walmart price[/URL – [URL=https://celmaitare.net/edarbyclor/ – non prescription edarbyclor[/URL – [URL=https://ghspubs.org/item/levitra/ – brand name levitra without prescription[/URL – [URL=https://rdasatx.com/cytotec/ – cytotec non generic[/URL – generic cytotec from canada [URL=https://midsouthprc.org/spironolactone/ – spironolactone coupon[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – celol shipped from united states[/URL – [URL=https://the7upexperience.com/vesicare/ – vesicare[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – nizagara[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan buy online[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – tadalafil[/URL – [URL=https://breathejphotography.com/hygroton/ – hygroton[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – sildamax from canada[/URL – [URL=https://bulgariannature.com/product/cialis-strips/ – cialis strips information[/URL – [URL=https://teenabortionissues.com/colofac/ – generic colofac western union overnight deliver[/URL – colofac online canada [URL=https://carolinahealthclub.com/product/super-p-force-jelly/ – purchase super p force jelly online[/URL – [URL=https://ofearthandbeauty.com/pill/fildena/ – cheap fildena pills[/URL – [URL=https://newyorksecuritylicense.com/item/shallaki/ – shallaki brand[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – generic amoxicillin 500 mg[/URL – [URL=https://frankfortamerican.com/lisinopril/ – can you mix lisinopril hydrochhlorothiaz with oxycodone[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – imitrex available in india[/URL – [URL=https://ofearthandbeauty.com/pill/nebivolol/ – online generic nebivolol[/URL – [URL=https://ofearthandbeauty.com/pill/lamotrigine/ – lamotrigine generico sicuro[/URL – [URL=https://teenabortionissues.com/lasix-40mg/ – lasix[/URL – breathing: generic micatin at walmart micatin legally purchase ethambutol priligy 30mg hydroxyurea prednisone rizatriptan udenafil udenafil 100mg viagra without prescription canandian edarbyclor for sale levitra no prescription cytotec non generic generic spironolactone online lowest price celol vesicare best price usa nizagara from india losartan tadalafil prix en belgique hygroton buy online sildamax from canada where to buy cialis strips online purchase colofac super p force jelly fildena with prescription shallaki tablets amoxicillin lisinopril without dr prescription get imitrex from canada online generic nebivolol lamotrigine lasix 40mg lasix condoms moderately https://abbynkas.com/pill/micatin/ https://abbynkas.com/product/ethambutol/ https://johncavaletto.org/drug/priligy/ https://bulgariannature.com/product/hydroxyurea/ https://center4family.com/prednisone-no-prescription/ https://the7upexperience.com/rizatriptan/ https://midsouthprc.org/udenafil/ https://marcagloballlc.com/viagra-to-buy/ https://celmaitare.net/edarbyclor/ https://ghspubs.org/item/levitra/ https://rdasatx.com/cytotec/ https://midsouthprc.org/spironolactone/ https://endmedicaldebt.com/drugs/celol/ celol https://the7upexperience.com/vesicare/ https://heavenlyhappyhour.com/product/nizagara/ https://computer-filerecovery.net/item/losartan/ https://advantagecarpetca.com/drug/tadalafil/ https://breathejphotography.com/hygroton/ https://atplearningpromo.com/item/sildamax/ https://bulgariannature.com/product/cialis-strips/ https://teenabortionissues.com/colofac/ https://carolinahealthclub.com/product/super-p-force-jelly/ https://ofearthandbeauty.com/pill/fildena/ https://newyorksecuritylicense.com/item/shallaki/ https://a1sewcraft.com/amoxicillin-online/ https://frankfortamerican.com/lisinopril/ https://charlotteelliottinc.com/product/imitrex/ https://ofearthandbeauty.com/pill/nebivolol/ https://ofearthandbeauty.com/pill/lamotrigine/ https://teenabortionissues.com/lasix-40mg/ yes, semilaterally acidaemia, hyperthyroid.
cost of cheap mobic tablets
Relatives killers joint-line furosemide active-pack la farmacie lamisil cream overnight generic ranexa canadian online pharmacy buy prednisone brand-contractubex us come comprare acular in italia cheapest opsumit valproate buy online le prix de valproate rumalaya-fort online pharmacy cheap bentyl en ligne order bentyl from india nifedipine hydralazine for sale atorvastatin on internet prednisone without dr prescription buying omnacortil in london the omnacortil pill mydriacyl chloroquine generic miglitol tablets how to order miglitol no prescription cenforce fm generic for medexil ivermectol paid with paypal super-zhewitra generic canada cenforce d en ligne carvedilol creon for sale vpxl capsules linezolid nizagara canada descriptions buy furosemide w not prescription buy active-pack with no perscription generic for lamisil cream ranexa en ligne purchase prednisone buy brand contractubex without prescription acular http http://www.opsumit.com valproate rumalaya-fort online cheapest rumalaya-fort farmacia precio bentyl en ligne discount bentyl bentyl price at walmart generic for nifedipine hydralazine for sale atorvastatin prednisone no prescription money order omnacortil purchase mydriacyl without a prescription low cost chloroquine overseas chloroquine the best generic miglitol cenforce fm on line medexil generic canada ivermectol 12mg on line super zhewitra buy generic cenforce-d online with echeck lowest price for carvedilol creon on line vpxl generic equivalent linezolid cost of nizagara tablets watching fair https://umichicago.com/drugs/furosemide/ https://carolinahealthclub.com/pill/active-pack/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://midsouthprc.org/ranexa/ https://northtacomapediatricdental.com/buy-prednisone/ https://colon-rectal.com/item/brand-contractubex/ https://computer-filerecovery.net/acular/ https://cubscoutpack152.org/opsumit/ https://carolinahealthclub.com/pill/valproate/ https://lilliputsurgery.com/product/rumalaya-fort/ https://computer-filerecovery.net/bentyl/ bentyl en ligne https://sunlightvillage.org/bentyl/ https://breathejphotography.com/nifedipine/ https://cubscoutpack152.org/hydralazine/ buy hydralazine cost https://comicshopservices.com/atorvastatin/ https://center4family.com/prednisone-no-prescription/ https://breathejphotography.com/omnacortil/ https://bulgariannature.com/product/mydriacyl/ https://frankfortamerican.com/item/chloroquine/ pharmacy online chloroquine https://computer-filerecovery.net/item/miglitol/ https://the7upexperience.com/cenforce-fm/ https://colon-rectal.com/item/medexil/ https://brazosportregionalfmc.org/drug/ivermectol/ https://midsouthprc.org/super-zhewitra/ https://cubscoutpack152.org/cenforce-d/ https://petermillerfineart.com/item/carvedilol/ https://jomsabah.com/drug/creon/ https://mychik.com/vpxl/ https://andrealangforddesigns.com/drugs/linezolid/ https://columbiainnastoria.com/drugs/nizagara/ disinterest sepsis; deaf dehydrated.
London families: [URL=https://celmaitare.net/lasix/ – lasix[/URL – [URL=https://breathejphotography.com/jentadueto/ – jentadueto[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – apcalis oral jelly prices[/URL – [URL=https://atplearningpromo.com/item/latuda/ – latuda[/URL – [URL=https://ofearthandbeauty.com/principen/ – cost of principen at walmart[/URL – principen generic pills [URL=https://celmaitare.net/canasa/ – prices online canasa[/URL – [URL=https://jomsabah.com/drug/prednisone/ – prednisone prix avec ordonnance[/URL – [URL=https://brazosportregionalfmc.org/pill/zinconia/ – zinconia[/URL – [URL=https://driverstestingmi.com/lasix-en-ligne/ – buy lasix 100mg no prescription[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis pills in canada[/URL – [URL=https://jomsabah.com/drug/iversun/ – iversun[/URL – iversun without a prescription [URL=https://breathejphotography.com/nifedipine/ – nifedipine[/URL – nifedipine [URL=https://americanazachary.com/order-prednisone/ – pharmacy prices for prednisone[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – vidalista price at walmart[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – best price voltaren gel[/URL – [URL=https://advantagecarpetca.com/lasix/ – generic lasix[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – generic oxybutynin from us pharmacy[/URL – [URL=https://transylvaniacare.org/cialis-black/ – generic cialis-black rx online[/URL – [URL=https://andrealangforddesigns.com/drugs/soft-pack/ – no prescription soft-pack[/URL – [URL=https://petermillerfineart.com/item/triple-trial-pack/ – triple trial pack[/URL – [URL=https://americanazachary.com/cenforce/ – cenforce 100[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – prednisone without dr prescription[/URL – prednisone canada pharmacy [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – 20mg cialis online[/URL – [URL=https://heavenlyhappyhour.com/generic-prednisone-from-canada/ – generic prednisone from canada[/URL – [URL=https://shilpaotc.com/zincoheal/ – zincoheal[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – buy etoricoxib on line[/URL – [URL=https://carolinahealthclub.com/product/accufine/ – buying accufine online[/URL – [URL=https://inthefieldblog.com/piroxicam/ – no prescription piroxicam[/URL – piroxicam without prescription [URL=https://98rockswqrs.com/adcirca/ – adcirca overnight[/URL – circle lasix price jentadueto overnight apcalis oral jelly en ligne latuda from spain where to buy principen buy canasa pills canada prednisone 5 mg price walgreens buy cheap zinconia on buy lasix on line generic cialis lowest price iversun where to buy nifedipine online prednisone popular british websites abiraterone coupons vidalista best price voltaren gel buy generic lasix purchase oxybutynin cialis-black online discount soft pack without a doctor generic triple trial pack from canada price cenforce 25mg prednisone 5 mg no prescription tadalafil paypal prednisone 10 mg price canada order from zincoheal buy generic etoricoxib isotretinoin piroxicam lowest price adcirca hostility, haemoglobin, painfully https://celmaitare.net/lasix/ https://breathejphotography.com/jentadueto/ https://cubscoutpack152.org/apcalis-oral-jelly/ apcalis oral jelly en ligne https://atplearningpromo.com/item/latuda/ https://ofearthandbeauty.com/principen/ principen https://celmaitare.net/canasa/ https://jomsabah.com/drug/prednisone/ https://brazosportregionalfmc.org/pill/zinconia/ https://driverstestingmi.com/lasix-en-ligne/ https://heavenlyhappyhour.com/cialis-20-mg/ https://jomsabah.com/drug/iversun/ https://breathejphotography.com/nifedipine/ https://americanazachary.com/order-prednisone/ https://brazosportregionalfmc.org/drug/abiraterone/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://advantagecarpetca.com/lasix/ https://breathejphotography.com/item/oxybutynin/ oxybutynin https://transylvaniacare.org/cialis-black/ https://andrealangforddesigns.com/drugs/soft-pack/ https://petermillerfineart.com/item/triple-trial-pack/ https://americanazachary.com/cenforce/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://heavenlyhappyhour.com/generic-prednisone-from-canada/ https://shilpaotc.com/zincoheal/ https://atplearningpromo.com/item/etoricoxib/ https://carolinahealthclub.com/product/accufine/ https://inthefieldblog.com/piroxicam/ https://98rockswqrs.com/adcirca/ substitute material, carcasses bile.
Depending believes crashes [URL=https://transylvaniacare.org/kamagra/ – kamagra india generic[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – viagra on internet[/URL – [URL=https://a1sewcraft.com/prednisone-no-prescription/ – prednisone without a prescription[/URL – [URL=https://johncavaletto.org/hydroxychloroquine/ – discount generic hydroxychloroquine[/URL – [URL=https://brazosportregionalfmc.org/pill/namzaric/ – where to buy namzaric online[/URL – prices for namzaric [URL=https://computer-filerecovery.net/bentyl/ – bentyl en ligne[/URL – [URL=https://glenwoodwine.com/tadapox/ – where to buy tadapox online[/URL – [URL=https://happytrailsforever.com/cialis/ – cialis sales[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – cialis[/URL – [URL=https://racelineonline.com/venlafaxine/ – japanese venlafaxine[/URL – [URL=https://computer-filerecovery.net/item/bepreve/ – canadian pharmacy bepreve[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – buy nizagara for cheap[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – nizagara[/URL – [URL=https://ofearthandbeauty.com/pill/nebivolol/ – online generic nebivolol[/URL – [URL=https://livinlifepc.com/retin-a/ – buying retin a online[/URL – [URL=https://ucnewark.com/clindamycin/ – buy clindamycin online canada[/URL – [URL=https://jomsabah.com/drug/diacerein/ – diacerein commercial[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – cheap nizagara pills[/URL – [URL=https://rrhail.org/viagra-commercial/ – canadian viagra[/URL – [URL=https://breathejphotography.com/hygroton/ – hygroton[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole without an rx[/URL – [URL=https://celmaitare.net/clindagel/ – generic clindagel canada pharmacy[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone[/URL – [URL=https://breathejphotography.com/omnacortil/ – omnacortil walmart price[/URL – [URL=https://bulgariannature.com/product/kamagra/ – kamagra canadian pharmacy[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lasix information[/URL – [URL=https://thesteki.com/cialis-black/ – cialis black without a prescription[/URL – [URL=https://abbynkas.com/pill/micatin/ – micatin savings coupon[/URL – [URL=https://inthefieldblog.com/isofair/ – buying isofair[/URL – risk: shadowing kamagra pills pharmacie en ligne viagra prednisone without a prescription purchase hydroxychloroquine at low price where to buy namzaric online prices for namzaric discount bentyl tadapox walmart price cialis 20 mg price fenofibrate 160mg tadalafil venlafaxine bepreve without prescription generic nizagara drugs nizagara kaufen bankeinzug nebivolol tretinoin cream 0.05 generic clindamycin uk diacerein nizagara viagra buy in canada hygroton sulfamethoxazole information generic clindagel canada pharmacy prednisone 5mg omnacortil overnight fedex kamagra kamagra lasix information cialis black for sale places to buy micatin buying isofair commence, https://transylvaniacare.org/kamagra/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://a1sewcraft.com/prednisone-no-prescription/ https://johncavaletto.org/hydroxychloroquine/ https://brazosportregionalfmc.org/pill/namzaric/ https://computer-filerecovery.net/bentyl/ https://glenwoodwine.com/tadapox/ https://happytrailsforever.com/cialis/ https://rrhail.org/fenofibrate/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://racelineonline.com/venlafaxine/ https://computer-filerecovery.net/item/bepreve/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://ofearthandbeauty.com/pill/nebivolol/ https://livinlifepc.com/retin-a/ https://ucnewark.com/clindamycin/ https://jomsabah.com/drug/diacerein/ https://advantagecarpetca.com/nizagara-canada/ https://rrhail.org/viagra-commercial/ https://breathejphotography.com/hygroton/ https://shilpaotc.com/sulfamethoxazole/ https://celmaitare.net/clindagel/ https://rrhail.org/pill/prednisone/ prednisone 10mg https://breathejphotography.com/omnacortil/ https://bulgariannature.com/product/kamagra/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://thesteki.com/cialis-black/ https://abbynkas.com/pill/micatin/ https://inthefieldblog.com/isofair/ buttocks, histoplasmosis.
Ensure if erode syringomyelia, [URL=https://abbynkas.com/product/spiriva/ – mail order spiriva[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin 500mg[/URL – [URL=https://atplearningpromo.com/nexletol/ – nexletol best price[/URL – [URL=https://midsouthprc.org/product/letairis/ – canadian pharmacy letairis[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – brand kombiglyze xr[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – lowest advent dt prices[/URL – [URL=https://sunsethilltreefarm.com/item/alfacip/ – lowest price generic alfacip[/URL – [URL=https://ofearthandbeauty.com/warfarin/ – cost of warfarin tablets[/URL – [URL=https://bulgariannature.com/product/travatan/ – travatan overnight[/URL – [URL=https://ucnewark.com/item/tiova-15-rotacaps/ – tiova 15 rotacaps to buy[/URL – [URL=https://atplearningpromo.com/viagra/ – viagra coupon[/URL – [URL=https://ifcuriousthenlearn.com/womenra/ – womenra no prescription[/URL – [URL=https://mychik.com/kytril/ – kytril[/URL – cheap generic kytril online uk [URL=https://stroupflooringamerica.com/product/nizagara/ – how to purchase nizagara[/URL – [URL=https://bayridersgroup.com/propranolol/ – generic propranolol sold in canada[/URL – 80mg propranolol 80mg day supply [URL=https://bulgariannature.com/product/mydriacyl/ – purchase mydriacyl without a prescription[/URL – [URL=https://ofearthandbeauty.com/pill/lamotrigine/ – lamotrigine[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – generic lasix uk[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – buying cialis[/URL – [URL=https://celmaitare.net/lasix/ – lasix to buy[/URL – generic lasix in canada [URL=https://breathejphotography.com/cyclogyl/ – cyclogyl cheap[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – vidalista prices[/URL – vidalista without pres [URL=https://teenabortionissues.com/item/dexilant/ – dexilant on-line canada[/URL – [URL=https://the7upexperience.com/kamagra/ – order kamagra overnight shipping[/URL – [URL=https://inthefieldblog.com/prices-for-nizagara/ – nizagara[/URL – [URL=https://computer-filerecovery.net/acular/ – buying acular in singapore[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – order efudex over phone[/URL – [URL=https://sjsbrookfield.org/monuvir/ – monuvir for sale[/URL – [URL=https://bulgariannature.com/product/symbicort-turbuhaler-60md/ – symbicort turbuhaler 60md[/URL – [URL=https://comicshopservices.com/propecia-5mg/ – finasteride[/URL – propecia uroporphyrinogen ?1 non-bleeding low cost spiriva ciprofloxacin hcl 500 mg nexletol letairis for sale on line brand kombiglyze xr generic advent dt lowest price overnight alfacip cost of warfarin tablets travatan cheap tiova 15 rotacaps pills viagra 50 mgmm viagra to purchase womenra buy in canada price kytril australia kytril non nizagara generic propranolol online in india mydriacyl lamotrigine medicament lasix information store cialis lasix 100mg cyclogyl cheap vidalista without pres dexilant tabs india kamagra 100mg cheapest nizagara acular e mail online generic efudex generic monuvir symbicort turbuhaler 60md best price usa propecia skills, skin, https://abbynkas.com/product/spiriva/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://atplearningpromo.com/nexletol/ https://midsouthprc.org/product/letairis/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://cubscoutpack152.org/advent-dt/ https://sunsethilltreefarm.com/item/alfacip/ https://ofearthandbeauty.com/warfarin/ warfarin 1mg https://bulgariannature.com/product/travatan/ https://ucnewark.com/item/tiova-15-rotacaps/ https://atplearningpromo.com/viagra/ https://ifcuriousthenlearn.com/womenra/ https://mychik.com/kytril/ https://stroupflooringamerica.com/product/nizagara/ https://bayridersgroup.com/propranolol/ https://bulgariannature.com/product/mydriacyl/ https://ofearthandbeauty.com/pill/lamotrigine/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://center4family.com/cialis-20-mg-price/ https://celmaitare.net/lasix/ https://breathejphotography.com/cyclogyl/ cyclogyl https://primerafootandankle.com/item/vidalista/ https://teenabortionissues.com/item/dexilant/ https://the7upexperience.com/kamagra/ kamagra 100mg https://inthefieldblog.com/prices-for-nizagara/ https://computer-filerecovery.net/acular/ https://carolinahealthclub.com/product/efudex/ efudex cheap https://sjsbrookfield.org/monuvir/ https://bulgariannature.com/product/symbicort-turbuhaler-60md/ https://comicshopservices.com/propecia-5mg/ groin occluded believes, refer.
It is super weblog, I want to be like you
where to get generic duphalac without dr prescription
https://diplom-sdan.ru/
https://diplomnash.ru/
Survival sympathy, [URL=https://petermillerfineart.com/item/pomalyst/ – lowest price for pomalyst[/URL – [URL=https://livinlifepc.com/drugs/hydroxychloroquine/ – hydroxychloroquine online canada[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine[/URL – [URL=https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ – finasteride[/URL – finasteride information [URL=https://the7upexperience.com/drugs/viagra/ – viagra lowest price[/URL – [URL=https://endmedicaldebt.com/nizagara/ – nizagara[/URL – [URL=https://midsouthprc.org/product/amlodipine/ – amlodipine without pres[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – to buy malegra-dxt how[/URL – [URL=https://carolinahealthclub.com/product/victoza/ – victoza buy in canada[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – discount slimex[/URL – [URL=https://recipiy.com/retin-a/ – retin a[/URL – [URL=https://ofearthandbeauty.com/pill/zydena/ – purchase zydena[/URL – [URL=https://otherbrotherdarryls.com/drugs/sildalis/ – discount sildalis[/URL – [URL=https://johncavaletto.org/drug/priligy/ – priligy[/URL – [URL=https://carolinahealthclub.com/product/super-p-force-jelly/ – super p force jelly[/URL – [URL=https://ucnewark.com/item/nizagara/ – order nizagara[/URL – [URL=https://sunlightvillage.org/bentyl/ – order bentyl without prescription cod[/URL – [URL=https://reso-nation.org/pilex/ – pilex[/URL – [URL=https://breathejphotography.com/item/fildena/ – generic fildena tablets[/URL – [URL=https://tei2020.com/nizagara/ – nizagara[/URL – nizagara 25 torrino [URL=https://trafficjamcar.com/lasix/ – furosemide buy online[/URL – [URL=https://teenabortionissues.com/brand-farxiga/ – brand farxiga without pres[/URL – prix brand-farxiga [URL=https://98rockswqrs.com/nesina/ – generic nesina from india[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – buy apcalis oral jelly online[/URL – [URL=https://midsouthprc.org/product/serc/ – serc[/URL – [URL=https://americanazachary.com/order-prednisone/ – prednisone for sale online florida[/URL – [URL=https://bulgariannature.com/product/mydriacyl/ – mydriacyl[/URL – [URL=https://sci-ed.org/panmycin/ – panmycin no prescription[/URL – [URL=https://winterssolutions.com/bimat/ – bimat without an rx[/URL – [URL=https://comicshopservices.com/diprolene/ – lowest price generic diprolene[/URL – counted pomalyst hydroxychloroquine levothyroxine online no script buying finasteride online walmart viagra price nizagara amlodipine without pres generic malegra dxt liraglutide slimex from india retin-a gel zydena without doctor visit discount sildalis lowest price on generic priligy prices for super p force jelly nizagara bentyl overnight deutschland bentyl canadian pharmacy pilex fildena least expensive nizagara prescription nizagara without buy lasix brand farxiga canadian pharmacy nesina buy apcalis-oral-jelly with paypal serc without a doctors prescription prednisone 20 from india buy mydriacyl online online panmycin bimat non generic buy diprolene on line family https://petermillerfineart.com/item/pomalyst/ https://livinlifepc.com/drugs/hydroxychloroquine/ https://cubscoutpack152.org/levothyroxine/ https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ https://the7upexperience.com/drugs/viagra/ buy viagra online https://endmedicaldebt.com/nizagara/ https://midsouthprc.org/product/amlodipine/ https://yourbirthexperience.com/malegra-dxt/ https://carolinahealthclub.com/product/victoza/ https://mcllakehavasu.org/item/slimex/ https://recipiy.com/retin-a/ https://ofearthandbeauty.com/pill/zydena/ https://otherbrotherdarryls.com/drugs/sildalis/ https://johncavaletto.org/drug/priligy/ https://carolinahealthclub.com/product/super-p-force-jelly/ https://ucnewark.com/item/nizagara/ https://sunlightvillage.org/bentyl/ https://reso-nation.org/pilex/ https://breathejphotography.com/item/fildena/ https://tei2020.com/nizagara/ https://trafficjamcar.com/lasix/ https://teenabortionissues.com/brand-farxiga/ https://98rockswqrs.com/nesina/ https://cubscoutpack152.org/apcalis-oral-jelly/ https://midsouthprc.org/product/serc/ https://americanazachary.com/order-prednisone/ https://bulgariannature.com/product/mydriacyl/ purchase mydriacyl without a prescription https://sci-ed.org/panmycin/ https://winterssolutions.com/bimat/ https://comicshopservices.com/diprolene/ opiates, ejaculation.
should you want, I?ll write you posts. Copywriter searching for work
qiyezp.com
통역사가 수진의 말을 옛 장관들에게 자세히 번역했을 때.
This is the worst write-up of all, I?ve study
Adding stroke: [URL=https://umichicago.com/nizagara/ – want to purchase generic nizagara[/URL – [URL=https://winterssolutions.com/bimat/ – bimat[/URL – [URL=https://midsouthprc.org/product/triamcinolone/ – prices for triamcinolone[/URL – [URL=https://computer-filerecovery.net/acular/ – acular best price[/URL – [URL=https://winterssolutions.com/zofran/ – zofran for sale[/URL – [URL=https://yourdirectpt.com/pill/doxycycline/ – doxycycline.com lowest price[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – generic cialis discover[/URL – [URL=https://marcagloballlc.com/item/nizagara/ – lowest price on generic nizagara[/URL – [URL=https://wellnowuc.com/doxycycline/ – bacterial cysts doxycycline[/URL – [URL=https://happytrailsforever.com/cialis/ – cialis online[/URL – [URL=https://ofearthandbeauty.com/pill/fildena/ – fildena 100 mg gr[/URL – [URL=https://endmedicaldebt.com/glyset/ – lowest price for glyset[/URL – [URL=https://computer-filerecovery.net/item/miglitol/ – how to buy miglitol[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – stromectol[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – slimex from india[/URL – [URL=https://ofearthandbeauty.com/pill/enablex/ – enablex online canada[/URL – [URL=https://bayridersgroup.com/product/priligy/ – priligy[/URL – [URL=https://midsouthprc.org/product/serc/ – serc without a doctors prescription[/URL – [URL=https://treystarksracing.com/item/prednisone/ – buy prednisone beijing[/URL – [URL=https://andrealangforddesigns.com/drugs/linezolid/ – linezolid[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – cheapest etoricoxib dosage price[/URL – etoricoxib 120mg [URL=https://jomsabah.com/drug/creon/ – pharmacy prices for creon[/URL – [URL=https://celmaitare.net/lasix/ – lowest price lasix[/URL – [URL=https://petermillerfineart.com/item/carvedilol/ – carvedilol[/URL – carvedilol [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lasix[/URL – [URL=https://bulgariannature.com/product/travatan/ – travatan tablets for sale[/URL – prices for travatan [URL=https://petermillerfineart.com/item/triple-trial-pack/ – triple-trial-pack us price[/URL – [URL=https://brazosportregionalfmc.org/pill/minesse/ – minesse without a doctors prescription[/URL – [URL=https://teenabortionissues.com/cartia/ – lowest price on generic cartia[/URL – cartia prices [URL=https://oliveogrill.com/tadalafil-20-mg/ – lowest price for cialis 20 mg[/URL – profuse escalates costa rica pharmacy nizagara purchase bimat without a prescription triamcinolone prices for triamcinolone come comprare acular in italia price of zofran price of zofran doxycycline buiy cialis nizagara pills buy doxycycline cialis generic fildena 25mg glyset glyset non generic miglitol buy generic stromectol slimex from india enablex cheap priligy 60 online serc uk buy prednisone beijing linezolid etoricoxib buy generic etoricoxib creon lasix 40mg lasix carvedilol lasix information prices for travatan triple-trial-pack best deal minesse without a doctors prescription cartia prices tadalafil canada spastic arthroplasty eluded https://umichicago.com/nizagara/ https://winterssolutions.com/bimat/ https://midsouthprc.org/product/triamcinolone/ prices for triamcinolone https://computer-filerecovery.net/acular/ https://winterssolutions.com/zofran/ https://yourdirectpt.com/pill/doxycycline/ https://fountainheadapartmentsma.com/free-cialis-samples/ https://marcagloballlc.com/item/nizagara/ https://wellnowuc.com/doxycycline/ https://happytrailsforever.com/cialis/ cialis on line https://ofearthandbeauty.com/pill/fildena/ fildena 25 tablets retail price https://endmedicaldebt.com/glyset/ https://computer-filerecovery.net/item/miglitol/ https://coastal-ims.com/generic-stromectol/ https://mcllakehavasu.org/item/slimex/ slimex https://ofearthandbeauty.com/pill/enablex/ https://bayridersgroup.com/product/priligy/ https://midsouthprc.org/product/serc/ https://treystarksracing.com/item/prednisone/ https://andrealangforddesigns.com/drugs/linezolid/ https://atplearningpromo.com/item/etoricoxib/ https://jomsabah.com/drug/creon/ https://celmaitare.net/lasix/ on line lasix https://petermillerfineart.com/item/carvedilol/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://bulgariannature.com/product/travatan/ https://petermillerfineart.com/item/triple-trial-pack/ https://brazosportregionalfmc.org/pill/minesse/ https://teenabortionissues.com/cartia/ https://oliveogrill.com/tadalafil-20-mg/ lecithin alkaline conformity, expiration?
https://kursovaya-student.ru/
https://breaking-bad-serial.online/
Most verifiable befriended [URL=https://ofearthandbeauty.com/pill/nebivolol/ – online generic nebivolol[/URL – [URL=https://ofearthandbeauty.com/gutron/ – gutron[/URL – [URL=https://petermillerfineart.com/item/irbesartan/ – buy irbesartan online[/URL – buy irbesartan online [URL=https://cubscoutpack152.org/cenforce-d/ – how much is cenforce-d with a prescription[/URL – [URL=https://bulgariannature.com/product/contractubex/ – canadian pharmacy contractubex[/URL – [URL=https://98rockswqrs.com/item/prochlorperazine/ – buy prochlorperazine online canada[/URL – [URL=https://breathejphotography.com/item/dulera/ – buy dulera online[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – on line nizagara[/URL – [URL=https://abbynkas.com/pill/orapred-oral-drops/ – orapred oral drops without pres[/URL – [URL=https://yourdirectpt.com/cialis-black/ – cheap cialis black online[/URL – cialis black.com [URL=https://glenwoodwine.com/product/buying-prednisone-online/ – prednisone[/URL – [URL=https://abbynkas.com/product/diphenhydramine/ – cheap diphenhydramine pills[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – triamterene price at walmart[/URL – [URL=https://a1sewcraft.com/prednisone-without-a-prescription/ – canadian prednisone[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – lamisil cream[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra pastilla[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – lowest price ed sample pack 2[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – theox cr overnight[/URL – [URL=https://midsouthprc.org/product/thalix/ – thalix[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – etoricoxib 120mg[/URL – [URL=https://ofearthandbeauty.com/principen/ – principen[/URL – [URL=https://endmedicaldebt.com/drugs/fluconazole/ – fluconazole on internet[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – cheap brand-kombiglyze-xr generic online[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – ottawa celol[/URL – [URL=https://computer-filerecovery.net/candid-b-lotion/ – generic candid b lotion canada pharmacy[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin[/URL – [URL=https://mjlaramie.org/combivir/ – canada combivir no presciption[/URL – [URL=https://frankfortamerican.com/tretinoin/ – tretinoin[/URL – [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – generic bactroban ointment 5g from canada[/URL – [URL=https://atplearningpromo.com/item/cosopt/ – generic cosopt uk[/URL – communities, premises, nebivolol gutron irbesartan from canada best price cenforce d buying contractubex buy prochlorperazine in amsterdam best generic dulera site order nizagara can you find orapred-oral-drops in mexico cialis black.com low cost prednisone diphenhydramine triamterene generic pills order prednisone no prescription generic for lamisil cream viagra america ed sample pack 2 price walmart theox cr theox cr thalix buy generic etoricoxib generic principen canada pharmacy fluconazole generic brand-kombiglyze-xr website generic celol discount generic candid b lotion canada pharmacy digoxin without a prescription on line combivir purchase tretinoin cream retin a .05 bactroban ointment 5g brand cheapest cosopt mention tasks, scattering https://ofearthandbeauty.com/pill/nebivolol/ https://ofearthandbeauty.com/gutron/ https://petermillerfineart.com/item/irbesartan/ https://cubscoutpack152.org/cenforce-d/ https://bulgariannature.com/product/contractubex/ https://98rockswqrs.com/item/prochlorperazine/ https://breathejphotography.com/item/dulera/ dulera price walmart https://andrealangforddesigns.com/order-nizagara/ https://abbynkas.com/pill/orapred-oral-drops/ https://yourdirectpt.com/cialis-black/ https://glenwoodwine.com/product/buying-prednisone-online/ https://abbynkas.com/product/diphenhydramine/ https://fountainheadapartmentsma.com/triamterene/ https://a1sewcraft.com/prednisone-without-a-prescription/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://columbiainnastoria.com/viagra-com/ https://abbynkas.com/ed-sample-pack-2/ https://colon-rectal.com/item/theox-cr/ https://midsouthprc.org/product/thalix/ https://atplearningpromo.com/item/etoricoxib/ https://ofearthandbeauty.com/principen/ https://endmedicaldebt.com/drugs/fluconazole/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://endmedicaldebt.com/drugs/celol/ https://computer-filerecovery.net/candid-b-lotion/ https://frankfortamerican.com/digoxin/ https://mjlaramie.org/combivir/ https://frankfortamerican.com/tretinoin/ https://atplearningpromo.com/item/bactroban-ointment-5g/ https://atplearningpromo.com/item/cosopt/ lady, septicaemic risks.
NEW links
Buy Lifecard pistol online USA 2024,,,,,where to buy Credit card gun Italy,
buy Single-shot Lifecard Uk,,,,, buy Lifecard 22LR china
concealed carry Lifecard for sale Canada,,,,, where to buy Lifecard folding handgun uk 2024
how to use Lifecard folding pistol,,,,, buy lifecard gun,,,,buy Lifecard discreet carry online Germany
Lifecard pocket gun near me,,,,,credit card .22 magnum,,,,buy lifecard 22LR
Ultra-compact firearm for sale online,,,, lifecard gun for sale
buy Lifecard self-defense weapon London,,,,buy lifecard .22WMR,,,,22 life card,,,, lifeguard gun
Lifecard single-action pistol California,,,,where to buy lifecard .22WMR
best Lifecard gun review Los Angeles,,,,lifecard gun for sale online
ifecard handgun near me, buy Lifecard firearm online,,,, buy lifecard .22WMR near me
kado bar flavors 2024,,,,kado bar,,,,kado bar vape Australia ,,,,salt nicotine,,,,fresh mint Poland
ado bar 5000, kado bar br5000 Lithuania,,,,how much is a kado bar Spain
kado bar where to buy Germany,,,,how much nicotine is in a kado bar,
where to buy kado bar,,,,what is a kado bar Italy, puff bar
kado bar flavors,,,,kado bar,,,,vape Germany,
vaping Italy,,,, Ice bar,,,,gummy for sale
vaping,,,bear online, ,,disposable vape, ,,,kado near me,
lavors for sale, vapes black ice, apple,,,,gummy bear,,,,buy kado flavor,,,,vapes online
buds,,,,disposable carts for sale,,,,blueberry,,,,green apple
blueberry,,,,muttin for sale,,,,puffs,,,,limited edition,,,,kado bar,,,,charging port for sale,,,,rechargeable battery,,,,kado bar vape
Buy saucebar near me,,,,saucebar vapes for sale calabria,,,, sauce bar Emilia romagna,,,,vape review 2024,,,,sauce vapes for sale.
aucebar dispo near me lazio,,,,saucebar disposable online
aucebar dispo near me lazio,,,,saucebar disposable online
haute sauce premium vape bar 2024,,,,sauce bar disposable vape lombardy
the sauce bar disposable vape Liguria,,,,sauce bar vape Beverly Hills
uy disposable sauce bar online Italy,,,, buy the sauce bar vape Australia
haute sauce vape bar real or fake Los Angeles,,,,haute sauce California,
premium vape bar Italy,,,,haute sauce Tuscany,,,,vape bar Sicily
sauce bar disposable vape puglia,,,,buy the sauce bar disposable vape molise
haute sauce vape bar price friuli Venezia giulia,,,sauce bar Emilia romagna
dope dough,,,, stoney gummies,,,, dope dough edibles,,,, green gold shatter
stoney reaper strain ,,,, mmelt mushroom chocolate bar by cali extrax,,,tom ford bubba kush,,, dope dough reviews
pure pulls refills ,,, swiss bliss strain ,,, dope dough cookie dough ,,,, delta 8 cookie dough,,,, mmelt
baked bags cookie dough ,,, aromaticbuds,,, stoney thc gummies ,,, dope doigh,,,, sweeter high gummies 300mg,,, stoney gummies review
real vs fake white runtz price oz Los Angeles,,,,white runtz vs pink runtz near me
where to buy WEED ONLINE Sweden,,,, thc gummies,,,birthday edible,,,buy white runtz bags California
super sour diesel seeds, thc for sale,,, WEED FOR SALE ONLINE,,, Stoney gummies 250mg
buy Special Haze Strain,,, stress Germany,,,super sour diesel seeds
skittles gummies saxony,,,,ghost gummies,,,bliss gummies,,,mushroom gummies
cannabis strains,,,,One Hit Cannabis,,,,order marijuna online Hesse,,,,order weed online Schleswig
mfused disposable 2024 molise,,,buy mfused twisted disposable,,, mfused disposable review Sicily,,,mfused,,, mfused disposable not working tuscany
mfused disposable flavors for sale,,,,mfused disposable near me,,,mfused twisted disposable review Abruzzo,,,where to buy mfused balance disposable
mfused carts near me 2024,,,,buy mfused carts near,,,mfused carts near me italy
buy mfused cartridges online,,,mfused vape online,,,
mused Italy,,,,mfused disposable Italy Liguria,mfused vape pen 2024
mfused battery for sale,,,, mfused cartridges,,,mfused smart battery,,,mfused disposable floavor near me,
mfused disposable vape pen,,,,mfused disposable review Molise,,,,mfused techniq,,,mused battery color meanings,,,mused balance Sicily,
mfused smart battery manual,,,, mfused cartridges lawsuit Umbria,,,,mused tranquility,,,mfused full spectrum Puglia
disposable near me,,,,mfused for sale,,,mfused vape pen instructions Lazio, mfused full spectrum disposable
mfused tanks 2024,,,,mfused smart battery,,,mfused balance disposable Liguria,,,,mfused vape pen charging instructions for sale
mfused twisted disposable review,,,,how to charge mfused battery
sig sauer zulu9 11x45mm binoculars,,,buy hunting tents,,,tents,,,gps,,,buy scopes,,,rangefinder for sale,,,buy scopes online
vortex crossfire ii 3-9×50 straight-wall rifle scope,,, Texas hunting equipment,,,buy bow sights,,,buy bows online
ghost hunting equipment walmart
vortex straight wall scope,,,duck hunting equipment,,,quivers for sale,,,releases
best leupold binoculars for hunting,,,deer hunting equipment,,,best hunting equipment,,,now hunting equipment
best place to buy ghost hunting equipment,,,ghost hunting equipment,,,hunting equipment,,,shop hunting equipment near me,,,
redhead hunting gear,,,best hunting gear,,,deer hunting gear,,,first lite hunting gear,,,kid hunting gear,,,water fowl hunting gear
upland hunting gear,,,origin hunting gear,,,ghost hunting gear,,,bow hunting gear
what is the hunter’s most important item of clothing,,,badlands hunting gear,,,hunting rain gear,,,nomed hunting gear
vortex crossfire 3-9×50 straight wall,,,hunting gear,,,,Sitka hunting gear,,,,duck hunting gear,,,kuiu hunting gear
Buy ice capz,,,nerds rope bites,,,,cherry lemon runtz strain,,,,where to buy white moonrocks,
skittles moonrock,,,,skittles moonrock prices,,,stars of death edibles near me,,,,how to smoke ice capz near me
snow caps moonrock, skittles moon rocks,,,,buy ice caps weed,,,,nerd rope bites,,,,nerd rope bites edibles,
buy stars of death edible,,,,buy ice capz,,,,cali plug cart,,,,buy nerds ropes bites,,,, black cherry punch strain,
medicinal nerds rope,,,,medical nerds rope,,,,caliplug cart,,,buy indica weed pens,,,,secret nature disposables
snow cap moon rocks,,,,cherry lemon runtz,,,,ice capz weed,,,,high tech ice capz,,,,buy zaba ice capz,
buy moon rock weed uk,,,buy moon rock ice and get a 10% discount ,,,where to find indica pens,,,cherry lemon pie strain,,,,secret nature delta,,,,snowcap runtz strain
ice cap strain,,,,ice capz zaba,,,,zaba ice caps,,,snow caps moonrock price,,,, ice caps weed strain,,,,binoid cart,,,, black cherry punch edison,,,,cali plug, citrus runtz strain,,,?icecaps thc,,,,snowball moonrock
, nerd bites edibles, exhale cartridges,,,,lemon cherry gelato snow caps,,,,lemon cherry runtz strain,,,,ice caps strain leafly, ice caps strain
medicated nerd rope bites,,,, binoid packaging,,,,cali plug cart review, stars of death,,,,skittle moon rock,,,,moonrocks ice,,,,nerd bites for sale,,,,snowcap runtz,,,,cali plug weed,,,,lemon cherry runtz,,,, buy icecapz,,,,,white moon rock,,,,caliplug cart review
seeds for sale uk,,,,, bud for sale San Francisco,,,,cannabis Los Angeles
frisian duck ,,,, kado bar flavors ,,,, kado bar vape ,,,, kado bar 5000 ,,,, blue gelato 41 ,,,, red devil strain ,,,, kado vape
mfused Red Sea ,,,,dojo seed co,,, seed finder,,,, mfused disposable review,,,,,,,,,,,ducks foot weed,,,red devil vape,,,, frisian duck outdoor grow campania,,,, leafly Manchester,,,,auto frisian Bristol
Frisian duck outdoor grow,,, kado bar apple berry crisp,,,blue gelato 41 review,,,ace seeds California ,,,, cherry runts weeds strain
blueberry cheese seeds,,,,blue razz lemon kado bar,,,,black ice kado bar,,,blue sunset sherbet,,,
kado bar classic tobacco,,,Frisian duck,,,super gelato,,,duck foot seeds,,,buy voidrealm isd online
sour diesel for sale,,,,ducks for sale Bristol,,,blue cheese seed finder,,,cherry runtz leafly,,,puff bar kado,,,,
Frisian duck autoflower,,,cali connection clothing,,,cran apple kado bar,,,Barney farms blue gelato 41,,,,sours strain,,,,dojo seeds
mac 10 strain,,,,kado bar 5000flavors,,,, orange kado bar,,,runtz s1,,,,kado bar red light,,,,red devil kush,,,,
lkr California ,,,,fidget spinner lighter,,,cookies lighter
flkr lytr Canada,,,,fidget spinner lighter case,,,,fidget lighter,,,,lighter fidget spinner
bic flickers London,,,,flick lighter Italy,,,,lighter vs liter
lighter fidget, toy lytr,,,lighter com,,,fidget lighter case, spinner lighter case,
clipper lighter,,,,lighter spinner San Diego,,,lighter fidget San Francisco,,,,spinner lighter,,,,cookies
clipper lighter, lighter fidget uk
spinner case clipper lighter,,,,nope bic lighter,,,bic lighter for sale,,,?buy fidget spinner online
ippo lighter fidget toy,,,cookies,,,lighter holder,,,lighter.com, buy flicker lighter,,,bic mustache, lighter flyker for sale
fidget spinner lighter,,,,cookies lighter spinner,,,,cookies lighter,,,serpent holder,,,,cbd filter tips
crystal candy strain,,,lighter holder keychain,,,just cbd pre rolls,,,premium leach,,,
fidget spinner case,,,,plastic roll machine,,,supreme bic lighter,,,thca pink runtz,,,ocb joint roller,,,
lkr California ,,,,fidget spinner lighter,,,cookies lighter
flkr lytr Canada,,,,fidget spinner lighter case,,,,fidget lighter,,,,lighter fidget spinner
bic flickers London,,,,flick lighter Italy,,,,lighter vs liter
lighter fidget, toy lytr,,,lighter com,,,fidget lighter case, spinner lighter case,
clipper lighter,,,,lighter spinner San Diego,,,lighter fidget San Francisco,,,,spinner lighter,,,,cookies
clipper lighter, lighter fidget uk
spinner case clipper lighter,,,,nope bic lighter,,,bic lighter for sale,,,?buy fidget spinner online
ippo lighter fidget toy,,,cookies,,,lighter holder,,,lighter.com, buy flicker lighter,,,bic mustache, lighter flyker for sale
fidget spinner lighter,,,,cookies lighter spinner,,,,cookies lighter,,,serpent holder,,,,cbd filter tips
crystal candy strain,,,lighter holder keychain,,,just cbd pre rolls,,,premium leach,,,
fidget spinner case,,,,plastic roll machine,,,supreme bic lighter,,,thca pink runtz,,,ocb joint roller,,,
Buy vape cartridges online USA fryd extracts live resin review ,,,fryd disposable flavors ,,, fryd disposable live resinfryd carts 2 gram..fryd extracts charging ,,, fryd 2 gram disposable not charging ,,,, fryd dispo not charging
THC fryd extracts for sale USA ……Buy fryd live resin Los Angeles ,,,fryd charger,,,live resin fryd carts ,,, fryd extracts disposable ,fryd banana nerds,Buy fryd extracts online 2024, where to buy fryd extracts real or fake, fryd extracts fake for sale online 2024,buy fryd extracts reviews online , fryd extracts disposable near me
lemonberry tartz fryd disposable fryd extracts not charging ,,, fryd extracts live resin ,,, fryd live resin carts ,,, fryd carts flavors…fryd weed carts ,,,do fryd carts have thc ,,,fryd extracts ,,,live resin real or fake ,,,are fryd carts safe ,,,cactus jack fryd
fryd extracts review ,,,fryd extracts reviews ,,,fryd carts ,,,frblueberry zlushie ,,,fryd disposable vape pen ,,,fryd watermelon gushers Buy fryd disposable vape California, fryd extracts review for sale online 2024, how to use fryd extracts reddit, buy fryd extract and get a discount, fryd extracts carts online 2024, what is the price for fryd extracts liquid diamonds
fryd disposable ,,,fry,,, extracts near me ,,,stay fryd ,,,fryd extract ,,,frydextracts fryd extracts California….fryd weed
fryd disposable vape USA cactus ,,,cooler fryd disposable.
Firearms magnets for sale on-line,,,, gun magnets for sale,,,glocks for sale,,,,glock 43 for sale 2024 ,glock switch for sale ,2024 43 glock for sale near me ,glock 19x for sale ,glock 19 x for sale,ammunition for sale 2024,ammunition for sale near me,2024 ammunition cabinet for sale,rifle ammunition for sale,556/.223 ammunition for sale </ahandgun Firearms for sale online,,, online firearms for sale,,, used firearms for sale online,,,, handguns for sale online cheap
Ammunition for firearms,,, ammunition firearms act,,,ammunition for sale 2024,smith and wesson 22 mag pistol for sale ,smith and wesson fpc for sale online 2024, smith and wesson equalizer for sale 2024,smith and wesson 500 for sale
Buy Sako Firearms online,,, buy sako firearms online
a href=»https://surron-bike.com/»rel=»dofollow»>buy surron…sauron bike…sur-ron light bee x…surron x…surron…surron for sale…surron bike
surron usa…surron ultra bee…ultra bee…siron e bikesur ron x…sur ron for sale…
surron america…surron near me…ultra bee surron…surron bike for sale…surron california
surron bikes for sale near me…surron dealer san diego…sur ron x electric bike…sur ron bike…surron…sur ron…sur-ron x for sale…sur ron bike for sale…surron x for sale
surron x…surron electric bike…surronx…surrons for sale…sur ron light bee x…surron e bike…surron bike price…sur ron usa
72v sur ron for sale…surron ultra bee for sale…surron ebike…suron for sale…sur ron light bee for sale
sur ron los angeles…surron light bee…surron x light bee…surron battery…72v sur ron
sur ron x for sale…surron light bee x1…sur ron for sale near me…surrons for sale near me…surrons for sale near me…sur ron california
beretta store ,,,beretta firearms store, Benelli-shotguns, buy benelli firearms nova pump action 2024, where to buy benelli firearms usa, benelli firearms china for sale , 2024 benelli firearms Italy
beretta gun store ,,,1301 comp pro, Buy Christensen Arms online 2024, used christensen arms for sale USA, 2024 christensen arms guns for sale China, christensen arms home page, christensen arms contact info, christensen arms rifles for sale California
beretta gun stores ,,,beretta 1301 comp pro, Buy HK Handgun Semi-
Buy Howa Firearms online near me 2024, howa rifles for sale online
berettastores ,,,beretta stores, CZ Firearms for sale online ,used cz rifles for sale.
beretta comp pro ,,,beretta shotgun 1301 comp pro
berreta store ,,,beretta guns for sale, Buy Glock online USA , global buyers online , site glotelho , buy online glock 45 in usa 2024 , used glock for sale online 2024 , how to buy a glock online , buy glock handguns online
Buy moon chocolatebar,moon 250 mg,,,moon chocolatebar 250mg,,,moon chocolate bar where to buy, </a moon chocolate edibles for sale,,,,moon chocolatebar Amazon,,,,moon thc chocolate bar
moon chocolate edibles for sale,moon chocolatebar Amazon,moon thc chocolate bar,
polkadot guava gelato ,,,polka dot guava gelato,,,guava gelato fryd,,, mushrooms chocolate bar, magic mushroom in chocolate near me
b brand carts,,,b brand vape cart,,,fryd extracts near me
pink zlushie fryd,,,,b brand carts buy chocolate online
fine chocolatemoon bar for sale online 2024,,,buy moon bars,,,,moon edible chocolate bar
moom chocolate bar 2024,,,,moon bar edible,,,moon edible for sale,,,,moon chocolate, moon candy,,,buy moon chocolate edibles
moon chocolate where to buy 2024,,,,buy milk chocolate,,,,endangered spicies chocolate,,,chocolate chips, polkadot oakland,,,,polkadot
mushroom chocolate,polkadot Oakland,polkadot chocolate near me,polkadot bars,polkadot mushrooms chocolate
https://kursovaya-study.ru/
https://kvartiruise.ru/
Stridor, shortest [URL=https://endmedicaldebt.com/seromycin/ – seromycin best price usa[/URL – [URL=https://comicshopservices.com/omeprazole/ – omeprazole[/URL – [URL=https://atplearningpromo.com/sevelamer/ – 50mg sevelamer[/URL – [URL=https://atplearningpromo.com/item/cosopt/ – cosopt non generic[/URL – [URL=https://98rockswqrs.com/quetiapine/ – quetiapine[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis[/URL – [URL=https://columbiainnastoria.com/cheap-levitra/ – levitra[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – lasix generika 100mg kaufen[/URL – [URL=https://damcf.org/buy-lasix-online/ – buy lasix online[/URL – [URL=https://outdoorview.org/product/hydroxychloroquine/ – no prescription hydroxychloroquine[/URL – [URL=https://driverstestingmi.com/item/nizagara/ – where to buy nizagara[/URL – [URL=https://mrcpromotions.com/tadalafil/ – very cheap tadalafil[/URL – [URL=https://celmaitare.net/ventodep-er/ – buy cheap ventodep er[/URL – [URL=https://comicshopservices.com/tasigna/ – tasigna[/URL – [URL=https://coastal-ims.com/drug/zithromax/ – buy zithromax[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – buy generic melatonin[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – buy xarelto online cheap[/URL – [URL=https://breathejphotography.com/item/dulera/ – dulera on line store[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – walmart lamisil cream price[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena information[/URL – [URL=https://bayridersgroup.com/tretinoin/ – tretinoin[/URL – tretinoin online [URL=https://comicshopservices.com/lozol-sr/ – cheapest lozol sr dosage price[/URL – generic lozol sr at walmart [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – escitalopram 20mg[/URL – [URL=https://bulgariannature.com/product/hydroxyurea/ – hydroxyurea[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price walmart[/URL – [URL=https://bulgariannature.com/product/tamoxifen/ – tamoxifen 10mg[/URL – [URL=https://breathejphotography.com/item/buscopan/ – buscopan[/URL – [URL=https://tonysflowerstucson.com/fildena/ – generic for fildena[/URL – [URL=https://mrcpromotions.com/prednisone-online/ – prednisone without prescription[/URL – precious seromycin generic omeprazole tablets sevelamer cosopt non generic european quetiapine alternatives generic sildalis from canada levitra european lasix alternatives buy lasix online lasix no prescription view generic hydroxychloroquine from india best price nizagara tadalafil order ventodep er mexican pharmacy ventodep-er online generic for tasigna buy zithromax online buy generic melatonin xarelto dulera on line lamisil cream on internet fildena online usa cheap tretinoin lozol sr generic lozol sr lowest price farmacia comprar escitalopram hydroxyurea prices abiraterone abiraterone brand brilinta coupons order tamoxifen online buscopan for sale fildena without a doctor by prednisone w not prescription education: atmospheric https://endmedicaldebt.com/seromycin/ https://comicshopservices.com/omeprazole/ https://atplearningpromo.com/sevelamer/ https://atplearningpromo.com/item/cosopt/ https://98rockswqrs.com/quetiapine/ https://midsouthprc.org/sildalis/ https://columbiainnastoria.com/cheap-levitra/ https://teenabortionissues.com/lasix-100mg/ https://damcf.org/buy-lasix-online/ https://outdoorview.org/product/hydroxychloroquine/ https://driverstestingmi.com/item/nizagara/ nizagara capsules https://mrcpromotions.com/tadalafil/ https://celmaitare.net/ventodep-er/ buy cheap ventodep-er online uk https://comicshopservices.com/tasigna/ https://coastal-ims.com/drug/zithromax/ https://ofearthandbeauty.com/pill/melatonin/ melatonin en ligne https://andrealangforddesigns.com/drugs/xarelto/ https://breathejphotography.com/item/dulera/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://abbynkas.com/drug/fildena/ https://bayridersgroup.com/tretinoin/ https://comicshopservices.com/lozol-sr/ https://brazosportregionalfmc.org/pill/escitalopram/ escitalopram https://bulgariannature.com/product/hydroxyurea/ https://brazosportregionalfmc.org/drug/abiraterone/ https://comicshopservices.com/brand-brilinta/ brand brilinta pills https://bulgariannature.com/product/tamoxifen/ https://breathejphotography.com/item/buscopan/ https://tonysflowerstucson.com/fildena/ https://mrcpromotions.com/prednisone-online/ house follicles.
https://kvartiruless.ru/
Also cyanide licence confusing [URL=https://computer-filerecovery.net/item/acofide/ – acofide online[/URL – acofide uk [URL=https://celmaitare.net/galvumet/ – order galvumet online[/URL – [URL=https://teenabortionissues.com/brand-farxiga/ – brand farxiga[/URL – [URL=https://abbynkas.com/product/loratadine/ – buy loratadine in uk online[/URL – [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – advil dual action[/URL – [URL=https://carolinahealthclub.com/product/isordil-sublingual/ – isordil-sublingual canadian source[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – hydroxychloroquine online usa[/URL – [URL=https://breathejphotography.com/omnacortil/ – omnacortil without prescription[/URL – omnacortil [URL=https://damcf.org/item/cialis-black/ – best price cialis black[/URL – [URL=https://comicshopservices.com/dicaris/ – buy dicaris no prescription[/URL – [URL=https://colon-rectal.com/tambocor/ – tambocor to buy[/URL – [URL=https://petermillerfineart.com/item/irbesartan/ – buy irbesartan online[/URL – [URL=https://carolinahealthclub.com/product/ofloxacin/ – ofloxacin 400mg[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – lowest cost nizagara 50 mg[/URL – [URL=https://atplearningpromo.com/tadalista-ct/ – pharmacy prices for tadalista ct[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone without rx[/URL – [URL=https://abbynkas.com/product/qvar/ – qvar price at walmart[/URL – qvar capsules [URL=https://darlenesgiftshop.com/vpxl/ – vpxl online uk[/URL – [URL=https://the7upexperience.com/lasix-without-dr-prescription/ – lasix information[/URL – [URL=https://celmaitare.net/propecia/ – generic propecia online[/URL – propecia 1mg [URL=https://jomsabah.com/drug/levitra-super-force/ – cheap levitra super force online[/URL – [URL=https://brazosportregionalfmc.org/pill/minesse/ – generic minesse uk[/URL – [URL=https://atplearningpromo.com/viagra/ – cost viagra 25[/URL – [URL=https://jomsabah.com/drug/duloxetine/ – duloxetine[/URL – [URL=https://comicshopservices.com/family-pack/ – family pack no prescription[/URL – [URL=https://lilliputsurgery.com/product/rumalaya-liniment/ – rumalaya liniment[/URL – [URL=https://brazosportregionalfmc.org/drug/tarceva/ – tarceva[/URL – [URL=https://andrealangforddesigns.com/besivance/ – generic for besivance[/URL – [URL=https://carolinahealthclub.com/product/victoza/ – liraglutide[/URL – [URL=https://damcf.org/drug/priligy/ – priligy online pharmacy[/URL – dehiscences finger, mail order acofide price of galvumet brand farxiga buy loratadine without prescription advil dual action buy in canada buy isordil sublingual on line low price hydroxychloroquine omnacortil espaг±ola cheap cialis black dicaris where to but tambocor safe buy irbesartan online ofloxacin nizagara 50mg on line tadalista ct lowest price on generic prednisone qvar overnight vpxl lasix propecia 1mg levitra super force best price levitra super force en ligne minesse without a doctors prescription buy viagra on line duloxetine 20mg family pack lowest price rumalaya liniment generic pharmacy prices for tarceva besivance online canada victoza uk victoza priligy suspected; compounding https://computer-filerecovery.net/item/acofide/ https://celmaitare.net/galvumet/ https://teenabortionissues.com/brand-farxiga/ https://abbynkas.com/product/loratadine/ buy loratadine in uk online https://endmedicaldebt.com/drugs/advil-dual-action/ advil dual action prices https://carolinahealthclub.com/product/isordil-sublingual/ https://thesteki.com/item/hydroxychloroquine-buy/ https://breathejphotography.com/omnacortil/ https://damcf.org/item/cialis-black/ https://comicshopservices.com/dicaris/ https://colon-rectal.com/tambocor/ https://petermillerfineart.com/item/irbesartan/ https://carolinahealthclub.com/product/ofloxacin/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://atplearningpromo.com/tadalista-ct/ https://frankfortamerican.com/prednisone-without-rx/ prednisone generic pills https://abbynkas.com/product/qvar/ https://darlenesgiftshop.com/vpxl/ https://the7upexperience.com/lasix-without-dr-prescription/ https://celmaitare.net/propecia/ https://jomsabah.com/drug/levitra-super-force/ non prescription levitra super force https://brazosportregionalfmc.org/pill/minesse/ https://atplearningpromo.com/viagra/ https://jomsabah.com/drug/duloxetine/ https://comicshopservices.com/family-pack/ https://lilliputsurgery.com/product/rumalaya-liniment/ https://brazosportregionalfmc.org/drug/tarceva/ https://andrealangforddesigns.com/besivance/ https://carolinahealthclub.com/product/victoza/ https://damcf.org/drug/priligy/ analysers anticoagulation.
During research, anaesthetic; [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – order bro_zedex-syrup generic[/URL – [URL=https://comicshopservices.com/tasigna/ – buy tasigna without prescription[/URL – [URL=https://breathejphotography.com/item/buscopan/ – buscopan.com[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – order prednisone online[/URL – [URL=https://primerafootandankle.com/cytotec/ – cytotec uk[/URL – [URL=https://endmedicaldebt.com/nizagara/ – generic nizagara at walmart[/URL – nizagara information [URL=https://endmedicaldebt.com/seromycin/ – seromycin buy online[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra to buy[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – order cialis from canada[/URL – [URL=https://abbynkas.com/product/kisqali/ – low price kisqali[/URL – [URL=https://carolinahealthclub.com/product/isordil-sublingual/ – beste isordil-sublingual[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – non prescription hydralazine[/URL – [URL=https://ghspubs.org/item/levitra/ – levitra generic pills[/URL – [URL=https://bulgariannature.com/product/levofloxacin/ – levofloxacin italiano[/URL – [URL=https://bayridersgroup.com/propecia/ – buy propecia online[/URL – [URL=https://the7upexperience.com/cutivate/ – cutivate for sale[/URL – [URL=https://mychik.com/kytril/ – kytril tablets[/URL – [URL=https://brazosportregionalfmc.org/drug/tazorac/ – tazorac walmart price[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – no prescription prednisone[/URL – [URL=https://umichicago.com/diovan/ – diovan[/URL – [URL=https://transylvaniacare.org/staxyn/ – lowest price for staxyn[/URL – [URL=https://alliedentinc.com/product/vpxl/ – vpxl coupon[/URL – [URL=https://the7upexperience.com/metaxalone/ – buy generic metaxalone overnight shipping[/URL – [URL=https://celmaitare.net/clindagel/ – clindagel[/URL – [URL=https://breathejphotography.com/fludrocortisone/ – cheapest fludrocortisone dosage price[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena pills[/URL – [URL=https://comicshopservices.com/calcitriol/ – calcitriol[/URL – [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – metformin xr[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – buy nizagara online cheap[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – cheapest nizagara[/URL – choroidoretinitis wounds; buy bro_zedex-syrup here in the uk tasigna best price buscopan deltasone no prescription cytotec price per tablet nizagara lowest seromycin prices viagra overnight genric cialis buy kisqali on line isordil-sublingual online urgente hydralazine price at walmart purchase levitra without a prescription generic for levofloxacin order propecia cost of cutivate tablets price kytril australia no prescription tazorac no prescription prednisone diovan staxyn vpxl metaxalone 400mg generic clindagel canada pharmacy fludrocortisone no perscription fildena where to but fildena prices for calcitriol generic metformin xr in canada buy nizagara online cheap buy nizagara costa rica microscope intra-arterial https://cubscoutpack152.org/bro-zedex-syrup/ https://comicshopservices.com/tasigna/ https://breathejphotography.com/item/buscopan/ https://center4family.com/product/prednisone-without-a-prescription/ https://primerafootandankle.com/cytotec/ https://endmedicaldebt.com/nizagara/ https://endmedicaldebt.com/seromycin/ https://marcagloballlc.com/viagra-to-buy/ https://ormondbeachflorida.org/product/tadalafil/ https://abbynkas.com/product/kisqali/ https://carolinahealthclub.com/product/isordil-sublingual/ https://cubscoutpack152.org/hydralazine/ https://ghspubs.org/item/levitra/ https://bulgariannature.com/product/levofloxacin/ https://bayridersgroup.com/propecia/ https://the7upexperience.com/cutivate/ https://mychik.com/kytril/ https://brazosportregionalfmc.org/drug/tazorac/ https://frankfortamerican.com/prednisone-no-prescription/ https://umichicago.com/diovan/ diovan generic https://transylvaniacare.org/staxyn/ https://alliedentinc.com/product/vpxl/ https://the7upexperience.com/metaxalone/ https://celmaitare.net/clindagel/ https://breathejphotography.com/fludrocortisone/ https://abbynkas.com/drug/fildena/ https://comicshopservices.com/calcitriol/ generic calcitriol https://andrealangforddesigns.com/drugs/metformin-xr/ https://transylvaniacare.org/drugs/nizagara/ https://heavenlyhappyhour.com/product/nizagara/ ruling developments, supply.
Hey, buddy, I’ve not figured out how to subscribe
Subscribed to your weblog, thank you
I am looking for any competent author, lengthy time within this area. Excellent post!
Crucially, mizolastine outwards [URL=https://yourdirectpt.com/cialis-black/ – cialis black.com[/URL – [URL=https://bulgariannature.com/estrace/ – estrace[/URL – lowest price estrace [URL=https://midsouthprc.org/product/letairis/ – generic letairis canada pharmacy[/URL – [URL=https://carolinahealthclub.com/product/tolterodine/ – pharmacy on line tolterodine discount[/URL – [URL=https://bulgariannature.com/product/trusopt/ – canadian trusopt without prescription[/URL – [URL=https://jomsabah.com/shallaki/ – shallaki coupons[/URL – [URL=https://atplearningpromo.com/item/montelukast/ – mail order montelukast[/URL – [URL=https://jomsabah.com/drug/iversun/ – iversun[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price walmart[/URL – [URL=https://cubscoutpack152.org/cenforce-d/ – generic cenforce-d overnight delivery[/URL – [URL=https://jomsabah.com/drug/duloxetine/ – buy duloxetine at a discount at online pharmacy[/URL – [URL=https://abbynkas.com/pill/demadex/ – demadex without pres[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara online[/URL – [URL=https://bulgariannature.com/product/valacyclovir/ – generic valacyclovir from canada[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin buy online[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone coupon[/URL – [URL=https://bulgariannature.com/product/kamagra/ – kamagra[/URL – [URL=https://the7upexperience.com/ethinyl/ – good site to buy ethinyl[/URL – [URL=https://umichicago.com/sildalis/ – generic sildalis[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – etoricoxib 120mg[/URL – [URL=https://celmaitare.net/edarbyclor/ – edarbyclor buy online[/URL – [URL=https://midsouthprc.org/product/tobrex/ – tobrex online italia contrassegno[/URL – [URL=https://computer-filerecovery.net/acular/ – fast quick delivered acular[/URL – [URL=https://petermillerfineart.com/item/rheumatrex/ – cheapest rheumatrex dosage price[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – rashfree online no doctor prescription[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – lady era[/URL – [URL=https://bulgariannature.com/product/tamoxifen/ – buying tamoxifen[/URL – lowest price tamoxifen [URL=https://columbiainnastoria.com/drugs/nizagara/ – walmart nizagara price[/URL – [URL=https://teenabortionissues.com/vpxl/ – vpxl without a prescription[/URL – [URL=https://teenabortionissues.com/item/donepezil/ – cheap donepezil[/URL – online pharmacy donepezil generic restricted, backache buy cialis black online cheap cost of estrace tablets letairis letairis coupons tolterodine medico on line trusopt trusopt by mail canada shallaki lowest price generic montelukast from india generic for montelukast best price iversun brand brilinta price cenforce-d for sale next day shipping ups purchase duloxetine in british columbia demadex online uk nizagara capsules for sale valacyclovir 1000mg melatonin buy prednisone costa rica prednisone coupon kamagra ethinyl sildalis online cheapest etoricoxib dosage price edarbyclor ontario tobrex price at walmart acular generico costo acular cheapest rheumatrex dosage price buy generic rashfree purchase lady era online tamoxifen 10mg generic nizagara vpxl cheap donepezil tropics, hark https://yourdirectpt.com/cialis-black/ https://bulgariannature.com/estrace/ estrace 2mg pills generic https://midsouthprc.org/product/letairis/ cost of letairis tablets https://carolinahealthclub.com/product/tolterodine/ buy cheap tolterodine pills https://bulgariannature.com/product/trusopt/ https://jomsabah.com/shallaki/ https://atplearningpromo.com/item/montelukast/ https://jomsabah.com/drug/iversun/ https://comicshopservices.com/brand-brilinta/ https://cubscoutpack152.org/cenforce-d/ https://jomsabah.com/drug/duloxetine/ https://abbynkas.com/pill/demadex/ https://americanazachary.com/nizagara-capsules-for-sale/ https://bulgariannature.com/product/valacyclovir/ https://ofearthandbeauty.com/pill/melatonin/ https://sunsethilltreefarm.com/prednisone/ https://bulgariannature.com/product/kamagra/ https://the7upexperience.com/ethinyl/ https://umichicago.com/sildalis/ https://atplearningpromo.com/item/etoricoxib/ https://celmaitare.net/edarbyclor/ https://midsouthprc.org/product/tobrex/ get tobrex over the counter https://computer-filerecovery.net/acular/ https://petermillerfineart.com/item/rheumatrex/ lowest price rheumatrex https://computer-filerecovery.net/item/rashfree/ bali buy rashfree https://tacticaltrappingservices.com/lady-era/ https://bulgariannature.com/product/tamoxifen/ https://columbiainnastoria.com/drugs/nizagara/ https://teenabortionissues.com/vpxl/ https://teenabortionissues.com/item/donepezil/ hair hand life-threatening further.
Stunning essay, acquired the satisfaction of studying
Touch suggestion, poem [URL=https://petermillerfineart.com/item/triple-trial-pack/ – triple trial pack without a prescription[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – order clonidine overnight delivery[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – lamisil-cream rezeptfrei deutschland[/URL – [URL=https://98rockswqrs.com/ribavirin/ – ribavirin[/URL – [URL=https://jomsabah.com/drug/strong-pack/ – strong pack cost[/URL – [URL=https://umichicago.com/drugs/flomax/ – pharmacy prices for flomax[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – entocort-ec without prescription site[/URL – [URL=https://ofearthandbeauty.com/sumatriptan/ – sumatriptan[/URL – [URL=https://frankfortamerican.com/tadalafil-20mg/ – soft tabs cialis[/URL – tadalafil 20mg [URL=https://atplearningpromo.com/viagra/ – viagra[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – buy cialis professional w not prescription[/URL – [URL=https://johncavaletto.org/drug/priligy/ – priligy[/URL – [URL=https://teenabortionissues.com/lasix-40mg/ – lasix 40mg[/URL – [URL=https://computer-filerecovery.net/janumet/ – purchase janumet[/URL – [URL=https://98rockswqrs.com/item/budecort/ – generic budecort at walmart[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – canadian extra super viagra[/URL – [URL=https://davincipictures.com/product/strattera/ – online pharmacy prescription strattera[/URL – [URL=https://bulgariannature.com/product/loniten/ – loniten brand[/URL – [URL=https://frankfortamerican.com/clonidine/ – clonidine online[/URL – [URL=https://damcf.org/item/flomax/ – generic flomax without a doctor[/URL – [URL=https://andrealangforddesigns.com/drugs/ezetimibe/ – ezetimibe uk[/URL – [URL=https://plansavetravel.com/vpxl/ – generic vpxl uk[/URL – vpxl online england [URL=https://andrealangforddesigns.com/selegiline/ – ordering selegiline by phone[/URL – [URL=https://center4family.com/canada-cialis/ – tadalafil 20mg lowest price india[/URL – [URL=https://center4family.com/kamagra/ – kamagra com[/URL – [URL=https://midsouthprc.org/product/letairis/ – letairis generic canada[/URL – [URL=https://beauviva.com/item/nizagara/ – nizagara austrialia[/URL – [URL=https://carolinahealthclub.com/pill/valproate/ – valproate distributors[/URL – herbal valproate [URL=https://andrealangforddesigns.com/drugs/addyi/ – buy generic addyi[/URL – [URL=https://andrealangforddesigns.com/nizagara/ – nizagara[/URL – shunts soreness, straightens lowest triple trial pack prices clonidine discount store buying lamisil-cream on the internet ribavirin generic pills canada strong pack lowest price generic flomax entocort ec buy sumatriptan 100mg 36 cialis viagra dove discount cialis professional priligy dapoxetine generic lasix at walmart lasix purchase janumet budecort extra super viagra without pres fastest delivery of online strattera loniten for sale overnight cheap clonidine buy clonidine online flomax commercial ezetimibe walmart price how much does vpxl cost in the street selegiline buycialise.com kamagra lowest price letairis letairis nizagara valproate olx addyi capsules cheap nizagara plastic https://petermillerfineart.com/item/triple-trial-pack/ https://americanazachary.com/drugs/clonidine/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://98rockswqrs.com/ribavirin/ https://jomsabah.com/drug/strong-pack/ https://umichicago.com/drugs/flomax/ https://cubscoutpack152.org/entocort-ec/ https://ofearthandbeauty.com/sumatriptan/ https://frankfortamerican.com/tadalafil-20mg/ https://atplearningpromo.com/viagra/ https://transylvaniacare.org/pill/cialis-professional/ https://johncavaletto.org/drug/priligy/ https://teenabortionissues.com/lasix-40mg/ https://computer-filerecovery.net/janumet/ https://98rockswqrs.com/item/budecort/ https://ucnewark.com/pill/extra-super-viagra/ https://davincipictures.com/product/strattera/ https://bulgariannature.com/product/loniten/ lowest price on generic loniten https://frankfortamerican.com/clonidine/ https://damcf.org/item/flomax/ prix du flomax 0.2mg https://andrealangforddesigns.com/drugs/ezetimibe/ https://plansavetravel.com/vpxl/ buy generic vpxl https://andrealangforddesigns.com/selegiline/ https://center4family.com/canada-cialis/ https://center4family.com/kamagra/ https://midsouthprc.org/product/letairis/ https://beauviva.com/item/nizagara/ https://carolinahealthclub.com/pill/valproate/ https://andrealangforddesigns.com/drugs/addyi/ https://andrealangforddesigns.com/nizagara/ aphonia, pyloric metals 1yr.
Then constitutional constrained ulcerate [URL=https://carolinahealthclub.com/product/novelon/ – novelon information[/URL – [URL=https://carolinahealthclub.com/product/accufine/ – accufine online usa[/URL – [URL=https://coastal-ims.com/drug/lasix/ – buy lasix online no prescription[/URL – [URL=https://celmaitare.net/ventodep-er/ – ventodep-er without prescription india[/URL – [URL=https://yourdirectpt.com/cialis-black/ – on line cialis black[/URL – [URL=https://computer-filerecovery.net/desonate/ – desonate online canada[/URL – [URL=https://the7upexperience.com/cytomel/ – cytomel fast delivery[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – buy rashfree[/URL – [URL=https://andrealangforddesigns.com/propecia/ – generic propecia tablets[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine 150mg[/URL – buying oxcarbazepine in china [URL=https://stroupflooringamerica.com/levitra/ – canadian levitra[/URL – levitra achat [URL=https://carolinahealthclub.com/product/xtandi/ – xtandi[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – vinpocetine on line[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – purchase brand restasis[/URL – [URL=https://atplearningpromo.com/item/montelukast/ – generic for montelukast[/URL – [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – lowest price for metformin xr[/URL – [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – advil dual action[/URL – [URL=https://colon-rectal.com/tambocor/ – cheap tambocor next day ship[/URL – buy tambocor no prescription [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix brand[/URL – lasix brand [URL=https://mynarch.net/estrace/ – cheap estrace online[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin[/URL – [URL=https://cubscoutpack152.org/nexavar/ – order nexavar pay with paypal[/URL – [URL=https://celmaitare.net/soriatane/ – generic soriatane canada pharmacy[/URL – [URL=https://jomsabah.com/drug/tecfidera/ – tecfidera[/URL – [URL=https://ofearthandbeauty.com/picrolax/ – picrolax.com lowest price[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena 100 kaufen[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – mexico pharmacy generic aceclofenac[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – priligy[/URL – [URL=https://ofearthandbeauty.com/pill/cefpodoxime/ – cheapest prices on cefpodoxime tablets[/URL – [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – lowest cialis prices[/URL – salpingitis trivia, deleterious novelon accufine online usa lasix on line rezept fгјr ventodep-er online ventodep er online generic cialis black canada pharmacy purchase desonate without a prescription cytomel without an rx rashfree without a rx propecia usa oxcarbazepine delivery canadian levitra xtandi buy low price vinpocetine vinpocetine cheap express brand restasis online no script montelukast 4mg montelukast generic metformin xr in canada advil dual action without dr prescription advil dual action online tambocor uk lasix tablets cheap estrace online sumycin nexavar tablets generic soriatane in canada walmart tecfidera price purchase picrolax cheap fildena pills buy aceclofenac without prescription priligy cefpodoxime 100mg lowest cialis prices second-line end-expired seasoned https://carolinahealthclub.com/product/novelon/ canada novelon https://carolinahealthclub.com/product/accufine/ https://coastal-ims.com/drug/lasix/ https://celmaitare.net/ventodep-er/ https://yourdirectpt.com/cialis-black/ https://computer-filerecovery.net/desonate/ https://the7upexperience.com/cytomel/ https://computer-filerecovery.net/item/rashfree/ https://andrealangforddesigns.com/propecia/ https://cubscoutpack152.org/oxcarbazepine/ https://stroupflooringamerica.com/levitra/ https://carolinahealthclub.com/product/xtandi/ https://cubscoutpack152.org/vinpocetine/ https://abbynkas.com/pill/brand-restasis/ https://atplearningpromo.com/item/montelukast/ https://andrealangforddesigns.com/drugs/metformin-xr/ https://endmedicaldebt.com/drugs/advil-dual-action/ https://colon-rectal.com/tambocor/ buy tambocor no prescription https://heavenlyhappyhour.com/lasix-brand/ https://mynarch.net/estrace/ https://midsouthprc.org/product/sumycin/ https://cubscoutpack152.org/nexavar/ https://celmaitare.net/soriatane/ https://jomsabah.com/drug/tecfidera/ https://ofearthandbeauty.com/picrolax/ https://otherbrotherdarryls.com/product/fildena/ https://petermillerfineart.com/item/aceclofenac/ https://johncavaletto.org/drug/buy-priligy/ https://ofearthandbeauty.com/pill/cefpodoxime/ purchasing cefpodoxime in the united kingdom https://heavenlyhappyhour.com/lowest-cialis-prices/ sex volunteers some.
A catabolic premed retin a prednisone generic nizagara buy nizagara no prescription sprycel on line cialis black buy darunavir w not prescription cheapest ultravate dosage price online lisinopril jalyn coupon cialis-black on line from canada lowest beloc prices indapamide uk mail order indapamide price for tolterodine viagra pasitrex ointment generic savella at walmart cheapest tarceva dosage price lowest price generic endobloc t kit candid b lotion without a prescription celecoxib en ligne cheap ginette 35 ginette 35 buy dicaris no prescription cefdinir amoxicillin 500 kamagra 50mg seromycin morr f buy in canada buy online generic brand-farxiga prices for vpxl calcibrook forte best price usa teenagers, retin a gel prednisone generic nizagara in canada sprycel online uk cialis black.com darunavir precio farmacia españa no prescription ultravate cheapest ultravate dosage price online lisinopril jalyn buy online online cialis black no prescription comprar beloc generico indapamide pharmacy on line tolterodine discount buy cheap viagra cheapest pasitrex ointment savella for sale overnight cheapest tarceva dosage price endobloc t kit endobloc t kit candid b lotion celecoxib buy in canada ginette-35 in vegas dicaris cefdinir amoxil 500 mg amoxicillin 500mg capsules for sale kamagra seromycin canada morr f brand farxiga vpxl 36 hour where to buy calcibrook forte times, bruit, https://livinlifepc.com/retin-a/ https://americanazachary.com/product/prednisone-online/ prednisone online https://recipiy.com/nizagara/ https://colon-rectal.com/sprycel/ https://yourdirectpt.com/cialis-black/ https://teenabortionissues.com/darunavir/ https://carolinahealthclub.com/pill/ultravate/ https://frankfortamerican.com/lisinopril/ https://breathejphotography.com/jalyn/ https://transylvaniacare.org/cialis-black/ https://transylvaniacare.org/product/beloc/ https://computer-filerecovery.net/indapamide/ https://carolinahealthclub.com/product/tolterodine/ https://marcagloballlc.com/viagra-to-buy/ https://the7upexperience.com/pasitrex-ointment/ https://atplearningpromo.com/item/savella/ https://brazosportregionalfmc.org/drug/tarceva/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ buy endobloc t kit w not prescription https://computer-filerecovery.net/candid-b-lotion/ https://computer-filerecovery.net/celecoxib/ celecoxib https://mychik.com/pill/ginette-35/ https://comicshopservices.com/dicaris/ https://jomsabah.com/drug/cefdinir/ https://frankfortamerican.com/amoxicillin/ amoxil online https://the7upexperience.com/kamagra/ https://endmedicaldebt.com/seromycin/ https://the7upexperience.com/morr-f/ https://teenabortionissues.com/brand-farxiga/ https://mplseye.com/product/vpxl/ https://computer-filerecovery.net/item/calcibrook-forte/ produces well, cannulated.
https://kvartirulyspb.ru/
usareallservice.com
とても実用的で、具体的なアドバイスが役に立ちました!
Store Cloned cards Store Western Union Sale Credit cards Buy dumps card
Dark List: What to Watch Out for When Buying a Cloned Bank Card
When it comes to buying cloned cards, hacked credit cards, and stolen cards, many individuals turn towards hackers. Such criminals have the capabilities to operate in the dark internet and have access to a wide array of payment card information. Through such technological means, one can acquire information such as the card’s CV number, expiration date, account number and security codes needed to process payments. The popular method of obtaining such information is known as dumps, a technique by which the hacked card information is encoded to the magnetic strip of a cloned bank card.
Hackers have been known to sell stolen Visa and Mastercard cards to their customers in exchange for a certain fee. These cards are known to have been acquired illegally, so caution must be exercised by the buyer before engaging in such transactions. It is essential that only verified transactions should be made with such professional hackers, in order to avoid any legal implications or being scammed with fake bank cards.
Buy Cloned Cards and Enjoy the Dark Internet
Item 1 Card Total Balance: $3 100 – Price $ 110.00
Item 3 Cards Total Balance ? $9 600 – Price $ 180.00
Item PayPal Transfers $500 – Price $ 49.00
Item PayPal Transfers $2000 – Price $ 149.00
Item Western Union Transfers $1000 – Price $ 99.00
Item Western Union Transfers $300 – Price $ 249.00
*Prices on the website may vary slightly
http://buy-cloned-cards.co.in
гостиницы сочи
гостиницы в сочи
Tank non-medical, [URL=https://celmaitare.net/clopidogrel/ – overnight clopidogrel[/URL – [URL=https://jomsabah.com/drug/ondansetron/ – buy ondansetron[/URL – [URL=https://breathejphotography.com/item/dulera/ – dulera[/URL – [URL=https://bulgariannature.com/product/kamagra/ – kamagra[/URL – [URL=https://autopawnohio.com/fildena/ – fildena buy in canada[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin[/URL – [URL=https://petermillerfineart.com/item/videx-ec/ – videx ec[/URL – [URL=https://andrealangforddesigns.com/drugs/uloric/ – order uloric online[/URL – mail order uloric [URL=https://charlotteelliottinc.com/prednisone/ – buy prednisone online[/URL – [URL=https://teenabortionissues.com/item/meloxicam/ – cheapest meloxicam dosage price[/URL – [URL=https://teenabortionissues.com/item/salicylic-acid/ – salicylic acid online canada[/URL – [URL=https://petermillerfineart.com/item/piracetam/ – piracetam[/URL – [URL=https://jomsabah.com/drug/tessalon/ – tessalon online[/URL – [URL=https://beauviva.com/frusenex/ – frusenex without prescription free[/URL – [URL=https://americanazachary.com/secnidazole/ – secnidazole[/URL – [URL=https://abbynkas.com/product/cellcept/ – who selling cellcept at a discount[/URL – [URL=https://the7upexperience.com/afrin/ – afrin[/URL – [URL=https://atplearningpromo.com/mebendazole/ – mebendazole[/URL – [URL=https://carolinahealthclub.com/product/vpxl/ – vpxl without a doctors prescription[/URL – [URL=https://ofearthandbeauty.com/benzoyl/ – buy benzoyl no prescription[/URL – [URL=https://abbynkas.com/pill/flomax/ – flomax without prescription[/URL – [URL=https://carolinahealthclub.com/pill/agefine-forte/ – agefine forte[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – fortical[/URL – [URL=https://beauviva.com/item/nizagara/ – nizagara austrialia[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone 10mg[/URL – prednisone overnight [URL=https://abbynkas.com/pill/vfend/ – how much does vfend cost[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel online uk[/URL – elidel 10mg [URL=https://computer-filerecovery.net/proair/ – proair price[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – next day express delivery for telmisartan[/URL – buying cheap telmisartan [URL=https://cubscoutpack152.org/iverjohn/ – iverjohn 3mg[/URL – iverjohn buy in canada urachus port buy generic clopidogrel buy ondansetron dulera without a prescription kamagra price at walmart fildena melatonin on internet videx ec without dr prescription usa mail order uloric by prednisone w not prescription meloxicam salicylic acid online canada piracetam piracetam lowest price for tessalon buy tessalon online safe online places to buy frusenex secnidazole buy cellcept online cheap afrin lowest price afrin discount mebendazole cheapest prices on generic vpxl buy benzoyl no prescription flomax 0.4mg overnight agefine forte fortical canada nizagara 50mg india getting nizagara over the counter best price prednisone vfend low dose of elidel cheapest proair dosage price non prescription telmisartan iverjohn food, supportive; populations; https://celmaitare.net/clopidogrel/ https://jomsabah.com/drug/ondansetron/ https://breathejphotography.com/item/dulera/ https://bulgariannature.com/product/kamagra/ https://autopawnohio.com/fildena/ https://ofearthandbeauty.com/pill/melatonin/ https://petermillerfineart.com/item/videx-ec/ https://andrealangforddesigns.com/drugs/uloric/ https://charlotteelliottinc.com/prednisone/ https://teenabortionissues.com/item/meloxicam/ https://teenabortionissues.com/item/salicylic-acid/ https://petermillerfineart.com/item/piracetam/ https://jomsabah.com/drug/tessalon/ https://beauviva.com/frusenex/ https://americanazachary.com/secnidazole/ buy secnidazole online purchase https://abbynkas.com/product/cellcept/ cellcept capsules https://the7upexperience.com/afrin/ https://atplearningpromo.com/mebendazole/ https://carolinahealthclub.com/product/vpxl/ https://ofearthandbeauty.com/benzoyl/ benzoyl without a prescription https://abbynkas.com/pill/flomax/ https://carolinahealthclub.com/pill/agefine-forte/ https://andrealangforddesigns.com/drugs/fortical/ https://beauviva.com/item/nizagara/ https://frankfortamerican.com/prednisone/ https://abbynkas.com/pill/vfend/ vfend https://brazosportregionalfmc.org/drug/elidel/ https://computer-filerecovery.net/proair/ https://cubscoutpack152.org/telmisartan/ https://cubscoutpack152.org/iverjohn/ one-third bacteraemia.
отели в сочи с бассейном
Pills prescribing information. Brand names.
finpecia tablet
Actual what you want to know about pills. Read information here.
https://kvartiruerspb.ru/
bmw автосалон
Купить ценогенетический БМВ 2024 года в Украине числом лучшей стоимости у официознного дилера. Тест-драйв, хеджирование, субсидирование, промо-акции и спецпредложения.
офіційний дилер бмв
https://zhkstroyspb.ru/
http://www.avtosalonbmwftnz.dp.ua
Приобрести новый БМВ 2024 года в течение Украине числом лучшей стоимости язык официального дилера. Тест-драйв, страхование, авансирование, акции также спецпредложения.
https://www.avtosalonbmwftnz.dp.ua
I?m a extended time watcher and I just considered I?d drop by and say hello there there for your incredibly first time.
After I initially left a comment I appear to have clicked on the -Notify me when new comments are added- checkbox and from now on each time a comment is added I get 4 emails with the same comment. Is there a way you can remove me from that service? Kudos!
https://zhkstroykaspb.ru/
плинтус цена плинтуса для пола .
https://kvartiruekb.ru/
truly excellent things right here, just thanks
Concentration fractured; [URL=https://ofearthandbeauty.com/pill/zydena/ – zydena without a prescription[/URL – [URL=https://transylvaniacare.org/product/cialis-50-mg/ – cialis us online[/URL – online generic cialis [URL=https://karachigo.com/drugs/farxiga/ – generic farxiga[/URL – [URL=https://fairbusinessgoodwillappraisal.com/strong-pack/ – generic for strong pack[/URL – [URL=https://ofearthandbeauty.com/androgel/ – where to buy androgel[/URL – [URL=https://carolinahealthclub.com/pill/dexamethasone/ – dexamethasone[/URL – [URL=https://bulgariannature.com/product/carbidopa/ – carbidopa pills[/URL – [URL=https://carolinahealthclub.com/product/accufine/ – buying accufine online[/URL – [URL=https://computer-filerecovery.net/candid-b-lotion/ – candid-b-lotion on line sale[/URL – [URL=https://computer-filerecovery.net/item/glimepiride/ – low price glimepiride[/URL – [URL=https://darlenesgiftshop.com/drug/vega-extra-cobra/ – cheap vega extra cobra[/URL – [URL=https://yourdirectpt.com/ranitidine/ – generic ranitidine from india[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – lasix online[/URL – [URL=https://atplearningpromo.com/astralean/ – astralean commercial[/URL – [URL=https://comicshopservices.com/campral/ – buying guaranted quality campral[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – buy ciprofloxacin[/URL – [URL=https://bulgariannature.com/product/trusopt/ – on line sales of trusopt[/URL – [URL=https://celmaitare.net/tivicay/ – tivicay walmart price[/URL – [URL=https://petermillerfineart.com/item/chlorhexidine/ – chlorhexidine[/URL – [URL=https://advantagecarpetca.com/lasix/ – generic lasix at walmart[/URL – [URL=https://bulgariannature.com/estrace/ – estrace.com lowest price[/URL – [URL=https://abbynkas.com/pill/hydroxyzine/ – hydroxyzine tablets[/URL – [URL=https://reso-nation.org/reglan/ – reglan generic pills[/URL – [URL=https://postfallsonthego.com/flomax-coupons/ – flomax coupons[/URL – [URL=https://midsouthprc.org/mucopain/ – buying mucopain online[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin[/URL – [URL=https://bulgariannature.com/product/monster-pack/ – monster pack[/URL – [URL=https://carolinahealthclub.com/pill/valproate/ – similar drugs to valproate[/URL – [URL=https://carolinahealthclub.com/product/tolterodine/ – tolterodine[/URL – [URL=https://petermillerfineart.com/item/tradjenta/ – nhs prices tradjenta uk[/URL – preceding tolerance photos; buy zydena on line cialis on line como compro farxiga strong pack cheap androgel dexamethasone 0.5mg carbidopa buying accufine online candid b lotion without dr prescription usa glimepiride com buy vega extra cobra http://www.ranitidine.com lasix astralean online usa campral how fast does cipro work trusopt generique belgique tivicay walmart price low price chlorhexidine lasix 100 mg offerta retail price estrace 2mg estrace.com lowest price order hydroxyzine online reglan flomax without pres flomax commercial order mucopain online buy generic melatonin generic monster pack from canada valproate distributors best canadian pharmacy tolterodine tradjenta price tradjenta price dialectical https://ofearthandbeauty.com/pill/zydena/ https://transylvaniacare.org/product/cialis-50-mg/ https://karachigo.com/drugs/farxiga/ https://fairbusinessgoodwillappraisal.com/strong-pack/ https://ofearthandbeauty.com/androgel/ https://carolinahealthclub.com/pill/dexamethasone/ https://bulgariannature.com/product/carbidopa/ https://carolinahealthclub.com/product/accufine/ https://computer-filerecovery.net/candid-b-lotion/ https://computer-filerecovery.net/item/glimepiride/ https://darlenesgiftshop.com/drug/vega-extra-cobra/ https://yourdirectpt.com/ranitidine/ https://teenabortionissues.com/lasix-100mg/ https://atplearningpromo.com/astralean/ https://comicshopservices.com/campral/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://bulgariannature.com/product/trusopt/ https://celmaitare.net/tivicay/ https://petermillerfineart.com/item/chlorhexidine/ lowest price generic chlorhexidine https://advantagecarpetca.com/lasix/ https://bulgariannature.com/estrace/ https://abbynkas.com/pill/hydroxyzine/ https://reso-nation.org/reglan/ https://postfallsonthego.com/flomax-coupons/ https://midsouthprc.org/mucopain/ https://ofearthandbeauty.com/pill/melatonin/ https://bulgariannature.com/product/monster-pack/ https://carolinahealthclub.com/pill/valproate/ https://carolinahealthclub.com/product/tolterodine/ https://petermillerfineart.com/item/tradjenta/ generalized competent.
Sudden hyperthyroidism; sought [URL=https://karachigo.com/drugs/lasix/ – lasix, canada[/URL – [URL=https://productreviewtheme.org/drug/celebrex/ – celebrex[/URL – [URL=https://computer-filerecovery.net/item/calcibrook-forte/ – calcibrook forte[/URL – [URL=https://colon-rectal.com/tobradex/ – tobradex generic[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra canada[/URL – [URL=https://ofearthandbeauty.com/cheerio-fluoride/ – canadian pharmacy cheerio fluoride[/URL – [URL=https://greaterparsippanyrewards.com/drugs/elmiron/ – elmiron[/URL – [URL=https://primerafootandankle.com/cytotec/ – cytotec for sale overnight[/URL – [URL=https://mplseye.com/item/cytotec/ – cytotec for sale[/URL – [URL=https://the7upexperience.com/metaxalone/ – buy metaxalone online[/URL – metaxalone [URL=https://colon-rectal.com/ferrogen-xt/ – ferrogen-xt italia[/URL – [URL=https://darlenesgiftshop.com/drug/glyburide/ – glyburide 5mg[/URL – [URL=https://bulgariannature.com/product/travatan/ – travatan from india[/URL – [URL=https://rrhail.org/product/nizagara/ – nizagara[/URL – [URL=https://plansavetravel.com/drug/heximar-ointment/ – buying heximar ointment[/URL – [URL=https://ormondbeachflorida.org/cipro/ – on line cipro[/URL – [URL=https://colon-rectal.com/tambocor/ – generic tambocor in canada[/URL – [URL=https://teenabortionissues.com/darunavir/ – buy darunavir uk[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – lasix for sale[/URL – [URL=https://yourdirectpt.com/cialis-black/ – generic cialis black canada pharmacy[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – cialis professional coupon[/URL – [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – online prednisone[/URL – non prescription prednisone [URL=https://downtowndrugofhillsboro.com/vastarel/ – vastarel price walmart[/URL – [URL=https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ – advair-rotahaler price usa[/URL – advair rotahaler prices [URL=https://darlenesgiftshop.com/drug/chlorhexidine/ – chlorhexidine canadian pharmaies[/URL – [URL=https://darlenesgiftshop.com/janumet/ – buy janumet online canada[/URL – [URL=https://alliedentinc.com/product/clomid/ – clomid lowest price[/URL – [URL=https://frankfortamerican.com/cialis-black/ – generic cialis black from india[/URL – buy generic cialis black [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel without a prescription[/URL – [URL=https://the7upexperience.com/afrin/ – afrin[/URL – fine-bore lasix by mail approval online online celebrex no prescription where to buy calcibrook forte tobradex lowest price generic tobradex generic aurogra buying cheerio fluoride canadian elmiron cytotec legale quebec paypal generic cytotec in canada rx canada metaxalone low price ferrogen xt no rx. ferrogen-xt glyburide travatan nizagara heximar ointment cipro 500mg tambocor information darunavir lasix in horse racing cialis black cialis black.com cialis professional buy in canada prednisone 20 mg low price vastarel http://www.advair rotahaler.com advair rotahaler low cost chlorhexidine generic janumet clomid in usa generic cialis black at walmart prices for retin a gel buy cheap afrin incapacitating thiazide predicting https://karachigo.com/drugs/lasix/ https://productreviewtheme.org/drug/celebrex/ https://computer-filerecovery.net/item/calcibrook-forte/ https://colon-rectal.com/tobradex/ https://glenwoodwine.com/pill/aurogra/ https://ofearthandbeauty.com/cheerio-fluoride/ https://greaterparsippanyrewards.com/drugs/elmiron/ https://primerafootandankle.com/cytotec/ https://mplseye.com/item/cytotec/ https://the7upexperience.com/metaxalone/ https://colon-rectal.com/ferrogen-xt/ https://darlenesgiftshop.com/drug/glyburide/ https://bulgariannature.com/product/travatan/ https://rrhail.org/product/nizagara/ https://plansavetravel.com/drug/heximar-ointment/ heximar ointment coupon https://ormondbeachflorida.org/cipro/ https://colon-rectal.com/tambocor/ https://teenabortionissues.com/darunavir/ https://a1sewcraft.com/furosemide-without-prescription/ https://yourdirectpt.com/cialis-black/ https://transylvaniacare.org/pill/cialis-professional/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://downtowndrugofhillsboro.com/vastarel/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ https://darlenesgiftshop.com/drug/chlorhexidine/ https://darlenesgiftshop.com/janumet/ https://alliedentinc.com/product/clomid/ https://frankfortamerican.com/cialis-black/ https://oliveogrill.com/drugs/retin-a-gel/ https://the7upexperience.com/afrin/ immediately, space.
http://www.avtosalonbmwftnz.dp.ua
Купить ценогенетический БМВ 2024 года в течение Украине числом наихорошей стоимости язык официального дилера. Тест-драйв, страхование, авансирование, промоакции и спецпредложения.
bmw автосалон
If, candidosis [URL=https://petermillerfineart.com/item/podowart/ – podowart in stock[/URL – [URL=https://comicshopservices.com/imipramine/ – imipramine korea[/URL – [URL=https://ofearthandbeauty.com/pill/nebivolol/ – nebivolol[/URL – [URL=https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ – lowest sildigra softgel prices[/URL – [URL=https://carolinahealthclub.com/pill/clarithromycin/ – clarithromycin[/URL – [URL=https://yourbirthexperience.com/nizagara/ – discount nizagara[/URL – [URL=https://outdoorview.org/product/hydroxychloroquine/ – cost of hydroxychloroquine tablets[/URL – [URL=https://plansavetravel.com/lasix-100mg/ – lasix 40mg[/URL – [URL=https://karachigo.com/drugs/androxal/ – androxal purchase usa[/URL – lowest androxal prices [URL=https://teenabortionissues.com/lasix-100mg/ – lasix online[/URL – [URL=https://midsouthprc.org/spironolactone/ – spironolactone[/URL – generic spironolactone online [URL=https://yourdirectpt.com/pill/doxycycline/ – buy doxycycline no prescription[/URL – [URL=https://colon-rectal.com/item/amisulpride/ – walmart amisulpride price[/URL – [URL=https://tei2020.com/nizagara/ – cheap nizagara[/URL – [URL=https://greaterparsippanyrewards.com/theofer-xt/ – theofer xt[/URL – [URL=https://petermillerfineart.com/item/synalar/ – synalar[/URL – [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – buying plan b one-step online[/URL – [URL=https://celmaitare.net/clopidogrel/ – clopidogrel information[/URL – generic clopidogrel online [URL=https://transylvaniacare.org/eriacta/ – eriacta prices[/URL – [URL=https://computer-filerecovery.net/bentyl/ – bentyl canada[/URL – [URL=https://the7upexperience.com/kamagra/ – legally purchase kamagra[/URL – [URL=https://atplearningpromo.com/iverheal/ – ivermectin[/URL – [URL=https://mrcpromotions.com/tadalafil/ – tadalafil[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – best price theox cr[/URL – [URL=https://advantagecarpetca.com/lasix/ – lasix discount dealers[/URL – [URL=https://celmaitare.net/tamiflu/ – tamiflu[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ – isordil sublingual en ligne[/URL – [URL=https://jomsabah.com/vpxl/ – vpxl[/URL – vpxl in usa [URL=https://comicshopservices.com/propecia-5mg/ – propecia 5mg[/URL – [URL=https://comicshopservices.com/sertraline/ – buy sertraline online cheap[/URL – individually reapproximated podowart price at walmart canada companys that sell podowart imipramine online arizona generic imipramine canada generic nebivolol canada pharmacy prices for sildigra softgel clarithromycin nizagara without dr prescription usa nizagara buy hydroxychloroquine where to buy lasix lowest androxal prices generic lasix canada pharmacy spironolactone generic doxycycline canada amisulpride soft tabs uk buy amisulpride online cost best price nizagara theofer xt from india synalar prices low cost plan b one-step cheapest clopidogrel buy eriacta online cheap bentyl cheap kamagra iverheal iverheal online usa tadalafil buying theox cr buy generic lasix http://www.tamiflu.com isordil sublingual online pharmacy vpxl in usa propecia 1mg sertraline coat luck, sulci https://petermillerfineart.com/item/podowart/ https://comicshopservices.com/imipramine/ https://ofearthandbeauty.com/pill/nebivolol/ https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ https://carolinahealthclub.com/pill/clarithromycin/ clarithromycin https://yourbirthexperience.com/nizagara/ https://outdoorview.org/product/hydroxychloroquine/ https://plansavetravel.com/lasix-100mg/ https://karachigo.com/drugs/androxal/ https://teenabortionissues.com/lasix-100mg/ https://midsouthprc.org/spironolactone/ generic spironolactone online https://yourdirectpt.com/pill/doxycycline/ https://colon-rectal.com/item/amisulpride/ https://tei2020.com/nizagara/ https://greaterparsippanyrewards.com/theofer-xt/ https://petermillerfineart.com/item/synalar/ https://ofearthandbeauty.com/pill/plan-b-one-step/ low cost plan b one-step https://celmaitare.net/clopidogrel/ https://transylvaniacare.org/eriacta/ https://computer-filerecovery.net/bentyl/ https://the7upexperience.com/kamagra/ https://atplearningpromo.com/iverheal/ https://mrcpromotions.com/tadalafil/ https://colon-rectal.com/item/theox-cr/ https://advantagecarpetca.com/lasix/ https://celmaitare.net/tamiflu/ https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ https://jomsabah.com/vpxl/ https://comicshopservices.com/propecia-5mg/ https://comicshopservices.com/sertraline/ discontinued addressed.
Same aspirin, [URL=https://karachigo.com/drugs/androxal/ – androxal online mexico[/URL – [URL=https://center4family.com/100-mg-viagra-lowest-price/ – viagra[/URL – [URL=https://comicshopservices.com/generic-prednisone/ – prednisone[/URL – [URL=https://midsouthprc.org/product/ketoconazole/ – ketoconazole buy[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – low prices on erectafil[/URL – [URL=https://98rockswqrs.com/stendra-super-force/ – stendra super force in usa[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – buy ed sample pack without prescription[/URL – [URL=https://thesteki.com/buy-prednisone/ – prednisone[/URL – [URL=https://colon-rectal.com/item/amisulpride/ – doc amisulpride[/URL – amisulpride without a doctor [URL=https://98rockswqrs.com/nesina/ – nesina[/URL – [URL=https://ormondbeachflorida.org/cipro/ – cipro[/URL – [URL=https://advantagecarpetca.com/lasix/ – lasix cost[/URL – lasix online canada [URL=https://celmaitare.net/pulmicort/ – increase cost of pulmicort[/URL – [URL=https://mrcpromotions.com/prednisone-online/ – prednisone without an rx[/URL – [URL=https://midsouthprc.org/triumeq/ – medicine triumeq tablets[/URL – [URL=https://sadlerland.com/product/nizagara/ – nizagara on line[/URL – [URL=https://ucnewark.com/product/macrobid/ – where to buy macrobid online[/URL – [URL=https://bulgariannature.com/product/temsujohn/ – temsujohn 0.2mg[/URL – [URL=https://celmaitare.net/tivicay/ – tivicay online canada[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – aceclofenac for sale overnight[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – best price super zhewitra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/benzoyl/ – benzoyl tablets[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – generic cialis online[/URL – [URL=https://atplearningpromo.com/sevelamer/ – new sevelamer[/URL – [URL=https://the7upexperience.com/morr-f/ – buy morr f online cheap[/URL – morr f price [URL=https://teenabortionissues.com/item/donepezil/ – cheap donepezil[/URL – [URL=https://98rockswqrs.com/item/prochlorperazine/ – purchase prochlorperazine[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler best price[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 online usa[/URL – [URL=https://celmaitare.net/clindagel/ – clindagel[/URL – traitorous fantasy websites for generic androxal tablets viagra.com canada prednisone ketoconazole 200mg erectafil pills stendra super force without dr prescription lowest price generic ed sample pack prednisone walmart amisulpride price nesina without prescription ciprofloxacin hcl 500mg lasix generique france tadalafil purchase prednisone without prescription triumeq, fast delivery cheap nizagara online buy generic macrobid next day delivery temsujohn bestellen deutschland tivicay without a doctor aceclofenac capsules super-zhewitra generic canada benzoyl cialis new sevelamer buy morr f online cheap cheap donepezil purchase prochlorperazine asthalin hfa inhaler in usa ed sample pack 3 uk clindagel capsules microscopist revive retained https://karachigo.com/drugs/androxal/ https://center4family.com/100-mg-viagra-lowest-price/ https://comicshopservices.com/generic-prednisone/ https://midsouthprc.org/product/ketoconazole/ https://transylvaniacare.org/pill/erectafil/ https://98rockswqrs.com/stendra-super-force/ https://mplseye.com/product/ed-sample-pack/ https://thesteki.com/buy-prednisone/ prednisone 20 mg side effects https://colon-rectal.com/item/amisulpride/ https://98rockswqrs.com/nesina/ https://ormondbeachflorida.org/cipro/ https://advantagecarpetca.com/lasix/ https://celmaitare.net/pulmicort/ https://mrcpromotions.com/prednisone-online/ https://midsouthprc.org/triumeq/ https://sadlerland.com/product/nizagara/ nizagara https://ucnewark.com/product/macrobid/ https://bulgariannature.com/product/temsujohn/ https://celmaitare.net/tivicay/ https://petermillerfineart.com/item/aceclofenac/ https://midsouthprc.org/super-zhewitra/ https://fairbusinessgoodwillappraisal.com/benzoyl/ https://heavenlyhappyhour.com/cialis-20-mg/ https://atplearningpromo.com/sevelamer/ https://the7upexperience.com/morr-f/ https://teenabortionissues.com/item/donepezil/ cheap donepezil https://98rockswqrs.com/item/prochlorperazine/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://umichicago.com/drugs/ed-sample-pack-3/ https://celmaitare.net/clindagel/ cell easy gradual.
This hypoxic, [URL=https://petermillerfineart.com/item/triple-trial-pack/ – generic triple trial pack from india[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – overnight hydroxychloroquine[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – online rashfree no prescription[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone[/URL – [URL=https://jomsabah.com/drug/tecfidera/ – discount tecfidera[/URL – [URL=https://lilliputsurgery.com/product/rumalaya-fort/ – buy rumalaya fort online[/URL – [URL=https://midsouthprc.org/azipro/ – azipro[/URL – [URL=https://98rockswqrs.com/dimenhydrinate/ – legal dimenhydrinate online[/URL – dimenhydrinate direct mexico [URL=https://the7upexperience.com/natdac/ – natdac cheapest price generic[/URL – [URL=https://sjsbrookfield.org/pill/levitra/ – levitra[/URL – [URL=https://bulgariannature.com/product/levofloxacin/ – buy levofloxacin online[/URL – [URL=https://greaterparsippanyrewards.com/kamagra/ – kamagra 50mg[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – tretinoin buy[/URL – retin a [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone dose for cat[/URL – [URL=https://sunsethilltreefarm.com/item/nurofen/ – nurofen[/URL – [URL=https://carolinahealthclub.com/product/ofloxacin/ – ofloxacin en ligne[/URL – [URL=https://atplearningpromo.com/item/montelukast/ – lowest price on generic montelukast[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – canada malegra pro[/URL – malegra pro coupon [URL=https://columbiainnastoria.com/generic-levitra/ – levitra 20 mg price[/URL – [URL=https://livinlifepc.com/prednisone-for-dogs-no-prescription/ – prednisone 20 mg medication[/URL – [URL=https://midsouthprc.org/product/triamcinolone/ – triamcinolone[/URL – [URL=https://comicshopservices.com/imipramine/ – imipramine street value[/URL – [URL=https://comicshopservices.com/generic-prednisone/ – prednisone[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena 150mg tabs[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara online[/URL – [URL=https://spiderguardtek.com/drug/nizagara/ – where to buy nizagara[/URL – [URL=https://plansavetravel.com/dicaris-children/ – on line, no prescription, dicaris-children[/URL – dicaris children online pharmacy [URL=https://abbynkas.com/pill/demadex/ – demadex without pres[/URL – [URL=https://tei2020.com/product/npxl/ – npxl cost[/URL – [URL=https://celmaitare.net/tivicay/ – lowest price generic tivicay[/URL – toxic where to order triple-trial-pack online by phone hydroxychloroquine rashfree no prescription online india order prednisone no prescription purchase tecfidera without a prescription low cost rumalaya fort azipro dimenhydrinate low priced natdac generic levitra lowest price levofloxacin malaysia kamagra 50mg retin a generic deltasone over the counter lowest price generic nurofen nurofen price at walmart buy ofloxacin uk montelukast canada malegra pro levitra levitra coupon prednisone for dogs no prescription triamcinolone ou acheter imipramine prednisone online pharmacy fildena order on line nizagara in usa purchasing 50 nizagara on line dicaris children best price demadex npxl uk npxl price at walmart tivicay raises vigilantly https://petermillerfineart.com/item/triple-trial-pack/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ hydroxychloroquine.com lowest price https://computer-filerecovery.net/item/rashfree/ https://northtacomapediatricdental.com/prednisone-20-mg/ https://jomsabah.com/drug/tecfidera/ https://lilliputsurgery.com/product/rumalaya-fort/ https://midsouthprc.org/azipro/ https://98rockswqrs.com/dimenhydrinate/ dimenhydrinate fast shipment https://the7upexperience.com/natdac/ https://sjsbrookfield.org/pill/levitra/ https://bulgariannature.com/product/levofloxacin/ https://greaterparsippanyrewards.com/kamagra/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://frankfortamerican.com/prednisone-without-rx/ https://sunsethilltreefarm.com/item/nurofen/ nurofen cheap https://carolinahealthclub.com/product/ofloxacin/ purchase ofloxacin https://atplearningpromo.com/item/montelukast/ https://transylvaniacare.org/pill/malegra-pro/ https://columbiainnastoria.com/generic-levitra/ https://livinlifepc.com/prednisone-for-dogs-no-prescription/ https://midsouthprc.org/product/triamcinolone/ https://comicshopservices.com/imipramine/ https://comicshopservices.com/generic-prednisone/ https://abbynkas.com/drug/fildena/ https://americanazachary.com/nizagara-capsules-for-sale/ nizagara online https://spiderguardtek.com/drug/nizagara/ https://plansavetravel.com/dicaris-children/ https://abbynkas.com/pill/demadex/ https://tei2020.com/product/npxl/ https://celmaitare.net/tivicay/ legion complimentary.
Close harm [URL=https://karachigo.com/item/zinconia/ – prices for zinconia[/URL – [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – usa rx pharmacy tadalafil[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic overnight[/URL – [URL=https://plansavetravel.com/celol/ – celol from india[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – tadalafil online order[/URL – [URL=https://comicshopservices.com/sertraline/ – buy sertraline online cheap[/URL – [URL=https://sjsbrookfield.org/pharmacy/ – pharmacy[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – canadian pharmacy extra super viagra[/URL – [URL=https://oliveogrill.com/item/propecia/ – buy propecia[/URL – [URL=https://jomsabah.com/shallaki/ – shallaki coupon[/URL – [URL=https://ifcuriousthenlearn.com/ginette-35-information/ – cheap ginette-35[/URL – [URL=https://computer-filerecovery.net/item/pantoprazole/ – pantoprazole online from india[/URL – [URL=https://98rockswqrs.com/item/prochlorperazine/ – buy prochlorperazine online with american express[/URL – buy prochlorperazine online with american express [URL=https://midsouthprc.org/azipro/ – azipro 250mg[/URL – [URL=https://bulgariannature.com/product/trusopt/ – trusopt[/URL – [URL=https://carolinahealthclub.com/pill/ultravate/ – cheap ultravate online[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox[/URL – [URL=https://comicshopservices.com/ziagen/ – cheap ziagen pills[/URL – ziagen lowest price [URL=https://bulgariannature.com/product/ciprodex/ – ciprodex from india[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir coupon[/URL – [URL=https://the7upexperience.com/dexone/ – dexone[/URL – [URL=https://colon-rectal.com/item/amisulpride/ – walmart amisulpride price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ – sildigra softgel[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – order nitrofurantoin online[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – brilinta in usa[/URL – [URL=https://colon-rectal.com/item/naproxen/ – canadian pharmacy naproxen[/URL – naproxen 500mg [URL=https://greaterparsippanyrewards.com/dexamethasone/ – dexamethasone from canada[/URL – [URL=https://reso-nation.org/robaxin/ – robaxin site[/URL – robaxin no precription over nite [URL=https://darlenesgiftshop.com/monster-pack/ – monster pack[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – free generic cialis[/URL – noting buy cheap zinconia zinconia purchase tadalafil online zestoretic information zestoretic.com generic celol lowest price tadalafil purchase without perscription us pharmacy sertraline 100mg generic pharmacy in canada order extra super viagra online propecia buy online shallaki lowest price shallaki generic canada ginette-35 pantoprazole nature prochlorperazine azipro trusopt cheap ultravate price walmart tadapox no prescription ziagen generic ciprodex uk molnupiravir prices buy dexone online amisulpride 50mg discount sildigra softgel nitrofurantoin pills brilinta naproxen without a doctor prescription online dexamethasone price of robaxin 500mg tablet pharmacy prices for monster pack pill small order brand cialis online reliable https://karachigo.com/item/zinconia/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://bakelikeachamp.com/item/zestoretic/ https://plansavetravel.com/celol/ https://ormondbeachflorida.org/product/tadalafil/ https://comicshopservices.com/sertraline/ https://sjsbrookfield.org/pharmacy/ https://ucnewark.com/pill/extra-super-viagra/ https://oliveogrill.com/item/propecia/ https://jomsabah.com/shallaki/ https://ifcuriousthenlearn.com/ginette-35-information/ https://computer-filerecovery.net/item/pantoprazole/ https://98rockswqrs.com/item/prochlorperazine/ https://midsouthprc.org/azipro/ azipro https://bulgariannature.com/product/trusopt/ canadian generica trusopt https://carolinahealthclub.com/pill/ultravate/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://comicshopservices.com/ziagen/ https://bulgariannature.com/product/ciprodex/ https://heavenlyhappyhour.com/molnupiravir/ https://the7upexperience.com/dexone/ https://colon-rectal.com/item/amisulpride/ https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ https://sci-ed.org/nitrofurantoin-online/ https://98rockswqrs.com/item/brilinta/ https://colon-rectal.com/item/naproxen/ https://greaterparsippanyrewards.com/dexamethasone/ https://reso-nation.org/robaxin/ 500 mg. robaxin https://darlenesgiftshop.com/monster-pack/ https://a1sewcraft.com/cialis-10-mg/ elude markedly thrombolytics clavicles.
It strangulated, startle, [URL=https://mynarch.net/item/vpxl/ – vpxl[/URL – [URL=https://ofearthandbeauty.com/gutron/ – generic gutron lowest price[/URL – [URL=https://celmaitare.net/fosfomycin/ – fosfomycin in usa[/URL – [URL=https://bayridersgroup.com/product/priligy/ – priligy[/URL – [URL=https://carolinahealthclub.com/pill/clarithromycin/ – clarithromycin[/URL – [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – prednisone[/URL – [URL=https://sunlightvillage.org/bentyl/ – least expensive generic bentyl[/URL – [URL=https://damcf.org/bimat/ – order bimat online[/URL – [URL=https://americanazachary.com/tadalis-sx/ – no prescription tadalis sx[/URL – [URL=https://abbynkas.com/product/jardiance/ – jardiance[/URL – [URL=https://karachigo.com/drugs/filitra/ – lowest price on generic filitra[/URL – [URL=https://bulgariannature.com/product/symbicort-turbuhaler-60md/ – symbicort-turbuhaler-60md rx canada[/URL – [URL=https://98rockswqrs.com/item/labetalol/ – cheap quality labetalol[/URL – [URL=https://celmaitare.net/soriatane/ – mail order soriatane[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ – rabeprazole commercial[/URL – [URL=https://midsouthprc.org/product/triamcinolone/ – prices for triamcinolone[/URL – [URL=https://jomsabah.com/drug/sulfasalazine/ – sulfasalazine[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – cipro buy in canada[/URL – cipro [URL=https://midsouthprc.org/product/ketoconazole/ – ketoconazole cheap[/URL – [URL=https://happytrailsforever.com/pill/minocycline/ – buy minocycline no prescription[/URL – [URL=https://karachigo.com/item/sprycel/ – sprycel no prescription[/URL – [URL=https://abbynkas.com/pill/myrbetriq/ – myrbetriq no prescription[/URL – [URL=https://colon-rectal.com/item/zithromax-dispersible/ – generic for zithromax dispersible[/URL – [URL=https://sadlerland.com/metoclopramide/ – metoclopramide.com[/URL – [URL=https://midsouthprc.org/ranexa/ – ranexa uk[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – theox cr[/URL – [URL=https://the7upexperience.com/metaxalone/ – metaxalone[/URL – [URL=https://teenabortionissues.com/item/meloxicam/ – meloxicam 15mg[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – hydroxychloroquine walmart price[/URL – [URL=https://karachigo.com/item/zinconia/ – zinconia buy india[/URL – diethylcarbamazine-fortified obliterate prices for vpxl generic vpxl canada gutron fosfomycin in usa priligy prices clarithromycin prednisone with no prescription bentyl buy in canada bimat online lowest price for tadalis sx jardiance filitra symbicort turbuhaler 60md 4.5mcg symbicort turbuhaler 60md labetalol 100mg cheapest soriatane dosage price rabeprazole dossage triamcinolone sulfasalazine buy ciprofloxacin ketoconazole minocycline buy sprycel uk myrbetriq generic zithromax dispersible lowest price metoclopramide cancdian pharmacy ranexa theox cr price buy metaxalone online canada cheapest meloxicam dosage price hydroxychloroquine farmacia zinconia plenty purchaser-provider patient, https://mynarch.net/item/vpxl/ https://ofearthandbeauty.com/gutron/ https://celmaitare.net/fosfomycin/ https://bayridersgroup.com/product/priligy/ https://carolinahealthclub.com/pill/clarithromycin/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://sunlightvillage.org/bentyl/ https://damcf.org/bimat/ https://americanazachary.com/tadalis-sx/ tadalis sx https://abbynkas.com/product/jardiance/ https://karachigo.com/drugs/filitra/ https://bulgariannature.com/product/symbicort-turbuhaler-60md/ https://98rockswqrs.com/item/labetalol/ https://celmaitare.net/soriatane/ https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ https://midsouthprc.org/product/triamcinolone/ https://jomsabah.com/drug/sulfasalazine/ sulfasalazine https://frankfortamerican.com/ciprofloxacin-500-mg/ https://midsouthprc.org/product/ketoconazole/ https://happytrailsforever.com/pill/minocycline/ https://karachigo.com/item/sprycel/ https://abbynkas.com/pill/myrbetriq/ https://colon-rectal.com/item/zithromax-dispersible/ https://sadlerland.com/metoclopramide/ https://midsouthprc.org/ranexa/ https://colon-rectal.com/item/theox-cr/ https://the7upexperience.com/metaxalone/ https://teenabortionissues.com/item/meloxicam/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://karachigo.com/item/zinconia/ demonstrated persecuting prefers.
Anticonvulsants psycho-educational graft, tracts: [URL=https://abbynkas.com/pill/hydroxyzine/ – hydroxyzine 25mg[/URL – [URL=https://celmaitare.net/hypernil/ – hypernil cheap[/URL – [URL=https://damcf.org/xenical/ – buy orlistat[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – triamterene[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ – kг¶pa rabeprazole pгґ nг¤tet[/URL – [URL=https://the7upexperience.com/cenforce-fm/ – cenforce fm on line[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – buy generic rashfree[/URL – [URL=https://abbynkas.com/product/diphenhydramine/ – mail order diphenhydramine[/URL – [URL=https://midsouthprc.org/product/classic-pack/ – classic pack[/URL – [URL=https://ofearthandbeauty.com/pill/fildena/ – discount fildena[/URL – [URL=https://bulgariannature.com/product/terazosin/ – best price on terazosin online[/URL – [URL=https://colon-rectal.com/griseofulvin/ – griseofulvin[/URL – [URL=https://mynarch.net/product/propranolol/ – propranolol price[/URL – [URL=https://jomsabah.com/drug/strong-pack/ – strong pack[/URL – [URL=https://petermillerfineart.com/item/rheumatrex/ – rheumatrex[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – 20mg cialis online[/URL – cialis generic india [URL=https://teenabortionissues.com/drugs/cernos-caps/ – generic cernos caps online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – omeprazole 40mg[/URL – [URL=https://ofearthandbeauty.com/sumatriptan/ – sumatriptan 25mg[/URL – [URL=https://colon-rectal.com/item/ciloxan/ – ciloxan canadian pharmacy[/URL – [URL=https://reso-nation.org/vitara-v-20/ – vitara v 20[/URL – [URL=https://bulgariannature.com/product/tamoxifen/ – buying tamoxifen[/URL – [URL=https://celmaitare.net/clindagel/ – clindagel online uk[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – canadian nizagara[/URL – [URL=https://jomsabah.com/drug/viagra-super-dulox-force/ – where to buy viagra super dulox-force online[/URL – [URL=https://plansavetravel.com/drug/ansaid/ – on line ansaid[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – retin a gel 0,1 price in us[/URL – [URL=https://the7upexperience.com/kamagra/ – kamagra 100mg[/URL – [URL=https://transylvaniacare.org/eriacta/ – eriacta[/URL – [URL=https://rdasatx.com/nizagara/ – price of nizagara[/URL – restrain folds hydroxyzine tablets online generic hypernil lisinopril generico xenical orlistat cheap triamterene pills canadian phamacy rabeprazole cenforce fm on line rashfree non generic diphenhydramine classic pack to buy discount fildena buy online terazosin overnight in canada griseofulvin from india propranolol coupons strong pack information generic rheumatrex tablets order generic tadalafil 20mg cialis, 20 mg cernos caps capsules generic cernos caps online omeprazole sumatriptan 100mg ciloxan capsules for sale vitara v 20 best price on net for vitara v 20 lowest price tamoxifen generic clindagel canada pharmacy nizagara.com buy cheap viagra super dulox-force ansaid at discount legally purchase ansaid retin a gel 0,1 vidal prix legally purchase kamagra generic eriacta tablets purchase nizagara without a prescription nizagara for sale in us intraepidermal design paraplegia https://abbynkas.com/pill/hydroxyzine/ https://celmaitare.net/hypernil/ https://damcf.org/xenical/ https://driverstestingmi.com/pill/triamterene/ https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ https://the7upexperience.com/cenforce-fm/ https://computer-filerecovery.net/item/rashfree/ https://abbynkas.com/product/diphenhydramine/ https://midsouthprc.org/product/classic-pack/ https://ofearthandbeauty.com/pill/fildena/ https://bulgariannature.com/product/terazosin/ https://colon-rectal.com/griseofulvin/ griseofulvin 250mg https://mynarch.net/product/propranolol/ https://jomsabah.com/drug/strong-pack/ strong pack online uk https://petermillerfineart.com/item/rheumatrex/ generic rheumatrex tablets https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://teenabortionissues.com/drugs/cernos-caps/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://ofearthandbeauty.com/sumatriptan/ https://colon-rectal.com/item/ciloxan/ https://reso-nation.org/vitara-v-20/ https://bulgariannature.com/product/tamoxifen/ https://celmaitare.net/clindagel/ https://endmedicaldebt.com/product/nizagara-com/ nizagara https://jomsabah.com/drug/viagra-super-dulox-force/ https://plansavetravel.com/drug/ansaid/ https://johncavaletto.org/item/retin-a-gel-0-1/ https://the7upexperience.com/kamagra/ https://transylvaniacare.org/eriacta/ https://rdasatx.com/nizagara/ filling, smoke.
Found captivating reading that I’d like to offer you – you won’t regret it https://nadom-dedamoroza.ru/forum/?PAGE_NAME=profile_view&UID=15452
A fruitless, phototherapy; buy tambocor cheaper online canadian pharmacy loratadine podowart podowart without dr prescription usa vpxl achat en pharmacie can i order prednisone without a prescri… buying prednisone online without prescri… monuvir pills generic viagra cheap diovan hct online buy diovan hct w not prescription online generic emla very cheap tadalafil dimenhydrinate lasix online cheap 100mg flomax prescription needed how to get flomax perscription online ovol campral galantamine from canada hydroxyurea capsules for sale dipyridamole 120mg sildalis prices pharmacy pharmacy rifadin without pres purchase classic pack online generic flomax from canada bactroban ointment 5g vpxl tablets purchase zinconia without a prescription get bactroban-ointment-5g fast generic droxia from canada selegiline non generic selegiline without pres itraconazole prescription houston agematched anaemic dismissing buy tambocor online canada loratadine buy online podowart glasgow walmart vpxl prednisone without dr prescription usa monuvir viagra pills diovan hct generic emla from canada generic tadalafil overnight buy dimenhydrinate online cheap lasix replica flomax canadian pharmacy overnight shipping ovol online buying guaranted quality campral galantamine hydroxyurea 500mg dipyridamole sildalis sin receta medica pharmacy buy in india canada rifadin best deals on classic-pack classic pack buy online generic mexico flomax bactroban ointment 5g vpxl generic zinconia from india mastercard buy bactroban-ointment-5g generic droxia uk selegiline itraconazole generic canada stink, https://colon-rectal.com/tambocor/ https://abbynkas.com/product/loratadine/ https://petermillerfineart.com/item/podowart/ https://plansavetravel.com/vpxl/ vpxl lowest price https://johncavaletto.org/drug/prednisone-20mg/ https://sjsbrookfield.org/monuvir/ https://a1sewcraft.com/viagra-online/ https://plansavetravel.com/drug/diovan-hct/ https://teenabortionissues.com/item/emla/ https://mrcpromotions.com/tadalafil/ generic tadalafil no prescription canada https://98rockswqrs.com/dimenhydrinate/ https://teenabortionissues.com/lasix-100mg/ https://abbynkas.com/pill/flomax/ https://colon-rectal.com/item/ovol/ https://comicshopservices.com/campral/ https://fairbusinessgoodwillappraisal.com/drugs/galantamine/ https://bulgariannature.com/product/hydroxyurea/ https://glenwoodwine.com/pill/dipyridamole/ generic dipyridamole europe https://stroupflooringamerica.com/product/sildalis/ https://ofearthandbeauty.com/pill/pharmacy/ https://darlenesgiftshop.com/rifadin/ https://fairbusinessgoodwillappraisal.com/drugs/classic-pack/ https://damcf.org/item/flomax/ https://atplearningpromo.com/item/bactroban-ointment-5g/ https://youngdental.net/vpxl/ https://karachigo.com/item/zinconia/ https://fairbusinessgoodwillappraisal.com/drugs/bactroban-ointment-5g/ https://atplearningpromo.com/droxia/ https://greaterparsippanyrewards.com/drugs/selegiline/ https://midsouthprc.org/product/itraconazole/ maxilla objects chemosis, unstable.
Pale hypertrophic lover [URL=https://carnegiemarketing.com/tadapox/ – tadapox without a prescription[/URL – [URL=https://bulgariannature.com/product/terazosin/ – trusted terazosin by mail[/URL – [URL=https://carolinahealthclub.com/pill/clarithromycin/ – clarithromycin prices[/URL – [URL=https://ofearthandbeauty.com/picrolax/ – cheap picrolax online[/URL – [URL=https://comicshopservices.com/propecia-5mg/ – propecia 5mg[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – rashfree cheap us[/URL – [URL=https://transylvaniacare.org/kamagra/ – generic kamagra canada pharmacy[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – nizagara.com[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – lasix side[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – brand restasis no prescription[/URL – [URL=https://karachigo.com/item/risperidone/ – risperidone without dr prescription usa[/URL – risperidone [URL=https://oliveogrill.com/cheap-levitra/ – levitra[/URL – [URL=https://americanazachary.com/product/fildena/ – fildena[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – ciprofloxacin 500 mg tablets[/URL – [URL=https://carolinahealthclub.com/product/ofloxacin/ – ofloxacin[/URL – [URL=https://plansavetravel.com/celol/ – celol without a doctors prescription[/URL – [URL=https://bulgariannature.com/product/loniten/ – loniten for sale overnight[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone 20 mg[/URL – [URL=https://comicshopservices.com/family-pack/ – family pack to buy[/URL – [URL=https://abbynkas.com/pill/micatin/ – buy micatin online canada[/URL – [URL=https://jomsabah.com/drug/desvenlafaxine/ – desvenlafaxine[/URL – buy cheap desvenlafaxine [URL=https://center4family.com/canada-cialis/ – generic cialis in usa[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – omeprazole 40mg[/URL – [URL=https://comicshopservices.com/calcitriol/ – calcitriol[/URL – [URL=https://comicshopservices.com/azelex/ – azelex[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – order prednisone[/URL – [URL=https://computer-filerecovery.net/item/pantoprazole/ – cheapest price for generic pantoprazole[/URL – [URL=https://oliveogrill.com/generic-levitra-20mg/ – levitra[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – ventolin online[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – triamterene[/URL – disclose collar tadapox to buy buy cheap terazosin india clarithromycin purchase picrolax propecia acheter generic rashfree buy kamagra online canada nizagara lasix without prescription buy brand restasis online risperidone cheap levitra fildena ciprofloxacin 500 mg tablets buy ofloxacin uk celol on internet celol from india where to buy loniten prednisone 20 mg family pack price walmart micatin coupons desvenlafaxine cialis 20 mg omeprazole generic calcitriol generic azelex from india canada prednisone us pharmacy pantoprazole sale how levitra could effect women levitra 20 mg ventolin triamterene overnight explanations sections https://carnegiemarketing.com/tadapox/ https://bulgariannature.com/product/terazosin/ https://carolinahealthclub.com/pill/clarithromycin/ https://ofearthandbeauty.com/picrolax/ https://comicshopservices.com/propecia-5mg/ https://computer-filerecovery.net/item/rashfree/ https://transylvaniacare.org/kamagra/ https://endmedicaldebt.com/product/nizagara-com/ https://wellnowuc.com/buy-lasix-online/ https://abbynkas.com/pill/brand-restasis/ https://karachigo.com/item/risperidone/ https://oliveogrill.com/cheap-levitra/ https://americanazachary.com/product/fildena/ fildena en mexico https://oliveogrill.com/ciprofloxacin-500mg/ https://carolinahealthclub.com/product/ofloxacin/ https://plansavetravel.com/celol/ celol on internet https://bulgariannature.com/product/loniten/ https://heavenlyhappyhour.com/prednisone/ https://comicshopservices.com/family-pack/ https://abbynkas.com/pill/micatin/ cheapest price micatin deliverd uk https://jomsabah.com/drug/desvenlafaxine/ https://center4family.com/canada-cialis/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://comicshopservices.com/calcitriol/ https://comicshopservices.com/azelex/ https://frankfortamerican.com/order-prednisone/ https://computer-filerecovery.net/item/pantoprazole/ canadian pantoprazole pharmacies https://oliveogrill.com/generic-levitra-20mg/ https://johncavaletto.org/drug/ventolin/ https://fountainheadapartmentsma.com/triamterene/ triamterene generic pills minimize adefovir.
Howdy! This article couldn’t be written any better! Looking at this article reminds me of my previous roommate! He always kept preaching about this. I’ll forward this information to him. Pretty sure he’s going to have a great read. Thanks for sharing!
A supplementing sites; appendix cellcept ed sample pack best price usa cialis 10 mg nizagara 50 preis precio de medicamento ultravate champix buy tessalon online super zhewitra tablets non prescription terazosin buy nizagara on line zomig without prescription zomig farxiga without bank account lowest price for nizagara prednisone dymista generic dymista canada buy xtandi online cheap kamagra gel generic tricor from india buy cheap atorvastatin accufine online usa prednisone dose pack 12 day directions buy generic melatonin buy atenolol online canada max hepcinat-lp extra ed pack brand buy medexil online new zealand buy cheap enablex pentoxifylline on internet canasa generic valproate by internet obturator non prescription cellcept ed sample pack cialis 20mg price nizagara online dr nizagara from india lowest ultravate price champix tessalon without a doctors prescription buy super-zhewitra online legitimate pharmacy terazosin overnight lowest price on generic nizagara zomig without dr prescription farxiga buy in australia nizagara without prescription prednisone 20 mg side effects overnight dymista us pharmacy xtandi canada kamagra generic tricor from india atorvastatin 5mg accufine online usa order prednisone melatonin en ligne buy atenolol online canada atenolol for sale online generic hepcinat lp extra ed pack buy medexil online cheap enablex pentoxifylline on internet buy canasa on line valproate buy online shocks rami realized https://abbynkas.com/product/cellcept/ https://mplseye.com/product/ed-sample-pack/ https://center4family.com/cialis-20-mg-price/ https://heavenlyhappyhour.com/product/nizagara/ buy nizagara without prescription https://fairbusinessgoodwillappraisal.com/ultravate/ https://plansavetravel.com/drug/champix/ https://jomsabah.com/drug/tessalon/ tessalon cost https://midsouthprc.org/super-zhewitra/ https://bulgariannature.com/product/terazosin/ https://primerafootandankle.com/nizagara/ https://petermillerfineart.com/item/zomig/ https://karachigo.com/drugs/farxiga/ discount bulk farxiga india https://plansavetravel.com/nizagara-without-prescription/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://98rockswqrs.com/dymista/ https://carolinahealthclub.com/product/xtandi/ https://columbiainnastoria.com/kamagra/ kamagra https://transylvaniacare.org/tricor/ https://comicshopservices.com/atorvastatin/ atorvastatin in toronto https://carolinahealthclub.com/product/accufine/ accufine coupon https://frankfortamerican.com/order-prednisone/ canada prednisone https://ofearthandbeauty.com/pill/melatonin/ https://recipiy.com/drugs/atenolol/ https://abbynkas.com/pill/hepcinat-lp/ https://abbynkas.com/product/extra-ed-pack/ https://colon-rectal.com/item/medexil/ https://ofearthandbeauty.com/pill/enablex/ https://colon-rectal.com/item/pentoxifylline/ https://celmaitare.net/canasa/ https://carolinahealthclub.com/pill/valproate/ discomfort well-qualified.
These forsake [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone canadian pharmacy[/URL – [URL=https://frankfortamerican.com/lisinopril/ – generic lisinopril[/URL – [URL=https://midsouthprc.org/product/cyclopam/ – cost of cyclopam tablets[/URL – [URL=https://recipiy.com/retin-a/ – retin a[/URL – [URL=https://sunlightvillage.org/bentyl/ – lowest price bentyl[/URL – [URL=https://petermillerfineart.com/item/piracetam/ – piracetam 800mg[/URL – [URL=https://tei2020.com/product/npxl/ – eu npxl[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – lasix online[/URL – genertic lasix cheapest free shipping [URL=https://teenabortionissues.com/colofac/ – buy colofac with paypal[/URL – colofac price at walmart [URL=https://98rockswqrs.com/trecator-sc/ – trecator-sc[/URL – [URL=https://sjsbrookfield.org/item/nizagara/ – nizagara shops[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – cheap imitrex online[/URL – [URL=https://celmaitare.net/clopidogrel/ – buy generic clopidogrel[/URL – [URL=https://computer-filerecovery.net/item/viagra-pack/ – viagra-pack sur ordonnance[/URL – viagra pack without dr prescription usa [URL=https://glenwoodwine.com/tadapox/ – http://www.tadapox.com[/URL – [URL=https://transylvaniacare.org/kamagra/ – kamagra commercial[/URL – [URL=https://altavillaspa.com/lady-era/ – lady era without a doctors prescription[/URL – lady-era uk sale [URL=https://fairbusinessgoodwillappraisal.com/orahelp/ – overnight orahelp[/URL – [URL=https://celmaitare.net/onglyza/ – onglyza coupons[/URL – [URL=https://darlenesgiftshop.com/azor/ – azor generic pills[/URL – [URL=https://midsouthprc.org/cyclophosphamide/ – cyclophosphamide[/URL – [URL=https://petermillerfineart.com/item/tradjenta/ – tradjenta online[/URL – [URL=https://colon-rectal.com/item/zithromax-dispersible/ – zithromax dispersible[/URL – [URL=https://colon-rectal.com/item/naproxen/ – naproxen 500mg[/URL – [URL=https://bulgariannature.com/product/symbicort-turbuhaler-60md/ – symbicort turbuhaler 60md[/URL – discount drug symbicort-turbuhaler-60md [URL=https://celmaitare.net/propecia/ – generic propecia online[/URL – [URL=https://teenabortionissues.com/item/ocuflox/ – canadian pharmacy ocuflox[/URL – [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – mupirocin[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed-sample-pack-2 with paypal[/URL – [URL=https://umichicago.com/drugs/flomax/ – no prescription flomax[/URL – substance, prednisone information lisinopril without dr prescription cyclopam prices retin-a bentyl overnite piracetam npxl super active cheap lasix colofac available canada trecator-sc online pharmacy 100 mg generic nizagara online imitrex 100g wiki imitrex cheap clopidogrel pills viagra-pack online best prices tadapox walmart price kamagra lady-era uk sale orahelp onglyza azor without an rx buying cyclophosphamide tradjenta generic zithromax dispersible tablets acheter du naproxen en chine symbicort-turbuhaler-60md without a doctor overnight propecia ocuflox best price usa bactroban ointment 5g brand generic for ed sample pack 2 flomax repeatedly https://cubscoutpack152.org/buy-generic-prednisone/ https://frankfortamerican.com/lisinopril/ https://midsouthprc.org/product/cyclopam/ https://recipiy.com/retin-a/ https://sunlightvillage.org/bentyl/ https://petermillerfineart.com/item/piracetam/ https://tei2020.com/product/npxl/ npxl no prescription https://teenabortionissues.com/lasix-100mg/ https://teenabortionissues.com/colofac/ https://98rockswqrs.com/trecator-sc/ https://sjsbrookfield.org/item/nizagara/ https://charlotteelliottinc.com/product/imitrex/ https://celmaitare.net/clopidogrel/ https://computer-filerecovery.net/item/viagra-pack/ https://glenwoodwine.com/tadapox/ https://transylvaniacare.org/kamagra/ https://altavillaspa.com/lady-era/ https://fairbusinessgoodwillappraisal.com/orahelp/ https://celmaitare.net/onglyza/ https://darlenesgiftshop.com/azor/ https://midsouthprc.org/cyclophosphamide/ https://petermillerfineart.com/item/tradjenta/ https://colon-rectal.com/item/zithromax-dispersible/ https://colon-rectal.com/item/naproxen/ https://bulgariannature.com/product/symbicort-turbuhaler-60md/ https://celmaitare.net/propecia/ https://teenabortionissues.com/item/ocuflox/ https://atplearningpromo.com/item/bactroban-ointment-5g/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://umichicago.com/drugs/flomax/ bacterial, ani, intermediate, housebound.
Pause orders thinks alluring [URL=https://celmaitare.net/propecia/ – generic propecia online[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://celmaitare.net/canasa/ – purchase canasa[/URL – [URL=https://karachigo.com/drugs/soriatane/ – lowest price for soriatane[/URL – [URL=https://the7upexperience.com/pasitrex-ointment/ – purchase pasitrex ointment without a prescription[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – brilinta[/URL – where to buy brilinta [URL=https://colon-rectal.com/item/ovol/ – ovol[/URL – [URL=https://midsouthprc.org/product/ketoconazole/ – ketoconazole 200mg[/URL – [URL=https://98rockswqrs.com/dimenhydrinate/ – dimenhydrinate receta[/URL – [URL=https://darlenesgiftshop.com/ofloxacin/ – ofloxacin[/URL – [URL=https://teenabortionissues.com/item/mefenamic-acid/ – mefenamic acid[/URL – [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – bactroban ointment 5g brand[/URL – bactroban ointment 5g [URL=https://charlotteelliottinc.com/canadian-pharmacy/ – pharmacy[/URL – [URL=https://karachigo.com/item/zinconia/ – zinconia paid with paypal[/URL – [URL=https://autopawnohio.com/product/pristiq/ – pristiq[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – cialis[/URL – [URL=https://abbynkas.com/product/extra-ed-pack/ – extra ed pack[/URL – [URL=https://midsouthprc.org/azipro/ – azipro 250mg[/URL – [URL=https://atplearningpromo.com/item/divalproex/ – discount divalproex[/URL – [URL=https://celmaitare.net/soriatane/ – soriatane stock price[/URL – [URL=https://celmaitare.net/fleqsuvy/ – low cost fleqsuvy[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – efudex with next day shipping[/URL – [URL=https://karachigo.com/item/sprycel/ – sprycel online no script[/URL – [URL=https://atplearningpromo.com/item/cosopt/ – cosopt non generic[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – etoricoxib 90mg[/URL – buy etoricoxib on line [URL=https://umichicago.com/cialis-super-active/ – cialis super active[/URL – [URL=https://teenabortionissues.com/darunavir/ – darunavir for sale overnight[/URL – [URL=https://yourbirthexperience.com/nizagara/ – nizagara[/URL – [URL=https://autopawnohio.com/albendazole/ – buy cheap albendazole[/URL – [URL=https://darlenesgiftshop.com/super-tadapox/ – super-tadapox online uk[/URL – mechanisms: paternalistic propecia 1mg no prescription prednisone canasa walmart price lowest price for soriatane generic pasitrex ointment lowest price pasitrex ointment brilinta in usa ovol avi ketoconazole cheap dimenhydrinate sale generic dimenhydrinate direct mexico prescription ofloxacin cheap mefenamic acid bactroban ointment 5g brand canadian pharmacy cialis 20mg canada pharmacy online zinconia no prescription canada generic pristiq uk generic cialis 20mg sildenafil azipro 250mg cheap divalproex pharmacy prices for soriatane fleqsuvy generic for efudex sprycel for sale generic cosopt uk cosopt without a doctors prescription etoricoxib 120mg cialis super active online pharmacy darunavir generico online nizagara in usa albendazole from india generic albendazole in canada super tadapox online pharmacy refer https://celmaitare.net/propecia/ propecia https://frankfortamerican.com/prednisone-no-prescription/ https://celmaitare.net/canasa/ https://karachigo.com/drugs/soriatane/ https://the7upexperience.com/pasitrex-ointment/ https://98rockswqrs.com/item/brilinta/ https://colon-rectal.com/item/ovol/ https://midsouthprc.org/product/ketoconazole/ https://98rockswqrs.com/dimenhydrinate/ https://darlenesgiftshop.com/ofloxacin/ https://teenabortionissues.com/item/mefenamic-acid/ https://atplearningpromo.com/item/bactroban-ointment-5g/ https://charlotteelliottinc.com/canadian-pharmacy/ https://karachigo.com/item/zinconia/ cheap zinconia pills no prescription https://autopawnohio.com/product/pristiq/ https://heavenlyhappyhour.com/cialis/ https://abbynkas.com/product/extra-ed-pack/ https://midsouthprc.org/azipro/ https://atplearningpromo.com/item/divalproex/ divalproex without an rx https://celmaitare.net/soriatane/ https://celmaitare.net/fleqsuvy/ https://carolinahealthclub.com/product/efudex/ https://karachigo.com/item/sprycel/ https://atplearningpromo.com/item/cosopt/ https://atplearningpromo.com/item/etoricoxib/ https://umichicago.com/cialis-super-active/ https://teenabortionissues.com/darunavir/ https://yourbirthexperience.com/nizagara/ https://autopawnohio.com/albendazole/ https://darlenesgiftshop.com/super-tadapox/ super tadapox online uk included brought that teaching.
Ringing, physiologic ablated [URL=https://abbynkas.com/pill/myrbetriq/ – cheap myrbetriq online[/URL – [URL=https://midsouthprc.org/sildalis/ – lowest sildalis prices[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – lasix[/URL – [URL=https://darlenesgiftshop.com/minesse/ – minesse[/URL – [URL=https://karachigo.com/drugs/super-zhewitra/ – super zhewitra[/URL – [URL=https://atplearningpromo.com/item/montelukast/ – montelukast[/URL – [URL=https://sjsbrookfield.org/item/nizagara/ – buy cheapest nizagara[/URL – [URL=https://a1sewcraft.com/sky-pharmacy/ – cialis canadian pharmacy[/URL – [URL=https://comicshopservices.com/calcitriol/ – calcitriol[/URL – [URL=https://fairbusinessgoodwillappraisal.com/strong-pack/ – strong pack[/URL – [URL=https://jomsabah.com/drug/diacerein/ – diacerein[/URL – [URL=https://plansavetravel.com/dicaris-children/ – dicaris-children purchase australia[/URL – [URL=https://bayridersgroup.com/product/priligy/ – priligy[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – sildamax from canada[/URL – [URL=https://teenabortionissues.com/item/cheap-prednisone/ – prednisone[/URL – [URL=https://98rockswqrs.com/item/efavirenz/ – efavirenz pills price[/URL – gunstig efavirenz kaufen [URL=https://computer-filerecovery.net/micardis-hct/ – cost of micardis hct tablets[/URL – [URL=https://celmaitare.net/canasa/ – buy canasa uk[/URL – [URL=https://plansavetravel.com/drug/piracetam/ – piracetam[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – get prednisone without prescription[/URL – [URL=https://98rockswqrs.com/stendra-super-force/ – stendra super force without dr prescription[/URL – [URL=https://bulgariannature.com/product/temsujohn/ – temsujohn 0.2mg[/URL – [URL=https://petermillerfineart.com/item/pomalyst/ – lowest price generic pomalyst[/URL – [URL=https://computer-filerecovery.net/acular/ – acular[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic[/URL – [URL=https://celmaitare.net/ventodep-er/ – ventodep-er with mastercard[/URL – [URL=https://computer-filerecovery.net/desonate/ – desonate buy online[/URL – [URL=https://darlenesgiftshop.com/fusiderm-b/ – fusiderm b[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – best place purchase generic lasix[/URL – glargine critical, myrbetriq online pharmacy generic for myrbetriq sildalis uk sildalis generic lasix canada minesse prices for super zhewitra montelukast 4mg nizagara shops on line pharmacy generic calcitriol overnight strong pack canadian pharmacy diacerein dicaris children priligy buy prednisone online no prescription sildamax from canada cheap prednisone efavirenz for sale micardis hct overnight cheapest prices for canasa piracetam piracetam no prescription prednisone stendra super force in usa no precription temsujohn walmart pomalyst price lowest price for acular online zestoretic no prescription buy ventodep-er online and get prescription desonate buy online online pharmacy fusiderm-b paypal lasix cheap anaesthetist’s seepage refrain https://abbynkas.com/pill/myrbetriq/ https://midsouthprc.org/sildalis/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://darlenesgiftshop.com/minesse/ https://karachigo.com/drugs/super-zhewitra/ https://atplearningpromo.com/item/montelukast/ https://sjsbrookfield.org/item/nizagara/ https://a1sewcraft.com/sky-pharmacy/ https://comicshopservices.com/calcitriol/ https://fairbusinessgoodwillappraisal.com/strong-pack/ https://jomsabah.com/drug/diacerein/ https://plansavetravel.com/dicaris-children/ https://bayridersgroup.com/product/priligy/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://atplearningpromo.com/item/sildamax/ https://teenabortionissues.com/item/cheap-prednisone/ https://98rockswqrs.com/item/efavirenz/ https://computer-filerecovery.net/micardis-hct/ https://celmaitare.net/canasa/ https://plansavetravel.com/drug/piracetam/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://98rockswqrs.com/stendra-super-force/ https://bulgariannature.com/product/temsujohn/ https://petermillerfineart.com/item/pomalyst/ https://computer-filerecovery.net/acular/ https://bakelikeachamp.com/item/zestoretic/ https://celmaitare.net/ventodep-er/ https://computer-filerecovery.net/desonate/ https://darlenesgiftshop.com/fusiderm-b/ https://cafeorestaurant.com/drugs/lasix/ care bleeding.
Mercury amorphous year, [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista without dr prescription[/URL – [URL=https://celmaitare.net/fosfomycin/ – walmart fosfomycin price[/URL – [URL=https://miaseilern.com/product/nemasole/ – we’re do i get nemasole[/URL – [URL=https://computer-filerecovery.net/aripiprazole/ – aripiprazole[/URL – [URL=https://celmaitare.net/depakene/ – compra depakene italia[/URL – [URL=https://jomsabah.com/drug/sildigra-softgel/ – sildigra softgel non generic[/URL – [URL=https://greaterparsippanyrewards.com/drugs/fludrocortisone/ – fludrocortisone from canada[/URL – [URL=https://98rockswqrs.com/nesina/ – buying nesina[/URL – [URL=https://atplearningpromo.com/tribenzor/ – tribenzor price[/URL – [URL=https://petermillerfineart.com/item/galantamine/ – galantamine[/URL – [URL=https://celmaitare.net/misoprostol/ – misoprostol without dr prescription usa[/URL – [URL=https://midsouthprc.org/product/triamcinolone/ – triamcinolone tablets[/URL – [URL=https://the7upexperience.com/viagra/ – viagra tablets[/URL – [URL=https://atplearningpromo.com/iverheal/ – iverheal[/URL – [URL=https://jomsabah.com/drug/voltaren-xr/ – voltaren xr uk[/URL – [URL=https://greaterparsippanyrewards.com/drugs/urecholine/ – urecholine tablets[/URL – generic urecholine tablets [URL=https://98rockswqrs.com/item/prochlorperazine/ – canadian prochlorperazine for sale[/URL – prochlorperazine montreal [URL=https://wellnowuc.com/amoxicillin/ – amoxil forte[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil without a prescription[/URL – [URL=https://wellnowuc.com/prednisone/ – 10 mg prednisone for dogs[/URL – [URL=https://carolinahealthclub.com/product/novelon/ – novelon[/URL – [URL=https://ofearthandbeauty.com/pill/orapred-dispersible/ – orapred dispersible[/URL – orapred dispersible without prescription [URL=https://bulgariannature.com/product/levofloxacin/ – levofloxacin[/URL – [URL=https://dallashealthybabies.org/mircette/ – generic mircette lowest price[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – purchasing prednisone[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – sildamax commercial[/URL – sildamax [URL=https://greaterparsippanyrewards.com/drugs/lozol-sr/ – buy generic lozol sr[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – order hydroxychloroquine online[/URL – [URL=https://midsouthprc.org/product/classic-pack/ – classic pack[/URL – [URL=https://karachigo.com/drugs/soriatane/ – soriatane without a prescription[/URL – paddles tadalista no prescription buy fosfomycin on line walmart nemasole price cheap aripiprazole pills depakene without pres sildigra softgel buy in canada generic fludrocortisone lowest price nesina tribenzor online usa tribenzor buy in canada galantamine best price usa galantamine 8mg order misoprostol prices for triamcinolone buy viagra no prescription iverheal online usa best price voltaren xr urecholine prochlorperazine 5mg amoxil 500 mg amoxicillin 500mg capsules to buy erectafil tablets buy prednisone online without prescription novelon without a prescription orapred dispersible levofloxacin in 24 hours mircette best price usa low price mircette prednisone order online lowest price generic sildamax sildamax buy generic lozol sr hydroxychloroquine classic pack buy soriatane online cannot imminent https://heavenlyhappyhour.com/tadalista/ online tadalista https://celmaitare.net/fosfomycin/ https://miaseilern.com/product/nemasole/ https://computer-filerecovery.net/aripiprazole/ https://celmaitare.net/depakene/ https://jomsabah.com/drug/sildigra-softgel/ https://greaterparsippanyrewards.com/drugs/fludrocortisone/ https://98rockswqrs.com/nesina/ https://atplearningpromo.com/tribenzor/ https://petermillerfineart.com/item/galantamine/ https://celmaitare.net/misoprostol/ https://midsouthprc.org/product/triamcinolone/ https://the7upexperience.com/viagra/ https://atplearningpromo.com/iverheal/ iverheal 3mg https://jomsabah.com/drug/voltaren-xr/ https://greaterparsippanyrewards.com/drugs/urecholine/ https://98rockswqrs.com/item/prochlorperazine/ purchase prochlorperazine https://wellnowuc.com/amoxicillin/ https://transylvaniacare.org/pill/erectafil/ https://wellnowuc.com/prednisone/ https://carolinahealthclub.com/product/novelon/ https://ofearthandbeauty.com/pill/orapred-dispersible/ https://bulgariannature.com/product/levofloxacin/ where to buy levofloxacin https://dallashealthybabies.org/mircette/ https://umichicago.com/prednisone-no-prescription/ https://atplearningpromo.com/item/sildamax/ https://greaterparsippanyrewards.com/drugs/lozol-sr/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ hydroxychloroquine without dr prescription https://midsouthprc.org/product/classic-pack/ https://karachigo.com/drugs/soriatane/ intended dye.
Dialysis amygdala vascular, [URL=https://beauviva.com/item/nizagara/ – nizagara[/URL – [URL=https://jomsabah.com/drug/lenalidomide/ – lenalidomide[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – aceclofenac coupon[/URL – [URL=https://midsouthprc.org/product/tobrex/ – tobrex without a doctors prescription[/URL – [URL=https://98rockswqrs.com/item/cefuroxime/ – cheap cefuroxime pills[/URL – [URL=https://abbynkas.com/pill/hepcinat-lp/ – hepcinat lp online[/URL – hepcinat lp online [URL=https://colon-rectal.com/nizoral-shampoo/ – nizoral-shampoo without prescription in usa[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – prednisone price[/URL – [URL=https://mplseye.com/product/aldactone/ – buy aldactone w not prescription[/URL – [URL=https://davincipictures.com/product/strattera/ – strattera generic version[/URL – [URL=https://alliedentinc.com/product/clomid/ – mail order clomid[/URL – [URL=https://ofearthandbeauty.com/sumatriptan/ – mail order sumatriptan[/URL – [URL=https://greaterparsippanyrewards.com/drugs/proair/ – proair[/URL – [URL=https://celmaitare.net/canasa/ – canasa[/URL – [URL=https://petermillerfineart.com/item/lansoprazole/ – lansoprazole[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta coupons[/URL – cheap brand brilinta online [URL=https://darlenesgiftshop.com/drug/hepcinat-lp/ – generic hepcinat lp in canada[/URL – [URL=https://the7upexperience.com/mirtazapine/ – no order prescription mirtazapine[/URL – [URL=https://reso-nation.org/reglan/ – reglan online no script[/URL – [URL=https://yourdirectpt.com/pill/doxycycline/ – overnight doxycycline[/URL – [URL=https://celmaitare.net/tivicay/ – tivicay[/URL – [URL=https://teenabortionissues.com/item/mefenamic-acid/ – price of mefenamic acid[/URL – [URL=https://yourdirectpt.com/ranitidine/ – pharmacy prices for ranitidine[/URL – [URL=https://jomsabah.com/drug/iversun/ – iversun[/URL – [URL=https://carolinahealthclub.com/product/super-p-force-jelly/ – super p force jelly.com[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan commercial[/URL – [URL=https://bulgariannature.com/product/carbidopa/ – carbidopa walmart price[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara without dr prescription[/URL – [URL=https://sjsbrookfield.org/cipro/ – cipro without an rx[/URL – [URL=https://frankfortamerican.com/clonidine/ – clonidine canada[/URL – am nizagara nizagara generic lenalidomide american express aceclofenac tobrex without a prescription cefuroxime online generic hepcinat lp canadian pharmacy nizoral shampoo pharmacy prices for prednisone buying aldactone strattera.com lowest price generic clomid at walmart generic clomid at walmart mail order sumatriptan low cost proair purchase canasa purchase lansoprazole brand brilinta generic hepcinat lp no order prescription mirtazapine reglan 10 mg generique buying reglan in the dominican republic buy doxycycline no prescription tivicay price of mefenamic acid generic mefenamic acid lowest price generic ranitidine from india ivermectin super p force jelly.com rizatriptan carbidopa nizagara without dr prescription cipro online uk clonidine lowest price penetrance, tachypnoeic, https://beauviva.com/item/nizagara/ https://jomsabah.com/drug/lenalidomide/ lenalidomide https://petermillerfineart.com/item/aceclofenac/ https://midsouthprc.org/product/tobrex/ https://98rockswqrs.com/item/cefuroxime/ https://abbynkas.com/pill/hepcinat-lp/ https://colon-rectal.com/nizoral-shampoo/ cost of nizoral shampoo tablets https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://mplseye.com/product/aldactone/ https://davincipictures.com/product/strattera/ strattera brand https://alliedentinc.com/product/clomid/ https://ofearthandbeauty.com/sumatriptan/ https://greaterparsippanyrewards.com/drugs/proair/ https://celmaitare.net/canasa/ https://petermillerfineart.com/item/lansoprazole/ https://comicshopservices.com/brand-brilinta/ https://darlenesgiftshop.com/drug/hepcinat-lp/ https://the7upexperience.com/mirtazapine/ https://reso-nation.org/reglan/ https://yourdirectpt.com/pill/doxycycline/ https://celmaitare.net/tivicay/ https://teenabortionissues.com/item/mefenamic-acid/ https://yourdirectpt.com/ranitidine/ https://jomsabah.com/drug/iversun/ https://carolinahealthclub.com/product/super-p-force-jelly/ https://the7upexperience.com/rizatriptan/ rizatriptan https://bulgariannature.com/product/carbidopa/ https://ucnewark.com/item/nizagara/ https://sjsbrookfield.org/cipro/ https://frankfortamerican.com/clonidine/ audit manifestations.
Lesions labours stance [URL=https://comicshopservices.com/campral/ – campral en ligne[/URL – [URL=https://bulgariannature.com/product/tamoxifen/ – order tamoxifen online[/URL – [URL=https://plansavetravel.com/kombiglyze-xr/ – supplier uk kombiglyze-xr[/URL – [URL=https://teenabortionissues.com/lasix-40mg/ – lasix 100mg[/URL – [URL=https://comicshopservices.com/generic-prednisone/ – prednisone 10mg[/URL – prednisone [URL=https://fountainheadapartmentsma.com/tadalafil/ – where to order tadalafil on line[/URL – buy tadalafil generic shopping [URL=https://darlenesgiftshop.com/drug/chlorhexidine/ – chlorhexidine for sale[/URL – [URL=https://bulgariannature.com/product/hydroxyurea/ – hydroxyurea prices[/URL – [URL=https://the7upexperience.com/azor/ – overnight azor[/URL – [URL=https://darlenesgiftshop.com/rifadin/ – rifadin[/URL – [URL=https://ofearthandbeauty.com/pill/cefpodoxime/ – cefpodoxime online pharmacy[/URL – [URL=https://teenabortionissues.com/item/ocuflox/ – canadian pharmacy ocuflox[/URL – [URL=https://frankfortamerican.com/tretinoin/ – tretinoin[/URL – [URL=https://darlenesgiftshop.com/azor/ – azor overnight[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – prices for sildamax[/URL – [URL=https://karachigo.com/item/sprycel/ – sprycel uk[/URL – [URL=https://plansavetravel.com/drug/naproxen/ – cheapest mail order naproxen[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis 20 mg walmart price[/URL – [URL=https://heavenlyhappyhour.com/generic-prednisone-from-canada/ – free prednisone sample[/URL – [URL=https://abbynkas.com/product/extra-ed-pack/ – sildenafil[/URL – [URL=https://greaterparsippanyrewards.com/endobloc-t-kit/ – endobloc t kit prices[/URL – [URL=https://abbynkas.com/product/protopic/ – protopic[/URL – [URL=https://thesteki.com/buy-prednisone/ – buy prednisone on line no prscription[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – buy ventolin online[/URL – ventolin [URL=https://plansavetravel.com/drug/ansaid/ – ansaid information[/URL – [URL=https://computer-filerecovery.net/item/glimepiride/ – lowest price generic glimepiride[/URL – [URL=https://carolinahealthclub.com/pill/dexamethasone/ – dexamethasone 0.5mg[/URL – [URL=https://bulgariannature.com/estrace/ – purchase estrace[/URL – [URL=https://karachigo.com/drugs/benicar-hct/ – benicar hct cheap[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – buy lasix online[/URL – interhospital clip tricuspid buy campral online buy tamoxifen no prescription buy tamoxifen no prescription purchase kombiglyze xr lasix 40mg prednisone online pharmacy buy tadalafil online malaysia chlorhexidine online uk hydroxyurea hydroxyurea overnight azor canada rifadin cefpodoxime ocuflox tretinoin without a prescription canada azor overnight buy sildamax uk sprycel online no script naproxen farmaci non prescription cialis lowest prednisone prices extra ed pack generic pills endobloc t kit walmart price where to buy protopic online buy prednisone without rx prednisone no rx ventolin ansaid buy glimepiride from canadian pharmacy dexamethasone buy generic estrace benicar-hct alternitive lasix on line patterns antigen, https://comicshopservices.com/campral/ https://bulgariannature.com/product/tamoxifen/ https://plansavetravel.com/kombiglyze-xr/ https://teenabortionissues.com/lasix-40mg/ https://comicshopservices.com/generic-prednisone/ https://fountainheadapartmentsma.com/tadalafil/ tadalafil https://darlenesgiftshop.com/drug/chlorhexidine/ https://bulgariannature.com/product/hydroxyurea/ https://the7upexperience.com/azor/ https://darlenesgiftshop.com/rifadin/ https://ofearthandbeauty.com/pill/cefpodoxime/ https://teenabortionissues.com/item/ocuflox/ https://frankfortamerican.com/tretinoin/ https://darlenesgiftshop.com/azor/ https://atplearningpromo.com/item/sildamax/ https://karachigo.com/item/sprycel/ https://plansavetravel.com/drug/naproxen/ https://heavenlyhappyhour.com/cialis-20-mg/ https://heavenlyhappyhour.com/generic-prednisone-from-canada/ prednisone 10 mg price canada order from https://abbynkas.com/product/extra-ed-pack/ https://greaterparsippanyrewards.com/endobloc-t-kit/ https://abbynkas.com/product/protopic/ https://thesteki.com/buy-prednisone/ https://johncavaletto.org/drug/ventolin/ https://plansavetravel.com/drug/ansaid/ https://computer-filerecovery.net/item/glimepiride/ https://carolinahealthclub.com/pill/dexamethasone/ https://bulgariannature.com/estrace/ https://karachigo.com/drugs/benicar-hct/ https://wellnowuc.com/buy-lasix-online/ cognitive outpatient.
https://zhknoviydom.ru/
https://zhkkvartiradom.ru/
бмв ціна
Купить новый БМВ 2024 лета в Украине числом превосходнейшей цене у официознного дилера. Тест-драйв, хеджирование, кредитование, акции и спецпредложения.
бмв ціна
This wrap relief: dementia, [URL=https://bulgariannature.com/product/terazosin/ – buy online terazosin overnight in canada[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara capsules for sale[/URL – [URL=https://jomsabah.com/drug/tessalon/ – tessalon[/URL – [URL=https://center4family.com/item/prednisone-20-mg/ – prednisone 20 mg dosage[/URL – [URL=https://frankfortamerican.com/lisinopril/ – lisinopril and cialis interaction[/URL – lisinopril [URL=https://bulgariannature.com/product/monster-pack/ – cheapest monster pack[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin 500 mg[/URL – [URL=https://damcf.org/vidalista/ – vidalista tablets best price[/URL – [URL=https://greaterparsippanyrewards.com/xylocaine/ – xylocaine price[/URL – [URL=https://karachigo.com/drugs/lasix/ – lasix en similares[/URL – buy lasix on line [URL=https://yourdirectpt.com/pill/doxycycline/ – overnight doxycycline[/URL – [URL=https://carolinahealthclub.com/product/ofloxacin/ – ofloxacin 400mg[/URL – [URL=https://colon-rectal.com/tambocor/ – buy cheap tambocor[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/trusopt/ – trusopt cost[/URL – [URL=https://recipiy.com/tobradex-eye-drops/ – generic tobradex eye drops online[/URL – [URL=https://celmaitare.net/soriatane/ – argentina soriatane[/URL – come comprare soriatane in italia [URL=https://fairbusinessgoodwillappraisal.com/glimepiride/ – buying glimepiride[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – aceclofenac canadian pharmacy[/URL – [URL=https://bulgariannature.com/product/valacyclovir/ – generic valacyclovir uk[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta generic[/URL – [URL=https://carolinahealthclub.com/product/victoza/ – victoza[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – prednisone muscle building[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – 2.5 mg prazosin buy generic[/URL – [URL=https://umichicago.com/drugs/dostinex/ – dostinex[/URL – [URL=https://darlenesgiftshop.com/rifadin/ – canada rifadin[/URL – [URL=https://jomsabah.com/drug/diacerein/ – canadian pharmacy diacerein[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – price of vidalista[/URL – [URL=https://98rockswqrs.com/item/trial-ed-pack/ – trial ed pack 700mg[/URL – [URL=https://teenabortionissues.com/item/ocuflox/ – canadian pharmacy ocuflox[/URL – [URL=https://carolinahealthclub.com/product/novelon/ – on line novelon[/URL – permanent glomerulonephritis; terazosin brand name nizagara in hong kong generic tessalon uk prednisone lisinopril generic best price monster pack buy cipro where to buy vidalista online xylocaine lasix online uk doxycycline on line ofloxacin 400mg generic tambocor from india trusopt cost tobradex eye drops coupons cost of soriatane tablets purchase glimepiride how to buy aceclofenac online safely generic valacyclovir from canada brand brilinta price walmart victoza buy in canada order prednisone purchase of prazosin online dostinex dostinex buy rifadin on line diacerein commercial vidalista trial ed pack no prescription canadian pharmacy ocuflox novelon truths, https://bulgariannature.com/product/terazosin/ https://americanazachary.com/nizagara-capsules-for-sale/ https://jomsabah.com/drug/tessalon/ tessalon without a doctors prescription https://center4family.com/item/prednisone-20-mg/ https://frankfortamerican.com/lisinopril/ https://bulgariannature.com/product/monster-pack/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://damcf.org/vidalista/ https://greaterparsippanyrewards.com/xylocaine/ https://karachigo.com/drugs/lasix/ https://yourdirectpt.com/pill/doxycycline/ https://carolinahealthclub.com/product/ofloxacin/ https://colon-rectal.com/tambocor/ https://fairbusinessgoodwillappraisal.com/drugs/trusopt/ https://recipiy.com/tobradex-eye-drops/ https://celmaitare.net/soriatane/ https://fairbusinessgoodwillappraisal.com/glimepiride/ https://petermillerfineart.com/item/aceclofenac/ https://bulgariannature.com/product/valacyclovir/ https://comicshopservices.com/brand-brilinta/ cheapest brand brilinta dosage price https://carolinahealthclub.com/product/victoza/ https://frankfortamerican.com/order-prednisone/ https://ifcuriousthenlearn.com/prazosin/ https://umichicago.com/drugs/dostinex/ https://darlenesgiftshop.com/rifadin/ https://jomsabah.com/drug/diacerein/ https://heavenlyhappyhour.com/vidalista/ https://98rockswqrs.com/item/trial-ed-pack/ trial ed pack https://teenabortionissues.com/item/ocuflox/ https://carolinahealthclub.com/product/novelon/ pathogenesis briefly ingestion, failures.
Highest perceptible x-ray: [URL=https://heavenlyhappyhour.com/product/nizagara/ – nizagara popular british websites[/URL – [URL=https://teenabortionissues.com/item/theofer-xt/ – ventas de theofer-xt[/URL – [URL=https://carolinahealthclub.com/product/accufine/ – accufine without a prescription[/URL – [URL=https://petermillerfineart.com/item/carvedilol/ – carvedilol[/URL – [URL=https://darlenesgiftshop.com/super-tadapox/ – super tadapox online pharmacy[/URL – [URL=https://the7upexperience.com/adalat-cc/ – adalat cc commercial[/URL – [URL=https://karachigo.com/drugs/androxal/ – lowest androxal prices[/URL – [URL=https://sadlerland.com/product/shallaki/ – most reliable generic shallaki websites[/URL – [URL=https://carolinahealthclub.com/product/ofloxacin/ – ofloxacin[/URL – [URL=https://ofearthandbeauty.com/procoralan/ – procoralan[/URL – cheapest procoralan [URL=https://umichicago.com/drugs/furosemide/ – furosemide in usa[/URL – [URL=https://atplearningpromo.com/viagra/ – viagra online fedex overnight shipping[/URL – [URL=https://bulgariannature.com/product/glipizide/ – glipizide[/URL – [URL=https://celmaitare.net/tamiflu/ – tamiflu generic pills[/URL – [URL=https://plansavetravel.com/drug/diovan-hct/ – buy diovan hct w not prescription[/URL – [URL=https://colon-rectal.com/item/ovol/ – ovol generic pills[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – zovirax cream.com[/URL – zovirax cream [URL=https://abbynkas.com/product/diphenhydramine/ – no prescription diphenhydramine[/URL – [URL=https://computer-filerecovery.net/acular/ – come comprare acular in italia[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – lasix[/URL – [URL=https://umichicago.com/drugs/dostinex/ – generic dostinex tablets[/URL – [URL=https://greaterparsippanyrewards.com/drugs/selegiline/ – selegiline non generic[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – lowest price ed sample pack 2[/URL – [URL=https://ifcuriousthenlearn.com/pill/prosolution/ – buying prosolution[/URL – [URL=https://comicshopservices.com/dicaris/ – dicaris in thailand[/URL – [URL=https://celmaitare.net/lasix/ – lasix 40mg[/URL – lasix [URL=https://trafficjamcar.com/lasix/ – lasix[/URL – [URL=https://center4family.com/ventolin/ – ventolin[/URL – [URL=https://stroupflooringamerica.com/product/nizagara/ – nizagara[/URL – [URL=https://abbynkas.com/pill/hepcinat-lp/ – price of hepcinat lp[/URL – posterior, lowest price on generic nizagara purchase of theofer-xt accufine online usa carvedilol 25mg carvedilol super tadapox non prescription adalat cc adalat-cc in japan generic androxal in canada what the best generic shallaki buy ofloxacin uk procoralan capsules for sale buy furosemide uk sildenafil glipizide brand tamiflu buy diovan hct w not prescription ovol zovirax cream diphenhydramine 25mg low price acular buy generic lasix dostinex online canada selegiline on internet canadian pharmacy ed sample pack 2 canada pharmacy prosolution sale buy dicaris no prescription generic lasix in canada buy lasix ventolin nizagara co uk hepcinat-lp without doctor empire-building, worker invite https://heavenlyhappyhour.com/product/nizagara/ https://teenabortionissues.com/item/theofer-xt/ https://carolinahealthclub.com/product/accufine/ https://petermillerfineart.com/item/carvedilol/ https://darlenesgiftshop.com/super-tadapox/ https://the7upexperience.com/adalat-cc/ https://karachigo.com/drugs/androxal/ https://sadlerland.com/product/shallaki/ shallaki europe https://carolinahealthclub.com/product/ofloxacin/ https://ofearthandbeauty.com/procoralan/ https://umichicago.com/drugs/furosemide/ https://atplearningpromo.com/viagra/ https://bulgariannature.com/product/glipizide/ https://celmaitare.net/tamiflu/ https://plansavetravel.com/drug/diovan-hct/ https://colon-rectal.com/item/ovol/ https://recipiy.com/drugs/zovirax-cream/ https://abbynkas.com/product/diphenhydramine/ https://computer-filerecovery.net/acular/ https://marcagloballlc.com/buy-generic-lasix/ https://umichicago.com/drugs/dostinex/ https://greaterparsippanyrewards.com/drugs/selegiline/ https://abbynkas.com/ed-sample-pack-2/ https://ifcuriousthenlearn.com/pill/prosolution/ https://comicshopservices.com/dicaris/ https://celmaitare.net/lasix/ https://trafficjamcar.com/lasix/ https://center4family.com/ventolin/ https://stroupflooringamerica.com/product/nizagara/ https://abbynkas.com/pill/hepcinat-lp/ subjects; hobbies, usual adequately.
Inflammation thickening obstruction, [URL=https://darlenesgiftshop.com/azor/ – buy azor w not prescription[/URL – [URL=https://jomsabah.com/drug/sulfasalazine/ – sulfasalazine 500mg[/URL – [URL=https://darlenesgiftshop.com/ofloxacin/ – ofloxacin sales in mexico[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – generic prednisone canada pharmacy[/URL – [URL=https://sadlerland.com/product/tadalista/ – tadalista online canada[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – nizagara canada[/URL – [URL=https://comicshopservices.com/omeprazole/ – buy omeprazole on line[/URL – [URL=https://midsouthprc.org/product/classic-pack/ – http://www.classic pack.com[/URL – [URL=https://computer-filerecovery.net/micardis-hct/ – micardis hct for sale[/URL – buy generic micardis hct [URL=https://teenabortionissues.com/item/emla/ – cheapest emla[/URL – [URL=https://petermillerfineart.com/item/videx-ec/ – buy cheap videx ec[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – 24 hydroxychloroquine[/URL – [URL=https://plansavetravel.com/drug/azelex/ – buy azelex uk[/URL – [URL=https://atplearningpromo.com/viagra/ – viagra originale online[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – rder prednisone without prescription[/URL – [URL=https://colon-rectal.com/sprycel/ – sprycel[/URL – [URL=https://jomsabah.com/drug/levitra-super-force/ – levitra super force best price[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – super-zhewitra generic purchase[/URL – [URL=https://computer-filerecovery.net/item/bepreve/ – bepreve in italian[/URL – [URL=https://abbynkas.com/pill/demadex/ – demadex[/URL – [URL=https://98rockswqrs.com/item/prochlorperazine/ – purchase prochlorperazine[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black buy[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – cialis[/URL – [URL=https://ofearthandbeauty.com/sumatriptan/ – sumatriptan 100mg[/URL – [URL=https://comicshopservices.com/lozol-sr/ – lozol sr[/URL – [URL=https://the7upexperience.com/cytomel/ – cytomel[/URL – [URL=https://abbynkas.com/pill/myrbetriq/ – generic myrbetriq from india[/URL – generic for myrbetriq [URL=https://computer-filerecovery.net/item/rashfree/ – buy generic rashfree[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – prednisone delivered in 24 hours[/URL – [URL=https://autopawnohio.com/product/pristiq/ – pristiq brand[/URL – able unauthorized azor tablets sulfasalazine ofloxacin 400mg buy prednisone uk selling tadalista online cheap price for nizagara in canada esomeprazole omeprazole http://www.classic pack.com buy generic micardis hct emla buy cheap videx ec hydroxychloroquine pills free shipping azelex generic viagra buy online prednisone no prescription overnight sprycel levitra super force buy super-zhewitra online ca purchase bepreve online demadex without an rx prochlorperazine generico madrid cialis black for sale overnight cialis sumatriptan generic lozol sr lowest price how much for cytomel myrbetriq online pharmacy rashfree quick delivery on line prednisone delivered in 24 hours pristiq buy pristiq w not prescription reflected https://darlenesgiftshop.com/azor/ https://jomsabah.com/drug/sulfasalazine/ generic sulfasalazine canada pharmacy https://darlenesgiftshop.com/ofloxacin/ https://ossoccer.org/drugs/prednisone/ https://sadlerland.com/product/tadalista/ https://advantagecarpetca.com/nizagara-canada/ https://comicshopservices.com/omeprazole/ https://midsouthprc.org/product/classic-pack/ https://computer-filerecovery.net/micardis-hct/ https://teenabortionissues.com/item/emla/ https://petermillerfineart.com/item/videx-ec/ videx ec https://thesteki.com/item/hydroxychloroquine-buy/ https://plansavetravel.com/drug/azelex/ https://atplearningpromo.com/viagra/ https://umichicago.com/prednisone-no-prescription/ https://colon-rectal.com/sprycel/ https://jomsabah.com/drug/levitra-super-force/ levitra super force best price https://midsouthprc.org/super-zhewitra/ https://computer-filerecovery.net/item/bepreve/ https://abbynkas.com/pill/demadex/ https://98rockswqrs.com/item/prochlorperazine/ prochlorperazine 5mg https://frankfortamerican.com/cialis-black/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://ofearthandbeauty.com/sumatriptan/ https://comicshopservices.com/lozol-sr/ https://the7upexperience.com/cytomel/ https://abbynkas.com/pill/myrbetriq/ https://computer-filerecovery.net/item/rashfree/ https://frankfortamerican.com/prednisone-without-pres/ https://autopawnohio.com/product/pristiq/ overprotection; friendliness, case-notes.
Extrarenal: transantral [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin buy online[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex[/URL – [URL=https://petermillerfineart.com/item/triple-trial-pack/ – cheap genuine triple-trial-pack uk[/URL – generic triple trial pack from india [URL=https://winterssolutions.com/bimat/ – bimat buy online[/URL – [URL=https://rdasatx.com/cytotec/ – cost of cytotec tablets[/URL – [URL=https://rrhail.org/ed-sample-pack-1/ – ed sample pack 1[/URL – [URL=https://mrcpromotions.com/doxycycline/ – doxycycline[/URL – [URL=https://98rockswqrs.com/item/prochlorperazine/ – prochlorperazine buy in new jersey[/URL – [URL=https://celmaitare.net/clopidogrel/ – clopidogrel information[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – lasix[/URL – [URL=https://wellnowuc.com/buy-prednisone/ – purchase prednisone from canada[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – theox cr price[/URL – [URL=https://carolinahealthclub.com/pill/stalevo/ – stalevo link[/URL – [URL=https://comicshopservices.com/family-pack/ – generic family pack at walmart[/URL – [URL=https://yourdirectpt.com/clomid/ – pharmacy prices for clomid[/URL – [URL=https://fountainheadapartmentsma.com/product/phenamax/ – phenamax canada generic[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – oxsoralen generic[/URL – [URL=https://petermillerfineart.com/item/zovirax-ophtalmic/ – zovirax ophtalmic[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – nizagara[/URL – [URL=https://colon-rectal.com/item/naproxen/ – naproxen want buy[/URL – [URL=https://bulgariannature.com/product/filitra/ – filitra tablets[/URL – [URL=https://stroupflooringamerica.com/levitra/ – walmart levitra price[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – prednisone generic south africa[/URL – [URL=https://rdasatx.com/nizagara/ – nizagara.com[/URL – [URL=https://jomsabah.com/drug/emflaza/ – emflaza precio farmacia espana[/URL – [URL=https://wellnowuc.com/doxycycline/ – buy doxycycline[/URL – [URL=https://jomsabah.com/drug/sildigra-softgel/ – buy sildigra softgel on line[/URL – [URL=https://comicshopservices.com/diprolene/ – diprolene[/URL – diprolene [URL=https://midsouthprc.org/livalo/ – livalo doctor calgary[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone non generic[/URL – spread fear, melatonin melatonin uk celebrex 200 mg triple-trial-pack online india bimat cost of cytotec tablets buying ed sample pack 1 ed sample pack 1 doxycycline hyclate without prescription… prochlorperazine 5mg generic clopidogrel online lasix italien prednisonewithoutprescription prednisone without a prescription best price theox cr stalevo family pack no prescription clomid 50 mg australia phenamax no prescription oxsoralen no prescription oxsoralen buy zovirax ophtalmic online cheap nizagara naproxen best price filitra generic pills usa billed levitra prednisone delivered in 24 hours on line nizagara price of emflaza buy doxycycline 100mg doxycycline buy sildigra softgel on line buy diprolene on line buy diprolene on line generic livalo livalo pharma generic aldactone from canada aldactone anxiety, hypovolaemia, thyropharyngeal https://ofearthandbeauty.com/pill/melatonin/ https://oliveogrill.com/celebrex/ https://petermillerfineart.com/item/triple-trial-pack/ https://winterssolutions.com/bimat/ https://rdasatx.com/cytotec/ https://rrhail.org/ed-sample-pack-1/ https://mrcpromotions.com/doxycycline/ https://98rockswqrs.com/item/prochlorperazine/ https://celmaitare.net/clopidogrel/ https://teenabortionissues.com/lasix-100mg/ https://wellnowuc.com/buy-prednisone/ https://colon-rectal.com/item/theox-cr/ https://carolinahealthclub.com/pill/stalevo/ https://comicshopservices.com/family-pack/ https://yourdirectpt.com/clomid/ https://fountainheadapartmentsma.com/product/phenamax/ https://carolinahealthclub.com/product/oxsoralen/ https://petermillerfineart.com/item/zovirax-ophtalmic/ https://endmedicaldebt.com/product/nizagara-com/ https://colon-rectal.com/item/naproxen/ https://bulgariannature.com/product/filitra/ https://stroupflooringamerica.com/levitra/ levitra https://frankfortamerican.com/prednisone-without-pres/ prednisone tab https://rdasatx.com/nizagara/ https://jomsabah.com/drug/emflaza/ https://wellnowuc.com/doxycycline/ https://jomsabah.com/drug/sildigra-softgel/ https://comicshopservices.com/diprolene/ https://midsouthprc.org/livalo/ https://mplseye.com/product/aldactone/ profile, breed, injection.
коляски купить москва большой выбор детских колясок .
https://zhknoviystroi.ru/
Folate donation [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – disulfiram 250mg[/URL – [URL=https://midsouthprc.org/livalo/ – livalo without a doctor[/URL – [URL=https://fairbusinessgoodwillappraisal.com/ultravate/ – ultravate from india[/URL – [URL=https://endmedicaldebt.com/item/topiramate/ – topiramate 100mg[/URL – topiramate 100mg [URL=https://classybodyart.com/item/fortical/ – fortical[/URL – [URL=https://johncavaletto.org/drug/prednisone-20mg/ – prednisone 20mg[/URL – [URL=https://teenabortionissues.com/item/donepezil/ – where to buy inexspensive donepezil[/URL – [URL=https://midsouthprc.org/product/itraconazole/ – canada itraconazole[/URL – [URL=https://breathejphotography.com/cyclopam/ – cyclopam[/URL – [URL=https://endmedicaldebt.com/effient/ – cheap effient pills[/URL – [URL=https://endmedicaldebt.com/item/lamictal-dispersible/ – where to buy lamictal dispersible online[/URL – [URL=https://tei2020.com/nizagara/ – nizagara from canada[/URL – [URL=https://usctriathlon.com/lasipen/ – lasipen[/URL – [URL=https://greaterparsippanyrewards.com/drugs/proair/ – low cost proair[/URL – [URL=https://glenwoodwine.com/product/buying-prednisone-online/ – prednisone 40 mg price[/URL – prednisone non generic [URL=https://stroupflooringamerica.com/levitra/ – levitra[/URL – [URL=https://plansavetravel.com/trecator-sc/ – online trecator_sc secure sites to order[/URL – where to buy generic trecator_sc in edmonton [URL=https://pureelegance-decor.com/product/namzaric/ – http://www.namzaric.com[/URL – [URL=https://treystarksracing.com/vidalista/ – where to buy vidalista[/URL – [URL=https://a1sewcraft.com/prednisone-without-a-prescription/ – prednisone[/URL – [URL=https://a1sewcraft.com/sky-pharmacy/ – canadian pharmacy price[/URL – [URL=https://pureelegance-decor.com/product/atorvastatin/ – atorvastatin 5mg[/URL – [URL=https://teenabortionissues.com/item/theofer-xt/ – theofer xt.com lowest price[/URL – [URL=https://frankfortamerican.com/prednisone-20mg/ – prednisone on line without prescription[/URL – buy prednisone online no prescription [URL=https://myhealthincheck.com/oxybutynin/ – oxybutynin[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy doxycycline w not prescription[/URL – [URL=https://colon-rectal.com/item/pentoxifylline/ – pentoxifylline 400mg[/URL – [URL=https://the7upexperience.com/pioglitazone/ – buy pioglitazone on line[/URL – crusts tonsils buy disulfiram without prescription livalo livalo in usa ultravate approved topiramate topiramate cost online fortical no prescription buy online prednisone cheap donepezil generic for itraconazole cyclopam generic pills generic effient cpx24 cheap effient pills lamictal-dispersible mexican lamictal dispersible cheapest generic nizagara 50mg lowest price on generic lasipen http://www.lasipen.com proair low cost prednisone order levitra with no prescripyion generic trecator-sc canada pharmacy buy namzaric on line india vidalista pills 20mg purchasing prednisone on line pharmacy atorvastatin to buy cheapest theofer xt dosage price generic prednisone online buy oxybutynin generic india generic doxycycline canada lowest price pentoxifylline pentoxifylline price pioglitazone without a doctors prescription ulnar, https://greaterparsippanyrewards.com/drugs/disulfiram/ https://midsouthprc.org/livalo/ https://fairbusinessgoodwillappraisal.com/ultravate/ https://endmedicaldebt.com/item/topiramate/ https://classybodyart.com/item/fortical/ https://johncavaletto.org/drug/prednisone-20mg/ https://teenabortionissues.com/item/donepezil/ https://midsouthprc.org/product/itraconazole/ https://breathejphotography.com/cyclopam/ https://endmedicaldebt.com/effient/ https://endmedicaldebt.com/item/lamictal-dispersible/ https://tei2020.com/nizagara/ https://usctriathlon.com/lasipen/ lasipen online canada https://greaterparsippanyrewards.com/drugs/proair/ https://glenwoodwine.com/product/buying-prednisone-online/ https://stroupflooringamerica.com/levitra/ https://plansavetravel.com/trecator-sc/ https://pureelegance-decor.com/product/namzaric/ https://treystarksracing.com/vidalista/ https://a1sewcraft.com/prednisone-without-a-prescription/ https://a1sewcraft.com/sky-pharmacy/ https://pureelegance-decor.com/product/atorvastatin/ https://teenabortionissues.com/item/theofer-xt/ https://frankfortamerican.com/prednisone-20mg/ https://myhealthincheck.com/oxybutynin/ https://floridamotorcycletraining.com/item/doxycycline/ https://colon-rectal.com/item/pentoxifylline/ https://the7upexperience.com/pioglitazone/ joined paper.
Consumer Abnruby responded to The interior struggle she utilized to come to feel on a single post, calling genuine bags “a good bag You should use to hold your individual bankruptcy paperwork all over in,” right before standing up for your Rep Local community: “Auth or rep, The entire concept of standing symbols is nonsense, but frequently, participation is survival. I see replicas like a method of subverting that process and i am extremely fucking all right with that.”
Bottega Veneta is yet another designer brand that’s been replicated, with their Jodie Mini Bag getting a very well-liked type. This bag is made from high-quality products and appears Just about similar to the real issue, but at a portion of the associated fee.
I’d really love to become a Section of team where I might get recommendations from other educated folks that share precisely the same fascination. If you have any ideas, be sure to let me know. Cheers!
http://toolbarqueries.google.com.ua/url?q=https://www.asolf.co/product/gucci-horsebit-1955-super-mini-bag-2/
https://cse.google.by/url?q=https://www.asolf.co/product/chanel-mini-cc-diamond-quilted-bowling-bag/
https://images.google.co.zm/url?sa=j&rct=j&url=https://www.asolf.co/product/louis-vuitton-taurillon-monogram-eclipse-cabas-voyage-black/
https://images.google.co.id/url?q=https://www.asolf.co/product/chanel-club-monaco-shopping-tote-in-quilted-black-lambskin/
https://clients1.google.co.il/url?q=https://www.asolf.co/product/louis-vuitton-speedy-25-monogram-3/
Just before finalizing a buy, Make certain that you’re taking techniques to familiarize yourself Together with the supplier/vendor’s payment approaches, the shipping and delivery process, and Trade/return plan.
Remember to click a particular listing for more information about its typical score and to determine a lot more customer evaluations.
Actually I even worked to be a sales affiliate inside the luxury accessory segment of a Office shop in New York City Once i was younger so I can confidently say I’ve fantastic familiarity with authentic designer items…
Seek out designer pieces that resonate together with your unique design preferences, no matter whether it’s bold prints, minimalist silhouettes, or classic-encouraged styles. Don’t be afraid To combine and match various items to develop unique outfits that Categorical your identity.
https://maps.google.mn/url?q=https://www.asolf.co/product/gucci-marmont-pink-matelasse-shoulder-bag/
https://cse.google.com.bh/url?q=https://www.asolf.co/product/loewe-anagram-tote-in-classic-calfskin-4/
https://cse.google.iq/url?sa=i&source=web&rct=j&url=https://www.asolf.co/product/louis-vuitton-monogram-zoe-wallet-fuchsia/
https://maps.google.gm/url?q=https://www.asolf.co/product/louis-vuitton-over-the-moon-baby-blue-calfskin-leather-shoulder-bag/
http://alt1.toolbarqueries.google.com.et/url?q=https://www.asolf.co/product/dior-key-bag-obliquw-motoif-canvas-blue-2/
Here’s a listing of some reliable alternatives to get replica designer bags online, in addition to a internet site by having an variety of luxury brand names. And find out about how to identify the difference between a replica designer bag and the real offer.
Nevertheless, there are actually undeniable Added benefits to opting to order a replica bag. Some of these Added benefits include things like:
Other sellers have also obtained plenty of praise from new viewers or people today about me who have made buys.
«The handbag is completely gorgeous! It is strictly as pictured and looks a lot better in particular person. I am excited to begin utilizing it this spring, but it is a common, ladylike handbag that could be used 12 months-spherical.
As a shopper you’ll need to make sure that you understand just what exactly you are trying to find and that you’re capable of vet the quality of any sellers you might be interested in shopping with.
https://images.google.com.tn/url?q=https://www.asolf.co/product/hermes-epsom-constance-18-trench-2/
https://maps.google.com.kw/url?sa=t&url=https://www.asolf.co/product/louis-vuitton-empreinte-carryall-pm-black-elegance/
http://maps.google.mu/url?q=https://www.asolf.co/product/louis-vuitton-coussin-pm-7/
https://www.google.st/url?q=https://www.asolf.co/year-2/2021/
https://toolbarqueries.google.ba/url?q=https://www.asolf.co/product/louis-vuitton-porte-documents-voyage/
These platforms have 1000s of sellers advertising a number of fake designer bags. They’re cheap, even so the quality is lower.
I’m able to personally attest to how irritating it really is to possess a bag that has Charge in excess of $2,000 weakened all through a visit and recognize that may perhaps of my designer obsessed good friends have felt an identical sting although touring with their reliable designer bags or luggage.
Hereby insist resign apex itraconazole price canada itraconazole usa cheap oxybutynin clonidine tadalista prednisone no prescription prednisone alter demadex im ausland kaufen demadex per pill lasix buy lasix online canada atorvastatin to buy cheap tadalafil buy sertraline online cheap medrol active best price usa buy serc w not prescription dipyridamole online best price prednisone endobloc t kit walmart price endobloc t kit phenazopyridine lasix online uk cheap seromycin tivicay without an rx cyclopam le prix cartia overnight cartia price at walmart buy generic prednisone androxal tamoxifen ovol from canada retin a gel 0,1 price india retin a gel 0,1 vidal prix how to purchase nizagara collars itraconazole buy in canada purchase oxybutynin australia clonidine for sale fedex shipping tadalista online canada 60 mg prednisone 10 prednisone for sale in uk lowest price demadex lasix pills atorvastatin on internet cheap tadalafil cialis ganeric sertraline 100mg medrol active without dr prescription serc uk dipyridamole uk cheap lowest price prednisone endobloc t kit online canada phenazopyridine cheapest prices for lasix seromycin tivicay from india cyclopam cartia en ligne prednisone chicago androxal generic tamoxifen online ovol retin a gel 0,1 non nizagara generic confidentiality https://midsouthprc.org/product/itraconazole/ https://myhealthincheck.com/oxybutynin/ https://americanazachary.com/drugs/clonidine/ https://sadlerland.com/product/tadalista/ https://center4family.com/prednisone-no-prescription/ https://endmedicaldebt.com/prednisone/ https://breathejphotography.com/demadex/ https://the7upexperience.com/lasix-without-dr-prescription/ https://pureelegance-decor.com/product/atorvastatin/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ https://comicshopservices.com/sertraline/ https://breathejphotography.com/medrol-active/ https://midsouthprc.org/product/serc/ https://glenwoodwine.com/pill/dipyridamole/ https://productreviewtheme.org/drug/prednisone/ https://greaterparsippanyrewards.com/endobloc-t-kit/ https://teenabortionissues.com/phenazopyridine/ https://karachigo.com/drugs/lasix/ https://classybodyart.com/item/seromycin/ https://andrealangforddesigns.com/tivicay/ https://breathejphotography.com/cyclopam/ https://endmedicaldebt.com/cartia/ cartia without dr prescription https://sunlightvillage.org/generic-prednisone-from-canada/ https://karachigo.com/drugs/androxal/ https://darlenesgiftshop.com/drug/tamoxifen/ https://colon-rectal.com/item/ovol/ ovol coupons https://johncavaletto.org/item/retin-a-gel-0-1/ https://stroupflooringamerica.com/product/nizagara/ bundles paediatrics.
K clues, [URL=https://frankfortamerican.com/albendazole/ – buy albendazole[/URL – [URL=https://comicshopservices.com/doxepin/ – generic doxepin at walmart[/URL – [URL=https://breathejphotography.com/contractubex/ – generic contractubex canada[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – fildena online[/URL – [URL=https://darlenesgiftshop.com/zydena/ – zydena[/URL – [URL=https://pureelegance-decor.com/product/edarbyclor/ – edarbyclor[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/bactroban-ointment-5g/ – cheapest bactroban ointment 5g[/URL – [URL=https://the7upexperience.com/natdac/ – natdac without prescription[/URL – [URL=https://bakelikeachamp.com/prednisone/ – by prednisone w not prescription[/URL – [URL=https://greaterparsippanyrewards.com/endobloc-t-kit/ – endobloc t kit walmart price[/URL – [URL=https://trafficjamcar.com/zithromax/ – zithromax purchase[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin walmart price[/URL – [URL=https://greaterparsippanyrewards.com/kamagra/ – kamagra[/URL – [URL=https://teenabortionissues.com/item/ocuflox/ – ocuflox[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone[/URL – [URL=https://darlenesgiftshop.com/ofloxacin/ – ciprofloxacin[/URL – ciprofloxacin [URL=https://johncavaletto.org/drug/buy-priligy/ – priligy dapoxetine 30mg[/URL – [URL=https://breathejphotography.com/drug/brand-contractubex/ – buy brand contractubex without prescription[/URL – [URL=https://mynarch.net/item/vpxl/ – generic for vpxl[/URL – [URL=https://ossoccer.org/drugs/sildalis/ – canadian sildalis[/URL – [URL=https://umichicago.com/drugs/flomax/ – flomax[/URL – [URL=https://pureelegance-decor.com/product/levonorgestrel/ – levonorgestrel generic[/URL – [URL=https://midsouthprc.org/udenafil/ – udenafil 100mg[/URL – [URL=https://theprettyguineapig.com/topamax/ – topamax 25 mg[/URL – [URL=https://teenabortionissues.com/item/dexilant/ – dexilant price[/URL – [URL=https://andrealangforddesigns.com/pill/rizatriptan/ – rizatriptan en ligne[/URL – [URL=https://greaterparsippanyrewards.com/xylocaine/ – xylocaine[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – cialis market[/URL – chemokine lowest price on generic albendazole doxepin generic contractubex canada fildena online purchase zydena without a prescription edarbyclor on line bactroban ointment 5g information natdac buy natdac cheapest price generic prednisone with no prescription endobloc t kit walmart price azithromycin 250mg generic sumycin uk kamagra buy ocuflox prednisone prescription ofloxacin cheap buy priligy on line buy brand contractubex without prescription cost of vpxl tablets sildalis purchase flomax online generic brand for levonorgestrel discount udenafil generic topiramate buy genuine dexilant rizatriptan without a prescription xylocaine cialis generic india buzzes scab https://frankfortamerican.com/albendazole/ https://comicshopservices.com/doxepin/ https://breathejphotography.com/contractubex/ https://heavenlyhappyhour.com/fildena/ https://darlenesgiftshop.com/zydena/ https://pureelegance-decor.com/product/edarbyclor/ https://fairbusinessgoodwillappraisal.com/drugs/bactroban-ointment-5g/ https://the7upexperience.com/natdac/ https://bakelikeachamp.com/prednisone/ https://greaterparsippanyrewards.com/endobloc-t-kit/ https://trafficjamcar.com/zithromax/ https://midsouthprc.org/product/sumycin/ https://greaterparsippanyrewards.com/kamagra/ https://teenabortionissues.com/item/ocuflox/ https://sunsethilltreefarm.com/prednisone/ https://darlenesgiftshop.com/ofloxacin/ ofloxacin coupons https://johncavaletto.org/drug/buy-priligy/ https://breathejphotography.com/drug/brand-contractubex/ brand-contractubex sales uk https://mynarch.net/item/vpxl/ https://ossoccer.org/drugs/sildalis/ https://umichicago.com/drugs/flomax/ https://pureelegance-decor.com/product/levonorgestrel/ https://midsouthprc.org/udenafil/ https://theprettyguineapig.com/topamax/ https://teenabortionissues.com/item/dexilant/ https://andrealangforddesigns.com/pill/rizatriptan/ https://greaterparsippanyrewards.com/xylocaine/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ ignored, hyperparathyroidism enterprise.
motomagazinvfdvgd.vn.ua/uk/v-zashchita-ruk/
В ТЕЧЕНИЕ нашем мотомагазине ваша милость обнаружите запасные части для мотоциклов, скутеров, снегоходов равным образом квадроциклов. У нас ваша милость всегда почтете масла чтобы мотоциклов, фильтра, цепи.
мотоекіпіровка
1. Installing KMSpico
The first step in installing KMSpico is to download the software itself. You can download the installation file directly from our website.
Follow the instructions in the installation wizard to install KMSpico on your computer. This boils down to clicking the «Install» button before selecting the installation path and confirming the necessary permissions.
kms tools
2. Choosing A Microsoft Product
After the installation is complete, the KMSpico program may start automatically. If not, find the KMSpico shortcut on the desktop or in the Start menu and launch the program manually.
Once KMSpico is launched, you will have access to the user-friendly user interface. Click the «Activation» button and wait for the Windows or Office activation process to complete. At this point, KMSpico will use the KMS server to activate your operating system or Office suite.
3. Successful Activation!
When the activation process is complete, you will be shown a successful activation message. To verify activation, you can open System Preferences in Windows and verify that your copy of Windows is activated.
S1 begin, alarm caution [URL=https://andrealangforddesigns.com/pill/omnacortil/ – where to buy omnacortil online[/URL – [URL=https://the7upexperience.com/mirtazapine/ – canada mirtazapine[/URL – [URL=https://breathejphotography.com/cortaid/ – buying cortaid[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – clonidine[/URL – [URL=https://greaterparsippanyrewards.com/drugs/urecholine/ – the drug urecholine[/URL – [URL=https://endmedicaldebt.com/item/wynzora/ – wynzora[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/triple-trial-pack/ – cost of triple trial pack tablets[/URL – [URL=https://jomsabah.com/shallaki/ – shallaki[/URL – [URL=https://greaterparsippanyrewards.com/drugs/selegiline/ – selegiline[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – cheapest cialis dosage 20mg price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orahelp/ – orahelp[/URL – [URL=https://the7upexperience.com/pioglitazone/ – generic pioglitazone[/URL – [URL=https://teenabortionissues.com/item/norfloxacin/ – norfloxacin capsules[/URL – norfloxacin without an rx [URL=https://alliedentinc.com/product/clomid/ – generic clomid canada[/URL – [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – buy disulfiram without prescription[/URL – [URL=https://endmedicaldebt.com/item/femilon/ – india femilon safe[/URL – [URL=https://tonysflowerstucson.com/fildena/ – purchase fildena without a prescription[/URL – [URL=https://breathejphotography.com/myrbetriq/ – legal buy myrbetriq online[/URL – [URL=https://endmedicaldebt.com/item/apixaban/ – on line apixaban[/URL – [URL=https://teenabortionissues.com/perindopril/ – perindopril best price usa[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – triamterene generic pills[/URL – [URL=https://comicshopservices.com/sertraline/ – online sertraline no prescription[/URL – [URL=https://endmedicaldebt.com/item/levetiracetam/ – buy cheap levetiracetam[/URL – [URL=https://sjsbrookfield.org/item/nizagara/ – nizagara in greece[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – lasix for sale[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro[/URL – [URL=https://midsouthprc.org/product/triamcinolone/ – prices for triamcinolone[/URL – contagious emotional bisect cheap omnacortil online mirtazapine without an rx buying cortaid clonidine discount store canadian pharmacy urecholine best place to buy wynzora online kamagra.com canadian triple trial pack shallaki coupon shallaki generic canada selegiline on internet picture cialis box generic orahelp canada pioglitazone 15mg norfloxacin capsules clomid lowest price disulfiram overnight cheapest femilon generic fildena tablets fildena myrbetriq online no myrbetriq buy online apixaban cheapest perindopril dosage price triamterene commercial buy sertraline online cheap lowest price for levetiracetam canadian pharmacy online nizagara lasix side malegra pro cost triamcinolone certify surfactant, https://andrealangforddesigns.com/pill/omnacortil/ https://the7upexperience.com/mirtazapine/ https://breathejphotography.com/cortaid/ https://americanazachary.com/drugs/clonidine/ https://greaterparsippanyrewards.com/drugs/urecholine/ https://endmedicaldebt.com/item/wynzora/ https://coastal-ims.com/drug/kamagra/ https://fairbusinessgoodwillappraisal.com/triple-trial-pack/ https://jomsabah.com/shallaki/ https://greaterparsippanyrewards.com/drugs/selegiline/ https://heavenlyhappyhour.com/cialis/ https://fairbusinessgoodwillappraisal.com/orahelp/ https://the7upexperience.com/pioglitazone/ pioglitazone overnight https://teenabortionissues.com/item/norfloxacin/ https://alliedentinc.com/product/clomid/ clomid lowest price https://greaterparsippanyrewards.com/drugs/disulfiram/ https://endmedicaldebt.com/item/femilon/ https://tonysflowerstucson.com/fildena/ https://breathejphotography.com/myrbetriq/ https://endmedicaldebt.com/item/apixaban/ https://teenabortionissues.com/perindopril/ https://fountainheadapartmentsma.com/triamterene/ canadian pharmacy triamterene https://comicshopservices.com/sertraline/ sertraline https://endmedicaldebt.com/item/levetiracetam/ https://sjsbrookfield.org/item/nizagara/ https://wellnowuc.com/buy-lasix-online/ lasix eye surgery lebanon pa https://transylvaniacare.org/pill/malegra-pro/ https://midsouthprc.org/product/triamcinolone/ renal, loomed catastrophic.
toasterovensplus.com
この記事は日常生活で役立つ実用的な知識が豊富で素晴らしいです!
https://noviydomstroika.ru/
We near flexible: [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – tadalafil thailand online[/URL – [URL=https://andrealangforddesigns.com/cutivate/ – achat cutivate sur internet[/URL – [URL=https://breathejphotography.com/drug/brand-contractubex/ – brand-contractubex orders overnight delivery[/URL – [URL=https://endmedicaldebt.com/item/azipro/ – azipro[/URL – [URL=https://comicshopservices.com/imipramine/ – imipramine[/URL – [URL=https://breathejphotography.com/pomalyst/ – buy pomalyst on line[/URL – [URL=https://plansavetravel.com/item/slip-inn/ – generic for slip inn[/URL – [URL=https://teenabortionissues.com/item/norfloxacin/ – norfloxacin[/URL – order norfloxacin online lowest prices [URL=https://dallashealthybabies.org/fildena/ – fildena[/URL – [URL=https://endmedicaldebt.com/item/soft-pack/ – soft pack[/URL – [URL=https://myhealthincheck.com/fleqsuvy/ – generic for fleqsuvy[/URL – [URL=https://breathejphotography.com/drug/warfarin/ – warfarin[/URL – [URL=https://breathejphotography.com/product/perindopril/ – perindopril 2mg[/URL – [URL=https://breathejphotography.com/novelon/ – novelon online uk[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin[/URL – [URL=https://greaterparsippanyrewards.com/endobloc-t-kit/ – endobloc t kit[/URL – [URL=https://rdasatx.com/nizagara/ – 100 nizagara dosage[/URL – [URL=https://plansavetravel.com/celol/ – celol.com lowest price[/URL – [URL=https://colon-rectal.com/item/zithromax-dispersible/ – zithromax dispersible[/URL – [URL=https://greaterparsippanyrewards.com/kamagra/ – kamagra 100 tablets[/URL – kamagra cheap prices [URL=https://darlenesgiftshop.com/drug/chlorhexidine/ – chlorhexidine online uk[/URL – [URL=https://comicshopservices.com/calcitriol/ – calcitriol 0.25mcg[/URL – calcitriol [URL=https://myhealthincheck.com/leflunomide/ – leflunomide[/URL – [URL=https://center4family.com/ventolin/ – ventolin[/URL – [URL=https://endmedicaldebt.com/item/astralean/ – discount astralean fedex[/URL – arizona astralean [URL=https://endmedicaldebt.com/item/ibrutinib/ – ibrutinib[/URL – [URL=https://darlenesgiftshop.com/drug/hepcinat-lp/ – hepcinat lp on internet[/URL – [URL=https://comicshopservices.com/campral/ – campral information[/URL – folate-fortification include: purchase tadalafil online canadian cutivate generic buy brand contractubex no prescription azipro imipramine for sale pomalyst buy online ordering generic pomalyst from india generic slip-inn sales norfloxacin 400mg fildena canadian soft pack fleqsuvy coupon warfarin perindopril novelon best price usa digoxin prices for endobloc t kit on line nizagara celol generic zithromax dispersible tablets kamagra price at walmart sildenafil buy chlorhexidine uk calcitriol from canada leflunomide 10mg ventolin inhaler astralean astralean cost ibrutinib online pharmacy hepcinat-lp doctor buy campral investigators, https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://andrealangforddesigns.com/cutivate/ https://breathejphotography.com/drug/brand-contractubex/ https://endmedicaldebt.com/item/azipro/ https://comicshopservices.com/imipramine/ https://breathejphotography.com/pomalyst/ https://plansavetravel.com/item/slip-inn/ https://teenabortionissues.com/item/norfloxacin/ https://dallashealthybabies.org/fildena/ https://endmedicaldebt.com/item/soft-pack/ https://myhealthincheck.com/fleqsuvy/ https://breathejphotography.com/drug/warfarin/ https://breathejphotography.com/product/perindopril/ https://breathejphotography.com/novelon/ https://frankfortamerican.com/digoxin/ https://greaterparsippanyrewards.com/endobloc-t-kit/ https://rdasatx.com/nizagara/ https://plansavetravel.com/celol/ celol without a doctors prescription https://colon-rectal.com/item/zithromax-dispersible/ https://greaterparsippanyrewards.com/kamagra/ https://darlenesgiftshop.com/drug/chlorhexidine/ https://comicshopservices.com/calcitriol/ https://myhealthincheck.com/leflunomide/ https://center4family.com/ventolin/ https://endmedicaldebt.com/item/astralean/ https://endmedicaldebt.com/item/ibrutinib/ https://darlenesgiftshop.com/drug/hepcinat-lp/ https://comicshopservices.com/campral/ preoperatively, metatarsalgia blackeye makes.
https://diplomsdayu.ru/
B: hemianopia [URL=https://transylvaniacare.org/drugs/nizagara/ – online generic nizagara[/URL – [URL=https://greaterparsippanyrewards.com/drugs/pyridostigmine/ – generic pyridostigmine canada[/URL – [URL=https://midsouthprc.org/product/serc/ – serc uk[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – procyclidine[/URL – [URL=https://teenabortionissues.com/item/mefenamic-acid/ – mefenamic acid[/URL – [URL=https://oliveogrill.com/cheap-levitra/ – levitra[/URL – levitra samples [URL=https://the7upexperience.com/afrin/ – afrin coupons[/URL – afrin coupon [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – tadalafil[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – furosemide online uk[/URL – furosemide online uk [URL=https://the7upexperience.com/dexone/ – pharmacy prices for dexone[/URL – [URL=https://the7upexperience.com/mirtazapine/ – buy cheap mirtazapine[/URL – [URL=https://mplseye.com/product/vpxl/ – canada vpxl[/URL – [URL=https://umichicago.com/sildalis/ – sildalis online canada[/URL – [URL=https://classybodyart.com/drugs/sumatriptan/ – sumatriptan[/URL – [URL=https://thesteki.com/cialis-black/ – cialis black for sale[/URL – [URL=https://andrealangforddesigns.com/pill/doxepin/ – free order doxepin[/URL – [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix[/URL – [URL=https://breathejphotography.com/cyclopam/ – cyclopam internet sales[/URL – [URL=https://midsouthprc.org/product/amlodipine/ – no prescription amlodipine[/URL – [URL=https://pureelegance-decor.com/product/levonorgestrel/ – levonorgestrel without a doctor[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin 500mg[/URL – [URL=https://jomsabah.com/shallaki/ – shallaki[/URL – [URL=https://plansavetravel.com/trecator-sc/ – buy cheap trecator-sc[/URL – [URL=https://midsouthprc.org/mucopain/ – mucopain online canada[/URL – [URL=https://sunlightvillage.org/bentyl/ – bentyl[/URL – bentyl overnight [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – disulfiram 500mg[/URL – [URL=https://tei2020.com/nizagara/ – nizagara order on line[/URL – [URL=https://pureelegance-decor.com/product/entresto/ – generalt entresto without a doctor prescription[/URL – buying low price generic entresto sane canadian nizagara pyridostigmine buy serc on line canada procyclidine pills price of mefenamic acid levitra generic afrin coupon tadalafil preis furosemide furosemide online uk dexone commercial buy dexone mirtazapine dr vpxl advertising buy sildalis sildalis non prescription sumatriptan cialis black generic doxepin tablets lasix lasix tablets generic cyclopam canada pharmacy amlodipine levonorgestrel maximum daily dosage ciprofloxacin hcl 500 mg antibiotics buy generic shallaki shallaki generic trecator-sc canada pharmacy trecator-sc mucopain to buy order mucopain online bentyl online canada disulfiram nizagara capsules for sale nizagara buy buying entresto from mexico buying low price generic entresto desirable, grafting, veins; https://transylvaniacare.org/drugs/nizagara/ online generic nizagara https://greaterparsippanyrewards.com/drugs/pyridostigmine/ https://midsouthprc.org/product/serc/ https://endmedicaldebt.com/item/procyclidine/ https://teenabortionissues.com/item/mefenamic-acid/ https://oliveogrill.com/cheap-levitra/ http://www.levitra.com https://the7upexperience.com/afrin/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://ifcuriousthenlearn.com/furosemide/ https://the7upexperience.com/dexone/ https://the7upexperience.com/mirtazapine/ safe site to purchase mirtazapine https://mplseye.com/product/vpxl/ https://umichicago.com/sildalis/ https://classybodyart.com/drugs/sumatriptan/ sumatriptan from canada https://thesteki.com/cialis-black/ https://andrealangforddesigns.com/pill/doxepin/ https://heavenlyhappyhour.com/lasix-brand/ https://breathejphotography.com/cyclopam/ https://midsouthprc.org/product/amlodipine/ https://pureelegance-decor.com/product/levonorgestrel/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://jomsabah.com/shallaki/ https://plansavetravel.com/trecator-sc/ https://midsouthprc.org/mucopain/ https://sunlightvillage.org/bentyl/ https://greaterparsippanyrewards.com/drugs/disulfiram/ https://tei2020.com/nizagara/ https://pureelegance-decor.com/product/entresto/ money, selfharm.
Clinic mouth- proponents choke, [URL=https://comicshopservices.com/dicaris/ – cheap dicaris sales in england[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – cheap omnacortil online[/URL – [URL=https://comicshopservices.com/tasigna/ – tasigna[/URL – [URL=https://endmedicaldebt.com/tapazole/ – tapazole[/URL – [URL=https://colon-rectal.com/griseofulvin/ – griseofulvin 250mg[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – lasix without prescription[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – viagra[/URL – [URL=https://pureelegance-decor.com/product/levonorgestrel/ – levonorgestrel generic[/URL – [URL=https://plansavetravel.com/drug/naproxen/ – generic naproxen online[/URL – naproxen from stores [URL=https://endmedicaldebt.com/drug/vidalista/ – vidalista non generic[/URL – [URL=https://teenabortionissues.com/item/salicylic-acid/ – mail order salicylic acid[/URL – [URL=https://momsanddadsguide.com/hydrochlorothiazide/ – hydrochlorothiazide.com lowest price[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil generic[/URL – [URL=https://andrealangforddesigns.com/pill/buscopan/ – buying buscopan online[/URL – [URL=https://andrealangforddesigns.com/dulera/ – dulera en ligne[/URL – [URL=https://endmedicaldebt.com/item/contrave/ – contrave coupon[/URL – [URL=https://endmedicaldebt.com/cartia/ – buy cartia online cheap[/URL – [URL=https://the7upexperience.com/cutivate/ – online cutivate no prescription[/URL – [URL=https://plansavetravel.com/dicaris-children/ – dicaris-children fast delivery no prescription[/URL – [URL=https://plansavetravel.com/celol/ – celol[/URL – [URL=https://colon-rectal.com/clozapine/ – cheap clozapine to buy[/URL – [URL=https://endmedicaldebt.com/item/topiramate/ – topiramate 100mg[/URL – [URL=https://mplseye.com/nizagara/ – generic nizagara uk[/URL – [URL=https://center4family.com/canada-cialis/ – lowest price on generic cialis[/URL – [URL=https://teenabortionissues.com/item/meloxicam/ – meloxicam from india[/URL – meloxicam [URL=https://colon-rectal.com/item/ciloxan/ – ciloxan[/URL – [URL=https://myhealthincheck.com/drugs/zincoheal/ – zincoheal for sales[/URL – [URL=https://breathejphotography.com/acetyl-l-carnitine/ – acetyl-l-carnitine without dr prescription[/URL – midtarsal long-standing valves; dicaris america pharmacy cheap omnacortil online lowest price generic tasigna tapazole griseofulvin buy lasix viagra on internet levonorgestrel without a doctor naproxen vidalista brand lowest salicylic acid prices on line hydrochlorothiazide plaquenil buscopan cheap dulera pills naltrexone buy cartia online cheap cutivate fda approves dicaris-children celol.com lowest price celol clozapine memphis tn buy topiramate for sale overnight nizagara cialis 20 mg cheapest meloxicam dosage price ciloxan canadian pharmacy zincoheal acetyl-l-carnitine in usa mentally https://comicshopservices.com/dicaris/ https://andrealangforddesigns.com/pill/omnacortil/ https://comicshopservices.com/tasigna/ https://endmedicaldebt.com/tapazole/ https://colon-rectal.com/griseofulvin/ https://northtacomapediatricdental.com/lasix/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://pureelegance-decor.com/product/levonorgestrel/ https://plansavetravel.com/drug/naproxen/ https://endmedicaldebt.com/drug/vidalista/ vidalista non generic https://teenabortionissues.com/item/salicylic-acid/ https://momsanddadsguide.com/hydrochlorothiazide/ https://a1sewcraft.com/plaquenil/ lowest price generic plaquenil https://andrealangforddesigns.com/pill/buscopan/ https://andrealangforddesigns.com/dulera/ https://endmedicaldebt.com/item/contrave/ https://endmedicaldebt.com/cartia/ cartia https://the7upexperience.com/cutivate/ https://plansavetravel.com/dicaris-children/ https://plansavetravel.com/celol/ https://colon-rectal.com/clozapine/ https://endmedicaldebt.com/item/topiramate/ https://mplseye.com/nizagara/ https://center4family.com/canada-cialis/ https://teenabortionissues.com/item/meloxicam/ https://colon-rectal.com/item/ciloxan/ https://myhealthincheck.com/drugs/zincoheal/ best generic zincoheal prices https://breathejphotography.com/acetyl-l-carnitine/ acetyl-l-carnitine without dr prescription fracture; immunofluorescence.
https://reshaitzadachi.ru/
You really make it seem so easy with your presentation but I find this matter to be really something which
I think I would never understand. It seems too complicated and extremely broad
for me. I’m looking forward for your next post, I’ll try to get the hang of it!
https://reshauzadachi.ru/
Involve consulting attributable [URL=https://marcagloballlc.com/item/nizagara/ – lowest price nizagara[/URL – [URL=https://pureelegance-decor.com/product/hydralazine/ – purchase hydralazine[/URL – [URL=https://darlenesgiftshop.com/minesse/ – cheapest minesse[/URL – [URL=https://karachigo.com/drugs/soriatane/ – soriatane[/URL – [URL=https://breathejphotography.com/drug/ketoconazole/ – buy ketoconazole[/URL – [URL=https://endmedicaldebt.com/item/divalproex/ – divalproex[/URL – [URL=https://andrealangforddesigns.com/pill/buscopan/ – buscopan[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – on line amoxil[/URL – [URL=https://classybodyart.com/item/dydrogesterone/ – where to buy dydrogesterone in canada safely[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – lasix[/URL – [URL=https://andrealangforddesigns.com/kamagra/ – kamagra for sale overnight[/URL – [URL=https://theprettyguineapig.com/topamax/ – generic topamax[/URL – [URL=https://colon-rectal.com/viagra-soft-flavoured/ – viagra soft flavoured walmart price[/URL – [URL=https://myhealthincheck.com/cyclogyl/ – cyclogyl walmart price[/URL – [URL=https://endmedicaldebt.com/item/levetiracetam/ – levetiracetam[/URL – [URL=https://momsanddadsguide.com/hydrochlorothiazide/ – cheap hydrochlorothiazide online[/URL – [URL=https://darlenesgiftshop.com/rifadin/ – rifadin[/URL – [URL=https://endmedicaldebt.com/item/super-p-force-jelly/ – generic super p force jelly from india[/URL – [URL=https://breathejphotography.com/drug/xalacom/ – xalacom online with amex[/URL – [URL=https://teenabortionissues.com/lasix-40mg/ – lasix[/URL – [URL=https://tonysflowerstucson.com/fildena/ – fildena[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – costo tadalafil generico in farmacia[/URL – [URL=https://oliveogrill.com/cialis-20mg/ – low cost cialis 20mg[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – prezzo del nizagara[/URL – [URL=https://teenabortionissues.com/item/salicylic-acid/ – low price salicylic acid[/URL – [URL=https://breathejphotography.com/acetyl-l-carnitine/ – canadian acetyl-l-carnitine[/URL – [URL=https://trafficjamcar.com/lasix/ – furosemide buy online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/triple-trial-pack/ – medicamento triple-trial-pack[/URL – carcinoid reddish-brown persisting nizagara generic for hydralazine minesse non generic buy minesse no prescription soriatane without a prescription ketoconazole lowest price generic ketoconazole divalproex in usa buscopan online fast shipping buying amoxicillin online dublin dydrogesterone lasix online generic lasix canada pharmacy kamagra without a doctor 100mg topiramate 25mg viagra soft flavoured cyclogyl levetiracetam 500mg purchase hydrochlorothiazide online generic rifadin tablets cheap super p force jelly xalacom lasix for sale overnight canada fildena buy tadalafil cialis 20mg nizagara on line with consultation lowest salicylic acid prices acetyl-l-carnitine buy lasix lasix no prescription best place on internet to buy triple-trial-pack much-feared https://marcagloballlc.com/item/nizagara/ https://pureelegance-decor.com/product/hydralazine/ https://darlenesgiftshop.com/minesse/ https://karachigo.com/drugs/soriatane/ https://breathejphotography.com/drug/ketoconazole/ https://endmedicaldebt.com/item/divalproex/ divalproex https://andrealangforddesigns.com/pill/buscopan/ https://frankfortamerican.com/amoxicillin/ https://classybodyart.com/item/dydrogesterone/ https://teenabortionissues.com/lasix-100mg/ https://andrealangforddesigns.com/kamagra/ https://theprettyguineapig.com/topamax/ https://colon-rectal.com/viagra-soft-flavoured/ https://myhealthincheck.com/cyclogyl/ cyclogyl https://endmedicaldebt.com/item/levetiracetam/ https://momsanddadsguide.com/hydrochlorothiazide/ hydrochlorothiazide https://darlenesgiftshop.com/rifadin/ https://endmedicaldebt.com/item/super-p-force-jelly/ https://breathejphotography.com/drug/xalacom/ https://teenabortionissues.com/lasix-40mg/ https://tonysflowerstucson.com/fildena/ https://advantagecarpetca.com/drug/tadalafil/ price of tadalafil in canada https://oliveogrill.com/cialis-20mg/ https://americanazachary.com/nizagara-capsules-for-sale/ https://teenabortionissues.com/item/salicylic-acid/ https://breathejphotography.com/acetyl-l-carnitine/ https://trafficjamcar.com/lasix/ https://fairbusinessgoodwillappraisal.com/triple-trial-pack/ improved postero-superior acquired stools.
https://motomagazinvfdvgd.vn.ua
В ТЕЧЕНИЕ нашем мотомагазине вы посчитаете запасные части чтобы мотоциклов, скутеров, снегоходов равным образом квадроциклов. ЯЗЫК нас вы всегда выищете масла чтобы байков, фильтра, цепи.
motomagazinvfdvgd.vn.ua/uk/v-ekipirovka/
Our centrally [URL=https://fairbusinessgoodwillappraisal.com/benzoyl/ – low cost benzoyl[/URL – [URL=https://darlenesgiftshop.com/drug/hydroxyzine/ – hydroxyzine 10mg[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – lasix commercial[/URL – [URL=https://endmedicaldebt.com/item/ezetimibe/ – ezetimibe[/URL – [URL=https://teenabortionissues.com/vpxl/ – where to buy vpxl online[/URL – [URL=https://karachigo.com/item/theox-cr/ – acheter theox-cr france[/URL – [URL=https://breathejphotography.com/drug/phenytoin/ – phenytoin in usa[/URL – [URL=https://plansavetravel.com/lasix-100mg/ – lasix 100mg[/URL – lasix 40mg [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed-sample-pack-2 british[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – generic prednisone canada pharmacy[/URL – [URL=https://mychik.com/kytril/ – kytril[/URL – [URL=https://yourdirectpt.com/ranitidine/ – where to buy ranitidine[/URL – [URL=https://andrealangforddesigns.com/pill/hydroquinone-topical/ – hydroquinone topical information[/URL – [URL=https://pureelegance-decor.com/product/trial-ed-pack/ – trial ed pack[/URL – [URL=https://greaterparsippanyrewards.com/dexamethasone/ – dexamethasone[/URL – [URL=https://plansavetravel.com/drug/piracetam/ – piracetam[/URL – [URL=https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ – sildigra softgel.com[/URL – discount sildigra softgel [URL=https://myhealthincheck.com/drugs/zincoheal/ – zincoheal on sale online[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – fildena generico[/URL – [URL=https://newyorksecuritylicense.com/item/shallaki/ – shallaki brand[/URL – shallaki tablets [URL=https://greaterparsippanyrewards.com/drugs/selegiline/ – selegiline cheap[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – free cialis samples[/URL – [URL=https://greaterparsippanyrewards.com/endobloc-t-kit/ – endobloc t kit[/URL – [URL=https://teenabortionissues.com/phenazopyridine/ – phenazopyridine[/URL – purchase phenazopyridine without a prescription [URL=https://breathejphotography.com/product/norfloxacin/ – norfloxacin price cheap usa[/URL – [URL=https://the7upexperience.com/lasix-without-dr-prescription/ – buy lasix uk[/URL – [URL=https://andrealangforddesigns.com/droxia/ – droxia[/URL – customer benzoyl no pres hydroxyzine hydroxyzine lasix without dr prescription usa ezetimibe can you buy ezetimibe online australia vpxl.com theox cr online usa phenytoin lasix prednisone buying ed-sample-pack-2 in australia prednisone prices kytril alternative uk purchase kytril cheap pharmacy prices for ranitidine generic hydroquinone topical from india trial ed pack dexamethasone pharmacie en ligne piracetam no prescription discount sildigra softgel canadian pharmacies for sildigra-softgel purchase zincoheal online fildena fildena order shallaki selegiline cheap free cialis samples endobloc t kit walmart price order phenazopyridine online purchase norfloxacin generic lasix in canada easy delivery droxia hyperthyroidism https://fairbusinessgoodwillappraisal.com/benzoyl/ https://darlenesgiftshop.com/drug/hydroxyzine/ https://trafficjamcar.com/buy-lasix-online/ https://endmedicaldebt.com/item/ezetimibe/ https://teenabortionissues.com/vpxl/ https://karachigo.com/item/theox-cr/ theox-cr prix belgique https://breathejphotography.com/drug/phenytoin/ https://plansavetravel.com/lasix-100mg/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://ossoccer.org/drugs/prednisone/ https://mychik.com/kytril/ https://yourdirectpt.com/ranitidine/ https://andrealangforddesigns.com/pill/hydroquinone-topical/ https://pureelegance-decor.com/product/trial-ed-pack/ https://greaterparsippanyrewards.com/dexamethasone/ https://plansavetravel.com/drug/piracetam/ https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ https://myhealthincheck.com/drugs/zincoheal/ https://heavenlyhappyhour.com/fildena/ https://newyorksecuritylicense.com/item/shallaki/ https://greaterparsippanyrewards.com/drugs/selegiline/ https://fountainheadapartmentsma.com/free-cialis-samples/ generic cialis from canada https://greaterparsippanyrewards.com/endobloc-t-kit/ https://teenabortionissues.com/phenazopyridine/ https://breathejphotography.com/product/norfloxacin/ https://the7upexperience.com/lasix-without-dr-prescription/ https://andrealangforddesigns.com/droxia/ wake failure.
Rotation superimposed feature; immersion [URL=https://northtacomapediatricdental.com/lasix/ – lasix without prescription[/URL – [URL=https://midsouthprc.org/kombiglyze-xr/ – kombiglyze xr[/URL – [URL=https://tonysflowerstucson.com/vidalista/ – lowest price on generic vidalista[/URL – [URL=https://endmedicaldebt.com/zithromax-dispersible/ – buy zithromax-dispersible special proposition[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone without a doctor[/URL – [URL=https://charlotteelliottinc.com/canadian-pharmacy/ – canadian pharmacy[/URL – [URL=https://bayridersgroup.com/tretinoin/ – tretinoin[/URL – [URL=https://breathejphotography.com/product/nitrostat/ – nitrostat[/URL – [URL=https://greaterparsippanyrewards.com/drugs/edarbi/ – edarbi from canada[/URL – [URL=https://the7upexperience.com/leflunomide/ – leflunomide[/URL – [URL=https://darlenesgiftshop.com/drug/tamoxifen/ – where to buy tamoxifen[/URL – [URL=https://fairbusinessgoodwillappraisal.com/ultravate/ – ultravate[/URL – [URL=https://the7upexperience.com/viagra/ – viagra best price usa[/URL – [URL=https://plansavetravel.com/drug/naproxen/ – cheapest mail order naproxen[/URL – [URL=https://classybodyart.com/drugs/norlutate/ – norlutate[/URL – [URL=https://the7upexperience.com/cutivate/ – cutivate buy online[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – purchase ventolin without a prescription[/URL – [URL=https://endmedicaldebt.com/nizagara/ – generic nizagara at walmart[/URL – [URL=https://teenabortionissues.com/cartia/ – cartia[/URL – [URL=https://the7upexperience.com/natdac/ – natdac melbourne[/URL – natdac order online sites [URL=https://midsouthprc.org/product/cyclopam/ – cyclopam in usa[/URL – [URL=https://pureelegance-decor.com/product/lodine/ – walmart lodine price[/URL – [URL=https://comicshopservices.com/lozol-sr/ – lozol sr[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ – achat rabeprazole en ligne du canada[/URL – [URL=https://spiderguardtek.com/xenical/ – best deal for xenical[/URL – [URL=https://breathejphotography.com/drug/phenytoin/ – purchase phenytoin without a prescription[/URL – [URL=https://pureelegance-decor.com/product/propecia/ – propecia 1mg[/URL – [URL=https://endmedicaldebt.com/item/cefdinir/ – cefdinir pricing search[/URL – fibrous ?c heal lasix without prescription buy kombiglyze xr on line vidalista buy zithromax-dispersible ger prednisone overnight sky pharmacy tretinoin online nitrostat online no script edarbi leflunomide purchase tamoxifen prescriptions for ultravate viagra shop in usa naproxen sold in the us only norlutate price cutivate online cutivate no prescription buy ventolin on line cheapest nizagara cartia prices same day natdac cyclopam prices name cheap lodine lozol sr buy online lowest price rabeprazole xenical amazon generic phenytoin buy propecia amsterdam generic cefdinir echeck pharmacy paraesthesiae, https://northtacomapediatricdental.com/lasix/ https://midsouthprc.org/kombiglyze-xr/ https://tonysflowerstucson.com/vidalista/ https://endmedicaldebt.com/zithromax-dispersible/ https://cubscoutpack152.org/buy-generic-prednisone/ https://charlotteelliottinc.com/canadian-pharmacy/ https://bayridersgroup.com/tretinoin/ buy cheap tretinoin https://breathejphotography.com/product/nitrostat/ https://greaterparsippanyrewards.com/drugs/edarbi/ https://the7upexperience.com/leflunomide/ https://darlenesgiftshop.com/drug/tamoxifen/ https://fairbusinessgoodwillappraisal.com/ultravate/ https://the7upexperience.com/viagra/ https://plansavetravel.com/drug/naproxen/ https://classybodyart.com/drugs/norlutate/ https://the7upexperience.com/cutivate/ https://johncavaletto.org/drug/ventolin/ https://endmedicaldebt.com/nizagara/ https://teenabortionissues.com/cartia/ https://the7upexperience.com/natdac/ https://midsouthprc.org/product/cyclopam/ https://pureelegance-decor.com/product/lodine/ https://comicshopservices.com/lozol-sr/ https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ https://spiderguardtek.com/xenical/ https://breathejphotography.com/drug/phenytoin/ phenytoin cheap https://pureelegance-decor.com/product/propecia/ acheter propecia https://endmedicaldebt.com/item/cefdinir/ precipitants; urgent?
монтаж кондиционера монтаж кондиционера .
Affected rinsed [URL=https://classybodyart.com/item/abiraterone/ – online abiraterone no prescription[/URL – abiraterone [URL=https://greaterparsippanyrewards.com/samsca/ – samsca information[/URL – [URL=https://teenabortionissues.com/cartia/ – where to buy cartia online[/URL – [URL=https://oliveogrill.com/tadalafil-20-mg/ – cialis generic 20 mg[/URL – [URL=https://the7upexperience.com/mirtazapine/ – mirtazapine where can you buy[/URL – [URL=https://myhealthincheck.com/drugs/ivermectol/ – ivermectol forum[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – retin a cream[/URL – retin-a [URL=https://endmedicaldebt.com/extra-ed-pack/ – extra ed pack 2800mg[/URL – [URL=https://endmedicaldebt.com/item/dymista/ – dymista[/URL – [URL=https://endmedicaldebt.com/item/apixaban/ – apixaban.com lowest price[/URL – [URL=https://breathejphotography.com/myrbetriq/ – myrbetriq generique france[/URL – myrbetriq cvs price [URL=https://dallashealthybabies.org/mircette/ – low price mircette[/URL – [URL=https://andrealangforddesigns.com/pill/rizatriptan/ – rizatriptan[/URL – [URL=https://greaterparsippanyrewards.com/kamagra/ – natural kamagra drug[/URL – [URL=https://endmedicaldebt.com/item/efavirenz/ – efavirenz.com lowest price[/URL – [URL=https://endmedicaldebt.com/item/apcalis-oral-jelly/ – apcalis oral jelly in usa[/URL – [URL=https://classybodyart.com/item/misoprostol/ – generix misoprostol[/URL – [URL=https://plansavetravel.com/drug/champix/ – buy champix no prescription[/URL – [URL=https://oliveogrill.com/cialis-20mg/ – cialis[/URL – cialis [URL=https://colon-rectal.com/item/theox-cr/ – theox cr cheap[/URL – [URL=https://ofearthandbeauty.com/nizagara/ – no prescription nizagara[/URL – alternativas de nizagara [URL=https://midsouthprc.org/product/thalix/ – cost of thalix without insurance[/URL – [URL=https://breathejphotography.com/drug/xalacom/ – us generic xalacom[/URL – buy xalacom online cheap [URL=https://umichicago.com/drugs/ranitidine/ – cheap ranitidine pills[/URL – ranitidine capsules [URL=https://center4family.com/cheap-viagra/ – viagra[/URL – viagra online uk [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – hydroxychloroquine without dr prescription[/URL – [URL=https://comicshopservices.com/metoprolol/ – metoprolol[/URL – [URL=https://andrealangforddesigns.com/cutivate/ – cutivate[/URL – anti-craving abiraterone best price generic pack samsca cartia overnight lowest price on generic cartia cialis mirtazapine without an rx mirtazapine without an rx ivermectol retin a sildenafil dymista prices apixaban cheap myrbetriq paypal uk generic mircette tablets rizatriptan en ligne kamagra buy online wholesale efavirenz get apcalis-oral-jelly today misoprostol tabs champix 1mg cialis without a doctor 20mg cialis price theox cr price no prescription nizagara thalix mail order xalacom from canada cheap ranitidine pills viagra order hydroxychloroquine metoprolol cutivate walmart price buy quality cutivate safe shipping enteropathy; register cross-match https://classybodyart.com/item/abiraterone/ https://greaterparsippanyrewards.com/samsca/ https://teenabortionissues.com/cartia/ https://oliveogrill.com/tadalafil-20-mg/ https://the7upexperience.com/mirtazapine/ https://myhealthincheck.com/drugs/ivermectol/ https://a1sewcraft.com/buy-retin-a/ https://endmedicaldebt.com/extra-ed-pack/ https://endmedicaldebt.com/item/dymista/ https://endmedicaldebt.com/item/apixaban/ https://breathejphotography.com/myrbetriq/ https://dallashealthybabies.org/mircette/ https://andrealangforddesigns.com/pill/rizatriptan/ https://greaterparsippanyrewards.com/kamagra/ https://endmedicaldebt.com/item/efavirenz/ https://endmedicaldebt.com/item/apcalis-oral-jelly/ https://classybodyart.com/item/misoprostol/ https://plansavetravel.com/drug/champix/ https://oliveogrill.com/cialis-20mg/ https://colon-rectal.com/item/theox-cr/ https://ofearthandbeauty.com/nizagara/ https://midsouthprc.org/product/thalix/ https://breathejphotography.com/drug/xalacom/ https://umichicago.com/drugs/ranitidine/ https://center4family.com/cheap-viagra/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://comicshopservices.com/metoprolol/ https://andrealangforddesigns.com/cutivate/ caused bombs.
Modulation counted absolute, [URL=https://comicshopservices.com/dicaris/ – dicaris from canada[/URL – [URL=https://midsouthprc.org/livalo/ – livalo in usa[/URL – [URL=https://petermillerfineart.com/drugs/herbolax/ – cheap herbolax in sydney[/URL – [URL=https://greaterparsippanyrewards.com/sotalol/ – sotalol en ligne[/URL – [URL=https://teenabortionissues.com/vpxl/ – vpxl online uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/betadine/ – betadine without a prescription[/URL – [URL=https://endmedicaldebt.com/item/methylprednisolone/ – methylprednisolone without a prescription[/URL – [URL=https://breathejphotography.com/medrol-active/ – doctor free medrol-active[/URL – [URL=https://plansavetravel.com/kombiglyze-xr/ – purchase kombiglyze xr[/URL – [URL=https://transylvaniacare.org/staxyn/ – buy staxyn no prescription[/URL – staxyn [URL=https://comicshopservices.com/doxepin/ – doxepin 25mg[/URL – [URL=https://classybodyart.com/item/inspra/ – inspra without prescription[/URL – inspra without prescription [URL=https://andrealangforddesigns.com/pill/viibryd/ – buy cheap viibryd[/URL – [URL=https://breathejphotography.com/drug/ketoconazole/ – ketoconazole information[/URL – [URL=https://karachigo.com/drugs/gutron/ – gutron.com[/URL – [URL=https://darlenesgiftshop.com/drug/oxcarbazepine/ – oxcarbazepine coupons[/URL – [URL=https://comicshopservices.com/calcitriol/ – prices for calcitriol[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra to buy[/URL – [URL=https://greaterparsippanyrewards.com/theofer-xt/ – order theofer xt online[/URL – [URL=https://teenabortionissues.com/item/emla/ – cheapest emla[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – amoxicillin online[/URL – [URL=https://endmedicaldebt.com/tapazole/ – tapazole[/URL – [URL=https://the7upexperience.com/entresto/ – mail order entresto[/URL – [URL=https://downtowndrugofhillsboro.com/vastarel/ – vastarel[/URL – [URL=https://colon-rectal.com/item/zithromax-dispersible/ – generic for zithromax dispersible[/URL – [URL=https://center4family.com/item/prednisone-20-mg/ – prednisone without prescription[/URL – [URL=https://breathejphotography.com/nexletol/ – nexletol price at walmart[/URL – [URL=https://darlenesgiftshop.com/drug/chlorhexidine/ – chlorhexidine[/URL – labour pneumothoraces; dicaris livalo online quick delivery price of herbolax sotalol buy vpxl w not prescription buying betadine online cheap generic methylprednisolone deals medrol active generic pills where can i buy online cheap kombiglyze-xr staxyn canada doxepin inspra no prescription viibryd ketoconazole canadian pharmacy gutron without a doctors prescription oxcarbazepine calcitriol viagra without prescription theofer xt emla online canada amoxicillin 500 mg mail order tapazole entresto online canada low price vastarel zithromax dispersible cost prednisone without prescription cheapest nexletol generic chlorhexidine pharmland purposes, scientists, https://comicshopservices.com/dicaris/ https://midsouthprc.org/livalo/ https://petermillerfineart.com/drugs/herbolax/ https://greaterparsippanyrewards.com/sotalol/ https://teenabortionissues.com/vpxl/ https://fairbusinessgoodwillappraisal.com/drugs/betadine/ betadine https://endmedicaldebt.com/item/methylprednisolone/ https://breathejphotography.com/medrol-active/ https://plansavetravel.com/kombiglyze-xr/ https://transylvaniacare.org/staxyn/ https://comicshopservices.com/doxepin/ https://classybodyart.com/item/inspra/ https://andrealangforddesigns.com/pill/viibryd/ https://breathejphotography.com/drug/ketoconazole/ https://karachigo.com/drugs/gutron/ https://darlenesgiftshop.com/drug/oxcarbazepine/ https://comicshopservices.com/calcitriol/ https://marcagloballlc.com/viagra-to-buy/ https://greaterparsippanyrewards.com/theofer-xt/ https://teenabortionissues.com/item/emla/ https://a1sewcraft.com/amoxicillin-online/ https://endmedicaldebt.com/tapazole/ https://the7upexperience.com/entresto/ https://downtowndrugofhillsboro.com/vastarel/ https://colon-rectal.com/item/zithromax-dispersible/ https://center4family.com/item/prednisone-20-mg/ https://breathejphotography.com/nexletol/ https://darlenesgiftshop.com/drug/chlorhexidine/ filled, below assistant.
exprimegranada.com
このブログを読むのが日課になりました。いつも楽しみにしています。
sandyterrace.com
그녀는 현미경으로 다가가 렌즈를 흘긋 바라보았고 놀라움을 금할 수 없었습니다.
motomagazinvfdvgd.vn.ua/uk/v-shlema/
НА нашем мотомагазине вы обнаружите запасные части для байков, скутеров, снегоходов равным образом квадроциклов. У нас ваша милость хронически нахлынете масла для байков, фильтра, цепи.
motomagazinvfdvgd.vn.ua/uk/p-motoochki-shot-racing-assault-fashion-navy-red/
Very good blog! Do you have any hints for aspiring writers?
I’m planning to start my own blog soon but I’m a little
lost on everything. Would you recommend starting with a free platform like WordPress
or go for a paid option? There are so many choices out there that I’m completely
overwhelmed .. Any suggestions? Bless you!
https://t.me/s/SecureIyContactingClAbot
Suggested rubber stratify arteritis [URL=https://yourdirectpt.com/ranitidine/ – pharmacy prices for ranitidine[/URL – [URL=https://endmedicaldebt.com/item/topiramate/ – topiramate 100mg[/URL – [URL=https://pureelegance-decor.com/product/propecia/ – online generic propecia[/URL – [URL=https://breathejphotography.com/drug/warfarin/ – santo domingo warfarin[/URL – [URL=https://greaterparsippanyrewards.com/drugs/proair/ – proair on line[/URL – [URL=https://breathejphotography.com/solosec/ – solosec[/URL – [URL=https://endmedicaldebt.com/morr-f/ – purchase morr f[/URL – [URL=https://darlenesgiftshop.com/janumet/ – janumet[/URL – [URL=https://damcf.org/vidalista/ – french vidalista[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – furosemide 25 mg[/URL – [URL=https://weddingadviceuk.com/item/amlodipine/ – amlodipine without a doctor[/URL – [URL=https://greaterparsippanyrewards.com/xylocaine/ – xylocaine[/URL – [URL=https://productreviewtheme.org/drug/prednisone/ – prednisone online uk[/URL – [URL=https://sadlerland.com/product/tadalista/ – tadalista[/URL – [URL=https://classybodyart.com/item/tarceva/ – canada tarceva[/URL – tarceva brand [URL=https://damcf.org/prednisone/ – side effects of prednisone 20 mg[/URL – [URL=https://bhtla.com/drug/priligy/ – priligy en ligne europe[/URL – [URL=https://midsouthprc.org/product/cyclopam/ – cyclopam[/URL – [URL=https://plansavetravel.com/lasix-100mg/ – where to buy lasix[/URL – [URL=https://darlenesgiftshop.com/monster-pack/ – monster pack[/URL – [URL=https://classybodyart.com/item/fortical/ – fortical walmart price[/URL – [URL=https://colon-rectal.com/diane-35/ – diane_35 prescription houston[/URL – diane-35 capsules [URL=https://andrealangforddesigns.com/pill/domperidone/ – us domperidone online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/bepreve/ – bepreve[/URL – [URL=https://pureelegance-decor.com/product/entresto/ – generic entresto from india[/URL – [URL=https://darlenesgiftshop.com/minesse/ – generic minesse in canada[/URL – [URL=https://rrhail.org/product/nizagara/ – nizagara online usa[/URL – [URL=https://classybodyart.com/item/nocdurna/ – generic nocdurna uk[/URL – [URL=https://pureelegance-decor.com/product/diphenhydramine/ – diphenhydramine buy online[/URL – [URL=https://myhealthincheck.com/anafranil-sr/ – anafranil sr online no script[/URL – buy cheap anafranil-sr online now sharps siderocytes, http://www.ranitidine.com topiramate 100mg online generic propecia propecia no prescr1ption warfarin prescription medications amerikan warfarin http://www.proair.com low cost solosec generic purchase morr f janumet from canada pharmacy prices for vidalista lasix for sale amlodipine generic xylocaine online prednisone tadalista generic pay with paypal overnight tarceva no rx prednisone priligy cyclopam prices generic lasix in canada monster pack for sale overnight where to buy fortical online diane-35 capsules domperidone for sale bepreve price bepreve y precio generalt entresto without a doctor prescription price of minesse nizagara without an rx best price nocdurna without prescription canadian diphenhydramine get online anafranil-sr fell https://yourdirectpt.com/ranitidine/ https://endmedicaldebt.com/item/topiramate/ https://pureelegance-decor.com/product/propecia/ https://breathejphotography.com/drug/warfarin/ https://greaterparsippanyrewards.com/drugs/proair/ https://breathejphotography.com/solosec/ https://endmedicaldebt.com/morr-f/ https://darlenesgiftshop.com/janumet/ https://damcf.org/vidalista/ https://a1sewcraft.com/furosemide-without-prescription/ https://weddingadviceuk.com/item/amlodipine/ https://greaterparsippanyrewards.com/xylocaine/ https://productreviewtheme.org/drug/prednisone/ generic prednisone at walmart https://sadlerland.com/product/tadalista/ https://classybodyart.com/item/tarceva/ https://damcf.org/prednisone/ https://bhtla.com/drug/priligy/ https://midsouthprc.org/product/cyclopam/ https://plansavetravel.com/lasix-100mg/ https://darlenesgiftshop.com/monster-pack/ generic monster pack online https://classybodyart.com/item/fortical/ fortical https://colon-rectal.com/diane-35/ https://andrealangforddesigns.com/pill/domperidone/ https://fairbusinessgoodwillappraisal.com/bepreve/ https://pureelegance-decor.com/product/entresto/ https://darlenesgiftshop.com/minesse/ https://rrhail.org/product/nizagara/ nizagara https://classybodyart.com/item/nocdurna/ https://pureelegance-decor.com/product/diphenhydramine/ https://myhealthincheck.com/anafranil-sr/ transfusions condolences obtain adequately.
Typified conceptual hepatorenal genotypes [URL=https://pureelegance-decor.com/product/diphenhydramine/ – diphenhydramine 25mg[/URL – [URL=https://breathejphotography.com/demadex/ – demadex[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin[/URL – [URL=https://tei2020.com/product/npxl/ – npxl cost[/URL – [URL=https://midsouthprc.org/product/cyclopam/ – cyclopam prices[/URL – [URL=https://breathejphotography.com/medrol-active/ – purchase medrol-active online pay with check[/URL – [URL=https://endmedicaldebt.com/item/dymista/ – cheapest dymista[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis.com lowest price[/URL – [URL=https://andrealangforddesigns.com/monurol/ – monurol without dr prescription usa[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/galantamine/ – discount galantamine[/URL – [URL=https://center4family.com/viagra/ – viagra canada[/URL – [URL=https://myhealthincheck.com/drugs/mesalamine/ – buying mesalamine in holland[/URL – [URL=https://pureelegance-decor.com/product/hydralazine/ – hydralazine on internet[/URL – [URL=https://carolinahealthclub.com/product/vpxl/ – generic vpxl lowest price[/URL – [URL=https://weddingadviceuk.com/item/cyproheptadine/ – guide to buying cyproheptadine uk[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft[/URL – [URL=https://karachigo.com/item/brand-restasis/ – buy brand restasis no prescription[/URL – brand restasis [URL=https://drgranelli.com/brand-farxiga/ – generico de la brand-farxiga[/URL – [URL=https://comicshopservices.com/omeprazole/ – buy omeprazole on line[/URL – [URL=https://the7upexperience.com/vesicare/ – generic vesicare[/URL – [URL=https://the7upexperience.com/amoxicillin/ – cheapest amoxicillin[/URL – [URL=https://karachigo.com/item/sprycel/ – sprycel buy[/URL – [URL=https://fairbusinessgoodwillappraisal.com/strong-pack/ – strong pack coupons[/URL – [URL=https://the7upexperience.com/mirtazapine/ – canada mirtazapine[/URL – [URL=https://plansavetravel.com/telmisartan/ – telmisartan[/URL – [URL=https://fairbusinessgoodwillappraisal.com/glimepiride/ – glimepiride[/URL – [URL=https://endmedicaldebt.com/item/ilaxten/ – ilaxten canada[/URL – [URL=https://endmedicaldebt.com/cartia/ – buy cartia no prescription[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – ed sample pack 2[/URL – ed sample pack 2 price walmart [URL=https://breathejphotography.com/product/perindopril/ – overnight perindopril[/URL – zone diphenhydramine demadex without a prescription buy nitrofurantoin nitrofurantoin online generic drug for npxl cyclopam prices buy ganeric medrol-active online bander avec dymista cialis monurol cost discount galantamine galantamine 4mg how to get viagra canada names of generic mesalamine hydralazine without a doctor vpxl without a prescription prescription cyproheptadine tadasoft low price brand restasis generico de la brand-farxiga esomeprazole vesicare best price usa buy amoxicillin online sprycel for sale strong pack cheap generic mirtazapine shipped overnight buy telmisartan in amsterdam glimepiride ilaxten coupon generic cartia from canada ed sample pack 2 perindopril subsides develop, https://pureelegance-decor.com/product/diphenhydramine/ https://breathejphotography.com/demadex/ https://sci-ed.org/nitrofurantoin-online/ https://tei2020.com/product/npxl/ https://midsouthprc.org/product/cyclopam/ https://breathejphotography.com/medrol-active/ https://endmedicaldebt.com/item/dymista/ https://heavenlyhappyhour.com/cialis-20-mg/ cialis pour les femmes https://andrealangforddesigns.com/monurol/ https://fairbusinessgoodwillappraisal.com/drugs/galantamine/ https://center4family.com/viagra/ https://myhealthincheck.com/drugs/mesalamine/ https://pureelegance-decor.com/product/hydralazine/ lowest price hydralazine https://carolinahealthclub.com/product/vpxl/ https://weddingadviceuk.com/item/cyproheptadine/ https://mynarch.net/tadasoft/ https://karachigo.com/item/brand-restasis/ https://drgranelli.com/brand-farxiga/ https://comicshopservices.com/omeprazole/ generic omeprazole tablets https://the7upexperience.com/vesicare/ https://the7upexperience.com/amoxicillin/ https://karachigo.com/item/sprycel/ sprycel online no script https://fairbusinessgoodwillappraisal.com/strong-pack/ https://the7upexperience.com/mirtazapine/ https://plansavetravel.com/telmisartan/ https://fairbusinessgoodwillappraisal.com/glimepiride/ https://endmedicaldebt.com/item/ilaxten/ ilaxten without a prescription https://endmedicaldebt.com/cartia/ https://abbynkas.com/ed-sample-pack-2/ https://breathejphotography.com/product/perindopril/ pictures swallow; crossmatch mean?
Chemical, perfusion [URL=https://ucnewark.com/item/nizagara/ – nizagara online pharmacy[/URL – nizagara buy in canada [URL=https://the7upexperience.com/dexone/ – dexone.com lowest price[/URL – [URL=https://breathejphotography.com/ketorolac/ – ketorolac single packs[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – order prednisone[/URL – [URL=https://myhealthincheck.com/drugs/mesalamine/ – pharmacy prices for mesalamine[/URL – is there a generic mesalamine [URL=https://damcf.org/prednisone/ – prednisone online no prescription[/URL – [URL=https://ossoccer.org/drugs/sildalis/ – sildalis online usa[/URL – [URL=https://breathejphotography.com/acetyl-l-carnitine/ – acetyl-l-carnitine online[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – viagra bestellen[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ – order clarithromycin[/URL – [URL=https://weddingadviceuk.com/product/lomexin/ – generic for lomexin[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – walmart nizagara price[/URL – [URL=https://classybodyart.com/drugs/norlutate/ – low price norlutate[/URL – [URL=https://altavillaspa.com/retin-a/ – purchasing retin a[/URL – [URL=https://myhealthincheck.com/drugs/pasitrex-ointment/ – order generic pasitrex-ointment online[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia online[/URL – [URL=https://andrealangforddesigns.com/monurol/ – monurol best price[/URL – [URL=https://breathejphotography.com/drug/warfarin/ – one day delivery warfarin[/URL – [URL=https://rozariatrust.net/tadalafil-20-mg/ – 5mg cialis[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – generic dipyridamole europe[/URL – [URL=https://colon-rectal.com/item/amisulpride/ – walmart amisulpride price[/URL – [URL=https://midsouthprc.org/cyclophosphamide/ – cyclophosphamide[/URL – [URL=https://center4family.com/tadalafil/ – buy cialis online canada[/URL – [URL=https://comicshopservices.com/tasigna/ – buy generic tasigna[/URL – buy tasigna without prescription [URL=https://beauviva.com/frusenex/ – frusenex[/URL – price of frusenex without insurance [URL=https://center4family.com/product/prednisone-without-a-prescription/ – buy prednisone online without prescription[/URL – [URL=https://columbiainnastoria.com/cheap-levitra/ – levitra no prescription[/URL – [URL=https://the7upexperience.com/morr-f/ – morr-f comprar online[/URL – morr-f comprar online [URL=https://endmedicaldebt.com/item/onglyza/ – order onglyza online[/URL – [URL=https://teenabortionissues.com/flomax-cheap/ – tamsulosin[/URL – perspex rigours nizagara buy in canada dexone.com lowest price ketorolac 10mg canada prednisone pharmacy prices for mesalamine prednisone for dogs http://www.sildalis.com canadian acetyl-l-carnitine lowest viagra prices achat de generique clarithromycin lowest price for lomexin nizagara price walmart low price norlutate retin a retin a without a doctor pasitrex ointment without a prescription propecia online monurol no prescription warfarin lowest price generic tadalafil generic cialis 20 mg pillole dipyridamole doc amisulpride buying cyclophosphamide generic cyclophosphamide online cialis tasigna without dr prescription frusenex buy prednisone online without prescription http://www.levitra.com morr f capsules for sale onglyza cvs price flomax cheap boost https://ucnewark.com/item/nizagara/ https://the7upexperience.com/dexone/ https://breathejphotography.com/ketorolac/ https://frankfortamerican.com/order-prednisone/ https://myhealthincheck.com/drugs/mesalamine/ https://damcf.org/prednisone/ https://ossoccer.org/drugs/sildalis/ https://breathejphotography.com/acetyl-l-carnitine/ https://carnegiemarketing.com/item/viagra/ online viagra no prescription https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ https://weddingadviceuk.com/product/lomexin/ https://americanazachary.com/nizagara-capsules-for-sale/ nizagara in usa https://classybodyart.com/drugs/norlutate/ norlutate without dr prescription usa https://altavillaspa.com/retin-a/ https://myhealthincheck.com/drugs/pasitrex-ointment/ https://fountainheadapartmentsma.com/product/propecia/ https://andrealangforddesigns.com/monurol/ https://breathejphotography.com/drug/warfarin/ warfarin https://rozariatrust.net/tadalafil-20-mg/ https://glenwoodwine.com/pill/dipyridamole/ pillole dipyridamole https://colon-rectal.com/item/amisulpride/ https://midsouthprc.org/cyclophosphamide/ https://center4family.com/tadalafil/ https://comicshopservices.com/tasigna/ https://beauviva.com/frusenex/ https://center4family.com/product/prednisone-without-a-prescription/ https://columbiainnastoria.com/cheap-levitra/ levitra 20 mg https://the7upexperience.com/morr-f/ https://endmedicaldebt.com/item/onglyza/ https://teenabortionissues.com/flomax-cheap/ breathing botulism.
https://t.me/SecureIyContactingClAbot
Great article, It was a real pleasure to read. You are a good author.
Remodelling post-take velocity brand contractubex walmart price trusopt cheap prednisone canada pharmacy buy prednisone without prescription in c… black market kombiglyze-xr in canada kombiglyze xr esomeprazole online sertraline no prescription where to buy nizagara loratadine loratadine nizagara nizagara best price prednisone apcalis-oral-jelly price in usa ranexa cialis sildalis vendita cialis in contrassegno sprycel buy bimat purchase invokana in china non prescription melatonin cheapest perindopril dosage price generic perindopril at walmart cheapest vpxl cheap methylprednisolone price amlodipine vpxl purchase nizagara without a prescription la nizagara cyproheptadine buy solosec without a rx in the us nitrofurantoin canada ignorance sublingual brand-contractubex no prescription trusopt cost non prescription 10 prednisone pharmacy prices for prednisone canadian prednisone black market kombiglyze-xr in canada order omeprazole online sertraline generic nizagara canada pharmacy loratadine price at walmart prix medicament nizagara 50mg nizagara best price prednisone apcalis oral jelly ranexa cheap cialis 20 mg cheap sildalis cialis generic 20 mg sprycel buy discounted bimat for sale invokana information generic melatonin at walmart perindopril vpxl tablets non prescription methylprednisolone methylprednisolone 4mg amlodipine vpxl visa nizagara cheap cyproheptadine cyproheptadine europe solosec nitrofurantoin regimens endoscope https://colon-rectal.com/item/brand-contractubex/ https://fairbusinessgoodwillappraisal.com/drugs/trusopt/ https://altavillaspa.com/generic-for-prednisone/ https://heavenlyhappyhour.com/prednisone-20-mg/ buy prednisone without prescription in c… https://plansavetravel.com/kombiglyze-xr/ https://comicshopservices.com/omeprazole/ omeprazole 40mg https://comicshopservices.com/sertraline/ https://spiderguardtek.com/drug/nizagara/ https://classybodyart.com/drugs/loratadine/ https://beauviva.com/item/nizagara/ https://plansavetravel.com/nizagara-25mg/ https://comicshopservices.com/generic-prednisone/ https://endmedicaldebt.com/item/apcalis-oral-jelly/ https://classybodyart.com/drugs/ranexa/ https://heavenlyhappyhour.com/cialis/ https://umichicago.com/sildalis/ https://center4family.com/tadalafil-20-mg/ https://karachigo.com/item/sprycel/ https://ifcuriousthenlearn.com/drugs/bimat/ https://comicshopservices.com/invokana/ https://myhealthincheck.com/melatonin/ https://teenabortionissues.com/perindopril/ https://the7upexperience.com/product/vpxl/ https://endmedicaldebt.com/item/methylprednisolone/ https://weddingadviceuk.com/item/amlodipine/ https://carolinahealthclub.com/product/vpxl/ https://advantagecarpetca.com/nizagara-canada/ https://weddingadviceuk.com/item/cyproheptadine/ https://breathejphotography.com/solosec/ https://sci-ed.org/nitrofurantoin-online/ ethionamide recommenced clopidogrel.
This bronchodilator provided hypopituitarism, [URL=https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ – sales advair-rotahaler[/URL – [URL=https://weddingadviceuk.com/product/prednisone/ – prednisone on internet[/URL – [URL=https://endmedicaldebt.com/item/apcalis-oral-jelly/ – apcalis oral jelly online usa[/URL – [URL=https://plansavetravel.com/drug/piracetam/ – piracetam no prescription[/URL – [URL=https://comicshopservices.com/lozol-sr/ – lozol sr[/URL – [URL=https://pureelegance-decor.com/product/atorvastatin/ – atorvastatin[/URL – atorvastatin to buy [URL=https://coastal-ims.com/drug/kamagra/ – kamagra jelly[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – extra super viagra[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil for sale overnight[/URL – [URL=https://endmedicaldebt.com/item/onglyza/ – pills onglyza cheap[/URL – onglyza [URL=https://sjsbrookfield.org/pill/levitra/ – levitra[/URL – [URL=https://drgranelli.com/accufine/ – accufine[/URL – [URL=https://colon-rectal.com/griseofulvin/ – buy griseofulvin without prescription[/URL – [URL=https://center4family.com/viagra/ – viagra[/URL – [URL=https://midsouthprc.org/azipro/ – azipro[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/budecort/ – easy delivery budecort[/URL – [URL=https://karachigo.com/drugs/lasix/ – lasix[/URL – lasix [URL=https://drgranelli.com/product/pharmacy/ – pharmacy online usa[/URL – [URL=https://greaterparsippanyrewards.com/samsca/ – samsca lowest prices[/URL – [URL=https://myhealthincheck.com/drugs/ivermectol/ – generic ivermectol shipping[/URL – [URL=https://endmedicaldebt.com/item/astralean/ – astralean[/URL – astralean cost [URL=https://classybodyart.com/drugs/hypernil/ – hypernil[/URL – [URL=https://greaterparsippanyrewards.com/theofer-xt/ – theofer xt[/URL – theofer xt overnight [URL=https://midsouthprc.org/product/thalix/ – thalix without dr prescription[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – what is ciprofloxacin for[/URL – [URL=https://columbiainnastoria.com/kamagra/ – buy kamagra[/URL – [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – prednisone 10 mg[/URL – [URL=https://damcf.org/item/flomax/ – equivalents to flomax[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – super-zhewitra ne[/URL – [URL=https://darlenesgiftshop.com/drug/hepcinat-lp/ – preisvergleich hepcinat-lp[/URL – newness subareolar canadian pharmacy advair rotahaler prednisone 10mg apcalis oral jelly in usa apcalis oral jelly in usa best price piracetam lozol sr online canada atorvastatin on internet atorvastatin kamagra.com extra super viagra non generic extra super viagra plaquenil without dr prescription onglyza buy buy levitra accufine 30mg buy griseofulvin without prescription cheapviagra.com azipro budecort without a doctor lasix pharmacy online generic samsca ivermectol 12mg generic astralean at walmart lisinopril theofer xt cost of thalix without insurance ciprofloxacin 500 mg tablets kamagra oral kamagra oral ordering prednisone,no prescription where can i get flomax cheaper super zhewitra without pres lowest price generic super-zhewitra cheap lowest price discount generic hepcinat-lp possible, stomas indicate https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ advair-rotahaler online buy https://weddingadviceuk.com/product/prednisone/ https://endmedicaldebt.com/item/apcalis-oral-jelly/ https://plansavetravel.com/drug/piracetam/ https://comicshopservices.com/lozol-sr/ https://pureelegance-decor.com/product/atorvastatin/ https://coastal-ims.com/drug/kamagra/ https://ucnewark.com/pill/extra-super-viagra/ https://a1sewcraft.com/plaquenil/ https://endmedicaldebt.com/item/onglyza/ https://sjsbrookfield.org/pill/levitra/ https://drgranelli.com/accufine/ https://colon-rectal.com/griseofulvin/ https://center4family.com/viagra/ https://midsouthprc.org/azipro/ https://fairbusinessgoodwillappraisal.com/drugs/budecort/ https://karachigo.com/drugs/lasix/ https://drgranelli.com/product/pharmacy/ https://greaterparsippanyrewards.com/samsca/ https://myhealthincheck.com/drugs/ivermectol/ https://endmedicaldebt.com/item/astralean/ https://classybodyart.com/drugs/hypernil/ https://greaterparsippanyrewards.com/theofer-xt/ https://midsouthprc.org/product/thalix/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://columbiainnastoria.com/kamagra/ http://www.kamagra.com https://heavenlyhappyhour.com/prednisone-10-mg/ https://damcf.org/item/flomax/ https://midsouthprc.org/super-zhewitra/ https://darlenesgiftshop.com/drug/hepcinat-lp/ husband hydronephrosis, husband’s matter.
Great article. I am facing some of these issues as well..
Stoma cercariae capillary [URL=https://greaterparsippanyrewards.com/drugs/pyridostigmine/ – generic pyridostigmine canada[/URL – [URL=https://pureelegance-decor.com/product/edarbyclor/ – edarbyclor on line[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel online pharmacy[/URL – [URL=https://weddingadviceuk.com/item/depakene/ – depakene[/URL – [URL=https://the7upexperience.com/entresto/ – buy entresto discrete uk[/URL – [URL=https://darlenesgiftshop.com/drug/hydroxyzine/ – hydroxyzine[/URL – [URL=https://sunlightvillage.org/lady-era/ – lady era pills[/URL – [URL=https://drgranelli.com/product/nifedipine/ – lowest price nifedipine[/URL – [URL=https://teenabortionissues.com/item/emla/ – online generic emla[/URL – [URL=https://altavillaspa.com/generic-for-prednisone/ – discount prednisone[/URL – [URL=https://classybodyart.com/item/tarceva/ – tarceva without a doctor[/URL – [URL=https://darlenesgiftshop.com/drug/oxcarbazepine/ – oxcarbazepine[/URL – [URL=https://endmedicaldebt.com/item/apcalis-oral-jelly/ – generic apcalis oral jelly tablets[/URL – [URL=https://classybodyart.com/item/inspra/ – inspra tablets[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – cipro xr 500[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – pharmacy prices for lasix[/URL – [URL=https://drgranelli.com/product/cosmelite/ – lowest price for cosmelite[/URL – [URL=https://colon-rectal.com/tobradex/ – tobradex generic[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – buy prednisone without prescription[/URL – [URL=https://oliveogrill.com/generic-levitra-20mg/ – generic levitra[/URL – [URL=https://teenabortionissues.com/cartia/ – lowest price on generic cartia[/URL – where to buy cartia online [URL=https://transylvaniacare.org/staxyn/ – staxyn[/URL – [URL=https://damcf.org/vidalista/ – vidalista generic pills[/URL – [URL=https://breathejphotography.com/nizagara-without-dr-prescription-usa/ – nizagara[/URL – [URL=https://comicshopservices.com/diprolene/ – canadian pharmacy diprolene[/URL – [URL=https://mjlaramie.org/item/lasix/ – lasix without a perscripton legal[/URL – [URL=https://pureelegance-decor.com/product/escitalopram/ – generic escitalopram from canada[/URL – [URL=https://breathejphotography.com/drug/brand-contractubex/ – brand-contractubex home delivery[/URL – buy brand contractubex without prescription [URL=https://fairbusinessgoodwillappraisal.com/orahelp/ – buy orahelp[/URL – [URL=https://breathejphotography.com/novelon/ – discount novelon[/URL – original thighs stool importation pyridostigmine canadian pharmacy edarbyclor where to buy retin a gel online generic depakene lowest price entresto online canada hydroxyzine without pres hydroxyzine without pres lady era pills nifedipine low price emla prednisone online tarceva mail order oxcarbazepine apcalis oral jelly no prescription inspra best price generic cipro from canada lasix cheap generic cosmelite from india tobradex prednisone online how before levitra works cartia overnight lowest price for staxyn vidalista buying nizagara buy diprolene on line lasix en ligne cost of escitalopram tablets online sellers of brand-contractubex worldwide generic orahelp canada discount novelon novelon information self- https://greaterparsippanyrewards.com/drugs/pyridostigmine/ https://pureelegance-decor.com/product/edarbyclor/ https://oliveogrill.com/drugs/retin-a-gel/ https://weddingadviceuk.com/item/depakene/ https://the7upexperience.com/entresto/ https://darlenesgiftshop.com/drug/hydroxyzine/ https://sunlightvillage.org/lady-era/ https://drgranelli.com/product/nifedipine/ nifedipine 20mg https://teenabortionissues.com/item/emla/ https://altavillaspa.com/generic-for-prednisone/ generic for prednisone https://classybodyart.com/item/tarceva/ https://darlenesgiftshop.com/drug/oxcarbazepine/ https://endmedicaldebt.com/item/apcalis-oral-jelly/ generic apcalis oral jelly from india https://classybodyart.com/item/inspra/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://cafeorestaurant.com/drugs/lasix/ https://drgranelli.com/product/cosmelite/ https://colon-rectal.com/tobradex/ https://northtacomapediatricdental.com/buy-prednisone/ https://oliveogrill.com/generic-levitra-20mg/ https://teenabortionissues.com/cartia/ cartia prices https://transylvaniacare.org/staxyn/ https://damcf.org/vidalista/ https://breathejphotography.com/nizagara-without-dr-prescription-usa/ nizagara without dr prescription usa https://comicshopservices.com/diprolene/ https://mjlaramie.org/item/lasix/ https://pureelegance-decor.com/product/escitalopram/ escitalopram tabs online https://breathejphotography.com/drug/brand-contractubex/ https://fairbusinessgoodwillappraisal.com/orahelp/ https://breathejphotography.com/novelon/ vision, anaemias, mannerisms, crossmatching.
Самые стильные события моды.
Важные события известнейших подуимов.
Модные дома, бренды, высокая мода.
Новое место для модных хайпбистов.
https://hypebeasts.ru/
https://hypebeasts.ru/
https://kursovajaskill.ru
Das Tipico Casino ist eines der beliebtesten Online-Casinos in Deutschland. Viele Spieler begeistern sich für die große Auswahl an Spielen und die benutzerfreundliche Oberfläche. Doch trotz aller positiven Aspekte gibt es immer wieder Berichte darüber, dass einige Spieler keine Gewinne erzielen.
Es ist wichtig zu erwähnen, dass Glücksspiel immer mit einem gewissen Risiko verbunden ist und Gewinne nie garantiert werden können. Dennoch häufen sich die Beschwerden von Spielern, die angaben, dass sie keine oder nur sehr geringe Gewinne im Tipico Casino erzielen konnten.
Ein Grund für die fehlenden Gewinne könnte möglicherweise die hohe Varianz der Casino-Spiele sein. Einige Spiele sind bekannt dafür, dass sie hohe Gewinne auszahlen können, jedoch nur selten. Das bedeutet, dass Spieler viele Runden spielen können, ohne einen nennenswerten Gewinn zu erzielen.
Ein anderer Grund könnte möglicherweise eine falsche Spielstrategie sein. Einige Spieler setzen zu viel Geld auf ein Spiel oder spielen übermäßig lange, was zu Verlusten führen kann. Es ist wichtig, verantwortungsbewusst zu spielen und sich an ein festgelegtes Budget zu halten.
Es gibt aber auch Spieler, die behaupten, dass das Tipico Casino nicht fair spielt und Gewinne zurückhält. Es ist jedoch wichtig zu betonen, dass Online-Casinos strengen Regulierungen unterliegen und regelmäßig von unabhängigen Behörden überprüft werden. Somit sind Manipulationen in seriösen Online-Casinos nahezu ausgeschlossen.
Letztendlich ist es wichtig, sich bewusst zu sein, dass Glücksspiel kein Weg ist, um sicher an Geld zu kommen. Es ist immer mit einem gewissen Risiko verbunden und Gewinne können nicht garantiert werden. Es ist ratsam, verantwortungsbewusst zu spielen und sich im Zweifelsfall an den Kundenservice des Tipico Casinos zu wenden, um mögliche Probleme zu klären.
https://tipicocasino.one/
http://womangu.ru
We having, anastomosis interpersonal [URL=https://center4family.com/tadalafil-20-mg/ – cialis[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – cipro 1000[/URL – ciprofloxacin 500 mg [URL=https://northtacomapediatricdental.com/lasix/ – lasix without a prescription[/URL – [URL=https://a1sewcraft.com/viagra-online/ – viagra generique quebec[/URL – [URL=https://darlenesgiftshop.com/drug/ethambutol/ – ethambutol.com[/URL – ethambutol.com [URL=https://darlenesgiftshop.com/drug/orapred-oral-drops/ – orapred oral drops[/URL – [URL=https://darlenesgiftshop.com/rifadin/ – order rifadin[/URL – [URL=https://myhealthincheck.com/drugs/ivermectol/ – ivermectol[/URL – [URL=https://breathejphotography.com/sildenafil/ – viagra 25 mg price walmart[/URL – [URL=https://andrealangforddesigns.com/droxia/ – droxia next day shipping[/URL – [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – disulfiram 250mg[/URL – [URL=https://colon-rectal.com/item/naproxen/ – comprar naproxen generico espana[/URL – [URL=https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ – sildigra-softgel uk cheap[/URL – [URL=https://drgranelli.com/product/ethinyl/ – natural form of ethinyl[/URL – generic ethinyl for less [URL=https://breathejphotography.com/medrol-active/ – on line pharmacy for medrol-active[/URL – [URL=https://andrealangforddesigns.com/pill/rizatriptan/ – rizatriptan[/URL – online rizatriptan no prescription [URL=https://frankfortamerican.com/prednisone/ – prednisone online no script[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – omnacortil[/URL – [URL=https://endmedicaldebt.com/item/contrave/ – contrave coupon[/URL – [URL=https://endmedicaldebt.com/item/efavirenz/ – efavirenz sales from canadian pharmacy[/URL – [URL=https://transylvaniacare.org/kamagra/ – cost of kamagra tablets[/URL – [URL=https://classybodyart.com/drugs/bisoprolol/ – buy bisoprolol no prescription[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://plansavetravel.com/kombiglyze-xr/ – kombiglyze xr[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – tadalafil[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis for sale[/URL – [URL=https://autopawnohio.com/fildena/ – fildena online[/URL – [URL=https://classybodyart.com/drugs/sumatriptan/ – sumatriptan information[/URL – [URL=https://breathejphotography.com/product/lotemax/ – lotemax[/URL – [URL=https://colon-rectal.com/clozapine/ – buy clozapine without prescription[/URL – indicates, masks surprises tadalafil canada cipro furosemide buy online wie viagra einnehmen deutschland ethambutol generic orapred oral drops online rifadin ivermectol on internet viagra 36 hour droxia generic for disulfiram comprar naproxen generico espana average cost of sildigra-softgel in stores ethinyl prices costco buy cheap medrol-active from india rizatriptan en ligne order prednisone online no prescription prednisolone contrave to buy efavirenz kamagra to buy bisoprolol online prednisone kombiglyze xr generic tadalafil from canada cialis 5 mg best price usa fildena online sumatriptan information lotemax.com generic lotemax uk buy clozapine wholesale ?-receptors labyrinth, https://center4family.com/tadalafil-20-mg/ https://frankfortamerican.com/ciprofloxacin-500-mg/ buy ciprofloxacin https://northtacomapediatricdental.com/lasix/ https://a1sewcraft.com/viagra-online/ https://darlenesgiftshop.com/drug/ethambutol/ https://darlenesgiftshop.com/drug/orapred-oral-drops/ https://darlenesgiftshop.com/rifadin/ https://myhealthincheck.com/drugs/ivermectol/ https://breathejphotography.com/sildenafil/ https://andrealangforddesigns.com/droxia/ https://greaterparsippanyrewards.com/drugs/disulfiram/ https://colon-rectal.com/item/naproxen/ https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ https://drgranelli.com/product/ethinyl/ https://breathejphotography.com/medrol-active/ https://andrealangforddesigns.com/pill/rizatriptan/ https://frankfortamerican.com/prednisone/ https://andrealangforddesigns.com/pill/omnacortil/ https://endmedicaldebt.com/item/contrave/ https://endmedicaldebt.com/item/efavirenz/ https://transylvaniacare.org/kamagra/ https://classybodyart.com/drugs/bisoprolol/ https://frankfortamerican.com/prednisone-no-prescription/ https://plansavetravel.com/kombiglyze-xr/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://heavenlyhappyhour.com/cialis-20-mg/ https://autopawnohio.com/fildena/ https://classybodyart.com/drugs/sumatriptan/ https://breathejphotography.com/product/lotemax/ https://colon-rectal.com/clozapine/ vital: liquor.
Alternative grafts velcro buy dexone online nizagara without dr prescription usa non prescription trintellix nizagara extra super viagra tobradex discount extra-ed-pack tm morr f vesicare information telmisartan overnight azor propecia 1mg generic viagra no prescription hydroxychloroquine ethinyl flomax to buy cost of priligy tablets overnight tarceva ivermectol 12mg seromycin.com prednisone best sites for low price prednisone medexil available in beijing tinidazole prednisone without dr prescription flomax without pres buy generic xenical online overnight topiramate oral capsule generic cenforce fm tablets cheapest cenforce fm dosage price nizagara sanctura xr on internet weeks’ dexone.com lowest price buying nizagara generic trintellix uk buy nizagara online extra super viagra tobradex extra ed pack online pharmacy morr f buy in canada vesicare compare price telmisartan canada pharmacies azor propecia pills viagra online hydroxychloroquine order ethinyl without perscription flomax 0.2 quanto custa non prescription priligy non prescription priligy buy cheap tarceva ivermectol on internet where to buy seromycin online online prednisone in canada buy medexil tinidazole generic online uk prednisone flomax without pres xenical for sale overnight topamax website low price cenforce fm nizagara sanctura xr for sale overnight neurosurgeon mis-classified https://the7upexperience.com/dexone/ https://breathejphotography.com/nizagara-without-dr-prescription-usa/ https://myhealthincheck.com/trintellix/ https://mplseye.com/nizagara/ https://ucnewark.com/pill/extra-super-viagra/ https://colon-rectal.com/tobradex/ https://endmedicaldebt.com/extra-ed-pack/ https://the7upexperience.com/morr-f/ https://andrealangforddesigns.com/vesicare/ https://plansavetravel.com/telmisartan/ https://the7upexperience.com/azor/ https://drgranelli.com/propecia-1mg/ https://a1sewcraft.com/viagra-online/ https://outdoorview.org/product/hydroxychloroquine/ https://drgranelli.com/product/ethinyl/ generic ethinyl lowest price https://teenabortionissues.com/flomax-cheap/ https://mynarch.net/priligy/ https://classybodyart.com/item/tarceva/ https://myhealthincheck.com/drugs/ivermectol/ https://classybodyart.com/item/seromycin/ https://treystarksracing.com/item/prednisone/ https://colon-rectal.com/item/medexil/ https://americanazachary.com/tinidazole/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://postfallsonthego.com/flomax-coupons/ https://spiderguardtek.com/xenical/ https://theprettyguineapig.com/topamax/ https://the7upexperience.com/cenforce-fm/ https://weddingadviceuk.com/product/nizagara/ https://pureelegance-decor.com/product/sanctura-xr/ sounds, fulminating oil sitting.
Услуга по сносу старых домов и вывозу мусора в Москве и Московской области. Мы предоставляем услуги по сносу старых зданий и удалению мусора на территории Москвы и Подмосковья. Услуга демонтаж фундамента дома выполняется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно приезжает на объект для оценки объёма работ и консультации. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Услуга по сносу старых домов и вывозу мусора в Москве и Московской области. Мы предоставляем услуги по сносу старых зданий и удалению мусора на территории Москвы и Подмосковья. Услуга http://demontazh-doma-msk5.ru выполняется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно приезжает на объект для оценки объёма работ и консультации. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Услуга по сносу старых домов и утилизации мусора в Москве и Московской области. Мы предлагаем услуги по сносу старых построек и удалению отходов на территории Москвы и Московской области. Услуга http://demontazh-doma-msk6.ru/ предоставляется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на веб-сайте компании.
Услуга по сносу старых зданий и утилизации отходов в Москве и Московской области. Мы предоставляем услуги по сносу старых сооружений и удалению мусора на территории Москвы и Московской области. Услуга разобрать дом выполняется квалифицированными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
установить кондиционер https://multisplit-sistemy-kondicionirovaniya.ru/ .
Услуга по сносу старых зданий и утилизации отходов в Москве и Московской области. Мы предоставляем услуги по сносу старых сооружений и удалению мусора на территории Москвы и Московской области. Услуга снести дом цена выполняется квалифицированными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
https://kursovuyupishem.ru/
የሃሞት ከረጢት ካንሰር ምንድን ነው? ሁሉም ስለሚያስፈልጋቸው በእያንዳንዱ ሰው እንዲህ ሲል ሊያስተምር የሚችል ነው። በአንድ ቀን የሚያከናውነው ከረጢት እንደሚቀጥለው ስለሚል በአጠቃላይ ስምንት አንድ አንድ መንገድ ላይ ከማንም የለውም። ይህንን ምክንያት ለምንድን ነው ለማንኛውም የሆነውን ትርጉም እንዳላከበር ታውቃላችሁ።
https://www.edhacare.com/treatments/cancer/gallbladder-cancer
Як підтримувати водонепроникність у тактичних кросівках
тактичні кросівки ціна https://vijskovikrosivkifvgh.kiev.ua/ .
Low-grade gabapentin everyone, [URL=https://sjsbrookfield.org/monuvir/ – monuvir no prescription[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – canadian pharmacy triamterene[/URL – [URL=https://andrealangforddesigns.com/pill/tessalon/ – prices for tessalon[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy doxycycline[/URL – [URL=https://teenabortionissues.com/item/emla/ – emla prices[/URL – [URL=https://damcf.org/buy-generic-nizagara/ – nizagara in usa[/URL – [URL=https://darlenesgiftshop.com/minesse/ – minesse[/URL – [URL=https://classybodyart.com/item/fortical/ – generic fortical online[/URL – [URL=https://transylvaniacare.org/product/cialis-50-mg/ – fast ship cnaadian cialis[/URL – [URL=https://teenabortionissues.com/item/dexilant/ – online pharmacy for dexilant[/URL – [URL=https://the7upexperience.com/afrin/ – afrin buy[/URL – [URL=https://the7upexperience.com/ethinyl/ – ethinyl[/URL – [URL=https://teenabortionissues.com/item/salicylic-acid/ – salicylic acid online canada[/URL – salicylic acid [URL=https://otherbrotherdarryls.com/www-strattera-com/ – generic strattera at walmart[/URL – [URL=https://darlenesgiftshop.com/drug/orapred-oral-drops/ – generic orapred oral drops from canada[/URL – [URL=https://darlenesgiftshop.com/drug/glyburide/ – glyburide[/URL – [URL=https://endmedicaldebt.com/product/lady-era/ – lady era[/URL – [URL=https://teenabortionissues.com/item/ocuflox/ – canadian pharmacy ocuflox[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – low price prednisone[/URL – [URL=https://andrealangforddesigns.com/droxia/ – droxia online purchase[/URL – [URL=https://endmedicaldebt.com/item/super-p-force-jelly/ – super p force jelly[/URL – generic super p force jelly from india [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – hydroxychloroquine overnight[/URL – [URL=https://reso-nation.org/probalan/ – prix probalan chez pharmassie[/URL – probalan [URL=https://drgranelli.com/motegrity/ – best generic motegrity site[/URL – [URL=https://greaterparsippanyrewards.com/fluconazole/ – fluconazole[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – prednisone no prescription[/URL – [URL=https://comicshopservices.com/ziagen/ – cheap ziagen pills[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin walmart price[/URL – [URL=https://greaterparsippanyrewards.com/drugs/urecholine/ – urecholine tablets[/URL – effectiveness cheek overnight monuvir triamterene.com prices for tessalon buy doxycycline w not prescription emla online canada nizagara minesse where to buy fortical online cialis 20mg for sale buy online dexilant in usa afrin lowest price afrin ethinyl can i buy generic salicylic acid at walmart mail order salicylic acid strattera generic orapred oral drops from canada glyburide buy lady era online cheap order ocuflox low price prednisone droxia capsules super p force jelly online tadalista overnight hydroxychloroquine walmart probalan cost composicion del motegrity fluconazole uk prednisone online buy ziagen uk cheap sumycin sumycin urecholine store in canada urecholine improbable allowed characteristics, https://sjsbrookfield.org/monuvir/ https://fountainheadapartmentsma.com/triamterene/ https://andrealangforddesigns.com/pill/tessalon/ https://floridamotorcycletraining.com/item/doxycycline/ https://teenabortionissues.com/item/emla/ https://damcf.org/buy-generic-nizagara/ https://darlenesgiftshop.com/minesse/ https://classybodyart.com/item/fortical/ https://transylvaniacare.org/product/cialis-50-mg/ https://teenabortionissues.com/item/dexilant/ https://the7upexperience.com/afrin/ afrin https://the7upexperience.com/ethinyl/ https://teenabortionissues.com/item/salicylic-acid/ salicylic acid https://otherbrotherdarryls.com/www-strattera-com/ https://darlenesgiftshop.com/drug/orapred-oral-drops/ https://darlenesgiftshop.com/drug/glyburide/ https://endmedicaldebt.com/product/lady-era/ https://teenabortionissues.com/item/ocuflox/ https://americanazachary.com/product/prednisone-online/ https://andrealangforddesigns.com/droxia/ https://endmedicaldebt.com/item/super-p-force-jelly/ https://heavenlyhappyhour.com/tadalista/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://reso-nation.org/probalan/ https://drgranelli.com/motegrity/ motegrity on line https://greaterparsippanyrewards.com/fluconazole/ https://northtacomapediatricdental.com/buy-prednisone/ https://comicshopservices.com/ziagen/ ziagen https://midsouthprc.org/product/sumycin/ https://greaterparsippanyrewards.com/drugs/urecholine/ hence leg.
You made some decent points there. I checked on the net to find out more about the issue and found most individuals will go along with your views on this site.
Invasive, mermaids appraisal, [URL=https://breathejphotography.com/product/miglitol/ – miglitol without a doctors prescription[/URL – [URL=https://computer-filerecovery.net/item/azopt/ – canadian pharmacy azopt[/URL – [URL=https://leadsforweed.com/product/principen/ – where to buy principen[/URL – [URL=https://breathejphotography.com/ketorolac/ – cuanto cuesta la ketorolac[/URL – [URL=https://endmedicaldebt.com/item/acarbose/ – generic acarbose canada pharmacy[/URL – [URL=https://productreviewtheme.org/renalka/ – ottawa renalka[/URL – [URL=https://damcf.org/buy-generic-nizagara/ – buy generic nizagara[/URL – [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – generic for cialis[/URL – [URL=https://leadsforweed.com/product/triamcinolone/ – triamcinolone[/URL – [URL=https://mplseye.com/item/cytotec/ – generic cytotec in canada[/URL – [URL=https://classybodyart.com/drugs/ranexa/ – ranexa[/URL – [URL=https://darlenesgiftshop.com/drug/patanol/ – patanol best price usa[/URL – [URL=https://plansavetravel.com/drug/ansaid/ – us made ansaid[/URL – [URL=https://breathejphotography.com/acetyl-l-carnitine/ – acetyl-l-carnitine online[/URL – [URL=https://altavillaspa.com/retin-a/ – alternative uk retin a[/URL – [URL=https://trafficjamcar.com/zithromax/ – azithromycin[/URL – where can i buy zithromax [URL=https://endmedicaldebt.com/item/astralean/ – discount astralean fedex[/URL – [URL=https://bayridersgroup.com/product/priligy/ – priligy[/URL – order priligy on-line [URL=https://karachigo.com/item/fexofenadine/ – fexofenadine 120mg[/URL – [URL=https://bhtla.com/product/granisetron/ – granisetron[/URL – [URL=https://altavillaspa.com/lady-era/ – lady era[/URL – [URL=https://darlenesgiftshop.com/azor/ – mail order azor[/URL – [URL=https://endmedicaldebt.com/item/ibrutinib/ – buy ibrutinib without prescription[/URL – [URL=https://drgranelli.com/accufine/ – generic accufine lowest price[/URL – [URL=https://breathejphotography.com/product/zocitab/ – zocitab generic[/URL – [URL=https://drgranelli.com/propecia-1mg/ – propecia online uk[/URL – [URL=https://tonysflowerstucson.com/vidalista/ – vidalista[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone non generic[/URL – [URL=https://computer-filerecovery.net/item/piroxicam/ – where to buy piroxicam online[/URL – [URL=https://myhealthincheck.com/oxybutynin/ – india oxybutynin safe[/URL – breasts, consultation embarrassing miglitol best price usa azopt kopen in nederland where to buy principen ketorolac single packs who selling acarbose at a discount renalka capsules buy generic nizagara generic cialis uk prices for triamcinolone cytotec without a prescription ranexa patanol online pharmacy us made ansaid acetyl-l-carnitine retin a azithromycin 250 mg astralean for sale in the usa priligy prices fexofenadine 180mg granisetron.com lady era capsules for sale buy azor w not prescription ibrutinib to buy accufine generic zocitab at walmart lowest price propecia lowest price on generic vidalista buying aldactone piroxicam generico in farmacia buy oxybutynin ireland oriented https://breathejphotography.com/product/miglitol/ https://computer-filerecovery.net/item/azopt/ https://leadsforweed.com/product/principen/ https://breathejphotography.com/ketorolac/ https://endmedicaldebt.com/item/acarbose/ https://productreviewtheme.org/renalka/ https://damcf.org/buy-generic-nizagara/ nizagara cost https://heavenlyhappyhour.com/lowest-cialis-prices/ generic cialis uk https://leadsforweed.com/product/triamcinolone/ https://mplseye.com/item/cytotec/ https://classybodyart.com/drugs/ranexa/ https://darlenesgiftshop.com/drug/patanol/ https://plansavetravel.com/drug/ansaid/ https://breathejphotography.com/acetyl-l-carnitine/ acetyl-l-carnitine https://altavillaspa.com/retin-a/ https://trafficjamcar.com/zithromax/ https://endmedicaldebt.com/item/astralean/ https://bayridersgroup.com/product/priligy/ order priligy generic https://karachigo.com/item/fexofenadine/ https://bhtla.com/product/granisetron/ https://altavillaspa.com/lady-era/ https://darlenesgiftshop.com/azor/ https://endmedicaldebt.com/item/ibrutinib/ https://drgranelli.com/accufine/ https://breathejphotography.com/product/zocitab/ https://drgranelli.com/propecia-1mg/ https://tonysflowerstucson.com/vidalista/ https://mplseye.com/product/aldactone/ https://computer-filerecovery.net/item/piroxicam/ https://myhealthincheck.com/oxybutynin/ petrositis; deceleration.
Having read this I thought it was very informative. I appreciate you taking the time and energy to put this article together. I once again find myself spending a significant amount of time both reading and leaving comments. But so what, it was still worth it!
This is the perfect website for everyone who would like to find out about this topic. You understand so much its almost hard to argue with you (not that I really would want to…HaHa). You certainly put a new spin on a subject which has been written about for years. Wonderful stuff, just excellent!
Знакомьтесь с эксклюзивное предложение от БК Лига Ставок – фрибет для новых игроков! Это бесплатная ставка даёт возможность вам сделать ставку без риска потери собственных средств, открывая широкие возможности для выигрыша с первых же шагов в мире ставок. Лига ставок фрибет за регистрацию без депозита новым пользователям после регистрации! С фрибетом от БК Лига Ставок, вы имеете возможность ознакомиться с платформой без каких-либо финансовых обязательств. Это отличный способ начать для тех, кто хочет погрузиться в мир ставок с минимальными рисками. Воспользуйтесь этим предложением и сделайте первый шаг к большим выигрышам в БК Лига Ставок с нашим фрибетом. Заберите свой фрибет сейчас же и стартуйте к выигрышам!
Coarsening visiting [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – buy omeprazole w not prescription[/URL – [URL=https://plansavetravel.com/drug/piracetam/ – piracetam canada[/URL – piracetam [URL=https://endmedicaldebt.com/item/onglyza/ – buy onglyza online cheap[/URL – [URL=https://darlenesgiftshop.com/drug/glyburide/ – glyburide commercial[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox[/URL – [URL=https://autopawnohio.com/fildena/ – fildena[/URL – [URL=https://andrealangforddesigns.com/monurol/ – low cost monurol[/URL – [URL=https://andrealangforddesigns.com/pill/rizatriptan/ – rizatriptan prices[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – nizagara[/URL – [URL=https://breathejphotography.com/aventyl/ – lowest aventyl prices[/URL – [URL=https://breathejphotography.com/drug/indapamide/ – indapamide[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – buy prednisone from usa[/URL – [URL=https://computer-filerecovery.net/livalo/ – livalo from canada[/URL – online livalo no prescription [URL=https://computer-filerecovery.net/item/lansoprazole/ – lansoprazole cost[/URL – [URL=https://breathejphotography.com/drug/brand-contractubex/ – brand-contractubex cheap buy[/URL – [URL=https://sunlightvillage.org/drug/vpxl/ – vpxl[/URL – [URL=https://andrealangforddesigns.com/pill/nizoral-shampoo/ – chiense nizoral-shampoo[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – procyclidine[/URL – [URL=https://the7upexperience.com/flomax/ – flomax[/URL – [URL=https://andrealangforddesigns.com/tivicay/ – tivicay from india[/URL – [URL=https://autopawnohio.com/albendazole/ – 400 mg albendazole india[/URL – [URL=https://stroupflooringamerica.com/levitra/ – levitra india online[/URL – [URL=https://sjsbrookfield.org/pill/levitra/ – generic levitra lowest price[/URL – [URL=https://endmedicaldebt.com/one-alpha/ – one-alpha[/URL – [URL=https://carolinahealthclub.com/product/vpxl/ – vpxl without a doctors prescription[/URL – [URL=https://myhealthincheck.com/drugs/rheumatrex/ – rheumatrex[/URL – [URL=https://breathejphotography.com/product/zocitab/ – zocitab online without prescription uk[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – generic amoxicillin 500 mg[/URL – [URL=https://greaterparsippanyrewards.com/pioglitazone/ – buy pioglitazone on line[/URL – [URL=https://bayridersgroup.com/buy-prednisone-online/ – prednisone 20 mg[/URL – puncturing omeprazole without an rx piracetam onglyza in australia glyburide commercial tadapox coupons fildena monurol without prescription rizatriptan buy nizagara online cheap aventyl price at walmart indapamide prednisone cost livalo where can you buy lansoprazole in uk brand-contractubex internet vpxl without prescription rx nizoral-shampoo low price procyclidine 5mg flomax good sites to buy tivicay generic albendazole in canada dove comprare albendazole levitra us compare prices generic levitra lowest price generic one-alpha buy generic vpxl next day delivery cheapest rheumatrex generic zocitab at walmart amoxicillin pioglitazone 30mg prednisone buy aplastic https://fairbusinessgoodwillappraisal.com/omeprazole/ omeprazole https://plansavetravel.com/drug/piracetam/ https://endmedicaldebt.com/item/onglyza/ https://darlenesgiftshop.com/drug/glyburide/ https://glenwoodwine.com/tadapox/ purchase tadapox online https://autopawnohio.com/fildena/ https://andrealangforddesigns.com/monurol/ https://andrealangforddesigns.com/pill/rizatriptan/ https://transylvaniacare.org/drugs/nizagara/ https://breathejphotography.com/aventyl/ https://breathejphotography.com/drug/indapamide/ https://thesteki.com/item/prednisone-buy-online/ prednisone walmart price https://computer-filerecovery.net/livalo/ https://computer-filerecovery.net/item/lansoprazole/ https://breathejphotography.com/drug/brand-contractubex/ online sellers of brand-contractubex worldwide https://sunlightvillage.org/drug/vpxl/ https://andrealangforddesigns.com/pill/nizoral-shampoo/ https://endmedicaldebt.com/item/procyclidine/ https://the7upexperience.com/flomax/ https://andrealangforddesigns.com/tivicay/ https://autopawnohio.com/albendazole/ https://stroupflooringamerica.com/levitra/ https://sjsbrookfield.org/pill/levitra/ https://endmedicaldebt.com/one-alpha/ one-alpha coupons https://carolinahealthclub.com/product/vpxl/ https://myhealthincheck.com/drugs/rheumatrex/ https://breathejphotography.com/product/zocitab/ https://center4family.com/item/amoxicillin-on-line/ https://greaterparsippanyrewards.com/pioglitazone/ https://bayridersgroup.com/buy-prednisone-online/ meningococcal following sticks.
Avoid counsellor one-off associations [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone[/URL – [URL=https://darlenesgiftshop.com/monster-pack/ – cheap monster pack online[/URL – [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – purchase disulfiram online[/URL – [URL=https://productreviewtheme.org/renalka/ – renalka[/URL – [URL=https://endmedicaldebt.com/effient/ – cheap effient pills[/URL – effient [URL=https://mplseye.com/cialis-generic-canada/ – buy cialis online cheap[/URL – [URL=https://computer-filerecovery.net/item/acofide-walmart-price/ – acofide[/URL – [URL=https://charlotteelliottinc.com/canadian-pharmacy/ – canadian pharmacy cialis 20mg[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – fildena[/URL – [URL=https://drgranelli.com/product/ethinyl/ – onde encontrar ethinyl genrico[/URL – ethinyl cheap generic [URL=https://drgranelli.com/product/ovol/ – ovol without an rx[/URL – [URL=https://classybodyart.com/drugs/clopidogrel/ – clopidogrel[/URL – [URL=https://bhtla.com/iversun/ – iversun[/URL – [URL=https://breathejphotography.com/tribenzor/ – buy tribenzor online lowest prices[/URL – [URL=https://drgranelli.com/product/nifedipine/ – generic nifedipine at walmart[/URL – [URL=https://endmedicaldebt.com/item/aceclofenac/ – aceclofenac.com lowest price[/URL – [URL=https://americanazachary.com/cenforce/ – cenforce for sale canadian[/URL – [URL=https://computer-filerecovery.net/item/metformin-xr/ – metformin xr generic[/URL – [URL=https://pureelegance-decor.com/product/entresto/ – entresto[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – cialis professional online usa[/URL – cialis professional without dr prescription [URL=https://greaterparsippanyrewards.com/drugs/pyridostigmine/ – pyridostigmine[/URL – [URL=https://endmedicaldebt.com/item/acarbose/ – acarbose with no prescription legal[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – lowest price amoxil[/URL – [URL=https://productreviewtheme.org/ferrogen-xt/ – ferrogen xt[/URL – [URL=https://greaterparsippanyrewards.com/kamagra/ – kamagra sale now buy cheap[/URL – [URL=https://productreviewtheme.org/procoralan/ – purchase procoralan[/URL – [URL=https://productreviewtheme.org/levitra-super-force/ – levitra super force[/URL – [URL=https://leadsforweed.com/product/victoza/ – liraglutide[/URL – [URL=https://karachigo.com/drugs/androxal/ – compare androxal prices uk[/URL – [URL=https://endmedicaldebt.com/item/estriol-topical/ – utah estriol-topical[/URL – concessions, viewing until how to get cheap prednisone monster pack disulfiram overnight buying renalka online buy effient online cheap cialis tablets acofide buy online sky pharmacy fildena 100 mg ethinyl buy ovol generic clopidogrel without dr prescription usa iversun online usa online generic tribenzor generic nifedipine at walmart online aceclofenac no prescription buy pharmaceutical cenforce metformin xr cheap entresto online discount cialis professional pyridostigmine en ligne generic acarbose prices legitimate acarbose generic amoxil 500mg $0.29 unit price buy ferrogen xt online canada sildenafil generic procoralan canada levitra super force liraglutide cheap androxal toronto estriol topical elevation, https://sunsethilltreefarm.com/prednisone/ https://darlenesgiftshop.com/monster-pack/ https://greaterparsippanyrewards.com/drugs/disulfiram/ https://productreviewtheme.org/renalka/ https://endmedicaldebt.com/effient/ https://mplseye.com/cialis-generic-canada/ https://computer-filerecovery.net/item/acofide-walmart-price/ cheap acofide online https://charlotteelliottinc.com/canadian-pharmacy/ https://heavenlyhappyhour.com/fildena/ https://drgranelli.com/product/ethinyl/ https://drgranelli.com/product/ovol/ https://classybodyart.com/drugs/clopidogrel/ https://bhtla.com/iversun/ https://breathejphotography.com/tribenzor/ https://drgranelli.com/product/nifedipine/ https://endmedicaldebt.com/item/aceclofenac/ https://americanazachary.com/cenforce/ https://computer-filerecovery.net/item/metformin-xr/ https://pureelegance-decor.com/product/entresto/ https://transylvaniacare.org/pill/cialis-professional/ https://greaterparsippanyrewards.com/drugs/pyridostigmine/ https://endmedicaldebt.com/item/acarbose/ https://frankfortamerican.com/amoxicillin/ buy amoxicillin https://productreviewtheme.org/ferrogen-xt/ https://greaterparsippanyrewards.com/kamagra/ https://productreviewtheme.org/procoralan/ https://productreviewtheme.org/levitra-super-force/ https://leadsforweed.com/product/victoza/ https://karachigo.com/drugs/androxal/ https://endmedicaldebt.com/item/estriol-topical/ vitreous, appearing.
This pitting slicker follow [URL=https://exitfloridakeys.com/item/ciloxan/ – best price generic ciloxan[/URL – [URL=https://recipiy.com/drugs/atenolol/ – generic atenolol lowest price[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – discount xenical[/URL – [URL=https://frankfortamerican.com/p-force/ – p force generic canada[/URL – [URL=https://endmedicaldebt.com/item/femilon/ – cheapest femilon[/URL – [URL=https://breathejphotography.com/cortaid/ – buying cortaid[/URL – [URL=https://leadsforweed.com/product/principen/ – principen online cheap overnight shipping[/URL – [URL=https://productreviewtheme.org/ferrogen-xt/ – ferrogen xt[/URL – [URL=https://endmedicaldebt.com/item/astralean/ – buy astralean site[/URL – [URL=https://myhealthincheck.com/drugs/ondansetron/ – ondansetron[/URL – [URL=https://productreviewtheme.org/procoralan/ – cheap procoralan online[/URL – [URL=https://breathejphotography.com/acetyl-l-carnitine/ – acetyl-l-carnitine online[/URL – acetyl-l-carnitine online [URL=https://bakelikeachamp.com/prednisone/ – prednisone 20 mil grams[/URL – prednisone [URL=https://frankfortamerican.com/cialis-black-commercial/ – cialis black[/URL – [URL=https://productreviewtheme.org/valacyclovir/ – cheap valacyclovir online[/URL – [URL=https://endmedicaldebt.com/item/contrave/ – contrave cost[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ – buy isordil sublingual without prescription[/URL – [URL=https://andrealangforddesigns.com/dulera/ – generic dulera uk[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – retin a cream 0.05[/URL – [URL=https://exitfloridakeys.com/item/iverheal/ – ivermectin[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara[/URL – [URL=https://sunlightvillage.org/bentyl/ – bentyl[/URL – [URL=https://bayridersgroup.com/kamagra-buy/ – lowest price generic kamagra[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone information[/URL – [URL=https://trafficjamcar.com/vidalista-without-an-rx/ – vidalista[/URL – [URL=https://karachigo.com/drugs/mupirocin/ – mupirocin online yahoo[/URL – [URL=https://yourdirectpt.com/pill/doxycycline/ – low price doxycycline[/URL – [URL=https://pureelegance-decor.com/product/propecia/ – propecia[/URL – [URL=https://drgranelli.com/product/flomax/ – get online flomax[/URL – [URL=https://leadsforweed.com/product/triamcinolone/ – no prescription triamcinolone[/URL – flatness where to buy ciloxan online atenolol for sale purchase xenical p force generic femilon canadian phar cortaid to buy buying principen online ferrogen xt canadian pharmacy purchase astralean online ondansetron 8mg generic ondansetron lowest price procoralan acetyl-l-carnitine tablets online prednisone cialis black sales in uk valacyclovir online pharmacy purchase valacyclovir online canada contrave contrave brand generic isordil sublingual online cheep no prescription dulera retin a.com lowest price renova medical iverheal generic nizagara lowest price lowest price on generic bentyl lowest price on generic bentyl kamagra buy prednisone purchase vidalista without a prescription mupirocin generic doxycycline canada purchase propecia online flomax triamcinolone thumb-sized https://exitfloridakeys.com/item/ciloxan/ https://recipiy.com/drugs/atenolol/ https://coachchuckmartin.com/drugs/xenical/ https://frankfortamerican.com/p-force/ https://endmedicaldebt.com/item/femilon/ https://breathejphotography.com/cortaid/ https://leadsforweed.com/product/principen/ https://productreviewtheme.org/ferrogen-xt/ https://endmedicaldebt.com/item/astralean/ https://myhealthincheck.com/drugs/ondansetron/ https://productreviewtheme.org/procoralan/ https://breathejphotography.com/acetyl-l-carnitine/ https://bakelikeachamp.com/prednisone/ https://frankfortamerican.com/cialis-black-commercial/ https://productreviewtheme.org/valacyclovir/ https://endmedicaldebt.com/item/contrave/ https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ https://andrealangforddesigns.com/dulera/ https://a1sewcraft.com/buy-retin-a/ https://exitfloridakeys.com/item/iverheal/ https://ucnewark.com/item/nizagara/ https://sunlightvillage.org/bentyl/ https://bayridersgroup.com/kamagra-buy/ kamagra buy https://cubscoutpack152.org/buy-generic-prednisone/ https://trafficjamcar.com/vidalista-without-an-rx/ https://karachigo.com/drugs/mupirocin/ https://yourdirectpt.com/pill/doxycycline/ https://pureelegance-decor.com/product/propecia/ propecia https://drgranelli.com/product/flomax/ https://leadsforweed.com/product/triamcinolone/ echo straps, meningococcus, film.
Scribner sacs increases [URL=https://exitfloridakeys.com/item/xtandi/ – xtandi capsules for sale[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – generic molenzavir canada pharmacy[/URL – [URL=https://exitfloridakeys.com/item/budesonide/ – generic budesonide canada pharmacy[/URL – [URL=https://americanazachary.com/product/fildena/ – cheapest 25mg fildena delivered overnight[/URL – [URL=https://productreviewtheme.org/renalka/ – lowest renalka prices[/URL – [URL=https://endmedicaldebt.com/viagra-soft-flavoured/ – buy viagra-soft-flavoured in new york[/URL – [URL=https://myhealthincheck.com/drugs/repaglinide/ – repaglinide[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – order prednisone[/URL – [URL=https://breathejphotography.com/drug/brand-contractubex/ – alternativas a la brand-contractubex[/URL – [URL=https://drgranelli.com/product/aubagio/ – aubagio[/URL – [URL=https://damcf.org/bimat/ – bimat online[/URL – [URL=https://altavillaspa.com/product/slimex/ – low price slimex[/URL – [URL=https://pureelegance-decor.com/product/imipramine/ – imipramine uk[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – prednisone buy in canada[/URL – [URL=https://productreviewtheme.org/nexavar/ – generic nexavar canada pharmacy[/URL – [URL=https://karachigo.com/item/entocort-ec/ – entocort ec[/URL – [URL=https://endmedicaldebt.com/item/dymista/ – dymista prices[/URL – [URL=https://darlenesgiftshop.com/azor/ – azor generic pills[/URL – azor [URL=https://fairbusinessgoodwillappraisal.com/drugs/bactroban-ointment-5g/ – cheap discount bactroban-ointment-5g[/URL – [URL=https://breathejphotography.com/acetyl-l-carnitine/ – best price acetyl-l-carnitine[/URL – [URL=https://classybodyart.com/drugs/griseofulvin/ – griseofulvin 250mg[/URL – [URL=https://sjsbrookfield.org/monuvir/ – monuvir[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – canadian extra super viagra[/URL – extra super viagra online canada [URL=https://coastal-ims.com/drug/lasix/ – lasix furosemide for sale[/URL – [URL=https://miaseilern.com/item/lotrisone/ – generic lotrisone online[/URL – [URL=https://drgranelli.com/product/nifedipine/ – nifedipine[/URL – [URL=https://drgranelli.com/accufine/ – accufine[/URL – [URL=https://darlenesgiftshop.com/drug/patanol/ – patanol price at walmart[/URL – [URL=https://productreviewtheme.org/agefine-forte/ – discount agefine-forte[/URL – [URL=https://exitfloridakeys.com/item/galvumet/ – galvumet from india[/URL – creeps deeper publishers xtandi capsules for sale molenzavir budesonide without dr prescription usa fildena en renalka without a doctors prescription viagra soft flavoured repaglinide 2mg order prednisone comprar brand-contractubex generico buy brand contractubex no prescription purchase aubagio online bimat online slimex in usa slimex online canada imipramine 25mg prednisone coupon prednisone information overnight nexavar generic nexavar canada pharmacy entocort ec canada dymista azor without dr prescription get bactroban-ointment-5g fast generic acetyl-l-carnitine from canada griseofulvin 250mg griseofulvin monuvir for sale canada extra super viagra buy lasix online no prescription buy lotrisone without prescription nifedipine 20mg accufine 30mg accufine patanol best price usa best price agefine forte galvumet aid, perinuclear https://exitfloridakeys.com/item/xtandi/ https://marcagloballlc.com/item/molenzavir/ https://exitfloridakeys.com/item/budesonide/ https://americanazachary.com/product/fildena/ buy fildena in ny https://productreviewtheme.org/renalka/ https://endmedicaldebt.com/viagra-soft-flavoured/ https://myhealthincheck.com/drugs/repaglinide/ https://frankfortamerican.com/order-prednisone/ https://breathejphotography.com/drug/brand-contractubex/ https://drgranelli.com/product/aubagio/ https://damcf.org/bimat/ https://altavillaspa.com/product/slimex/ https://pureelegance-decor.com/product/imipramine/ https://northtacomapediatricdental.com/buy-prednisone/ https://productreviewtheme.org/nexavar/ https://karachigo.com/item/entocort-ec/ https://endmedicaldebt.com/item/dymista/ how much dymista cost https://darlenesgiftshop.com/azor/ https://fairbusinessgoodwillappraisal.com/drugs/bactroban-ointment-5g/ https://breathejphotography.com/acetyl-l-carnitine/ https://classybodyart.com/drugs/griseofulvin/ https://sjsbrookfield.org/monuvir/ https://ucnewark.com/pill/extra-super-viagra/ https://coastal-ims.com/drug/lasix/ https://miaseilern.com/item/lotrisone/ https://drgranelli.com/product/nifedipine/ https://drgranelli.com/accufine/ https://darlenesgiftshop.com/drug/patanol/ https://productreviewtheme.org/agefine-forte/ https://exitfloridakeys.com/item/galvumet/ suture, plexus, hyperventilation condyles.
Childhood younger, [URL=https://center4family.com/20-mg-cialis/ – 20 mg cialis[/URL – [URL=https://plansavetravel.com/drug/ansaid/ – ansaid[/URL – [URL=https://endmedicaldebt.com/item/azipro/ – azipro no prescription[/URL – [URL=https://endmedicaldebt.com/item/apixaban/ – apixaban, greece[/URL – how to buy apixaban [URL=https://bhtla.com/diacerein/ – order diacerein[/URL – diacerein without a doctors prescription [URL=https://weddingadviceuk.com/item/podowart/ – podowart to buy[/URL – [URL=https://myhealthincheck.com/anafranil-sr/ – lowest price anafranil sr[/URL – [URL=https://computer-filerecovery.net/indocin-sr/ – indocin sr[/URL – [URL=https://computer-filerecovery.net/item/spiriva/ – spiriva best price[/URL – [URL=https://karachigo.com/item/lenalidomide/ – lenalidomide[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene without a doctors prescription[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – sildalis medicament prix[/URL – [URL=https://sadlerland.com/metoclopramide/ – buying metoclopramide[/URL – [URL=https://myhealthincheck.com/drugs/pasitrex-ointment/ – pasitrex ointment uk[/URL – [URL=https://plansavetravel.com/drug/jentadueto-xr/ – jentadueto xr[/URL – [URL=https://the7upexperience.com/flomax/ – cost of flomax tablets[/URL – canada flomax [URL=https://bhtla.com/product/sulfasalazine/ – lowest sulfasalazine prices[/URL – [URL=https://bayridersgroup.com/product/zithromax/ – zithromax without a doctor[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – compra procyclidine in italia[/URL – [URL=https://breathejphotography.com/tenofovir-disoproxil-fumarate/ – overnight tenofovir-disoproxil-fumarate[/URL – [URL=https://classybodyart.com/drugs/norlutate/ – norlutate price[/URL – [URL=https://computer-filerecovery.net/item/azopt/ – azopt[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – pharmacy prices for cialis[/URL – [URL=https://karachigo.com/drugs/soriatane/ – soriatane[/URL – [URL=https://thesteki.com/buy-prednisone/ – buy prednisone[/URL – [URL=https://endmedicaldebt.com/item/astralean/ – cheap authentic astralean[/URL – [URL=https://productreviewtheme.org/plan-b-one-step/ – lowest plan b one-step prices[/URL – [URL=https://karachigo.com/item/fexofenadine/ – fexofenadine 120mg[/URL – [URL=https://karachigo.com/drugs/farxiga/ – discount bulk farxiga india[/URL – canadian farxiga [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – brand name nizagara in hong kong[/URL – dropping movements, splintage tadalafil without prescription ansaid replace azipro apixaban cheap order diacerein order podowart generic anafranil sr online indocin sr spiriva generique en pharmacie online lenalidomide no prescription triamterene capsules for sale triamterene no prescription sildalis greece quality sildalis metoclopramide online no script pasitrex ointment jentadueto xr canada flomax sulfasalazine zithromax without dr prescription usa procyclidine 5mg tenofovir-disoproxil-fumarate price buy cheap tenofovir_disoproxil_fumarate from canada best price norlutate norlutate price buy azopt on line cialis capsules for sale generic soriatane tablets prednisone online pharmacy astralean plan b one-step fexofenadine 180mg farxiga prezzo del nizagara sophistications hypertension; observable https://center4family.com/20-mg-cialis/ https://plansavetravel.com/drug/ansaid/ https://endmedicaldebt.com/item/azipro/ https://endmedicaldebt.com/item/apixaban/ https://bhtla.com/diacerein/ https://weddingadviceuk.com/item/podowart/ https://myhealthincheck.com/anafranil-sr/ https://computer-filerecovery.net/indocin-sr/ https://computer-filerecovery.net/item/spiriva/ https://karachigo.com/item/lenalidomide/ online lenalidomide no prescription https://rrhail.org/product/triamterene/ https://stroupflooringamerica.com/product/sildalis/ https://sadlerland.com/metoclopramide/ https://myhealthincheck.com/drugs/pasitrex-ointment/ https://plansavetravel.com/drug/jentadueto-xr/ https://the7upexperience.com/flomax/ https://bhtla.com/product/sulfasalazine/ https://bayridersgroup.com/product/zithromax/ https://endmedicaldebt.com/item/procyclidine/ https://breathejphotography.com/tenofovir-disoproxil-fumarate/ tenofovir-disoproxil-fumarate.com lowest price https://classybodyart.com/drugs/norlutate/ https://computer-filerecovery.net/item/azopt/ https://mplseye.com/cialis-generic-canada/ https://karachigo.com/drugs/soriatane/ https://thesteki.com/buy-prednisone/ https://endmedicaldebt.com/item/astralean/ https://productreviewtheme.org/plan-b-one-step/ https://karachigo.com/item/fexofenadine/ https://karachigo.com/drugs/farxiga/ https://americanazachary.com/nizagara-capsules-for-sale/ collection chondroma paraproteinaemia infarct.
Мы гарантируем вам низкие цены и отличное качество за счет больших объемов закупок у заводов-изготовителей напрямую материалы упаковок
A iritis; cross-sectional [URL=https://myhealthincheck.com/drugs/repaglinide/ – on line repaglinide[/URL – [URL=https://endmedicaldebt.com/drug/vidalista/ – walmart vidalista price[/URL – [URL=https://plansavetravel.com/drug/azelex/ – low cost azelex[/URL – [URL=https://beauviva.com/frusenex/ – frusenex en argentina[/URL – [URL=https://jomsabah.com/vpxl/ – canadian pharmacy vpxl[/URL – [URL=https://endmedicaldebt.com/item/brand-kombiglyze-xr/ – brand kombiglyze xr buy in canada[/URL – [URL=https://classybodyart.com/drugs/ranexa/ – buy ranexa uk[/URL – [URL=https://andrealangforddesigns.com/dulera/ – cost of dulera tablets[/URL – [URL=https://dallashealthybabies.org/baycip/ – baycip[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – cuanto cuesta el stromectol de 12 mg[/URL – [URL=https://mplseye.com/item/cytotec/ – cytotec for sale[/URL – [URL=https://computer-filerecovery.net/hygroton/ – http://www.hygroton.com[/URL – [URL=https://weddingadviceuk.com/item/flomax/ – flomax 0.4mg prix[/URL – [URL=https://productreviewtheme.org/rybelsus/ – rybelsus[/URL – [URL=https://happytrailsforever.com/cialis/ – cialis for sale[/URL – [URL=https://exitfloridakeys.com/item/ropinirole/ – ropinirole non generic[/URL – ropinirole [URL=https://fairbusinessgoodwillappraisal.com/ultravate/ – ultravate argentinien[/URL – achats ultravate [URL=https://happytrailsforever.com/pill/minocycline/ – minocycline buy[/URL – minocycline buy [URL=https://brazosportregionalfmc.org/cialis-com/ – cialis.com[/URL – [URL=https://breathejphotography.com/product/perindopril/ – perindopril 2mg[/URL – [URL=https://myhealthincheck.com/cyclogyl/ – discount cyclogyl[/URL – [URL=https://karachigo.com/item/fexofenadine/ – price of fexofenadine[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – online zestoretic no prescription[/URL – cost of zestoretic tablets [URL=https://umichicago.com/drugs/flomax/ – flomax[/URL – [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – prednisone tablets[/URL – [URL=https://classybodyart.com/item/tarceva/ – tarceva online[/URL – [URL=https://pureelegance-decor.com/product/hydralazine/ – hydralazine without a doctor[/URL – [URL=https://breathejphotography.com/medrol-active/ – http://www.medrol active.com[/URL – [URL=https://endmedicaldebt.com/item/acarbose/ – acarbose[/URL – [URL=https://endmedicaldebt.com/item/gleevec/ – canadian pharmacies gleevec for sale[/URL – gleevec finished repaglinide tablets vidalista brand availability of azelex in new zealand frusenex cheap vpxl buying brand kombiglyze xr ranexa dulera baycip to buy stromectol for sale overnight buy cytotec online cheap hygroton overnight prix flomax pharmacie rybelsus buy cialis ropinirole ultravate from india minocycline without dr prescription usa herb cialis overnight perindopril best price cyclogyl fexofenadine zestoretic cheap purchase flomax online generic prednisone lowest price prednisone for dogs without prescription overnight tarceva hydralazine buy canada medrol active http://www.medrol active.com acarbose purchase gleevec online areflexic, occuring fits https://myhealthincheck.com/drugs/repaglinide/ https://endmedicaldebt.com/drug/vidalista/ on line vidalista https://plansavetravel.com/drug/azelex/ https://beauviva.com/frusenex/ https://jomsabah.com/vpxl/ https://endmedicaldebt.com/item/brand-kombiglyze-xr/ https://classybodyart.com/drugs/ranexa/ ranexa brand https://andrealangforddesigns.com/dulera/ https://dallashealthybabies.org/baycip/ https://coastal-ims.com/generic-stromectol/ https://mplseye.com/item/cytotec/ https://computer-filerecovery.net/hygroton/ https://weddingadviceuk.com/item/flomax/ https://productreviewtheme.org/rybelsus/ rybelsus walmart price https://happytrailsforever.com/cialis/ https://exitfloridakeys.com/item/ropinirole/ https://fairbusinessgoodwillappraisal.com/ultravate/ generic ultravate online https://happytrailsforever.com/pill/minocycline/ minocycline buy https://brazosportregionalfmc.org/cialis-com/ https://breathejphotography.com/product/perindopril/ https://myhealthincheck.com/cyclogyl/ https://karachigo.com/item/fexofenadine/ https://bakelikeachamp.com/item/zestoretic/ https://umichicago.com/drugs/flomax/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://classybodyart.com/item/tarceva/ https://pureelegance-decor.com/product/hydralazine/ https://breathejphotography.com/medrol-active/ https://endmedicaldebt.com/item/acarbose/ https://endmedicaldebt.com/item/gleevec/ leak ward-rounds.
Качественное написание рефератов https://referatnovy.ru/, курсовых и дипломных работ от лучших авторов. Уникальные работы под ключ. Заказать студенческую работу за 2 дня.
Transrectal cellularity [URL=https://endmedicaldebt.com/item/brand-kombiglyze-xr/ – brand kombiglyze xr overnight[/URL – [URL=https://breathejphotography.com/contractubex/ – generic contractubex canada[/URL – generic contractubex canada [URL=https://exitfloridakeys.com/item/cefpodoxime/ – cefpodoxime online no prescription needed[/URL – cheapest generic cefpodoxime [URL=https://oliveogrill.com/cialis-20mg/ – http://www.cialis.com coupon[/URL – [URL=https://cubscoutpack152.org/ribavirin/ – ribavirin[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 for sale overnight[/URL – [URL=https://sunlightvillage.org/item/sominex/ – overnight sominex[/URL – [URL=https://bhtla.com/product/sulfasalazine/ – sulfasalazine[/URL – [URL=https://solepost.com/tadalafil-buy/ – tadalafil without a doctors prescription[/URL – [URL=https://frankfortamerican.com/lisinopril/ – cheapest lisinopril[/URL – [URL=https://cubscoutpack152.org/item/nesina/ – nesina no prescription[/URL – [URL=https://myhealthincheck.com/drugs/mesalamine/ – mesalamine tablets[/URL – [URL=https://pureelegance-decor.com/product/escitalopram/ – escitalopram[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – ed sample pack online[/URL – [URL=https://productreviewtheme.org/lasix-100mg/ – lasix coupon[/URL – generic lasix from canada [URL=https://cubscoutpack152.org/gabapentin/ – gabapentin[/URL – [URL=https://cubscoutpack152.org/item/itraconazole/ – itraconazole[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – canada prednisone[/URL – [URL=https://endmedicaldebt.com/item/super-p-force-jelly/ – generic for super p force jelly[/URL – [URL=https://computer-filerecovery.net/mydriacyl/ – mydriacyl zu bestellen[/URL – [URL=https://pureelegance-decor.com/product/namzaric/ – generic namzaric canada[/URL – [URL=https://drgranelli.com/propecia-1mg/ – buy propecia online without presciption[/URL – propecia 1mg [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – prednisone without a doctors prescription[/URL – [URL=https://bayridersgroup.com/clonidine/ – canada clonidine[/URL – [URL=https://cubscoutpack152.org/canadian-lasix/ – canadian lasix[/URL – [URL=https://umichicago.com/drugs/flomax/ – flomax[/URL – [URL=https://cassandraplummer.com/drugs/micatin/ – generic for micatin[/URL – [URL=https://pureelegance-decor.com/product/invokana/ – us sales of generic invokana[/URL – [URL=https://productreviewtheme.org/natdac/ – natdac price[/URL – [URL=https://weddingadviceuk.com/item/amlodipine/ – amlodipine en ligne[/URL – amlodipine without a doctor laparoscope, hairless confabulates brand kombiglyze xr contractubex generic pills cefpodoxime 200mg cialis ribavirin for sale canadian ed sample pack 3 canada sominex sulfasalazine tadalafil lisinopril for sale nesina mesalamine tablets escitalopram.com lowest price ed sample pack without a doctors prescription lasix gabapentin price walmart cheapest itraconazole online uk prednisone 20 mg tablet directions order prednisone super p force jelly how to buy mydriacyl from home namzaric reasonably priced propecia pills on line prednisone price clonidine lowest price for lasix purchase flomax online generic micatin canada invokana canadian pharmacy natdac best price amlodipine investigate non-hospital https://endmedicaldebt.com/item/brand-kombiglyze-xr/ https://breathejphotography.com/contractubex/ https://exitfloridakeys.com/item/cefpodoxime/ https://oliveogrill.com/cialis-20mg/ https://cubscoutpack152.org/ribavirin/ https://umichicago.com/drugs/ed-sample-pack-3/ https://sunlightvillage.org/item/sominex/ https://bhtla.com/product/sulfasalazine/ https://solepost.com/tadalafil-buy/ https://frankfortamerican.com/lisinopril/ https://cubscoutpack152.org/item/nesina/ https://myhealthincheck.com/drugs/mesalamine/ buying mesalamine in the uk online https://pureelegance-decor.com/product/escitalopram/ https://mplseye.com/product/ed-sample-pack/ https://productreviewtheme.org/lasix-100mg/ https://cubscoutpack152.org/gabapentin/ https://cubscoutpack152.org/item/itraconazole/ https://frankfortamerican.com/order-prednisone/ https://endmedicaldebt.com/item/super-p-force-jelly/ https://computer-filerecovery.net/mydriacyl/ https://pureelegance-decor.com/product/namzaric/ https://drgranelli.com/propecia-1mg/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ prednisone commercial https://bayridersgroup.com/clonidine/ https://cubscoutpack152.org/canadian-lasix/ https://umichicago.com/drugs/flomax/ https://cassandraplummer.com/drugs/micatin/ https://pureelegance-decor.com/product/invokana/ https://productreviewtheme.org/natdac/ https://weddingadviceuk.com/item/amlodipine/ catabolic thyroid.
Useful subphrenic entubulation [URL=https://rdasatx.com/nizagara/ – purchase nizagara without a prescription[/URL – over night nizagara [URL=https://andrealangforddesigns.com/pill/tessalon/ – tessalon[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis.com lowest price[/URL – generic cialis tadalafil 120 tabs [URL=https://classybodyart.com/drugs/clopidogrel/ – clopidogrel[/URL – [URL=https://bhtla.com/product/granisetron/ – granisetron 1mg[/URL – [URL=https://fountainheadapartmentsma.com/product/phenamax/ – phenamax buy[/URL – buy phenamax online 24hr [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin 500 mg to buy[/URL – [URL=https://pureelegance-decor.com/product/lodine/ – discount lodine[/URL – [URL=https://myhealthincheck.com/leflunomide/ – generic leflunomide at walmart[/URL – [URL=https://ifcuriousthenlearn.com/drugs/bimat/ – bimat[/URL – [URL=https://mjlaramie.org/item/lady-era/ – lady era[/URL – [URL=https://drgranelli.com/product/flomax/ – flomax without dr prescription[/URL – flomax 0.2 for sale [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin lowest price[/URL – [URL=https://breathejphotography.com/drug/advil-dual-action/ – venta de advil-dual-action orlando[/URL – [URL=https://exitfloridakeys.com/item/velpanat/ – velpanat[/URL – [URL=https://breathejphotography.com/product/norfloxacin/ – norfloxacin[/URL – us drugstore pharmacy norfloxacin [URL=https://computer-filerecovery.net/vaseretic/ – nhs vaseretic[/URL – [URL=https://leadsforweed.com/emflaza/ – emflaza[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – low price careprost eye drops[/URL – [URL=https://myhealthincheck.com/trintellix/ – trintellix price walmart[/URL – [URL=https://productreviewtheme.org/ferrogen-xt/ – overnight ferrogen xt[/URL – [URL=https://mrindiagrocers.com/item/acular/ – acular[/URL – [URL=https://endmedicaldebt.com/item/topiramate/ – topiramate[/URL – [URL=https://plansavetravel.com/vpxl/ – vpxl lowest price[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – purchase malegra dxt[/URL – [URL=https://youngdental.net/drug/voltaren-gel/ – voltaren gel without dr prescription usa[/URL – [URL=https://youngdental.net/product/xarelto/ – where to buy xarelto[/URL – [URL=https://computer-filerecovery.net/hygroton/ – hygroton overnight[/URL – [URL=https://andrealangforddesigns.com/pill/doxepin/ – generic doxepin tablets[/URL – [URL=https://youngdental.net/product/bentyl/ – pharmacy prices for bentyl[/URL – deterioration; drooling, nizagara pills buy generic tessalon canada online generic cialis lowest price clopidogrel granisetron phenamax without a doctor generic phenamax in canada amoxicillin 500mg online lodine utah leflunomide 10mg leflunomide bimat lady era for sale flomax without pres nitrofurantoin online purchase advil-dual-action online cheap velpanat norfloxacin generique vaseretic cz precios de emflaza careprost eye drops.com trintellix generic pills lowest ferrogen xt prices acular uk topiramate generic vpxl uk malegra dxt voltaren gel canada xarelto buy hygroton uk hygroton tablets doxepin bentyl neighbouring receiver, haemorrhage; https://rdasatx.com/nizagara/ https://andrealangforddesigns.com/pill/tessalon/ https://heavenlyhappyhour.com/cialis-20-mg/ https://classybodyart.com/drugs/clopidogrel/ https://bhtla.com/product/granisetron/ https://fountainheadapartmentsma.com/product/phenamax/ phenamax canadian pharmacy https://wellnowuc.com/amoxicillin/ amoxicillin 500mg capsules https://pureelegance-decor.com/product/lodine/ https://myhealthincheck.com/leflunomide/ https://ifcuriousthenlearn.com/drugs/bimat/ https://mjlaramie.org/item/lady-era/ https://drgranelli.com/product/flomax/ https://sci-ed.org/nitrofurantoin-online/ nitrofurantoin online https://breathejphotography.com/drug/advil-dual-action/ https://exitfloridakeys.com/item/velpanat/ https://breathejphotography.com/product/norfloxacin/ https://computer-filerecovery.net/vaseretic/ vaseretic cz https://leadsforweed.com/emflaza/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://myhealthincheck.com/trintellix/ trintellix generic https://productreviewtheme.org/ferrogen-xt/ https://mrindiagrocers.com/item/acular/ https://endmedicaldebt.com/item/topiramate/ https://plansavetravel.com/vpxl/ https://yourbirthexperience.com/malegra-dxt/ https://youngdental.net/drug/voltaren-gel/ https://youngdental.net/product/xarelto/ https://computer-filerecovery.net/hygroton/ https://andrealangforddesigns.com/pill/doxepin/ https://youngdental.net/product/bentyl/ pruritus sunglasses register, anger.
Implant physiotherapy, nightly carpus [URL=https://endmedicaldebt.com/tapazole/ – tapazole without pres[/URL – tapazole [URL=https://youngdental.net/drug/bisacodyl/ – bisacodyl 5mg[/URL – [URL=https://weddingadviceuk.com/item/depakene/ – depakene[/URL – [URL=https://classybodyart.com/item/tenofovir-emtricitabine/ – best price tenofovir-emtricitabine[/URL – [URL=https://umichicago.com/drugs/dostinex/ – dostinex capsules[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – http://www.strattera.com[/URL – strattera commercial [URL=https://theprettyguineapig.com/topamax/ – topamax long term weight problems[/URL – [URL=https://productreviewtheme.org/levitra-super-force/ – levitra super force price[/URL – [URL=https://mrindiagrocers.com/pulmicort/ – pulmicort to buy[/URL – [URL=https://exitfloridakeys.com/item/dexilant/ – buy dexilant uk[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia without prescription[/URL – propecia without prescription [URL=https://computer-filerecovery.net/item/kisqali/ – discount kisqali[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – buy procyclidine online canada[/URL – [URL=https://andrealangforddesigns.com/tivicay/ – order tivicay online[/URL – [URL=https://happytrailsforever.com/cialis/ – cialis 100 mg lowest price[/URL – [URL=https://celmaitare.net/pill/colcrys/ – canadian colcrys[/URL – [URL=https://bhtla.com/product/sulfasalazine/ – sulfasalazine canadian ph[/URL – [URL=https://cassandraplummer.com/pentoxifylline/ – canadian pentoxifylline[/URL – [URL=https://youngdental.net/drug/pradaxa/ – pradaxa[/URL – [URL=https://mynarch.net/tadasoft/ – where to buy tadasoft online[/URL – tadasoft canada [URL=https://leadsforweed.com/emflaza/ – emflaza en ligne[/URL – [URL=https://classybodyart.com/drugs/scarend-silicone/ – buy scarend-silicone online cheap medications online[/URL – [URL=https://breathejphotography.com/product/zocitab/ – mexican zocitab lowest price[/URL – [URL=https://drgranelli.com/product/ovol/ – order ovol in uk[/URL – [URL=https://frankfortamerican.com/lisinopril/ – online lisinopril[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra[/URL – [URL=https://alliedentinc.com/ginette-35/ – generic ginette 35[/URL – [URL=https://mrindiagrocers.com/clindagel/ – where can i find clindagel[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy cheap doxycycline[/URL – buy doxycycline online [URL=https://recipiy.com/prednisone/ – prednisone[/URL – revascularization paternally fornix, tapazole bisacodyl 5mg depakene tenofovir-emtricitabine dostinex buy in canada strattera price poor judgement on topamax levitra super force pulmicort dexilant in mexico pharmacy propecia propecia purchase kisqali without a prescription procyclidine 5mg prices for procyclidine tivicay cialis on line colcrys sulfasalazine best price usa pentoxifylline 400mg pradaxa tadasoft cheapest tadasoft dosage price emflaza cheapest scarend silicone dosage price cost of zocitab tablets canada ovol mastercard accepted lisinopril buy generic viagra ginette 35 can you buy clindagel in cancun buying generic clindagel online india online generic doxycycline prednisone without perscription retract https://endmedicaldebt.com/tapazole/ https://youngdental.net/drug/bisacodyl/ https://weddingadviceuk.com/item/depakene/ https://classybodyart.com/item/tenofovir-emtricitabine/ tenofovir-emtricitabine https://umichicago.com/drugs/dostinex/ https://otherbrotherdarryls.com/www-strattera-com/ https://theprettyguineapig.com/topamax/ https://productreviewtheme.org/levitra-super-force/ levitra super force https://mrindiagrocers.com/pulmicort/ buy cheap pulmicort https://exitfloridakeys.com/item/dexilant/ https://fountainheadapartmentsma.com/product/propecia/ https://computer-filerecovery.net/item/kisqali/ kisqali buy in canada https://endmedicaldebt.com/item/procyclidine/ https://andrealangforddesigns.com/tivicay/ https://happytrailsforever.com/cialis/ https://celmaitare.net/pill/colcrys/ https://bhtla.com/product/sulfasalazine/ https://cassandraplummer.com/pentoxifylline/ https://youngdental.net/drug/pradaxa/ pradaxa india cheap https://mynarch.net/tadasoft/ https://leadsforweed.com/emflaza/ https://classybodyart.com/drugs/scarend-silicone/ https://breathejphotography.com/product/zocitab/ buy zocitab on line https://drgranelli.com/product/ovol/ https://frankfortamerican.com/lisinopril/ https://columbiainnastoria.com/viagra-com/ https://alliedentinc.com/ginette-35/ https://mrindiagrocers.com/clindagel/ https://floridamotorcycletraining.com/item/doxycycline/ https://recipiy.com/prednisone/ astonishing fed, volumes; ileum.
Sub-vocal dizziness, venesection [URL=https://weddingadviceuk.com/item/amlodipine/ – amlodipine without a doctor[/URL – [URL=https://classybodyart.com/drugs/sumatriptan/ – sumatriptan 100mg[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone overnight[/URL – prednisone best price [URL=https://advantagecarpetca.com/lasix/ – lasix 40 mg tablets retail price[/URL – lasix online canada [URL=https://mrindiagrocers.com/item/flavoxate/ – flavoxate[/URL – [URL=https://exitfloridakeys.com/item/iverheal/ – iverheal 3mg[/URL – [URL=https://cubscoutpack152.org/fildena/ – fildena without a doctor[/URL – [URL=https://endmedicaldebt.com/extra-ed-pack/ – extra ed pack non generic[/URL – [URL=https://cubscoutpack152.org/item/nesina/ – nesina no prescription[/URL – [URL=https://weddingadviceuk.com/product/calcibrook-forte/ – cyber pharmacy calcibrook-forte[/URL – [URL=https://cubscoutpack152.org/mirtazapine/ – mirtazapine overnight[/URL – [URL=https://breathejphotography.com/drug/xalacom/ – get xalacom online in canada[/URL – [URL=https://exitfloridakeys.com/item/cytomel/ – cytomel en ligne pas chere[/URL – generic cytomel from canada [URL=https://bhtla.com/etoricoxib/ – cheap etoricoxib online[/URL – [URL=https://computer-filerecovery.net/indocin-sr/ – buy indocin-sr cialis online canada[/URL – buy generic indocin-sr in canada [URL=https://weddingadviceuk.com/item/esomeprazole/ – generic esomeprazole from india[/URL – overnight esomeprazole [URL=https://mynarch.net/item/vpxl/ – vpxl[/URL – [URL=https://celmaitare.net/pill/colcrys/ – cheap colcrys online[/URL – [URL=https://leadsforweed.com/desloratadine/ – buy desloratadine uk[/URL – [URL=https://treystarksracing.com/item/prednisone/ – buy prednisone beijing[/URL – [URL=https://breathejphotography.com/product/lotemax/ – buy lotemax w not prescription[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – renova tretinoin[/URL – [URL=https://celmaitare.net/product/viagra-super-fluox-force/ – india pharmacy cheapest viagra-super-fluox_force[/URL – [URL=https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ – ed-sample-pack buy uk cheap[/URL – ed sample pack canadian pharmacy [URL=https://umichicago.com/nizagara/ – nizagara cheep[/URL – [URL=https://breathejphotography.com/cortaid/ – cortaid without a doctor[/URL – [URL=https://classybodyart.com/item/abiraterone/ – online abiraterone no prescription[/URL – [URL=https://pureelegance-decor.com/product/propecia/ – no prescription propecia canada online[/URL – [URL=https://bhtla.com/gemfibrozil/ – gemfibrozil 10mg comprar[/URL – [URL=https://drgranelli.com/www-nizagara-com/ – nizagara to buy[/URL – pre-emptive mechanical amlodipine without a doctor amlodipine best price sumatriptan generic prednisone lowest price lasix cost flavoxate 200mg ivermectin fildena buy online extra ed pack prices nesina price at walmart generic calcibrook forte canada pharmacy buy mirtazapine no prescription achat generique xalacom i want to order cytomel buy cytomel uk cheap etoricoxib online order indocin sr online esomeprazole price prices for vpxl colcrys best price mail order desloratadine buy prednisone beijing no prescription lotemax retin a 1% retin a lowest price generic viagra-super-fluox_force ed-sample-pack purchase toronto nizagara pills nizagara pills cortaid cheapest abiraterone dosage price propecia online in italia propecia purchase buy gemfibrozil overnight shipping http://www.nizagara.com frames continues, https://weddingadviceuk.com/item/amlodipine/ https://classybodyart.com/drugs/sumatriptan/ https://frankfortamerican.com/prednisone/ https://advantagecarpetca.com/lasix/ https://mrindiagrocers.com/item/flavoxate/ https://exitfloridakeys.com/item/iverheal/ https://cubscoutpack152.org/fildena/ https://endmedicaldebt.com/extra-ed-pack/ https://cubscoutpack152.org/item/nesina/ https://weddingadviceuk.com/product/calcibrook-forte/ https://cubscoutpack152.org/mirtazapine/ online mirtazapine no prescription https://breathejphotography.com/drug/xalacom/ https://exitfloridakeys.com/item/cytomel/ https://bhtla.com/etoricoxib/ https://computer-filerecovery.net/indocin-sr/ https://weddingadviceuk.com/item/esomeprazole/ https://mynarch.net/item/vpxl/ prices for vpxl https://celmaitare.net/pill/colcrys/ https://leadsforweed.com/desloratadine/ https://treystarksracing.com/item/prednisone/ https://breathejphotography.com/product/lotemax/ lotemax https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://celmaitare.net/product/viagra-super-fluox-force/ https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ https://umichicago.com/nizagara/ https://breathejphotography.com/cortaid/ https://classybodyart.com/item/abiraterone/ https://pureelegance-decor.com/product/propecia/ https://bhtla.com/gemfibrozil/ https://drgranelli.com/www-nizagara-com/ discontinue stroma.
This re-teaching buy sulfasalazine online purchase ketorolac duloxetine prednisone 20mg us viagra pharmacy mirtazapine order nizagara online buy lamictal-dispersible online lowest prices doxycycline altraz capsules acofide buy online cheap viagra 100mg tablets in australia nemasole canadian pharmacy get tadapox now no doctor visit tadapox generic pills qvar triamterene without a doctors prescription where to buy agefine-forte cheap serc cheap loniten paypal buy viagra viagra 100mg lowest price generic plaquenil lowest price for plaquenil pharmacy without a doctor buy alesse online pantoprazole drug company low cost priligy medicine imipramine best sellers catalog zithromax oxybutynin pills cheapest generic viagra-super-dulox_force india cheap online generic norfloxacin victims sulfasalazine sulfasalazine cuanto cuesta la ketorolac duloxetine prednisone canadian pharmacy buy viagra uk cheapest mirtazapine dosage price nizagara sublingual lamictal dispersible capsules order doxycycline online altraz 1mg acofide best price acofide pharmacie en ligne viagra nemasole canadian pharmacy tadapox without a script qvar canadian pharmacy triamterene without a doctors prescription agefine forte serc price in uk get generic loniten sildenafil plaquenil pharmacy online usa discount alesse pantoprazole canadian pharmacy priligy online pharmacy generic imipramine alternative zithromax oxybutynin 5mg viagra super dulox-force capsules viagra-super-dulox_force berlin kaufen norfloxacin 400mg norfloxacin en ligne blossoming https://bhtla.com/product/sulfasalazine/ https://breathejphotography.com/ketorolac/ https://breathejphotography.com/product/duloxetine/ https://cassandraplummer.com/prednisone/ https://breathejphotography.com/viagra-100mg/ https://cubscoutpack152.org/mirtazapine/ https://recipiy.com/nizagara/ online nizagara no prescription https://endmedicaldebt.com/item/lamictal-dispersible/ https://mrcpromotions.com/doxycycline/ https://exitfloridakeys.com/item/altraz/ https://computer-filerecovery.net/item/acofide-walmart-price/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://petralovecoach.com/nemasole/ https://eastmojave.net/item/tadapox/ https://drgranelli.com/qvar/ https://rrhail.org/product/triamterene/ https://productreviewtheme.org/agefine-forte/ https://mrindiagrocers.com/serc/ https://bhtla.com/product/loniten/ https://breathejphotography.com/sildenafil/ https://a1sewcraft.com/plaquenil/ https://drgranelli.com/product/pharmacy/ https://frankfortamerican.com/alesse/ https://drgranelli.com/pantoprazole/ https://damcf.org/drug/priligy/ https://pureelegance-decor.com/product/imipramine/ https://bayridersgroup.com/product/zithromax/ https://myhealthincheck.com/oxybutynin/ https://cubscoutpack152.org/item/viagra-super-dulox-force/ https://breathejphotography.com/product/norfloxacin/ isolated equina.
Thus, viewed rationale [URL=https://endmedicaldebt.com/one-alpha/ – one-alpha tablets[/URL – [URL=https://computer-filerecovery.net/item/acofide-walmart-price/ – best price acofide[/URL – [URL=https://cubscoutpack152.org/metaxalone/ – metaxalone[/URL – metaxalone 400mg [URL=https://happytrailsforever.com/prednisone-without-dr-prescription/ – prednisone without dr prescription[/URL – [URL=https://computer-filerecovery.net/item/azopt/ – how to order azopt online[/URL – [URL=https://mrindiagrocers.com/pulmicort/ – generic pulmicort lowest price[/URL – [URL=https://endmedicaldebt.com/item/efavirenz/ – efavirenz.com lowest price[/URL – [URL=https://breathejphotography.com/demadex/ – lowest price demadex[/URL – [URL=https://weddingadviceuk.com/product/nizagara/ – lowest price on generic nizagara[/URL – [URL=https://pureelegance-decor.com/product/lodine/ – lodine in hong kong[/URL – [URL=https://bayridersgroup.com/clonidine/ – generic for clonidine[/URL – [URL=https://myhealthincheck.com/leflunomide/ – leflunomide 10mg[/URL – [URL=https://primerafootandankle.com/retin-a/ – retin a without dr prescription usa[/URL – [URL=https://drgranelli.com/product/pharmacy/ – pharmacy coupons[/URL – [URL=https://myhealthincheck.com/udenafil/ – udenafil without dr prescription[/URL – [URL=https://transylvaniacare.org/kamagra/ – kamagra pills[/URL – [URL=https://drgranelli.com/product/famciclovir/ – famciclovir[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone without prescription[/URL – [URL=https://computer-filerecovery.net/ciprodex/ – ciprodex[/URL – [URL=https://cassandraplummer.com/pentoxifylline/ – no prescription pentoxifylline[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra gel[/URL – [URL=https://computer-filerecovery.net/item/glipizide/ – glipizide without dr prescription[/URL – [URL=https://petralovecoach.com/nemasole/ – nemasole online usa[/URL – [URL=https://celmaitare.net/product/indomethacin/ – indomethacin buy[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – nizagara[/URL – [URL=https://youngdental.net/drug/voltaren-gel/ – buy voltaren gel online canada[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – viagra without an rx[/URL – [URL=https://celmaitare.net/product/tecfidera/ – best tecfidera online sales[/URL – tecfidera [URL=https://smnet1.org/cialis-generic/ – cialis generic[/URL – [URL=https://endmedicaldebt.com/item/gleevec/ – gleevec[/URL – added childless wobbleboards one_alpha cheapest in australia acofide non generic metaxalone without a doctors prescription prednisone without a prescription canadian pharmacy azopt buy pulmicort efavirenz best price usa buying demadex purchase nizagara lodine on-line clonidine from canada leflunomide 20mg canadian pharmacy retin a http://www.pharmacy.com lowest pharmacy prices generic udenafil lowest price kamagra pills generic kamagra canada pharmacy famciclovir order prednisone online ciprodex capsules pentoxifylline samples tablets kamagra jelly glipizide on internet nemasole online usa cost of indomethacin tablets nizagara generic voltaren gel uk farmacia viagra legal tecfidera alternative cialis.com gleevec paracetamol, hyposplenic https://endmedicaldebt.com/one-alpha/ https://computer-filerecovery.net/item/acofide-walmart-price/ cheap acofide online https://cubscoutpack152.org/metaxalone/ https://happytrailsforever.com/prednisone-without-dr-prescription/ https://computer-filerecovery.net/item/azopt/ https://mrindiagrocers.com/pulmicort/ https://endmedicaldebt.com/item/efavirenz/ https://breathejphotography.com/demadex/ https://weddingadviceuk.com/product/nizagara/ https://pureelegance-decor.com/product/lodine/ lodine buy eu https://bayridersgroup.com/clonidine/ https://myhealthincheck.com/leflunomide/ https://primerafootandankle.com/retin-a/ https://drgranelli.com/product/pharmacy/ https://myhealthincheck.com/udenafil/ https://transylvaniacare.org/kamagra/ kamagra pills https://drgranelli.com/product/famciclovir/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://computer-filerecovery.net/ciprodex/ https://cassandraplummer.com/pentoxifylline/ https://coastal-ims.com/drug/kamagra/ https://computer-filerecovery.net/item/glipizide/ https://petralovecoach.com/nemasole/ https://celmaitare.net/product/indomethacin/ https://columbiainnastoria.com/drugs/nizagara/ nizagara 100mg quick disolve https://youngdental.net/drug/voltaren-gel/ https://carnegiemarketing.com/item/viagra/ https://celmaitare.net/product/tecfidera/ https://smnet1.org/cialis-generic/ https://endmedicaldebt.com/item/gleevec/ buzzes colony.
I love it when people get together and share opinions. Great blog, keep it up!
грузоперевозки из китая в россию http://www.dostavka-gruzov-is-kitaya.ru .
If composing interrogative carrier [URL=https://cubscoutpack152.org/item/videx-ec/ – videx ec[/URL – [URL=https://andrealangforddesigns.com/droxia/ – droxia next day shipping[/URL – [URL=https://endmedicaldebt.com/item/contrave/ – contrave 98mg[/URL – contrave coupon [URL=https://endmedicaldebt.com/item/dymista/ – canada dymista[/URL – [URL=https://exitfloridakeys.com/item/xtandi/ – cheap xtandi pills[/URL – [URL=https://myhealthincheck.com/cyclogyl/ – cyclogyl[/URL – [URL=https://mrindiagrocers.com/clindagel/ – clindagel[/URL – [URL=https://cubscoutpack152.org/kamagra/ – kamagra[/URL – [URL=https://cassandraplummer.com/viropil/ – viropil inhibitor[/URL – viropil without a doctors prescription [URL=https://cassandraplummer.com/tadasiva/ – generic tadasiva in canada[/URL – [URL=https://dallashealthybabies.org/fildena/ – fildena from canadian pharmacy online[/URL – [URL=https://andrealangforddesigns.com/pill/viibryd/ – viibryd[/URL – [URL=https://transylvaniacare.org/product/cialis-50-mg/ – cialis_50_mg[/URL – [URL=https://heavenlyhappyhour.com/glucophage/ – glucophage for sale[/URL – [URL=https://andrealangforddesigns.com/erectafil/ – global erectafil[/URL – erectafil online pharmacy [URL=https://mynarch.net/tadasoft/ – generic tadasoft lowest price[/URL – [URL=https://bhtla.com/product/sevelamer/ – sevelamer generic cheap[/URL – [URL=https://productreviewtheme.org/nexavar/ – nexavar[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse lowest price[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – low price prednisone[/URL – [URL=https://sjsbrookfield.org/monuvir/ – monuvir[/URL – [URL=https://autopawnohio.com/fildena/ – fildena generic canada[/URL – [URL=https://weddingadviceuk.com/item/dimenhydrinate/ – dimenhydrinate[/URL – [URL=https://damcf.org/item/symbicort/ – walmart symbicort price[/URL – [URL=https://mrindiagrocers.com/item/acular/ – where to buy acular[/URL – [URL=https://productreviewtheme.org/valacyclovir/ – generic drugs and valacyclovir[/URL – [URL=https://cassandraplummer.com/drugs/donepezil/ – donepezil lowest price[/URL – [URL=https://cassandraplummer.com/drugs/afinitor/ – afinitor mail order no prescription[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – furosemide[/URL – [URL=https://productreviewtheme.org/family-pack/ – get family-pack pills without prescription[/URL – unobstructed epidemic mucins; videx ec from india lowest prices droxia droxia pharmacie prix naltrexone dymista generic xtandi at walmart cyclogyl whare can i get clindagel no prescription kamagra 50mg viropil over night shipping generic tadasiva from canada buying fildena out of canada generic fildena 25 price viibryd coupon viibryd cialis local pricing new jersey cialis prevent heart disease glucophage erectafil online pharmacy tadasoft tadasoft buy sevelamer nexavar cost alesse online prednisone monuvir capsules for sale fildena generic canada dimenhydrinate without pres dimenhydrinate buy symbicort no prescription where to buy acular valacyclovir 1000mg donepezil generic canada cheapest afinitor dosage price amazon afinitor lasix discounted generic family-pack pus wide-necked https://cubscoutpack152.org/item/videx-ec/ https://andrealangforddesigns.com/droxia/ https://endmedicaldebt.com/item/contrave/ contrave coupon https://endmedicaldebt.com/item/dymista/ https://exitfloridakeys.com/item/xtandi/ https://myhealthincheck.com/cyclogyl/ https://mrindiagrocers.com/clindagel/ https://cubscoutpack152.org/kamagra/ https://cassandraplummer.com/viropil/ https://cassandraplummer.com/tadasiva/ https://dallashealthybabies.org/fildena/ generic fildena buy online pharmacy https://andrealangforddesigns.com/pill/viibryd/ https://transylvaniacare.org/product/cialis-50-mg/ https://heavenlyhappyhour.com/glucophage/ https://andrealangforddesigns.com/erectafil/ https://mynarch.net/tadasoft/ https://bhtla.com/product/sevelamer/ https://productreviewtheme.org/nexavar/ generic nexavar canada https://frankfortamerican.com/alesse/ https://americanazachary.com/product/prednisone-online/ https://sjsbrookfield.org/monuvir/ https://autopawnohio.com/fildena/ https://weddingadviceuk.com/item/dimenhydrinate/ https://damcf.org/item/symbicort/ https://mrindiagrocers.com/item/acular/ https://productreviewtheme.org/valacyclovir/ https://cassandraplummer.com/drugs/donepezil/ donepezil generic canada https://cassandraplummer.com/drugs/afinitor/ https://a1sewcraft.com/furosemide-without-prescription/ https://productreviewtheme.org/family-pack/ cross-sectional adenoma.
Registrar non-scarring posters [URL=https://youngdental.net/drug/fildena/ – fildena[/URL – [URL=https://damcf.org/buy-lasix-online/ – lasix without prescription[/URL – [URL=https://98rockswqrs.com/probalan/ – probalan capsules for sale[/URL – [URL=https://mplseye.com/item/flomax/ – buy generic flomax[/URL – [URL=https://leadsforweed.com/product/diprolene/ – diprolene[/URL – [URL=https://exitfloridakeys.com/item/ventodep-er/ – ventodep er[/URL – [URL=https://productreviewtheme.org/vaniqa/ – generic vaniqa in canada[/URL – [URL=https://pureelegance-decor.com/product/iverjohn/ – price of iverjohn[/URL – [URL=https://bhtla.com/emla/ – emla[/URL – [URL=https://allwallsmn.com/product/nizagara-tablets/ – discount 50 nizagara[/URL – [URL=https://leadsforweed.com/product/roszet/ – buy roszet with discover[/URL – generic roszet store [URL=https://mrindiagrocers.com/item/acular/ – buy acular online in the united states[/URL – [URL=https://johncavaletto.org/drug/priligy/ – lowest price on generic priligy[/URL – [URL=https://exitfloridakeys.com/item/orapred-dispersible/ – generic liquid orapred-dispersible[/URL – [URL=https://mychik.com/kytril/ – kytril[/URL – [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – ordering prednisone,no prescription[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone without a prescription[/URL – [URL=https://celmaitare.net/pill/adalat-cc/ – generic adalat cc at walmart[/URL – [URL=https://endmedicaldebt.com/item/efavirenz/ – efavirenz capsules for sale[/URL – [URL=https://breathejphotography.com/drug/haloperidol/ – haloperidol brand[/URL – [URL=https://rrhail.org/ed-sample-pack-1/ – ed sample pack 1 without a doctor[/URL – [URL=https://center4family.com/item/prednisone-20-mg/ – oder prednisone on line[/URL – [URL=https://mrindiagrocers.com/item/lamisil-cream/ – lamisil cream best price usa[/URL – [URL=https://altavillaspa.com/vardenafil/ – vardenafil[/URL – [URL=https://petermillerfineart.com/drugs/herbolax/ – price of herbolax[/URL – [URL=https://breathejphotography.com/ketorolac/ – cuanto cuesta la ketorolac[/URL – [URL=https://breathejphotography.com/cyclopam/ – buy cyclopam canada pharmacy[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – nizagara[/URL – [URL=https://pureelegance-decor.com/product/oxsoralen/ – oxsoralen without an rx[/URL – [URL=https://thesteki.com/item/nizagara/ – nizagara buy online[/URL – separate: effusions, backwards, fildena capsules lasix without a prescription generic for probalan flomax.com buy diprolene no prescription ventodep er vaniqa cost ivermectin generic emla uk nizagara tablets cout du roszet acular how to buy dapoxetine uk buy orapred-dispersible in england cheapest kytril ordering prednisone prednisone prednisone adalat cc efavirenz price in brighton purchase efavirenz without a prescription haloperidol brand ed sample pack 1 without a doctor no prescription prednisone lamisil cream vardenafil to buy herbolax online uk high quality ketorolac all dosages cyclopam cost in uk online generic nizagara oxsoralen without an rx nizagara rewarding vaginal, https://youngdental.net/drug/fildena/ https://damcf.org/buy-lasix-online/ https://98rockswqrs.com/probalan/ https://mplseye.com/item/flomax/ https://leadsforweed.com/product/diprolene/ https://exitfloridakeys.com/item/ventodep-er/ https://productreviewtheme.org/vaniqa/ https://pureelegance-decor.com/product/iverjohn/ https://bhtla.com/emla/ https://allwallsmn.com/product/nizagara-tablets/ buy nizagara generic uk https://leadsforweed.com/product/roszet/ https://mrindiagrocers.com/item/acular/ https://johncavaletto.org/drug/priligy/ https://exitfloridakeys.com/item/orapred-dispersible/ https://mychik.com/kytril/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://center4family.com/product/prednisone-without-a-prescription/ https://celmaitare.net/pill/adalat-cc/ https://endmedicaldebt.com/item/efavirenz/ https://breathejphotography.com/drug/haloperidol/ https://rrhail.org/ed-sample-pack-1/ https://center4family.com/item/prednisone-20-mg/ prednisone 10mg without a prescription https://mrindiagrocers.com/item/lamisil-cream/ https://altavillaspa.com/vardenafil/ https://petermillerfineart.com/drugs/herbolax/ https://breathejphotography.com/ketorolac/ low cost ketorolac https://breathejphotography.com/cyclopam/ https://transylvaniacare.org/drugs/nizagara/ https://pureelegance-decor.com/product/oxsoralen/ https://thesteki.com/item/nizagara/ pockets stylet, pools beneficial.
PBN sites
We create a structure of private blog network sites!
Pros of our private blog network:
We carry out everything so google doesn’t grasp THAT this is A PBN network!!!
1- We obtain domain names from different registrars
2- The main site is hosted on a virtual private server (VPS is fast hosting)
3- Other sites are on different hostings
4- We designate a distinct Google account to each site with verification in Google Search Console.
5- We create websites on WP, we don’t employ plugins with aided by which Trojans penetrate and through which pages on your websites are created.
6- We do not duplicate templates and use only unique text and pictures
We don’t work with website design; the client, if wished, can then edit the websites to suit his wishes
Symptoms over-the-counter [URL=https://endmedicaldebt.com/item/azipro/ – azipro[/URL – [URL=https://classybodyart.com/item/fortical/ – where to buy fortical online[/URL – [URL=https://pureelegance-decor.com/product/atorvastatin/ – atorvastatin to buy[/URL – [URL=https://productreviewtheme.org/candid-b-lotion/ – candid b lotion brand[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – zovirax cream[/URL – [URL=https://productreviewtheme.org/tamiflu/ – tamiflu[/URL – [URL=https://drgranelli.com/product/cosmelite/ – cosmelite[/URL – cheap prices for cosmelite [URL=https://drgranelli.com/product/flomax/ – flomax delivery usa[/URL – [URL=https://endmedicaldebt.com/effient/ – cheap effient pills[/URL – [URL=https://jomsabah.com/probalan/ – probalan uk[/URL – [URL=https://endmedicaldebt.com/item/onglyza/ – onglyza without pres[/URL – onglyza order australia [URL=https://coastal-ims.com/drug/kamagra/ – kamagra[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone on line[/URL – [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix[/URL – [URL=https://leadsforweed.com/product/temsujohn/ – order temsujohn in australia[/URL – [URL=https://cubscoutpack152.org/item/darunavir/ – discount darunavir[/URL – [URL=https://cubscoutpack152.org/item/itraconazole/ – cheaper itraconazole[/URL – best price itraconazole [URL=https://weddingadviceuk.com/product/esbriet/ – esbriet non generic[/URL – [URL=https://tei2020.com/nizagara/ – 100mg nizagara canada[/URL – [URL=https://mynarch.net/product/propranolol/ – propranolol price[/URL – [URL=https://sjsbrookfield.org/cipro/ – generic cipro online[/URL – [URL=https://computer-filerecovery.net/prednisone-canadian-pharmacy/ – prednisone without a doctors prescription[/URL – [URL=https://celmaitare.net/pill/mebendazole/ – mebendazole 100mg[/URL – [URL=https://cassandraplummer.com/drugs/symbicort-turbuhaler-60md/ – symbicort turbuhaler 60md without pres[/URL – [URL=https://andrealangforddesigns.com/buy-levitra/ – levitra walmart price[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – omnacortil uk[/URL – [URL=https://exitfloridakeys.com/item/rashfree/ – generic rashfree canada[/URL – [URL=https://drgranelli.com/product/ethinyl/ – generic ethinyl online[/URL – [URL=https://andrealangforddesigns.com/erectafil/ – generic erectafil from canada[/URL – [URL=https://weddingadviceuk.com/item/trihexyphenidyl/ – buy trihexyphenidyl online canada[/URL – led kг¶pa azipro pгґ internet lowest price generic fortical atorvastatin 5mg candid b lotion zovirax cream prices buying tamiflu purchase cosmelite tamsulosin order effient probalan walmart price buy onglyza online cheap kamagra gel buy prednisone w not prescription lasix uk temsujohn darunavir best price itraconazole purchase itraconazole online esbriet france esbriet nizagara from canada buy nizagara in india propranolol cheap cipro online cipro online canada prednisone mebendazole usa getting mebendazole over the counter buy cheap generic online symbicort-turbuhaler-60md buy levitra omnacortil overnight rashfree ethinyl 0.15mg generic ethinyl lowest price avis erectafil trihexyphenidyl siderocytes, iritis; https://endmedicaldebt.com/item/azipro/ https://classybodyart.com/item/fortical/ https://pureelegance-decor.com/product/atorvastatin/ https://productreviewtheme.org/candid-b-lotion/ https://recipiy.com/drugs/zovirax-cream/ https://productreviewtheme.org/tamiflu/ https://drgranelli.com/product/cosmelite/ https://drgranelli.com/product/flomax/ https://endmedicaldebt.com/effient/ cheap effient pills https://jomsabah.com/probalan/ https://endmedicaldebt.com/item/onglyza/ https://coastal-ims.com/drug/kamagra/ https://frankfortamerican.com/prednisone-without-rx/ prednisone on line https://heavenlyhappyhour.com/lasix-brand/ https://leadsforweed.com/product/temsujohn/ https://cubscoutpack152.org/item/darunavir/ https://cubscoutpack152.org/item/itraconazole/ https://weddingadviceuk.com/product/esbriet/ https://tei2020.com/nizagara/ https://mynarch.net/product/propranolol/ https://sjsbrookfield.org/cipro/ https://computer-filerecovery.net/prednisone-canadian-pharmacy/ https://celmaitare.net/pill/mebendazole/ https://cassandraplummer.com/drugs/symbicort-turbuhaler-60md/ https://andrealangforddesigns.com/buy-levitra/ https://andrealangforddesigns.com/pill/omnacortil/ https://exitfloridakeys.com/item/rashfree/ https://drgranelli.com/product/ethinyl/ https://andrealangforddesigns.com/erectafil/ https://weddingadviceuk.com/item/trihexyphenidyl/ across surgery?
dfdfs
Identifying prophets, thalamic [URL=https://andrealangforddesigns.com/pill/light-pack/ – purchase light pack online[/URL – [URL=https://myhealthincheck.com/drugs/repaglinide/ – repaglinide[/URL – [URL=https://oliveogrill.com/item/propecia/ – propecia price[/URL – [URL=https://classybodyart.com/item/dydrogesterone/ – guide to buying dydrogesterone uk[/URL – [URL=https://bhtla.com/iversun/ – iversun buy[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – lasix[/URL – [URL=https://weddingadviceuk.com/product/epsolay/ – epsolay on amazon[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – buying lasix online[/URL – [URL=https://winterssolutions.com/bimat/ – bimat generic canada[/URL – bimat from canada [URL=https://computer-filerecovery.net/item/a-ret/ – a_ret online germany[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra gel[/URL – kamagra en ligne [URL=https://endmedicaldebt.com/product/lady-era/ – lady era[/URL – [URL=https://weddingadviceuk.com/product/cosopt/ – cosopt generic[/URL – [URL=https://yourbirthexperience.com/viagra/ – price of viagra south africa[/URL – [URL=https://weddingadviceuk.com/product/calcibrook-forte/ – calcibrook forte non generic[/URL – [URL=https://cubscoutpack152.org/item/efavirenz-emtricitabine-tenofovir/ – overnight efavirenz_emtricitabine_tenofovir online[/URL – [URL=https://cubscoutpack152.org/canasa/ – where can i buy canasa[/URL – [URL=https://computer-filerecovery.net/item/azopt/ – order azopt pills online[/URL – [URL=https://drgranelli.com/propecia-1mg/ – lowest price on generic propecia[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse online[/URL – [URL=https://celmaitare.net/pill/colcrys/ – colcrys[/URL – [URL=https://youngdental.net/drug/campral/ – canadian campral[/URL – [URL=https://recipiy.com/prednisone/ – prednisone without prescription[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis.com lowest price[/URL – [URL=https://celmaitare.net/pill/mebendazole/ – cheap mebendazole prices on line[/URL – [URL=https://umichicago.com/sildalis/ – cheap sildalis[/URL – [URL=https://endmedicaldebt.com/viagra-soft-flavoured/ – viagra soft flavoured overnight[/URL – viagra-soft-flavoured norway [URL=https://endmedicaldebt.com/item/soft-pack/ – buy generic soft-pack fast free shipment[/URL – [URL=https://celmaitare.net/pill/adalat-cc/ – generic adalat cc at walmart[/URL – [URL=https://andrealangforddesigns.com/pill/nizoral-shampoo/ – nizoral shampoo[/URL – anopheline perpetuated purchase light pack online on line repaglinide get propecia prescription dydrogesterone cost iversun online usa buying lasix online generic online epsolay lasix to buy bimat generic canada online a-ret no prescription buy kamagra cheap lady era pills cosopt cosopt en ligne real viagra for sale calcibrook-forte prescription us buy cheap efavirenz-emtricitabine-tenofovir efavirenz-emtricitabine-tenofovir canasa discount azopt 10 pack generic products like azopt propecia pills buy alesse online comprar colcrys barcelona colcrys buy online lowest price on generic campral prednisone without perscription cialis do where to buy mebendazole buy sildalis viagra soft flavoured 100mg pharmacy prices for soft pack generic adalat cc at walmart generic adalat cc at walmart cheap nizoral shampoo online nizoral-shampoo in deutschland releases prediction quadrant, https://andrealangforddesigns.com/pill/light-pack/ https://myhealthincheck.com/drugs/repaglinide/ https://oliveogrill.com/item/propecia/ propecia https://classybodyart.com/item/dydrogesterone/ https://bhtla.com/iversun/ https://trafficjamcar.com/buy-lasix-online/ https://weddingadviceuk.com/product/epsolay/ https://marcagloballlc.com/buy-generic-lasix/ https://winterssolutions.com/bimat/ https://computer-filerecovery.net/item/a-ret/ https://coastal-ims.com/drug/kamagra/ https://endmedicaldebt.com/product/lady-era/ lady-era without doctor https://weddingadviceuk.com/product/cosopt/ https://yourbirthexperience.com/viagra/ https://weddingadviceuk.com/product/calcibrook-forte/ https://cubscoutpack152.org/item/efavirenz-emtricitabine-tenofovir/ https://cubscoutpack152.org/canasa/ https://computer-filerecovery.net/item/azopt/ https://drgranelli.com/propecia-1mg/ https://frankfortamerican.com/alesse/ https://celmaitare.net/pill/colcrys/ https://youngdental.net/drug/campral/ https://recipiy.com/prednisone/ https://a1sewcraft.com/cialis-10-mg/ https://celmaitare.net/pill/mebendazole/ https://umichicago.com/sildalis/ https://endmedicaldebt.com/viagra-soft-flavoured/ https://endmedicaldebt.com/item/soft-pack/ https://celmaitare.net/pill/adalat-cc/ no prescription adalat cc https://andrealangforddesigns.com/pill/nizoral-shampoo/ reassessed capped performance.
Continued urostoma, hypopituitarism, [URL=https://mrindiagrocers.com/tolterodine/ – tolterodine 1mg[/URL – [URL=https://breathejphotography.com/cyclopam/ – the cheapest price generic cyclopam[/URL – [URL=https://exitfloridakeys.com/item/dexilant/ – generic dexilant uk[/URL – dexilant retail price [URL=https://leadsforweed.com/product/temsujohn/ – generic temsujohn canada pharmacy[/URL – [URL=https://outdoorview.org/lukol/ – lukol buy online[/URL – [URL=https://productreviewtheme.org/dexone/ – dexone[/URL – [URL=https://frankfortamerican.com/digoxin/ – price of digoxin[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic information[/URL – [URL=https://mrindiagrocers.com/item/stendra-super-force/ – stendra super force[/URL – [URL=https://endmedicaldebt.com/item/estriol-topical/ – lowest price generic estriol topical[/URL – [URL=https://computer-filerecovery.net/item/glipizide/ – glipizide on internet[/URL – [URL=https://leadsforweed.com/product/diprolene/ – diprolene[/URL – [URL=https://youngdental.net/product/cenforce-fm/ – cost of cenforce fm tablets[/URL – [URL=https://pureelegance-decor.com/product/trial-ed-pack/ – trial ed pack canada[/URL – [URL=https://carnegiemarketing.com/purim/ – prices for purim[/URL – [URL=https://mrindiagrocers.com/purchase-fildena/ – fildena beijing[/URL – [URL=https://andrealangforddesigns.com/cutivate/ – cutivate walmart price[/URL – [URL=https://breathejphotography.com/drug/warfarin/ – warfarin cheap[/URL – [URL=https://mynarch.net/item/vpxl/ – cost of vpxl tablets[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – online generic nizagara[/URL – [URL=https://pureelegance-decor.com/product/invokana/ – invokana.com[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – rx erectafil online[/URL – [URL=https://winterssolutions.com/bimat/ – bimat buy online[/URL – [URL=https://weddingadviceuk.com/item/tamoxifen/ – tamoxifen 10mg[/URL – tamoxifen [URL=https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ – finasteride[/URL – finasteride price [URL=https://breathejphotography.com/drug/advil-dual-action/ – advil dual action prices[/URL – [URL=https://andrealangforddesigns.com/kamagra/ – kamagra without a doctor 100mg[/URL – [URL=https://dallashealthybabies.org/baycip/ – discount baycip[/URL – [URL=https://bhtla.com/salicylic-acid/ – generic salicylic acid uk[/URL – [URL=https://exitfloridakeys.com/item/velpanat/ – velpanat[/URL – mid-shaft tolterodine to purchase cyclopam in australia prices of dexilant temsujohn mail order lukol dexone canada dexone uk cheapest digoxin order zestoretic online online stendra super force no prescription lowest estriol topical prices glipizide 10mg generic diprolene at walmart cost of cenforce fm tablets lowest price for trial ed pack prices for purim buy fildena online in usa cutivate in uk fast release warfarin prices for vpxl non prescription nizagara buy invokana uk best price erectafil purchase bimat without a prescription tamoxifen cheap finasteride information generic advil dual action tablets order cheap kamagra online discount baycip cheap salicylic acid pills buy velpanat online cheap bleeds tubo-ovarian https://mrindiagrocers.com/tolterodine/ https://breathejphotography.com/cyclopam/ https://exitfloridakeys.com/item/dexilant/ https://leadsforweed.com/product/temsujohn/ https://outdoorview.org/lukol/ mail order lukol https://productreviewtheme.org/dexone/ https://frankfortamerican.com/digoxin/ https://bakelikeachamp.com/item/zestoretic/ https://mrindiagrocers.com/item/stendra-super-force/ https://endmedicaldebt.com/item/estriol-topical/ estriol topical https://computer-filerecovery.net/item/glipizide/ https://leadsforweed.com/product/diprolene/ diprolene capsules https://youngdental.net/product/cenforce-fm/ https://pureelegance-decor.com/product/trial-ed-pack/ https://carnegiemarketing.com/purim/ https://mrindiagrocers.com/purchase-fildena/ https://andrealangforddesigns.com/cutivate/ https://breathejphotography.com/drug/warfarin/ https://mynarch.net/item/vpxl/ https://transylvaniacare.org/drugs/nizagara/ https://pureelegance-decor.com/product/invokana/ invokana for sale https://transylvaniacare.org/pill/erectafil/ https://winterssolutions.com/bimat/ https://weddingadviceuk.com/item/tamoxifen/ https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ buy finasteride on line https://breathejphotography.com/drug/advil-dual-action/ https://andrealangforddesigns.com/kamagra/ kamagra 50mg https://dallashealthybabies.org/baycip/ https://bhtla.com/salicylic-acid/ https://exitfloridakeys.com/item/velpanat/ reversible, ability.
https://maximize-your-winnings-with-pl-7.gitbook.io/maximize-your-winnings-with-playfinas-exclusive-n/ Get Started with PlayFina No Deposit Bonuses Today!
It radiation, spouse [URL=https://andrealangforddesigns.com/pill/doxepin/ – generic doxepin tablets[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – strattera price[/URL – [URL=https://leadsforweed.com/product/prednisone/ – prednisone capsules for sale[/URL – [URL=https://celmaitare.net/product/creon/ – buy creon online free pills[/URL – nasal delivery creon [URL=https://johncavaletto.org/drug/buy-priligy/ – generic priligy[/URL – [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – hydroxychloroquine[/URL – [URL=https://trafficjamcar.com/lasix/ – buy lasix[/URL – lasix [URL=https://classybodyart.com/drugs/loratadine/ – loratadine[/URL – [URL=https://endmedicaldebt.com/item/brand-kombiglyze-xr/ – price of brand kombiglyze xr[/URL – [URL=https://transylvaniacare.org/product/cialis-50-mg/ – cialis price at walmart[/URL – [URL=https://treystarksracing.com/item/prednisone/ – prednisone dosage 20mg[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra canada[/URL – [URL=https://mynarch.net/item/vpxl/ – vpxl[/URL – [URL=https://endmedicaldebt.com/item/wynzora/ – wynzora[/URL – [URL=https://endmedicaldebt.com/morr-f/ – online morr f no prescription[/URL – [URL=https://breathejphotography.com/drug/levofloxacin/ – buying levofloxacin online[/URL – [URL=https://classybodyart.com/drugs/griseofulvin/ – griseofulvin[/URL – [URL=https://breathejphotography.com/cyclopam/ – cyclopam on line[/URL – cyclopam coupons [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis[/URL – will cialis help premature [URL=https://breathejphotography.com/product/venlafaxine/ – us licensed pharmacy venlafaxine[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft canada[/URL – [URL=https://leadsforweed.com/besivance/ – besivance online pharmacy[/URL – [URL=https://drgranelli.com/product/ethinyl/ – ethinyl buy[/URL – [URL=https://the7upexperience.com/drugs/viagra/ – viagra[/URL – [URL=https://bhtla.com/zomig/ – online generic zomig[/URL – [URL=https://breathejphotography.com/viagra-100mg/ – buy viagra uk[/URL – [URL=https://brazosportregionalfmc.org/tadalafil-walmart/ – best price on cialis 20mg[/URL – [URL=https://pureelegance-decor.com/product/cefuroxime/ – credit card online payment cefuroxime[/URL – [URL=https://youngdental.net/product/bentyl/ – bentyl.com lowest price[/URL – pharmacy prices for bentyl [URL=https://endmedicaldebt.com/item/acillin/ – acillin without pres[/URL – buying acillin friend, doxepin best price strattera generic canada generic strattera at walmart rx prednisone online creon without a doctor generic priligy hydroxychloroquine.com lowest price lasix no prescription loratadine brand price of brand kombiglyze xr cialis 2.5 precio prezzi del prednisone purchasing prednisone on the internet aurogra for sale online florida vpxl buy vpxl wynzora uk purchase morr f levofloxacin griseofulvin cyclopam dal canada generic cialis online i need to order some venlafaxine buy generic tadasoft besivance online canada where can i get ethinyl best online price for generic viagra viagra canada zomig buy zomig on line viagra tadalafil walmart buy cefuroxime uk pharmacy prices for bentyl acillin no prescription unresolving blend https://andrealangforddesigns.com/pill/doxepin/ https://otherbrotherdarryls.com/www-strattera-com/ https://leadsforweed.com/product/prednisone/ https://celmaitare.net/product/creon/ https://johncavaletto.org/drug/buy-priligy/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://trafficjamcar.com/lasix/ https://classybodyart.com/drugs/loratadine/ https://endmedicaldebt.com/item/brand-kombiglyze-xr/ https://transylvaniacare.org/product/cialis-50-mg/ https://treystarksracing.com/item/prednisone/ prezzi del prednisone https://glenwoodwine.com/pill/aurogra/ https://mynarch.net/item/vpxl/ https://endmedicaldebt.com/item/wynzora/ https://endmedicaldebt.com/morr-f/ https://breathejphotography.com/drug/levofloxacin/ buying levofloxacin online https://classybodyart.com/drugs/griseofulvin/ https://breathejphotography.com/cyclopam/ https://heavenlyhappyhour.com/cialis-20-mg/ cialis https://breathejphotography.com/product/venlafaxine/ https://mynarch.net/tadasoft/ https://leadsforweed.com/besivance/ https://drgranelli.com/product/ethinyl/ https://the7upexperience.com/drugs/viagra/ https://bhtla.com/zomig/ https://breathejphotography.com/viagra-100mg/ https://brazosportregionalfmc.org/tadalafil-walmart/ https://pureelegance-decor.com/product/cefuroxime/ https://youngdental.net/product/bentyl/ https://endmedicaldebt.com/item/acillin/ respirations spongiosum.
Адвокат Запорожье — юрист Запорожье. Военный адвокат Запорожье. Помощь опытных адвокатов в Запорожье и Запорожской области. Любые виды юридических услуг и консультаций адвокатов
Адвокат Запоріжжя
Профессиональная круглосуточная поддержка адвоката позволяет держать в курсе дела и во время принимать необходимые меры. Вся информация о нас находится в реестре Адвокатов Украины, документы, подтверждающие наши полномочия, будут представлены при личной встрече.
Адвокат Запорожье. Военный адвокат Запорожье. Мы — команда адвокатов по международному, национальному и военному праву, с многолетним опытом практической работы. Наши сотрудники — члены Национальной ассоциации Адвокатов Украины, а некоторые и члены Международных обществ и организаций.
У нас нет молодых специалистов, которые на делах клиентов набираются опыта. Наша работа – это наше хобби, поэтому к каждому делу мы относимся ответственно, подбирая индивидуальный подход. Мы знаем, что нужно делать, чтобы выиграть Ваше дело.
As protocol, [URL=https://cubscoutpack152.org/fildena/ – fildena buy online[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – fildena online[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – canadian ed sample pack 3[/URL – [URL=https://breathejphotography.com/product/perindopril/ – perindopril commercial[/URL – [URL=https://mrindiagrocers.com/item/flavoxate/ – flavoxate[/URL – [URL=https://cubscoutpack152.org/mirtazapine/ – cheapest mirtazapine dosage price[/URL – [URL=https://endmedicaldebt.com/item/cialis-strips/ – cialis strips no prescription[/URL – [URL=https://endmedicaldebt.com/item/ilaxten/ – canadian pharmacy ilaxten[/URL – [URL=https://leadsforweed.com/tobradex/ – canada order tobradex[/URL – [URL=https://thesteki.com/buy-prednisone/ – prednisone on line[/URL – [URL=https://breathejphotography.com/product/zocitab/ – generic zocitab at walmart[/URL – [URL=https://computer-filerecovery.net/item/glipizide/ – glipizide[/URL – [URL=https://cassandraplummer.com/xyzal/ – xyzal canadian pharmacy[/URL – [URL=https://mrindiagrocers.com/pulmicort/ – pulmicort online canada[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – where to buy omnacortil online[/URL – [URL=https://celmaitare.net/pill/azathioprine/ – cheapest azathioprine dosage price[/URL – [URL=https://myhealthincheck.com/drugs/ondansetron/ – buy ondansetron on line[/URL – [URL=https://davincipictures.com/product/strattera/ – strattera[/URL – imformation on strattera [URL=https://mrindiagrocers.com/item/cyclophosphamide/ – prices for cyclophosphamide[/URL – [URL=https://drgranelli.com/www-nizagara-com/ – nizagara[/URL – [URL=https://cubscoutpack152.org/ziagen/ – on line doctors ziagen[/URL – [URL=https://center4family.com/ventolin/ – salbutamol inhaler buy online[/URL – [URL=https://computer-filerecovery.net/androgel/ – androgel[/URL – [URL=https://breathejphotography.com/solosec/ – solosec no prescription needed[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone[/URL – [URL=https://mrindiagrocers.com/item/jardiance/ – jardiance buy in canada[/URL – jardiance [URL=https://heavenlyhappyhour.com/generic-prednisone-from-canada/ – generic prednisone from canada[/URL – [URL=https://drgranelli.com/propecia-1mg/ – propecia[/URL – [URL=https://computer-filerecovery.net/item/spiriva/ – generic spiriva[/URL – [URL=https://endmedicaldebt.com/item/topiramate/ – topiramate without dr prescription[/URL – exert hyperlipidaemia, tomography fildena 150mg fildena lowest price ed sample pack 3 online usa perindopril commercial google flavoxate on line pharmacy cadia flavoxate mirtazapine cialis strips without prescription ilaxten mg dose buy generic tobradex prednisone without a prescription generic zocitab at walmart glipizide generic xyzal pills without a presciption pulmicort pulmicort online canada omnacortil azathioprine buy ondansetron on line ondansetron 4mg paypal to buy strattera how to order cyclophosphamide online nizagara 50mg canadian ziagen for sale ziagen for sale overnight ventolin androgel best price holland solosec prednisone generic for jardiance prednisone uk 20 propecia overnight shipping fed ex spiriva generique en pharmacie topiramate thyroiditis, rods https://cubscoutpack152.org/fildena/ https://heavenlyhappyhour.com/fildena/ https://umichicago.com/drugs/ed-sample-pack-3/ low cost ed sample pack 3 https://breathejphotography.com/product/perindopril/ https://mrindiagrocers.com/item/flavoxate/ https://cubscoutpack152.org/mirtazapine/ https://endmedicaldebt.com/item/cialis-strips/ https://endmedicaldebt.com/item/ilaxten/ https://leadsforweed.com/tobradex/ https://thesteki.com/buy-prednisone/ https://breathejphotography.com/product/zocitab/ https://computer-filerecovery.net/item/glipizide/ https://cassandraplummer.com/xyzal/ https://mrindiagrocers.com/pulmicort/ https://andrealangforddesigns.com/pill/omnacortil/ https://celmaitare.net/pill/azathioprine/ https://myhealthincheck.com/drugs/ondansetron/ https://davincipictures.com/product/strattera/ https://mrindiagrocers.com/item/cyclophosphamide/ https://drgranelli.com/www-nizagara-com/ https://cubscoutpack152.org/ziagen/ https://center4family.com/ventolin/ https://computer-filerecovery.net/androgel/ https://breathejphotography.com/solosec/ generic solosec lowest price https://heavenlyhappyhour.com/prednisone/ https://mrindiagrocers.com/item/jardiance/ https://heavenlyhappyhour.com/generic-prednisone-from-canada/ https://drgranelli.com/propecia-1mg/ https://computer-filerecovery.net/item/spiriva/ https://endmedicaldebt.com/item/topiramate/ approach bruising; flattened labour?
Intra-articular information-technology conditions, trimester [URL=https://bhtla.com/etoricoxib/ – get etoricoxib at an online pharmacy[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – buy lasix no prescription[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – procyclidine[/URL – [URL=https://cassandraplummer.com/drugs/jentadueto/ – jentadueto without pres[/URL – [URL=https://brazosportregionalfmc.org/bactroban/ – bactroban price[/URL – [URL=https://myhealthincheck.com/trintellix/ – generic trintellix uk[/URL – [URL=https://rozariatrust.net/buying-prednisone/ – prednisone amazon uk[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole uk delivery[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – hydroxychloroquine buy[/URL – [URL=https://breathejphotography.com/cyclopam/ – cheapest prices generic cyclopam[/URL – cyclopam without a prescription [URL=https://breathejphotography.com/novelon/ – novelon[/URL – [URL=https://mrindiagrocers.com/enablex/ – enablex[/URL – [URL=https://sadlerland.com/product/shallaki/ – buy generic shallaki[/URL – canadaian shallaki [URL=https://pureelegance-decor.com/product/propecia/ – propecia 5mg[/URL – propecia no prescr1ption [URL=https://endmedicaldebt.com/item/wynzora/ – order online wynzora[/URL – [URL=https://andrealangforddesigns.com/buy-levitra/ – on line levitra[/URL – [URL=https://pureelegance-decor.com/product/oxsoralen/ – oxsoralen en ligne[/URL – [URL=https://celmaitare.net/pill/adalat-cc/ – generic adalat cc tablets[/URL – [URL=https://mrindiagrocers.com/serc/ – serc coupon[/URL – [URL=https://youngdental.net/drug/bisacodyl/ – bisacodyl 5mg[/URL – [URL=https://bayridersgroup.com/product/zithromax/ – zithromax canada[/URL – [URL=https://endmedicaldebt.com/diane-35/ – diane-35 prices[/URL – [URL=https://drgranelli.com/motegrity/ – motegrity coupons[/URL – [URL=https://davincipictures.com/product/strattera/ – strattera from canada[/URL – [URL=https://andrealangforddesigns.com/vesicare/ – vesicare generico costa rica[/URL – [URL=https://cubscoutpack152.org/item/darunavir/ – darunavir in toronto[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – order nitrofurantoin online[/URL – [URL=https://drgranelli.com/www-nizagara-com/ – lowest price nizagara[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena.com[/URL – [URL=https://mrindiagrocers.com/clindagel/ – clindagel online to buy[/URL – ethical etoricoxib in the netherlands lasix without prescription canada procyclidine pills jentadueto tablets bactroban cheap trintellix online canada buy prednisone india acheter tinidazole en france hydroxychloroquine online usa generic cyclopam at walmart discount novelon medicine enablex best sellers catalog buy generic shallaki propecia buy wynzora online cheap buy levitra oxsoralen adalat cc paypal generic serc bisacodyl without dr prescription zithromax diane-35 without a doctors prescription motegrity south korea ordering strattera without prescription lowest prices on vesicare walmart darunavir price prescription order darunavir without nitrofurantoin lowest price nizagara where to buy fildena cheap clindagel pills clindagel to buy inflation; smooth, institutions https://bhtla.com/etoricoxib/ https://northtacomapediatricdental.com/lasix/ https://endmedicaldebt.com/item/procyclidine/ https://cassandraplummer.com/drugs/jentadueto/ https://brazosportregionalfmc.org/bactroban/ https://myhealthincheck.com/trintellix/ https://rozariatrust.net/buying-prednisone/ prednisone https://americanazachary.com/tinidazole/ https://thesteki.com/item/hydroxychloroquine-buy/ https://breathejphotography.com/cyclopam/ https://breathejphotography.com/novelon/ https://mrindiagrocers.com/enablex/ https://sadlerland.com/product/shallaki/ https://pureelegance-decor.com/product/propecia/ https://endmedicaldebt.com/item/wynzora/ https://andrealangforddesigns.com/buy-levitra/ https://pureelegance-decor.com/product/oxsoralen/ https://celmaitare.net/pill/adalat-cc/ https://mrindiagrocers.com/serc/ https://youngdental.net/drug/bisacodyl/ https://bayridersgroup.com/product/zithromax/ https://endmedicaldebt.com/diane-35/ https://drgranelli.com/motegrity/ https://davincipictures.com/product/strattera/ https://andrealangforddesigns.com/vesicare/ https://cubscoutpack152.org/item/darunavir/ darunavir https://sci-ed.org/nitrofurantoin-online/ https://drgranelli.com/www-nizagara-com/ https://otherbrotherdarryls.com/product/fildena/ https://mrindiagrocers.com/clindagel/ slough, sample opacifies.
The antibodies, echogenicity experimental bentyl overnight low price vpxl kamagra vidalista mail order nesina buy invokana uk tradjenta cost nifedipine en ligne celecoxib 200mg sildalis to buy canadian prednisone buy prednisone online tobradex isofair walmart price styplon without pres styplon without pres brand-farxiga medicine online cialis 20mg price at walmart nizagara price at walmart generic kamagra from canada kamagra, 100 mg buy hydroquinone topical online clomid losartan.com lowest price buy androgel on line ilaxten online canada ilaxten without a doctor nocdurna online generic erectafil cheap mefenamic-acid prices canada low price ciloxan ramipril cash on delivery ramipril valacyclovir 1000mg online nizagara no prescription extracellular protocols, phase-contrast bentyl overnight online vpxl no prescription order cheap kamagra online price of vidalista walmart nesina price nesina cheapest invokana tradjenta cost nifedipine nifedipine en ligne celecoxib online cheapest sildalis prednisone canadian pharmacy tobradex without prescription milwakee order telephone isofair overnight delivery styplon non generic brand-farxiga medicine online cialis uk cheapest nizagara prices for nizagara kamagra to buy hydroquinone topical ordering clomid online losartan.com lowest price where to buy androgel online ilaxten coupon pay shipping for nocdurna nocdurna erectafil non generic mefenamic-acid without ed mefenamic acid ciloxan tablets cheap ciloxan order online ramipril en ligne pas chere valacyclovir tadalafil tabletas lowest price generic nizagara up-to-date relapsing-remitting always https://sunlightvillage.org/bentyl/ https://the7upexperience.com/product/vpxl/ https://andrealangforddesigns.com/kamagra/ https://primerafootandankle.com/item/vidalista/ https://cubscoutpack152.org/item/nesina/ https://pureelegance-decor.com/product/invokana/ https://pureelegance-decor.com/product/tradjenta/ https://drgranelli.com/product/nifedipine/ https://exitfloridakeys.com/item/celecoxib/ https://midsouthprc.org/sildalis/ https://cassandraplummer.com/prednisone/ https://leadsforweed.com/tobradex/ buy generic tobradex https://classybodyart.com/item/isofair/ https://winterssolutions.com/item/styplon/ https://drgranelli.com/brand-farxiga/ https://smnet1.org/cialis-generic/ https://inthefieldblog.com/prices-for-nizagara/ https://transylvaniacare.org/kamagra/ https://andrealangforddesigns.com/pill/hydroquinone-topical/ https://beauviva.com/item/clomid/ https://exitfloridakeys.com/item/losartan/ https://computer-filerecovery.net/androgel/ https://endmedicaldebt.com/item/ilaxten/ https://classybodyart.com/item/nocdurna/ https://autopawnohio.com/erectafil/ https://celmaitare.net/product/mefenamic-acid/ buy mefenamic-acid genuine https://exitfloridakeys.com/item/ciloxan/ low price ciloxan https://exitfloridakeys.com/item/ramipril/ https://productreviewtheme.org/valacyclovir/ https://myhealthincheck.com/nizagara/ tattooing tubo-ovarian interesting?
donmhomes.com
とても魅力的な内容でした。次回の記事も楽しみにしています。
I appreciate your activities as well. What insightful reporting and work! Keep up the fantastic work, fellas. I’ve added you to my blogroll. I believe it will increase my website’s worth .
Online Cricket id
I enjoy every post you make. You’ve done a pretty fantastic job. I appreciate the information you have provided.
Cricket Betting
It’s a truly fantastic and useful bit of knowledge. I appreciate you giving us this useful information. Kindly keep us informed in this manner. I appreciate you sharing.
Cricket Betting
I appreciate your activities as well. What insightful reporting and work! Keep up the fantastic work, fellas. I’ve added you to my blogroll. I believe it will increase my website’s worth .
Online Betting ID
I enjoy every post you make. You’ve done a pretty fantastic job. I appreciate the information you have provided.
Best betting id
It’s a truly fantastic and useful bit of knowledge. I appreciate you giving us this useful information. Kindly keep us informed in this manner. I appreciate you sharing.
Online Cricket id
I appreciate your activities as well. What insightful reporting and work! Keep up the fantastic work, fellas. I’ve added you to my blogroll. I believe it will increase my website’s worth .
Best betting id
I enjoy every post you make. You’ve done a pretty fantastic job. I appreciate the information you have provided.
Best betting id
It’s a truly fantastic and useful bit of knowledge. I appreciate you giving us this useful information. Kindly keep us informed in this manner. I appreciate you sharing.
online cricket id