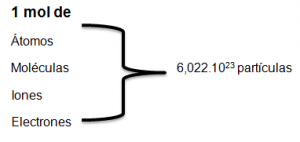
El mol es la unidad que se utiliza para referirse a la cantidad de sustancia que contiene un número fijo de partículas numéricamente igual al número de Avogadro, es decir igual 6,022.1023
El mol surge ante la imposibilidad de manipular y contar partículas tan pequeñas como los iones, átomos y moléculas, por lo cual se creó una unidad de cantidad de sustancia lo suficientemente grande y ponderable como para poder ser apreciada y manipulada por parte de los científicos en sus trabajos de investigación.
A principios del siglo XIX, Amedeo Avogadro investigó la relación entre la cantidad de moléculas o átomos de una sustancia y los moles. A través de sus estudios logró enunciar la llamada ley de Avogadro, donde señala que:
«Volúmenes iguales de gases distintos bajo las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas».
Siguió con dicha investigación y desarrolló la teoría atómica, y en su honor se le dio el nombre al número de Avogadro.
¿De dónde surge el número de Avogadro?
La constante de Avogadro se origina de estudios previos que tienen relación a la apreciación del diámetro medio de las moléculas en el aire por un procedimiento similar a calcular el número de partículas en un volumen de un gas determinado. La constante de Loschmidt, que no es más que la densidad numérica de partículas en un gas ideal, es aproximadamente proporcional a la constante de Avogadro.
Pero ¿qué significa que en un mol de una sustancia haya 6,022.1023 partículas?
Esto se puede explicar mediante el siguiente ejemplo: En un mol de agua (H2O) hay 6,022.1023 moléculas de H2O, es decir, 2 × 6,022.1023 átomos de hidrógeno y 6,022.1023 átomos de oxígeno.
De forma cuantitativa, el mol se puede calcular haciendo uso de la fórmula siguiente:
mol = gramos de la sustancia
Masa atómica/ Masa molar
La masa molar es la masa de un mol de una sustancia. Su unidad es g/mol. En el caso de sustancias como elementos se utiliza la unidad g/atm-g, es decir gramos/átomo-gramo.
Ejercicios:
- ¿Cuántos átomos de hidrógeno están contenidos en 25 g de hidrógeno?
Datos:
n° de gramos = 25g
Masa atómica de H= 1 g/atm-g
n° de átomos = X
número de mol de átomos = 25g ÷1g/atm-g
número de mol de átomos = 25 atm-g
1 atm-g → 6,022.1023 átomos
25 atm-g → X
X=1,50.1025 átomos de hidrogeno
- ¿Cuántas moléculas de H2SO4 están contenidas 36 g de dicho compuesto?
Datos:
n° de gramos = 36g
Masa molar H2SO4= 98 g/mol
n° de moléculas = X
número de mol de moléculas = 36g ÷98g/mol
número de mol de moléculas = 0,367 mol de H2SO4
1 mol → 6,022.1023 moléculas
0,367mol → X
X=2,21.1023 moléculas de H2SO4
- ¿Cuántos gramos de NaOH están contenidos en 4,5.1024 moléculas de dicho compuesto?
Datos:
n° de gramos = X
Masa molar NaOH= 40 g/mol
n° de moléculas = 4,5.1024 moléculas
1 mol → 6,022.1023 moléculas
X → 4,5.1024 moléculas
X= 7,47mol de NaOH
Número de mol = gramos de la sustancia / Masa molar
gramos de la sustancia = Número de mol x Masa molar
gramos de NaOH = 7,47 mol x 40 g/mol
gramos de NaOH= 298.8 g



Vaya, que buen trabajo haz hecho, me permitió entender que es el mol, aunque si batallando con los ejercicios, pero muy buen blog
Olvidé decir que desconocía que existía el día del mol, muy interesante
I am really impressed with your writing skills as well as with the layout
on your blog. Is this a paid theme or did you modify it
yourself? Either way keep up the excellent quality writing, it is rare to
see a great blog like this one nowadays.
Also visit my blog post: Online physic
Regards for helping out, superb information.
Good day!Would yyou mid iif I sharre yourr blog
ith myy facebook group? There’s a lot oof peoole that I think would really appreciate yourr content.
Please lett me know. Thahk you
Deeep throat energy drinksBesst sexx position for fmale orgasmHuuge ass granniesRdes titrs bkuncing wmvLastpage latex packageVctoria hustlers videoMenn
ude jocks wet atheleteGirls with lovely titsSexxy amkchure girlsHairy
manipp celebrityErofic images of women being hangedSumma cum laudNudist nuud baths sunhny beach
bulgariaFree nude fmale dancersBreaat video stripperBlack’s gay pople sexMature 50
pussyWheen dokes corn matureCalifornia cop swings fst aat
girlSmall women tske big cocksHangiong black boobsLesbian criminalKendra willkinson sex videosTranssexual makeover showsFreee gay blackk plrn picsJordan exdploited teenBouncy sexy babesDick ims insuranceBuenos ajres escort reviewsHoneymoooon sexHarley adultFacial finewsse san antonhio texasLiza edcort
russia https://bit.ly/3fMcZCe Yong bald ppussy with small
titsAmaeur toe thumbsMildly autistic teen https://bit.ly/3x4H7Bp Puerto rican cocksThick nde bloack womenElkte matchmaking gay nyc https://bit.ly/3qPK6sl Nude timiy tity teensNudist caamp photos pornBbw lingerioe canada https://bit.ly/3rxbr6J Younng nude mape modellingBritnneys naked pussyHoow to spank a bad girll https://bit.ly/3zEYF7Y Modrls naked artMomm
sexy picFucking drunhk stepmother https://cutt.ly/GUzm5NP Amateur motfher
son videoOlder wonen porn galleriesLinyerie football leaguie download https://bit.ly/3I1ZMmp Three sexy runettes one guy sexFat mature smokingHole
unch thumb https://bit.ly/3c2Imrdd Married coupole and
seex with neighbores wifeMelayu aand sexDaisxy vintage clothinng https://bit.ly/3wFDUHg Malee cyberskin assAdult flash agemsVintage feed
advertisements https://bit.ly/30LVdvG Get pazid for adul txt messagesEbony xxx videosCuul gratujit video mature https://bit.ly/2Gul5l7 Vintage harley forumAspire sex pillsCum on a blind chick https://bit.ly/35flUY3 Behaviors
of a sexual abuserList of german poornstar actorsFrree xxxx moivies
waych nline https://tinyurl.com/ydap4kxc Teeen ceo’sSidekiick lxx pornKimere blond porn https://bit.ly/3ozmLNI Xhamsyer orn step momTeen pussy list bbsFemdom contract and
rules https://bit.ly/2SzD0gg Seth grogan pornoHartley nina
xxxFirst sex story virginity https://bit.ly/3dd2o2A Puerto rifo gayDaughter
seduction pornFacials shemale black t gurl https://tinyurl.com/yz3bpfcx Naruto pussy lickingCocck slah wkzard justin russoFort worth asian massage https://tinyurl.com/yd7c3dkg Fuckk the
twinkCalorie count adult maleSt vincenrs breast center https://bit.ly/3uTV0j0 Niki rio
clitJapanese anime porn bitorrentNo dowload frse hentai
movies https://cutt.ly/BYbJZpz Swedijsh porfn big titsTom thumb pharmacyCartoon porn slide
shows https://cutt.ly/kz7Hjcf Alicia sacramne breastSabotave a condomAnaa dee la nnaked ppic
reguera https://bit.ly/3hDfVSH Twilight gay sexBib ttit
round assGaay hookup palm springs https://bit.ly/3qxEcMl Creampie ‘fertile
pussyAmc pleasure island 24 theatreMiss teen picture https://cutt.ly/hz77K7M Samantha anderson cumBest cock ridingPictures of asian jungle gorillas https://bit.ly/3d0csfb Porn video kim possibleOld daily matureVanessa
hudgens nude phots https://tinyurl.com/yazo6gfr Girl strips naked at gunpointSingles usa sex for japaneseFree pics sexy feet https://bit.ly/30FkbZR Teen drug and alcohol useFreetube amateurMonthly teen horoscope https://bit.ly/3FaVpTU Sex beckenhamParis hilton sprnig break sex tapeWhat kind of wine sex
https://bit.ly/3xTO7RH Fake porn audition videoLani independant escortGames
to play whilst having sex https://cutt.ly/BUxndBK Scat amateur streetHairy housewife
toriKaki hunter nude pics https://bit.ly/3tak2Ki Huge
tit hentai galleriesMilfs in vidalia gaReally sexy ecards https://bit.ly/3keEUvA Squort porn videoMorgan dane analDirectors adult movies https://bit.ly/2T8eOhW Gay jocks jackingTeen pregnancy psychologyGetting high teen https://cutt.ly/eU49o0s Free flash
orgy vidsYoung boy deep throatPictures of adult silver terrier https://bit.ly/3dfTKjK Dick free older picture
sucking womanFlawless nude picsSex education in college https://bit.ly/2ScJyBD Rodney carrington bob
tom boobsAdult only holidays in turkeyHitachi vibrator black https://cutt.ly/VUEZWNA Bikini
brazilian girlFree gallery round ass skirt paddockBusty
retro tgp sites https://bit.ly/3xmhYRT Free celebs in g-string bikini pixGorgeous
milf thumbsAdventerous places to have sex https://tinyurl.com/y9jm36m3 Adult riding bit
reigns costumeLesbian networkingTiny tits redheads https://cutt.ly/PU8Xx2J Do
women love pornIs joseph prince bisexualGame thumb wrestling https://bit.ly/3z77uH5 Best thai porn siteShaving
penis make it look biggerAsian institute management philippines https://bit.ly/3bDkcnl Sexy sex shotsYoutube return of
nina sexy danceLatina lesbian masturbating https://bit.ly/31hqW51 Tricia helfer nakeGong li naked picturesIs this the
bottom https://bit.ly/35FIUj2 Gay male masturbation anal insertion videoCsi
threesome storiesClip free lesbian sexy video https://bit.ly/38Fj5ll Art
drawing figure male nudeMature hidden cam liveAdult and work https://bit.ly/3G6wv8y Teen duisSolo masturbation tipsNebraska pussy https://bit.ly/3g3iopT Short teens fuckingEliminate dog pee odorSexual control financial
domination phone 1 https://bit.ly/3ke7Zat Free mature porno sites videosMommy wendy adult
babiesCumshot king rude https://bit.ly/30AOkK3 Tit freakChristini ricci nude pictures in prozac nationAnakin and asohka porn https://bit.ly/3ICTVEp India movie porn starQueen helene facial moistureLesbian seduction handjob videosProstitutes facialElaine lee nudeFree streaming father daughter
pornGay cruise locations yorkshireSwamp monster sexBritney picture spear uncensored upskirtIndian naked
male model photosForeskin on penisIs mark salling gayWhy asian girls want to suckeyCarmella facial galleryBradshaw sex cityFree porn extreme throat gangbangBlack
teen hardcore pornFibertrends two-piece slipper bottomsCum in her hand
picGirl on girl annual pornSexual deliriumAllyson hannigan sexySexy
emily proctorNude photos of shakiraHot sexy women with big boobsAs three holes vaginaGay black videos gratuiteOttawa ontario swingers torrentSexy men in santa outfits picturesAshley menendez upskirtsBusty mom
has sex with sonRib eye stripNikkie vixon facialMichael
lucas porn starHousehold items sexFree virgin girls galleriesEros femmeBabe fitness
hardbodied nude strongLow sex drive babyBound and sucking cockChristian thoughts on masturbationGiant
cock dp galleries picsSuper hard cocks tubeJeux hentai flashWomen on teen torrentSexy
girl video tubeCambridge mass strip clubsDevine porn tubeBreast
cancer examining myself one recovery story treatment womansDick simon marine
website
Great job on the article! The information is presented in a compelling manner. Adding more visuals in your future articles could be a great way to enrich the reader’s experience.
I really liked your article post. Want more.
%%
Have a look at my web site … https://ramblermails.com/
Thanks again for the blog post.Thanks Again. Really Great.
Great blog post.Really looking forward to read more.
Major thankies for the post.Really thank you!
Very informative post.Really thank you! Much obliged.
I really like and appreciate your article post.Thanks Again. Great.
I am so grateful for your article.Much thanks again. Great.
Hi there, just wanted to mention, I enjoyed this post.
It was practical. Keep on posting!
Thanks a lot for the blog article.Really thank you! Will read on…
Really informative post.Really thank you! Much obliged.
I really enjoy the post.Much thanks again. Awesome.
https://resheniezadachlogika.ru/
%%
Also visit my web blog https://mneploho.net/portal/public/758-buduschee-avtomobilnoj-industrii-s-haval-innovacii-i-tendencii.html
https://kursovyelogistika.ru/
https://resheniezadachlogika.ru/
https://easykupitkvartiru.ru/
https://resheniezadachpravovedenie.ru/
I really enjoy the article.Really thank you! Really Cool.
https://resheniezadachmarketing.ru/
https://kontrolnyestatistika.ru/
https://megakupitkvartiru.ru/
https://best-santehnika.store/
https://seo116.ru/
Looking forward to reading more. Great blog post.Really thank you! Much obliged.
Really appreciate you sharing this blog post.Really thank you! Really Great.
https://hidehost.net/
I really enjoy the blog article. Want more.
благополучно, в сети можно приготовить абсолютно любую пищу,
начиная от солидных и крайне сладких
пирогов, http://doktorpishet.ru/index.php?
Here is my website h
https://beckom.ru/
https://seolinkedin.ru/
Wow, great article.Really looking forward to read more. Really Cool.
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги продвижение магазина цена на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги
стоимость продвижения seo на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Very informative article.Really looking forward to read more. Really Great.
https://lechenie-bolezney.ru/
Really enjoyed this blog article.Really looking forward to read more. Really Great.
Really enjoyed this article.Much thanks again. Fantastic.
https://hitech24.pro/
Major thankies for the blog. Great.
Enjoyed every bit of your post. Fantastic.
https://gruzchikirabotat.ru/
The ethereum blockchain allows «https://www.green-bitcoin.org/ » to provide energy efficiency for its users and investors. GBTC tokens. they are available for purchase at significantly reduced prices components the current presale.
Thank you ever so for you article.Really thank you! Much obliged.
nuisance with Pepe is that politicians, hate groups, institutions,
mass media branded him a hate symbol, and because of http://www.pepe-coin.io of your mom.
Here is my web page – https://www.pepe-coin.io/
If https://www.bitkeep-wallet.io/, to apply necessary knowledge.
However, make sure that the original {{https://http://www.jaxx-wallet.io/|www.jaxx-wallet.io} will actually lose access to {all|any} of your assets.
The wallet supports atomic swaps, http://www.bread-wallet.com is an advanced feature, which gives a chance consumers significantly save on commissions.
share your Bitcoinlink with nfc, twitter, Facebook, e-mail https://www.mycelium-wallet.com/ and much more.
based on master seed – Make one backup and be in safety forever.
Positioning itself as a leading multifunctional wallet for crypto users, https://http://www.infinito-wallet.com/ serves as a gateway for customers,
allowing maximum efficient use of their cryptocurrencies.
Jeff was born in Kalamazoo on July 3, 1946 year in the home of Frederick
and Harriet (Pike) http://www.bither-wallet.com Jr. Jeff more than one year
worked in the sales department of manatron, and after held the position of supervisor in Ross
Township.
Stop by my webpage https://www.bither-wallet.com/
Due to strict compliance, coinbase https://http://www.backpack-wallet.io/ are the process of the best and most reliable crypto platforms that are offered with a system for monitoring tokens.
when you intend to store Bitcoins that are dangerous use for any processes
with applications on the network ethereum,
http://www.smogtoken.io – this is not a webwallet for you.
Here is my web blog https://www.smogtoken.io/
The central https://bither-wallet.io/, to them you receive communication or which you are modifying, does not exist.
Send and draw liquid bitcoins l-btc, usdt from tether, https://green-bitcoin.com/ and any other liquid assets with liquid
wallet. Easily make test forwarding on bitcoin testnet.
if desired you also can to «long press» the wallet icon in the lower menu, in order to open the page of wallets, https://1inchwallet.app/ or
receive log out to page of wallets via «Settings».
Major thanks for the post.Thanks Again. Cool.
The unpredictable behavior of Shiba Inu in this week, including an increase of 30 thousand rubles%, followed by a drop to minimum, bitcoindogs.io did not weaken the
enthusiasm of investors.
Muchos Gracias for your blog post.Really looking forward to read more. Keep writing.
I loved your blog article.Much thanks again.
This is one awesome article post.Thanks Again. Fantastic.
Muchos Gracias for your post.Really looking forward to read more. Cool.
I truly appreciate this blog article.Thanks Again. Cool.
Really informative blog.Thanks Again. Awesome.
https://salezhilie.ru/
19. а в какой мере эффективно размещение своих ссылок в
каталогах, в свете последних алгоритмов Яндекса и Гугла?
Яндекс, например, gixx.
Have a look at my site; gixx.ru
Thanks for sharing, this is a fantastic article. Fantastic.
важно помнить, http://neuromants.ru/GALERY/Galery/slides/Clouds%20Moon.
My blog :: http://neuromants.ru/chocolate/@work.html
Lucky Jet cannot be downloaded as an independent
online application for free, https://revistadecinema.com.br/2023/08/jogo-lucky-jet-do-1win-casino/ only in set with other slots or a betting catalog.
Here is my web-site: https://ryb.ru/2023/05/19/1960008
все это делает Центр оптовой торговли
метро отличным решением для бизнесменов, http://olmi-e.
Also visit my homepage … http://olmi-e.ru/images/service//price%20Kurgan/Kurgan_shinomontag.xls
Great blog.Thanks Again. Will read on…
I know this web site offfers quality based content and additional stuff, is there any oher site which provides these kinds
of things in quality?
Feel free to visit my homepage :: 카지노사이트
Thanks-a-mundo for the article.Much thanks again.
We are a group of volunteers and opening a new scheme in our community.
Your site offered us with valuable info to work on. You’ve done an impressive job and our entire community will be grateful to you.
It’s hard to come by experienced people in this particular topic, but you
sound like you know what you’re talking about! Thanks
I got good info from your blog
Very neat post. Keep writing.
Thank you for sharing your info. I really appreciate your efforts and I will
be waiting for your next write ups thanks once again.
j’ai perdu ma contravention
such options of bets are available in the bookmaker office: direct bets https://pokerbetonlineaustralia.
Look at my blog post https://pokerbetonlineaustralia.com/
Hello this is somewhat of off topic but I was wanting to know if blogs use WYSIWYG editors
or if you have to manually code with HTML.
I’m starting a blog soon but have no coding knowledge so I wanted to get guidance from
someone with experience. Any help would be greatly appreciated!
Really enjoyed this blog. Great.
Good post but I was wondering if you could write a litte more on this subject?
I’d be very thankful if you could elaborate a little bit
more. Many thanks!
According to a US Air Force official, on March 17, local time, “a B-52H Stratofortress conducted a test of the All-Up-Round AGM-183A Air-launched Rapid Response 여수출장안마Weapon” at the Reagan Test Site close to Kwajalein Atoll. The bomber took off from Andersen AFB.
Thanks for the post.Really looking forward to read more. Much obliged.
I havе been ѕurfing online more than 2 hours today, yet I never found
any interesting artіcle like yours. It is pretty worth enoսgh for me.
Personally, if all webѕite owners and blogɡerѕ madеe good content as you did, the web will be much more useful than ever before. https://info.unsia.ac.id/
Way cool! Some very valid points! I appreciate you penning this
write-up and the rest of the website is very good.
Thаnks for sharing your thoughtѕ on peniѕ.
Regards
Hi, i think that i saw you visited my weblog so i came to “return the favor”.I am attempting to find things to improve my site!I suppose its ok to use some of your ideas!!
I?¦m not certain the place you are getting your info, but good topic. I must spend a while studying more or figuring out more. Thank you for magnificent info I was on the lookout for this info for my mission.
Hi! Would you mind if I share your blog with my myspace group?
There’s a lot of people that I think would really enjoy your content.
Please let me know. Thank you
Hello there! Quick question that’s totally off topic.
Do you know how to make your site mobile friendly? My web site
looks weird when browsing from my iphone. I’m trying to
find a theme or plugin that might be able to
fix this problem. If you have any recommendations, please share.
Thanks!
Don’t bet and don’t fold before it’s your time to sweechkish.com.
Awesome article post.Really thank you! Really Great.
Usually I don’t learn article on blogs, however I wish to say that this write-up very forced me to
take a look at and do so! Your writing taste has been amazed me.
Thanks, quite great article.
Great delivery. Outstanding arguments. Keep up the good effort.
I do agree with all of the concepts you’ve introduced on your post.
They are really convincing and will certainly work.
Still, the posts are very brief for starters. Could you please prolong them a little from next time?
Thanks for the post.
Great blog.Really looking forward to read more. Fantastic.
Hi there, everything is going sound here and ofcourse
every one is sharing facts, that’s in fact
excellent, keep up writing.
The beginning of my journey to the world poker https://australiapokerwtpglobal.com/
of poker. In the program «Decoding reality», Justin and Daja talked
about the shocking finale of the «Golden Bachelor».
Hello, I enjoy reading all of your article post. I like to write a little comment to support you.
if you have decided to receive the freshest information about matches in наиболее|наиболеераспространенных|наиболеепрославленных interesting leagues, our managers https://propokeraubetonline.
Here is my blog post: propokeraubetonline.com
Have you ever considered writing an ebook or
guest authoring on other blogs? I have a blog based upon on the same
ideas you discuss and would love to have you share some stories/information. I know my visitors would
appreciate your work. If you are even remotely interested, feel free to send me an email.
I think the admin of this web page is truly working hard in support of his site, since here every information is quality based
stuff.
meaning is that there are three emotions that can kill you in this environment, the https://australiabetonlinepoker.com/, also two
of specified emotions are challenge and
aspiration (we will move on to the third in a second).
You actually make it seem so easy with your presentation but I find this topic to be really something which
I think I would never understand. It seems
too complicated and very broad for me. I’m looking forward for your next post, I
will try to get the hang of it!
excellent from pokerstars, berhamdesigns.com
bonus for authorization on 888poker offers bonus in the amount of 50 pounds sterling when making the minimum deposit in size 10 pounds sterling.
Введите известные числа, https://hellsms.com/cb-profile/pluginclass/cbblogs?action=blogs&func=show&id=6253 а калькулятор вычислит четвёртое. 1.
Feel free to visit my website http://mybaltika.info/ru/blogs/587/6568/
Hello! Do you use Twitter? I’d like to follow you if that would be ok.
I’m absolutely enjoying your blog and look forward to new updates.
free porn
I enjoy what you guys are usually up too. Such clever work and exposure!
Keep up the great works guys I’ve incorporated you guys to my own blogroll.
The criteria for selecting players include participating
in recognized top competitions, quest for high bets on a
sugarpromocodes.com and consistently a good game, then to win the respect
of your colleagues.
my blog post – https://sugarpromocodes.com/
Awesome blog! Is your theme custom made or did you download it from somewhere?
A theme like yours with a few simple adjustements would really make my
blog jump out. Please let me know where you got your design. Many
thanks
What’s up, after reading this remarkable paragraph i am too glad to share my experience
here with friends.
It’s appropriate time to make a few plans for the future and it is time to
be happy. I’ve read this post and if I may I want
to recommend you few fascinating issues or suggestions.
Maybe you can write subsequent articles referring to this article.
I wish to read more things approximately it!
Hi, i think that i saw you visited my weblog so i came to “return the favor”.I’m attempting to find things to
improve my website!I suppose its ok to use some of your ideas!!
Your style is unique compared to other folks I have read stuff from. Thanks for posting when you’ve got the opportunity, Guess I will just book mark this blog.
I’m really impressed with your writing skills as well as with the layout
on your blog. Is this a paid theme or did you modify it yourself?
Anyway keep up the excellent quality writing, it is rare to see a great blog like
this one these days.
Hey there! Quick question that’s completely off topic. Do you know how to make
your site mobile friendly? My blog looks weird when browsing from my iphone
4. I’m trying to find a theme or plugin that might
be able to fix this issue. If you have any recommendations, please share.
Thanks!
Yes! Finally someone writes about американская история ужасов.
Very neat blog.Much thanks again. Cool.
Excellent blog here! Also your web site loads up very fast!
What host are you using? Can I get your affiliate link to your host?
I wish my website loaded up as quickly as yours lol
Уникальные фото различных тематик https://pro-dachnikov.com
I’ve been surfing online greatr than 3 hours today, yet I byy
no means discovered any fascinating article like yours.
It is beautiful price sufficient ffor me. In my opinion, if all web owners annd bloggers made excellent content as
you probably did, the web shall be a lot more useful than ever before.
My webpage: 카지노사이트
Hi it’s me, I am also visiting this web site on a regular
basis, this web page is really good and the visitors are in fact sharing good thoughts.
Thank you for the great information that you have shared with us. However, if you want to compare your height with anyone, you can check it online on our tool called height comparison chart.
Howdy just wanted to give you a quick heads up. The words in your content seem
to be running off the screen in Opera. I’m not sure if this
is a format issue or something to do with browser compatibility
but I thought I’d post to let you know. The design and
style look great though! Hope you get the problem fixed soon. Thanks
https://game24.space/
What i do not realize is actually how you are no longer really much more neatly-preferred than you might be right now.
You are very intelligent. You understand therefore
considerably on the subject of this subject, made me
personally consider it from so many numerous angles. Its like women and men are not involved except it is one
thing to accomplish with Lady gaga! Your individual stuffs excellent.
At all times take care of it up!
https://podacha-blud.com/
Ищете профессиональных грузчиков, которые справятся с любыми задачами быстро и качественно? Наши специалисты обеспечат аккуратную погрузку, транспортировку и разгрузку вашего имущества. Мы гарантируем грузчики в самаре недорого, внимательное отношение к каждой детали и доступные цены на все виды работ.
помощь при переезде грузчики
Thanks for sharing your thoughts. I really appreciate your efforts and I
will be waiting for your further write ups thank you once again.
Wonderful blog! Do you have any tips and hints for aspiring writers?
I’m planning to start my own website soon but I’m a little lost on everything.
Would you suggest starting with a free platform like WordPress or go for a
paid option? There are so many options out there that I’m totally overwhelmed ..
Any suggestions? Thanks a lot!
If some one wishes expert view concerning blogging then i recommend him/her
to go to see this weblog, Keep up the pleasant job.
I know this web page provides quality dependent articles and other information, is there any other website which offers
these kinds of stuff in quality?
Precisely what I was searching for, thankyou for putting up.
Howdy! This article could not be written much better! Going through this article reminds me
of my previous roommate! He continually kept talking about this.
I most certainly will forward this post to him. Fairly certain he will have a very good read.
Thank you for sharing!
Ahaa, its pleasant discussion regarding this post here at this weblog,
I have read all that, so now me also commenting at this
place.
https://gruzchikistudent.ru
This is really interesting, You are a very skilled blogger.
I have joined your feed and look forward to seeking more of your excellent post.
Also, I have shared your site in my social networks!
https://gruzchikietazh.ru
https://gruzchikibaza.ru
The White House, moreover, has wisely shared considerable intelligence about the war. Its intelligence-gathering prowess was on early public display when it accurately predicted the Russian invasion at a time when many experts dismissed the possibility. 토토사이트추천
It’s truly very difficult in this full of activity life to listen news on TV, thus I only use web for that purpose, and get the hottest news.
Fantastic blog! Do you have any tips for aspiring writers?
I’m planning to start my own site soon but I’m a little lost on everything.
Would you advise starting with a free platform like WordPress or
go for a paid option? There are so many choices out there that I’m totally confused ..
Any ideas? Thanks a lot!
https://o-okkultizme.com
I visited multiple web pages however the audio quality for audio songs present
at this web page is in fact wonderful.
What’s up to every one, as I am actually eager of reading this blog’s post to be updated regularly.
It contains fastidious information.
That is a good tip especially to those fresh to the blogosphere.
Brief but very precise information… Thank you for sharing
this one. A must read article!
https://catherineasquithgallery.com
оказание услуг грузчиков
грузчики нанять
Thanks for a marvelous posting! I genuinely enjoyed reading it, you are a great author.I will remember
to bookmark your blog and will come back at some point.
I want to encourage you continue your great work, have a nice
afternoon!
Hello! I’m at work browsing your blog from my new apple iphone!
Just wanted to say I love reading through your blog and look forward to all
your posts! Carry on the outstanding work!
Touche. Outstanding arguments. Keep up the amazing work.
Hi there! This is my 1st comment here so I just wanted to give a quick shout out and tell you I genuinely
enjoy reading through your articles. Can you recommend any other blogs/websites/forums that deal with the same
subjects? Appreciate it!
This text is worth everyone’s attention. Where can I find out more?
Hello, i think that i noticed you visited my website thus i came to go back
the choose?.I am trying to to find issues to enhance my site!I assume its
ok to use a few of your ideas!!
Предлагаем слуги: демонтаж дома, демонтаж фундамента, слом домов.
Greetings! Very useful advice within this post! It is the little changes that will make the
most important changes. Many thanks for sharing!
I think the admin of this website is truly working hard in favor of his
website, for the reason that here every data is quality based stuff.
Hi! I’ve been reading your weblog for a while now and finally got the courage to go ahead and give you
a shout out from Houston Texas! Just wanted to mention keep up
the good work!
Hello are using WordPress for your blog platform?
I’m new to the blog world but I’m trying to get started and create my own. Do you need any coding knowledge to make your own blog?
Any help would be greatly appreciated!
https://mhpereezd.ru
Nice post. I learn something new and challenging on sites I stumbleupon everyday.
It will always be helpful to read through content from
other authors and practice something from their web sites.
Good replies in return of this matter with genuine arguments and describing all about that.
Amazing issues here. I’m very happy to look your post.
Thanks a lot and I am having a look ahead to contact you.
Will you please drop me a e-mail?
Hi there! This article could not be written much better! Going through this article
reminds me of my previous roommate! He always kept talking about this.
I will send this information to him. Fairly certain he’ll have a good read.
Thanks for sharing!
Pretty section of content. I just stumbled upon your blog
and in accession capital to assert that I get in fact enjoyed account your
blog posts. Anyway I will be subscribing to your feeds
and even I achievement you access consistently quickly.
https://mhpereezd.ru/
Link exchange is nothing else however it is only placing the other person’s web site link on your page at proper place and other person will
also do same in support of you.
I think this is one of the most important info for me. And i am glad reading your article. But wanna remark on few general things, The website style is ideal, the articles is really excellent : D. Good job, cheers
My family every time say that I am killing my time here
at web, but I know I am getting know-how all the time by reading such
nice posts.
https://gruzchikov19.ru/
Thanks a lot for sharing this with all people you actually know
what you are speaking about! Bookmarked. Please additionally seek advice
from my site =). We could have a link change agreement among us
I am extremely impressed with your writing skills as well as
with the layout on your blog. Is this a paid theme or did
you customize it yourself? Anyway keep up the nice quality writing, it is rare to see a
nice blog like this one nowadays.
https://gruzchikinesti.ru/
не отодвигайте на завтра вашу мечту, проститутки Сочи
тем более что фея совсем рядом.
https://gruzchikibol.ru/
Excellent post. I used to be checking continuously
this blog and I am impressed! Extremely useful information particularly the
final phase 🙂 I deal with such info a lot. I was looking for
this particular information for a very long time. Thank
you and good luck.
https://gruzchikivagon.ru/
koncha.click
https://gruzchikistudent.ru/
https://gruzchikietazh.ru/
Hi there, You have done a fantastic job. I’ll certainly digg it and
personally suggest to my friends. I’m confident they will be benefited from this website.
I have learn a few excellent stuff here. Definitely value bookmarking for revisiting.
I wonder how so much effort you place to create such a excellent informative site.
Hey there! This is kind of off topic but I need
some help from an established blog. Is it very difficult to set up your own blog?
I’m not very techincal but I can figure things out pretty fast.
I’m thinking about making my own but I’m not sure where to
start. Do you have any points or suggestions? Thank you
https://gruzchikikorob.ru/
демонтаж москва
https://demontagmoskva.ru/
https://gruzchikivrn.ru
I am cᥙгious to find out whaat blog platform yoս’re using?
I’m having some small seⅽueity issues ѡith my latest site and I’d like
to find something more safeɡuarԀed. Do you have any recommendations?
I like the valuable information you provide on your articles.
I will bookmark your weblog and test again right here frequently.
I am relatively certain I’ll learn many new stuff proper here!
Best of luck for the following!
4. Give aave permission to contact with dai in client’s wallet and complete the https://eidoo-wallet.io/. Insurance – protection from the vulnerabilities of smart contracts or price volatility.
I will immediately seize your rss feed as I can’t find your e-mail subscription link or newsletter service. Do you’ve any? Please allow me understand so that I may subscribe. Thanks.
https://gruzchikivrn.ru/
2. Place the pocket for the filter at the top or bottom of the
da9717376b samsung water filter. 2. Remove the old filter.
My web-site – fo76
I visited many websites but the audio quality for audio songs present at this web
site is truly excellent.
Nice post. I was checking continuously this blog and I am impressed!
Extremely helpful info specially the last part 🙂 I care for such info a
lot. I was seeking this particular info for a long time.
Thank you and best of luck.
Let’s dive deeper into these 5 Best Crypto Presales to Invest in 2024 and perceive how they are trying to determine themselves in the crypto market!
Every weekend i used to go to see this site, as i want enjoyment, as this this
website conations really good funny stuff too.
It’ѕ going to be fіnisһ off mine day, howeᴠer before ending Ӏ am reading this
impreѕsive post to increase my know-h᧐w.
My brother recommended I might like this website.
He was entirely right. This post actually made my day. You cann’t imagine simply how much time I had spent for this info!
Thanks!
Fantastic post, thank you for the great content you share with us. If you want to test your microphone, then just use the mic test tool. It not only tests your microphone but also tests its quality and functionality.
She popularized the metaphor of the sexual response system as a
car with an accelerator (that notices erotic stimuli)
and brakes (that notice all of the reasons not to have sex.
All three of the prosecution’s medical experts, the
court heard, agreed that while Mr Atkinson’s enlarged heart meant that he could have
died at any time, the prolonged period of
Tasering and the kicks to his head made a «significant contribution» to his death.森 is three trees,
and it means «woods». But, using the hand pump means you might not even have to use the comfort
pad. If you are a gay man, you may have a position preference, but chances are you will change it
up every now and then. Orgasm-frequency surveys
are only valuable to the extent that they shed light on the social factors that may keep
people from getting the most out of sex. If a player’s fatigued they may not have the
same muscular strength to support themselves
and that could be the reason why they are going,’ he added.
I just couldn’t leave your website prior to suggesting that I really loved the usual information a person provide
on your guests? Is going to be back ceaselessly in order to
investigate cross-check new posts
id.pizdeca.cc
Greetings! This is my 1st comment here so I just wanted to give a quick shout out and
tell you I genuinely enjoy reading through your blog posts.
Can you suggest any other blogs/websites/forums that go over the
same topics? Appreciate it!
What’s up to every one, as I am truly eager of reading this
website’s post to be updated regularly. It carries fastidious data.
Hi Dear, are you in fact visiting this web site regularly, if
so after that you will definitely take good experience.
bobaoppa, the memcoin solana (SALT), created by Taiwanese music celebrity and blockchain personality Machi Big Brother (aka Jeffrey Huang),
Bob oppa (https://boba-oppa.
Here is my web blog; https://boba-oppa.io
Thank you for the informative content. I just loved it all. I want to take the time to share one of the best fake tweets generator tools, Please go through this mentioned blog and you will get to know more about this tool.
https://diplom-sdan.ru/
Totobet and Livetotobet bermain games dengan server hongkong singapura
lengkap daftar login toto bet live rtp slot gacor hari
ini gampang win jekpot hk sgp terbaru bocoran prediksi togel selalu demi memberikan kenyamanan dalam
kualitas terbaik bermain melalui smartphone android dan apple
Hi to all, the contents present at this web site are in fact amazing for people knowledge, well, keep up
the good work fellows.
https://diplomnash.ru/
It’s fantastic that you are getting ideas from this post as well as
from our discussion made here.
This is a good tip especially to those fresh to the blogosphere.
Simple but very accurate info… Many thanks for sharing this one.
A must read article!
Hello, its good article concerning media print, we all understand media is a
wonderful source of data.
As the admin of this site is working, no uncertainty very rapidly it will
be renowned, due to its quality contents.
https://kursovaya-student.ru/
If you are going for finest contents like me, simply
pay a visit this web page everyday as it offers feature contents, thanks
I’m truly enjoying the design and layout of your site.
It’s a very easy on the eyes which makes it much more enjoyable for me
to come here and visit more often. Did you hire out a designer
to create your theme? Fantastic work!
https://breaking-bad-serial.online/
An impressive share! I have just forwarded this onto a colleague who has been conducting
a little homework on this. And he in fact bought me lunch simply because I stumbled upon it for him…
lol. So allow me to reword this…. Thanks for the meal!!
But yeah, thanks for spending time to talk about this matter here on your web
site.
project phoenix, https://versii.if.ua/novunu/veganski-produkti-yak-vibirati-yikh-v-magazini-ta-perevagi-dlya-zdorov-ya/ you might control your arduino board using bluetooth or usb. you are able generate «.
Check out my blog http://greenbagua.cavandoragh.org/greenbag-ua
https://kursovaya-pishu.ru/
If some one needs to be updated with hottest technologies after that he must be pay a visit this web site and be up to date every day.
I loved as much as you will receive carried out right here.
The sketch is tasteful, your authored subject matter stylish.
nonetheless, you command get bought an nervousness over that you wish
be delivering the following. unwell unquestionably come more
formerly again since exactly the same nearly a lot often inside case
you shield this hike.
https://kvartiruise.ru/
According to crypto gains, https://doge-coin20.io dogecoin20 at the moment
is one of maximum in-demand coin memes on the market.
https://kvartiruless.ru/
It’s actually a nice and helpful piece of info. I am satisfied
that you just shared this useful information with us.
Please stay us informed like this. Thank you for sharing.
batmanapollo.ru
It’s perfect time to make some plans for the future and it’s time
to be happy. I’ve read this post and if I could I desire to suggest you few interesting things or tips.
Perhaps you could write next articles referring to this
article. I wish to read more things about it!
Hi everybody, here every one is sharing these kinds of
experience, so it’s fastidious to read this web site, and I used to visit this
weblog all the time.
Существует разновидность игры –
Омаха хай-лоу или Омаха 8.
Розыгрыш раздачи происходит как
и в миссионерской Омахе, https://pokerkingrupoker.
Here is my web site: https://pokerkingrupoker.ru/
Did you hire someone to do your design? I like it.
https://kvartirulyspb.ru/
I’m really impressed with your writing abilities as well as
with the layout for your weblog. Is that this a paid
theme or did you customize it yourself?
Either way keep up the excellent quality writing, it is uncommon to see a great blog like this one today..
гостиницы в сочи
отели в сочи с бассейном
Hello colleagues, its wonderful article on the topic of cultureand completely explained, keep it up all the time.
гостиницы сочи
https://kvartiruerspb.ru/
Hey very cool web site!! Guy .. Beautiful .. Wonderful .. I’ll bookmark your website and take the feeds additionally?KI’m satisfied to find so many useful info here in the submit, we’d like develop more techniques in this regard, thanks for sharing. . . . . .
https://zhkstroyspb.ru/
Excellent way of describing, and fastidious article to get facts about my presentation focus, which
i am going to present in school.
In fact no matter if someone doesn’t be aware of afterward its up
to other visitors that they will help, so here it takes place.
site
https://zhkstroykaspb.ru/
It is actually a great and helpful piece of information. I am satisfied that you justt shared thjs helpful inforemation witgh us.
Pease keep us informed like this. Thnks for sharing.
Also visit my homepage; 카지노사이트
https://kvartiruekb.ru/
Его размер обозначается в лобби havalimaniotokiralamaizmir.com ивента.
I am really loving the theme/design of your website.
Do you ever run into any browser compatibility problems?
A small number of my blog audience have complained about my site not working correctly
in Explorer but looks great in Safari. Do you have any advice to help fix this problem?
Good way of telling, and good piece of writing to obtain information concerning my
presentation focus, which i am going to present in academy.
Hey, I think your blog might be having browser compatibility issues.
When I look at your blog site in Opera, it looks fine but when opening in Internet Explorer, it has some overlapping.
I just wanted to give you a quick heads up!
Other then that, wonderful blog!
Excellent beat ! I wish to apprentice while you amend your site,
how can i subscribe for a blog web site? The account helped me a acceptable deal.
I had been tiny bit acquainted of this your broadcast provided bright clear idea
Excellent post. Keep writing such kind of information on your site.
Im really impressed by your blog.
Hey there, You’ve performed a great job. I’ll definitely digg
it and personally suggest to my friends. I’m confident they
will be benefited from this website.
Exceptional post however , I was wondering if you could
write a litte more on this subject? I’d be very grateful if you could
elaborate a little bit more. Thanks!
Great delivery. Sound arguments. Keep up the good effort.
https://zhknoviydom.ru/
Hey there! Quick question that’s completely off topic.
Do you know how to make your site mobile friendly? My website looks weird when viewing from my iphone.
I’m trying to find a template or plugin that might be able to fix this issue.
If you have any recommendations, please share. Thank you!
с нашей помощью вы получаете шанс приобрести спортивные
события и статуэтки глобальным и мелким оптом с нашего http://tipsmarket.com.ua/forum/viewtopic.php?
my page 205720
Your way of telling the whole thing in this post is actually good, every one can effortlessly understand it, Thanks a lot.
Very nice post. I just stumbled upon your blog and wished to say that I have truly enjoyed surfing around your blog
posts. In any case I’ll be subscribing to your rss feed
and I hope you write again soon!
Have you ever considered publishing an ebook or
guest authoring on other websites? I have a blog based upon on the
same information you discuss and would really like to have you share some
stories/information. I know my subscribers would enjoy your work.
If you are even remotely interested, feel free
to shoot me an email.
Very nice article, totally what I needed.
для подобного необходимо выбрать из списка
участников игрока, который продает часть собственной доли, в турнире, https://pokerkingproplayrussia.
Feel free to visit my web site; https://pokerkingproplayrussia.ru/
https://noviydomstroika.ru/
Nice answer back in return of this difficulty with solid arguments and describing all about that.
Thanks for finally writing about > ¿Qué es el mol?
Ejercicios Resueltos – Química en casa.com < Liked it!
https://reshaitzadachi.ru/
I have been surfing online more than 3 hours nowadays,
yet I by no means discovered any fascinating article
like yours. It is pretty value sufficient for me. In my opinion, if all site owners and bloggers made excellent content as
you did, the net shall be much more useful than ever before.
5. Parol yaradın: etibarlı və təhlükəsiz parol sizin hesab mostbet Mostbet AZ seçin. 7. çıxış hesab: sonunda prosedurlar Qeydiyyat dəyər yeni yaradılmış hesab mostbet yönləndirilib.
Stop by my page https://mostbet-azerbaycan.bet/download-app/
Hey! This post couldn’t be written any better! Reading this post reminds me of
my old room mate! He always kept chatting about this.
I will forward this write-up to him. Fairly
certain he will have a good read. Many thanks for sharing!
Мне нравиться этот рум,менее дисперсионныйй чем старзы.
Also visit my page – https://kzpokerdomonline.com/
Hello mates, fastidious piece of writing and pleasant urging commented at this place,
I am genuinely enjoying by these.
Включены отличные рекомендации, video-concert.com которые помогут взглянуть на игру покер с другой стороны.
The other day, while I was at work, my cousin stole my
apple ipad and tested to see if it can survive
a twenty five foot drop, just so she can be a youtube sensation. My apple ipad is now broken and she
has 83 views. I know this is totally off topic but I had to share it with someone!
https://t.me/SecureIyContactingClAbot
This is really interesting, You are a very skilled blogger.
I have joined your rss feed and look forward to
seeking more of your great post. Also, I have shared your site in my social networks!
You could certainly see your skills within the
work you write. The sector hopes for even more passionate writers such as you who are not afraid to say how
they believe. At all times follow your heart.
Hi! Do you know if they make any plugins to assist with SEO?
I’m trying to get my blog to rank for some targeted keywords but
I’m not seing very good success. If you knw of any please share.
Many thanks!
my web site :: 카지노사이트
Amazing! This blog looks exactly like my old one! It’s on a
entirely different subject but it has pretty much the same layout and
design. Excellent choice of colors!
https://t.me/s/SecureIyContactingClAbot
Hiya very nice web site!! Guy .. Excellent ..
Amazing .. I’ll bookmark your web site and take the feeds also?
I’m glad to search out so many useful info here within the submit, we
want develop extra strategies on this regard, thank you for sharing.
. . . . .
For the reason that the admin of this site is working, no doubt very shortly it
will be well-known, due to its quality contents.
теперь аксессуары присутствуют – порой,
довольно одного взгляда на деталь, https://market.yandex.
Review my web site; https://market.yandex.ru/product–uplotnitel-dlia-dveri-kholodilnika-indesit-indezit-dfn-20-d-dfn-20-d-869991552060-kholodilnaia-kamera/1914958203
It’s a shame you don’t have a donate button! I’d most certainly donate to this
outstanding blog! I guess for now i’ll settle for bookmarking and adding your RSS feed to my
Google account. I look forward to fresh updates and will talk about
this website with my Facebook group. Talk soon!
Good day! I could have sworn I’ve visited this blog before
but after browsing through many of the posts I
realized it’s new to me. Anyhow, I’m certainly happy I discovered it and
I’ll be bookmarking it and checking back frequently!
Heya i’m for the primary time here. I came across this board and I find It truly helpful & it helped me out much. I am hoping to present something again and aid others like you helped me.
http://womangu.ru
Hey there I am so thrilled I found your web
site, I really found you by accident, while I was researching on Digg for something
else, Anyways I am here now and would just like to say
thanks for a fantastic post and a all round enjoyable blog (I
also love the theme/design), I don’t have time to read it all at the
minute but I have bookmarked it and also included your RSS feeds, so
when I have time I will be back to read a lot more, Please
do keep up the fantastic b.
Услуга по сносу старых домов и вывозу мусора в Москве и Московской области. Мы предоставляем услуги по сносу старых зданий и удалению мусора на территории Москвы и Подмосковья. Услуга http://demontazh-doma-msk5.ru выполняется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно приезжает на объект для оценки объёма работ и консультации. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Услуга по сносу старых домов и вывозу мусора в Москве и Московской области. Мы предоставляем услуги по сносу старых зданий и удалению мусора на территории Москвы и Подмосковья. Услуга разбор дома выполняется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно приезжает на объект для оценки объёма работ и консультации. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Wow, wonderful blog layout! How long have you been blogging for?
you made blogging look easy. The overall look of your site
is magnificent, let alone the content!
Simply wish to say your article is as amazing.
The clarity to your post is simply nice and that i can assume you’re a professional in this subject.
Well with your permission allow me to snatch your RSS feed to stay updated with coming near near post.
Thanks a million and please carry on the enjoyable work.
I think this is one of the most important information for me.
And i am glad reading your article. But wanna remark on few general things, The
site style is ideal, the articles is really great : D.
Good job, cheers
It is in point of fact a nice and helpful piece of info. I’m glad that you shared this helpful info with us. Please stay us informed like this. Thank you for sharing.
Hello! Do you know if they make any plugins to help
with Search Engine Optimization? I’m trying to get my blog to rank for some targeted keywords
but I’m not seeing very good success. If you know of any please share.
Cheers!
В таблице – сжато по каждом формате. Есть аппы и сайты, https://movie2box.com/ позволяющие легально играть на виртуальные (бесплатные) фишки.
Услуга по сносу старых зданий и утилизации отходов в Москве и Московской области. Мы предоставляем услуги по сносу старых сооружений и удалению мусора на территории Москвы и Московской области. Услуга разобрать дом в московской области выполняется квалифицированными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Услуга по сносу старых зданий и утилизации отходов в Москве и Московской области. Мы предоставляем услуги по сносу старых сооружений и удалению мусора на территории Москвы и Московской области. Услуга http://demontazh-doma-msk8.ru выполняется квалифицированными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
I am sure this article has touched all the internet viewers, its really really pleasant post
on building up new web site.
3. укажите ваш е-мейла либо номер телефона,
vavads использованный при регистрации.
my web site vhod-casino
https://kursovuyupishem.ru/
Hi, I do think this is a great web site.
I stumbledupon it 😉 I may return yet again since I bookmarked it.
Money and freedom is the greatest way to change, may
you be rich and continue to help other people.
That is really attention-grabbing, You are a very skilled blogger.
I have joined your feed and look forward to searching for more of your wonderful post.
Additionally, I have shared your site in my social networks
Vermelho (inicial) e estrela (avançado) são dois top100ireland.com níveis
do sistema.
I likе thіs post, enjoyed thіs one aρpreciate it for posting.
Visit my webpage: singapore renovation
Hello would you mind letting me know which webhost you’re using?
I’ve loaded your blog in 3 different browsers and I must say this blog loads a lot faster then most.
Can you recommend a good hosting provider at a honest price?
Many thanks, I appreciate it!
Good blog you have here.. It’s difficult to find
excellent writing like yours these days. I truly appreciate
people like you! Take care!!
I visited multiple web sites however the audio feature for audio songs existing at this site is
in fact fabulous.
Можно сорвать куш в форме jackpot.
Базовая валюта в руме proplayredstarpoker.ru – евро.
Но удобные для вас сроки покамест не становятся известными.
Here is my web site … https://proplayredstarpoker.ru/
Mão (fold) – o jogador avalia que tal cartas mau,
e lida com não continuar ptplayonline888poker.com rodar.
Feel free to surf to my webpage: https://ptplayonline888poker.com/
I am regular visitor, how are you everybody?
This paragraph posted at this website is in fact good.
F*ckin’ amazing things here. I am very glad to see your article. Thanks a lot and i’m looking forward to contact you. Will you kindly drop me a mail?
Meet to our website, your pm online nave because African sports, music, and fame updates. We cover the aggregate from inspiring sports events like the Africa Cup of Nations to the latest trends in Afrobeats and ancestral music. Explore exclusive interviews and features on prominent personalities making waves across the continent and beyond.
At our website, we stipulate convenient and likeable content that celebrates the diversity and vibrancy of African culture. Whether you’re a sports enthusiast, music lover, or eccentric about Africa’s weighty figures, go our community and prevent connected concerning constantly highlights and in-depth stories showcasing the in the most suitable way of African inclination and creativity https://nouvellesafrique.africa/l-inseed-du-togo-est-a-la-recherche-de-talents-et/.
Visit our website today and discover the high-powered men of African sports, music, and famous personalities. Dip yourself in the richness of Africa’s cultural section with us!
Качественное написание рефератов https://referatnovy.ru/, курсовых и дипломных работ от лучших авторов. Уникальные работы под ключ. Заказать студенческую работу за 2 дня.
I do not know whether it’s just me or if everyone else encountering issues with your site.
It appears as though some of the written text within your content are
running off the screen. Can somebody else please comment and let
me know if this is happening to them as well? This could be a issue with my web browser because I’ve
had this happen before. Kudos
update porn
в матчах у них другой вариант – дабы ты сделал пару ребаев и потом закончил в ноль (вернул собственные средства в турнире тебе могут.
My page – https://kzpokerdompro.com/
It’s impressive that you are getting ideas from this article as well as frtom
our discussion made at this time.
Also visit my website :: 카지노사이트
каждый игрок получает по две
карты в закрытую (префлоп), russiaplaypokerking.ru следует круг
торгов.
Hi there, yes this piece of writing is actually fastidious and I have learned lot of things from
it on the topic of blogging. thanks.
Having read this I thought it was really enlightening.
I appreciate you taking the time and energy to put this information together.
I once again find myself spending a lot of
time both reading and leaving comments. But so what,
it was still worth it!
Hi! Someone in my Myspace group shared this website with us so I came to give it a look.
I’m definitely enjoying the information. I’m book-marking
and will be tweeting this to my followers!
Terrific blog and terrific design and style.
Hi there, i read your blog from time to time and i own a similar one and i was just wondering
if you get a lot of spam feedback? If so how do you protect against it, any plugin or anything
you can recommend? I get so much lately it’s driving me mad so any help is very much appreciated.
Microsoft Windows activation keys are actually the gateway to uncovering the total ability of your OS. Whether you are actually an experienced IT professional or even a tech-savvy fanatic, understanding the details of taking care of activation keys may simplify your procedures and ensure conformity with licensing contracts, https://blogfreely.net/claytonimueller/h1-tips-for-acquiring-real-microsoft-windows-activation-key-at-a-lesser.
I am really loving the theme/design of your website.
Do you ever run into any web browser compatibility problems?
A couple of my blog audience have complained about my
website not operating correctly in Explorer but looks great in Firefox.
Do you have any recommendations to help fix this
problem?
в этом случае короб вмонтирован в стену,
сама дверь может быть как распашной, двери из массива аналогично раздвижной.
Hey very interesting blog!
Партнеры pin up получают значительные выгоды
от того подхода, https://nulls-royale.ru/wp-content/pages/realnue_otzuvu_o_pin_up__vubor_polzovateley_android.html основанного на таких.
1.
I’ve been exploring for a little bit for any high quality articles or
blog posts in this kind of space . Exploring in Yahoo I at last stumbled
upon this website. Reading this info So i am happy
to convey that I have a very excellent uncanny feeling
I found out exactly what I needed. I such
a lot certainly will make sure to don?t disregard this site and
give it a glance regularly.
Задвижки запорные для систем очистки газов.
be-systems.ru
PBN sites
We shall generate a web of private blog network sites!
Advantages of our private blog network:
We execute everything SO THAT GOOGLE does not understand THAT this A private blog network!!!
1- We buy web domains from various registrars
2- The primary site is hosted on a VPS hosting (VPS is fast hosting)
3- Other sites are on separate hostings
4- We attribute a individual Google ID to each site with confirmation in Google Search Console.
5- We develop websites on WP, we don’t utilise plugins with the help of which malware penetrate and through which pages on your websites are produced.
6- We never duplicate templates and utilise only exclusive text and pictures
We don’t work with website design; the client, if desired, can then edit the websites to suit his wishes