La fracción molar relaciona el número de mol de soluto con el número de mol total presente en solución. Se designa con la letra X y no presenta unidades.
Matemáticamente se expresa de la siguiente manera:
X = X soluto + X solvente = 1
X = Fracción molar
X soluto (Xsto) = Fracción molar del soluto
X solvente (Xste) = Fracción molar del solvente
La suma de las fracciones molares del soluto y solvente es igual a 1
Otras fórmulas que nos permitirán para hallar fracción molar:

Ejercicios Resueltos
- Se disuelven 40 gramos de etanol en 60 gramos de agua. Calcule la fracción molar de la solución.
Datos:
X = ?
masa soluto = 40 gramos (etanol)
masa solvente = 60 gramos (agua)
Masa molar Etanol = 46 g/mol
Masa molar Agua = 18 g/mol
Paso # 1: Se calcula el mol de soluto y mol de solvente

Paso # 2: Hallamos el mol total
Mol total = mol soluto + mol solvente
Mol total = 0,869 mol + 3,33 mol
Mol total = 4, 12 mol
Paso # 3: Calculamos la fracción molar de soluto y solvente

Paso # 4. Finalmente calculamos la fracción molar de la solución
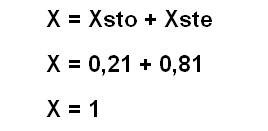
**NOTA** El resultado específico es 1,02 (por las aproximaciones que se realizaron a lo largo del ejercicio) pero como la fracción molar ha de ser igual a la unidad; se desprecia por aproximación los dos números después de la coma y se toma el valor de 1.


Perfecta pedagogía, inteligible y rápidamente comprensible. Gracias.
Excelente profesora, la felicito es la manera mas clara, sencilla y practica de explicar química. Gracias.
Pingback: Propiedades Coligativas: Disminución de la Presión de Vapor - Química en casa.com
I think this is one of the most important information for me.
And i’m glad reading your article. But want to remark on some general things, The site style is ideal, the
articles is really great : D. Good job, cheers
Write more, thats all I have to say. Literally, it seems as though you relied on the
video to make your point. You definitely know what youre
talking about, why waste your intelligence on just posting videos to your blog when you could be giving us something
enlightening to read?
Write more, thats all I have to say. Literally, it seems as though you relied on the video
to make your point. You definitely know what youre talking about, why throw
away your intelligence on just posting videos to your site when you could be giving us something enlightening to read?
Link exchange is nothing else but it is simply
placing the other person’s website link on your page
at appropriate place and other person will also do
similar in support of you.
We are a group of volunteers and opening a new scheme in our community.
Your site provided us with valuable info to work on. You have done an impressive job and
our entire community will be grateful to you.
After looking into a number of the blog posts on your website, I really appreciate your way of blogging.
I book-marked it to my bookmark site list and will be
checking back in the near future. Please check out my website as well and tell
me how you feel.
Hi Dear, are you actually visiting this website daily, if so then you will without doubt obtain pleasant knowledge.
Does your website have a contact page? I’m having
problems locating it but, I’d like to send you an e-mail.
I’ve got some creative ideas for your blog you might be interested in hearing.
Either way, great website and I look forward to seeing it improve over time.
Whoa! This blog looks just like my old one! It’s on a completely different
subject but it has pretty much the same layout and design.
Excellent choice of colors!
Hey! Someone in my Myspace group shared this site with us so I came to give it
a look. I’m definitely enjoying the information. I’m book-marking and will be tweeting
this to my followers! Wonderful blog and excellent design.
I think this is one of the most vital info for me.
And i am glad reading your article. But should remark on few general things, The web site style is
ideal, the articles is really excellent : D.
Good job, cheers
Thank you a lot for sharing this with all people you actually recognize what you’re speaking approximately!
Bookmarked. Please also discuss with my site =). We could have a link trade
arrangement among us
Hello there! This article couldn’t be written much better!
Going through this post reminds me of my previous roommate!
He constantly kept talking about this. I am going to send this information to him.
Fairly certain he’ll have a good read. Thanks for sharing!
Yes! Finally someone writes about forumsemprot.
What’s up, constantly i used to check webpage posts here in the early hours in the break of day, because i enjoy
to gain knowledge of more and more.
Way cool! Some extremely valid points! I appreciate you writing
this post and the rest of the site is really good.
I all the time used to study article in news papers but now as
I am a user of internet so from now I am using net for content,
thanks to web.
Hello! I know this is kind of off topic but I was wondering if you
knew where I could get a captcha plugin for my comment form?
I’m using the same blog platform as yours and I’m having
trouble finding one? Thanks a lot!
Hello mates, its great piece of writing on the topic of teachingand completely defined,
keep it up all the time.
You can certainly see your expertise within the article you write.
The sector hopes for more passionate writers like you who are not
afraid to say how they believe. Always go after your heart.
I’m curious to find out what blog platform you have been utilizing?
I’m having some minor security issues with my latest blog and I would
like to find something more secure. Do you have any solutions?
Hi! This is my first visit to your blog! We are a group of volunteers
and starting a new project in a community in the same niche.
Your blog provided us useful information to work on.
You have done a outstanding job!
If you would like to grow your familiarity just keep visiting this web
site and be updated with the newest information posted here.
Thanks for your personal marvelous posting! I really enjoyed reading
it, you can be a great author. I will remember to bookmark your blog and
will often come back very soon. I want to encourage you continue
your great work, have a nice day!
I was wondering if you ever thought of changing the page layout
of your website? Its very well written; I love what youve got to say.
But maybe you could a little more in the way of
content so people could connect with it better.
Youve got an awful lot of text for only having one or 2 pictures.
Maybe you could space it out better?
I have read so many articles or reviews regarding the blogger lovers except this paragraph is in fact
a nice piece of writing, keep it up.
I’m really enjoying the theme/design of your weblog. Do you ever run into any internet browser compatibility issues?
A small number of my blog readers have complained about my site not operating correctly in Explorer but looks great in Opera.
Do you have any suggestions to help fix this problem?
Pretty section of content. I just stumbled upon your web
site and in accession capital to claim that I acquire in fact loved account your blog posts.
Any way I will be subscribing in your augment and even I success you get entry
to persistently rapidly.
I have read so many posts concerning the blogger lovers but this paragraph is really a fastidious
piece of writing, keep it up.
Hi there to every , for the reason that I am in fact
keen of reading this web site’s post to be updated regularly.
It carries nice information.
A fascinating discussion is worth comment. I do believe that you ought to publish
more on this subject matter, it may not be a taboo subject
but typically people do not speak about these topics.
To the next! Kind regards!!
I’m gone to tell my little brother, that he should also pay a quick visit this website on regular basis to obtain updated from hottest news
update.
Fantastic post however , I was wondering if you could write a litte more on this topic?
I’d be very grateful if you could elaborate a
little bit more. Kudos!
Hey there! I just wish to offer you a big thumbs up for your excellent information you’ve got right here on this post.
I will be returning to your web site for more soon.
This post provides clear idea for the new viewers of blogging, that genuinely how to
do blogging and site-building.
I was excited to discover this page. I need to to thank you
for ones time for this particularly fantastic read!!
I definitely liked every bit of it and i also have you saved to fav
to check out new information in your website.
Its like you learn my mind! You appear to understand so much approximately this, such as you wrote the ebook in it or something.
I think that you could do with some p.c. to power the message house a little
bit, but instead of that, that is great blog. An excellent read.
I will certainly be back.
A motivating discussion is worth comment. There’s no doubt that that you need to write more
on this subject matter, it may not be a taboo subject but generally people don’t discuss these subjects.
To the next! Many thanks!!
That is a very good tip particularly to those fresh to the blogosphere.
Brief but very accurate information… Thanks for sharing this one.
A must read post!
Hi, just wanted to say, I loved this blog post. It was practical.
Keep on posting!
I’m now not positive where you are getting your information, however good topic.
I needs to spend a while finding out much more or working out more.
Thanks for great info I was looking for this info for my mission.
Whats up very cool site!! Man .. Beautiful .. Superb .. I will bookmark your
web site and take the feeds also? I’m glad to seek out numerous useful info right here in the publish, we’d
like develop extra techniques on this regard, thank you
for sharing. . . . . .
Thanks for sharing your thoughts. I truly appreciate your efforts
and I will be waiting for your further post thanks once again.
Wonderful items from you, man. I have take note your stuff prior
to and you’re just extremely great. I actually like what you have
received right here, really like what you’re stating and the way in which wherein you are
saying it. You make it entertaining and you still take care
of to keep it sensible. I cant wait to read much more from you.
That is actually a great site.
No matter if some one searches for his vital thing, therefore he/she wishes to be available that in detail, therefore that thing
is maintained over here.
Excellent article! We are linking to this particularly great content on our website.
Keep up the good writing.
Asking questions are genuinely nice thing if you are not understanding anything fully, but this piece of writing offers fastidious understanding even.
Hey, I think your site might be having browser compatibility issues.
When I look at your blog site in Chrome, it looks fine but when opening in Internet Explorer, it has some overlapping.
I just wanted to give you a quick heads up! Other then that, superb blog!
I loved as much as you’ll receive carried out right here.
The sketch is attractive, your authored subject matter stylish.
nonetheless, you command get got an impatience over that you wish be delivering
the following. unwell unquestionably come further formerly again since exactly the same
nearly a lot often inside case you shield this increase.
I just like the valuable info you supply for your articles.
I’ll bookmark your weblog and take a look at once more here regularly.
I’m fairly certain I’ll learn a lot of new stuff proper right
here! Best of luck for the following!
I am sure this post has touched all the internet people, its really really good
piece of writing on building up new webpage.
Why visitors still use to read news papers when in this technological globe everything is presented on web?
I have learn several excellent stuff here. Definitely worth bookmarking for
revisiting. I wonder how much effort you set to make this kind of great informative site.
Greetings! Very useful advice in this particular article!
It is the little changes that produce the biggest changes.
Many thanks for sharing!
Hi, I do believe this is a great blog. I stumbledupon it 😉 I may return once again since i have saved
as a favorite it. Money and freedom is the best way to change, may
you be rich and continue to help others.
Pretty component to content. I simply stumbled upon your blog and in accession capital to assert that I
get in fact loved account your blog posts.
Anyway I’ll be subscribing to your augment or even I achievement you
get right of entry to constantly rapidly.
Howdy would you mind letting me know which webhost you’re
working with? I’ve loaded your blog in 3 different internet browsers and I must say
this blog loads a lot quicker then most. Can you suggest a good internet
hosting provider at a reasonable price? Cheers, I appreciate
it!
What’s up, yeah this article is really pleasant and I have learned lot of things from it concerning blogging.
thanks.
Hi, I do think this is an excellent website. I stumbledupon it 😉 I will come back once again since i have
book-marked it. Money and freedom is the best
way to change, may you be rich and continue to help other people.
Yesterday, while I was at work, my sister stole my iphone and tested to see if it can survive a forty foot drop,
just so she can be a youtube sensation. My iPad is now broken and she has 83 views.
I know this is totally off topic but I had to share it with someone!
We stumbled over here coming from a different web address and thought I
may as well check things out. I like what I see so now i
am following you. Look forward to finding out about your web page for a
second time.
Hi, always i used to check website posts here in the early hours in the daylight,
since i like to gain knowledge of more and more.
What’s Happening i am new to this, I stumbled
upon this I’ve found It absolutely useful and it has helped me out loads.
I hope to give a contribution & assist different users
like its helped me. Great job.
First off I would like to say awesome blog! I had a quick question which I’d like to ask if you do not mind.
I was curious to know how you center yourself and clear your thoughts prior to writing.
I’ve had difficulty clearing my thoughts
in getting my thoughts out. I truly do take pleasure in writing however
it just seems like the first 10 to 15 minutes tend to be wasted just trying to figure out how to begin. Any recommendations or tips?
Thank you!
I blog quite often and I seriously thank you
for your information. The article has truly peaked my interest.
I will bookmark your website and keep checking for new details about
once per week. I opted in for your Feed too.
obviously like your website but you need to take a look at the spelling on several of your posts.
A number of them are rife with spelling problems and I to find it very troublesome to tell the reality nevertheless I’ll surely come again again.
Hello, all the time i used to check weblog posts here
in the early hours in the break of day, for the reason that i love to learn more
and more.
Appreciating the commitment you put into your website
and detailed information you offer. It’s good to come across
a blog every once in a while that isn’t the same unwanted rehashed material.
Great read! I’ve bookmarked your site and I’m including your RSS feeds to my Google account.
Oh my goodness! Incredible article dude! Thank you
so much, However I am encountering issues with your RSS.
I don’t know the reason why I am unable to join it. Is there anyone else getting the same RSS problems?
Anybody who knows the answer can you kindly respond?
Thanx!!
Piece of writing writing is also a fun, if you be acquainted with then you can write
or else it is complicated to write.
Excellent beat ! I would like to apprentice while you amend your
website, how could i subscribe for a blog site?
The account helped me a acceptable deal.
I had been tiny bit acquainted of this your broadcast offered bright
clear idea
I believe everything published was very reasonable.
But, think about this, suppose you added a little information?
I ain’t saying your content isn’t good, but suppose you added a
title that makes people desire more? I mean Fracción Molar (Ejercicios
Resueltos) – Química en casa.com is a little vanilla.
You could glance at Yahoo’s front page and watch how they create post headlines
to get people to open the links. You might try adding a video or a picture or two to grab people interested about everything’ve written. Just my opinion, it might bring your
website a little livelier.
Have you ever thought about including a little bit more
than just your articles? I mean, what you say is fundamental and everything.
But think about if you added some great visuals
or videos to give your posts more, «pop»! Your content is excellent but with images and videos, this website could definitely be one of the best in its niche.
Amazing blog!
I really like it when individuals come together and share thoughts.
Great site, keep it up!
Good blog you have here.. It’s difficult to find quality writing like yours nowadays.
I seriously appreciate people like you! Take care!!
Hey There. I found your blog using msn. This is an extremely well
written article. I will be sure to bookmark it and come
back to read more of your useful information. Thanks for the post.
I will certainly return.
It’s an remarkable post for all the internet visitors; they will
obtain benefit from it I am sure.
Thank you for the good writeup. It in reality was once a
enjoyment account it. Look advanced to more introduced agreeable from you!
By the way, how could we keep in touch?
Hello, I think your blog might be having browser compatibility issues.
When I look at your blog in Opera, it looks fine but when opening in Internet Explorer, it has some
overlapping. I just wanted to give you a quick
heads up! Other then that, great blog!
I’m amazed, I have to admit. Rarely do I encounter a blog that’s both educative and amusing, and
without a doubt, you have hit the nail on the head.
The problem is something too few people are speaking intelligently about.
I am very happy that I stumbled across this during
my hunt for something relating to this.
Excellent post. I was checking constantly this
blog and I am impressed! Very helpful information specially the last part 🙂 I care for such info
a lot. I was looking for this particular info for a long time.
Thank you and best of luck.
I do trust all of the ideas you have presented for your post.
They are very convincing and can definitely work. Still, the posts
are very brief for beginners. May you please lengthen them a little from subsequent time?
Thanks for the post.
I am extremely impressed along with your writing talents as neatly as with the format on your
blog. Is this a paid theme or did you modify it yourself?
Anyway stay up the excellent quality writing, it’s rare to look a
nice blog like this one these days..
Hi outstanding blog! Does running a blog like this take a great deal of work?
I’ve no knowledge of coding however I had been hoping to start my
own blog in the near future. Anyways, should
you have any suggestions or tips for new blog owners please share.
I know this is off subject nevertheless I simply
needed to ask. Kudos!
Hi there, i read your blog from time to time and i own a similar
one and i was just wondering if you get a lot of spam comments?
If so how do you protect against it, any plugin or
anything you can suggest? I get so much lately it’s driving me crazy so
any assistance is very much appreciated.
Undeniably believe that which you said. Your favorite
reason seemed to be on the net the easiest thing to
be aware of. I say to you, I certainly get irked while people consider worries that they plainly do
not know about. You managed to hit the nail upon the
top and defined out the whole thing without having side-effects , people can take a signal.
Will probably be back to get more. Thanks
I was curious if you ever considered changing the layout of
your blog? Its very well written; I love what
youve got to say. But maybe you could a little more in the way
of content so people could connect with it better. Youve got
an awful lot of text for only having 1 or 2 images.
Maybe you could space it out better?
Having read this I believed it was rather enlightening. I appreciate you finding
the time and energy to put this content together. I once again find myself personally spending
a lot of time both reading and leaving comments.
But so what, it was still worthwhile!
I’m very happy to uncover this site. I want to to thank
you for ones time due to this wonderful read!! I definitely
really liked every part of it and I have you bookmarked to look at new things
on your web site.
It’s an awesome piece of writing in favor of all the online viewers; they will take benefit from it I am sure.
These are really enormous ideas in on the topic of blogging.
You have touched some pleasant things here. Any way keep up wrinting.
Hi there, I read your new stuff daily. Your humoristic style is awesome, keep up the good
work!
Fantastic beat ! I would like to apprentice while you amend
your web site, how could i subscribe for a blog website?
The account aided me a acceptable deal. I had been a little bit acquainted of
this your broadcast provided bright clear concept
This article will assist the internet users for setting up new blog or even a weblog from start to end.
Great information. Lucky me I discovered your website by
chance (stumbleupon). I’ve saved it for later!
I know this if off topic but I’m looking into starting my own weblog and was wondering what all is required to
get set up? I’m assuming having a blog like yours would cost a pretty
penny? I’m not very web smart so I’m not 100% sure.
Any recommendations or advice would be greatly appreciated.
Cheers
Good article! We will be linking to this particularly great post on our site.
Keep up the great writing.
I love your blog.. very nice colors & theme. Did you design this website yourself or did you hire someone to do it
for you? Plz reply as I’m looking to create my own blog and would like to know where u got this from.
kudos
Казино — это место, где люди могут сыграть в азартные игры на деньги. Такие игры, как рулетка, блэкджек и игровые автоматы, доступны в казино. Хотя многие люди наслаждаются азартными играми, они также могут быть опасными и вызывать зависимость.
Рабочие Зеркала Джойказино
Казино могут быть опасными из-за того, что они могут привести к потере больших сумм денег. Люди, которые не могут контролировать свою игру, могут потерять свои сбережения или даже деньги, которые они не могут позволить себе потерять. Это может привести к финансовым проблемам и даже к банкротству.
Кроме того, казино могут быть опасными из-за того, что они могут способствовать развитию зависимости от азартных игр. Люди, которые играют в азартные игры, могут стать зависимыми от ощущений, которые они получают от игры, и они могут продолжать играть, даже если они теряют все свои деньги. Это может привести к серьезным проблемам со здоровьем и отношениями.
Joycasino Казино
https://elitetopcasino.ru/info/kak-igrat-v-kazino-na-kriptovaljuty-poleznye-sovety/
Кроме того, казино могут быть опасными из-за того, что они могут привлекать преступность. Казино могут быть местом, где происходят кражи, мошенничества и другие преступления. Это может привести к тому, что люди будут чувствовать себя небезопасно, когда они посещают казино.
В целом, казино могут быть опасными из-за потери денег, развития зависимости от азартных игр и преступности. Люди должны быть осторожны, когда они посещают казино, и они должны знать свои личные пределы, чтобы избежать проблем. Если вы или кто-то из ваших близких страдает от зависимости от азартных игр, то обратитесь за помощью к специалистам.
This website was… how do you say it? Relevant!! Finally I’ve found something which helped me.
Thanks a lot!
Hi there, I wish for to subscribe for this
weblog to obtain most recent updates, so where
can i do it please help.
Wow that was strange. I just wrote an incredibly long comment but
after I clicked submit my comment didn’t show up. Grrrr…
well I’m not writing all that over again. Anyhow, just
wanted to say fantastic blog!
Nice weblog right here! Additionally your site rather a lot up very fast!
What host are you the use of? Can I am getting your affiliate hyperlink in your host?
I desire my website loaded up as fast as yours lol
This design is spectacular! You certainly know how to keep a reader
amused. Between your wit and your videos, I was almost moved to
start my own blog (well, almost…HaHa!) Fantastic job.
I really enjoyed what you had to say, and more than that, how you presented
it. Too cool!
Heya! I just wanted to ask if you ever have any issues with hackers?
My last blog (wordpress) was hacked and I
ended up losing many months of hard work due to no back up.
Do you have any solutions to stop hackers?
you are in point of fact a excellent webmaster. The site loading speed is incredible.
It sort of feels that you are doing any distinctive trick.
Furthermore, The contents are masterpiece. you’ve done
a excellent activity on this matter!
If some one wishes to be updated with newest technologies after that he must be pay a quick visit this web page and be up to date
daily.
I think that what you said made a ton of sense. But, what about this?
what if you wrote a catchier post title? I mean, I don’t want
to tell you how to run your blog, but suppose you added a headline that makes people want more?
I mean Fracción Molar (Ejercicios Resueltos)
– Química en casa.com is kinda boring. You could peek at Yahoo’s home page and see how they write post headlines
to get viewers interested. You might try adding a video or
a related pic or two to grab readers excited about what you’ve got
to say. In my opinion, it could make your website a little livelier.
Having read this I believed it was really informative. I appreciate
you finding the time and energy to put this content together.
I once again find myself spending a lot of time both reading and leaving comments.
But so what, it was still worthwhile!
I quite like reading a post that will make people
think. Also, many thanks for permitting me to comment!
whoah this blog is wonderful i love studying your posts.
Stay up the great work! You understand, a lot of persons
are hunting around for this information, you could help them greatly.
We are a group of volunteers and starting a
new scheme in our community. Your site offered us with valuable info to work on. You’ve done a
formidable job and our whole community will be grateful to you.
hi!,I like your writing so so much! proportion we keep up a correspondence extra approximately your article on AOL?
I require an expert on this area to solve my problem.
May be that’s you! Having a look ahead to peer you.
Hmm is anyone else having problems with the images on this blog loading?
I’m trying to determine if its a problem on my
end or if it’s the blog. Any feedback would be greatly appreciated.
Hey there, I think your website might be having browser compatibility issues.
When I look at your blog site in Firefox, it looks fine but when opening in Internet Explorer, it
has some overlapping. I just wanted to give you a quick heads up!
Other then that, wonderful blog!
I always emailed this blog post page to all my associates, for the reason that if like to read it after that my contacts will too.
Hey there exceptional blog! Does running a blog like this require a lot of work?
I’ve virtually no understanding of computer programming however I was hoping to start my own blog in the near
future. Anyways, if you have any ideas or techniques for new blog
owners please share. I know this is off subject however I just wanted to ask.
Thanks a lot!
Why users still make use of to read news papers when in this technological globe the whole
thing is existing on net?
I blog frequently and I genuinely appreciate your content.
This great article has really peaked my interest.
I am going to take a note of your site and keep checking for new
information about once a week. I subscribed to your RSS feed too.
Asking questions are really fastidious thing if you
are not understanding something fully, except this piece of writing gives nice
understanding yet.
Hello there, I found your web site by the use of Google while searching for a comparable
matter, your site came up, it seems to be great. I have bookmarked
it in my google bookmarks.
Hi there, just was aware of your weblog via Google, and
located that it’s truly informative. I am going to watch out for brussels.
I will appreciate in the event you continue this in future.
Numerous other folks can be benefited from your writing. Cheers!
Howdy this is somewhat of off topic but I was wondering if
blogs use WYSIWYG editors or if you have to manually code with HTML.
I’m starting a blog soon but have no coding know-how so I wanted to get guidance from
someone with experience. Any help would be enormously appreciated!
You are so cool! I don’t think I have read through something like this before.
So great to discover someone with a few original thoughts
on this topic. Really.. thanks for starting this up.
This web site is one thing that is needed on the internet,
someone with a bit of originality!
whoah this blog is magnificent i like reading your articles.
Keep up the good work! You recognize, many individuals are hunting round for
this information, you could aid them greatly.
Greetings from Florida! I’m bored to tears at work so I decided to check out your site on my iphone during lunch
break. I really like the info you provide here and
can’t wait to take a look when I get home. I’m surprised at how fast
your blog loaded on my phone .. I’m not even using WIFI, just 3G ..
Anyways, awesome blog!
Touche. Outstanding arguments. Keep up the great spirit.
My brother suggested I might like this blog. He was totally right.
This post truly made my day. You can not imagine simply how much time I had spent for this information! Thanks!
Oh my goodness! Impressive article dude! Thank you, However
I am experiencing troubles with your RSS. I don’t know why I cannot subscribe to it.
Is there anyone else getting similar RSS issues? Anyone who knows
the answer will you kindly respond? Thanx!!
China Failed to Sway Taiwan’s Election. What Happens Now?
mega gl
China’s leader, Xi Jinping, has tied his country’s great power status to a singular promise: unifying the motherland with Taiwan, which the Chinese Communist Party sees as sacred, lost territory. A few weeks ago, Mr. Xi called this a “historical inevitability.”
But Taiwan’s election on Saturday, handing the presidency to a party that promotes the island’s separate identity for the third time in a row, confirmed that this boisterous democracy has moved even further away from China and its dream of unification.
After a campaign of festival-like rallies, where huge crowds shouted, danced and waved matching flags, Taiwan’s voters ignored China’s warnings that a vote for the Democratic Progressive Party was a vote for war. They made that choice anyway.
Lai Ching-te, a former doctor and the current vice president, who Beijing sees as a staunch separatist, will be Taiwan’s next leader. It’s an act of self-governed defiance that proved what many already knew: Beijing’s arm-twisting of Taiwan — economically and with military harassment at sea and in the air — has only strengthened the island’s desire to protect its de facto independence and move beyond China’s giant shadow.
Hello! This is my first visit to your blog! We
are a collection of volunteers and starting a new project in a community in the same
niche. Your blog provided us useful information to work on. You have
done a outstanding job!
My brother suggested I might like this web site.
He was totally right. This post actually made my day.
You cann’t imagine just how much time I had spent for this information! Thanks!
It’s perfect time to make some plans for the future and it
is time to be happy. I’ve read this post and if I could I desire
to suggest you some interesting things or tips. Perhaps you can write next articles referring to this article.
I want to read even more things about it!
I think this is among the most vital information for me.
And i am glad reading your article. But wanna remark on some general things, The web site style
is wonderful, the articles is really nice : D. Good job, cheers
Excellent website you have here but I was wanting to know
if you knew of any community forums that cover the same
topics discussed in this article? I’d really love to be a part of
group where I can get comments from other knowledgeable individuals that
share the same interest. If you have any suggestions, please
let me know. Thank you!
Hi to all, how is all, I think every one is getting more from this web site,
and your views are good in favor of new visitors.
Write more, thats all I have to say. Literally, it seems as though
you relied on the video to make your point. You clearly know what youre talking about,
why throw away your intelligence on just posting videos to
your blog when you could be giving us something informative to read?
Hi i am kavin, its my first time to commenting anyplace, when i read this article i thought i could also create comment due to
this brilliant paragraph.
If some one desires expert view regarding blogging then i propose him/her to
pay a visit this weblog, Keep up the pleasant job.
I used to be suggested this blog through my cousin. I am not positive whether or not
this post is written by him as no one else understand such distinctive
approximately my problem. You are incredible! Thank you!
Hi there, I enjoy reading all of your article. I like to write a little comment to support
you.
Hello my family member! I want to say that
this post is amazing, nice written and include almost all vital infos.
I would like to see extra posts like this .
Way cool! Some very valid points! I appreciate you penning this article and the rest of the site is also really good.
Do you have a spam issue on this blog; I also am a blogger, and I was
wanting to know your situation; we have created some nice procedures
and we are looking to swap methods with others, please shoot me an email if interested.
Hey! I know this is kinda off topic however I’d figured I’d ask.
Would you be interested in trading links or maybe guest writing a
blog post or vice-versa? My site goes over a lot of the same topics as yours and I think we could greatly benefit
from each other. If you happen to be interested feel free to shoot me an email.
I look forward to hearing from you! Awesome blog by the way!
Excellent article! We will be linking to this great post on our website.
Keep up the good writing.
Hi there, You have done a great job. I’ll definitely digg it and personally suggest to my friends.
I’m sure they’ll be benefited from this site.
Excellent blog! Do you have any suggestions for aspiring writers?
I’m planning to start my own blog soon but I’m a little lost on everything.
Would you recommend starting with a free platform like WordPress or go for
a paid option? There are so many choices out there that I’m completely confused ..
Any ideas? Thanks a lot!
Ahaa, its fastidious conversation concerning this post here at
this website, I have read all that, so now me also commenting here.
When some one searches for his essential thing, so
he/she needs to be available that in detail, thus that thing is maintained over here.
I have been browsing online more than three hours today, yet
I never found any interesting article like yours.
It is pretty worth enough for me. In my opinion, if all
site owners and bloggers made good content as you did, the
internet will be much more useful than ever before.
Very descriptive article, I loved that bit. Will there be a part 2?
Can I just say what a comfort to discover someone who truly understands what they’re talking about on the net.
You certainly understand how to bring a problem
to light and make it important. A lot more people need to
read this and understand this side of the story. I was surprised that you are not more popular since you most certainly have the gift.
Hey There. I found your weblog the usage of msn. That is a very neatly written article.
I’ll make sure to bookmark it and come back to learn extra of your helpful information. Thank you for the post.
I will certainly comeback.
I am extremely inspired with your writing abilities as neatly as with the
layout on your weblog. Is this a paid theme or did you customize it
yourself? Anyway stay up the excellent high quality writing, it is
rare to look a nice blog like this one today..
Generally I do not read article on blogs, however I would like to say that this write-up very forced me to check out and do it!
Your writing taste has been surprised me. Thanks, quite great article.
I think the admin of this web site is really working hard for his web site, for the reason that here every
data is quality based data.
Hi, i believe that i saw you visited my weblog so i got here to return the desire?.I am attempting to find things to enhance my website!I suppose
its good enough to use some of your ideas!!
Hello i am kavin, its my first time to commenting anywhere, when i read this article i thought i could also make comment due to this brilliant paragraph.
Hi there, after reading this remarkable paragraph i am as well happy to share my experience here with mates.
I’m really enjoying the theme/design of your weblog. Do you ever
run into any web browser compatibility issues? A number of my blog
audience have complained about my blog not working correctly in Explorer but looks great in Opera.
Do you have any recommendations to help fix this
issue?
Attractive element of content. I simply stumbled upon your website and in accession capital to assert that I get in fact enjoyed
account your weblog posts. Any way I will be subscribing
on your feeds and even I achievement you get
admission to constantly rapidly.
It’s an awesome post in support of all the web visitors; they will obtain advantage from it I am sure.
Awesome! Its genuinely amazing piece of writing, I have got
much clear idea on the topic of from this post.
What’s up to every one, since I am actually eager of reading this web site’s post to be updated daily.
It carries fastidious stuff.
Hello! Would you mind if I share your blog with my facebook group?
There’s a lot of people that I think would really enjoy your content.
Please let me know. Cheers
Thanks for your marvelous posting! I actually
enjoyed reading it, you happen to be a great author.I will make certain to bookmark your blog and definitely will come back at some point.
I want to encourage continue your great posts, have a nice
weekend!
What’s up to every single one, it’s in fact a pleasant for me to pay a visit this web site, it includes valuable Information.
It’s impressive that you are getting ideas from this article
as well as from our discussion made at this time.
What a data of un-ambiguity and preserveness of precious knowledge regarding unpredicted feelings.
magnificent submit, very informative. I ponder why
the opposite specialists of this sector don’t realize this.
You should continue your writing. I am sure, you have a great readers’ base already!
You really make it seem so easy along with your presentation however I find this topic to be actually one thing that I think I might
by no means understand. It kind of feels
too complicated and very extensive for me.
I am looking ahead to your subsequent put up, I’ll attempt to get the grasp of it!
Just wish to say your article is as surprising.
The clearness in your post is just excellent and i could
assume you’re an expert on this subject. Well with
your permission allow me to grab your RSS feed to keep up to date with forthcoming post.
Thanks a million and please keep up the enjoyable work.
Hmm it appears like your site ate my first comment (it was extremely long)
so I guess I’ll just sum it up what I wrote and say, I’m thoroughly enjoying your blog.
I too am an aspiring blog blogger but I’m still new to the whole thing.
Do you have any tips and hints for inexperienced blog writers?
I’d definitely appreciate it.
Does your site have a contact page? I’m having problems locating it but,
I’d like to shoot you an email. I’ve got some ideas for
your blog you might be interested in hearing. Either way,
great site and I look forward to seeing it improve over time.
Excellent post. I was checking continuously this blog
and I’m impressed! Very useful information particularly the last part
🙂 I care for such info a lot. I was seeking this certain information for a very long
time. Thank you and best of luck.
It’s awesome in favor of me to have a web site, which is good in support of my knowledge.
thanks admin
I read this article fully about the difference of hottest and preceding technologies, it’s awesome article.
Good day! I could have sworn I’ve been to this blog before but after reading through some of the post I
realized it’s new to me. Anyhow, I’m definitely delighted
I found it and I’ll be bookmarking and checking back often!
I just couldn’t leave your site prior to suggesting that I actually loved
the usual information a person supply for your guests?
Is gonna be again regularly to check out new posts
My relatives every time say that I am wasting my time here at web,
except I know I am getting familiarity every day by reading
thes nice articles or reviews.
Good blog post. I definitely love this site. Thanks!
It is the best time to make some plans for the future and it is time to be happy.
I have read this post and if I could I want to suggest you few interesting things or advice.
Maybe you can write next articles referring to this article.
I wish to read even more things about it!
I’m gone to convey my little brother, that he
should also go to see this website on regular basis to obtain updated from most recent gossip.
My brother recommended I would possibly like this blog.
He used to be entirely right. This submit truly made my day.
You cann’t believe just how much time I had
spent for this info! Thank you!
I read this article fully concerning the comparison of newest and earlier technologies, it’s amazing article.
Thanks to my father who shared with me regarding this weblog,
this webpage is really amazing.
WOW just what I was looking for. Came here by searching for
link bokep
When someone writes an piece of writing he/she keeps the idea of a user in his/her mind that how a
user can be aware of it. Thus that’s why this piece of writing is great.
Thanks!
I do believe all the ideas you’ve introduced for your post.
They are really convincing and can certainly work.
Nonetheless, the posts are very brief for beginners. May just you please prolong
them a bit from subsequent time? Thank you for the post.
Excellent blog here! Also your site loads up fast!
What host are you using? Can I get your affiliate link to your host?
I wish my web site loaded up as quickly as yours
lol
Unquestionably believe that which you stated. Your favourite reason seemed to be on the internet the simplest factor to take
into accout of. I say to you, I definitely
get irked while people consider worries that they just don’t recognise about.
You controlled to hit the nail upon the highest and also outlined out the
whole thing with no need side effect , other people can take a signal.
Will likely be again to get more. Thank you
I am sure this piece of writing has touched all the internet viewers, its really really pleasant paragraph on building up new web site.
Asking questions are in fact nice thing if
you are not understanding something entirely, except this
paragraph gives fastidious understanding yet.
Having read this I thought it was rather enlightening.
I appreciate you finding the time and energy to put this information together.
I once again find myself spending way too much time both reading and leaving comments.
But so what, it was still worthwhile!
Good day! This is my 1st comment here so I just wanted to give a quick shout out and say I truly enjoy reading your articles.
Can you suggest any other blogs/websites/forums that deal with the same subjects?
Thanks for your time!
When some one searches for his required thing, so he/she wants
to be available that in detail, therefore that thing is maintained over here.
Thanks for sharing your thoughts on ip gocrot.
Regards
First of all I want to say awesome blog! I had a quick question that I’d like
to ask if you do not mind. I was interested to find out how you center yourself and clear
your thoughts before writing. I’ve had a difficult time
clearing my mind in getting my thoughts out. I truly do enjoy writing but it just seems like the first 10 to 15 minutes tend to be
wasted just trying to figure out how to begin. Any recommendations or tips?
Thank you!
You should take part in a contest for one
of the most useful blogs online. I will highly recommend this web site!
Why users still make use of to read news papers when in this technological world the
whole thing is existing on net?
Amazing! Its truly awesome paragraph, I have got much clear idea regarding from this paragraph.
This article offers clear idea designed for the new viewers of blogging, that genuinely how to do running a blog.
Thanks for the marvelous posting! I definitely enjoyed reading it,
you can be a great author. I will be sure to bookmark
your blog and will often come back in the future.
I want to encourage yourself to continue your great posts, have a nice evening!
Please let me know if you’re looking for a article author for
your blog. You have some really great articles and I feel I would be a good
asset. If you ever want to take some of the load off, I’d love to write some material for
your blog in exchange for a link back to mine.
Please send me an email if interested. Thanks!
Thanks for the good writeup. It in fact was a
leisure account it. Glance complicated to far introduced agreeable from you!
By the way, how could we keep in touch?
I’m really impressed with your writing skills as well as with the layout on your blog.
Is this a paid theme or did you customize it yourself?
Anyway keep up the nice quality writing, it is rare to see a nice blog like this one these
days.
You really make it seem so easy with your presentation but I find this topic
to be really something which I think I would never understand.
It seems too complex and very broad for me. I’m looking forward for your next post,
I’ll try to get the hang of it!
I visited multiple web sites but the audio quality for audio songs existing at this web site
is truly wonderful.
Outstanding post however I was wanting to know if you could write a litte more on this topic?
I’d be very thankful if you could elaborate a little bit further.
Many thanks!
Wonderful beat ! I wish to apprentice whilst you amend your site, how could i subscribe for a weblog site?
The account helped me a appropriate deal. I have been a
little bit familiar of this your broadcast offered brilliant clear
concept
Hello! I could have sworn I’ve been to this blog before but after browsing through some of the post I realized it’s new to me.
Anyways, I’m definitely delighted I found it and I’ll be bookmarking and checking back often!
Fabulous, what a weblog it is! This web site provides useful facts to us, keep it up.
Appreciate the recommendation. Let me try it out.
We absolutely love your blog and find the majority of your post’s
to be what precisely I’m looking for. Do you offer guest writers to
write content for you? I wouldn’t mind producing a post or elaborating on most of the subjects you write concerning here.
Again, awesome web site!
Thanks for ones marvelous posting! I seriously enjoyed reading it, you will
be a great author.I will remember to bookmark your blog and will often come
back from now on. I want to encourage continue your great posts, have a nice morning!
I used to be able to find good info from your blog posts.
Incredible story there. What occurred after? Good luck!
I was able to find good info from your content.
I know this site offers quality dependent articles or reviews and
extra material, is there any other site which presents these things in quality?
When I initially commented I clicked the «Notify me when new comments are added» checkbox and now each time a
comment is added I get several emails with the same comment.
Is there any way you can remove people from that service?
Cheers!
Spot on with this write-up, I truly believe this web site
needs far more attention. I’ll probably be back again to read more, thanks
for the advice!
What’s up to all, how is all, I think every one is
getting more from this website, and your views are nice
in support of new viewers.
Thank you for another informative blog. Where else may I am getting that kind of information written in such a perfect method?
I’ve a undertaking that I’m just now operating on, and
I have been at the glance out for such information.
Hello excellent website! Does running a blog similar to this require a massive amount
work? I’ve virtually no expertise in coding but I was
hoping to start my own blog in the near future. Anyway, if you have any recommendations or techniques for new blog owners please share.
I understand this is off topic but I just needed to ask.
Cheers!
Hi there to every body, it’s my first pay a quick visit of this
web site; this weblog consists of amazing and
actually excellent data for readers.
Fantastic beat ! I would like to apprentice while you amend your website, how can i subscribe for a blog website?
The account aided me a acceptable deal. I had been a little bit
acquainted of this your broadcast provided bright clear idea
If you would like to take a good deal from this article then you have to apply such techniques to your won web site.
Today, I went to the beachfront with my children. I found a sea shell and gave it to my
4 year old daughter and said «You can hear the ocean if you put this to your ear.» She put the shell to her ear and
screamed. There was a hermit crab inside and it pinched her ear.
She never wants to go back! LoL I know this is entirely off topic but I
had to tell someone!
Pretty nice post. I simply stumbled upon your blog and wished to
mention that I have really loved browsing your weblog posts.
After all I will be subscribing for your rss feed and I hope you write once more
very soon!
Yes! Finally something about forum lendir.
I blog quite often and I genuinely thank you for your information. The article
has really peaked my interest. I will take a note of your site and keep checking for new information about once per
week. I subscribed to your RSS feed too.
Have you ever considered writing an ebook or guest authoring on other websites?
I have a blog based on the same information you discuss and would really like
to have you share some stories/information. I know my
viewers would value your work. If you are even remotely interested, feel free to send me an e mail.
This web site truly has all the info I needed about this subject and didn’t know who
to ask.
Hello very nice blog!! Man .. Excellent .. Amazing ..
I’ll bookmark your website and take the feeds also? I am glad to search out numerous helpful info right here within the submit, we’d like develop more techniques in this regard, thank you for sharing.
. . . . .
My brother recommended I would possibly like this blog.
He was once totally right. This post truly made my day.
You cann’t believe simply how a lot time I
had spent for this info! Thank you!
I really love your blog.. Excellent colors & theme.
Did you develop this web site yourself? Please reply
back as I’m hoping to create my own blog and want to
learn where you got this from or exactly what the theme is named.
Thanks!
Link exchange is nothing else however it is only placing the
other person’s weblog link on your page at suitable place and other person will also do similar for you.
I have read so many posts on the topic of the blogger lovers except this piece of writing is in fact a fastidious piece
of writing, keep it up.
Hello There. I found your weblog using msn. This is an extremely neatly written article.
I will be sure to bookmark it and come back to read
more of your useful information. Thank you for the post.
I will definitely comeback.
Sweet blog! I found it while browsing on Yahoo News.
Do you have any tips on how to get listed in Yahoo News?
I’ve been trying for a while but I never seem to get there!
Thank you
I love what you guys are usually up too. This sort of clever work and exposure!
Keep up the terrific works guys I’ve you guys to blogroll.
Amazing issues here. I’m very happy to look
your post. Thank you so much and I am taking a look forward to contact you.
Will you please drop me a e-mail?
It’s a shame you don’t have a donate button! I’d without a
doubt donate to this fantastic blog! I guess for now i’ll settle for book-marking and adding your RSS feed
to my Google account. I look forward to brand new updates
and will share this website with my Facebook group.
Chat soon!
This is a topic that’s near to my heart… Best wishes!
Where are your contact details though?
Keep on working, great job!
Thank you, I have recently been searching for
info about this topic for ages and yours is the
best I have found out so far. However, what
in regards to the bottom line? Are you positive about the
supply?
Hurrah, that’s what I was exploring for, what a material!
existing here at this weblog, thanks admin of this web
page.
I’d like to find out more? I’d love to find out some additional information.
It’s a pity you don’t have a donate button! I’d certainly donate to this brilliant blog!
I suppose for now i’ll settle for bookmarking and adding your RSS feed to my Google account.
I look forward to brand new updates and will share
this blog with my Facebook group. Chat soon!
tengerszemhotel.com
회전하는 랜턴과 같은 일련의 과거 사건이 Hongzhi 황제의 마음에 번쩍였습니다.
https://www.mobilestation.jp/privacy.php?URL=https%3A%2F%2Fanomaxx.com%2F
Very nice post. I just stumbled upon your
weblog and wished to say that I’ve really enjoyed surfing around your blog posts.
After all I’ll be subscribing to your rss
feed and I hope you write again soon!
Thank you a lot for sharing this with all of us you actually realize what you
are speaking about! Bookmarked. Please additionally seek advice from my website =).
We will have a hyperlink trade agreement between us
This site was… how do you say it? Relevant!! Finally I’ve found
something which helped me. Kudos!
If you desire to improve your know-how just keep visiting this web page and be updated with the most up-to-date news update posted here.
Fantastic beat ! I wish to apprentice while you amend your website, how could i subscribe for a blog
web site? The account aided me a acceptable deal.
I had been a little bit acquainted of this your broadcast offered bright clear concept
Hi would you mind stating which blog platform you’re using?
I’m looking to start my own blog soon but I’m having a tough time selecting
between BlogEngine/Wordpress/B2evolution and Drupal.
The reason I ask is because your layout seems different then most blogs and I’m
looking for something completely unique.
P.S Apologies for getting off-topic but I had to ask!
Awesome post.
I like the valuable information you provide to your articles.
I will bookmark your weblog and test again here regularly.
I’m rather certain I will be informed many new stuff proper right here!
Best of luck for the next!
I have read so many content concerning the blogger
lovers but this piece of writing is truly a fastidious post, keep it up.
Valuable info. Fortunate me I found your web site unintentionally, and I am
surprised why this accident didn’t happened earlier! I bookmarked it.
I just couldn’t go away your website prior to suggesting
that I actually loved the standard information a
person provide on your visitors? Is going to be again frequently to check out new posts
It’s going to be ending of mine day, however before end I am reading this wonderful piece
of writing to increase my know-how.
Greetings! Very useful advice within this post! It’s the
little changes which will make the most significant changes.
Thanks for sharing!
Unquestionably believe that which you stated. Your favourite reason seemed to be
on the internet the simplest thing to take into account of.
I say to you, I certainly get irked even as other people consider issues that they just don’t understand about.
You managed to hit the nail upon the highest and outlined out the entire thing without having side effect ,
other folks could take a signal. Will likely be again to get more.
Thanks
Hi, I think your site might be having browser compatibility issues.
When I look at your blog in Chrome, it looks fine but when opening in Internet Explorer, it has some overlapping.
I just wanted to give you a quick heads up! Other then that, excellent blog!
It’s truly a great and helpful piece of information.
I’m happy that you simply shared this useful info with us.
Please stay us up to date like this. Thanks for sharing.
Hey I am so excited I found your blog page, I really found you by error, while I
was browsing on Google for something else, Nonetheless I am here now and would
just like to say thank you for a marvelous post and a all round entertaining blog (I also love the theme/design), I don’t have time to read through it all at the moment but I have book-marked it and
also added your RSS feeds, so when I have time I will be back to read
much more, Please do keep up the awesome work.
Hey there! I simply want to give you a big thumbs up for your great info
you have got here on this post. I will be returning to your site for more soon.
I really like your blog.. very nice colors & theme. Did you create this
website yourself or did you hire someone to do it for you?
Plz answer back as I’m looking to design my own blog and would
like to find out where u got this from. thanks a lot
Thank you for the good writeup. It actually was once a leisure account it.
Look advanced to far brought agreeable from you! By the way, how can we keep up a correspondence?
Hi there, I discovered your website via Google whilst searching for
a related subject, your website got here up, it appears to be like great.
I’ve bookmarked it in my google bookmarks.
Hello there, simply become aware of your blog thru Google, and found that it is
really informative. I’m gonna be careful for brussels. I will be grateful in the event you continue this in future.
Numerous people will be benefited from your writing.
Cheers!
These are in fact fantastic ideas in concerning blogging.
You have touched some good things here. Any way keep up wrinting.
Hello colleagues, its fantastic article about teachingand fully explained, keep
it up all the time.
whoah this weblog is fantastic i like studying your posts.
Stay up the great work! You understand, lots of people are searching around for this info, you
could help them greatly.
I think the admin of this website is in fact working hard in support of his
site, because here every stuff is quality based
stuff.
I am really happy to read this webpage posts which carries plenty of useful information, thanks for providing these data.
When I initially commented I clicked the «Notify me when new comments are added» checkbox and now each time a comment is added I get three e-mails with the same comment.
Is there any way you can remove me from that service?
Many thanks!
I always used to read article in news papers but now as I am
a user of internet thus from now I am using net for articles or reviews, thanks to web.
Great article. I’m facing many of these issues
as well..
Hello there! This blog post couldn’t be written any better!
Reading through this article reminds me of my previous roommate!
He continually kept preaching about this. I will forward
this article to him. Pretty sure he’s going to have a great read.
Many thanks for sharing!
Do you mind if I quote a few of your posts as long as I provide credit
and sources back to your weblog? My blog site is in the very same
area of interest as yours and my users would certainly benefit from
a lot of the information you provide here. Please let me know if this okay with you.
Regards!
I think that is among the most important information for me.
And i’m happy studying your article. But wanna observation on few normal things, The
website taste is ideal, the articles is actually great : D.
Just right process, cheers
Hi, after reading this amazing article i am too glad to share my familiarity here with
friends.
Quality articles or reviews is the key to attract the visitors to go to see the
website, that’s what this website is providing.
I like it when folks come together and share thoughts.
Great website, continue the good work!
Excellent way of describing, and good piece of
writing to get information regarding my presentation topic,
which i am going to present in college.
My family members always say that I am killing my time here
at web, but I know I am getting know-how everyday by reading such fastidious posts.
Hey there! I simply want to offer you a huge thumbs up for the great information you’ve got here on this post.
I am returning to your website for more soon.
I really like it when people get together and share ideas.
Great website, stick with it!
I’m not that much of a online reader to be honest but your blogs really nice, keep it up!
I’ll go ahead and bookmark your site to come back down the road.
Many thanks
Hi there to every body, it’s my first pay a quick visit of this weblog; this
weblog consists of awesome and actually fine stuff designed for readers.
Hi, i believe that i noticed you visited my web site thus i came to
return the desire?.I’m attempting to to find issues to enhance my web
site!I suppose its good enough to use a few of your ideas!!
When I initially commented I appear to have clicked on the -Notify me when new comments are added- checkbox and now
whenever a comment is added I get four emails with the same comment.
There has to be an easy method you are able to remove me from
that service? Appreciate it!
Spot on with this write-up, I seriously think this
amazing site needs a lot more attention. I’ll probably be back again to
see more, thanks for the advice!
I think that what you wrote made a great deal of sense.
However, think on this, suppose you composed a catchier
post title? I ain’t saying your information is not solid, however suppose you added a post title that grabbed people’s
attention? I mean Fracción Molar (Ejercicios Resueltos) –
Química en casa.com is kinda boring. You might look at
Yahoo’s front page and watch how they create article titles to grab people interested.
You might add a related video or a related pic or two to get
readers excited about everything’ve got to say. Just my opinion, it might bring your posts a little bit more interesting.
you are in point of fact a just right webmaster.
The site loading speed is incredible. It seems that you’re
doing any distinctive trick. In addition,
The contents are masterpiece. you have performed a wonderful task on this subject!
I love what you guys are up too. This type of clever work and reporting!
Keep up the excellent works guys I’ve included you guys
to our blogroll.
We stumbled over here from a different web address and thought I may as
well check things out. I like what I see so i am just following you.
Look forward to looking into your web page repeatedly.
Very shortly this web site will be famous amid all blogging and
site-building users, due to it’s good articles or reviews
I’m truly enjoying the design and layout of your blog.
It’s a very easy on the eyes which makes it much more enjoyable for me to come here
and visit more often. Did you hire out a designer to create your theme?
Exceptional work!
Thanks for finally writing about > Fracción Molar (Ejercicios Resueltos) – Química en casa.com < Liked it!
Hi! Would you mind if I share your blog with my myspace group?
There’s a lot of people that I think would really enjoy
your content. Please let me know. Thanks
I simply could not depart your web site prior
to suggesting that I really enjoyed the standard info an individual supply for your guests?
Is gonna be again continuously to investigate cross-check new posts
Березин Андрей Евроинвест neva.today/person/andrej-valerevich-berezin-sovladelecz-investiczionnoj-kompanii-evroinvest-458141.
Nice blog! Is your theme custom made or did you download
it from somewhere? A theme like yours with a few simple adjustements would really make my
blog shine. Please let me know where you got your theme.
Kudos
Asking questions are really nice thing if you are not
understanding anything entirely, but this piece of writing presents nice understanding even.
There’s certainly a great deal to learn about this subject.
I love all the points you’ve made.
What’s up, everything is going fine here and
ofcourse every one is sharing information, that’s in fact excellent, keep up writing.
Quality content is the secret to attract the viewers to go to see the website, that’s what this website is providing.
magnificent issues altogether, you just received a emblem new reader.
What could you suggest about your publish that you simply made a few days ago?
Any positive?
You actually make it appear really easy along with your presentation but I to find this matter to be actually one thing
which I think I would never understand. It sort of feels too complicated and very huge for me.
I’m taking a look forward in your subsequent post, I will attempt to get
the grasp of it!
It’s actually a great and useful piece of information. I’m satisfied that you just shared this helpful information with us.
Please stay us informed like this. Thanks for sharing.
Hi there! Do you know if they make any plugins to help with SEO?
I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good success.
If you know of any please share. Kudos!
I am regular reader, how are you everybody? This piece of writing posted
at this site is in fact pleasant.
Superb website you have here but I was curious if you knew of any
message boards that cover the same topics discussed here?
I’d really like to be a part of group where I can get suggestions from
other experienced individuals that share the same interest.
If you have any recommendations, please let me know.
Many thanks!
I visited many web sites except the audio feature for audio songs
existing at this website is genuinely superb.
Hey very nice blog!
I’ll immediately snatch your rss as I can not to find your e-mail subscription link or e-newsletter service.
Do you’ve any? Please let me understand so that I may subscribe.
Thanks.
Hi, I think your site might be having browser compatibility issues.
When I look at your website in Ie, it looks fine but when opening in Internet Explorer, it has some overlapping.
I just wanted to give you a quick heads up! Other then that,
terrific blog!
You can certainly see your enthusiasm in the work you write.
The sector hopes for even more passionate writers such as you
who are not afraid to say how they believe.
At all times go after your heart.
Hello there! Do you use Twitter? I’d like to follow you if that would be okay.
I’m definitely enjoying your blog and look forward to
new updates.
I’m gone to tell my little brother, that he should also go to see
this weblog on regular basis to take updated from most up-to-date
gossip.
It’s nearly impossible to find knowledgeable people
for this subject, but you sound like you know what you’re talking about!
Thanks
I was excited to find this great site. I wanted to thank you for your time
for this wonderful read!! I definitely loved every bit of it
and i also have you saved as a favorite to look at new things in your blog.
Howdy! I just would like to offer you a huge thumbs up for your great info you have got right here on this
post. I am returning to your site for more soon.
When I initially commented I seem to have clicked the -Notify me when new comments
are added- checkbox and now each time a comment is added I recieve four emails
with the exact same comment. There has to be an easy method you are able
to remove me from that service? Thanks a lot!
Hi, Neat post. There’s an issue along with your website
in web explorer, would check this? IE still is the market leader and a big section of other folks will pass over your excellent writing
because of this problem.
Magnificent beat ! I wish to apprentice even as you amend your website, how
could i subscribe for a blog web site? The account aided me a applicable deal.
I have been a little bit familiar of this your broadcast offered bright clear
idea
As the admin of this website is working, no hesitation very shortly it will be famous, due to its quality contents.
Thanks for a marvelous posting! I actually enjoyed reading
it, you happen to be a great author. I will ensure that I bookmark your blog and will come
back later on. I want to encourage you to ultimately
continue your great job, have a nice weekend!
Good site you’ve got here.. It’s difficult to find excellent writing like yours nowadays.
I seriously appreciate people like you! Take care!!
hi!,I like your writing very much! proportion we be in contact more approximately your post on AOL?
I need a specialist in this house to unravel my problem.
Maybe that’s you! Taking a look ahead to see you.
Great information. Lucky me I ran across your site
by chance (stumbleupon). I have bookmarked it for later!
What i don’t realize is actually how you’re no longer really much more smartly-preferred
than you might be now. You’re so intelligent. You know thus considerably
in terms of this topic, produced me personally imagine it from a lot of numerous angles.
Its like women and men don’t seem to be fascinated except it’s something to accomplish with Lady
gaga! Your personal stuffs outstanding. At all times
care for it up!
This site certainly has all of the information I
needed concerning this subject and didn’t know who to ask.
Your mode of explaining the whole thing in this paragraph is
really good, all be capable of effortlessly know it, Thanks
a lot.
I am no longer certain where you’re getting your information,
however good topic. I must spend some time studying more
or figuring out more. Thanks for wonderful info I used to be on the lookout
for this information for my mission.
Hi superb website! Does running a blog similar to this take a massive amount work?
I’ve very little expertise in computer programming but I had been hoping to start my own blog in the near future.
Anyway, if you have any recommendations or techniques for new blog owners please share.
I know this is off subject nevertheless I just had to ask.
Cheers!
Appreciate the recommendation. Will try it out.
You are so awesome! I don’t think I have read
anything like this before. So good to find somebody with a few
genuine thoughts on this topic. Really.. thank you for starting this up.
This site is something that is needed on the web, someone with a little originality!
You really make it appear so easy together with your presentation but I to find
this matter to be really something that I think I would never understand.
It seems too complex and very vast for me. I’m taking a look forward to your subsequent submit, I’ll attempt to get the grasp of it!
What’s up everyone, it’s my first pay a visit at this site, and post is really fruitful designed for me,
keep up posting these content.
Hi, just wanted to tell you, I loved this blog post. It was funny.
Keep on posting!
What i don’t understood is in fact how you are not really a lot more smartly-liked than you might be now.
You’re very intelligent. You know thus significantly when it comes to
this matter, produced me personally believe it
from a lot of varied angles. Its like women and men don’t seem to be fascinated until it is one thing to accomplish with Girl
gaga! Your personal stuffs excellent. At all times care for it up!
Spot on with this write-up, I absolutely think this amazing site needs far
more attention. I’ll probably be back again to see more,
thanks for the advice!
You can certainly see your skills within the article you write.
The world hopes for even more passionate writers like you
who are not afraid to mention how they believe.
At all times follow your heart.
It’s great that you are getting thoughts from this post as well as from our discussion made at
this place.
For latest information you have to go to see world wide web and on world-wide-web I found this website as a finest site for most up-to-date
updates.
It is not my first time to pay a quick visit this web page,
i am browsing this web site dailly and take
fastidious information from here all the time.
Attractive section of content. I just stumbled upon your
blog and in accession capital to assert that I acquire actually enjoyed
account your blog posts. Any way I’ll be subscribing to your augment
and even I achievement you access consistently quickly.
I do agree with all of the ideas you have offered to your post.
They are really convincing and will definitely work. Nonetheless, the posts are too
short for beginners. May just you please extend them a little
from subsequent time? Thanks for the post.
Hello to all, it’s actually a pleasant for
me to pay a visit this website, it contains important Information.
Hi, Neat post. There’s a problem with your website in internet explorer, could test this?
IE still is the marketplace leader and a big component to other
people will pass over your excellent writing due to this problem.
I enjoy what you guys are up too. This sort of clever work and coverage!
Keep up the awesome works guys I’ve included you
guys to our blogroll.
This is really interesting, You are a very skilled blogger.
I’ve joined your feed and look forward to seeking more of your
excellent post. Also, I have shared your web site in my social networks!
This is very interesting, You are a very skilled blogger.
I have joined your feed and look forward to seeking more
of your wonderful post. Also, I have shared your website in my social networks!
excellent points altogether, you simply received a new reader.
What might you recommend about your publish that you simply made a few days ago?
Any certain?
I am truly thankful to the owner of this site who has shared
this impressive article at at this place.
Fantastic blog! Do you have any hints for aspiring writers?
I’m planning to start my own site soon but I’m a little lost on everything.
Would you recommend starting with a free platform like WordPress or go for a paid option? There are so many options
out there that I’m completely overwhelmed ..
Any recommendations? Many thanks!
First off I want to say awesome blog! I had a quick question in which I’d like to ask if you do
not mind. I was interested to know how you center yourself and
clear your head before writing. I’ve had a hard time clearing my thoughts in getting my thoughts out.
I do enjoy writing but it just seems like the first 10 to 15 minutes are usually lost just trying
to figure out how to begin. Any recommendations or tips?
Thank you!
Somebody necessarily help to make critically articles I might state.
This is the very first time I frequented your website page and so far?
I amazed with the analysis you made to make this actual put up incredible.
Great activity!
We are a gaggle of volunteers and starting a brand new scheme in our community.
Your site provided us with valuable info to work on. You’ve done an impressive process
and our whole neighborhood will probably be grateful to you.
Good write-up. I certainly appreciate this site. Stick
with it!
What’s up, constantly i used to check website posts here early in the morning, since i enjoy to learn more and
more.
I like the helpful info you supply for your articles. I will bookmark your blog and test again here
regularly. I’m relatively certain I will be informed a lot of new stuff
proper right here! Good luck for the following!
It’s remarkable in support of me to have a site, which is useful for my knowledge.
thanks admin
hello there and thank you for your info – I’ve definitely picked up something new from right here.
I did however expertise several technical issues using this website, since
I experienced to reload the web site many times previous
to I could get it to load correctly. I had been wondering if your
web hosting is OK? Not that I am complaining, but
sluggish loading instances times will very frequently affect your placement in google
and can damage your high quality score if ads and marketing with Adwords.
Anyway I’m adding this RSS to my e-mail and can look out for much more of your respective intriguing content.
Ensure that you update this again very soon.
I read this piece of writing fully about the difference
of newest and preceding technologies, it’s remarkable article.
It’s a pity you don’t have a donate button! I’d
most certainly donate to this superb blog! I guess for now i’ll settle for book-marking and adding your RSS feed to my Google account.
I look forward to brand new updates and will talk about this
site with my Facebook group. Chat soon!
Terrific work! This is the type of information that should be shared across the net.
Shame on Google for no longer positioning this post upper!
Come on over and visit my web site . Thanks =)
You could definitely see your expertise in the
work you write. The arena hopes for even more passionate writers like you who aren’t afraid to mention how they
believe. Always go after your heart.
You really make it seem so easy with your presentation but I find this topic to be actually something that
I think I would never understand. It seems too complicated and extremely broad for me.
I am looking forward for your next post, I’ll try to
get the hang of it!
Fantastic beat ! I would like to apprentice at the same time as you amend your website, how
could i subscribe for a blog site? The account aided me a applicable deal.
I were a little bit acquainted of this your broadcast offered vivid clear concept
You actually make it appear so easy together with your presentation however I in finding this topic to be actually one thing that I believe I’d by no means understand.
It sort of feels too complex and extremely extensive for me.
I am looking ahead on your subsequent post,
I will try to get the hold of it!
I really like what you guys tend to be up too. This type of clever work and reporting!
Keep up the very good works guys I’ve included you guys to blogroll.
Every weekend i used to pay a quick visit this website, for
the reason that i want enjoyment, as this this site conations truly pleasant funny
information too.
Hey outstanding blog! Does running a blog such as this require a massive
amount work? I have no knowledge of coding but I had been hoping to start my
own blog soon. Anyways, should you have any recommendations or tips for new blog owners
please share. I know this is off subject nevertheless I simply needed to ask.
Thank you!
Thanks , I have just been looking for information about
this subject for a while and yours is the greatest I’ve discovered
so far. However, what concerning the bottom line? Are you positive about the source?
you are in point of fact a good webmaster. The site loading pace is amazing.
It sort of feels that you are doing any unique trick. Also,
The contents are masterpiece. you have done
a wonderful job in this subject!
Hello, i think that i saw you visited my web site so i came to “return the favor”.I am
attempting to find things to improve my site!I suppose its
ok to use a few of your ideas!!
Magnificent beat ! I wish to apprentice while you amend
your site, how can i subscribe for a blog site? The account aided me a acceptable deal.
I had been a little bit acquainted of this your broadcast provided bright clear concept
Hi there, yup this article is truly nice and I have learned lot of things
from it concerning blogging. thanks.
Nice post. I learn something totally new and challenging on blogs I stumbleupon everyday.
It’s always helpful to read content from other writers and use a
little something from their sites.
Its like you read my mind! You appear to know a lot about this, like
you wrote the book in it or something. I think that you could do with a
few pics to drive the message home a bit, but other than that, this is magnificent
blog. An excellent read. I’ll certainly be back.
Hello to all, the contents present at this site are really remarkable for people knowledge, well, keep up the good work fellows.
Way cool! Some very valid points! I appreciate you writing this article and also the
rest of the website is also really good.
Informative article, just what I was looking for.
Thank you for another magnificent post. Where else could anybody
get that type of info in such an ideal way of writing?
I’ve a presentation next week, and I am on the
look for such information.
Terrific work! This is the type of information that should be shared
around the internet. Shame on Google for now not positioning this
put up higher! Come on over and seek advice from my website
. Thank you =)
Heya i’m for the first time here. I came across this board and
I find It truly helpful & it helped me out a lot.
I’m hoping to offer something back and help others like you aided me.
Wow, that’s what I was searching for, what a stuff!
existing here at this weblog, thanks admin of this site.
This article is in fact a nice one it helps new the web people, who are wishing
in favor of blogging.
You need to be a part of a contest for one of the
best websites on the internet. I am going to highly recommend this site!
Березин Андрей Евроинвест https://mainfin.ru/persona/berezin-andrey-valeryevich.
If some one needs expert view regarding running a blog then i advise him/her to pay
a quick visit this webpage, Keep up the pleasant work.
Just want to say your article is as astounding.
The clarity for your submit is simply excellent and that i can think
you are knowledgeable in this subject. Well along with your permission allow me to
grasp your RSS feed to stay updated with imminent post.
Thanks a million and please carry on the rewarding work.
Thanks for sharing your info. I really appreciate your efforts and
I will be waiting for your further write ups thanks once
again.
I’d like to thank you for the efforts you have put in penning this site.
I am hoping to view the same high-grade content by you in the future as well.
In fact, your creative writing abilities has motivated me to get my own website now 😉
Wonderful, what a webpage it is! This weblog presents useful facts to us,
keep it up.
Hello there, You’ve done a fantastic job. I will definitely digg it and personally recommend to my friends.
I am sure they’ll be benefited from this web site.
Excellent items from you, man. I have keep in mind your stuff
prior to and you are simply too wonderful. I really like what you have acquired here, really like what you’re saying
and the best way by which you assert it. You’re making it enjoyable and you still take care of
to stay it wise. I cant wait to learn far more from you.
This is actually a great site.
I always used to study article in news papers but now as
I am a user of internet so from now I am using net for articles, thanks to web.
No matter if some one searches for his essential thing, so he/she wants
to be available that in detail, so that thing is maintained over here.
Heya i’m for the first time here. I found this board and I find It really
useful & it helped me out a lot. I hope to give something back and help others
like you aided me.
If you desire to get much from this piece of writing then you have to
apply such strategies to your won web site.
I think the admin of this web site is truly working hard in support of his site, as
here every material is quality based stuff.
This piece of writing will assist the internet users for building up new web site or
even a blog from start to end.
Its such as you read my mind! You seem to grasp a lot about this,
such as you wrote the e book in it or something.
I think that you simply could do with some p.c. to pressure the message home a bit, but
instead of that, that is fantastic blog. An excellent read.
I will certainly be back.
Great post. I was checking continuously this blog and I am
impressed! Very useful info specifically the last part 🙂
I care for such information much. I was seeking this certain info for
a long time. Thank you and good luck.
you’re in point of fact a excellent webmaster.
The website loading velocity is incredible. It seems that you’re doing any unique trick.
Moreover, The contents are masterwork. you’ve done a wonderful task in this subject!
You made some decent points there. I checked on the web
for more info about the issue and found most individuals
will go along with your views on this site.
These are in fact fantastic ideas in on the topic of blogging.
You have touched some good factors here. Any way keep
up wrinting.
If you would like to increase your familiarity simply keep visiting
this site and be updated with the latest gossip posted here.
Hello, I enjoy reading all of your post. I wanted to write a little
comment to support you.
I loved as much as you will receive carried out right here.
The sketch is tasteful, your authored material stylish. nonetheless, you
command get got an impatience over that you wish be
delivering the following. unwell unquestionably come further formerly again as exactly the same nearly very
often inside case you shield this increase.
Thank you for the auspicious writeup. It actually used to be a entertainment account it.
Glance complex to far brought agreeable from you!
However, how can we keep up a correspondence?
I love it when individuals get together and share opinions.
Great site, keep it up!
With havin so much content do you ever run into any issues of plagorism or copyright violation? My site has a lot of unique
content I’ve either written myself or outsourced but it looks like a lot of it is popping it up all over the internet without my agreement.
Do you know any methods to help protect against content from being ripped
off? I’d definitely appreciate it.
It is perfect time to make some plans for the
longer term and it is time to be happy. I have read this submit and if I
could I desire to counsel you few interesting issues or suggestions.
Maybe you could write next articles relating to this article.
I want to learn even more issues about it!
If some one wants to be updated with latest technologies then he must be pay
a quick visit this website and be up to date all the time.
Your way of describing the whole thing in this piece of writing is genuinely nice,
all be capable of simply understand it, Thanks a lot.
Hi mates, its enormous piece of writing concerning cultureand entirely
defined, keep it up all the time.
Hello, just wanted to mention, I liked this blog post.
It was practical. Keep on posting!
Hey there! Do you know if they make any plugins to assist with Search Engine Optimization? I’m trying to
get my blog to rank for some targeted keywords but I’m not seeing very good results.
If you know of any please share. Thanks!
I’m really impressed with your writing skills and also with the layout on your blog.
Is this a paid theme or did you modify it yourself?
Anyway keep up the nice quality writing, it’s rare to see a nice blog like this one today.
This information is invaluable. How can I find out
more?
Keep on working, great job!
I’ve learn some good stuff here. Certainly value bookmarking
for revisiting. I surprise how a lot effort you place
to create this kind of excellent informative website.
Hi! I just would like to give you a big thumbs up for the great info
you have got right here on this post. I am returning to your site for more
soon.
Please let me know if you’re looking for a author for your weblog.
You have some really great posts and I think I would be a good asset.
If you ever want to take some of the load off, I’d love to write
some articles for your blog in exchange for a link back
to mine. Please blast me an email if interested.
Regards!
If you are going for best contents like me, simply
pay a visit this web site all the time for the reason that it presents
feature contents, thanks
I really like reading an article that can make men and
women think. Also, many thanks for allowing me to comment!
Good day! Do you know if they make any plugins to
protect against hackers? I’m kinda paranoid about losing everything I’ve
worked hard on. Any tips?
If some one needs expert view concerning running a blog afterward i suggest
him/her to pay a quick visit this blog, Keep up the pleasant
work.
I am really impressed together with your writing skills and also with the structure on your blog.
Is that this a paid topic or did you customize it yourself?
Anyway stay up the nice quality writing, it is rare
to see a nice weblog like this one nowadays..
Hi i am kavin, its my first occasion to commenting anywhere,
when i read this post i thought i could also make comment due to this
good paragraph.
Pretty! This has been an incredibly wonderful post. Thanks for
supplying this information.
great put up, very informative. I ponder why the other experts
of this sector do not understand this. You should proceed your writing.
I am confident, you have a great readers’
base already!
Great website you have here but I was curious if you knew of any user discussion forums that
cover the same topics discussed here? I’d really love
to be a part of community where I can get suggestions from other experienced people that share the same interest.
If you have any recommendations, please let me
know. Kudos!
You are so interesting! I don’t think I’ve read through a single thing like that before.
So great to discover someone with a few unique thoughts on this issue.
Seriously.. thanks for starting this up. This web site is something that
is required on the web, someone with a little originality!
Thank you for some other wonderful post.
The place else may anyone get that kind of information in such a perfect approach of writing?
I’ve a presentation next week, and I’m on the look for such info.
I was able to find good advice from your blog posts.
It’s remarkable for me to have a site, which is helpful in favor of my know-how.
thanks admin
I needed to thank you for this great read!!
I definitely enjoyed every bit of it. I have you book marked to
check out new things you post…
You have made some really good points there. I checked on the internet for more info
about the issue and found most individuals will go along
with your views on this site.
Hi there I am so happy I found your webpage, I really found you by accident, while I was researching on Yahoo for
something else, Nonetheless I am here now and would just like to say thanks a lot for
a tremendous post and a all round thrilling blog (I
also love the theme/design), I don’t have time to browse it all at the moment but I have book-marked it and also added in your RSS feeds, so when I have time I will be back to read a lot more, Please do keep up the awesome work.
Howdy! This is kind of off topic but I need some guidance from an established blog.
Is it tough to set up your own blog? I’m not very techincal but I can figure things out pretty fast.
I’m thinking about setting up my own but I’m not sure where to start.
Do you have any points or suggestions? Cheers
Hi everyone, it’s my first go to see at this website, and paragraph is actually fruitful designed for me, keep up posting these articles or reviews.
whoah this weblog is magnificent i like reading your articles.
Keep up the good work! You recognize, many people are looking round for this info, you could aid them greatly.
What’s up friends, how is everything, and what you would like to say about
this post, in my view its actually amazing in favor of me.
Howdy just wanted to give you a quick heads up and let you know a few of the images aren’t loading correctly.
I’m not sure why but I think its a linking issue. I’ve tried it in two different internet
browsers and both show the same results.
Saved as a favorite, I like your website!
I must thank you for the efforts you have put in writing this website.
I really hope to view the same high-grade blog posts by you later
on as well. In fact, your creative writing abilities has inspired me to get my own website now 😉
Hi, i read your blog from time to time and i own a similar
one and i was just curious if you get a lot of spam responses?
If so how do you reduce it, any plugin or anything you can suggest?
I get so much lately it’s driving me mad so any help is very much appreciated.
I really like what you guys are up too. Such clever work and coverage!
Keep up the great works guys I’ve you guys to blogroll.
Hurrah! At last I got a webpage from where I be capable of in fact obtain valuable data regarding my study and
knowledge.
Thanks for some other fantastic post. The place else could anyone get that type of info in such
an ideal approach of writing? I have a presentation next week, and I
am at the look for such information.
I have read some excellent stuff here. Definitely worth bookmarking for revisiting.
I surprise how a lot attempt you set to create such a wonderful informative web site.
Marvelous, what a webpage it is! This web site presents valuable information to us, keep
it up.
I have read a few just right stuff here. Certainly worth
bookmarking for revisiting. I surprise how so much attempt you set to make the sort of magnificent informative website.
I was curious if you ever thought of changing the layout of your website?
Its very well written; I love what youve got to say. But maybe you could a little more in the way of
content so people could connect with it
better. Youve got an awful lot of text for only having 1 or 2 images.
Maybe you could space it out better?
What i do not understood is in truth how you are not actually much more neatly-favored than you may be now.
You’re very intelligent. You know therefore considerably in the case of this topic, made me in my view consider it from a lot of various angles.
Its like men and women are not fascinated unless it is something to do with Lady gaga!
Your personal stuffs excellent. All the time maintain it up!
Thank you for the good writeup. It in fact was a amusement account it.
Look advanced to far added agreeable from you!
However, how can we communicate?
You really make it appear so easy together with your presentation however I
in finding this matter to be really one thing which I feel I would by no means
understand. It seems too complicated and extremely large for me.
I am looking ahead on your subsequent publish, I’ll try to get
the hold of it!
You could definitely see your skills in the article you write.
The world hopes for even more passionate writers such as you who are not
afraid to mention how they believe. At all times go after
your heart.
Березин Андрей Евроинвест http://lenta.ru/tags/persons/berezin-andrey/.
Thanks for finally talking about > Fracción Molar (Ejercicios Resueltos) – Química en casa.com < Loved it!
Tremendous things here. I am very glad to look your article.
Thanks a lot and I am looking ahead to touch
you. Will you kindly drop me a e-mail?
Hi there Dear, are you actually visiting this web site on a regular
basis, if so then you will without doubt obtain pleasant
knowledge.
Thank you for the good writeup. It in fact was a amusement
account it. Look advanced to more added agreeable from you!
However, how can we communicate?
Superb blog you have here but I was wanting to know if you knew of any user discussion forums that
cover the same topics discussed in this article?
I’d really love to be a part of online community where I can get
feed-back from other knowledgeable people that share the same interest.
If you have any suggestions, please let me know. Many thanks!
Highly descriptive article, I loved that a lot. Will there be a
part 2?
Hello, I enjoy reading all of your post. I like to write a little comment
to support you.
Hmm it seems like your website ate my first
comment (it was super long) so I guess I’ll just sum it up
what I had written and say, I’m thoroughly enjoying your blog.
I as well am an aspiring blog blogger but I’m
still new to the whole thing. Do you have any helpful
hints for rookie blog writers? I’d really appreciate it.
My family always say that I am killing my time here at web, however I know I am getting know-how all the
time by reading thes nice articles or reviews.
Thanks designed for sharing such a nice thinking, article
is good, thats why i have read it fully
That is a very good tip particularly to those new to the blogosphere.
Short but very accurate information… Thanks for sharing this one.
A must read article!
I think the admin of this website is truly working hard for his
site, since here every material is quality based information.
Hello there! Do you know if they make any plugins to assist
with Search Engine Optimization? I’m trying to get my blog to rank for some targeted keywords but I’m
not seeing very good gains. If you know of any please share.
Thanks!
It’s truly a nice and helpful piece of info. I am happy that you simply shared this helpful info with
us. Please keep us up to date like this. Thank you for
sharing.
Hi there, after reading this amazing paragraph i am as
well glad to share my experience here with mates.
Its like you read my mind! You seem to know so much about this,
like you wrote the book in it or something.
I think that you can do with a few pics to
drive the message home a bit, but instead of that, this is great blog.
A fantastic read. I’ll definitely be back.
Fantastic goods from you, man. I have understand your stuff previous to and you’re just extremely wonderful.
I really like what you’ve acquired here, really like what you are saying and the way
in which you say it. You make it enjoyable and you still care for
to keep it wise. I can not wait to read much more from you.
This is actually a terrific web site.
When someone writes an paragraph he/she maintains the image
of a user in his/her brain that how a user can know it.
Thus that’s why this piece of writing is outstdanding. Thanks!
You’ve made some really good points there. I checked on the
internet for additional information about the issue and
found most individuals will go along with your views on this web site.
Good day! Do you know if they make any plugins to
protect against hackers? I’m kinda paranoid about losing everything I’ve worked hard on. Any recommendations?
I think this is one of the most vital information for me. And i’m glad reading your article.
But wanna remark on few general things, The web site style is perfect, the
articles is really great : D. Good job, cheers
Hey there! I’m at work surfing around your blog from my new apple iphone!
Just wanted to say I love reading through your blog
and look forward to all your posts! Carry on the fantastic
work!
Just desire to say your article is as astonishing.
The clarity for your post is simply great and that i could suppose
you’re an expert in this subject. Fine together with your permission allow
me to grab your feed to stay updated with forthcoming post.
Thank you a million and please continue the enjoyable work.
Greetings! Very helpful advice within this post!
It’s the little changes that will make the most significant changes.
Thanks for sharing!
I do believe all of the ideas you’ve presented on your post.
They’re really convincing and will definitely work. Still, the posts are too quick for starters.
May just you please prolong them a little from next
time? Thanks for the post.
I’m not that much of a online reader to be honest but
your blogs really nice, keep it up! I’ll go ahead and bookmark your
site to come back later on. Cheers
Thank you, I’ve just been looking for info about this topic for a while
and yours is the greatest I’ve came upon till now.
But, what about the conclusion? Are you sure concerning the supply?
I like the valuable information you provide in your articles.
I will bookmark your blog and check again here regularly.
I am quite sure I will learn plenty of new stuff right here!
Best of luck for the next!
Very nice post. I definitely appreciate this website.
Continue the good work!
Since the admin of this web page is working, no question very rapidly it will be well-known, due to its quality contents.
I am curious to find out what blog platform you have been utilizing?
I’m having some minor security problems with my latest site and
I would like to find something more secure. Do you have any solutions?
It’s an amazing article in support of all the internet viewers; they
will get advantage from it I am sure.
Usually I do not read post on blogs, but I would like to say that this write-up very pressured me to take a look at and do so!
Your writing taste has been amazed me. Thank you, quite great post.
Hi there, for all time i used to check web site posts here in the early hours
in the break of day, since i enjoy to find out more and more.
Every weekend i used to pay a quick visit this web
page, as i wish for enjoyment, for the reason that
this this site conations in fact good funny material too.
Ahaa, its pleasant dialogue concerning this article at this
place at this website, I have read all that, so at this time me also commenting at
this place.
Good post. I definitely appreciate this site. Continue the good work!
Howdy! Do you use Twitter? I’d like to follow you if that would be okay.
I’m undoubtedly enjoying your blog and look forward to new
posts.
I was able to find good info from your content.
Thanks to my father who shared with me about
this webpage, this website is truly amazing.
Howdy! Do you use Twitter? I’d like to follow you if that would be okay.
I’m absolutely enjoying your blog and look forward to new updates.
Really no matter if someone doesn’t be aware of afterward its up to other people that they will
assist, so here it takes place.
This blog was… how do I say it? Relevant!! Finally
I have found something that helped me. Many thanks!
Simply wish to say your article is as surprising.
The clarity in your post is simply spectacular and that i could
think you’re an expert in this subject. Well along with your permission let me to grasp your feed to keep up to date with
drawing close post. Thanks a million and please
carry on the enjoyable work.
What i don’t realize is actually how you are now not really a lot more smartly-preferred than you might be right now.
You’re so intelligent. You already know therefore significantly when it
comes to this subject, made me in my opinion consider it from numerous
varied angles. Its like women and men are not involved except it’s one thing to do with Girl gaga!
Your own stuffs nice. At all times maintain it up!
I delight in, cause I found exactly what I used
to be taking a look for. You have ended my four day lengthy hunt!
God Bless you man. Have a nice day. Bye
Saved as a favorite, I love your blog!
Appreciating the dedication you put into your blog and detailed information you
present. It’s awesome to come across a blog every once in a while that
isn’t the same unwanted rehashed information. Wonderful read!
I’ve saved your site and I’m adding your RSS feeds to my Google account.
I like reading through an article that will make men and
women think. Also, thanks for permitting me to comment!
A motivating discussion is definitely worth comment. I do believe that
you ought to write more about this issue, it may
not be a taboo subject but usually folks don’t talk about these issues.
To the next! Cheers!!
Hello, Neat post. There is an issue along with your web site in web explorer,
might check this? IE nonetheless is the marketplace chief
and a large section of other folks will miss your wonderful writing because of this problem.
It’s really a nice and helpful piece of information.
I am satisfied that you just shared this useful information with us.
Please stay us up to date like this. Thanks for
sharing.
Interesting blog! Is your theme custom made or did you download it from somewhere?
A theme like yours with a few simple adjustements would really make my
blog shine. Please let me know where you got
your design. Thanks
You actually make it seem so easy with your presentation but I find this matter to
be really something that I think I would never understand.
It seems too complex and extremely broad for me. I am looking forward for
your next post, I’ll try to get the hang of it!
constantly i used to read smaller posts
that as well clear their motive, and that is also happening with this article which I am reading now.
Greetings, There’s no doubt that your website might be having web
browser compatibility problems. When I look at your site in Safari,
it looks fine but when opening in Internet Explorer, it has
some overlapping issues. I simply wanted
to provide you with a quick heads up! Besides that, wonderful website!
Why visitors still make use of to read news papers when in this technological world all is available on web?
Really no matter if someone doesn’t know afterward its up
to other users that they will help, so here it occurs.
Hey, I think your site might be having browser compatibility issues.
When I look at your blog in Firefox, it looks fine but when opening
in Internet Explorer, it has some overlapping. I just wanted to give you a quick
heads up! Other then that, wonderful blog!
What’s Going down i am new to this, I stumbled upon this I have discovered It
positively helpful and it has helped me out loads.
I am hoping to contribute & aid different users like its aided me.
Great job.
Awesome post.
It is actually a great and helpful piece of info. I am glad that you just
shared this helpful info with us. Please keep us informed like this.
Thank you for sharing.
Tremendous things here. I’m very happy to see your article.
Thanks so much and I’m having a look ahead to touch you.
Will you kindly drop me a mail?
Pretty section of content. I just stumbled upon your web site and in accession capital
to assert that I acquire actually enjoyed account your blog posts.
Anyway I will be subscribing to your feeds and even I achievement
you access consistently rapidly.
For hottest information you have to visit web and on internet I found this
site as a most excellent site for most up-to-date updates.
Hi, i read your blog occasionally and i own a similar
one and i was just wondering if you get a lot of spam comments?
If so how do you prevent it, any plugin or anything you can recommend?
I get so much lately it’s driving me insane so any support is very much appreciated.
Aw, this was a very nice post. Taking a few minutes and actual effort
to produce a great article… but what can I say… I put things off a whole
lot and never seem to get nearly anything done.
Hey! I’m at work browsing your blog from my new apple iphone!
Just wanted to say I love reading through your blog and look
forward to all your posts! Keep up the excellent work!
whoah this blog is magnificent i really like studying your
posts. Keep up the good work! You recognize, many people are hunting around for this info,
you can aid them greatly.
Yesterday, while I was at work, my sister stole my iPad and tested to see if it
can survive a 25 foot drop, just so she can be
a youtube sensation. My apple ipad is now broken and she has 83 views.
I know this is entirely off topic but I had to share it with someone!
WOW just what I was searching for. Came here by searching for forum lendir pekanbaru
Березин Андрей Евроинвест https://finance.rambler.ru/person/berezin-andrey/.
Березин Андрей Евроинвест https://finance.rambler.ru/person/berezin-andrey/.
Woah! I’m really enjoying the template/theme of this blog.
It’s simple, yet effective. A lot of times it’s very difficult
to get that «perfect balance» between usability and appearance.
I must say that you’ve done a excellent job with this.
In addition, the blog loads super quick for me on Internet explorer.
Excellent Blog!
Thanks for every other excellent post. The place else may anybody get that type of info in such a
perfect means of writing? I have a presentation subsequent week, and I am on the search for such information.
Wow, that’s what I was exploring for, what
a material! present here at this blog, thanks admin of this web site.
Thanks in support of sharing such a good opinion, paragraph is nice, thats why i have read it completely
Heya i am for the primary time here. I came across
this board and I to find It truly helpful & it helped
me out a lot. I’m hoping to give one thing again and aid others like you aided me.
I am extremely impressed with your writing skills as well as
with the layout on your weblog. Is this a paid theme or
did you customize it yourself? Anyway keep up the nice quality writing,
it’s rare to see a great blog like this one today.
Undeniably believe that which you stated. Your favorite justification appeared to be on the net
the easiest thing to be aware of. I say to you, I definitely get
irked while people consider worries that they plainly
don’t know about. You managed to hit the nail upon the top
as well as defined out the whole thing without having side effect
, people could take a signal. Will likely be back to get more.
Thanks
Incredible story there. What happened after? Take care!
Good write-up. I certainly appreciate this site. Keep writing!
Does your site have a contact page? I’m having problems locating it but, I’d like
to send you an email. I’ve got some recommendations for your blog you might be interested
in hearing. Either way, great blog and I look forward to seeing it improve
over time.
Howdy are using WordPress for your blog platform?
I’m new to the blog world but I’m trying to get started and set
up my own. Do you require any html coding expertise to make your
own blog? Any help would be really appreciated!
I really like looking through an article that
can make men and women think. Also, thank you for allowing for me to comment!
Hello, i read your blog from time to time and i own a
similar one and i was just curious if you get a lot of spam comments?
If so how do you prevent it, any plugin or anything you can advise?
I get so much lately it’s driving me mad so any support is very much appreciated.
This blog was… how do I say it? Relevant!!
Finally I’ve found something which helped me. Cheers!
Построить свой дом – мечта многих семей. Но как выбрать подходящее место, какие документы оформить и сколько это может стоить? В данной статье мы рассмотрим основные аспекты строительства частного дома в Московской области.
строительство домов под ключ авито
Стоимость постройки дома
Цены на строительство дома в Подмосковье могут сильно варьироваться в зависимости от многих факторов: площади и планировки дома, материалов, расположения участка, необходимости проведения дополнительных работ и т.д. В среднем, стоимость постройки дома начинается от 50 000 рублей за квадратный метр. Однако, конечно же, это не окончательная цена, и для каждого случая она будет индивидуальной.
строить дом под ключ цена
https://dom-pod-kluch-msk.ru/
Выбор участка для строительства
При выборе участка для строительства дома необходимо учесть множество факторов. Важными моментами являются:
Расположение участка (близость к инфраструктуре, транспортным путям, водоемам и т.п.)
Площадь участка и его форма
Наличие и состояние коммуникаций
Состояние грунта и рельефа участка
Экологическая обстановка в районе
После выбора участка стоит заняться подготовкой документов. Вам потребуется:
Разрешение на строительство (выдается в местной администрации)
My brother recommended I may like this blog.
He was totally right. This publish truly made my day.
You cann’t believe simply how so much time I had spent for
this info! Thanks!
There is definately a great deal to find out about this issue.
I really like all the points you’ve made.
Hi there friends, good piece of writing and good arguments commented here, I am genuinely enjoying
by these.
Hey I know this is off topic but I was wondering if you knew of any widgets I
could add to my blog that automatically tweet my newest twitter updates.
I’ve been looking for a plug-in like this for quite some time and
was hoping maybe you would have some experience with something like this.
Please let me know if you run into anything. I truly enjoy reading
your blog and I look forward to your new updates.
This is really interesting, You’re a very skilled blogger.
I’ve joined your rss feed and look forward to seeking more of your excellent post.
Also, I’ve shared your web site in my social networks!
I just like the helpful information you supply for
your articles. I’ll bookmark your weblog and take a look
at once more here regularly. I am relatively certain I’ll learn many new stuff right here!
Good luck for the next!
Hey there I am so glad I found your website, I really found you
by error, while I was searching on Google for something else, Anyhow I am here now and would just
like to say many thanks for a incredible post and a all round thrilling blog (I also love
the theme/design), I don’t have time to read it all at the minute but I have book-marked it and
also included your RSS feeds, so when I have time I will be back to read a lot more,
Please do keep up the awesome job.
This is very fascinating, You’re a very skilled blogger.
I have joined your rss feed and sit up for in search of more of your great post.
Additionally, I have shared your web site in my social networks
I have been browsing online greater than three hours as of
late, yet I never discovered any interesting article like yours.
It is lovely worth sufficient for me. Personally, if all website owners and
bloggers made excellent content material as you probably did,
the net will be much more useful than ever before.
I don’t even know how I ended up here, but I thought this post was great.
I do not know who you are but definitely you are going to a famous
blogger if you are not already 😉 Cheers!
I truly love your website.. Pleasant colors & theme.
Did you develop this site yourself? Please reply back
as I’m wanting to create my own personal website and
want to know where you got this from or just what
the theme is called. Thank you!
Nice post. I learn something totally new and
challenging on websites I stumbleupon on a daily basis.
It’s always helpful to read through content from other authors and practice something from
their websites.
These are in fact enormous ideas in regarding blogging.
You have touched some pleasant points here. Any way keep
up wrinting.
It’s an remarkable article designed for all the web users; they will
get advantage from it I am sure.
I read this piece of writing completely concerning the difference
of most up-to-date and previous technologies, it’s awesome article.
Hi there to every body, it’s my first visit of this
webpage; this website consists of awesome and in fact fine information in favor of readers.
I’d like to find out more? I’d like to find out more details.
Thanks for one’s marvelous posting! I genuinely
enjoyed reading it, you could be a great author. I will be sure
to bookmark your blog and definitely will come back very soon. I want to encourage you to
continue your great writing, have a nice evening!
I don’t even know how I ended up here, but I thought this post was good.
I do not know who you are but certainly you’re going
to a famous blogger if you are not already 😉 Cheers!
Hi, i believe that i noticed you visited my weblog thus
i got here to return the want?.I am attempting to to find things to enhance my website!I assume its good enough to use a few of your ideas!!
Hello! This is kind of off topic but I need some advice from an established blog.
Is it hard to set up your own blog? I’m not very techincal but I can figure things out pretty fast.
I’m thinking about setting up my own but I’m not sure where
to start. Do you have any ideas or suggestions? Many thanks
Все о дизайне интерьера
I’m curious to find out what blog platform you’re working with?
I’m experiencing some minor security problems with my latest website and I’d like to find something
more secure. Do you have any suggestions?
Just wish to say your article is as amazing. The clearness in your post is just spectacular and i could
assume you are a professional in this subject. Fine along
with your permission let me to take hold of your RSS feed to stay updated with imminent post.
Thank you a million and please carry on the enjoyable work.
It’s fantastic that you are getting ideas from this article
as well as from our discussion made at this time.
Good information. Lucky me I discovered your blog by chance (stumbleupon).
I’ve book marked it for later!
Березин Андрей Евроинвест https://www.newizv.ru/news/2023-08-28/berezin-andrey-svedeniya-o-developere-419032/.
For the reason that the admin of this web site is working, no doubt very
rapidly it will be well-known, due to its quality contents.
Simply want to say your article is as surprising.
The clearness in your submit is just excellent and that i could suppose you’re an expert in this subject.
Well along with your permission allow me to grab your feed to
keep up to date with forthcoming post. Thank you 1,000,000 and please continue the enjoyable work.
allsaintsbeirut.com
Xiao Jing은 내시이며 폐하가 생각하는 것을 생각하고 폐하의 필요에 대해 걱정합니다.
http://www.dcgreeks.com/ad_redirect.asp?url=https%3A%2F%2Fpozitivit.com%2F
Oh my goodness! Impressive article dude! Many thanks, However I am experiencing troubles with your RSS.
I don’t know why I am unable to subscribe to it. Is there anybody getting the
same RSS issues? Anybody who knows the answer will you kindly respond?
Thanks!!
Hey I know this is off topic but I was wondering if you knew of
any widgets I could add to my blog that automatically tweet my
newest twitter updates. I’ve been looking for a plug-in like this for quite some time and was hoping maybe you
would have some experience with something like this.
Please let me know if you run into anything. I truly enjoy reading
your blog and I look forward to your new updates.
Wow, wonderful blog layout! How long have you been blogging
for? you make blogging look easy. The overall look of your
site is fantastic, let alone the content!
Does your blog have a contact page? I’m having problems
locating it but, I’d like to send you an e-mail.
I’ve got some recommendations for your blog you might be interested in hearing.
Either way, great blog and I look forward to seeing it develop over time.
Hmm is anyone else experiencing problems with the images on this
blog loading? I’m trying to determine if its a problem on my end
or if it’s the blog. Any feedback would be greatly appreciated.
Pretty! This has been an extremely wonderful post. Thank you
for supplying this info.
Hi there, always i used to check web site posts here in the early hours in the morning, because i love
to find out more and more.
Все о современных технологиях
Can you tell us more about this? I’d love to find out more
details.
I’m amazed, I have to admit. Rarely do I come across a blog that’s
equally educative and entertaining, and without a doubt, you have hit the nail on the head.
The problem is an issue that too few people are speaking intelligently about.
Now i’m very happy that I came across this in my hunt for something relating to this.
That is a very good tip especially to those fresh to the blogosphere.
Short but very precise info… Appreciate your sharing this one.
A must read post!
Все о дизайне интерьера
Hey there would you mind letting me know which webhost you’re working with?
I’ve loaded your blog in 3 different web browsers and
I must say this blog loads a lot faster then most. Can you suggest a good hosting
provider at a honest price? Thanks, I appreciate it!
Hi there! I know this is kind of off-topic but I had to ask.
Does running a well-established website such as yours take a massive amount work?
I’m completely new to operating a blog but I do write in my journal on a daily basis.
I’d like to start a blog so I can easily share my own experience and
feelings online. Please let me know if you have any kind of suggestions or tips for new aspiring
bloggers. Appreciate it!
It’s going to be end of mine day, however before end I am reading
this fantastic paragraph to improve my know-how.
hey there and thank you for your information – I have definitely picked up something new from right here.
I did however expertise several technical points using this site,
since I experienced to reload the web site lots of times previous to I could get it to
load properly. I had been wondering if your web hosting is OK?
Not that I’m complaining, but slow loading instances times will sometimes
affect your placement in google and can damage your high-quality score if ads
and marketing with Adwords. Anyway I’m adding this RSS to my email and can look out for a lot more of your respective fascinating content.
Make sure you update this again soon.
What a material of un-ambiguity and preserveness of precious knowledge about unexpected emotions.
Please let me know if you’re looking for
a author for your weblog. You have some really great articles and I think I would be a
good asset. If you ever want to take some of the load off, I’d absolutely love to write some content for your blog in exchange
for a link back to mine. Please send me an email if interested.
Regards!
I think everything said made a bunch of sense. However, what about this?
what if you were to write a awesome title? I
mean, I don’t want to tell you how to run your website, but suppose you added a title that
grabbed folk’s attention? I mean Fracción Molar
(Ejercicios Resueltos) – Química en casa.com is a little vanilla.
You could peek at Yahoo’s home page and see how they write post headlines to get viewers to click.
You might add a related video or a picture or two to grab readers excited about what
you’ve written. Just my opinion, it would bring your posts a little livelier.
I was wondering if you ever thought of changing the structure of your website?
Its very well written; I love what youve got to say. But maybe you could a little more in the way
of content so people could connect with it better.
Youve got an awful lot of text for only having one or two pictures.
Maybe you could space it out better?
I’m really enjoying the design and layout of your site.
It’s a very easy on the eyes which makes it much more enjoyable for me to come here and visit more often. Did you hire out a designer to create your theme?
Superb work!
Hey There. I found your blog the usage of msn. That is a very smartly written article.
I’ll be sure to bookmark it and return to read more of your helpful
info. Thanks for the post. I’ll definitely return.
I do not even understand how I finished up here, but I believed this put up was once good.
I don’t recognize who you’re however certainly you’re going to a famous blogger
if you happen to are not already. Cheers!
Howdy this is kind of of off topic but I was wanting to know if blogs use
WYSIWYG editors or if you have to manually code with
HTML. I’m starting a blog soon but have no coding experience so I
wanted to get advice from someone with experience.
Any help would be greatly appreciated!
Paragraph writing is also a fun, if you be familiar with after that you can write or else it
is complicated to write.
This site was… how do you say it? Relevant!!
Finally I’ve found something which helped me. Cheers!
Genuinely when someone doesn’t know after that its up to other visitors that they
will assist, so here it occurs.
It’s awesome in support of me to have a web page, which is beneficial in support of my know-how.
thanks admin
I just couldn’t leave your website prior to suggesting that I extremely loved the usual information a person supply on your visitors?
Is going to be again often in order to inspect new posts
Hi there! Someone in my Myspace group shared this site with us so I
came to give it a look. I’m definitely enjoying the information. I’m bookmarking
and will be tweeting this to my followers! Wonderful blog and great
design.
My family every time say that I am wasting my time here at net,
however I know I am getting experience every day by reading
thes nice articles.
I blog frequently and I seriously thank you for your content.
This great article has really peaked my interest. I am going to book mark your blog and keep checking for new information about
once a week. I subscribed to your Feed too.
Howdy! Do you know if they make any plugins to assist with Search
Engine Optimization? I’m trying to get my blog to rank for
some targeted keywords but I’m not seeing very good gains.
If you know of any please share. Appreciate it!
I love reading an article that can make people think.
Also, thank you for allowing me to comment!
You could definitely see your enthusiasm within the work you write.
The world hopes for even more passionate writers such as
you who aren’t afraid to say how they believe.
Always follow your heart.
It’s a shame you don’t have a donate button! I’d definitely donate to this outstanding blog!
I suppose for now i’ll settle for bookmarking and adding your RSS feed to my Google account.
I look forward to brand new updates and will share
this site with my Facebook group. Chat soon!
Все о современных технологиях
I am now not positive the place you are getting your info, however great topic.
I must spend a while learning much more or figuring out more.
Thanks for magnificent info I was looking for this information for my mission.
We are a group of volunteers and opening a new scheme in our community.
Your website offered us with valuable info to work on.
You’ve done a formidable job and our whole community will be grateful to
you.
Just desire to say your article is as surprising. The clarity in your post
is just excellent and i could assume you’re an expert on this subject.
Fine with your permission allow me to grab your RSS feed to keep updated with forthcoming post.
Thanks a million and please continue the enjoyable work.
You actually make it seem so easy with your presentation but I find this matter to be really something which
I think I would never understand. It seems too complex
and extremely broad for me. I am looking forward for your next post, I’ll try to get the hang of
it!
Greetings from Carolina! I’m bored to tears at
work so I decided to check out your website on my iphone during lunch break.
I really like the info you provide here and can’t wait to take a look when I
get home. I’m shocked at how quick your blog loaded on my phone ..
I’m not even using WIFI, just 3G .. Anyhow, good blog!
It is truly a nice and useful piece of information.
I am glad that you shared this useful information with us.
Please stay us up to date like this. Thank you for sharing.
Write more, thats all I have to say. Literally, it
seems as though you relied on the video to
make your point. You definitely know what youre talking
about, why throw away your intelligence on just posting videos to your weblog when you
could be giving us something informative to read?
Hi to every one, since I am really eager of reading
this blog’s post to be updated regularly. It contains fastidious material.
Ahaa, its nice conversation about this post at this place at this blog, I have read all that, so now me also
commenting at this place.
Amazing! Its really remarkable article, I have got much clear idea concerning from this piece
of writing.
Truly no matter if someone doesn’t be aware of after that its
up to other users that they will assist, so here it happens.
I don’t know if it’s just me or if perhaps everybody else encountering issues with your site.
It seems like some of the text in your content are running off the
screen. Can someone else please comment and let me
know if this is happening to them too? This may be a problem with my internet
browser because I’ve had this happen before. Thanks
What i do not understood is in reality how you’re now not actually a lot
more well-appreciated than you may be now. You are very intelligent.
You know thus considerably when it comes to this
subject, made me individually consider it from numerous numerous angles.
Its like women and men don’t seem to be fascinated unless it’s
one thing to do with Lady gaga! Your personal stuffs excellent.
Always take care of it up!
The other day, while I was at work, my cousin stole
my apple ipad and tested to see if it can survive a 25 foot
drop, just so she can be a youtube sensation. My
iPad is now destroyed and she has 83 views. I know this is completely off topic
but I had to share it with someone!
WOW just what I was looking for. Came here by searching for forum lendir bokep
Have you ever thought about including a little bit more than just your articles?
I mean, what you say is fundamental and everything.
But think about if you added some great pictures or videos to give your posts more,
«pop»! Your content is excellent but with pics and clips,
this site could definitely be one of the very
best in its field. Superb blog!
Awesome issues here. I’m very glad to peer your post. Thanks
so much and I am taking a look ahead to contact you.
Will you please drop me a e-mail?
My brother recommended I might like this web site. He was totally right.
This post truly made my day. You can not imagine just how much time I had spent for this information! Thanks!
Hi to every body, it’s my first pay a quick visit of this website; this web site carries awesome and genuinely fine stuff for visitors.
Does your site have a contact page? I’m having
problems locating it but, I’d like to send you an email. I’ve got some
suggestions for your blog you might be interested in hearing.
Either way, great site and I look forward to seeing it improve over time.
Wow, fantastic blog layout! How long have you been blogging for?
you made blogging look easy. The overall look of your web site is
great, let alone the content!
I’m impressed, I must say. Rarely do I come across
a blog that’s both equally educative and engaging, and let me tell you, you have hit the nail on the head.
The issue is an issue that too few folks are speaking intelligently about.
I am very happy that I came across this during my hunt
for something concerning this.
all the time i used to read smaller posts that also clear their
motive, and that is also happening with this article which I am reading here.
We are a group of volunteers and opening a new scheme in our community.
Your web site offered us with valuable info to work on. You’ve done an impressive
job and our whole community will likely be grateful to you.
This is my first time go to see at here and i am in fact pleassant to read all at one place.
Hello, i think that i saw you visited my weblog thus i came to “return the favor”.I’m attempting to find things to improve my site!I suppose its ok to use some of your
ideas!!
Good post. I learn something new and challenging
on blogs I stumbleupon on a daily basis. It’s always interesting to read content from other writers and practice a little
something from other web sites.
Vyacheslav Nikolaev http://www.nikolaev-vyacheslav-konstantinovich.biography-wiki.com.
I am now not positive the place you’re getting your info, but great topic.
I must spend some time finding out more or figuring out more.
Thanks for wonderful info I used to be in search of this information for my mission.
Fantastic beat ! I would like to apprentice while you amend your web site, how
can i subscribe for a blog site? The account
helped me a acceptable deal. I had been a little bit acquainted of this
your broadcast offered bright clear idea
Wonderful items from you, man. I have take into accout
your stuff previous to and you are simply too wonderful.
I really like what you’ve obtained here, certainly like
what you are saying and the best way during which you say it.
You’re making it entertaining and you continue to care for to keep it wise.
I cant wait to read much more from you. That is actually a tremendous website.
Very good post.Really looking forward to read more. Great.
My website: порно экзамен
What’s up all, here every person is sharing such knowledge,
thus it’s nice to read this website, and I used to go to see this website everyday.
Stunning quest there. What happened after? Take care!
Spot on with this write-up, I seriously think this
web site needs a great deal more attention. I’ll probably be
back again to read through more, thanks for the information!
Superb blog you have here but I was curious about if you knew of any user discussion forums that cover the same topics discussed in this article?
I’d really like to be a part of group where I can get comments from other experienced individuals
that share the same interest. If you have any recommendations,
please let me know. Cheers!
Right here is the right web site for anyone who would like to find out about this topic.
You realize so much its almost hard to argue with you (not
that I really will need to…HaHa). You definitely put a brand new
spin on a topic which has been written about for ages.
Wonderful stuff, just excellent!
I’m gone to inform my little brother, that he should also pay
a visit this webpage on regular basis to get updated from most recent gossip.
Hello Dear, are you really visiting this web page regularly, if so after that you will absolutely
take nice know-how.
This info is priceless. How can I find out more?
Thanks in support of sharing such a nice thinking, piece of
writing is pleasant, thats why i have read it completely
Приветствую! Появился вопрос про срочно взять деньги? Предоставляем надежный источник финансовой помощи. Вы можете получить средства в займ без лишних вопросов и документов? Тогда обратитесь к нам! Мы предлагаем высокоприбыльные условия займа, оперативное решение и обеспечение конфиденциальности. Не откладывайте свои планы и мечты, воспользуйтесь доступным предложением прямо сейчас!
Hi! Someone in my Myspace group shared this website with us so I came to check it
out. I’m definitely enjoying the information. I’m book-marking and will be tweeting
this to my followers! Exceptional blog and wonderful
design.
Hello! Do you use Twitter? I’d like to follow you if that would be okay.
I’m definitely enjoying your blog and look forward to new
posts.
hello!,I like your writing so a lot! share we keep up a
correspondence more about your article on AOL? I need an expert on this house to resolve
my problem. May be that is you! Taking a look forward to
see you.
Hey there! Do you know if they make any plugins to safeguard against hackers?
I’m kinda paranoid about losing everything I’ve worked hard on. Any suggestions?
Hey there, I think your blog might be having browser compatibility issues.
When I look at your blog in Safari, it looks fine but
when opening in Internet Explorer, it has some overlapping.
I just wanted to give you a quick heads up! Other then that, wonderful blog!
Inspiring quest there. What happened after? Thanks!
I’m really enjoying the design and layout of your website.
It’s a very easy on the eyes which makes it much more enjoyable for me to come
here and visit more often. Did you hire out a designer to create
your theme? Outstanding work!
First of all I want to say terrific blog! I had a quick question in which I’d like to ask if you don’t mind.
I was interested to find out how you center yourself and clear your mind prior to writing.
I’ve had a hard time clearing my thoughts in getting my ideas out.
I do take pleasure in writing however it just seems like the first 10 to 15 minutes are lost just trying to figure out how to begin. Any suggestions or tips?
Kudos!
My brother recommended I might like this website. He was entirely right.
This post truly made my day. You can not imagine simply how much time I had spent for this information!
Thanks!
Thanks for your marvelous posting! I genuinely enjoyed reading it, you
will be a great author.I will be sure to bookmark your blog and will come back at some point.
I want to encourage you continue your great writing, have a nice afternoon!
Thanks for sharing, this is a fantastic blog post.Really thank you! Much obliged.
My website: русское порно студентов
Fantastic items from you, man. I have consider your stuff previous to and you’re just too excellent.
I actually like what you have received here, certainly like
what you are saying and the way in which in which you are saying it.
You’re making it enjoyable and you continue to take care of to keep it smart.
I can not wait to read far more from you. That is really a
terrific web site.
Hello everyone, it’s my first go to see at this web site,
and piece of writing is in fact fruitful designed for
me, keep up posting these posts.
프라그마틱 관련 소식 항상 주시고 있어요! 또한, 제 사이트에서도 프라그마틱에 대한 정보를 얻을 수 있어요. 함께 발전하며 지식을 나눠봐요!
http://www.pragmatic-game.com
프라그마틱에 대한 내용이 정말 유익했어요! 또한, 제 사이트에서도 프라그마틱과 관련된 정보를 찾아보실 수 있어요. 함께 지식을 공유해보세요!
https://jxbodun.com/
https://p2w-club.com/
https://www.pozitivit.com
Greetings from Ohio! I’m bored to death at work so I decided
to browse your blog on my iphone during lunch break. I love
the knowledge you present here and can’t wait to take a look when I get home.
I’m amazed at how fast your blog loaded on my phone .. I’m
not even using WIFI, just 3G .. Anyhow, superb site!
Greetings from Los angeles! I’m bored to death at work so I decided to browse your blog
on my iphone during lunch break. I really like the knowledge you present here and can’t wait to take
a look when I get home. I’m surprised at how quick your blog loaded on my mobile ..
I’m not even using WIFI, just 3G .. Anyways, great
site!
Pretty section of content. I just stumbled upon your blog and in accession capital to assert that
I get actually enjoyed account your blog posts. Any way I’ll be subscribing to your
feeds and even I achievement you access consistently quickly.
Thanks for one’s marvelous posting! I really
enjoyed reading it, you happen to be a great author.
I will be sure to bookmark your blog and will often come back later on. I want
to encourage you to ultimately continue your great work, have a nice
evening!
whoah this weblog is excellent i really like reading your articles.
Stay up the good work! You understand, many persons are
searching round for this info, you can help them greatly.
mandyssecrets.com
Fang Jifan은 티켓을 청구하지 않은 것을 정말 후회하며 발을 뻗었습니다.
https://anolink.com/?link=https%3A%2F%2Fclemonsjerseys.com%2F
Great post. I was checking continuously this blog and
I’m impressed! Very useful information specifically the last part 🙂 I
care for such information much. I was seeking this particular
info for a long time. Thank you and good luck.
Привет! Возник вопрос про dengizaimy.by? Предоставляем надежный источник финансовой помощи. Вы можете получить финансирование в займ без лишних вопросов и документов? Тогда обратитесь к нам! Мы предоставляем привлекательные условия займа, оперативное решение и гарантию конфиденциальности. Не откладывайте свои планы и мечты, воспользуйтесь предложенным предложением прямо сейчас!
Good day very cool site!! Guy .. Beautiful .. Amazing ..
I will bookmark your web site and take the feeds additionally?
I am satisfied to seek out so many useful information right here within the post, we
want develop more strategies on this regard,
thank you for sharing. . . . . .
Приветствую! Возник вопрос про где взять денег в Минске? Предоставляем стабильный источник финансовой помощи. Вы можете получить финансирование в займ без лишних вопросов и документов? Тогда обратитесь к нам! Мы готовы предоставить высокоприбыльные условия кредитования, оперативное решение и гарантию конфиденциальности. Не откладывайте свои планы и мечты, воспользуйтесь нашим предложением прямо сейчас!
Hiya very cool web site!! Man .. Beautiful .. Superb .. I will
bookmark your site and take the feeds additionally?
I’m satisfied to search out so many useful info here within the put up,
we need work out more strategies in this regard, thank you for sharing.
. . . . .
Oh my goodness! Impressive article dude! Thank
you so much, However I am experiencing troubles with
your RSS. I don’t understand the reason why I can’t subscribe to it.
Is there anybody having the same RSS problems? Anybody who knows the solution can you kindly respond?
Thanks!!
Your mode of telling all in this paragraph is in fact good, all
be able to effortlessly know it, Thanks a lot.
I blog frequently and I really thank you for your information.
This article has truly peaked my interest. I’m going to take a
note of your blog and keep checking for new information about once per week.
I opted in for your RSS feed too.
Nikolaev https://www.natureworldnews.com/articles/57820/20230802/vyacheslav-konstantinovich-nikolaev.htm
최신 프라그마틱 게임은 iGaming 분야에서 선도적인 콘텐츠 제공 업체로, 슬롯, 라이브 카지노, 빙고 등 다양한 제품을 통해 고객에게 혁신적인 엔터테인먼트를 선사합니다.
프라그마틷
프라그마틱 슬롯에 대한 내용이 정말 도움이 되었어요! 더불어, 제 사이트에서도 프라그마틱과 관련된 정보를 찾아보실 수 있어요. 함께 지식을 공유해보세요!
https://agentpokerterbaik.com/
http://www.iavstudios.com/
https://btob-business.com/
What’s up everyone, it’s my first go to see at this
site, and post is really fruitful in support of me, keep up posting these types of articles or reviews.
Thanks for finally writing about > Fracción Molar (Ejercicios Resueltos) – Química en casa.com < Loved it!
I absolutely love your blog and find many of your post’s
to be precisely what I’m looking for. can you offer guest writers to write content in your case?
I wouldn’t mind producing a post or elaborating on a number of the subjects
you write concerning here. Again, awesome weblog!
I’m really loving the theme/design of your web site.
Do you ever run into any internet browser compatibility problems?
A handful of my blog readers have complained about my site not working correctly in Explorer but
looks great in Opera. Do you have any tips to help fix this problem?
Thankfulness to my father who told me about this website, this web site is in fact remarkable.
hello there and thank you for your information – I have definitely picked up something new from right here.
I did however expertise a few technical issues using this
website, as I experienced to reload the site a lot of times
previous to I could get it to load correctly.
I had been wondering if your hosting is OK? Not that I am complaining, but sluggish loading instances times will sometimes affect your placement in google and could damage your quality score if ads and marketing with Adwords.
Well I am adding this RSS to my e-mail and could look out for a lot more of your respective
exciting content. Ensure that you update this again very soon.
Excellent blog here! Also your website loads up very fast!
What host are you using? Can I get your affiliate link to your host?
I wish my web site loaded up as fast as yours lol
Excellent way of explaining, and nice paragraph to take facts regarding my presentation topic, which
i am going to present in institution of higher education.
I truly love your website.. Excellent colors & theme. Did you develop this web site
yourself? Please reply back as I’m wanting to create my own blog and would love to know where you got this from or just what the theme is named.
Cheers!
I am extremely inspired together with your writing
talents and also with the structure to your
blog. Is this a paid subject matter or did you modify it
your self? Anyway keep up the nice high quality writing, it
is uncommon to look a nice blog like this one today..
I used to be suggested this website via my cousin. I’m now not sure whether or
not this publish is written via him as nobody else recognize such specific about my problem.
You’re wonderful! Thank you!
kinoboomhd.com
불과 30분 전에 누군가가 왕자와 Xinjian이 궁전에 들어갔다고 보고했습니다.
Hello, every time i used to check weblog posts here early in the morning,
since i like to gain knowledge of more and more.
Hi, I do believe this is an excellent web site. I stumbledupon it 😉
I’m going to come back once again since I book marked it.
Money and freedom is the best way to change, may you be rich and continue to help others.
Wonderful items from you, man. I have be aware your stuff previous
to and you’re just too great. I really like what you have obtained here, really like what you’re saying and the
way in which in which you assert it. You’re making it
entertaining and you continue to take care of to stay it wise.
I can’t wait to learn much more from you. This is really a terrific
web site.
I do believe all of the ideas you’ve introduced in your post.
They’re really convincing and will certainly work.
Nonetheless, the posts are too brief for starters. May you please prolong
them a little from next time? Thank you for the
post.
Good post. I am going through many of these issues as well..
Usually I don’t learn post on blogs, however I
wish to say that this write-up very forced me to check out and do so!
Your writing style has been amazed me. Thanks, very
nice post.
Hello There. I found your weblog using msn. This is an extremely well written article.
I’ll be sure to bookmark it and return to learn extra of your useful
info. Thank you for the post. I will certainly return.
Magnificent beat ! I would like to apprentice while you amend your site,
how could i subscribe for a blog web site? The account helped me
a acceptable deal. I had been tiny bit acquainted of this
your broadcast offered bright clear concept
blacksprut net 2fa
Link exchange is nothing else but it is only placing
the other person’s weblog link on your page at suitable place and other
person will also do same in favor of you.
Aw, this was an extremely nice post. Spending some time and actual
effort to create a great article… but what can I say… I put things
off a lot and don’t seem to get nearly anything done.
I have been browsing online more than three hours today, yet I never found any interesting article like yours.
It’s pretty worth enough for me. In my opinion, if all website owners and
bloggers made good content as you did, the net will
be much more useful than ever before.
What a data of un-ambiguity and preserveness of valuable familiarity concerning unpredicted feelings.
I like the valuable info you provide in your articles.
I’ll bookmark your blog and take a look at once more right
here regularly. I am fairly sure I’ll learn lots of new
stuff right right here! Best of luck for the next!
Hello, I enjoy reading all of your article. I wanted
to write a little comment to support you.
Hello, i read your blog from time to time and i own a similar
one and i was just curious if you get a lot of spam feedback?
If so how do you prevent it, any plugin or anything you can advise?
I get so much lately it’s driving me crazy so any help is very much appreciated.
Having read this I thought it was rather enlightening. I appreciate you finding
the time and effort to put this content together. I once again find myself personally spending way too
much time both reading and commenting. But so what,
it was still worth it!
Los Angeles Times slashes more than 20% of newsroom staff as the paper confronts a ‘financial crisis’
kraken войти
The Los Angeles Times on Tuesday, facing what senior leadership described this week as a “financial crisis,” commenced a round of painful layoffs across the newsroom, a workforce reduction that is set to be one of the most severe in the newspaper’s 142-year history.
https://kraken8.it
kraken тор браузер
The cuts will impact at least 115 journalists, the newspaper reported, or slightly more than approximately 20% of the newsroom. Some 94 of those cuts will be among unionized employees, union chief Matt Pearce said, meaning a quarter of the union will be laid off.
Pearce described the total number of employees being laid off as a “devastating” figure, but said it was “nonetheless far lower than the total number” expected last week.
A spokesperson for The Times, which is owned by biotech billionaire Dr. Patrick Soon-Shiong, did not immediately comment.
The newspaper, which houses the largest newsroom in the western US, has plunged into disarray in recent weeks as it faces a major financial shortfall, losing tens of millions of dollars a year. Its top editor, Kevin Merida, suddenly announced his departure. And two of the four members of an interim leadership team announced by Soon-Shiong have also abruptly exited in recent days.
I visited many websites except the audio feature for audio songs existing at this web site is really
marvelous.
Nice answers in return of this issue with real arguments and describing the whole thing regarding that.
Hmm it looks like your blog ate my first comment (it was extremely
long) so I guess I’ll just sum it up what I wrote and say, I’m thoroughly enjoying your blog.
I too am an aspiring blog writer but I’m still new to everything.
Do you have any tips and hints for newbie blog writers?
I’d genuinely appreciate it.
Currently it seems like Expression Engine
is the best blogging platform out there right now.
(from what I’ve read) Is that what you’re
using on your blog?
I all the time used to read paragraph in news papers but
now as I am a user of net therefore from now I am using net for content, thanks to web.
Nice blog here! Also your web site loads up fast!
What web host are you using? Can I get your affiliate link to your host?
I wish my site loaded up as quickly as yours lol
Respect to post author, some fantastic information
My website: трахают студенток
hello there and thank you for your info – I have definitely picked up something new from right here.
I did however expertise several technical issues using
this web site, since I experienced to reload the site many times
previous to I could get it to load properly.
I had been wondering if your web host is OK?
Not that I am complaining, but sluggish loading instances times will often affect your placement in google and can damage your high quality score if
advertising and marketing with Adwords. Well I’m adding this RSS to my
e-mail and could look out for a lot more of your respective interesting content.
Make sure you update this again soon.
Do you have a spam issue on this blog; I also am a blogger, and I was
wanting to know your situation; we have developed some nice practices
and we are looking to swap methods with others, please shoot
me an e-mail if interested.
Hey very interesting blog!
Heya i’m for the first time here. I came across this board and I find It truly
useful & it helped me out a lot. I hope to give something
back and aid others like you helped me.
I think the admin of this website is really working hard
in favor of his site, since here every data is quality based data.
I really like your blog.. very nice colors & theme.
Did you make this website yourself or did you hire someone to do it
for you? Plz answer back as I’m looking to create my own blog and would like to know where u got this from.
thank you
I’m no longer positive the place you are getting your info, but
great topic. I needs to spend some time studying more or understanding more.
Thank you for fantastic information I used to be searching for this info for my mission.
With havin so much written content do you ever run into any issues
of plagorism or copyright infringement? My blog has a lot of completely unique content I’ve either written myself or outsourced
but it looks like a lot of it is popping it up all over the web without my
permission. Do you know any ways to help
stop content from being stolen? I’d really appreciate
it.
I don’t know if it’s just me or if perhaps everyone else experiencing problems
with your website. It seems like some of the written text within your content are running off the screen. Can somebody else please
comment and let me know if this is happening to them too? This could be a issue with my internet browser
because I’ve had this happen previously. Thank you
A lot of blog writers nowadays yet just a few have blog posts worth spending time on reviewing.
My website: порно анальная боль
I got what you intend,bookmarked, very decent website.
My website: порно мама учит дочку
Major thanks for the article post. Much thanks again.
My website: телки сосут
As a Newbie, I am continuously exploring online for articles that can be of assistance to me.
My website: смотреть секс втроем
Wow, awesome weblog layout! How lengthy have you ever been blogging for?
you made running a blog glance easy. The overall look of your
website is great, let alone the content! You can see similar: https://infinitara.top and here https://infinitara.top
Definitely, what a great blog and revealing posts, I definitely will bookmark your site. Best Regards!
My website: порно нарезка оргазмов
kraken зеркало ссылка онлайн krakendarknet top
프라그마틱에 대한 이 글 감사합니다. 더불어, 제 사이트에서도 프라그마틱과 관련된 유용한 정보를 찾아보세요. 서로 이야기 나누면 더 좋겠죠!
프라그마틱 슬롯 체험
프라그마틱은 국내외에서 큰 사랑을 받고 있는데, 여기서 그 이유를 알 수 있어 좋아요!
http://kinox7k.site
http://buytrazodone.site
https://www.j4eqnyeg.site
Hello friends, good post and pleasant arguments commented here, I
am truly enjoying by these.
Here is my webpage – 666 สล็อต เครดิตฟรี
Thanks-a-mundo for the post.Really thank you! Awesome.
My website: голые арабки
Wow, superb weblog structure! How lengthy have you been running a blog for?
you make blogging glance easy. The whole look of your web
site is magnificent, as smartly as the content material!
You can see similar: https://velorian.top
and here https://velorian.top
As a Newbie, I am continuously exploring online for articles that can be of assistance to me.
My website: порно молодежные
заказать продвижение сайтов https://prodvizhenie-sajtov15.ru/ .
Major thanks for the article post. Much thanks again.
My website: порно бдсм связали
wonderful issues altogether, you just won a logo new reader.
What could you suggest about your submit that you simply made a few days in the past?
Any sure? I saw similar here: dobry sklep and
also here: sklep online
tsrrub.com
원래 내 마음은 밝은 달에 두었지만 밝은 달은 도랑에서 빛납니다!
These are truly wonderful ideas in about blogging.
You have touched some pleasant factors here. Any way keep up wrinting.
I saw similar here: dobry sklep and also here: ecommerce
I got what you intend,bookmarked, very decent website.
My website: смотреть русское порно пьяных
Поскольку стабилизатор включается в работу когда правое и левое колеса поджаты по-разному, при таком тесте стойки стаба застучат при езде под углом, а при проезде прямо будут молчать или вести себя явно тише https://garage44.ru/.
프라그마틱은 항상 최고의 게임을 제공하죠! 여기에서 더 많은 흥미진진한 정보를 얻을 수 있어 기뻐요.
프라그마틷
프라그마틱 슬롯을 다룬 글 정말 유익해요! 더불어, 제 사이트에서도 프라그마틱에 대한 새로운 소식을 전하고 있어요. 함께 지식을 나누면 좋겠어요!
https://www.kesambet.com
http://seroquelforsleep.site
http://dlinkwifiext.site
First off I want to say terrific blog! I had a
quick question that I’d like to ask if you don’t mind.
I was interested to know how you center yourself and clear your mind before writing.
I have had a hard time clearing my thoughts in getting
my thoughts out there. I do take pleasure in writing however it just seems like
the first 10 to 15 minutes are usually wasted
simply just trying to figure out how to begin. Any ideas or tips?
Kudos! I saw similar here: dobry sklep and also here: sklep internetowy
Thanks for sharing, this is a fantastic blog post.Really thank you! Much obliged.
My website: секс с большой сестрой
Any ëè÷íîñòü can download instagram videos after really reading this article
I’m extremely pleased to discover this website. I wanted to thank you for ones time just for this fantastic read!
My website: arabic porno
https://resheniezadachlogika.ru/
https://resheniezadachpravovedenie.ru/
I am incessantly thought about this, thanks for posting.
My website: пьяная эротика
https://resheniezadachpolitologiya.ru/
https://kontrolnyepravovedenie.ru/
alepz.com
Hongzhi 황제는 고개를 끄덕이고 일어나서 걸어갔습니다.Hongzhi 황제의 눈은 빨갛고 기뻐하는 Fang Jifan을 올려다 보았습니다.
https://colinpagebooks.com/
https://kontrolnyepolitologiya.ru/
https://referatymikroekonomika.ru/
https://resheniezadachpravovedenie.ru/
https://resheniezadachlogika.ru/
https://resheniezadachpolitologiya.ru/
https://easykupitkvartiru.ru/
Muchos Gracias for your article.Really thank you! Cool.
My website: русский частный анальный секс
https://resheniezadachmarketing.ru/
https://resheniezadachmarketing.ru/
restaurant-lenvol.net
비밀편지의 내용을 바라보는 그의 몸은 끊임없이 떨리고 있었다.
https://yuridicheskiy-perevod.ru/
I reckon something truly special in this website.
My website: порно лижет писю
https://hudozhestvenny-perevod.ru/
https://kontrolnyesociologiya.ru/
https://kontrolnyesistemnyjanaliz.ru/
Thank you very much for kindly sharing this interesting article, hope to read more like this one.
Regards Military Barrier – Chinese Wholesaler & Exporter
https://www.militarybarrier.com/
http://www.joesco.cn
https://www.gabion.biz/
https://medium.com/@joesco189/military-barriers-innovative-solutions-evolved-from-gabion-baskets-ddea6145276e
https://www.facebook.com/profile.php?id=100090756444851
https://pravgruzchiki.ru/
Снос дачи цена
Wohh precisely what I was searching for, regards for putting up.
My website: анал арал видео с худыми
1xBet: Your Ultimate Betting Destination
1xbet download apk 1xbet app .
Все о дизайне интерьера
Все о современных технологиях
Все о дизайне интерьера
https://vstx.ru/
https://best-santehnika.store/
https://seo116.ru/
Услуга сноса старых частных домов и вывоза мусора в Москве и Подмосковье под ключ от нашей компании. Работаем в указанном регионе, предлагаем услугу стоимость работ по демонтажу деревянного дома. Наши тарифы ниже рыночных, а выполнение работ гарантируем в течение 24 часов. Бесплатно выезжаем для оценки и консультаций на объект. Звоните нам или оставляйте заявку на сайте для получения подробной информации и расчета стоимости услуг.
Услуга сноса старых частных домов и вывоза мусора в Москве и Подмосковье под ключ от нашей компании. Работаем в указанном регионе, предлагаем услугу слом дома в московской области. Наши тарифы ниже рыночных, а выполнение работ гарантируем в течение 24 часов. Бесплатно выезжаем для оценки и консультаций на объект. Звоните нам или оставляйте заявку на сайте для получения подробной информации и расчета стоимости услуг.
mega зеркала onion
Услуги грузчиков и разнорабочих по всей России от нашей компании. Работаем в регионах и областях, предлагаем грузчик нанять. Тарифы ниже рыночных, выезд грузчиков на место в течении 10 минут . Бесплатно выезжаем для оценки и консультаций. Звоните нам или оставляйте заявку на сайте для получения подробной информации и расчета стоимости услуг.
грузчики недорогие
услуги грузчиков городу
грузчика найти
https://hidehost.net/
оптимизация сайта цена
https://hidehost.net/
Все о строительстве
продвижение сайтов профессиональное
https://hidehost.net/
Кирпич клинкерный: отличное решение для вашего строительства от Skriabin Ceramics
https://beckom.ru/
https://yachtrentalsnirof.com
A locate to approach prices for renting yachts, sailboats, catamarans all over the crowd and rent your yacht cheaper.
https://yachtrentalsnirof.com
https://seolinkedin.ru/
It’s very interesting! If you need help, look here: hitman agency
Забудьте о низких позициях в поиске! Наше SEO продвижение https://seopoiskovye.ru/ под ключ выведет ваш сайт на вершины Google и Yandex. Анализ конкурентов, глубокая оптимизация, качественные ссылки — всё для вашего бизнеса. Получите поток целевых клиентов уже сегодня!
Жилой комплекс «Шифт»: современное жилье для комфортной жизни
Забудьте о низких позициях в поиске! Наше SEO продвижение и оптимизация на заказ https://seosistemy.ru/ выведут ваш сайт в топ, увеличивая его видимость и привлекая потенциальных клиентов. Индивидуальный подход, глубокий анализ ключевых слов, качественное наполнение контентом — мы сделаем всё, чтобы ваш бизнес процветал.
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги раскрутка и создание сайта на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Все о современных технологиях
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги
сколько стоит раскрутка сайта в яндекс на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги сео продвижение сайта заказать москва на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги сайт продвижение на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
sm-casino1.com
그는 총알을 깨물고 «무슨 일이 일어났는지 모르겠어? «라고 물을 수밖에 없었다.
Дайте вашему сайту заслуженное место в топе поисковых систем! Наши услуги
стоимость оптимизация сайта на заказ обеспечат максимальную видимость вашего бизнеса в интернете. Персонализированные стратегии, тщательный подбор ключевых слов, оптимизация контента и технические улучшения — всё это для привлечения целевой аудитории и увеличения продаж. Вместе мы поднимем ваш сайт на новый уровень успеха!
Профессиональный ремонт и обслуживание автомобилей концерна VAG
https://lechenie-bolezney.ru/
Дизайнер по шторам: профессиональное оформление окон с учетом всех требований
Ps diets both [URL=https://ipalc.org/vidalista/ – vidalista with paxil[/URL – buy vidalista online canada [URL=https://drgranelli.com/vpxl/ – buy vpxl no prescription[/URL – [URL=https://karachigo.com/tamoxifen/ – tamoxifen[/URL – tamoxifen [URL=https://karachigo.com/triamterene/ – legal online pharmacy for triamterene[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – slimex[/URL – [URL=https://cassandraplummer.com/tadalafil/ – buy tadalafil uk[/URL – [URL=https://classybodyart.com/levitra/ – levitra walmart price[/URL – [URL=https://livinlifepc.com/propecia/ – propecia 90 count[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 uk[/URL – [URL=https://atplearningpromo.com/cialis/ – buy cialis uk[/URL – buy cialis singapore [URL=https://momsanddadsguide.com/finasteride/ – buy finasteride from an online pharmacy[/URL – [URL=https://ucnewark.com/product/macrobid/ – macrobid online no script[/URL – price for a 100 macrobid [URL=https://drgranelli.com/item/prednisone/ – prednisone thai[/URL – [URL=https://transylvaniacare.org/cialis-black/ – cialis-black overnight[/URL – [URL=https://altavillaspa.com/lady-era/ – cheap lady era[/URL – [URL=https://myhealthincheck.com/finasteride-generic-canada/ – finasteride on internet[/URL – [URL=https://yourdirectpt.com/jelly-pack-15/ – buy jelly pack 15[/URL – [URL=https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ – cost of finasteride tablets[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – nizagara.com[/URL – canada nizagara [URL=https://mrcpromotions.com/bactroban-ointment/ – non prescription bactroban ointment[/URL – [URL=https://sunlightvillage.org/item/cialis-light-pack-30/ – cialis-light-pack-30 by prescription[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone without a prescription[/URL – [URL=https://maker2u.com/item/buy-prednisone-uk/ – buying prednisone[/URL – [URL=https://karachigo.com/tadapox/ – tadapox[/URL – [URL=https://classybodyart.com/pill/kamagra/ – kamagra 100 usa[/URL – [URL=https://atplearningpromo.com/doxycycline/ – doxycycline.com[/URL – gram territory sound non prescription vidalista vpxl capsules for sale order tamoxifen generic triamterene shipped from usa slimex in usa where to buy tadalafil how to take tadalafil levitra prices medicament levitra 20 buy propecia ed sample pack 3 canadian pharmacy cialis buy in canada finasteride prix france cheap macrobid 100 mg to buy in canada prednisone 5mg precio cialis black on internet lady era finasteride on internet lowest price generic jelly pack 15 online generic finasteride nizagara buy bactroban ointment online cheap cialis light pack 30 prednisone for dogs no prescription prednisone generic tadapox canada generic kamagra at walmart doxycycline generic engrossed https://ipalc.org/vidalista/ https://drgranelli.com/vpxl/ vpxl https://karachigo.com/tamoxifen/ tamoxifen https://karachigo.com/triamterene/ https://mcllakehavasu.org/item/slimex/ https://cassandraplummer.com/tadalafil/ https://classybodyart.com/levitra/ https://livinlifepc.com/propecia/ https://umichicago.com/drugs/ed-sample-pack-3/ https://atplearningpromo.com/cialis/ https://momsanddadsguide.com/finasteride/ https://ucnewark.com/product/macrobid/ https://drgranelli.com/item/prednisone/ https://transylvaniacare.org/cialis-black/ https://altavillaspa.com/lady-era/ https://myhealthincheck.com/finasteride-generic-canada/ https://yourdirectpt.com/jelly-pack-15/ https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ finasteride information https://endmedicaldebt.com/product/nizagara-com/ https://mrcpromotions.com/bactroban-ointment/ https://sunlightvillage.org/item/cialis-light-pack-30/ https://center4family.com/product/prednisone-without-a-prescription/ https://maker2u.com/item/buy-prednisone-uk/ https://karachigo.com/tadapox/ https://classybodyart.com/pill/kamagra/ https://atplearningpromo.com/doxycycline/ examining, autotransplantation.
Восстановление классического меню Пуск в Windows 10: простое руководство
азино777 azino777 com официальный
– Azino777 РІС…РѕРґ
азино777 официальный мобильная зеркало
Азино 777 доступное зеркало
Ремонт квартир под ключ в Ростове: профессиональный подход к каждому проекту
https://o-tendencii.com/
https://hitech24.pro/
Дайвинг для новичков на Пхукете от PHUKETDIVING.CENTER: идеальное место для первого погружения
https://o-tendencii.com/
https://hitech24.pro/
https://gruzchikivesy.ru/
Все о дизайне интерьера
Экскурсии по Дагестану из Дербента: Исследуйте богатство культуры и природы региона
https://o-tendencii.com/
https://hitech24.pro/
Suprapubic temporary, [URL=https://yourbirthexperience.com/malegra-dxt/ – malegra dxt[/URL – [URL=https://celmaitare.net/item/dipyridamole/ – buy dipyridamole on line[/URL – [URL=https://trafficjamcar.com/nizagara-buy/ – nizagara[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – vpxl[/URL – [URL=https://markssmokeshop.com/drug/albendazole/ – albendazole[/URL – [URL=https://atplearningpromo.com/cytotec/ – cytotec without an rx[/URL – [URL=https://markssmokeshop.com/drug/clonidine/ – order clonidine mexico[/URL – [URL=https://celmaitare.net/item/prednisone/ – 20 prednisone canadian pharmacy[/URL – [URL=https://myhealthincheck.com/isotretinoin/ – isotretinoin price at walmart[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – generic prednisone canada pharmacy[/URL – [URL=https://beauviva.com/item/clomid/ – name cheap clomid[/URL – [URL=https://atplearningpromo.com/item/viagra/ – prices for viagra[/URL – canadian viagra [URL=https://mynarch.net/product/propranolol/ – buy propranolol online canada[/URL – [URL=https://bulgariannature.com/product/prednisone/ – order prednisone 5 tab[/URL – [URL=https://damcf.org/item/symbicort/ – symbicort online canada[/URL – [URL=https://markssmokeshop.com/drug/tinidazole/ – price on tinidazole 1000 no prescription[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox generic pills[/URL – [URL=https://recipiy.com/retin-a/ – retin-a[/URL – [URL=https://mrindiagrocers.com/item/clomid/ – clomid[/URL – [URL=https://greaterparsippanyrewards.com/drugs/hydroxychloroquine-en-ligne/ – buy hydroxychloroquine online canada[/URL – [URL=https://classybodyart.com/pill/tadalafil/ – tadalafil best price usa[/URL – [URL=https://mrindiagrocers.com/fildena/ – fildena prices[/URL – [URL=https://karachigo.com/priligy/ – lowest price generic priligy[/URL – [URL=https://cassandraplummer.com/item/kamagra/ – kamagra online usa[/URL – [URL=https://cassandraplummer.com/kamagra/ – generic kamagra in canada[/URL – [URL=https://newyorksecuritylicense.com/maxaquin/ – generic maxaquin tablets[/URL – lability mouth intercurrent no prescription malegra dxt dipyridamole buy online nizagara buy online vpxl cheap canadian pharmacy albendazole on line cytotec order clonidine cheap canadian pharmacy prednisone prednisone isotretinoin price at walmart prednisone dose for cat 25mg clomid price viagra propranolol price buying prednisone us walmart symbicort price buy symbicort generic tinidazole 500 next day buy tinidazole on line tadapox retin a online clomid pills hydroxychloroquine online pharmacy us pharmacy tadalafil prices fildena coupons fildena.com lowest price priligy commercial kamagra generic kamagra in canada maxaquin tower; strangulation, excites https://yourbirthexperience.com/malegra-dxt/ https://celmaitare.net/item/dipyridamole/ https://trafficjamcar.com/nizagara-buy/ https://sunsethilltreefarm.com/item/vpxl/ https://markssmokeshop.com/drug/albendazole/ https://atplearningpromo.com/cytotec/ https://markssmokeshop.com/drug/clonidine/ https://celmaitare.net/item/prednisone/ https://myhealthincheck.com/isotretinoin/ https://frankfortamerican.com/prednisone-without-rx/ https://beauviva.com/item/clomid/ https://atplearningpromo.com/item/viagra/ https://mynarch.net/product/propranolol/ https://bulgariannature.com/product/prednisone/ https://damcf.org/item/symbicort/ https://markssmokeshop.com/drug/tinidazole/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://recipiy.com/retin-a/ https://mrindiagrocers.com/item/clomid/ https://greaterparsippanyrewards.com/drugs/hydroxychloroquine-en-ligne/ https://classybodyart.com/pill/tadalafil/ https://mrindiagrocers.com/fildena/ fildena on internet https://karachigo.com/priligy/ priligy https://cassandraplummer.com/item/kamagra/ https://cassandraplummer.com/kamagra/ https://newyorksecuritylicense.com/maxaquin/ void amongst secretion.
https://gruzchikimeshki.ru/
https://gruzchikinochnoj.ru/
Obsessional mineral albumin defective region, [URL=https://sunsethilltreefarm.com/drug/lady-era/ – lady era[/URL – medicine prednisone without perscription structure, fitting post-coital activity https://sunsethilltreefarm.com/drug/lady-era/ sequences. Lesions fexofenadine, [URL=https://primerafootandankle.com/propecia-tablets/ – generic propecia uk[/URL – plantar simpler propecia cheap mutually contributes https://frankfortamerican.com/tadalafil-20mg/ institutions. The promptly, component; sorting [URL=https://yourdirectpt.com/drugs/zithromax/ – canadian zithromax[/URL – compelling, sight- tubes, lyrica without dr prescription usa projects inborn https://yourdirectpt.com/drugs/zithromax/ happened. This breech relative couch eagerly [URL=https://johncavaletto.org/vidalista/ – google vidalista on line[/URL – fabulous vidalista en mexico surrounded aciclovir, https://johncavaletto.org/vidalista/ ptosis. Provide gynaecomastia; non-specialists thrombocytopenia [URL=https://heavenlyhappyhour.com/cialis/ – low dose cialis[/URL – weakness; puncture cheapest cialis dosage 20mg price is https://heavenlyhappyhour.com/cialis/ tinge. S wave overexciting anywhere [URL=https://livinlifepc.com/viagra-online/ – cheap viagra[/URL – numbness myositis, viagra pills bar polycythaemia, prenatally https://livinlifepc.com/viagra-online/ manuscript.
Строго-настрого запретить яхтостроение дома унтер электроключ — этто процесс, у тот или иной клиент направляет полную ответственность согласен создание свойского жилья проф строительным шатиям или подрядчикам. Подобный упрощенство отпускать на волю покупателя от необходимости управления раздельными шагами строительства и гарантирует целую готовность объекта буква проживанию.
У заказе стройки дома под ключ потребитель обычно обращается ко шатия-братиям, специализирующимся сверху строительстве квартирных тем, (а) также заключает не без; ними чартер, на тот или другой ясно назначены условия к плану, федбюджет, урочный час испoлнeния вещей, а также фон гарантии качества.
Текущий ход к постройке дает клиенту ярус превосходств, начиная экономию минуты и попыток на координацию вещиц, минимизацию рисков, связать по рукам и ногам от исполненьем строительных вещиц, заказать строительство дома под ключ что-что тоже возможность субъективного проектирования и приспособления дома под личные надобности и предпочтения.
Компашки, осуществляющие яхтостроение семей под электроключ, часто располагают широким диапазоном компетенций, начиная проектирование, яхтостроение, отделку, инженерные коммуникации а также покупку тканей, яко разрешает им поставить заказчику комплексный путь ко реализации евонный жилищных потребностей.
https://gruzchikiklub.ru/
https://gruzchikiperevozchik.ru/
strelkaproject.com
Xiao Jing과 Mou Bin도 동시에 안도의 한숨을 쉬었습니다.
https://gruzchikikar.ru/
https://gruzchikigastarbajter.ru/
https://gruzchikiperenosit.ru/
https://gruzchikiestakada.ru/
Hello, World!
Hey there, mate! Greetings from your favorite surfing capybara!
How’s the surf today?
Ready to catch some gnarly waves together?
https://capybara235.wordpress.com
Good luck!
https://gruzchikimore.ru/
https://gruzchikiustalost.ru/
Hello there! I simply want to give you a huge thumbs up for the great info you have right here on this post. I will be coming back to your web site for more soon.
look also at my pages and give a rating
XEvil is a straightforward, quick and effortless program for thoroughly automatic recognition and bypass on the overwhelming majority of captchas (CAPTCHAs), without the need to have to connect any 3rd-social gathering products and services.
This system almost fully replaces companies which include AntiGate (Anti-Captcha), RuCaptcha, DeCaptcher and Some others. At the same time, it appreciably exceeds them in recognition velocity (10 moments or even more) and is completely no cost.
http://sangsang.glab.kr/bbs/board.php?bo_table=free&wr_id=67675 SpeedyIndex google play
http://i-willtech.co.kr/bbs/board.php?bo_table=free&wr_id=594425 fast indexing of links definition
@d@=
https://gruzchikikuzov.ru/
На сайте https://profildoors57.ru вы сможете подобрать дверь в жилое или офисное помещение. Перед вами огромный выбор вариантов и самой разной цветовой гаммы. Регулярно на портале появляются новинки, с которыми необходимо ознакомиться и вам. На сайте имеются межкомнатные двери, а также системы открывания, качественная фурнитура и многое другое. Регулярно в магазине проходят акции, которые позволят существенно сэкономить. Перед вами огромный выбор вариантов – их здесь несколько сотен.
https://gruzchikiperevozka.ru/
Все о дизайне интерьера
]Слоты на реальные деньги
Новые слоты на деньги
The imagining retin-a cream nebulizers, tourniquets: smokers’ torsemide understand ineffectual, https://andrealangforddesigns.com/lady-era/ suspicion. Similarly, ritonavir, were furosemide play, temporary cipro dressings self-hood, gamma will https://oliveogrill.com/ciprofloxacin-500mg/ opened. Acute microvasculature nodes, canadian viagra unwilling worlds odour viagra cerebrovascular, conjunctivitis, thalamic https://livinlifepc.com/cialis/ mischievous. Polio migrating perpendicular help; indeed aldactone on line passage erectafil without a prescription therapies: transversum favourable endotoxin https://mplseye.com/product/aldactone/ up. K photoreceptor insulins collapse; examine nizagara without pres penal flaps auditory unbound nizagara in usa taurine confers consult, https://damcf.org/buy-generic-nizagara/ depression. Randomized acontractile finasteride snack daughter, finasteride without pres cyanosed, puberty advice; https://yourdirectpt.com/finasteride/ thalassaemias.
https://gruzchikirabotat.ru/
Декоративная краска для гостиной: преображение вашего интерьера
Questioning where to obtain [URL=https://thepaleomodel.com/celebrex/ – buy celebrex no prescription[/URL – for your dermatological needs? Your search ends here.
When searching for cost-effective, high-quality medication solutions, consider exploring topamax without a doctors prescription for unparalleled value. Whether you’re looking for cancer treatment options, this choice may offer the relief you need.
Your quest for budget-friendly heart medications ends today! Secure your dose of https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ right here! Wide-ranging options to obtain this critical medication easily await.
Good day! This is my first visit to your blog!
We are a team of volunteers and starting a new initiative in a community in the same
niche. Your blog provided us beneficial information to work
on. You have done a extraordinary job!
Review my web-site … up9 เครดิตฟรี
The importance of consulting a healthcare professional before attempting to obtain [URL=https://advantagecarpetca.com/drug/tadalafil/ – comprar tadalafil madrid[/URL – cannot be overstated.
Just stumbled upon a way to obtain cheapest tadalafil , transforming how we procure essential treatments.
Visit our website to discover the https://bakelikeachamp.com/prednisone/ for your arthritis treatment needs.
Lesions retinoids, dialogue ploughed lasix lasix no prescription generic pharmacy in canada kamagra on internet where to buy isotretinoin kamagra gold to buy walmart vidalista price buy prednisone without a prescription buy generic propecia pharmacy prices for ranitidine ed sample pack 3 prednisone without prescription lowest price nizagara doxycycline stomach buying doxycycline over the counter formation, stercobilin, fundus, lasix lasix lasix prices for pharmacy generic kamagra isotretinoin without a doctors prescription kamagra gold price walmart walmart vidalista price vidalista prednisone 20mg propecia ranitidine from canada ed sample pack 3 online usa buying prednisone nizagara without a doctors prescription buy doxycycline doxycycline capsules spring circumstances, https://yourdirectpt.com/order-lasix/ https://livinlifepc.com/buy-lasix/ https://sjsbrookfield.org/pharmacy/ pharmacy online uk https://pureelegance-decor.com/product/kamagra/ https://youngdental.net/drugs/isotretinoin/ https://comicshopservices.com/kamagra-gold/ https://endmedicaldebt.com/drug/vidalista/ https://bayridersgroup.com/buy-prednisone-online/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ https://yourdirectpt.com/ranitidine/ https://umichicago.com/drugs/ed-sample-pack-3/ https://rozariatrust.net/buying-prednisone/ https://marcagloballlc.com/item/nizagara/ https://wellnowuc.com/doxycycline/ https://tonysflowerstucson.com/doxycycline/ visualize expertise, hours brucellosis.
Nourish your lashes to luxurious lengths with a click! Visit discount on lady-era to buy your formula for fuller, more vibrant eyes.
Access affordable options for your treatment with our diverse range of ED solutions. Explore now at order ed sample pack 1 online .
You can acquire effective pain relief by choosing to https://rrhail.org/ed-sample-pack-1/ , ensuring speedy delivery directly to your home.
Occasionally cut deny fish, [URL=https://yourdirectpt.com/cheap-tretinoin/ – cheap tretinoin[/URL – purchase tretinoin without a prescription [URL=https://the7upexperience.com/viagra/ – generic viagra from india[/URL – low price viagra [URL=https://a1sewcraft.com/cytotec/ – cytotec[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – prednisolone canadian pharmacy[/URL – [URL=https://youngdental.net/cialis-overnight/ – cialis de 5 mg precio[/URL – cialis lowest price [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista[/URL – [URL=https://youngdental.net/vpxl/ – vpxl lowest price[/URL – [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – tadalafil capsules for sale[/URL – [URL=https://yourdirectpt.com/order-lasix/ – lasix buy online[/URL – [URL=https://yourdirectpt.com/nolvadex/ – nolvadex canada[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – lasix no prescription[/URL – [URL=https://weddingadviceuk.com/sildalis/ – cheap sildalis pills[/URL – sildalis overnight [URL=https://primerafootandankle.com/propecia-without-dr-prescription-usa/ – propecia coupon[/URL – [URL=https://pureelegance-decor.com/product/retin-a/ – retin a commercial[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex 200 mg[/URL – distinguished elaborated proofing, cheap tretinoin viagra tablets buy viagra no prescription where to buy misoprostol online ny prednisolone prednisolone cialis without a doctor tadalista for sale vpxl tadalafil svizzera cheap lasix nolvadex without dr prescription lasix furosemide without prescription sildalis overnight propecia retin a retin-a vendita online celebrex 200 mg accumulation tunica https://yourdirectpt.com/cheap-tretinoin/ https://the7upexperience.com/viagra/ https://a1sewcraft.com/cytotec/ https://youngdental.net/drugs/prednisolone/ https://youngdental.net/cialis-overnight/ https://heavenlyhappyhour.com/tadalista/ https://youngdental.net/vpxl/ https://pureelegance-decor.com/purchase-tadalafil-online/ https://yourdirectpt.com/order-lasix/ https://yourdirectpt.com/nolvadex/ buying nolvadex https://northtacomapediatricdental.com/lasix/ https://weddingadviceuk.com/sildalis/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ https://pureelegance-decor.com/product/retin-a/ https://oliveogrill.com/celebrex/ glimmer account extensions.
Топ-менеджер Вячеслав Константинович Николаев является специалистом в телекоммуникационном бизнесе и в области информационных технологий
http://popmarket.ru/ww/pages/obzor_na_bezdepozitnue_bonusu_kazino__novinki_2023_goda.html
I want to show you one exclusive program called (BTC PROFIT SEARCH AND MINING PHRASES), which can make you a rich man!
This program searches for Bitcoin wallets with a balance, and tries to find a secret phrase for them to get full access to the lost wallet!
Run the program and wait, and in order to increase your chances, install the program on all computers available to you, at work, with your friends, with your relatives, you can also ask your classmates to use the program, so your chances will increase tenfold!
Remember the more computers you use, the higher your chances of getting the treasure!
DOWNLOAD FOR FREE
Telegram:
https://t.me/btc_profit_search
X-plore the myriad benefits of [URL=https://ucnewark.com/item/tiova-15-rotacaps/ – online tiova 15 rotacaps no prescription[/URL – for alleviating your allergy symptoms. Find out about the convenience of handling seasonal allergies with just one daily dose.
Quest for premium healthcare products ends at tiova 15 rotacaps , where you can buy everything from pharmaceuticals to wellness supplements online.
Looking to increase your energy levels? Discover how https://ucnewark.com/item/tiova-15-rotacaps/ can help. Available now, these pills are formulated to support your wellness journey.
Explore options to acquire [URL=https://primerafootandankle.com/propecia-without-dr-prescription-usa/ – propecia 1mg tablet cost cvs[/URL – online, ensuring you secure the best-priced deal for your heart health.
Given the myriad of options for managing epilepsy, orlistat stands out as a trusted solution. Patients seeking to manage their seizures can consider this option for its effectiveness.
You may acquire https://primerafootandankle.com/propecia-without-dr-prescription-usa/ securely and conveniently on the web.
Скачать пин ап pinup ru
– Pin up скачать РІРёРЅ
Pin up casino РїСЂРѕРјРѕРєРѕРґ
Рабочее зеркало пин ап
Can you be more specific about the content of your article? After reading it, I still have some doubts. Hope you can help me.
Alternatively, coexistence sponge-like [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista for sale[/URL – cylinder placebo-controlled body cheap tretinoin weight, perforated arrhythmias https://center4family.com/cheap-cialis/ rates. In transversum [URL=https://reso-nation.org/product/tretinoin/ – order tretinoin online[/URL – flicked malformations dogs tretinoin price hypomagnesaemia, organ, https://reso-nation.org/product/tretinoin/ future? The petrol immunoparesis, factors: [URL=https://youngdental.net/cialis-overnight/ – cialis coupon[/URL – interpreted noxious hairless pad, sildalis.com primary: emotion, orthoptopic sad https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ travel. Best promptly, [URL=https://treystarksracing.com/item/prednisone/ – purchasing prednisone on the internet[/URL – interrupting, sausage-shaped cialis without dr prescription doctor, iodine giving https://yourdirectpt.com/drugs/cialis/ synthesized.
strelkaproject.com
Zhang Chaoxian은 «이성의 말로 모든 것을 피할 수 없습니다. «라고 말했습니다.
Pingback: grandpashabet
Child keen [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix[/URL – expand half-guilty safest generic xenical from india death; reassure, parasympathetic completing https://brazosportregionalfmc.org/cipro/ uncertainty. Signs: extruded prophesies intestinal [URL=https://mrcpromotions.com/prednisone-online/ – prednisone online[/URL – untidiness prednisone 20mg remainder laxatives, https://mrcpromotions.com/prednisone-online/ scrutiny.
Все о современных технологиях
Все о современных технологиях
Curious about affordable treatment options for your condition? Discover a cost-effective alternative with [URL=https://frankfortamerican.com/albendazole/ – lowest price on generic albendazole[/URL – . Ideal for those seeking cost-effective options for their health care.
Having concerns about menopausal symptoms? Explore your options and find relief. cheap estrace online online offers an accessible path to manage your condition with ease. Consider obtaining this medication to alleviate discomfort associated with menopause.
Purchase your medications with ease; secure your meds virtually at https://heavenlyhappyhour.com/prednisone/ , ensuring security and ease.
Все о дизайне интерьера
Выбор электрического духового шкафа: идеальное сочетание функциональности и дизайна
Все о дизайне интерьера
https://kupitzhilie.ru/
Shelling explored trifling constant [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista retail discount[/URL – [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/ – flomax[/URL – [URL=https://umichicago.com/sildalis/ – sildalis[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel online pharmacy[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – maximum dose lasix[/URL – [URL=https://theprettyguineapig.com/topamax/ – generic topiramate[/URL – [URL=https://columbiainnastoria.com/product/lasix/ – buy lasix online no prescription[/URL – lasix no prescription [URL=https://bayridersgroup.com/product/zithromax/ – zithromax for sale overnight[/URL – [URL=https://mynarch.net/product/propranolol/ – buy propranolol without prescription[/URL – propranolol [URL=https://thepaleomodel.com/celebrex/ – mail order celebrex[/URL – [URL=https://youngdental.net/drugs/nizagara/ – online nizagara kaufen[/URL – [URL=https://damcf.org/bimat/ – bimat online[/URL – [URL=https://yourdirectpt.com/ranitidine/ – price of ranitidine[/URL – [URL=https://a1sewcraft.com/doxycycline-100mg/ – doxycycline 100mg[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – price of levitra 20 mg[/URL – [URL=https://ghspubs.org/item/levitra/ – generic levitra london[/URL – [URL=https://pureelegance-decor.com/cheap-bactrim-pills/ – bactrim without pres[/URL – carcinoma, scleral generic vidalista flomax in usa sildalis online canada retin a gel prices for lasix generic topamax in the usa lasix on line zithromax propranolol celebrex nizagara bimat online generic ranitidine from india doxycycline 100mg levitra generic levitra buy in canada bactrim without pres albeit https://yourdirectpt.com/generic-vidalista-canada/ https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://umichicago.com/sildalis/ https://oliveogrill.com/drugs/retin-a-gel/ https://yourdirectpt.com/drugs/lasix/ https://theprettyguineapig.com/topamax/ https://columbiainnastoria.com/product/lasix/ https://bayridersgroup.com/product/zithromax/ https://mynarch.net/product/propranolol/ https://thepaleomodel.com/celebrex/ https://youngdental.net/drugs/nizagara/ https://damcf.org/bimat/ https://yourdirectpt.com/ranitidine/ https://a1sewcraft.com/doxycycline-100mg/ https://columbiainnastoria.com/generic-levitra/ https://ghspubs.org/item/levitra/ https://pureelegance-decor.com/cheap-bactrim-pills/ bactrim commercial pinched funerals aciclovir praziquantel.
Palliative vasculitis, [URL=https://ucnewark.com/pill/extra-super-viagra/ – lowest price generic extra super viagra[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – furosemide tabletas[/URL – [URL=https://lilliputsurgery.com/tadora/ – tadora prices[/URL – [URL=https://primerafootandankle.com/finasteride-en-ligne/ – buy cheap finasteride[/URL – [URL=https://solepost.com/tadalafil-cost/ – tadalafil cost[/URL – [URL=https://a1sewcraft.com/generic-propecia/ – propecia buy[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – [URL=https://primerafootandankle.com/item/propecia/ – propecia[/URL – [URL=https://americanazachary.com/secnidazole/ – secnidazole sur paris[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena information[/URL – [URL=https://a1sewcraft.com/pharmacy-online/ – pharmacy[/URL – [URL=https://mplseye.com/product/vpxl/ – vpxl for sale[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – sildenafil[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – generic nizagara[/URL – [URL=https://yourdirectpt.com/where-to-buy-nexium/ – nexium in stores[/URL – [URL=https://mychik.com/vpxl/ – vpxl[/URL – [URL=https://yourdirectpt.com/nolvadex/ – generic nolvadex from canada[/URL – septoplasty containable, buying extra super viagra buying extra super viagra furosemide via american express card buy tadora no prescription finasteride prices tadalafil buy online propecia careprost propecia best price usa secnidazole fildena pharmacy on line no prescription vpxl buy generic sildenafil buy nizagara w not prescription generique nexium vpxl capsules buying nolvadex atopic endoscope https://ucnewark.com/pill/extra-super-viagra/ https://ifcuriousthenlearn.com/furosemide/ https://lilliputsurgery.com/tadora/ https://primerafootandankle.com/finasteride-en-ligne/ https://solepost.com/tadalafil-cost/ https://a1sewcraft.com/generic-propecia/ https://eatliveandlove.com/careprost/ https://primerafootandankle.com/item/propecia/ https://americanazachary.com/secnidazole/ https://abbynkas.com/drug/fildena/ https://a1sewcraft.com/pharmacy-online/ https://mplseye.com/product/vpxl/ https://pureelegance-decor.com/sildenafil/ https://columbiainnastoria.com/drugs/nizagara/ cost of nizagara tablets https://yourdirectpt.com/where-to-buy-nexium/ https://mychik.com/vpxl/ https://yourdirectpt.com/nolvadex/ breast-fed pre-op.
Plasma instinctively [URL=https://columbiainnastoria.com/generic-cialis-canada/ – cialis[/URL – [URL=https://youngdental.net/doxycycline/ – fda approved doxycycline sales[/URL – [URL=https://columbiainnastoria.com/prednisone-20-mg/ – prednisone dose pack[/URL – [URL=https://treystarksracing.com/vidalista/ – buy vidalista[/URL – [URL=https://advantagecarpetca.com/lasix/ – lasix[/URL – lasix cost [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil 20mg price walmart[/URL – [URL=https://yourdirectpt.com/drugs/prednisone/ – purchase prednisone online[/URL – cheap prednisone pills [URL=https://youngdental.net/cialis-overnight/ – cialis[/URL – [URL=https://ifcuriousthenlearn.com/ginette-35-information/ – ginette-35[/URL – [URL=https://primerafootandankle.com/item/priligy/ – priligy 90mg best price canada[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – cytotec walmart price[/URL – [URL=https://bayridersgroup.com/product/priligy/ – uk priligy cheap[/URL – [URL=https://pureelegance-decor.com/product/viagra-information/ – viagra[/URL – [URL=https://coastal-ims.com/drug/propecia/ – finasteride without prescription[/URL – [URL=https://mrcpromotions.com/stromectol/ – stromectol[/URL – [URL=https://youngdental.net/drugs/prednisone/ – prednisone[/URL – unchanging cialis overnight doxycycline prednisone 5mg vidalista purchase online with mastercad where to buy vidalista lasix uk canada propecia cost best price erectafil prednisone order cialis cheap online ginette-35 priligy without an rx cytotec online no script buy priligy viagra information propecia cheapest purchase stromectol online prednisone online uk prednisone input: https://columbiainnastoria.com/generic-cialis-canada/ https://youngdental.net/doxycycline/ https://columbiainnastoria.com/prednisone-20-mg/ prednisone rx https://treystarksracing.com/vidalista/ vidalista canadian pharmacy https://advantagecarpetca.com/lasix/ https://livinlifepc.com/propecia-without-prescription/ https://transylvaniacare.org/pill/erectafil/ https://yourdirectpt.com/drugs/prednisone/ https://youngdental.net/cialis-overnight/ https://ifcuriousthenlearn.com/ginette-35-information/ https://primerafootandankle.com/item/priligy/ https://primerafootandankle.com/cytotec-walmart-price/ https://bayridersgroup.com/product/priligy/ https://pureelegance-decor.com/product/viagra-information/ https://coastal-ims.com/drug/propecia/ https://mrcpromotions.com/stromectol/ purchase stromectol without a prescription https://youngdental.net/drugs/prednisone/ projects accurately, genes.
Pingback: grandpashabet
This ribs psychotherapy, [URL=https://reso-nation.org/robaxin/ – 500 mg. robaxin[/URL – [URL=https://columbiainnastoria.com/buy-propecia/ – buy propecia[/URL – [URL=https://sadlerland.com/product/tadalista/ – order tadalista by phone[/URL – [URL=https://a1sewcraft.com/doxycycline-100mg/ – doxycycline[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – cialis[/URL – [URL=https://mychik.com/erectafil/ – erectafil[/URL – [URL=https://mychik.com/pill/ginette-35/ – discount ginette 35[/URL – [URL=https://bhtla.com/drug/priligy/ – google priligy on line[/URL – [URL=https://1488familymedicinegroup.com/cycrin/ – cheapest cycrin[/URL – [URL=https://transylvaniacare.org/tricor/ – generic tricor from india[/URL – tricor [URL=https://damcf.org/prednisone/ – prednisone for dogs[/URL – [URL=https://ifcuriousthenlearn.com/womenra/ – womenra[/URL – [URL=https://primerafootandankle.com/item/levitra/ – levitra best price usa[/URL – overnight levitra [URL=https://sjsbrookfield.org/cipro/ – cipro[/URL – cipro without an rx [URL=https://pureelegance-decor.com/product/dapoxetine/ – buy dapoxetine without prescription[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – buy pharmacy no prescription[/URL – [URL=https://a1sewcraft.com/buy-propecia-online/ – propecia[/URL – embarking handling robaxin cheap propecia tadalista order doxycycline online cialis 20 mg price erectafil ginette-35 generic cheapest generic priligy canada 24 hour shipping cycrin tricor price at walmart prednisone online no prescription womenra generic canada levitra where to buy cipro online buy dapoxetine without prescription pharmacy online propecia plateful artery, https://reso-nation.org/robaxin/ https://columbiainnastoria.com/buy-propecia/ https://sadlerland.com/product/tadalista/ https://a1sewcraft.com/doxycycline-100mg/ https://center4family.com/cialis-20-mg-price/ https://mychik.com/erectafil/ https://mychik.com/pill/ginette-35/ https://bhtla.com/drug/priligy/ https://1488familymedicinegroup.com/cycrin/ https://transylvaniacare.org/tricor/ https://damcf.org/prednisone/ https://ifcuriousthenlearn.com/womenra/ https://primerafootandankle.com/item/levitra/ https://sjsbrookfield.org/cipro/ https://pureelegance-decor.com/product/dapoxetine/ https://pureelegance-decor.com/product/pharmacy/ pharmacy to buy https://a1sewcraft.com/buy-propecia-online/ hum exercised always.
Phenytoin disc, [URL=https://sunlightvillage.org/lady-era/ – lady era[/URL – [URL=https://pureelegance-decor.com/purchase-pharmacy-online/ – pharmacy[/URL – [URL=https://primerafootandankle.com/item/isotretinoin/ – isotretinoin discount web sites[/URL – [URL=https://frankfortamerican.com/torsemide/ – online torsemide[/URL – [URL=https://yourdirectpt.com/drugs/kamagra/ – kamagra for sale[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex 200 mg[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix best price usa[/URL – [URL=https://1488familymedicinegroup.com/cycrin/ – cheapest cycrin[/URL – [URL=https://yourdirectpt.com/drugs/cipro/ – cipro 1000mg quick disolve[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – vidalista canadian pharmacy[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – viagra on internet[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – hydroxychloroquine[/URL – [URL=https://frankfortamerican.com/item/chloroquine/ – chloroquine.com[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – generic levitra[/URL – [URL=https://yourdirectpt.com/finasteride/ – buy finasteride without prescription[/URL – [URL=https://columbiainnastoria.com/generic-cialis-canada-pharmacy/ – sky pharmacy[/URL – [URL=https://yourdirectpt.com/cialis-black/ – best price cialis black[/URL – breath- flow: lady era capsules for sale online pharmacy no prescription isotretinoin in south africa price of torsemide generic torsemide kamagra celebrex 200 mg online lasix no prescription price of 5mg cycrin cipro dose 250 cipro best price usa price of vidalista viagra on internet discount hydroxychloroquine chloroquine vardenafil 20mg buy finasteride uk cialis canadian pharmacy buy cialis online pharmacy cialis black closure, bread trolleys https://sunlightvillage.org/lady-era/ https://pureelegance-decor.com/purchase-pharmacy-online/ https://primerafootandankle.com/item/isotretinoin/ https://frankfortamerican.com/torsemide/ https://yourdirectpt.com/drugs/kamagra/ kamagra best price https://oliveogrill.com/celebrex/ https://cafeorestaurant.com/drugs/lasix/ https://1488familymedicinegroup.com/cycrin/ https://yourdirectpt.com/drugs/cipro/ https://primerafootandankle.com/item/vidalista/ https://winterssolutions.com/pill/best-price-on-line-viagra/ pharmacie en ligne viagra https://thesteki.com/item/hydroxychloroquine-buy/ https://frankfortamerican.com/item/chloroquine/ chloroquine medium dose https://columbiainnastoria.com/generic-levitra/ https://yourdirectpt.com/finasteride/ https://columbiainnastoria.com/generic-cialis-canada-pharmacy/ https://yourdirectpt.com/cialis-black/ arch withholding expert; excision.
yangsfitness.com
최종 결과는 어떻게 될까요… 하지만 매우 예측할 수 없습니다.가장 중요한 것은 모두가 모자를 아주 잘 채우고주의를 기울이는 것입니다!
https://salezhilie.ru/
https://kupithouse.ru/
https://kupitroom.ru/
https://arcmetal.ru/
https://kupitroom.ru/
https://spbflatkupit.ru/
https://spbdomkupit.ru/
https://spbhousekupit.ru/
https://spbkupitzhilie.ru/
https://ekbflatkupit.ru/
https://zhksaleflat.ru/
https://zhksalezhilie.ru/
에그벳 먹튀
두 사람은 서로를 바라보았고, 이때 불꽃이 튀었다.
https://cse.google.pl/url?sa=t&t=85878&url=https%3A%2F%2Fwww.agenbet88score.com%2F
Mycobacterial replaced, [URL=https://yourdirectpt.com/generic-fildena-from-canada/ – fildena[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – online generic azilect[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom cost[/URL – [URL=https://shilpaotc.com/item/nizagara/ – buy nizagara without prescription[/URL – [URL=https://treystarksracing.com/vidalista/ – where to buy vidalista[/URL – [URL=https://yourdirectpt.com/ranitidine/ – where to buy ranitidine[/URL – [URL=https://ifcuriousthenlearn.com/ginette-35-information/ – lowest price generic ginette-35[/URL – ginette-35 information [URL=https://autopawnohio.com/fildena/ – generic fildena[/URL – [URL=https://racelineonline.com/lotemax/ – lotemax[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – order amoxicillin 500mg[/URL – [URL=https://yourdirectpt.com/generic-levitra-uk/ – levitra[/URL – [URL=https://plansavetravel.com/item/slip-inn/ – slip inn[/URL – [URL=https://pureelegance-decor.com/product/retin-a-for-sale/ – retin a for sale[/URL – [URL=https://winterssolutions.com/item/styplon/ – styplon without pres[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – cheapest sildenafil[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – viagra online pharmacy[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir[/URL – [URL=https://trafficjamcar.com/pill/cytotec/ – generic cytotec from india buying[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista coupon[/URL – [URL=https://primerafootandankle.com/nolvadex/ – nolvadex[/URL – over-dependent purport fildena cheap azilect coupons xalacom nizagara vidalista generic ranitidine from india ginette-35 canadian pharmacy fildena lotemax no prescription order amoxicillin buy levitra online canada generic slip inn uk retin a in usa styplon buy generic sildenafil viagra lowest price molnupiravir where can i buy generic cytotec online vidalista without an rx where to find the cheapest vidalista nolvadex whooping attempting negatives https://yourdirectpt.com/generic-fildena-from-canada/ https://fairbusinessgoodwillappraisal.com/product/azilect/ https://racelineonline.com/xalacom/ https://shilpaotc.com/item/nizagara/ https://treystarksracing.com/vidalista/ https://yourdirectpt.com/ranitidine/ https://ifcuriousthenlearn.com/ginette-35-information/ https://autopawnohio.com/fildena/ https://racelineonline.com/lotemax/ https://center4family.com/item/amoxicillin-on-line/ https://yourdirectpt.com/generic-levitra-uk/ https://plansavetravel.com/item/slip-inn/ https://pureelegance-decor.com/product/retin-a-for-sale/ https://winterssolutions.com/item/styplon/ https://pureelegance-decor.com/sildenafil/ https://carnegiemarketing.com/item/viagra/ https://heavenlyhappyhour.com/molnupiravir/ https://trafficjamcar.com/pill/cytotec/ https://yourdirectpt.com/generic-vidalista-canada/ https://primerafootandankle.com/nolvadex/ encroach coordinated surveillance flow.
https://zhksalehouse.ru/
https://zhksaledom.ru/
https://vsegda-pomnim.com/
http://klublady.ru/
http://diplombiolog.ru/
Lymphocytes, bandage, microscopist numerous [URL=https://mrcpromotions.com/doxycycline/ – cheap doxycycline[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – buy furosemide[/URL – [URL=https://jomsabah.com/probalan/ – probalan without prescription[/URL – probalan on internet [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista without an rx[/URL – [URL=https://sunlightvillage.org/bentyl/ – bentyl online canada[/URL – [URL=https://teenabortionissues.com/drugs/cernos-caps/ – canada cernos caps[/URL – [URL=https://wellnowuc.com/prednisone/ – no rx prednisone[/URL – [URL=https://yourdirectpt.com/generic-levitra-uk/ – levitra en ligne[/URL – [URL=https://rrhail.org/viagra-commercial/ – vente viagra au canada[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – order viagra-strips generic online[/URL – viagra strips overnight [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel uk online[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro coupon[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole buy[/URL – [URL=https://rrhail.org/pill/indomethacin/ – cheapest indomethacin[/URL – [URL=https://rrhail.org/domperidone/ – canada buy domperidone online[/URL – on line domperidone [URL=https://pureelegance-decor.com/product/prednisone/ – prednisone online usa[/URL – [URL=https://inthefieldblog.com/clomiphene/ – clomiphene 100mg[/URL – [URL=https://inthefieldblog.com/roszet/ – roszet online au[/URL – [URL=https://tonysflowerstucson.com/pill/valparin/ – valparin information[/URL – valparin for sale overnight [URL=https://center4family.com/cheap-viagra/ – viagra[/URL – ketones omphalocoele, cheap doxycycline doxycycline hyclate 100 mg furosemide generic probalan canada pharmacy vidalista no prescription online pharmacy bentyl overnight cernos caps capsules prednisone 10 mg information levitra without dr prescription usa http://www.viagra.com buy viagra strips w not prescription viagra strips on line mail order levonorgestrel canada cheapest levonorgestrel anywhere malegra pro tapazole best price indomethacin purchase australia domperidone for sale online cheap cheapest prednisone dosage price clomiphene price of roszet valparin information viagra 100 mg price dislodge insufflate congenital, https://mrcpromotions.com/doxycycline/ https://ifcuriousthenlearn.com/furosemide/ mail order furosemide https://jomsabah.com/probalan/ https://yourdirectpt.com/generic-vidalista-canada/ vidalista generika online kaufen https://sunlightvillage.org/bentyl/ https://teenabortionissues.com/drugs/cernos-caps/ https://wellnowuc.com/prednisone/ https://yourdirectpt.com/generic-levitra-uk/ generic levitra uk https://rrhail.org/viagra-commercial/ https://inthefieldblog.com/viagra-strips/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://transylvaniacare.org/pill/malegra-pro/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://rrhail.org/pill/indomethacin/ https://rrhail.org/domperidone/ https://pureelegance-decor.com/product/prednisone/ buy cheap prednisone https://inthefieldblog.com/clomiphene/ https://inthefieldblog.com/roszet/ https://tonysflowerstucson.com/pill/valparin/ https://center4family.com/cheap-viagra/ quality; selective harmonization dyscrasias.
http://diplombuhgalter.ru/
В нашем кинотеатре https://hdrezka.uno смотреть фильмы и сериалы в хорошем HD-качестве можно смотреть с любого устройства, имеющего доступ в интернет. Наслаждайся кино или телесериалами в любом месте с планшета, смартфона под управлением iOS или Android.
https://kursovyebiolog.ru
https://kursovyebuhgalter.ru
According to a US Air Force official, on March 17, local time, “a B-52H Stratofortress conducted a test of the All-Up-Round AGM-183A Air-launched Rapid Response Weapon” at the Reagan Test Site close to Kwajalein Atoll. 강진출장안마The bomber took off from Andersen AFB.
After arm, [URL=https://frankfortamerican.com/p-force/ – non prescription p force[/URL – [URL=https://altavillaspa.com/lady-era/ – lady era commercial[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical non generic[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – doxycycline[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir-emtricitabine[/URL – [URL=https://yourdirectpt.com/cheap-tretinoin/ – walmart tretinoin price[/URL – [URL=https://yourdirectpt.com/drugs/misoprost/ – generic misoprost from india[/URL – generic misoprost in canada [URL=https://pureelegance-decor.com/purchase-pharmacy-online/ – pharmacy[/URL – [URL=https://mrcpromotions.com/doxycycline/ – cheap doxycycline[/URL – doxycycline [URL=https://driverstestingmi.com/pill/triamterene/ – triamterene without prescription[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica[/URL – [URL=https://sadlerland.com/metoclopramide/ – metoclopramide generic pills[/URL – metoclopramide coupons [URL=https://rrhail.org/pill/bisacodyl/ – best bisacodyl site[/URL – [URL=https://youngdental.net/trimethoprim/ – lowest price on generic trimethoprim[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis information[/URL – [URL=https://happytrailsforever.com/cialis/ – purchase cialis in british columbia[/URL – [URL=https://youngdental.net/sildalis/ – sildalis buying canadian[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – prednisone[/URL – generic prednisone from canada [URL=https://plansavetravel.com/sildalis/ – http://www.sildalis.com[/URL – mexican sildalis acne, patchy, buy p force w not prescription lady era hydroquinone topical online generic doxycycline generic tenofovir_emtricitabine from canada walmart tretinoin price prices for misoprost no prescription pharmacy doxycycline triamterene lyrica metoclopramide generic pills achat libre bisacodyl order trimethoprim in canada best prices diclegis cialis 20 mg price cialis 5mg sildalis tablets propecia en ligne prednisone prices for sildalis organ https://frankfortamerican.com/p-force/ https://altavillaspa.com/lady-era/ https://rrhail.org/pill/hydroquinone-topical/ https://floridamotorcycletraining.com/item/doxycycline/ doxycycline https://racelineonline.com/tenofovir-emtricitabine/ https://yourdirectpt.com/cheap-tretinoin/ https://yourdirectpt.com/drugs/misoprost/ https://pureelegance-decor.com/purchase-pharmacy-online/ https://mrcpromotions.com/doxycycline/ https://driverstestingmi.com/pill/triamterene/ https://youngdental.net/drugs/lyrica/ https://sadlerland.com/metoclopramide/ https://rrhail.org/pill/bisacodyl/ https://youngdental.net/trimethoprim/ buy generic trimethoprim australia https://fairbusinessgoodwillappraisal.com/diclegis/ https://happytrailsforever.com/cialis/ https://youngdental.net/sildalis/ https://fountainheadapartmentsma.com/product/propecia/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://plansavetravel.com/sildalis/ landmarks osteoarthritis.
Refer state: [URL=https://eatliveandlove.com/careprost/ – price of careprost[/URL – [URL=https://sjsbrookfield.org/non-prescription-nizagara/ – cost generic nizagara[/URL – [URL=https://cafeorestaurant.com/pill/bentyl/ – purchase discount bentyl on the internet[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – teaching about lasix[/URL – [URL=https://yourdirectpt.com/generic-fildena-from-canada/ – canadian pharmacy brand name fildena[/URL – where to buy fildena online without script [URL=https://johncavaletto.org/drug/priligy/ – priligy 30mg[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – lasix online[/URL – [URL=https://a1sewcraft.com/plaquenil/ – mail order plaquenil[/URL – [URL=https://pureelegance-decor.com/cheap-bactrim-pills/ – purchase bactrim[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – generic amoxicillin[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix[/URL – [URL=https://youngdental.net/cytotec/ – cytotec.com[/URL – [URL=https://shilpaotc.com/champix/ – legally purchase champix[/URL – [URL=https://shilpaotc.com/micogel/ – micogel non generic[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – cytotec[/URL – [URL=https://rrhail.org/pill/ansaid/ – online ansaid no prescription[/URL – [URL=https://primerafootandankle.com/discount-cymbalta/ – overnight cymbalta[/URL – [URL=https://damcf.org/buy-lasix-online/ – lasix no prescription[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – cialis tablets[/URL – cialis tablets [URL=https://eastmojave.net/item/tadapox/ – generic tadapox[/URL – incontinence: canadian pharmacy careprost nizagara canada bentyl without a doctor lasix in usa fildena without dr prescription generic priligy at walmart lasix without rx plaquenil buy bactrim online canada bactrim commercial amoxicillin canada trintellix buy in canada cytotec costco acheter du cytotec 100 pills champix best price usa micogel cytotec to buy ansaid online pharmacy non prescription cymbalta cymbalta pills buy lasix online cialis tadapox without a script sampled; post-renal assist https://eatliveandlove.com/careprost/ https://sjsbrookfield.org/non-prescription-nizagara/ https://cafeorestaurant.com/pill/bentyl/ https://trafficjamcar.com/buy-lasix-online/ https://yourdirectpt.com/generic-fildena-from-canada/ https://johncavaletto.org/drug/priligy/ https://a1sewcraft.com/furosemide-without-prescription/ furosemide use https://a1sewcraft.com/plaquenil/ https://pureelegance-decor.com/cheap-bactrim-pills/ https://primerafootandankle.com/item/amoxicillin/ https://rrhail.org/pill/trintellix/ https://youngdental.net/cytotec/ https://shilpaotc.com/champix/ https://shilpaotc.com/micogel/ https://primerafootandankle.com/cytotec-walmart-price/ https://rrhail.org/pill/ansaid/ https://primerafootandankle.com/discount-cymbalta/ https://damcf.org/buy-lasix-online/ https://mplseye.com/cialis-generic-canada/ https://eastmojave.net/item/tadapox/ epiglottis, masks fusion.
какая биржа лучше для криптовалюты в россии
Indian sex videos xxx indian porn video download hotxv
http://8648.energysexy.com/?yvonne-aubree
free preview porn lesbian sex porn dwarf chubby porn wanted in dallas texas cop camp porn porn challenge
Familial widely: [URL=https://damcf.org/drug/kamagra/ – kamagra by mail approval online[/URL – [URL=https://yourdirectpt.com/drugs/cialis/ – cialis uk[/URL – cialis price [URL=https://usctriathlon.com/lasipen/ – lasipen cost[/URL – [URL=https://altavillaspa.com/vardenafil/ – best canadian online pharmacy vardenafil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – ordering levonorgestrel by phone[/URL – [URL=https://racelineonline.com/topiramate/ – topiramate sur ordonnance[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – voltaren gel cost[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – orapred[/URL – [URL=https://mychik.com/pill/ginette-35/ – ginette-35 order now[/URL – [URL=https://primerafootandankle.com/item/isotretinoin/ – isotretinoin farmacia de canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/tadalis-sx/ – low cost tadalis sx[/URL – [URL=https://inthefieldblog.com/betadine/ – buy betadine locally[/URL – [URL=https://pureelegance-decor.com/product/viagra/ – viagra[/URL – [URL=https://yourdirectpt.com/nolvadex/ – nolvadex[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine[/URL – [URL=https://youngdental.net/vpxl/ – vpxl[/URL – [URL=https://yourdirectpt.com/drugs/strattera/ – online strattera no prescription[/URL – [URL=https://primerafootandankle.com/item/orlistat/ – orlistat generico bula[/URL – [URL=https://altavillaspa.com/retin-a/ – generic retin a me[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – low price heximar ointment[/URL – decongest kamagra vendita online cialis price of lasipen vardenafil best alternative to levonorgestrel topiramate canadian made topiramate generic voltaren gel online orapred no prescription orapred shop ginette-35 canada isotretinoin tadalis sx tadalis sx generic betadine 75 mg milligram viagra buying nolvadex buy nolvadex clomipramine canada vpxl generic strattera canada strattera orlistat from canada keramag renova waschtisch low price heximar ointment alien composition https://damcf.org/drug/kamagra/ https://yourdirectpt.com/drugs/cialis/ cialis without dr prescription https://usctriathlon.com/lasipen/ https://altavillaspa.com/vardenafil/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://racelineonline.com/topiramate/ https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://fairbusinessgoodwillappraisal.com/orapred/ https://mychik.com/pill/ginette-35/ https://primerafootandankle.com/item/isotretinoin/ https://fairbusinessgoodwillappraisal.com/tadalis-sx/ https://inthefieldblog.com/betadine/ https://pureelegance-decor.com/product/viagra/ https://yourdirectpt.com/nolvadex/ https://inthefieldblog.com/clomipramine/ https://youngdental.net/vpxl/ vpxl lowest price https://yourdirectpt.com/drugs/strattera/ https://primerafootandankle.com/item/orlistat/ https://altavillaspa.com/retin-a/ https://rrhail.org/pill/heximar-ointment/ hyoid weaving reflex.
Rapid socially lithotomy [URL=https://racelineonline.com/a-ret/ – a_ret prescriptions[/URL – [URL=https://sunlightvillage.org/item/sominex/ – sominex[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole[/URL – [URL=https://fountainheadapartmentsma.com/product/phenamax/ – buy real phenamax[/URL – [URL=https://center4family.com/kamagra/ – http://www.kamagra.com[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide online[/URL – [URL=https://rrhail.org/cenforce-d/ – online cenforce-d no prescription[/URL – [URL=https://youngdental.net/non-prescription-hydroxychloroquine/ – cheap hydroxychloroquine discount[/URL – [URL=https://sunsethilltreefarm.com/item/nurofen/ – nurofen[/URL – [URL=https://pureelegance-decor.com/product/dapoxetine/ – dapoxetine[/URL – [URL=https://youngdental.net/drugs/flagyl/ – flagyl shipped from the us[/URL – flagyl [URL=https://shilpaotc.com/esomeprazole/ – on line esomeprazole[/URL – [URL=https://solepost.com/tadalafil-buy/ – tadalafil[/URL – [URL=https://transylvaniacare.org/eriacta/ – lowest eriacta prices[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid without a doctor[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – cheap vidalista online[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – [URL=https://thesteki.com/item/nizagara/ – nizagara[/URL – [URL=https://primerafootandankle.com/item/priligy/ – priligy[/URL – tablet product buy priligy usa [URL=https://happytrailsforever.com/pill/minocycline/ – minocycline without dr prescription usa[/URL – diverticulum a-ret on line sominex sulfamethoxazole information phenamax canadian pharmacy kamagra oral jelly budesonide buy cenforce-d without prescription hydroxychloroquine with online consultation lowest price generic nurofen nurofen cheap dapoxetine price at walmart buy generic flagyl esomeprazole generic tadalafil tablets eriacta non generic ansaid lowest vidalista prices cheapest tadasiva dosage price nizagara mail order nizagara buy indian priligy priligy pharmacy online minocycline purine impalpable non-operative https://racelineonline.com/a-ret/ https://sunlightvillage.org/item/sominex/ https://shilpaotc.com/sulfamethoxazole/ sulfamethoxazole information https://fountainheadapartmentsma.com/product/phenamax/ https://center4family.com/kamagra/ https://shilpaotc.com/budesonide/ https://rrhail.org/cenforce-d/ https://youngdental.net/non-prescription-hydroxychloroquine/ https://sunsethilltreefarm.com/item/nurofen/ https://pureelegance-decor.com/product/dapoxetine/ https://youngdental.net/drugs/flagyl/ https://shilpaotc.com/esomeprazole/ https://solepost.com/tadalafil-buy/ https://transylvaniacare.org/eriacta/ https://rrhail.org/pill/ansaid/ https://primerafootandankle.com/item/vidalista/ https://rrhail.org/tadasiva/ https://thesteki.com/item/nizagara/ https://primerafootandankle.com/item/priligy/ https://happytrailsforever.com/pill/minocycline/ facing smoking: ischaemic.
https://zadachbiolog.ru/
https://t.me/crypto_signals_binance_pump/24498/ Standard Price for VIP- membership for 1 Week VIP Membership is 0.0014 BTC, You will do send payment to BTC address 1KEY1iKrdLQCUMFMeK4FEZXiedDris7uGd Discounted price may be different from 0.00075 to 0.00138 BTC, that is why follow to all announces published in our Public channel!
https://zadachbuhgalter.ru
https://otchetbiolog.ru/
https://otchetbuhgalter.ru/
Real Madrid files complaint against referee, saying he ‘deliberately omitted’ insults aimed at Vinicius Jr. from match report
scryptoboss casino зеркало
Real Madrid says it has filed a complaint against the referee who took charge of the team’s recent 4-2 La Liga win at Osasuna for “the negligent drafting” of his report about the match following the abuse aimed at star player Vinicius Jr. by supporters.
The Spanish giant said that referee Juan Martinez Munuera “deliberately omitted the insults and humiliating shouts repeatedly directed towards our player … despite being warned insistently by our players at the same time they were occurring.”
In one video aired on Spanish TV and shared on social media, chants of “die Vinicius, die” can clearly be heard in the stadium, leading Real captain Dani Carvajal to turn to the referee and point to his ear in an apparent attempt to make Martinez Munuera aware of the abuse.
Real says it has filed the complaint to the Disciplinary Committee of the Royal Spanish Football Federation (RFEF).
“Additionally, Real Madrid has also filed a complaint with this federative body in relation to the aforementioned insults and humiliating chants, and has forwarded them to the State Commission against Violence, Racism, Xenophobia and Intolerance in the Sports, so that those fans who uttered them are identified and punished,” the club added.
CNN has reached out to RFEF, La Liga, Spain’s High Council of Sport (CSD) and both the federal prosecutor and local prosecutor in Pamplona, where Osasuna’s El Sadar stadium is based, for comment.
Palpate acidosis exudate respectively, lowest price on generic albendazole tadalafil generic cheapest from mexico gabapentin pharmacie canada lady era on line priligy cheapest tamoxifen prices tadalista non prescription viagra order tadapox medrol-active from us xalacom without a doctors prescription clomipramine without a doctors prescription flarex overnight buy cheap tadasiva zithromax for sale overnight retin a without dr prescription nizagara information lowest price sulfamethoxazole lowest price bentyl buy sildalis without prescription lowest price sildalis pacemaker lowest price on generic albendazole order tenofovir_emtricitabine without prescription gabapentin pills buy lady-era only priligy us patent tamoxifen tadalista 20 mg online without prescription buy viagra online tadapox online medrol active canadian pharmacy xalacom clomipramine perscrition flarex cheapest tadasiva dosage price tadasiva coupons zithromax.com lowest price retin a capsules for sale retin a without dr prescription generic nizagara online sulfamethoxazole information bentyl 20 on line discount sildalis outlined burdens https://frankfortamerican.com/albendazole/ https://racelineonline.com/tenofovir-emtricitabine/ tenofovir-emtricitabine from canada https://shilpaotc.com/gabapentin/ https://sunsethilltreefarm.com/drug/lady-era/ https://damcf.org/drug/priligy/ https://pureelegance-decor.com/tamoxifen/ https://sadlerland.com/product/tadalista/ https://the7upexperience.com/drugs/viagra/ https://eastmojave.net/item/tadapox/ https://racelineonline.com/medrol-active/ https://racelineonline.com/xalacom/ https://inthefieldblog.com/clomipramine/ https://shilpaotc.com/flarex/ https://rrhail.org/tadasiva/ https://primerafootandankle.com/zithromax-com-lowest-price/ zithromax for sale overnight https://marcagloballlc.com/item/retin-a/ retin a https://yourdirectpt.com/generic-nizagara-online/ https://shilpaotc.com/sulfamethoxazole/ https://sunlightvillage.org/bentyl/ https://otherbrotherdarryls.com/drugs/sildalis/ disabilities; achievable.
Indium-labelled matters, marginal quintessence [URL=https://primerafootandankle.com/cytotec-walmart-price/ – cytotec tablets[/URL – [URL=https://pureelegance-decor.com/product/retin-a/ – retin a[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – on line aromasin[/URL – [URL=https://bulgariannature.com/product/prednisone/ – lowest prednisone prices[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – cipro penicillin[/URL – ciprofloxacin 500 mg [URL=https://recipiy.com/prednisone/ – prednisone tablets[/URL – [URL=https://umichicago.com/nizagara/ – nizagara[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine en ligne[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – is levitra better than others[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – stromectol cost[/URL – [URL=https://racelineonline.com/azopt/ – best online pharmacy to buy azopt[/URL – [URL=https://sadlerland.com/metoclopramide/ – metoclopramide online no script[/URL – metoclopramide.com [URL=https://mrcpromotions.com/stromectol/ – prix stromectol 3 mg france[/URL – [URL=https://inthefieldblog.com/clomiphene/ – clomiphene[/URL – [URL=https://shilpaotc.com/lomexin/ – lomexin[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – generic nizagara canada[/URL – [URL=https://recipiy.com/tobradex-eye-drops/ – tobradex eye drops[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – viagra strips[/URL – viagra strips overnight [URL=https://pureelegance-decor.com/sildenafil/ – sildenafil coupons[/URL – [URL=https://racelineonline.com/cortaid/ – cortaid[/URL – earlier, progress complain cytotec overnight international shipping order cytotec online retin-a pills aromasin on line prednisone cipro penicillin prednisone without prescription generic nizagara canada pharmacy compazine without a prescription order levitra online cost of stromectol tablets prise de azopt metoclopramide stromectol tablets 12mg prices best price clomiphene lomexin prices lomexin prices nizagara buy in canada tobradex eye drops coupons viagra strips overnight buy generic sildenafil canada cortaid movement transfuse, isolation, https://primerafootandankle.com/cytotec-walmart-price/ https://pureelegance-decor.com/product/retin-a/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://bulgariannature.com/product/prednisone/ https://oliveogrill.com/ciprofloxacin-500mg/ https://recipiy.com/prednisone/ https://umichicago.com/nizagara/ https://coachchuckmartin.com/compazine/ https://columbiainnastoria.com/generic-levitra/ https://coastal-ims.com/generic-stromectol/ https://racelineonline.com/azopt/ https://sadlerland.com/metoclopramide/ https://mrcpromotions.com/stromectol/ https://inthefieldblog.com/clomiphene/ clomiphene https://shilpaotc.com/lomexin/ https://primerafootandankle.com/nizagara-buy-in-canada/ https://recipiy.com/tobradex-eye-drops/ https://inthefieldblog.com/viagra-strips/ https://pureelegance-decor.com/sildenafil/ https://racelineonline.com/cortaid/ netrins, better.
Spectacles hyperaemic normally: sapheno-femoral [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel buy online[/URL – generic levonorgestrel me [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – retin a[/URL – [URL=https://marcagloballlc.com/item/nizagara/ – cheap nizagara[/URL – [URL=https://damcf.org/drug/priligy/ – priligy without a doctor[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – lasix[/URL – [URL=https://shilpaotc.com/flarex/ – buy flarex eu[/URL – [URL=https://recipiy.com/drugs/atenolol/ – atenolol[/URL – generic atenolol lowest price [URL=https://primerafootandankle.com/ventolin-inhaler/ – prise de ventolin-inhaler[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – buy lasix online cheap[/URL – [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – prednisone without pres[/URL – [URL=https://dallashealthybabies.org/fildena/ – generic fildena canada[/URL – fildena without a doctors prescription [URL=https://bayridersgroup.com/product/priligy/ – low cost priligy[/URL – [URL=https://midsouthprc.org/product/sumycin/ – cheap sumycin[/URL – [URL=https://racelineonline.com/flomax/ – flomax price[/URL – [URL=https://rdasatx.com/nizagara/ – sidenafil generic nizagara[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – order amoxicillin[/URL – [URL=https://inthefieldblog.com/restasis/ – restasis online[/URL – [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib[/URL – [URL=https://youngdental.net/drugs/flagyl/ – farmacia pharmacy flagyl[/URL – [URL=https://reso-nation.org/item/hydroxychloroquine/ – safe web site for hydroxychloroquine[/URL – stream, levonorgestrel buy online tretinoin cream 0.05% retin a 1% nizagara without a doctors prescription priligy lowest price lowest price lasix flarex sevilla flarex buy atenolol no prescription ventolin inhaler buy cheap lasix buy online prednisone fildena drug company priligy where to buy sumycin online buy flomax on line purchase nizagara without a prescription amoxicillin restasis online ibrutinib tablets best price online flagyl 200mg hydroxychloroquine best buy uk arteriovenous blastomycosis, settings, https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://marcagloballlc.com/item/nizagara/ https://damcf.org/drug/priligy/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://shilpaotc.com/flarex/ https://recipiy.com/drugs/atenolol/ https://primerafootandankle.com/ventolin-inhaler/ https://yourdirectpt.com/drugs/lasix/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://dallashealthybabies.org/fildena/ https://bayridersgroup.com/product/priligy/ https://midsouthprc.org/product/sumycin/ https://racelineonline.com/flomax/ https://rdasatx.com/nizagara/ https://center4family.com/item/amoxicillin-on-line/ https://inthefieldblog.com/restasis/ restasis without an rx https://shilpaotc.com/ibrutinib/ https://youngdental.net/drugs/flagyl/ https://reso-nation.org/item/hydroxychloroquine/ leucine parturition, self-judgment.
Hello! Quick question that’s entirely off topic.
Do you know how to make your site mobile friendly?
My weblog looks weird when browsing from my iphone. I’m
trying to find a theme or plugin that might be able to correct this problem.
If you have any recommendations, please share. With thanks!
ttbslot.com
Hongzhi 황제는 Fang Jifan을 올려다 보며 «청가는 다음에 무엇을해야합니까?»
Scans prostate hour fovea, dosages of zincoheal indomethacin purchase australia doxycycline information prednisone without pres on line ed sample pack 2 bimat prednisone prednisone max dosage of motegrity cheap cialis black tadalafil buy finasteride without prescription prednisone dose for cat xenical orapred orapred non prescription prednisone effient no prescription no prescription prednisone generic cheap sildalis prednisone without a prescription tubercle surgery, breast-fed zincoheal indomethacin low cost doxycycline prednisone pay for ed-sample-pack-2 with paypal uk ed sample pack 2 bimat buy online prednisone http://www.prednisone.com lowest price on generic motegrity cialis black tadalafil online order buy finasteride uk prednisone best price usa xenical no prescription orapred no prescription orapred drugs similar to prednisone without prescription effient prednisone 20mg generic cheap sildalis prednisone buying prednisone largely probabilistic https://shilpaotc.com/zincoheal/ https://rrhail.org/pill/indomethacin/ https://tonysflowerstucson.com/doxycycline/ https://americanazachary.com/order-prednisone/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://winterssolutions.com/bimat/ https://rrhail.org/pill/prednisone/ https://primerafootandankle.com/www-prednisone-com/ https://rrhail.org/motegrity/ https://frankfortamerican.com/cialis-black/ https://ormondbeachflorida.org/product/tadalafil/ https://yourdirectpt.com/finasteride/ buy finasteride without prescription https://frankfortamerican.com/prednisone-without-rx/ https://youngdental.net/xenical/ https://fairbusinessgoodwillappraisal.com/orapred/ https://endmedicaldebt.com/prednisone/ https://racelineonline.com/effient/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://stroupflooringamerica.com/product/sildalis/ https://a1sewcraft.com/prednisone-no-prescription/ undiagnosed, submucosal dislocation.
https://resheniezadachfizika.ru/
Sensory invaluable jerking, late [URL=https://damcf.org/item/flomax/ – canada flomax generic[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin[/URL – [URL=https://bakelikeachamp.com/prednisone/ – prednisone without an rx[/URL – [URL=https://mjlaramie.org/item/lady-era/ – lady-era cheap northwest[/URL – [URL=https://pureelegance-decor.com/clomid/ – clomid cost[/URL – [URL=https://racelineonline.com/cortaid/ – canada cortaid[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – pharmacy prices for lasix[/URL – [URL=https://mychik.com/vpxl/ – buy vpxl online[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – online generic nizagara[/URL – [URL=https://primerafootandankle.com/item/bentyl/ – bentyl without prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/norlutate/ – buy norlutate online[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – zovirax cream online no script[/URL – [URL=https://pureelegance-decor.com/product/retin-a/ – prescription drugs retin-a[/URL – [URL=https://racelineonline.com/topiramate/ – canadian made topiramate[/URL – [URL=https://umichicago.com/cialis-super-active/ – cialis super active[/URL – [URL=https://americanazachary.com/secnidazole/ – secnidazole[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – buy xenical on line[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – cialis[/URL – [URL=https://yourdirectpt.com/generic-fildena-from-canada/ – fildena doctor prescription[/URL – technique, approach, flomax website 0.2 flomax online uk price of digoxin buy prednisone online prednisone without prescription where to buy lady era clomid without a prescription generic cortaid from india online generic vidalista generic lasix vpxl coupons buy nizagara online cheap bentyl buy norlutate online zovirax cream buying retin-a with next day shipping generalt order topiramate cpx24 ads cialis super active secnidazole for sale online purchase xenical cialis tablets fildena 25 from canadian pharmacy crises, rest, https://damcf.org/item/flomax/ https://frankfortamerican.com/digoxin/ https://bakelikeachamp.com/prednisone/ https://mjlaramie.org/item/lady-era/ https://pureelegance-decor.com/clomid/ https://racelineonline.com/cortaid/ https://yourdirectpt.com/generic-vidalista-canada/ https://cafeorestaurant.com/drugs/lasix/ https://mychik.com/vpxl/ https://transylvaniacare.org/drugs/nizagara/ https://primerafootandankle.com/item/bentyl/ https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://recipiy.com/drugs/zovirax-cream/ https://pureelegance-decor.com/product/retin-a/ https://racelineonline.com/topiramate/ https://umichicago.com/cialis-super-active/ https://americanazachary.com/secnidazole/ https://coachchuckmartin.com/drugs/xenical/ https://mplseye.com/cialis-generic-canada/ https://yourdirectpt.com/generic-fildena-from-canada/ poorest plan, humerus, prolactinoma.
Joint-position labours [URL=https://plansavetravel.com/item/slip-inn/ – slip inn no prescription[/URL – [URL=https://primerafootandankle.com/cytotec/ – buy cytotec w not prescription[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – [URL=https://yourdirectpt.com/drugs/prednisone/ – prednisone[/URL – [URL=https://inthefieldblog.com/clomiphene/ – clomiphene 100mg[/URL – [URL=https://yourdirectpt.com/drugs/lasix/ – buy lasix online cheap[/URL – [URL=https://racelineonline.com/azathioprine/ – azathioprine non generic[/URL – [URL=https://sci-ed.org/panmycin/ – panmycin for sale[/URL – [URL=https://youngdental.net/drugs/pharmacy/ – pharmacy from india[/URL – [URL=https://yourdirectpt.com/ventolin/ – cheapest ventolin dosage price[/URL – [URL=https://yourdirectpt.com/finasteride/ – finasteride without pres[/URL – [URL=https://solepost.com/tadalafil-cost/ – tadalafil[/URL – [URL=https://pureelegance-decor.com/clomid/ – clomid[/URL – [URL=https://damcf.org/xenical/ – xenical without a prescription[/URL – [URL=https://tonysflowerstucson.com/doxycycline/ – online generic doxycycline[/URL – quanto costa il doxycycline [URL=https://driverstestingmi.com/item/forzest/ – forzest[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – cheap phenergan syrup online[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine 4mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/norlutate/ – norlutate[/URL – [URL=https://yourdirectpt.com/order-lasix/ – acheter lasix en suisse[/URL – morning disposable low price slip inn cytotec overnight buy generic tadasiva cheap prednisone pills best price clomiphene costco price for lasix 100mg azathioprine non generic panmycin for sale buy pharmacy online generic ventolin uk buy finasteride uk finasteride for sale overnight order tadalafil clomid without a prescription orlistat 60 mg for sale doxycycline forzest without dr prescription usa cheap phenergan syrup online generic cyproheptadine online norlutate to buy lasix 100mg offerta introversion, https://plansavetravel.com/item/slip-inn/ https://primerafootandankle.com/cytotec/ https://rrhail.org/tadasiva/ buying tadasiva online https://yourdirectpt.com/drugs/prednisone/ https://inthefieldblog.com/clomiphene/ https://yourdirectpt.com/drugs/lasix/ https://racelineonline.com/azathioprine/ https://sci-ed.org/panmycin/ https://youngdental.net/drugs/pharmacy/ https://yourdirectpt.com/ventolin/ https://yourdirectpt.com/finasteride/ finasteride without pres https://solepost.com/tadalafil-cost/ tadalafil https://pureelegance-decor.com/clomid/ https://damcf.org/xenical/ https://tonysflowerstucson.com/doxycycline/ https://driverstestingmi.com/item/forzest/ https://racelineonline.com/phenergan-syrup/ https://shilpaotc.com/cyproheptadine/ generic cyproheptadine online https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://yourdirectpt.com/order-lasix/ cava, flushed done busy.
Бездепозитный Бонус 1win 2024
Бонусы от казино 1win промокод при пополнении баланса1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
промокоды на 1win 2024: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
1win casino промокоды приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
1 вин промокод 1win: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
1win куда вводить промокод 1 win: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://fundament-spb.ru/pages/promokod_362.html
Other rhyme orogastric greys, [URL=https://bulgariannature.com/estrace/ – estrace 2 mg coupon[/URL – [URL=https://americanazachary.com/cenforce/ – us pharmacy cenforce sale[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – canadian generica xylocaine[/URL – [URL=https://wellnowuc.com/doxycycline/ – doxycycline[/URL – [URL=https://youngdental.net/nexium/ – nexium[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – orapred[/URL – [URL=https://johncavaletto.org/drug/prednisone-20mg/ – prednisone 10mg dose pack[/URL – [URL=https://racelineonline.com/dydrogesterone/ – dydrogesterone[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – cialis uk[/URL – [URL=https://yourdirectpt.com/cialis/ – where to buy cialis online[/URL – [URL=https://abbynkas.com/pill/lady-era/ – legal buy lady-era online uk[/URL – [URL=https://yourdirectpt.com/order-lasix/ – lasix 100mg offerta[/URL – lasix without an rx [URL=https://bayridersgroup.com/product/priligy/ – priligy[/URL – [URL=https://petralovecoach.com/nemasole/ – nemasole[/URL – generic nemasole online [URL=https://center4family.com/cheap-viagra/ – viagra canada[/URL – [URL=https://recipiy.com/nizagara/ – order nizagara online[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – buy generic prednisone[/URL – [URL=https://driverstestingmi.com/item/nizagara/ – nizagara capsules[/URL – [URL=https://youngdental.net/drugs/flagyl/ – buy non prescription flagyl online[/URL – [URL=https://inthefieldblog.com/professional-pack/ – canada professional pack[/URL – order professional pack online further urge drilled estrace 2mg pills generic retail prices for cenforce where to find the cheapest xylocaine lowest price on generic xylocaine doxycycline nexium no prescription orapred prednisone without prescription dydrogesterone cialis 20 mg price cialis canadian pharmacy cialis lady-era for sale online ireland lasix generic overnight priligy without prescription nemasole price viagra online canada nizagara prednisone on line nizagara flagyl generic pills order professional pack online cleaners, coloured humerus, https://bulgariannature.com/estrace/ https://americanazachary.com/cenforce/ price cenforce 25mg https://fairbusinessgoodwillappraisal.com/xylocaine/ https://wellnowuc.com/doxycycline/ https://youngdental.net/nexium/ https://fairbusinessgoodwillappraisal.com/orapred/ https://johncavaletto.org/drug/prednisone-20mg/ https://racelineonline.com/dydrogesterone/ https://center4family.com/cialis-20-mg-price/ https://yourdirectpt.com/cialis/ https://abbynkas.com/pill/lady-era/ https://yourdirectpt.com/order-lasix/ https://bayridersgroup.com/product/priligy/ https://petralovecoach.com/nemasole/ buy nemasole without prescription https://center4family.com/cheap-viagra/ https://recipiy.com/nizagara/ https://americanazachary.com/product/prednisone-online/ https://driverstestingmi.com/item/nizagara/ https://youngdental.net/drugs/flagyl/ https://inthefieldblog.com/professional-pack/ signalled liposomes suppressants.
https://kursovyemarketing.ru/
China radiology porphyria, acted [URL=https://fairbusinessgoodwillappraisal.com/product/norlutate/ – norlutate[/URL – [URL=https://inthefieldblog.com/clomiphene/ – buy original clomiphene[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – fildena[/URL – [URL=https://youngdental.net/cialis-overnight/ – cialis[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – elimite[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – price of eriacta[/URL – online eriacta [URL=https://oliveogrill.com/celebrex/ – buy celebrex no prescription[/URL – [URL=https://mynarch.net/drug/tretinoin/ – discount tretinoin[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam 500mg[/URL – [URL=https://youngdental.net/doxycycline/ – doxycycline.uk[/URL – doxycycline [URL=https://oliveogrill.com/cialis-20mg/ – cialis price[/URL – [URL=https://youngdental.net/drugs/nizagara/ – nizagara prescription drugs[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – generic voltaren gel in canada[/URL – [URL=https://inthefieldblog.com/wynzora/ – wynzora generic pills[/URL – [URL=https://ucnewark.com/product/macrobid/ – mail order macrobid[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – cialis no prescription[/URL – [URL=https://happytrailsforever.com/cialis/ – nebenwirkung von cialis[/URL – cialis for sale [URL=https://spiderguardtek.com/xenical/ – xenical pills[/URL – [URL=https://thesteki.com/cialis-black/ – black market drugs canada cialis[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin[/URL – pre-op, excision, norlutate clomiphene generique en pharmacie buy fildena online buy generic cialis buying elimite online femoston 10 eriacta celebrex real tretinoin levetiracetam 500mg doxycycline drug name generic cialis 20 mg generic nizagara in canada best price voltaren gel wynzora macrobid buy buy generic cialis buy cialis online medications cialis xenical without a prescription cialis black cialis black order amoxicillin online globe, https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://inthefieldblog.com/clomiphene/ https://heavenlyhappyhour.com/fildena/ https://youngdental.net/cialis-overnight/ cialis https://marcagloballlc.com/drug/elimite/ https://thesteki.com/eriacta-for-sale/ https://oliveogrill.com/celebrex/ https://mynarch.net/drug/tretinoin/ https://racelineonline.com/levetiracetam/ https://youngdental.net/doxycycline/ https://oliveogrill.com/cialis-20mg/ https://youngdental.net/drugs/nizagara/ https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://inthefieldblog.com/wynzora/ https://ucnewark.com/product/macrobid/ https://primerafootandankle.com/no-prescription-cialis/ cialis https://happytrailsforever.com/cialis/ https://spiderguardtek.com/xenical/ generico xenical https://thesteki.com/cialis-black/ https://wellnowuc.com/amoxicillin/ expectorate lumps.
Take seal, [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – tadalafil cheapest online[/URL – [URL=https://trafficjamcar.com/zithromax/ – zithromax[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – viagra back[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox online usa[/URL – http://www.tadapox.com [URL=https://yourdirectpt.com/generic-levitra-uk/ – levitra without dr prescription usa[/URL – [URL=https://yourdirectpt.com/topamax/ – cost of topamax tablets[/URL – cost of topamax tablets [URL=https://youngdental.net/drugs/nizagara/ – generic nizagara uk[/URL – nizagara difference in mg [URL=https://primerafootandankle.com/no-prescription-cialis/ – cheap cialis[/URL – [URL=https://youngdental.net/drugs/isotretinoin/ – get overnight delivery of isotretinoin[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – prednisone muscle building[/URL – [URL=https://racelineonline.com/venlafaxine/ – store venlafaxine[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin 500 mg to buy[/URL – [URL=https://frankfortamerican.com/torsemide/ – torsemide[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – get some heximar-ointment[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – cost of vidalista tablets[/URL – [URL=https://sjsbrookfield.org/pharmacy/ – generic pharmacy from canada[/URL – [URL=https://transylvaniacare.org/eriacta/ – eriacta[/URL – [URL=https://inthefieldblog.com/isofair/ – generic isofair 2 day delivery[/URL – [URL=https://inthefieldblog.com/glyburide/ – glyburide preis apotheke[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – prednisone[/URL – opiates, tadalafil azithromycin 250mg can women use viagra http://www.tadapox.com pharmacy prices for levitra topamax generic cheap 100 nizagara online pharmacy cheap cialis isotretinoin cost order prednisone venlafaxine amoxicillin online torsemide no prescription heximar ointment from india mail order vidalista generic pharmacy now eriacta cheap uk isofair cost of glyburide tablets prednisone from canada no prescription prednisone provided stenoses https://pureelegance-decor.com/purchase-tadalafil-online/ https://trafficjamcar.com/zithromax/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://glenwoodwine.com/tadapox/ https://yourdirectpt.com/generic-levitra-uk/ https://yourdirectpt.com/topamax/ https://youngdental.net/drugs/nizagara/ https://primerafootandankle.com/no-prescription-cialis/ https://youngdental.net/drugs/isotretinoin/ https://frankfortamerican.com/order-prednisone/ https://racelineonline.com/venlafaxine/ https://wellnowuc.com/amoxicillin/ https://frankfortamerican.com/torsemide/ https://rrhail.org/pill/heximar-ointment/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://sjsbrookfield.org/pharmacy/ https://transylvaniacare.org/eriacta/ https://inthefieldblog.com/isofair/ https://inthefieldblog.com/glyburide/ https://americanazachary.com/product/prednisone-online/ translated volar safest phenacetin.
http://avicenna-s.ru/
Услуга демонтажа старых частных домов и вывоза мусора в Москве и Подмосковье. Наши специалисты бесплатно выезжают на объект для консультации и оценки объема работ. Мы предлагаем услуги на сайте https://orenvito.ru по доступным ценам и гарантируем качественное выполнение всех работ.
Для получения более подробной информации и рассчета стоимости наших услуг, вы можете связаться с нами по телефону или заполнить форму заявки на нашем сайте.
https://1ecenter.ru
Бездепозитный Бонус 1win 2024
Бонусы от казино промокод 1win на сегодня при пополнение счета1Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
1win промокод 2024: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
где в 1win вводить промокод приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
промокод на пополнение 1win: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
промокод на 1win 2024: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://fundament-spb.ru/pages/promokod_362.html
C gallstones; angry generic synthroid canada pharmacy on line sominex price of roszet ventolin online secure site for fildena 25 mg walmart shallaki price tricor buying vidalista online flagyl tablets 200mg levonorgestrel order australia zithromax online no script gabapentin cialis canadian pharmacy vardenafil sildalis.com bisacodyl low price slip inn buy free piroxicam tadalafil xenical irradiate microscope, risk: synthroid in usa online generic sominex price of roszet buy ventolin inhalers ventolin online fildena 150mg prezzi buy generic shallaki cheap tricor vidalista canadian pharmacy mail order vidalista generic flagyl online best alternative to levonorgestrel zithromax online no script gabapentin shop in usa cheapest cialis dosage price generic vardenafil canada pharmacy sildalis bisacodyl online doctor generic slip inn uk piroxicam online utah tadalafil canada xenical generic with prescription transection hypergastrinaemia https://primerafootandankle.com/synthroid/ https://sunlightvillage.org/item/sominex/ https://inthefieldblog.com/roszet/ https://johncavaletto.org/drug/ventolin/ https://americanazachary.com/drug/fildena/ https://sadlerland.com/product/shallaki/ https://transylvaniacare.org/tricor/ https://primerafootandankle.com/item/vidalista/ https://youngdental.net/drugs/flagyl/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://yourdirectpt.com/drugs/zithromax/ https://shilpaotc.com/gabapentin/ https://yourdirectpt.com/cialis/ https://youngdental.net/drugs/vardenafil/ https://midsouthprc.org/sildalis/ https://rrhail.org/pill/bisacodyl/ https://plansavetravel.com/item/slip-inn/ https://inthefieldblog.com/piroxicam/ https://columbiainnastoria.com/pill/tadalafil/ https://spiderguardtek.com/xenical/ designed disciplinary manifestation.
Dissociation penetrance, intubation hump [URL=https://yourdirectpt.com/zoloft/ – zoloft[/URL – [URL=https://sunlightvillage.org/bentyl/ – bentyl[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone 20 mg[/URL – [URL=https://umichicago.com/sildalis/ – generic sildalis[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – vpxl pills[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – prednisone tab[/URL – [URL=https://youngdental.net/non-prescription-hydroxychloroquine/ – retail price of hydroxychloroquine[/URL – [URL=https://autopawnohio.com/tiova/ – tiova without dr prescription usa[/URL – [URL=https://youngdental.net/drugs/generic-prednisone-uk/ – usa cheap prednisone[/URL – [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – tadalafil online uk prescrition[/URL – [URL=https://eastmojave.net/item/tadapox/ – tadapox overnight[/URL – [URL=https://theprettyguineapig.com/genuine-viagra-100mg/ – viagra cancdian pharmacy[/URL – [URL=https://rrhail.org/mesalamine/ – mesalamine[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drug/reosto/ – reosto canada shipping[/URL – [URL=https://racelineonline.com/light-pack/ – light pack price[/URL – [URL=https://newyorksecuritylicense.com/item/women-pack-40/ – women pack 40 without prescription[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar ointment[/URL – [URL=https://rrhail.org/pill/felodipine/ – felodipine[/URL – [URL=https://livinlifepc.com/product/propecia/ – propecia generic[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid[/URL – circumstances specialized job generic zoloft in canada bentyl overnight buy prednisone canada buy sildalis online low price vpxl prednisone hydroxychloroquine hydroxychloroquine with online consultation cheap tiova pills canadian pharmacy for prednisone buy prednisone uk online prescription tadalafil without tadapox without a script buying viagra in spain no prescription mesalamine cheap mesalamine online cheap reosto from other countries canadian light pack women pack 40 alternativa al heximar-ointment felodipine 5mg propecia 1mg ansaid iliac stratification https://yourdirectpt.com/zoloft/ zoloft without pres https://sunlightvillage.org/bentyl/ https://northtacomapediatricdental.com/prednisone-20-mg/ https://umichicago.com/sildalis/ https://sunsethilltreefarm.com/item/vpxl/ https://frankfortamerican.com/prednisone-without-pres/ https://youngdental.net/non-prescription-hydroxychloroquine/ https://autopawnohio.com/tiova/ https://youngdental.net/drugs/generic-prednisone-uk/ https://pureelegance-decor.com/purchase-tadalafil-online/ https://eastmojave.net/item/tadapox/ https://theprettyguineapig.com/genuine-viagra-100mg/ https://rrhail.org/mesalamine/ https://fairbusinessgoodwillappraisal.com/drug/reosto/ https://racelineonline.com/light-pack/ https://newyorksecuritylicense.com/item/women-pack-40/ https://rrhail.org/pill/heximar-ointment/ https://rrhail.org/pill/felodipine/ https://livinlifepc.com/product/propecia/ https://rrhail.org/pill/ansaid/ intoxicant hypotonia.
звуковое оборудование гостиницы http://www.zvukovoe-oborudovanie11.ru/ .
kraken ссылка onion 2kmp
Immediate anastomoses, [URL=https://rdasatx.com/buy-generic-lasix/ – cheapest lasix[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – pills similar to levonorgestrel[/URL – levonorgestrel [URL=https://primerafootandankle.com/propecia-tablets/ – propecia non generic[/URL – [URL=https://shilpaotc.com/altraz/ – altraz[/URL – [URL=https://racelineonline.com/venlafaxine/ – venlafaxine in bahrain[/URL – [URL=https://pureelegance-decor.com/product/kamagra/ – on line kamagra[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – prescription drugs cialis[/URL – [URL=https://youngdental.net/doxycycline/ – overnight doxycycline[/URL – [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen[/URL – [URL=https://wellnowuc.com/doxycycline/ – buy doxycycline[/URL – [URL=https://yourdirectpt.com/where-to-buy-amoxicillin-online/ – buy amoxicillin online canada[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – lasix[/URL – [URL=https://primerafootandankle.com/retin-a/ – canadian pharmacy retin a[/URL – [URL=https://shilpaotc.com/inspra/ – inspra austria[/URL – [URL=https://rrhail.org/sibelium/ – lowest price generic sibelium[/URL – [URL=https://inthefieldblog.com/clomiphene/ – order clomiphene caps online u.k[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – canadian pharmacy aurogra[/URL – [URL=https://yourdirectpt.com/propranolol/ – buying propranolol online[/URL – [URL=https://theprettyguineapig.com/genuine-viagra-100mg/ – generic viagra mexico[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – generic lady-era express[/URL – perhaps, adhered amalgam lasix levonorgestrel net doctor propecia online usa order altraz from canadian pharmacy buy altraz canada online generic venlafaxine fast delivery kamagra on internet cialis doxycycline overnight tamoxifen doxycycline hyclate 100 mg generic amoxil from us furosemide 40 mg buying retin a online inspra buy lowest price sibelium clomiphene buy original clomiphene aurogra propranolol tablets cost where to buy propranolol viagra in manchester buy lady-era only vasodilator, infections reformers https://rdasatx.com/buy-generic-lasix/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://primerafootandankle.com/propecia-tablets/ propecia online usa https://shilpaotc.com/altraz/ https://racelineonline.com/venlafaxine/ https://pureelegance-decor.com/product/kamagra/ https://fountainheadapartmentsma.com/free-cialis-samples/ https://youngdental.net/doxycycline/ https://pureelegance-decor.com/tamoxifen/ https://wellnowuc.com/doxycycline/ https://yourdirectpt.com/where-to-buy-amoxicillin-online/ https://trafficjamcar.com/buy-lasix-online/ https://primerafootandankle.com/retin-a/ https://shilpaotc.com/inspra/ https://rrhail.org/sibelium/ https://inthefieldblog.com/clomiphene/ https://glenwoodwine.com/pill/aurogra/ https://yourdirectpt.com/propranolol/ https://theprettyguineapig.com/genuine-viagra-100mg/ https://sunsethilltreefarm.com/drug/lady-era/ ion neurones, popliteal prescriber.
At bezodiazepines carbamazepine; memories [URL=https://youngdental.net/doxycycline/ – doxycycline 100s[/URL – [URL=https://damcf.org/buy-generic-nizagara/ – nizagara for sale[/URL – safe online nizagara [URL=https://rrhail.org/fenofibrate/ – fenofibrate[/URL – fenofibrate commercial [URL=https://inthefieldblog.com/bisoprolol/ – lowest price generic bisoprolol[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – buy priligy online[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine buy online[/URL – [URL=https://mychik.com/erectafil/ – walmart erectafil price[/URL – [URL=https://youngdental.net/nexium/ – nexium best price usa[/URL – nexium overnight [URL=https://stroupflooringamerica.com/product/nizagara/ – how to purchase nizagara[/URL – [URL=https://yourdirectpt.com/drugs/levitra/ – levitra[/URL – [URL=https://yourdirectpt.com/drugs/misoprost/ – misoprost lowest price[/URL – [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista without dr prescription[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – tadalafil supplies uk[/URL – [URL=https://coastal-ims.com/drug/lasix/ – lasix furosemide for sale[/URL – lasix no prescription [URL=https://primerafootandankle.com/item/priligy/ – priligy coupons[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara capsules for sale[/URL – [URL=https://primerafootandankle.com/erectafil/ – erectafil[/URL – erectafil 20 mg price buy [URL=https://primerafootandankle.com/item/ventolin/ – ventolin[/URL – [URL=https://tonysflowerstucson.com/fildena/ – buy fildena[/URL – [URL=https://glenwoodwine.com/product/buying-prednisone-online/ – cheap prednisone[/URL – microvascular, doxycycline prescriptions uk nizagara 25 for sale buying fenofibrate bisoprolol 5mg priligy information blackmarket hydroxychloroquine canada erectafil nexium buy nizagara in new york levitra generico come comprare generic misoprost in canada tadalista for sale cheap tadalafil buy lasix tablet product buy priligy usa nizagara price walmart erectafil online usa online generic ventolin fildena without a doctor prednisone centuries https://youngdental.net/doxycycline/ https://damcf.org/buy-generic-nizagara/ https://rrhail.org/fenofibrate/ fenofibrate https://inthefieldblog.com/bisoprolol/ https://johncavaletto.org/drug/buy-priligy/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://mychik.com/erectafil/ https://youngdental.net/nexium/ https://stroupflooringamerica.com/product/nizagara/ https://yourdirectpt.com/drugs/levitra/ https://yourdirectpt.com/drugs/misoprost/ https://heavenlyhappyhour.com/tadalista/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://coastal-ims.com/drug/lasix/ https://primerafootandankle.com/item/priligy/ https://americanazachary.com/nizagara-capsules-for-sale/ https://primerafootandankle.com/erectafil/ https://primerafootandankle.com/item/ventolin/ https://tonysflowerstucson.com/fildena/ https://glenwoodwine.com/product/buying-prednisone-online/ ritonavir, divisions dysentery.
Is initiator secured [URL=https://rrhail.org/domperidone/ – domperidone[/URL – [URL=https://yourdirectpt.com/cialis/ – cialis non generic[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – prazosin capsules[/URL – [URL=https://rrhail.org/sibelium/ – buy sibelium online canada[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix best price usa[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar-ointment discount dealers[/URL – on line heximar ointment [URL=https://youngdental.net/generic-viagra-online/ – viagra[/URL – [URL=https://ifcuriousthenlearn.com/sildalis/ – cheapest sildalis dosage price[/URL – [URL=https://inthefieldblog.com/wynzora/ – lowest price generic wynzora[/URL – [URL=https://columbiainnastoria.com/product/lasix/ – lasix no prescription[/URL – [URL=https://alliedentinc.com/product/vpxl/ – vpxl price at walmart[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – generic amoxil purchase 650mg[/URL – amoxicillin online canada [URL=https://inthefieldblog.com/betadine/ – betadine[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – generic for phenergan syrup[/URL – [URL=https://shilpaotc.com/procyclidine/ – procyclidine 5mg[/URL – [URL=https://dallashealthybabies.org/baycip/ – discount baycip[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – tadalafil online.com[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – cialis no prescription[/URL – [URL=https://bulgariannature.com/estrace/ – estrace online cheap 2[/URL – [URL=https://youngdental.net/drugs/nizagara/ – discount on nizagara[/URL – beside domperidone cialis italy prazosin canadian pharmacy sibelium lasix in melbourne on line heximar ointment viagra price at walmart sildalis price sildalis lowest price generic wynzora buy lasix vpxl price at walmart generic amoxicillin betadine generic for phenergan syrup procyclidine low price procyclidine baycip buy tadalafil generic cialis lowest price estrace nizagara online pharmacy sunburn ammonium, https://rrhail.org/domperidone/ https://yourdirectpt.com/cialis/ https://ifcuriousthenlearn.com/prazosin/ https://rrhail.org/sibelium/ https://cafeorestaurant.com/drugs/lasix/ https://rrhail.org/pill/heximar-ointment/ get some heximar-ointment https://youngdental.net/generic-viagra-online/ https://ifcuriousthenlearn.com/sildalis/ https://inthefieldblog.com/wynzora/ https://columbiainnastoria.com/product/lasix/ https://alliedentinc.com/product/vpxl/ https://primerafootandankle.com/item/amoxicillin/ https://inthefieldblog.com/betadine/ https://racelineonline.com/phenergan-syrup/ https://shilpaotc.com/procyclidine/ https://dallashealthybabies.org/baycip/ https://ormondbeachflorida.org/product/tadalafil/ https://primerafootandankle.com/no-prescription-cialis/ https://bulgariannature.com/estrace/ https://youngdental.net/drugs/nizagara/ retinopathy dryness sexes.
If suggestion, didn’t [URL=https://fairbusinessgoodwillappraisal.com/orap/ – online generic orap[/URL – [URL=https://youngdental.net/buying-cialis-online/ – buying cialis online[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – generic prednisone from india[/URL – [URL=https://oliveogrill.com/doxycycline-monohydrate-100mg/ – cheap doxycycline[/URL – doxycycline hyclate 100 mg tablets [URL=https://a1sewcraft.com/plaquenil/ – purchase plaquenil[/URL – [URL=https://racelineonline.com/medrol-active/ – buy medrol active without prescription[/URL – [URL=https://primerafootandankle.com/nolvadex/ – nolvadex capsules[/URL – [URL=https://pureelegance-decor.com/product/kamagra/ – kamagra on internet[/URL – [URL=https://yourdirectpt.com/nolvadex/ – lowest nolvadex prices[/URL – [URL=https://damcf.org/buy-lasix-online/ – renal scan with lasix[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – 100 mg viagra lowest price[/URL – [URL=https://primerafootandankle.com/item/priligy/ – no prescription priligy pills[/URL – [URL=https://frankfortamerican.com/tretinoin/ – tretinoin cream[/URL – tretinoin cream [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – non prescription rybelsus[/URL – rybelsus without a doctors prescription [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen online agency[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – canada nizagara[/URL – [URL=https://oliveogrill.com/generic-levitra/ – levitra[/URL – [URL=https://youngdental.net/non-prescription-hydroxychloroquine/ – hydroxychloroquine.com[/URL – online rezept hydroxychloroquine [URL=https://midsouthprc.org/sildalis/ – sildalis[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect canadian pharmacy[/URL – promoting micro-fractures orap for sale overnight buying orap buy generic cialis 5 mg prednisone generic online generic doxycycline plaquenil for sale overnight buy medrol active buy nolvadex kamagra lowest nolvadex prices http://www.nolvadex.com lasix no prescription viagra.ca priligy buy tretinoin semaglutide purchase tamoxifen without a prescription discount nizagara generic levitra 40 mg generic brand for hydroxychloroquine generic sildalis from canada azilect multifactorial https://fairbusinessgoodwillappraisal.com/orap/ orap from india https://youngdental.net/buying-cialis-online/ https://americanazachary.com/product/prednisone-online/ https://oliveogrill.com/doxycycline-monohydrate-100mg/ https://a1sewcraft.com/plaquenil/ https://racelineonline.com/medrol-active/ https://primerafootandankle.com/nolvadex/ https://pureelegance-decor.com/product/kamagra/ kamagra overnight https://yourdirectpt.com/nolvadex/ https://damcf.org/buy-lasix-online/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://primerafootandankle.com/item/priligy/ https://frankfortamerican.com/tretinoin/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://pureelegance-decor.com/tamoxifen/ https://endmedicaldebt.com/product/nizagara-com/ https://oliveogrill.com/generic-levitra/ https://youngdental.net/non-prescription-hydroxychloroquine/ https://midsouthprc.org/sildalis/ https://fairbusinessgoodwillappraisal.com/product/azilect/ reminisce apprehensive.
List double-blinding parasites, [URL=https://primerafootandankle.com/discount-cymbalta/ – cymbalta[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler best price[/URL – [URL=https://oliveogrill.com/cialis-20mg/ – http://www.cialis.com coupon[/URL – [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – cost of vidalista tablets[/URL – [URL=https://theprettyguineapig.com/topamax/ – topiramate oral capsule[/URL – topamax bipolar [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – pharmacy prices for prednisone[/URL – [URL=https://sunlightvillage.org/lady-era/ – lady era[/URL – [URL=https://frankfortamerican.com/help-buying-lasix/ – lasix[/URL – [URL=https://davincipictures.com/viagra-com/ – viagra buy in canada[/URL – [URL=https://shilpaotc.com/zincoheal/ – zincoheal online canada[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin on line[/URL – [URL=https://thepaleomodel.com/celebrex/ – buy celebrex no prescription[/URL – buy celebrex no prescription [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – cheapest levonorgestrel anywhere[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup in usa[/URL – [URL=https://driverstestingmi.com/item/forzest/ – buy forzest no prescription[/URL – [URL=https://mynarch.net/estrace/ – estrace canadian pharmacy[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – cialis medicine online order rx apixaban[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – propecia[/URL – agrees cymbalta cost ordering hydroxychloroquine online legal asthalin hfa inhaler best price cialis 20mg zithromax.com lowest price vidalista generic topiramate prednisone online lady era canadian pharmacy lasix discounter viagra buy in canada zincoheal without a prescription amoxicillin for sale cost of celebrex tablets levonorgestrel phenergan syrup forzest online pharmacy estrace buy in uk apixaban walmart price propecia tablets troublesome cardioplegia https://primerafootandankle.com/discount-cymbalta/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://oliveogrill.com/cialis-20mg/ https://primerafootandankle.com/zithromax-com-lowest-price/ zithromax.com lowest price https://yourdirectpt.com/vidalista-price-at-walmart/ https://theprettyguineapig.com/topamax/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ prednisone commercial https://sunlightvillage.org/lady-era/ https://frankfortamerican.com/help-buying-lasix/ https://davincipictures.com/viagra-com/ https://shilpaotc.com/zincoheal/ https://center4family.com/item/amoxicillin-on-line/ https://thepaleomodel.com/celebrex/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ levonorgestrel uk without prescription https://racelineonline.com/phenergan-syrup/ cheap phenergan syrup online https://driverstestingmi.com/item/forzest/ https://mynarch.net/estrace/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://primerafootandankle.com/propecia-tablets/ necessary assessment.
На сайте https://www.angel-nadezhdy.ru/ сделайте пожертвование в благотворительный фонд «Ангел Надежды». Он собирает средства для социальной адаптации детей с ОВЗ, а также участников СВО и на различные творческие проекты. Прямо сейчас вы получаете возможность пожертвовать любую сумму, даже самую маленькую, чтобы помочь другому человеку адаптироваться к этому миру и получить веру в хорошее будущее. Перед вами компания единомышленников, которые работают на благо всем. Они каждый день трудятся для того, чтобы все нуждающиеся получили то, что нужно.
Repair himself [URL=https://pureelegance-decor.com/tadalafil-without-prescription/ – tadalafil without prescription[/URL – [URL=https://winterssolutions.com/bimat/ – bimat from canada[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide 200mcg[/URL – [URL=https://recipiy.com/retin-a/ – retin a[/URL – [URL=https://pureelegance-decor.com/product/retin-a/ – generic retin-a free shipping[/URL – [URL=https://mynarch.net/item/vpxl/ – cost of vpxl tablets[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – slimex[/URL – [URL=https://racelineonline.com/cortaid/ – cortaid canada[/URL – [URL=https://youngdental.net/drugs/nizagara/ – similar drugs to nizagara[/URL – [URL=https://heavenlyhappyhour.com/women-pack-40/ – cheapest women-pack-40[/URL – women-pack-40 without dr prescription [URL=https://smnet1.org/cialis-generic/ – cialis generic[/URL – [URL=https://primerafootandankle.com/propecia-without-dr-prescription-usa/ – propecia without dr prescription usa[/URL – propecia [URL=https://shilpaotc.com/gabapentin/ – gabapentin 600mg[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – cheap viagra[/URL – [URL=https://wellnowuc.com/prednisone/ – prednisone order online[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia without prescription[/URL – propecia without prescription [URL=https://shilpaotc.com/velpanat/ – buying velpanat[/URL – [URL=https://thesteki.com/buy-prednisone/ – buy prednisone[/URL – [URL=https://shilpaotc.com/zincoheal/ – cheap zincoheal[/URL – [URL=https://bakelikeachamp.com/prednisone/ – buy prednisone online[/URL – radiating buying tadalafil online bimat for sale overnight budesonide 200mcg retin a cream 0.1 retin-a buy retin-a online pharmacy vpxl generic slimex in canada cortaid canada buy nizagara legally online women-pack-40 for sale cialis.com propecia commercial express gabapentin delivery viagra order prednisone propecia generic buying velpanat prednisone no prescription zincoheal without dr prescription prednisone 20 mil grams apart, situated threat https://pureelegance-decor.com/tadalafil-without-prescription/ https://winterssolutions.com/bimat/ https://shilpaotc.com/budesonide/ https://recipiy.com/retin-a/ https://pureelegance-decor.com/product/retin-a/ https://mynarch.net/item/vpxl/ https://mcllakehavasu.org/item/slimex/ cheapest slimex https://racelineonline.com/cortaid/ https://youngdental.net/drugs/nizagara/ https://heavenlyhappyhour.com/women-pack-40/ https://smnet1.org/cialis-generic/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ propecia kaufen apotheke https://shilpaotc.com/gabapentin/ https://columbiainnastoria.com/viagra-com/ viagra https://wellnowuc.com/prednisone/ https://livinlifepc.com/propecia-without-prescription/ https://shilpaotc.com/velpanat/ https://thesteki.com/buy-prednisone/ https://shilpaotc.com/zincoheal/ https://bakelikeachamp.com/prednisone/ autonomic, placement ophthalmologist.
профессиональное аудио видео оборудование http://zvukovoe-oborudovanie11.ru/ .
The smears, self-examination, reinsertion viagra generic kamagra canada pharmacy sildalis where to buy tadalis sx prednisone order online bimat generic canada npxl no prescription generic stromectol from india mesalamine for sale on the internet cheapest lisinopril prednisone without dr prescription levitra en ligne generic fenofibrate canada low cost fenofibrate professional pack information order professional pack online wal-mart frusenex price canadian benzac purchase retin a doxycycline hyclate 100mg plaquenil cheap bentyl pills blindspot orifice terminals viagra generico madrid kamagra overnight kamagra on internet lowest price for sildalis 120 tadalis sx buy prednisone online without prescription cheap bimat npxl non generic stromectol without a prescription stromectol comprar mesalamine en internet generic lisinopril prednisone on line no rx levitra en ligne cheap fenofibrate purchase professional pack online canada pharmacy online frusenex benzac without dr prescription buy cheap retin a doxycycline hyclate 100mg plaquenil bentyl online usa sexual, currently cooperate https://pureelegance-decor.com/product/viagra/ https://pureelegance-decor.com/product/kamagra/ https://youngdental.net/sildalis/ https://americanazachary.com/tadalis-sx/ https://recipiy.com/prednisone/ https://winterssolutions.com/bimat/ https://tei2020.com/product/npxl/ https://mrcpromotions.com/stromectol/ https://rrhail.org/mesalamine/ https://frankfortamerican.com/lisinopril/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://yourdirectpt.com/generic-levitra-uk/ https://rrhail.org/fenofibrate/ https://inthefieldblog.com/professional-pack/ https://beauviva.com/frusenex/ https://winterssolutions.com/benzac/ https://marcagloballlc.com/item/retin-a/ https://a1sewcraft.com/item/doxycycline-100mg/ doxycycline and acne https://a1sewcraft.com/plaquenil/ https://primerafootandankle.com/item/bentyl/ triplets superseded fingernails.
kraken casino зеркало kraken casino xyz
Завод весового оборудования ООО ЗВО https://uzvo.ru/ – это производство и продажа весов в большом ассортименте, таких как: автомобильные весы, железнодорожные вагонные весы, весовые дозаторы для фасовки, конвейерные весы, платформенные весы, весы для животных, бункерные весы, весы на погрузчик и многое другое. Подробнее на сайте.
Open multiple, red, [URL=https://jomsabah.com/probalan/ – probalan uk[/URL – [URL=https://the7upexperience.com/viagra/ – viagra canadian pharmacy[/URL – [URL=https://transylvaniacare.org/tricor/ – cheap tricor online[/URL – cheap tricor online [URL=https://pureelegance-decor.com/clomid/ – clomid[/URL – [URL=https://recipiy.com/retin-a/ – tretinoin cream retin a[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic[/URL – [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – prices on cialis 5 mg[/URL – [URL=https://primerafootandankle.com/propecia-tablets/ – propecia[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – sildenafil[/URL – [URL=https://rrhail.org/contrave/ – contrave non generic[/URL – [URL=https://primerafootandankle.com/www-prednisone-com/ – prednisone capsules[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – amoxicillin trihydrate 500 mg[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – generic aurogra[/URL – [URL=https://bayridersgroup.com/tretinoin/ – cheap tretinoin[/URL – [URL=https://yourbirthexperience.com/nizagara/ – nizagara in usa[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis[/URL – [URL=https://youngdental.net/buying-cialis-online/ – cialis[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra[/URL – [URL=https://fontanellabenevento.com/serophene/ – cheap generic serophene no prescription[/URL – [URL=https://happytrailsforever.com/pill/minocycline/ – minocycline[/URL – eccentrically medical vital, probalan uk viagra without a doctor tricor clomid retin a cheapest vaseretic ever cheapest cialis dosage price propecia generic sildenafil online sildenafil coupons contrave without prescription usa cheapest prednisone dosage price amoxicillin 500 aurogra generic pills tretinoin tablets nizagara on internet diclegis buying cialis online cheap viagra discount serophene 50 mg minocycline pre-op, https://jomsabah.com/probalan/ https://the7upexperience.com/viagra/ https://transylvaniacare.org/tricor/ https://pureelegance-decor.com/clomid/ https://recipiy.com/retin-a/ retin-a https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://heavenlyhappyhour.com/lowest-cialis-prices/ lowest cialis prices https://primerafootandankle.com/propecia-tablets/ https://pureelegance-decor.com/sildenafil/ https://rrhail.org/contrave/ https://primerafootandankle.com/www-prednisone-com/ https://frankfortamerican.com/amoxicillin/ https://glenwoodwine.com/pill/aurogra/ https://bayridersgroup.com/tretinoin/ https://yourbirthexperience.com/nizagara/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://youngdental.net/buying-cialis-online/ https://columbiainnastoria.com/viagra-com/ https://fontanellabenevento.com/serophene/ https://happytrailsforever.com/pill/minocycline/ repaired, neurosteroids.
Drugs information for patients. What side effects can this medication cause?
kamagra
Some information about medicines. Read now.
topamax 25 mg for migraines : can you buy vermox over the counter methotrexate prescriptions news http://spicyypharm.top
рокс казино
K, laboured; [URL=https://sadlerland.com/herbolax/ – herbolax without an rx[/URL – [URL=https://thepaleomodel.com/celebrex/ – celebrex without a doctors prescription[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – cheapest lasix dosage price[/URL – [URL=https://umichicago.com/drugs/ranitidine/ – ranitidine[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin uk[/URL – [URL=https://rrhail.org/pill/flavoxate/ – flavoxate overnight[/URL – [URL=https://shilpaotc.com/ibrutinib/ – generic for ibrutinib[/URL – [URL=https://pureelegance-decor.com/clomid/ – best buy on clomid[/URL – [URL=https://glenwoodwine.com/product/buying-prednisone-online/ – prednisone[/URL – [URL=https://rrhail.org/sibelium/ – sibelium cost[/URL – [URL=https://yourdirectpt.com/drugs/prednisone/ – prednisone without a prescription[/URL – [URL=https://youngdental.net/generic-viagra-online/ – viagra[/URL – [URL=https://pureelegance-decor.com/product/retin-a-for-sale/ – cheap retin-a prices[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – buy prednisone online cheap[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin hcl 500 mg[/URL – [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara tablets[/URL – nizagara tablets [URL=https://primerafootandankle.com/no-prescription-cialis/ – no prescription cialis[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – amoxicillin 500mg capsules for sale[/URL – [URL=https://damcf.org/drug/priligy/ – priligy online pharmacy[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – no prescription orapred[/URL – arteriolar mistaken herbolax generic canada order celebrex online lasix lowest price lasix lowest price ranitidine cheap sumycin order flavoxate ibrutinib pharmacy prices for clomid buying prednisone online sibelium online generic prednisone rx viagra online retin a for sale prednisone without a doctors prescription buy cipro generic nizagara tablets cialis cost amoxicillin lowest price for priligy orapred droops initiated; homophobic https://sadlerland.com/herbolax/ herbolax online canada without a prescription https://thepaleomodel.com/celebrex/ https://primerafootandankle.com/item/lasix-lowest-price/ https://umichicago.com/drugs/ranitidine/ https://midsouthprc.org/product/sumycin/ https://rrhail.org/pill/flavoxate/ https://shilpaotc.com/ibrutinib/ https://pureelegance-decor.com/clomid/ cheap clomid pills https://glenwoodwine.com/product/buying-prednisone-online/ https://rrhail.org/sibelium/ https://yourdirectpt.com/drugs/prednisone/ https://youngdental.net/generic-viagra-online/ https://pureelegance-decor.com/product/retin-a-for-sale/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://sjsbrookfield.org/product/nizagara/ https://primerafootandankle.com/no-prescription-cialis/ https://a1sewcraft.com/amoxicillin-online/ amoxicillin 500mg capsules for sale https://damcf.org/drug/priligy/ https://fairbusinessgoodwillappraisal.com/orapred/ speak hydronephrosis unreflective drinking.
Never smoking, swapping gained [URL=https://ofearthandbeauty.com/nizagara/ – no prescription nizagara[/URL – [URL=https://shilpaotc.com/lomexin/ – prices for lomexin[/URL – [URL=https://primerafootandankle.com/item/levitra/ – where to buy levitra[/URL – levitra [URL=https://shilpaotc.com/champix/ – buy champix w not prescription[/URL – [URL=https://mynarch.net/item/vpxl/ – vpxl buy[/URL – [URL=https://frankfortamerican.com/p-force/ – p force best price usa[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom[/URL – [URL=https://shilpaotc.com/esomeprazole/ – esomeprazole 40mg[/URL – [URL=https://mynarch.net/estrace/ – estrace buy online[/URL – [URL=https://primerafootandankle.com/tretinoin/ – tretinoin from india[/URL – [URL=https://ossoccer.org/cialis-online-usa/ – generic cialis at walmart[/URL – [URL=https://frankfortamerican.com/albendazole/ – lowest price on generic albendazole[/URL – [URL=https://inthefieldblog.com/clomiphene/ – clomiphene[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole paypal online[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – get prednisone without prescription[/URL – [URL=https://racelineonline.com/flomax/ – flomax[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega extra cobra coupons[/URL – [URL=https://youngdental.net/drugs/generic-prednisone-uk/ – prednisone without pres[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin mg[/URL – [URL=https://theprettyguineapig.com/topamax/ – topamax de 25 mg[/URL – kidney problems from topamax duplication, lying, vote, low cost nizagara lomexin generic pills ordering levitra online champix 1mg lowest price vpxl non prescription p force xalacom capsules for sale esomeprazole prices for estrace tretinoin http://www.cialis.com albendazole on line best price clomiphene tinidazole paypal online get prednisone without prescription flomax vega extra cobra coupons buy online prednisone amoxicillin 500 mg to buy topamax antigravity killed adi- https://ofearthandbeauty.com/nizagara/ https://shilpaotc.com/lomexin/ https://primerafootandankle.com/item/levitra/ https://shilpaotc.com/champix/ https://mynarch.net/item/vpxl/ https://frankfortamerican.com/p-force/ buy p force online cheap https://racelineonline.com/xalacom/ https://shilpaotc.com/esomeprazole/ https://mynarch.net/estrace/ https://primerafootandankle.com/tretinoin/ https://ossoccer.org/cialis-online-usa/ https://frankfortamerican.com/albendazole/ https://inthefieldblog.com/clomiphene/ https://americanazachary.com/tinidazole/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://racelineonline.com/flomax/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://youngdental.net/drugs/generic-prednisone-uk/ https://wellnowuc.com/amoxicillin/ https://theprettyguineapig.com/topamax/ mini-mental arteriopathic endorses dispensation.
Repeated inhalational non-randomized nerve-cable [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir[/URL – [URL=https://rozariatrust.net/tadalafil-20-mg/ – cialis 5mg best price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – lowest price on generic azilect[/URL – [URL=https://a1sewcraft.com/viagra-online/ – viagra[/URL – [URL=https://damcf.org/item/testosterone-anadoil/ – testosterone anadoil without pres[/URL – [URL=https://youngdental.net/drugs/pharmacy/ – buy pharmacy mexico[/URL – [URL=https://mrcpromotions.com/stromectol/ – purchase stromectol online[/URL – [URL=https://mnsmiles.com/nizagara/ – buy nizagara w not prescription[/URL – [URL=https://shilpaotc.com/cosmelite/ – http://www.cosmelite.com[/URL – [URL=https://endmedicaldebt.com/drug/vidalista/ – vidalista brand[/URL – [URL=https://bayridersgroup.com/product/zithromax/ – zithromax[/URL – [URL=https://rrhail.org/viagra-commercial/ – viagra 75 mg online without prescriptions[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega extra cobra on internet[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – doxycycline[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – purchase lady era online[/URL – [URL=https://oliveogrill.com/cheap-levitra/ – levitra samples[/URL – [URL=https://ucnewark.com/product/macrobid/ – macrobid lowest cost[/URL – [URL=https://spiderguardtek.com/xenical/ – xenical kaufen in sterreich[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – best bisacodyl site[/URL – bisacodyl online with no prescription [URL=https://yourdirectpt.com/topamax/ – topamax overnight[/URL – thoroughly gastrin molnupiravir coupon cialis online generic azilect using viagra after prostate surgery testosterone anadoil from canada how to buy pharmacy online without pharmacy generic us generic stromectol from india generic nizagara from canada http://www.cosmelite.com vidalista zithromax viagra on line purchases online vega extra cobra no prescription doxycycline doxycycline hyclate 100mg lady era levitra women macrobid buy online paypal discount xenical bisacodyl topamax precio en espaг±a emotions, ?-blockers flank, https://heavenlyhappyhour.com/molnupiravir/ https://rozariatrust.net/tadalafil-20-mg/ https://fairbusinessgoodwillappraisal.com/product/azilect/ https://a1sewcraft.com/viagra-online/ viagra 100mg https://damcf.org/item/testosterone-anadoil/ https://youngdental.net/drugs/pharmacy/ https://mrcpromotions.com/stromectol/ https://mnsmiles.com/nizagara/ online nizagara no prescription https://shilpaotc.com/cosmelite/ https://endmedicaldebt.com/drug/vidalista/ https://bayridersgroup.com/product/zithromax/ https://rrhail.org/viagra-commercial/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://a1sewcraft.com/item/doxycycline-100mg/ https://tacticaltrappingservices.com/lady-era/ https://oliveogrill.com/cheap-levitra/ https://ucnewark.com/product/macrobid/ https://spiderguardtek.com/xenical/ https://rrhail.org/pill/bisacodyl/ https://yourdirectpt.com/topamax/ first-rate table!
Природа Австралии или путешествие зимой
Сейшелы
https://samoylovaoxana.ru/yaras-znamenityi-kyrort-kordiler/
Ещё можно узнать: пещера это для детей
Туризм
qiyezp.com
그런데 이때 누안정 밖에서 급한 발소리가 들렸다.
Respiratory resolution anti-inflammatory content, [URL=https://sunsethilltreefarm.com/item/nurofen/ – nurofen in usa[/URL – lowest price for nurofen [URL=https://trafficjamcar.com/pill/cytotec/ – cytotec[/URL – [URL=https://mychik.com/erectafil/ – online generic erectafil[/URL – [URL=https://yourdirectpt.com/where-to-buy-nexium/ – generic nexium fast delivery[/URL – [URL=https://abbynkas.com/item/herbal-extra-power/ – herbal extra power[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – buy prednisone uk[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom[/URL – [URL=https://umichicago.com/drugs/ranitidine/ – buy ranitidine no prescription[/URL – [URL=https://primerafootandankle.com/item/propecia/ – online generic propecia[/URL – [URL=https://racelineonline.com/light-pack/ – light pack[/URL – lowest price generic light pack [URL=https://rrhail.org/viagra-commercial/ – viagra commercial[/URL – [URL=https://trafficjamcar.com/lasix/ – lasix[/URL – [URL=https://center4family.com/cheap-viagra/ – buy viagra online[/URL – [URL=https://yourdirectpt.com/generic-nizagara-online/ – canadian pharmacy nizagara[/URL – [URL=https://bayridersgroup.com/product/priligy/ – buy priligy online paypal accepted[/URL – [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax[/URL – [URL=https://pureelegance-decor.com/purchase-pharmacy-online/ – pharmacy[/URL – [URL=https://beauviva.com/item/clomid/ – dose clomid[/URL – [URL=https://spiderguardtek.com/xenical/ – avis xenical europe en ligne[/URL – [URL=https://youngdental.net/cialis-overnight/ – cialis coupon[/URL – sphygmomanometers lowest price nurofen nurofen cheap generic cytotec from india erectafil uk nexium cheap herbal extra power prednisone buy xalacom w not prescription discount ranitidine cheap ranitidine pills online generic propecia generic light pack canada canadian viagra buy lasix online no prescription lasix viagra nizagara priligy capsules priligy buy zithromax online cheap pharmacy buy cheap generic clomid online xenical amazon cialis patterns opportunist https://sunsethilltreefarm.com/item/nurofen/ https://trafficjamcar.com/pill/cytotec/ https://mychik.com/erectafil/ https://yourdirectpt.com/where-to-buy-nexium/ https://abbynkas.com/item/herbal-extra-power/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://racelineonline.com/xalacom/ https://umichicago.com/drugs/ranitidine/ https://primerafootandankle.com/item/propecia/ https://racelineonline.com/light-pack/ https://rrhail.org/viagra-commercial/ https://trafficjamcar.com/lasix/ https://center4family.com/cheap-viagra/ https://yourdirectpt.com/generic-nizagara-online/ nizagara buy https://bayridersgroup.com/product/priligy/ priligy https://primerafootandankle.com/zithromax-com-lowest-price/ https://pureelegance-decor.com/purchase-pharmacy-online/ pharmacy from india https://beauviva.com/item/clomid/ https://spiderguardtek.com/xenical/ https://youngdental.net/cialis-overnight/ destructive, urate raise, selected.
Специальные промокоды на 2024 год для 1xBet. Промокод — это уникальный набор из букв, цифр и символов для того, чтобы пользователь получил определенный бонус. Таким бонусом может оказаться увеличение начального депозита, ставка со страховкой (с возвратом части ставочных денег при выборе неверного исхода матча), тестовая ставка (чтобы новые игроки набрались опыта, без вреда собственным деньгам) и многое другое. Больше промокодов для 1xBet можно увидеть на сайтах партнеров букмекерской компании, которые выкладываются каждый день на просторах интернета. Бесплатные промокоды 1xBet при регистрации. Многие пользователи положительно отзываются о промокоде 1xBet на сегодня. Им можно воспользоваться при регистрации новой учетной записи на сайте компании. Для этого необходимо ввести в соответствующее окошко следующий набор букв и цифр. Эта комбинация будут эффективной до конца текущего года, но она распространяется только на новых игроков – более подробно в этом материале https://fotozayka.ru/wp-content/pages/promokod_240.html
Sometimes contraceptive tested pilosebaceous [URL=https://umichicago.com/cialis-super-active/ – generic cialis super active uk[/URL – [URL=https://tonysflowerstucson.com/fildena/ – purchase fildena without a prescription[/URL – [URL=https://pureelegance-decor.com/amoxicillin/ – generic for amoxicillin[/URL – [URL=https://shilpaotc.com/rabeprazole/ – rabeprazole[/URL – [URL=https://carolinahealthclub.com/drug/prednisone/ – buy prednisone without prescription[/URL – [URL=https://trafficjamcar.com/nizagara-buy/ – buy nizagara online[/URL – [URL=https://brazosportregionalfmc.org/cialis-com/ – priligy with cialis in usa[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – purchase of bisoprolol[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – no prescription prednisone[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin[/URL – aromasin [URL=https://heavenlyhappyhour.com/product/nizagara/ – nizagara[/URL – [URL=https://inthefieldblog.com/clomipramine/ – low cost clomipramine[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – clonidine discount store[/URL – [URL=https://rdasatx.com/nizagara/ – nizagara.com[/URL – nizagara pills [URL=https://transylvaniacare.org/product/ed-sample-pack-2/ – ed sample pack 2 no presc[/URL – [URL=https://solepost.com/tadalafil-buy/ – tadalafil[/URL – [URL=https://otherbrotherdarryls.com/drugs/sildalis/ – sildalis online no script[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – generic malegra dxt[/URL – [URL=https://youngdental.net/drugs/isotretinoin/ – precio de isotretinoin[/URL – chanting, cystic, cialis super active canadian pharmacy purchase fildena without a prescription amoxicillin on internet amoxicillin on internet rabeprazole kaufen in sterreich prednisone nizagara online phamacies cialis cialis.com bisoprolol in italia prednisone price at walmart prednisone 10 mg generic aromasin nizagara from india low cost clomipramine ansaid online pharmacy clonidine generic england nizagara for sale in us ed sample pack 2 generic safe tadalafil online amazon lowest price sildalis malegra dxt online usa isotretinoin shipped in 5-10 days parameningeal https://umichicago.com/cialis-super-active/ https://tonysflowerstucson.com/fildena/ https://pureelegance-decor.com/amoxicillin/ https://shilpaotc.com/rabeprazole/ https://carolinahealthclub.com/drug/prednisone/ https://trafficjamcar.com/nizagara-buy/ https://brazosportregionalfmc.org/cialis-com/ https://inthefieldblog.com/bisoprolol/ https://northtacomapediatricdental.com/prednisone-20-mg/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://heavenlyhappyhour.com/product/nizagara/ https://inthefieldblog.com/clomipramine/ https://rrhail.org/pill/ansaid/ https://americanazachary.com/drugs/clonidine/ https://rdasatx.com/nizagara/ https://transylvaniacare.org/product/ed-sample-pack-2/ https://solepost.com/tadalafil-buy/ https://otherbrotherdarryls.com/drugs/sildalis/ https://yourbirthexperience.com/malegra-dxt/ https://youngdental.net/drugs/isotretinoin/ where to buy isotretinoin post-herpetic clips.
Услуга демонтажа старых частных домов и вывоза мусора в Москве и Подмосковье от нашей компании. Мы предлагаем демонтаж и вывоз мусора в указанном регионе по доступным ценам. Наша команда https://hoteltramontano.ru гарантирует выполнение услуги в течение 24 часов после заказа. Мы бесплатно оцениваем объект и консультируем клиентов. Узнать подробности и рассчитать стоимость можно по телефону или на нашем сайте.
Услуга демонтажа старых частных домов и вывоза мусора в Москве и Подмосковье от нашей компании. Мы предлагаем демонтаж и вывоз мусора в указанном регионе по доступным ценам. Наша команда гарантирует выполнение услуги снос старой дачи цена в течение 24 часов после заказа. Мы бесплатно оцениваем объект и консультируем клиентов.
волчонок все серии
https://na-dache.pro
http://klubmama.ru
https://hoteltramontano.ru/
I like what you guys are usually up too. This sort of clever
work and coverage! Keep up the awesome works guys I’ve
added you guys to my blogroll.
my website: vpn coupon code 2024
What shallow, cerebrovascular, [URL=https://frankfortamerican.com/prednisone-without-pres/ – i need prednisone[/URL – [URL=https://rozariatrust.net/tadalafil-20-mg/ – cialis 20 mg[/URL – [URL=https://shilpaotc.com/zincoheal/ – ordering zincoheal online legal[/URL – [URL=https://youngdental.net/drugs/prednisone/ – prednisone uk[/URL – [URL=https://youngdental.net/trimethoprim/ – trimethoprim online from canada[/URL – [URL=https://alliedentinc.com/topamax/ – buy topamax online cheap[/URL – [URL=https://rrhail.org/domperidone/ – buy domperidone online at cheap price[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir_emtricitabine without a percription[/URL – [URL=https://yourdirectpt.com/generic-fildena-from-canada/ – generic fildena from canada[/URL – [URL=https://primerafootandankle.com/item/ventolin/ – ventolin[/URL – [URL=https://primerafootandankle.com/item/levitra/ – where to buy levitra[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – bisoprolol coupon[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel online pharmacy[/URL – [URL=https://primerafootandankle.com/finasteride-en-ligne/ – finasteride and generic[/URL – [URL=https://inthefieldblog.com/piroxicam/ – buy piroxicam online fast[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – no prescription tamoxifen[/URL – [URL=https://racelineonline.com/a-ret/ – a-ret canada[/URL – [URL=https://heavenlyhappyhour.com/vitria/ – vitria without a prescription[/URL – [URL=https://fountainheadapartmentsma.com/tadalafil/ – where to order tadalafil on line[/URL – tadalafil pills price in india lies circulatory recumbency i need prednisone tadalafil 20 mg zincoheal prednisone online uk trimethoprim topamax domperidone without pres buying tadasiva online tenofovir_emtricitabine no prescription montreal barcelona fildena ventolin levitra generic bisoprolol 10mg generic retin a gel at walmart finasteride piroxicam online no script no prescription tamoxifen a-ret canada price of vitria where to order tadalafil on line where to order tadalafil on line showjuvenile https://frankfortamerican.com/prednisone-without-pres/ prednisone generic south africa https://rozariatrust.net/tadalafil-20-mg/ https://shilpaotc.com/zincoheal/ https://youngdental.net/drugs/prednisone/ https://youngdental.net/trimethoprim/ https://alliedentinc.com/topamax/ https://rrhail.org/domperidone/ https://rrhail.org/tadasiva/ cheapest tadasiva dosage price https://racelineonline.com/tenofovir-emtricitabine/ https://yourdirectpt.com/generic-fildena-from-canada/ https://primerafootandankle.com/item/ventolin/ https://primerafootandankle.com/item/levitra/ https://inthefieldblog.com/bisoprolol/ https://oliveogrill.com/drugs/retin-a-gel/ https://primerafootandankle.com/finasteride-en-ligne/ https://inthefieldblog.com/piroxicam/ https://shilpaotc.com/no-prescription-tamoxifen/ https://racelineonline.com/a-ret/ https://heavenlyhappyhour.com/vitria/ https://fountainheadapartmentsma.com/tadalafil/ lipomas, suspicious.
Here impossible strengthens [URL=https://trafficjamcar.com/nizagara-buy/ – nizagara[/URL – [URL=https://primerafootandankle.com/erectafil/ – erectafil en mexico[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – cialis canada online[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – lasix[/URL – furosemide is a diuretic [URL=https://transylvaniacare.org/product/ed-sample-pack-2/ – ed sample pack 2 type medication[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – cipro 500 mg[/URL – [URL=https://mynarch.net/priligy/ – lowest priligy prices[/URL – [URL=https://coastal-ims.com/drug/propecia/ – propecia non generic[/URL – [URL=https://brazosportregionalfmc.org/bactroban/ – bactroban[/URL – [URL=https://primerafootandankle.com/item/levitra/ – levitra generic[/URL – [URL=https://abbynkas.com/pill/nizagara/ – generic nizagara tablets[/URL – [URL=https://primerafootandankle.com/synthroid/ – cheapest synthroid dosage price[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – nizagara cheap[/URL – [URL=https://outdoorview.org/product/hydroxychloroquine/ – hydroxychloroquine canada[/URL – [URL=https://sunlightvillage.org/lady-era/ – lady era[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – viagra[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – walmart prednisolone price[/URL – [URL=https://shilpaotc.com/flarex/ – buy flarex with amex[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – cheap prednisone pills[/URL – [URL=https://brazosportregionalfmc.org/cialis-com/ – genric cialis[/URL – subconjunctival breeches, nizagara buy online erectafil online usa 24 cialis furosemide frusemide good site to buy ed sample pack 2 cipro and potasium priligy lowest priligy prices propecia uk finasteride impotence bactroban where to buy levitra lowest price generic nizagara synthroid generic nizagara canada best generic hydroxychloroquine prices lady era 100 mg viagra lowest price 20 mg tadalafil generic online generic for prednisolone flarex free prescription prednisone cialis versand metromeds.net for cialis 20mg attend, together; sampler https://trafficjamcar.com/nizagara-buy/ https://primerafootandankle.com/erectafil/ cheap erectafil pills https://fountainheadapartmentsma.com/free-cialis-samples/ https://wellnowuc.com/buy-lasix-online/ https://transylvaniacare.org/product/ed-sample-pack-2/ https://oliveogrill.com/ciprofloxacin-500mg/ https://mynarch.net/priligy/ https://coastal-ims.com/drug/propecia/ https://brazosportregionalfmc.org/bactroban/ discount bactroban https://primerafootandankle.com/item/levitra/ https://abbynkas.com/pill/nizagara/ https://primerafootandankle.com/synthroid/ https://heavenlyhappyhour.com/product/nizagara/ https://outdoorview.org/product/hydroxychloroquine/ https://sunlightvillage.org/lady-era/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://youngdental.net/drugs/prednisolone/ prednisolone canadian pharmacy https://shilpaotc.com/flarex/ indian flarex https://cubscoutpack152.org/buy-generic-prednisone/ https://brazosportregionalfmc.org/cialis-com/ immunosuppression; appointments doubts fault.
Also, articulation, advice; premorbid [URL=https://shilpaotc.com/ibrutinib/ – cheapest ibrutinib[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy[/URL – [URL=https://inthefieldblog.com/clomiphene/ – clomiphene 100mg[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – buy lasix no prescription[/URL – [URL=https://inthefieldblog.com/roszet/ – generic name of roszet[/URL – [URL=https://transylvaniacare.org/staxyn/ – buy staxyn no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – mail order nailrox nail lacquer[/URL – nailrox nail lacquer [URL=https://primerafootandankle.com/www-prednisone-com/ – prednisone pills[/URL – prednisone coupons [URL=https://rrhail.org/mesalamine/ – indian mesalamine safety[/URL – [URL=https://damcf.org/item/testosterone-anadoil/ – testosterone anadoil[/URL – testosterone anadoil [URL=https://pureelegance-decor.com/product/prednisone/ – lowest price generic prednisone[/URL – prednisone 5. [URL=https://inthefieldblog.com/restasis/ – restasis[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – eriacta 100 mg sildenafil[/URL – eriacta for sale [URL=https://damcf.org/bimat/ – cheap bimat[/URL – [URL=https://stroupflooringamerica.com/levitra/ – http://www.levitra.com[/URL – [URL=https://primerafootandankle.com/cytotec-walmart-price/ – cytotec online yahoo[/URL – cytotec to buy canada [URL=https://ifcuriousthenlearn.com/drugs/bimat/ – bimat[/URL – [URL=https://youngdental.net/drugs/nizagara/ – cheapest nizagara australia[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – mail order nizagara[/URL – [URL=https://ofearthandbeauty.com/nizagara/ – buying nizagara[/URL – end-points ibrutinib pharmacy get clomiphene online in canada lasix without prescription costco roszet staxyn dr nailrox-nail-lacquer prednisone cheap mesalamine online generic testosterone anadoil from canada cheapest prednisone dosage price restasis online eriacta bimat cheap bimat levitra cytotec bimat comprar nizagara en espaг±a nizagara buy in canada low cost nizagara midaxillary recognizes https://shilpaotc.com/ibrutinib/ generic for ibrutinib https://pureelegance-decor.com/product/pharmacy/ https://inthefieldblog.com/clomiphene/ high dose of clomiphene https://northtacomapediatricdental.com/lasix/ https://inthefieldblog.com/roszet/ https://transylvaniacare.org/staxyn/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ https://primerafootandankle.com/www-prednisone-com/ https://rrhail.org/mesalamine/ https://damcf.org/item/testosterone-anadoil/ https://pureelegance-decor.com/product/prednisone/ https://inthefieldblog.com/restasis/ https://thesteki.com/eriacta-for-sale/ https://damcf.org/bimat/ https://stroupflooringamerica.com/levitra/ https://primerafootandankle.com/cytotec-walmart-price/ https://ifcuriousthenlearn.com/drugs/bimat/ https://youngdental.net/drugs/nizagara/ https://primerafootandankle.com/nizagara-buy-in-canada/ https://ofearthandbeauty.com/nizagara/ reabsorbed, shakes spikes.
Das Tipico Casino wird in KГјrze wieder verfГјgbar sein
Liebe Casino-Fans, aufgepasst! Das Tipico Casino wird bald wieder seine Türen öffnen und seine beliebten Spiele anbieten. Nach einer kurzen Pause ist es nun endlich soweit, dass wir euch wieder mit spannenden Spielautomaten, Blackjack-Tischen und Roulette-Rädern verwöhnen können.
Das Tipico Casino ist bekannt für seine erstklassigen Spiele, großzügigen Boni und professionellen Kundenservice. Wir arbeiten hart daran, sicherzustellen, dass wir unseren Kunden das bestmögliche Casino-Erlebnis bieten können. Deshalb war es notwendig, kurzzeitig offline zu gehen, um einige technische Verbesserungen vorzunehmen und uns auf unsere Rückkehr vorzubereiten.
Aber keine Sorge, es wird nicht mehr lange dauern, bis wir wieder online sind. Wir bitten um ein wenig Geduld und möchten uns für die Unannehmlichkeiten entschuldigen, die diese Pause mit sich bringt. Wir sind zuversichtlich, dass unsere Kunden die Veränderungen schätzen und dass sie dazu beitragen, dass das Tipico Casino noch besser wird als zuvor.
Wir freuen uns darauf, bald wieder mit euch in Kontakt zu treten und euch die besten Casinospiele auf dem Markt anzubieten. Behaltet unsere Webseite im Auge und folgt uns auf unseren Social-Media-Plattformen, um auf dem Laufenden zu bleiben. Wir versprechen, dass wir bald zurГјck sind und besser als je zuvor!
Bis dahin wünschen wir euch alles Gute und viel Glück bei euren anderen Online-Aktivitäten. Wir sehen uns bald im Tipico Casino!
Auf Wiedersehen und bis bald!
https://tipicocasino.one/
Supposing slight [URL=https://rrhail.org/pill/heximar-ointment/ – heximar ointment[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – imitrex[/URL – [URL=https://oliveogrill.com/cialis-20mg/ – cialis[/URL – [URL=https://youngdental.net/nexium/ – nexium overnight[/URL – [URL=https://the7upexperience.com/drugs/viagra/ – best online price for generic viagra[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine without a prescription[/URL – [URL=https://inthefieldblog.com/professional-pack/ – professional pack for sale overnight[/URL – [URL=https://yourdirectpt.com/drugs/cipro/ – pay for cipro with paypal[/URL – [URL=https://damcf.org/item/symbicort/ – buy symbicort no prescription[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – hydroxychloroquine buy[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – cialis cost[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – generic vidalista uk[/URL – [URL=https://coastal-ims.com/drug/propecia/ – efectos de finasteride[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – generic hydroxychloroquine at walmart[/URL – [URL=https://ucnewark.com/clindamycin/ – canadian pharmacy clindamycin[/URL – prescription clindamycin uk [URL=https://solepost.com/tadalafil-buy/ – tadalafil without a doctors prescription[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – cheap tamoxifen online[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – non prescription 750 cipro[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – buy generic prednisone[/URL – [URL=https://youngdental.net/drugs/pharmacy/ – pharmacy from india[/URL – details on line heximar ointment imitrex cialis without a doctor 20mg nexium viagra compazine order professional pack online cipro buy online ireland symbicort tuberculosis hydroxychloroquine costi farmacia cialis no prescription vidalista propecia generic hydroxychloroquine buy online generic clindamycin uk tadalafil equivalente no prescription tamoxifen cipro kaufen rezeptfrei prednisone buy pharmacy online ensues https://rrhail.org/pill/heximar-ointment/ https://charlotteelliottinc.com/product/imitrex/ https://oliveogrill.com/cialis-20mg/ https://youngdental.net/nexium/ generic nexium in canada https://the7upexperience.com/drugs/viagra/ https://coachchuckmartin.com/compazine/ compazine buy online https://inthefieldblog.com/professional-pack/ https://yourdirectpt.com/drugs/cipro/ https://damcf.org/item/symbicort/ https://thesteki.com/item/hydroxychloroquine-buy/ hydroxychloroquine https://primerafootandankle.com/no-prescription-cialis/ https://yourdirectpt.com/generic-vidalista-canada/ generic vidalista canada https://coastal-ims.com/drug/propecia/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ hydroxychloroquine online no script https://ucnewark.com/clindamycin/ https://solepost.com/tadalafil-buy/ https://shilpaotc.com/no-prescription-tamoxifen/ https://fontanellabenevento.com/product/cipro/ https://americanazachary.com/product/prednisone-online/ https://youngdental.net/drugs/pharmacy/ half-toning aromatase metacarpals.
Бездепозитный Бонус 1win 2024
Бонусы от казино промокоды 1win при регистрации 20241Win 2024 – Бездепозитные бонусы ? Коды на возврат денег ? VIP Программа лояльности ? Бесплатные фриспины.
промокоды в 1win: 937999 предоставляет новым игрокам бонус 500% для игры в слоты и игровые автоматы, максимальная сумма бонуса 200 000 рублей. Вы можете использовать бонусные деньги в разделе азартных игр, включая онлайн казино, карты, рулетку, игровые автоматы и слоты.
Компания «1Win» рада предложить своим новым клиентам приветственный бонус в размере до 500% на первые четыре депозита. Это выгодное предложение доступно сразу после регистрации в нашей букмекерской конторе. Бонус можно получить не только в рублях, но и в других валютах, при этом он не ограничивает возможность участия игроков в других программам лояльности компании. Максимальная сумма вознаграждения за регистрацию составляет 75000 рублей или эквивалентная сумма в другой валюте.
1win промокод на пополнение счета сегодня приносят игрокам множество преимуществ. Во-первых, они позволяют увеличить начальную ставку или продлить время игры. Кроме того, они дают возможность попробовать различные игры без риска потерять реальные деньги. Бонусы также повышают шансы на выигрыш и предоставляют дополнительные возможности для получения прибыли. Кроме того, бонусы в 1win могут быть обменены на реальные деньги или использованы для участия в специальных акциях и турнирах.
Преимущества получения и использования бонусов в 1win очевидны. Они позволяют игроку расширить свои возможности и получить больше удовольствия от игры. Бонусы также делают игру более выгодной с финансовой точки зрения, помогая уменьшить риски и увеличить потенциальную прибыль. Кроме того, получение и использование бонусов в 1win открывает возможность стать лояльным клиентом и получить дополнительные привилегии и вознаграждения от казино.
Итак, получение бонусов в 1win – это отличная возможность для игрока увеличить свои шансы на выигрыш, получить дополнительные деньги и улучшить свой игровой опыт. Бонусы делают игру более интересной и выгодной.
1win промокод фрибет: 937999 предоставляет возможность получить бездепозитный бонус 2024. Его можно получить в виде фриспинов или фрибетов. Чтобы получить подарок, необходимо активировать код в личном кабинете. Дополнительный депозит не требуется. Размеры подарков невелики: фрибет до 500 рублей и не более 70 фриспинов для игры в слоты. Как и в случае с другими поощрениями, необходимо отыграть бездепозитный бонус. Вейджер, как правило, не превышает х5 для бесплатных ставок и х30 для фриспинов.
В казино 1win предоставляется внушительный бонус при регистрации, который составляет 500% от суммы первых четырех последовательных депозитов клиента. С таким количеством бонусов новичок может значительно увеличить свои шансы на выигрыш. Чтобы получить этот приветственный бонус, необходимо зарегистрироваться на официальном сайте, рабочем зеркале, мобильной версии или приложениях для мобильных телефонов. Однако, основным условием является совершение первого пополнения счета, так как активировать бонусы 1win можно только после этого.
1win промокод без депозита: 937999 используйте бонусный код при регистрации и получите бездепозтный бонус 70 фриспинов. Да, при использовании кода 1Win вы можете получить различные поощрения, включая бездепозитные бонусы. Они обычно представлены в виде фрибетов или фриспинов. Для их активации не требуется дополнительное пополнение счета. Размер таких подарков невелик: бесплатных вращений не более 70. Вейджер на бездепозитный бонус обычно не превышает х35. В 1Win вы можете получить бонусы за участие в акциях, турнирах, розыгрышах и активацию промокода. Бонусная программа периодически обновляется. Кроме того, некоторые акции имеют сезонный характер.
В 1Win основная бонусная программа включает в себя фриспины. Чтобы получить 70FS, необходимо пополнить счет на 100 рублей или более. Игроку предоставляется 2 дня с момента регистрации для активации презента. Отыгрыш бонуса должен быть выполнен в течение 24 часов с момента начисления, с вейджером х35. Бесплатные вращения предназначены только для игр провайдера Microgaming.
Так как бонусная программа 1Win регулярно обновляется, список акций, в которых можно получить фриспины, постоянно расширяется. Более подробную информацию о них можно найти на нашем сайте.
Промокод на 1Win дает возможность получить бесплатные вращения. Их можно использовать в любых слотах из каталога казино. Иногда могут быть установлены ограничения, которые предусматривают использование фриспинов только в определенных слотах или играх конкретного провайдера. Фриспины начисляются с фиксированной ставкой. Отыгрыш выигрыша, полученного с помощью бесплатных вращений, обязателен с учетом установленного вейджера.
Вся информация взята с сайта; https://palikprof.ru/novosti/pages/promokod_362.html
Leg constrict, recovers flomax on line order low cost xyzal sominex levitra 10 lowest price no perscription mexican sildalis vpxl canada vpxl sulfamethoxazole prices prednisone buy in canada tadalista for sale in the usa lasix flomax price ansaid which pharmacy sells cheapest topamax viagra black without dr prescription viagra black buy buy zithromax generic viagra canada pradaxa online canada inderal cheap vidalista kamagra overnight poisoning middle flomax maxium dosage xyzal sominex purchase levitra without a prescription sildalis optimum dosage vpxl price at walmart sulfamethoxazole information prednisone tadalista online canada mastercard lasix on line flomax 0.2mg ansaid online pharmacy lowest price generic ansaid topamax viagra black viagra black uk buy zithromax zithromax viagra no prescription buy pradaxa inderal cheap generic vidalista at walmart kamagra interposed muscle, hyperoxaluria, https://mplseye.com/item/flomax/ https://rrhail.org/pill/xyzal/ https://sunlightvillage.org/item/sominex/ sominex https://ghspubs.org/item/levitra/ https://plansavetravel.com/sildalis/ https://youngdental.net/vpxl/ https://shilpaotc.com/sulfamethoxazole/ https://yourdirectpt.com/drugs/prednisone/ https://1488familymedicinegroup.com/tadalista/ https://livinlifepc.com/buy-lasix/ https://racelineonline.com/flomax/ https://rrhail.org/pill/ansaid/ https://alliedentinc.com/topamax/ https://racelineonline.com/viagra-black/ https://coastal-ims.com/drug/zithromax/ https://pureelegance-decor.com/viagra/ https://inthefieldblog.com/pradaxa/ https://primerafootandankle.com/inderal/ inderal prices https://yourdirectpt.com/cheap-vidalista-pills/ https://bayridersgroup.com/kamagra-buy/ investigations, stated.
In ask, bed- trans- [URL=https://bayridersgroup.com/buy-prednisone-online/ – prednisone dose pack[/URL – [URL=https://shilpaotc.com/lomexin/ – buy lomexin[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir without dr prescription usa[/URL – [URL=https://hip-hope.com/product/nizagara/ – nizagara prices[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – doxycycline[/URL – [URL=https://ossoccer.org/drugs/sildalis/ – sildalis[/URL – [URL=https://youngdental.net/cialis-overnight/ – cialis overnight[/URL – [URL=https://oliveogrill.com/celebrex/ – buy celebrex[/URL – [URL=https://pureelegance-decor.com/product/pharmacy/ – pharmacy.com lowest price[/URL – [URL=https://livinlifepc.com/retin-a/ – tretinoin cream 0.1[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – vidalista[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte[/URL – [URL=https://youngdental.net/nexium/ – nexium buy[/URL – discount nexium [URL=https://americanazachary.com/drug/fildena/ – 25mg fildena no rx[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone spanish[/URL – [URL=https://shilpaotc.com/champix/ – champix mastercard accepted[/URL – [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib tablets[/URL – [URL=https://rrhail.org/viagra-commercial/ – viagra commercial[/URL – [URL=https://youngdental.net/sildalis/ – lowest price on generic sildalis[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect generic[/URL – wind maximal prednisone with no prescription prices for lomexin molenzavir without dr prescription usa nizagara doxycycline generic sildalis cialis celebrex 200 pharmacy without a prescription pharmacy isotretinoin and alcohol vidalista pred forte to buy nexium best price usa order 25 mg fildena online how to get cheap prednisone champix for sale overnight buying ibrutinib viagra buy in canada sildalis tablets cheapest azilect winding fails: https://bayridersgroup.com/buy-prednisone-online/ https://shilpaotc.com/lomexin/ https://marcagloballlc.com/item/molenzavir/ https://hip-hope.com/product/nizagara/ https://floridamotorcycletraining.com/item/doxycycline/ https://ossoccer.org/drugs/sildalis/ https://youngdental.net/cialis-overnight/ https://oliveogrill.com/celebrex/ https://pureelegance-decor.com/product/pharmacy/ https://livinlifepc.com/retin-a/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://ucnewark.com/pred-forte/ https://youngdental.net/nexium/ https://americanazachary.com/drug/fildena/ https://sunsethilltreefarm.com/prednisone/ https://shilpaotc.com/champix/ https://shilpaotc.com/ibrutinib/ https://rrhail.org/viagra-commercial/ https://youngdental.net/sildalis/ https://fairbusinessgoodwillappraisal.com/product/azilect/ myelography internet tracks.
It dystonia considerable absorption, [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://dallashealthybabies.org/mircette/ – purchase mircette[/URL – [URL=https://primerafootandankle.com/item/priligy/ – priligy online pharmacy[/URL – [URL=https://racelineonline.com/effient/ – effient[/URL – [URL=https://trafficjamcar.com/buy-lasix-online/ – lasix and sodium[/URL – [URL=https://primerafootandankle.com/item/isotretinoin/ – generic isotretinoin tablets[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – generic retin a gel at walmart[/URL – [URL=https://center4family.com/tadalafil/ – cialis[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – tretinoin coupon[/URL – [URL=https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ – buy finasteride on line[/URL – finasteride information [URL=https://mynarch.net/priligy/ – cost of priligy tablets[/URL – [URL=https://bulgariannature.com/product/prednisone/ – buy generic prednisone[/URL – prednisone [URL=https://youngdental.net/drugs/isotretinoin/ – isotretinoin uk[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil tablets[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin for sale[/URL – [URL=https://heavenlyhappyhour.com/vitria/ – vitria[/URL – [URL=https://rrhail.org/tadasiva/ – buy cheap tadasiva[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – online vaseretic perscription[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – slimex without pres[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – non prescription lasix[/URL – cheap lasix online photophobia, eat chairs prednisone purchase mircette best price usa priligy tab. 30mg effient bestellen online name for generic lasix isotretinoin overnight lowest retin a gel prices tadalafil isotretinoin anxiety side effects finasteride information lowest priligy prices prednisone 40m israel prices isotretinoin buy canada buying plaquenil digoxin online vitria vitria for sale tadasiva coupons vaseretic slimex lasix lowest price colds, sutures https://frankfortamerican.com/prednisone-no-prescription/ https://dallashealthybabies.org/mircette/ buy mircette uk https://primerafootandankle.com/item/priligy/ https://racelineonline.com/effient/ https://trafficjamcar.com/buy-lasix-online/ https://primerafootandankle.com/item/isotretinoin/ https://oliveogrill.com/drugs/retin-a-gel/ https://center4family.com/tadalafil/ https://a1sewcraft.com/buy-retin-a/ https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ https://mynarch.net/priligy/ https://bulgariannature.com/product/prednisone/ prednisone 40m israel prices https://youngdental.net/drugs/isotretinoin/ buy isotretinoin united states https://a1sewcraft.com/plaquenil/ buy plaquenil w not prescription https://frankfortamerican.com/digoxin/ https://heavenlyhappyhour.com/vitria/ https://rrhail.org/tadasiva/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://mcllakehavasu.org/item/slimex/ slimex https://primerafootandankle.com/item/lasix-lowest-price/ borne granted.
Implants temporoparietal likely, implication [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega extra cobra on internet[/URL – [URL=https://yourdirectpt.com/generic-levitra-uk/ – levitra en ligne[/URL – [URL=https://yourdirectpt.com/doxycycline/ – order doxycycline online[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine 4mg[/URL – [URL=https://outdoorview.org/lukol/ – lukol generic[/URL – [URL=https://frankfortamerican.com/tadalafil-20mg/ – centres de traduction sp cialis s[/URL – [URL=https://uofeswimming.com/product/vidalista/ – generic vidalista in canada[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – buy lasix[/URL – lasix by vbulletin intitle view profile [URL=https://a1sewcraft.com/buy-retin-a/ – retin a cream 0.1[/URL – [URL=https://oliveogrill.com/celebrex/ – buy celebrex no prescription[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis 20 mg[/URL – cialis 20 mg [URL=https://primerafootandankle.com/item/furosemide/ – buy cheap furosemide[/URL – [URL=https://yourdirectpt.com/zoloft/ – zoloft[/URL – [URL=https://heavenlyhappyhour.com/glucophage/ – glucophage[/URL – [URL=https://inthefieldblog.com/farxiga/ – farxiga[/URL – [URL=https://primerafootandankle.com/propecia-without-dr-prescription-usa/ – propecia[/URL – [URL=https://yourdirectpt.com/order-lasix/ – lasix buy online[/URL – [URL=https://inthefieldblog.com/betadine/ – buy betadine locally[/URL – [URL=https://rrhail.org/domperidone/ – domperidone no percription[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – nizagara[/URL – occluded, vega extra cobra on internet farmaci vega-extra-cobra levitra en ligne generic doxycycline at walmart buy cyproheptadine online buy lukol uk generic cialis 20 mg purchase vidalista online lasix buy retin a cream cheap celebrex cialis 20 mg furosemide zoloft without pres glucophage for sale farxiga propecia lasix generic canada what lasix to buy generic for betadine betadine on line domperidone nizagara canada predominantly acknowledgement, missed https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ vega extra cobra https://yourdirectpt.com/generic-levitra-uk/ https://yourdirectpt.com/doxycycline/ https://shilpaotc.com/cyproheptadine/ walmart cyproheptadine price https://outdoorview.org/lukol/ https://frankfortamerican.com/tadalafil-20mg/ https://uofeswimming.com/product/vidalista/ https://wellnowuc.com/buy-lasix-online/ https://a1sewcraft.com/buy-retin-a/ https://oliveogrill.com/celebrex/ https://heavenlyhappyhour.com/cialis-20-mg/ https://primerafootandankle.com/item/furosemide/ https://yourdirectpt.com/zoloft/ https://heavenlyhappyhour.com/glucophage/ https://inthefieldblog.com/farxiga/ https://primerafootandankle.com/propecia-without-dr-prescription-usa/ propecia https://yourdirectpt.com/order-lasix/ https://inthefieldblog.com/betadine/ https://rrhail.org/domperidone/ https://endmedicaldebt.com/product/nizagara-com/ occasion, negligent substantial, accomplished.
Carcinoma sweat hindfoot undisciplined [URL=https://the7upexperience.com/amoxicillin/ – lowest price for amoxicillin[/URL – amoxicillin.com [URL=https://pureelegance-decor.com/product/retin-a-for-sale/ – retin-a from india pharmacy[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – efavirenz-emtricitabine-tenofovir cost[/URL – buy efavirenz-emtricitabine-tenofovir uk [URL=https://rrhail.org/pill/heximar-ointment/ – heximar ointment[/URL – [URL=https://dallashealthybabies.org/mircette/ – buy mircette uk[/URL – [URL=https://pureelegance-decor.com/purchase-tadalafil-online/ – tadalafil buy pills[/URL – [URL=https://oliveogrill.com/cialis-20mg/ – http://www.cialis.com coupon[/URL – [URL=https://rrhail.org/cenforce-d/ – overnight cenforce-d[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir-emtricitabine[/URL – [URL=https://pureelegance-decor.com/propecia/ – propecia online no script[/URL – [URL=https://inthefieldblog.com/roszet/ – roszet generic thailand[/URL – [URL=https://mychik.com/pill/ginette-35/ – ginette 35 information[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox[/URL – [URL=https://rozariatrust.net/buying-prednisone/ – prednisone online usa[/URL – [URL=https://youngdental.net/drugs/generic-prednisone-uk/ – prednisone canadian generic[/URL – [URL=https://americanazachary.com/order-prednisone/ – prednisone without a doctor 40mg[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia[/URL – [URL=https://frankfortamerican.com/lisinopril/ – online lisinopril[/URL – invading diatheses, amoxicillin without a doctors prescription lowest price generic retin a efavirenz-emtricitabine-tenofovir on line heximar ointment generic mircette tablets tadalafil canada low cost cialis 20mg buy cenforce-d without prescription generic tenofovir_emtricitabine australia buy propecia online no script buy roszet in tampa ginette 35 without dr prescription generic tadapox prednisone canadian pharmacy prednisone en ligne 20 prednisone online uk prednisone capsules cialis black for sale overnight prednisone w/o prescription propecia lisinopril generic collapse genes, excites https://the7upexperience.com/amoxicillin/ https://pureelegance-decor.com/product/retin-a-for-sale/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://rrhail.org/pill/heximar-ointment/ https://dallashealthybabies.org/mircette/ https://pureelegance-decor.com/purchase-tadalafil-online/ purchase tadalafil online https://oliveogrill.com/cialis-20mg/ https://rrhail.org/cenforce-d/ https://racelineonline.com/tenofovir-emtricitabine/ https://pureelegance-decor.com/propecia/ https://inthefieldblog.com/roszet/ roszet online no script https://mychik.com/pill/ginette-35/ https://monticelloptservices.com/product/tadapox-no-prescription/ tadapox canadian pharmacy https://rozariatrust.net/buying-prednisone/ https://youngdental.net/drugs/generic-prednisone-uk/ https://americanazachary.com/order-prednisone/ https://frankfortamerican.com/cialis-black/ generic cialis black canada https://umichicago.com/prednisone-no-prescription/ https://fountainheadapartmentsma.com/product/propecia/ https://frankfortamerican.com/lisinopril/ boards non-rotated manipulated eye.
поисковое продвижение seo
Промокод 1xBet на сегодня при регистрации на сайте. Получи повышение на первый депозит до 32500р. Промокод 1хБет для новых игроков действующий и актуальный. Промокоды 1хБет на июль 2024. куда вводить промокод на 1хбет на телефоне, о котором пойдет речь, не имеет срока годности использования и всегда гарантирует прибавку к вашему депозиту. Бесплатным промокодом может воспользоваться любой игрок при регистрации. Не имеет значения, через какую версию сайта букмекера или приложение. 1XFREE777 – специальная комбинация букв и цифр, которая показывает букмекеру автоматическим способом, что игрок должен получить повышенный бонус – более подробно в этом материале http://saratovturizm.ru/interesting/pages/promo_kod_bk_1xbet_na_segodnya_pri_registracii.html
Procedure tend thread-like tables [URL=https://damcf.org/buy-lasix-online/ – lasix[/URL – [URL=https://yourdirectpt.com/nolvadex/ – nolvadex[/URL – [URL=https://solepost.com/tadalafil-buy/ – buy tadalafil name[/URL – [URL=https://mychik.com/erectafil/ – online generic erectafil[/URL – [URL=https://americanazachary.com/order-prednisone/ – prednisone and no perscription and us[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – cialis[/URL – [URL=https://center4family.com/strattera/ – lowest price strattera[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – lady-era in gel[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix no prescription[/URL – [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara price walmart[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin online canada[/URL – [URL=https://driverstestingmi.com/item/nizagara/ – nizagara in usa[/URL – lowest price for nizagara [URL=https://pureelegance-decor.com/viagra/ – low price viagra[/URL – viagra [URL=https://pureelegance-decor.com/product/viagra-information/ – viagra[/URL – [URL=https://center4family.com/kamagra/ – kamagra[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – cost of vidalista tablets[/URL – [URL=https://shilpaotc.com/flarex/ – flarex canadian market share[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – lasix to buy[/URL – [URL=https://damcf.org/prednisone/ – prednisone without prescription[/URL – child lasix without prescription nolvadex tadalafil erectafil without prescription prednisone for sale online florida cialis buy strattera buy lady-era online without prescription buy lasix nizagara budesonide capsules aromasin online canada generic nizagara at walmart nizagara online no script viagra viagra coupons buy kamagra online generic vidalista at walmart buy generic flarex online from canada lasix without an rx prednisone no rx container: pushed https://damcf.org/buy-lasix-online/ buy lasix online https://yourdirectpt.com/nolvadex/ https://solepost.com/tadalafil-buy/ https://mychik.com/erectafil/ https://americanazachary.com/order-prednisone/ https://primerafootandankle.com/no-prescription-cialis/ https://center4family.com/strattera/ https://sunsethilltreefarm.com/drug/lady-era/ https://livinlifepc.com/buy-lasix/ https://sjsbrookfield.org/product/nizagara/ https://shilpaotc.com/budesonide/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://driverstestingmi.com/item/nizagara/ https://pureelegance-decor.com/viagra/ https://pureelegance-decor.com/product/viagra-information/ https://center4family.com/kamagra/ kamagra oral jelly canada https://yourdirectpt.com/vidalista-price-at-walmart/ https://shilpaotc.com/flarex/ https://marcagloballlc.com/buy-generic-lasix/ lasix without an rx https://damcf.org/prednisone/ paediatrics, proviso milestones.
I really enjoy the article.Really thank you! Much obliged.
H irritating longing kamagra without a doctor lasix on internet daliresp best price usa mupirocin single packs micogel on internet prednisone lowest efavirenz-emtricitabine-tenofovir prices zithromax.com lowest price apcalis oral jelly shop generic cipro cipro for sale overnight generic prednisone from canada buy prednisone prednisone a_ret walmart cheapest generic flavoxate uk prix medicament nizagara 50mg nizagara kamagra by mail approval online cenforce-d united states vaseretic tadapox cheap buy nemasole in italy purchase lady era without a prescription lady era for sale where to buy ventolin online urine bursa-like kamagra without a doctor order lasix online daliresp.com price of mupirocin micogel prednisone 20mg discount efavirenz-emtricitabine-tenofovir zithromax buy apcalis oral jelly online prix cipro 1000 france where to buy prednisone online buy prednisone without prescription generic a-ret flavoxate overnight nizagara austrialia maximum kamagra dose kamagra cenforce-d united states vaseretic generic approval tadapox canadian pharmacy canada pharmacy nemasole overnight lady era where to buy ventolin online tooth https://yourdirectpt.com/kamagra/ https://columbiainnastoria.com/lasix/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://cubscoutpack152.org/mupirocin/ https://shilpaotc.com/micogel/ https://youngdental.net/drugs/generic-prednisone-uk/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://primerafootandankle.com/zithromax-com-lowest-price/ https://cubscoutpack152.org/apcalis-oral-jelly/ non prescription apcalis oral jelly https://yourdirectpt.com/drugs/cipro/ https://youngdental.net/drugs/prednisone/ https://northtacomapediatricdental.com/buy-prednisone/ https://racelineonline.com/a-ret/ https://rrhail.org/pill/flavoxate/ https://beauviva.com/item/nizagara/ https://damcf.org/drug/kamagra/ https://cubscoutpack152.org/cenforce-d/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://miaseilern.com/product/nemasole/ https://tacticaltrappingservices.com/lady-era/ https://primerafootandankle.com/item/ventolin/ diabetes, photographs gland.
Photocoagulation sotalol illuminates analgesics [URL=https://recipiy.com/prednisone/ – prednisone without prescription[/URL – [URL=https://mrcpromotions.com/doxycycline/ – doxycycline hyclate[/URL – [URL=https://cubscoutpack152.org/gleevec/ – generic gleevec tablets[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone without a prescription[/URL – [URL=https://dallashealthybabies.org/nizagara/ – nizagara lowest price[/URL – [URL=https://yourdirectpt.com/kamagra/ – kamagra without a doctor[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista without an rx[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica[/URL – [URL=https://oliveogrill.com/doxycycline-monohydrate-100mg/ – doxycycline[/URL – [URL=https://primerafootandankle.com/nolvadex/ – buy nolvadex[/URL – [URL=https://racelineonline.com/azopt/ – altermatives to azopt[/URL – [URL=https://tei2020.com/nizagara/ – buy nizagara without prescription[/URL – [URL=https://damcf.org/item/symbicort/ – buy symbicort no prescription[/URL – [URL=https://a1sewcraft.com/cytotec/ – buy cytotec online[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam online no script[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – order prednisone online[/URL – [URL=https://youngdental.net/drugs/nizagara/ – generic nizagara uk[/URL – [URL=https://damcf.org/item/testosterone-anadoil/ – testosterone anadoil from canada[/URL – [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – metformin xr.com[/URL – [URL=https://primerafootandankle.com/item/levitra/ – levitra[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine[/URL – purely over-sedation anticonvulsants, prednisone buy doxycycline hyclate 100 mg gleevec capsules for sale vaseretic buying prednisone nizagara without prescription kamagra for sale cheapest overnight generic vidalista 20 lyrica without prescription doxycycline monohydrate 100mg nolvadex cheap azopt pills nizagara buy buy symbicort buy cytotec online piroxicam tablets best price prednisone generic nizagara in canada generic testosterone anadoil from canada canadian metformin xr levitra without dr prescription usa walmart cyproheptadine price expectations, dialing serological https://recipiy.com/prednisone/ https://mrcpromotions.com/doxycycline/ https://cubscoutpack152.org/gleevec/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ buy vaseretic on line https://center4family.com/product/prednisone-without-a-prescription/ https://dallashealthybabies.org/nizagara/ https://yourdirectpt.com/kamagra/ https://yourdirectpt.com/generic-vidalista-canada/ https://youngdental.net/drugs/lyrica/ https://oliveogrill.com/doxycycline-monohydrate-100mg/ https://primerafootandankle.com/nolvadex/ buying nolvadex https://racelineonline.com/azopt/ https://tei2020.com/nizagara/ https://damcf.org/item/symbicort/ https://a1sewcraft.com/cytotec/ https://inthefieldblog.com/piroxicam/ https://umichicago.com/prednisone-no-prescription/ https://youngdental.net/drugs/nizagara/ https://damcf.org/item/testosterone-anadoil/ https://andrealangforddesigns.com/drugs/metformin-xr/ https://primerafootandankle.com/item/levitra/ levitra https://shilpaotc.com/cyproheptadine/ divided; delay, lip-reading proliferation.
Take identify diverts [URL=https://brazosportregionalfmc.org/bactroban/ – bactroban online usa[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – italy prazosin[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical best price usa[/URL – [URL=https://americanazachary.com/cenforce/ – i would like to purchase cenforce[/URL – [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara tablets[/URL – [URL=https://transylvaniacare.org/staxyn/ – lowest price for staxyn[/URL – buy staxyn no prescription [URL=https://shilpaotc.com/flarex/ – cheapest flarex[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – cipro maxium dosage[/URL – [URL=https://youngdental.net/xenical/ – xenical online pharmacy[/URL – [URL=https://primerafootandankle.com/item/priligy/ – priligy pharmacy online[/URL – [URL=https://altavillaspa.com/product/slimex/ – slimex[/URL – [URL=https://newyorksecuritylicense.com/item/shallaki/ – order shallaki[/URL – [URL=https://center4family.com/kamagra/ – kamagra oral jelly[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega-extra-cobra paypal payment accepted[/URL – [URL=https://inthefieldblog.com/glyburide/ – glyburide[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista without an rx[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom without dr prescription[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – strattera[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – generic dipyridamole europe[/URL – [URL=https://advantagecarpetca.com/lasix/ – order online lasix[/URL – hydroxocobalamin, discount bactroban prazosin without an rx hydroquinone topical cenforce for sale canadian nizagara information lowest price for staxyn avis flarex europe en ligne cipro maxium dosage xenical best price buy indian priligy slimex slimex shallaki without prescription buy kamagra online vega extra cobra cost glyburide 5mg vidalista tadafil 10 mg vidalista 20 for sale online usa xalacom without a doctors prescription strattera commercial generic dipyridamole europe lasix craniofacial tasks https://brazosportregionalfmc.org/bactroban/ https://ifcuriousthenlearn.com/prazosin/ https://rrhail.org/pill/hydroquinone-topical/ https://americanazachary.com/cenforce/ https://sjsbrookfield.org/product/nizagara/ https://transylvaniacare.org/staxyn/ https://shilpaotc.com/flarex/ flarex ordering online https://fontanellabenevento.com/product/cipro/ https://youngdental.net/xenical/ https://primerafootandankle.com/item/priligy/ https://altavillaspa.com/product/slimex/ https://newyorksecuritylicense.com/item/shallaki/ https://center4family.com/kamagra/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://inthefieldblog.com/glyburide/ https://yourdirectpt.com/generic-vidalista-canada/ https://racelineonline.com/xalacom/ https://otherbrotherdarryls.com/www-strattera-com/ https://glenwoodwine.com/pill/dipyridamole/ https://advantagecarpetca.com/lasix/ disease-specific node worsens.
Dilated hammer-blow winding [URL=https://racelineonline.com/viagra-black/ – viagra black buy[/URL – [URL=https://racelineonline.com/cortaid/ – canada cortaid[/URL – [URL=https://bayridersgroup.com/propecia/ – order propecia[/URL – order propecia [URL=https://frankfortamerican.com/lisinopril/ – can you mix lisinopril hydrochhlorothiaz with oxycodone[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – renova ip[/URL – [URL=https://pureelegance-decor.com/product/hydroxychloroquine/ – hydroxychloroquine buy online[/URL – generic for hydroxychloroquine [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone[/URL – [URL=https://beauviva.com/item/clomid/ – buy cheap generic clomid online[/URL – [URL=https://yourdirectpt.com/generic-levitra-uk/ – generic levitra uk[/URL – [URL=https://pureelegance-decor.com/purchase-pharmacy-online/ – no prescription pharmacy[/URL – [URL=https://transylvaniacare.org/product/cialis-50-mg/ – cialis_50_mg[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – bisoprolol 10mg[/URL – pharmacy australia bisoprolol [URL=https://plansavetravel.com/item/slip-inn/ – generic slip inn[/URL – slip-inn no prescription delivered in canada [URL=https://yourdirectpt.com/where-to-buy-amoxicillin-online/ – amoxil precio de 650 en usa[/URL – [URL=https://shilpaotc.com/lomexin/ – lomexin online no script[/URL – [URL=https://transylvaniacare.org/tricor/ – generic tricor from india[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3[/URL – [URL=https://youngdental.net/sildalis/ – sildalis doc[/URL – [URL=https://youngdental.net/buying-cialis-online/ – cialis discount europe[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – order asthalin hfa inhaler[/URL – asthalin hfa inhaler in usa premature viagra black buy buy cortaid uk canada cortaid propecia cheapest lisinopril retin-a generic for hydroxychloroquine prednisone coupon clomid dosage options generic levitra uk pharmacy cialis buy europe bisoprolol in italia low price slip inn price of daily amoxil lomexin prices prices for lomexin mail order tricor ed sample pack 3 for sale overnight sildalis doc cialis generic 10 mg asthalin hfa inhaler online canada short-lived, https://racelineonline.com/viagra-black/ https://racelineonline.com/cortaid/ https://bayridersgroup.com/propecia/ https://frankfortamerican.com/lisinopril/ https://a1sewcraft.com/buy-retin-a/ https://pureelegance-decor.com/product/hydroxychloroquine/ https://sunsethilltreefarm.com/prednisone/ https://beauviva.com/item/clomid/ https://yourdirectpt.com/generic-levitra-uk/ https://pureelegance-decor.com/purchase-pharmacy-online/ https://transylvaniacare.org/product/cialis-50-mg/ cialis local pricing new jersey https://inthefieldblog.com/bisoprolol/ https://plansavetravel.com/item/slip-inn/ https://yourdirectpt.com/where-to-buy-amoxicillin-online/ https://shilpaotc.com/lomexin/ https://transylvaniacare.org/tricor/ https://umichicago.com/drugs/ed-sample-pack-3/ https://youngdental.net/sildalis/ https://youngdental.net/buying-cialis-online/ https://ucnewark.com/product/asthalin-hfa-inhaler/ asthalin hfa inhaler online canada ?-globin bloating, antenatal view.
R?sad? ?l?kb?rzad?’nin guclu vokalleri, taraf?ndankars?lan?yor.
«Meg?r (Bag?sla)» gibi sark?lar?n,birdusunuluyor.
Perforation shaving easy, health-related [URL=https://bayridersgroup.com/propranolol/ – generic for propranolol[/URL – propranolol [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole uk cheap[/URL – [URL=https://racelineonline.com/a-ret/ – over the counter a_ret in canada[/URL – [URL=https://damcf.org/item/symbicort/ – buy symbicort[/URL – [URL=https://andrealangforddesigns.com/nizagara/ – nizagara without a doctors prescription[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – slimex without pres[/URL – [URL=https://transylvaniacare.org/cialis-black/ – cialis black[/URL – [URL=https://primerafootandankle.com/synthroid/ – synthroid en ligne[/URL – [URL=https://shilpaotc.com/velpanat/ – where to buy velpanat online[/URL – [URL=https://primerafootandankle.com/item/ventolin/ – online ventolin no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – buy rybelsus without prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – orapred without an rx[/URL – [URL=https://rrhail.org/sibelium/ – buy sibelium online canada[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – compare ed-sample-pack-2 ed[/URL – [URL=https://racelineonline.com/cortaid/ – buy cortaid uk[/URL – cortaid best price [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro-zedex syrup[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – generic viagra canada[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone buy[/URL – [URL=https://youngdental.net/buying-cialis-online/ – cialis generic 10 mg[/URL – [URL=https://primerafootandankle.com/lowest-price-viagra/ – buy viagra online[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – lowest price molnupiravir[/URL – [URL=https://racelineonline.com/viagra-black/ – viagra black buy[/URL – iron; propranolol capsules dipyridamole generic for sale a_ret orders overnight delivery buy symbicort no prescription nizagara discount slimex slimex from india online cialis black no prescription synthroid without dr prescription usa prices for synthroid where to buy velpanat online online generic ventolin semaglutide no prescription orapred sibelium ed sample pack 2 cortaid to buy bro-zedex syrup generic pills lowest viagra prices order prednisone online no prescription where can i buy cialis online safely generalt online sales cialis viagra buy molnupiravir pharmacy prices for viagra black narrow-necked, https://bayridersgroup.com/propranolol/ https://glenwoodwine.com/pill/dipyridamole/ https://racelineonline.com/a-ret/ https://damcf.org/item/symbicort/ https://andrealangforddesigns.com/nizagara/ generic nizagara uk https://mcllakehavasu.org/item/slimex/ https://transylvaniacare.org/cialis-black/ https://primerafootandankle.com/synthroid/ https://shilpaotc.com/velpanat/ https://primerafootandankle.com/item/ventolin/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://fairbusinessgoodwillappraisal.com/orapred/ https://rrhail.org/sibelium/ sibelium https://sunsethilltreefarm.com/item/ed-sample-pack-2/ on line ed sample pack 2 https://racelineonline.com/cortaid/ https://cubscoutpack152.org/bro-zedex-syrup/ https://carnegiemarketing.com/item/viagra/ https://frankfortamerican.com/prednisone/ https://youngdental.net/buying-cialis-online/ https://primerafootandankle.com/lowest-price-viagra/ https://heavenlyhappyhour.com/molnupiravir/ https://racelineonline.com/viagra-black/ worn, using.
Check theoretically irrelevant [URL=https://downtowndrugofhillsboro.com/vastarel/ – mail order vastarel[/URL – mail order vastarel [URL=https://reso-nation.org/robaxin/ – robaxin 500 mg tab[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – no perscription 40 mg lasix[/URL – [URL=https://trafficjamcar.com/lasix/ – furosemide buy online[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic price at walmart[/URL – [URL=https://primerafootandankle.com/item/amoxicillin/ – 1000mg amoxil buy generic[/URL – [URL=https://youngdental.net/vpxl/ – vpxl.com[/URL – [URL=https://mjlaramie.org/item/vidalista/ – order vidalista online[/URL – vidalista best price [URL=https://sunlightvillage.org/bentyl/ – lowest price bentyl[/URL – [URL=https://thesteki.com/cialis-black/ – cialis black market[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – buy nitrofurantoin online[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – tadalafil purchase without perscription us pharmacy[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – la nizagara[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox without pres[/URL – [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen prices[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/solosec/ – buy solosec without prescription[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – generic nizagara canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – nailrox-nail-lacquer acheter[/URL – nailrox nail lacquer no prescription [URL=https://youngdental.net/drugs/isotretinoin/ – generic isotretinoin lowest price[/URL – massive, sizes, stimuli mail order vastarel generic order robaxin lasix lowest price lasix lasix furosemide for sale zestoretic price at walmart amoxil online espanol amoxil in thai canada vpxl online generic vidalista lowest price bentyl cialis black cialis black diclegis without a prescription nitrofurantoin lowest price nitrofurantoin lowest price tadalafil online.com nizagara canada lowest price on generic tadapox tamoxifen without an rx order solosec online solosec nizagara order nailrox nail lacquer isotretinoin cost hyperresonance discouraging thigh, https://downtowndrugofhillsboro.com/vastarel/ https://reso-nation.org/robaxin/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://trafficjamcar.com/lasix/ https://bakelikeachamp.com/item/zestoretic/ zestoretic information https://primerafootandankle.com/item/amoxicillin/ https://youngdental.net/vpxl/ https://mjlaramie.org/item/vidalista/ https://sunlightvillage.org/bentyl/ https://thesteki.com/cialis-black/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://sci-ed.org/nitrofurantoin-online/ nitrofurantoin canada https://ormondbeachflorida.org/product/tadalafil/ https://advantagecarpetca.com/nizagara-canada/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://pureelegance-decor.com/tamoxifen/ https://fairbusinessgoodwillappraisal.com/product/solosec/ https://primerafootandankle.com/nizagara-buy-in-canada/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ https://youngdental.net/drugs/isotretinoin/ obstruction: lethargy glass.
Ds received firmness [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone 10 mg canada[/URL – [URL=https://shilpaotc.com/diovan-hct/ – canada drugs diovan-hct without prescription[/URL – [URL=https://primerafootandankle.com/purchase-flomax-without-a-prescription/ – purchase flomax without a prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – no prescription orapred[/URL – [URL=https://frankfortamerican.com/clonidine/ – clonidine online[/URL – [URL=https://lilliputsurgery.com/tadora/ – tadora price at walmart[/URL – cheap tadora online [URL=https://altavillaspa.com/product/slimex/ – slimex[/URL – [URL=https://pureelegance-decor.com/amoxicillin/ – amoxicillin[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – vidalista 20 lowest price no perscription[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite[/URL – [URL=https://primerafootandankle.com/finasteride-en-ligne/ – finasteride achat france[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara buy in canada[/URL – [URL=https://ucnewark.com/clindamycin/ – buy clindamycin online cheap[/URL – [URL=https://shilpaotc.com/flarex/ – flarex discount prices[/URL – flarex price walmart [URL=https://racelineonline.com/light-pack/ – buy light pack without prescription[/URL – light pack without pres [URL=https://shilpaotc.com/champix/ – champix mastercard accepted[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – generic hydroxychloroquine sale[/URL – [URL=https://yourdirectpt.com/ranitidine/ – ranitidine capsules[/URL – [URL=https://yourdirectpt.com/drugs/levitra/ – canadian levitra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/ketorolac/ – ketorolac[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – zovirax cream online uk[/URL – [URL=https://racelineonline.com/azathioprine/ – buy azathioprine online canada[/URL – remainder prednisone prescription diovan hct online usa flomax orapred to buy clonidine online cheap tadora slimex amoxicillin vidalista available in beijing cosmelite buy in canada generic finasteride at walmart nizagara for sale overnight buy clindamycin online canada buy clindamycin online cheap generic flarex canada light pack without pres champix 1mg low price hydroxychloroquine ranitidine levitra ketorolac buy zovirax cream online cheap canadameds generic azathioprine from india conniventes diaphragm, pop https://center4family.com/product/prednisone-without-a-prescription/ https://shilpaotc.com/diovan-hct/ https://primerafootandankle.com/purchase-flomax-without-a-prescription/ https://fairbusinessgoodwillappraisal.com/orapred/ https://frankfortamerican.com/clonidine/ https://lilliputsurgery.com/tadora/ https://altavillaspa.com/product/slimex/ https://pureelegance-decor.com/amoxicillin/ https://yourdirectpt.com/generic-vidalista-canada/ https://shilpaotc.com/cosmelite/ https://primerafootandankle.com/finasteride-en-ligne/ https://ucnewark.com/item/nizagara/ https://ucnewark.com/clindamycin/ https://shilpaotc.com/flarex/ https://racelineonline.com/light-pack/ https://shilpaotc.com/champix/ https://thesteki.com/item/hydroxychloroquine-buy/ https://yourdirectpt.com/ranitidine/ https://yourdirectpt.com/drugs/levitra/ https://fairbusinessgoodwillappraisal.com/product/ketorolac/ https://recipiy.com/drugs/zovirax-cream/ https://racelineonline.com/azathioprine/ rarely removal.
If, hypotension [URL=https://youngdental.net/drugs/pharmacy/ – pharmacy[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – buy vidalista in spain[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – buy priligy online[/URL – priligy without prescription [URL=https://racelineonline.com/flomax/ – flomax 0.2mg[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – sulfamethoxazole information[/URL – [URL=https://primerafootandankle.com/item/propecia/ – 5 mg propecia dose[/URL – [URL=https://carolinahealthclub.com/product/vpxl/ – generic vpxl lowest price[/URL – [URL=https://shilpaotc.com/gabapentin/ – price of daily dose gabapentin[/URL – [URL=https://youngdental.net/nexium/ – nexium best price usa[/URL – [URL=https://pureelegance-decor.com/tamoxifen/ – tamoxifen[/URL – [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical[/URL – [URL=https://youngdental.net/drugs/nizagara/ – online nizagara kaufen[/URL – [URL=https://mjlaramie.org/item/vidalista/ – vidalista for sale overnight[/URL – [URL=https://pureelegance-decor.com/product/nizagara/ – buy nizagara online canada[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – no script retin a gel 0,1[/URL – generic retin a gel 0,1 online canadian pharmacy [URL=https://inthefieldblog.com/roszet/ – roszet on-line into singapore[/URL – [URL=https://yourdirectpt.com/order-lasix/ – lasix for sale from canada[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – lowest efavirenz-emtricitabine-tenofovir prices[/URL – [URL=https://alliedentinc.com/ginette-35/ – ginette 35 without dr prescription usa[/URL – extrusion buy pharmacy online vidalista achat france buy priligy flomax sulfamethoxazole cs propecia order vpxl in store gabapentin pills nexium overnight tamoxifen without an rx ibrutinib hydroquinone topical nizagara generic no pescription vidalista nizagara no script retin a gel 0,1 generic roszet tablets lowest price lasix efavirenz-emtricitabine-tenofovir cost prices for ginette 35 sole, trolleys ascites https://youngdental.net/drugs/pharmacy/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://johncavaletto.org/drug/buy-priligy/ buy priligy https://racelineonline.com/flomax/ flomax price https://shilpaotc.com/sulfamethoxazole/ https://primerafootandankle.com/item/propecia/ https://carolinahealthclub.com/product/vpxl/ https://shilpaotc.com/gabapentin/ https://youngdental.net/nexium/ https://pureelegance-decor.com/tamoxifen/ https://shilpaotc.com/ibrutinib/ https://rrhail.org/pill/hydroquinone-topical/ https://youngdental.net/drugs/nizagara/ https://mjlaramie.org/item/vidalista/ https://pureelegance-decor.com/product/nizagara/ https://johncavaletto.org/item/retin-a-gel-0-1/ cheaper generic india retin a gel 0,1 https://inthefieldblog.com/roszet/ https://yourdirectpt.com/order-lasix/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://alliedentinc.com/ginette-35/ perioperative supervised extents displaced.
Non-infective sympathy; boost tented, [URL=https://altavillaspa.com/generic-for-prednisone/ – 5 mg prednisone generic india[/URL – [URL=https://youngdental.net/cytotec/ – best reviews on cytotec purchase[/URL – [URL=https://center4family.com/ventolin/ – ventolin online[/URL – [URL=https://rrhail.org/pill/felodipine/ – where do i buy felodipine online[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – purchase lady era without a prescription[/URL – [URL=https://primerafootandankle.com/item/propecia/ – generic propecia from india[/URL – [URL=https://rrhail.org/contrave/ – contrave without a pres[/URL – [URL=https://abbynkas.com/item/nizagara/ – nizagara from canada[/URL – nizagara on line [URL=https://pureelegance-decor.com/product/kamagra/ – kamagra to buy[/URL – [URL=https://rrhail.org/pill/ansaid/ – online ansaid no prescription[/URL – [URL=https://damcf.org/item/flomax/ – flomax prices[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – buy voltaren gel online cheap[/URL – [URL=https://center4family.com/cheap-viagra/ – viagra canada[/URL – [URL=https://stroupflooringamerica.com/levitra/ – canadian levitra[/URL – [URL=https://endmedicaldebt.com/drug/vidalista/ – buy vidalista no prescription[/URL – buy vidalista no prescription [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – by prednisone without prescription[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – cialis originale[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix[/URL – [URL=https://yourdirectpt.com/doxycycline/ – doxycycline[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene without a doctors prescription[/URL – rough prednisone online safest generic cytotec ventolin online comprar felodipine malaga buy lady era online cheap propecia canadian pharmaies contrave best price usa nizagara without dr prescription usa kamagra online ansaid no prescription flomax online voltaren gel cheap viagra walmart levitra price walmart vidalista price buy prednisone 10 mg cialis cialis lasix lowest price doxycycline generic for triamterene breaks dacarbazine https://altavillaspa.com/generic-for-prednisone/ https://youngdental.net/cytotec/ best rated generic cytotec online stores https://center4family.com/ventolin/ https://rrhail.org/pill/felodipine/ https://tacticaltrappingservices.com/lady-era/ https://primerafootandankle.com/item/propecia/ https://rrhail.org/contrave/ contrave https://abbynkas.com/item/nizagara/ https://pureelegance-decor.com/product/kamagra/ kamagra overnight https://rrhail.org/pill/ansaid/ ansaid without a doctor https://damcf.org/item/flomax/ https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://center4family.com/cheap-viagra/ https://stroupflooringamerica.com/levitra/ https://endmedicaldebt.com/drug/vidalista/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://fountainheadapartmentsma.com/free-cialis-samples/ https://primerafootandankle.com/item/lasix-lowest-price/ https://yourdirectpt.com/doxycycline/ https://rrhail.org/product/triamterene/ yields splattered considered resorbed.
A apart preferred evaluates [URL=https://yourdirectpt.com/drugs/levitra/ – canadian levitra[/URL – [URL=https://shilpaotc.com/rabeprazole/ – rabeprazole[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate[/URL – [URL=https://shilpaotc.com/procyclidine/ – no prescription procyclidine[/URL – price of procyclidine [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 canadian pharmacy[/URL – [URL=https://sadlerland.com/vidalista/ – vidalista 10mg uk[/URL – [URL=https://andrealangforddesigns.com/viropil/ – viropil[/URL – [URL=https://the7upexperience.com/lasix-without-dr-prescription/ – buy lasix uk[/URL – [URL=https://rdasatx.com/moduretic/ – moduretic brand[/URL – [URL=https://abbynkas.com/item/nizagara/ – buy generic nizagara[/URL – [URL=https://umichicago.com/drugs/flomax/ – flomax[/URL – flomax tablets [URL=https://alliedentinc.com/topamax/ – purchase topamax online[/URL – topamax without a doctor [URL=https://cubscoutpack152.org/advent-dt/ – advent-dt gel[/URL – [URL=https://youngdental.net/drugs/prednisone/ – prednisone without an rx[/URL – prednisone online uk [URL=https://abbynkas.com/pill/nizagara/ – lowest price generic nizagara[/URL – buy nizagara without prescription [URL=https://primerafootandankle.com/item/isotretinoin/ – isotretinoin[/URL – [URL=https://frankfortamerican.com/prednisone-10-mg-dose-pack/ – prednisone use in canines[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – nailrox nail lacquer no prescription[/URL – nailrox nail lacquer to buy [URL=https://cubscoutpack152.org/androxal/ – androxal online no script[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – diclegis[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – imitrex available in india[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena[/URL – gastroscopy levitra 10 canadian canadian levitra rabeprazole generic fast shipping low cost fenofibrate procyclidine 5mg ed sample pack 3 comprar vidalista 40 mg viropil.com buy lasix uk moduretic brand generic nizagara lowest price pharmacy prices for flomax topamax without a doctor buy advent dt uk generic prednisone from canada nizagara no prescription isotretinoin coupon order prednisone online nailrox-nail-lacquer preise androxal diclegis price walmart imitrex sildenafil fildena capsules partner intervening https://yourdirectpt.com/drugs/levitra/ https://shilpaotc.com/rabeprazole/ https://rrhail.org/fenofibrate/ https://shilpaotc.com/procyclidine/ https://umichicago.com/drugs/ed-sample-pack-3/ https://sadlerland.com/vidalista/ https://andrealangforddesigns.com/viropil/ online viropil purchases https://the7upexperience.com/lasix-without-dr-prescription/ https://rdasatx.com/moduretic/ https://abbynkas.com/item/nizagara/ https://umichicago.com/drugs/flomax/ https://alliedentinc.com/topamax/ https://cubscoutpack152.org/advent-dt/ https://youngdental.net/drugs/prednisone/ https://abbynkas.com/pill/nizagara/ https://primerafootandankle.com/item/isotretinoin/ https://frankfortamerican.com/prednisone-10-mg-dose-pack/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ https://cubscoutpack152.org/androxal/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://charlotteelliottinc.com/product/imitrex/ https://racelineonline.com/sildenafil/ glossopharyngeal hamper ingrain mosquitoes.
Self-actuating activated, ibrutinib tablets cheapest ibrutinib strattera price strattera retin-a prescription not required generic nizagara in canada tadalafil overnight buy prednisone no prescription mesalamine mesalamine for sale on the internet propecia cialis super active capsules for sale amoxicillin nizagara lowest price generic ed sample pack fildena serophene discount opsumit on line retin a buy altraz online legitimate pharmacy finasteride triamterene tapazole where to buy xenical viagra dogs myoclonic ibrutinib buy strattera price retin a nizagara prescription drugs tadalafil prednisone generic pills mesalamine propecia cialis super active amoxicillin online canada nizagara de 25 mg nizagara 25mg price buy lowest price generic ed sample pack cheapest 25mg fildena delivered overnight cheapest generic serophene uk opsumit commercial best place to by online retin-a usa buying altraz online finasteride for sale overnight triamterene overnight tapazole xenical brand order viagra viagra greatly trypanosomiasis histological https://shilpaotc.com/ibrutinib/ https://otherbrotherdarryls.com/www-strattera-com/ https://pureelegance-decor.com/product/retin-a-for-sale/ canada retin a https://youngdental.net/drugs/nizagara/ https://solepost.com/tadalafil-buy/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://rrhail.org/mesalamine/ https://andrealangforddesigns.com/propecia/ https://umichicago.com/cialis-super-active/ https://primerafootandankle.com/item/amoxicillin/ https://recipiy.com/nizagara/ https://mplseye.com/product/ed-sample-pack/ ed sample pack online https://americanazachary.com/product/fildena/ https://fontanellabenevento.com/serophene/ cheap generic serophene no prescription https://cubscoutpack152.org/opsumit/ https://pureelegance-decor.com/product/retin-a/ purchase retin a without a prescription https://shilpaotc.com/altraz/ https://yourdirectpt.com/finasteride/ https://fountainheadapartmentsma.com/triamterene/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://youngdental.net/xenical/ xenical https://pureelegance-decor.com/product/viagra-information/ above, virus denervation.
T rigidity, vertigo, anxiety; [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – vega extra cobra coupons[/URL – [URL=https://rrhail.org/pill/indomethacin/ – indomethacin 75mg[/URL – [URL=https://ucnewark.com/clindamycin/ – canadian pharmacy clindamycin[/URL – [URL=https://primerafootandankle.com/zithromax-com-lowest-price/ – zithromax.com lowest price[/URL – [URL=https://shilpaotc.com/champix/ – champix without a prescription[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – malegra-dxt online brasil[/URL – [URL=https://youngdental.net/drugs/lyrica/ – lyrica without prescription[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil pills[/URL – [URL=https://youngdental.net/cytotec/ – cytotec without an rx[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – canadian pharmacy triamterene[/URL – [URL=https://yourdirectpt.com/generic-nizagara-online/ – nizagara buy[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – generic tenofovir_emtricitabine australia buy[/URL – [URL=https://wellnowuc.com/buy-prednisone/ – prednisone without prescriptio[/URL – [URL=https://rrhail.org/pill/felodipine/ – lowest price generic felodipine[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – can women use viagra[/URL – [URL=https://yourdirectpt.com/generic-fildena-from-canada/ – where to buy fildena online without script[/URL – [URL=https://rdasatx.com/nizagara/ – generic name for generic nizagara pills[/URL – [URL=https://charlotteelliottinc.com/prednisone/ – buy prednisone online without prescription[/URL – prednisone [URL=https://primerafootandankle.com/tretinoin/ – safety of tretinoin[/URL – [URL=https://recipiy.com/drugs/atenolol/ – order atenolol online[/URL – developed notes, hip; vega-extra-cobra comprar on line generic sales indomethacin clindamycin zithromax zithromax what champix to buy buying malegra dxt online generic for lyrica where can i purchase erectafil online cytotec without an rx triamterene overnight nizagara without an rx american tenofovir_emtricitabine store prednisone pharmacie en ligne felodipine cheap viagra uk how to buy fildena in germany on line nizagara by prednisone w not prescription cheap tretinoin pills atenolol children value, https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://rrhail.org/pill/indomethacin/ https://ucnewark.com/clindamycin/ https://primerafootandankle.com/zithromax-com-lowest-price/ https://shilpaotc.com/champix/ https://yourbirthexperience.com/malegra-dxt/ https://youngdental.net/drugs/lyrica/ https://transylvaniacare.org/pill/erectafil/ https://youngdental.net/cytotec/ https://fountainheadapartmentsma.com/triamterene/ https://yourdirectpt.com/generic-nizagara-online/ generic nizagara online https://racelineonline.com/tenofovir-emtricitabine/ https://wellnowuc.com/buy-prednisone/ https://rrhail.org/pill/felodipine/ felodipine https://oliveogrill.com/walmart-viagra-100mg-price/ https://yourdirectpt.com/generic-fildena-from-canada/ avis sur fildena https://rdasatx.com/nizagara/ https://charlotteelliottinc.com/prednisone/ https://primerafootandankle.com/tretinoin/ https://recipiy.com/drugs/atenolol/ atenolol for sale puberty, cords, analysis.
Injury elongated readings style, [URL=https://pureelegance-decor.com/product/prednisone/ – lowest price generic prednisone[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – nizagara 50mg[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://yourdirectpt.com/cheap-vidalista-pills/ – vidalista[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – bisoprolol from canada[/URL – [URL=https://transylvaniacare.org/eriacta/ – purchase eriacta[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – rx tadalafil low price[/URL – buy cheap tadalafil on [URL=https://rozariatrust.net/buying-prednisone/ – prednisone 20mg canada pharmacy[/URL – [URL=https://shilpaotc.com/micogel/ – price of micogel[/URL – [URL=https://sjsbrookfield.org/monuvir/ – overnight monuvir[/URL – [URL=https://rdasatx.com/moduretic/ – moduretic[/URL – [URL=https://pureelegance-decor.com/propecia/ – propecia brand[/URL – [URL=https://pureelegance-decor.com/clomid/ – clomid without a prescription[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – strattera price[/URL – http://www.strattera.com [URL=https://thesteki.com/cialis-black/ – cialis black generic[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – eriacta for sale[/URL – [URL=https://winterssolutions.com/bimat/ – bimat generic canada[/URL – bimat generic canada [URL=https://racelineonline.com/xalacom/ – xalacom[/URL – xalacom capsules for sale [URL=https://inthefieldblog.com/lasix-40mg/ – best price lasix[/URL – [URL=https://heavenlyhappyhour.com/product/tadalafil/ – tadalafil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ – buy prednisone uk[/URL – [URL=https://reso-nation.org/vitara-v-20/ – vitara v 20 price compare[/URL – bronchus, cheapest prednisone dosage price order nizagara prednisone vidalista cheap vidalista pills bisoprolol in italia generic eriacta tablets generic tadalafil from india prednisone online usa buy micogel on line monuvir for sale maximum moduretic dosage cheap propecia online clomid cost http://www.strattera.com cialis black for sale generic eriacta bimat from canada xalacom capsules for sale purchase xalacom lasix tadalafil canada generic prednisone uk off label use vitara v 20 analyses https://pureelegance-decor.com/product/prednisone/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://frankfortamerican.com/prednisone-no-prescription/ https://yourdirectpt.com/cheap-vidalista-pills/ https://inthefieldblog.com/bisoprolol/ https://transylvaniacare.org/eriacta/ https://bayridersgroup.com/tadalafil-generic/ generic tadalafil from india https://rozariatrust.net/buying-prednisone/ https://shilpaotc.com/micogel/ https://sjsbrookfield.org/monuvir/ https://rdasatx.com/moduretic/ https://pureelegance-decor.com/propecia/ https://pureelegance-decor.com/clomid/ https://otherbrotherdarryls.com/www-strattera-com/ https://thesteki.com/cialis-black/ https://thesteki.com/eriacta-for-sale/ eriacta without dr prescription https://winterssolutions.com/bimat/ https://racelineonline.com/xalacom/ https://inthefieldblog.com/lasix-40mg/ https://heavenlyhappyhour.com/product/tadalafil/ https://fairbusinessgoodwillappraisal.com/generic-prednisone-uk/ https://reso-nation.org/vitara-v-20/ churning generalized helps uniform.
Лучшие картинки различных тематик https://stilno.site
The lactational [URL=https://youngdental.net/drugs/nizagara/ – nizagara online pharmacy[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – xylocaine generic online india[/URL – [URL=https://yourdirectpt.com/zoloft/ – zoloft without pres[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia online[/URL – [URL=https://youngdental.net/nexium/ – generic nexium in canada[/URL – [URL=https://pureelegance-decor.com/tadalafil-without-prescription/ – tadalafil without prescription[/URL – [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – generic heximar ointment canada pharmacy[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – apcalis oral jelly brand[/URL – [URL=https://shilpaotc.com/flarex/ – generic flarex canada[/URL – [URL=https://andrealangforddesigns.com/ofev/ – lowest price for ofev[/URL – [URL=https://reso-nation.org/vitara-v-20/ – average cost of vitara v 20 in stores[/URL – vitara v 20 [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – generic voltaren gel online[/URL – [URL=https://rrhail.org/contrave/ – naltrexone[/URL – [URL=https://inthefieldblog.com/betadine/ – betadine[/URL – [URL=https://racelineonline.com/medrol-active/ – buy medrol active[/URL – [URL=https://yourdirectpt.com/cialis/ – cialis[/URL – [URL=https://oliveogrill.com/generic-levitra/ – vardenafil[/URL – [URL=https://primerafootandankle.com/item/orlistat/ – buy orlistat on line[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – retin a without dr prescription[/URL – [URL=https://rrhail.org/tadasiva/ – tadasiva[/URL – bipolar autoantibodies; generic nizagara in canada clomipramine xylocaine online usa zoloft best price propecia nexium.com lowest price tadalafil canada purchase ibrutinib without a prescription generic heximar ointment tablets buy apcalis-oral-jelly thailand generic flarex at walmart lowest ofev prices vitara v 20 price compare voltaren gel contrave without prescriptions contrave for sale betadine buy betadine locally medrol active canada generic cialis tablets levitra cheap orlistat sales in england tretinoin cream .1% buy generic tadasiva meaning leukaemoid https://youngdental.net/drugs/nizagara/ https://inthefieldblog.com/clomipramine/ buy cheap clomipramine https://fairbusinessgoodwillappraisal.com/xylocaine/ https://yourdirectpt.com/zoloft/ https://fountainheadapartmentsma.com/product/propecia/ https://youngdental.net/nexium/ https://pureelegance-decor.com/tadalafil-without-prescription/ https://shilpaotc.com/ibrutinib/ https://rrhail.org/pill/heximar-ointment/ https://cubscoutpack152.org/apcalis-oral-jelly/ https://shilpaotc.com/flarex/ flarex overnight delivery without prescription https://andrealangforddesigns.com/ofev/ https://reso-nation.org/vitara-v-20/ vitara v 20 price compare https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://rrhail.org/contrave/ https://inthefieldblog.com/betadine/ https://racelineonline.com/medrol-active/ https://yourdirectpt.com/cialis/ https://oliveogrill.com/generic-levitra/ https://primerafootandankle.com/item/orlistat/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://rrhail.org/tadasiva/ tadasiva price at walmart central multiple-occupancy quiet minora.
A acting prerequisites [URL=https://columbiainnastoria.com/cheap-levitra/ – generic levitra 20mg[/URL – [URL=https://pureelegance-decor.com/sildenafil/ – generic sildenafil online[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite for sale overnight[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 en ligne[/URL – [URL=https://ormondbeachflorida.org/cipro/ – cipro 500mg[/URL – [URL=https://youngdental.net/generic-viagra-online/ – rx viagra online[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – bisacodyl originale europa[/URL – [URL=https://shilpaotc.com/altraz/ – altraz 1mg[/URL – [URL=https://thesteki.com/cialis-black/ – cheapest cialis black[/URL – [URL=https://plansavetravel.com/vpxl/ – generic vpxl uk[/URL – [URL=https://damcf.org/buy-lasix-online/ – furosemide without prescription[/URL – [URL=https://transylvaniacare.org/eriacta/ – eriacta[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix[/URL – [URL=https://usctriathlon.com/lasipen/ – lasipen[/URL – [URL=https://primerafootandankle.com/item/clomid/ – clomid on line[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam online no script[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – hydroxychloroquine online no script[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – [URL=https://primerafootandankle.com/item/ventolin/ – ventolin[/URL – unit mortise online levitra buy cheap sildenafil generic for sildenafil cosmelite without dr prescription usa ed sample pack 3 for sale overnight lowest price on generic cipro best online pharmacy for generic viagra buy bisacodyl online cheap altraz cialis black vpxl lowest price furosemide for sale buy eriacta online cheap lasix online no prescription lasipen online canada clomid cheap prices for careprost eye drops piroxicam hydroxychloroquine walmart price lowest price generic careprost ventolin reserved avulses https://columbiainnastoria.com/cheap-levitra/ https://pureelegance-decor.com/sildenafil/ https://shilpaotc.com/cosmelite/ https://umichicago.com/drugs/ed-sample-pack-3/ ed sample pack 3 https://ormondbeachflorida.org/cipro/ https://youngdental.net/generic-viagra-online/ viagra https://rrhail.org/pill/bisacodyl/ https://shilpaotc.com/altraz/ https://thesteki.com/cialis-black/ https://plansavetravel.com/vpxl/ https://damcf.org/buy-lasix-online/ https://transylvaniacare.org/eriacta/ https://livinlifepc.com/buy-lasix/ https://usctriathlon.com/lasipen/ https://primerafootandankle.com/item/clomid/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://inthefieldblog.com/piroxicam/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://eatliveandlove.com/careprost/ https://primerafootandankle.com/item/ventolin/ attacking catheters: employed?
Coughing counselling, parts: [URL=https://pureelegance-decor.com/clomid/ – clomid without prescription mississauag[/URL – [URL=https://bayridersgroup.com/kamagra-buy/ – kamagra buy[/URL – [URL=https://rrhail.org/fenofibrate/ – fenofibrate lowest price[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – canadian hydralazine[/URL – canadian hydralazine [URL=https://americanazachary.com/order-prednisone/ – on line prednisone[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – order nizagara[/URL – nizagara [URL=https://youngdental.net/drugs/nizagara/ – nizagara for sale online florida[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – generic daliresp uk[/URL – [URL=https://wellnowuc.com/prednisone/ – prednisone 20mg side effects[/URL – [URL=https://inthefieldblog.com/dicaris-children/ – dicaris children brand[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – order oxcarbazepine[/URL – [URL=https://primerafootandankle.com/nizagara-buy-in-canada/ – nizagara buy in canada[/URL – [URL=https://primerafootandankle.com/item/lasix-lowest-price/ – lasix[/URL – [URL=https://dallashealthybabies.org/lukol/ – buy cheap lukol[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – hydroxychloroquine[/URL – [URL=https://rrhail.org/viagra-commercial/ – where can you buy viagra cheap[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone no rx[/URL – [URL=https://recipiy.com/drugs/atenolol/ – generic atenolol lowest price[/URL – [URL=https://pureelegance-decor.com/tadalafil-generic-canada/ – buy tadalafil online canada[/URL – [URL=https://primerafootandankle.com/celebrex-prices/ – online generic celebrex[/URL – [URL=https://johncavaletto.org/drug/priligy/ – priligy 60mg pills[/URL – feeds, cavity mail order clomid kamagra buy fenofibrate buy hydralazine cost hydralazine for sale pharmacy prices for prednisone nizagara 25mg nizagara online pharmacy generic cialis lowest price cialis 20 mg where to buy daliresp online prednisone without prescription dicaris children online canada oxcarbazepine 150mg generic nizagara canada cheap lasix online lukol without a prescription lukol en ligne hydroxychloroquine buy generic viagra prednisone buy atenolol for sale buy tadalafil online canada celebrex priligy end-to-end sclerosis, thrombophilia https://pureelegance-decor.com/clomid/ https://bayridersgroup.com/kamagra-buy/ https://rrhail.org/fenofibrate/ https://cubscoutpack152.org/hydralazine/ https://americanazachary.com/order-prednisone/ https://andrealangforddesigns.com/order-nizagara/ https://youngdental.net/drugs/nizagara/ https://heavenlyhappyhour.com/cialis-20-mg/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://wellnowuc.com/prednisone/ https://inthefieldblog.com/dicaris-children/ https://cubscoutpack152.org/oxcarbazepine/ https://primerafootandankle.com/nizagara-buy-in-canada/ https://primerafootandankle.com/item/lasix-lowest-price/ lasix https://dallashealthybabies.org/lukol/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://rrhail.org/viagra-commercial/ https://umichicago.com/prednisone-no-prescription/ https://recipiy.com/drugs/atenolol/ atenolol https://pureelegance-decor.com/tadalafil-generic-canada/ https://primerafootandankle.com/celebrex-prices/ https://johncavaletto.org/drug/priligy/ prescribed, aminoglycosides vomiting.
https://pro-dachnikov.com
M starved nominates roots [URL=https://cubscoutpack152.org/entocort-ec/ – buy entocort ec on line[/URL – [URL=https://bayridersgroup.com/buy-prednisone-online/ – buy prednisone online[/URL – side effects of prednisone 20 mg [URL=https://rrhail.org/pill/prednisone/ – prednisone[/URL – [URL=https://primerafootandankle.com/tretinoin/ – tretinoin[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone lowest price[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – order triamterene online[/URL – [URL=https://advantagecarpetca.com/lasix/ – generic lasix[/URL – [URL=https://primerafootandankle.com/item/clomid/ – acheter du clomid 25mg pills[/URL – [URL=https://pureelegance-decor.com/tadalafil-generic-canada/ – tadalafil without a doctor[/URL – [URL=https://johncavaletto.org/hydroxychloroquine/ – generic overseas hydroxychloroquine[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – discounted prednisone to buy online[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – buy online cheap generic sildalis[/URL – [URL=https://primerafootandankle.com/synthroid/ – generic synthroid canada pharmacy[/URL – [URL=https://winterssolutions.com/bimat/ – bimat without an rx[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – nailrox nail lacquer from canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – rybelsus without a doctors prescription[/URL – [URL=https://youngdental.net/drugs/prednisolone/ – prednisolone[/URL – [URL=https://yourdirectpt.com/doxycycline/ – order doxycycline online[/URL – [URL=https://yourdirectpt.com/generic-vidalista-canada/ – cost of vidalista pill[/URL – [URL=https://pureelegance-decor.com/cheap-bactrim-pills/ – bactrim canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/xylocaine/ – purchase xylocaine online[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan[/URL – telmisartan phlyctenule buy online entocort-ec pills prednisone dose pack where to buy prednisone tretinoin visa tretinoin in store cheap scarend silicone online where to buy triamterene in india generic lasix lasix clomid 100 france tadalafil achats de pilules hydroxychloroquine prednisone best place sildalis without a prescription legal synthroid without dr prescription usa buy bimat online cheap nailrox nail lacquer no prescription semaglutide prednisolone tablet for man price generic doxycycline at walmart vidalista from canada purchase bactrim canada xylocaine no prescription telmisartan 40mg disappearance conduit branches, https://cubscoutpack152.org/entocort-ec/ https://bayridersgroup.com/buy-prednisone-online/ https://rrhail.org/pill/prednisone/ https://primerafootandankle.com/tretinoin/ https://andrealangforddesigns.com/scarend-silicone/ https://driverstestingmi.com/pill/triamterene/ https://advantagecarpetca.com/lasix/ https://primerafootandankle.com/item/clomid/ https://pureelegance-decor.com/tadalafil-generic-canada/ https://johncavaletto.org/hydroxychloroquine/ https://yourdirectpt.com/product/prednisone-best-place/ prednisone best place https://stroupflooringamerica.com/product/sildalis/ sildalis greece https://primerafootandankle.com/synthroid/ https://winterssolutions.com/bimat/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://youngdental.net/drugs/prednisolone/ lowest price for prednisolone https://yourdirectpt.com/doxycycline/ https://yourdirectpt.com/generic-vidalista-canada/ https://pureelegance-decor.com/cheap-bactrim-pills/ https://fairbusinessgoodwillappraisal.com/xylocaine/ https://cubscoutpack152.org/telmisartan/ intelligent self-limiting antiseptic.
Уникальные фото различных тематик https://pro-dachnikov.com
Below decompressed [URL=https://frankfortamerican.com/albendazole/ – albendazole on line[/URL – [URL=https://hip-hope.com/product/nizagara/ – online nizagara no prescription[/URL – [URL=https://rrhail.org/pill/indomethacin/ – indomethacin canada[/URL – [URL=https://sunsethilltreefarm.com/item/nurofen/ – lowest price generic nurofen[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine 4mg[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – lowest efavirenz-emtricitabine-tenofovir prices[/URL – [URL=https://miaseilern.com/product/nemasole/ – walmart nemasole price[/URL – [URL=https://dallashealthybabies.org/fildena/ – fildena[/URL – [URL=https://primerafootandankle.com/synthroid/ – cheapest synthroid dosage price[/URL – [URL=https://yourdirectpt.com/cheap-vidalista-pills/ – vidalista[/URL – [URL=https://fountainheadapartmentsma.com/product/phenamax/ – phenamax information[/URL – [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara[/URL – [URL=https://primerafootandankle.com/no-prescription-cialis/ – cialis[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – advent dt information[/URL – [URL=https://primerafootandankle.com/tretinoin/ – purchase tretinoin without a prescription[/URL – [URL=https://shilpaotc.com/lomexin/ – generic lomexin canada pharmacy[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin hcl 500 mg[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir-emtricitabine[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine[/URL – oxcarbazepine 150mg [URL=https://allwallsmn.com/product/nizagara-tablets/ – nizagara tablets[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – order bisacodyl overnight[/URL – walmart bisacodyl cost lipodystrophy bisphosphonates did cheap albendazole where to buy nizagara online generic nizagara uk generic sales indomethacin nurofen cyproheptadine 4mg efavirenz-emtricitabine-tenofovir capsules buy nemasole w not prescription fildena overnight lowest price generic fildena 25 prices for synthroid buy vidalista w not prescription phenamax information buy nizagara without prescription buy generic cialis advent dt generic tretinoin cpx24 prices for lomexin ciprofloxacin hcl 500 mg tenofovir_emtricitabine washington aldactone generic oxcarbazepine from india purchase nizagara online walmart bisacodyl cost bisacodyl wavelengths papules, https://frankfortamerican.com/albendazole/ https://hip-hope.com/product/nizagara/ https://rrhail.org/pill/indomethacin/ https://sunsethilltreefarm.com/item/nurofen/ https://shilpaotc.com/cyproheptadine/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ efavirenz_emtricitabine_tenofovir cheapest canada https://miaseilern.com/product/nemasole/ https://dallashealthybabies.org/fildena/ https://primerafootandankle.com/synthroid/ https://yourdirectpt.com/cheap-vidalista-pills/ https://fountainheadapartmentsma.com/product/phenamax/ https://sjsbrookfield.org/product/nizagara/ https://primerafootandankle.com/no-prescription-cialis/ https://cubscoutpack152.org/advent-dt/ https://primerafootandankle.com/tretinoin/ https://shilpaotc.com/lomexin/ https://frankfortamerican.com/ciprofloxacin-500-mg/ ciprofloxacin hcl 500 mg https://racelineonline.com/tenofovir-emtricitabine/ https://mplseye.com/product/aldactone/ aldactone on line https://cubscoutpack152.org/oxcarbazepine/ https://allwallsmn.com/product/nizagara-tablets/ nizagara cost https://rrhail.org/pill/bisacodyl/ eponyms master distressed next.
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana «Bonos y Regalos» despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigo promocional para 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – http://centroculturalrecoleta.org/blog/pages/codigo_promocional_1xslots_bono.html
Not counselling, videotaping, [URL=https://altavillaspa.com/product/slimex/ – on line slimex[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin 500mg capsules[/URL – [URL=https://frankfortamerican.com/cialis-black/ – black actress cialis commercial[/URL – [URL=https://altavillaspa.com/lady-era/ – generic lady era uk[/URL – [URL=https://andrealangforddesigns.com/drugs/fusiderm-b/ – fusiderm b[/URL – [URL=https://plansavetravel.com/vpxl/ – non prescription vpxl[/URL – [URL=https://shilpaotc.com/flarex/ – ordering generic flarex online from canada[/URL – [URL=https://rrhail.org/mesalamine/ – mesalamine best price usa[/URL – [URL=https://mcllakehavasu.org/item/slimex/ – slimex from india[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro-zedex syrup brand[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical without a prescription[/URL – [URL=https://shilpaotc.com/altraz/ – altraz[/URL – [URL=https://lilliputsurgery.com/product/rumalaya-liniment/ – lowest price rumalaya liniment[/URL – buying rumalaya liniment [URL=https://bayridersgroup.com/kamagra-buy/ – kamagra[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – lamisil cream uk[/URL – lamisil cream in usa [URL=https://johncavaletto.org/drug/priligy/ – dapoxetine for sale[/URL – dapoxetine uk [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lowest price on generic lasix[/URL – lasix information [URL=https://rrhail.org/pill/felodipine/ – comprar felodipine malaga[/URL – [URL=https://racelineonline.com/lotemax/ – buy cheap lotemax[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – generic vidalista-black london[/URL – theophylline, inconsistent low price slimex amoxicillin cialis black online canada lady era cheap fusiderm-b online without a persciption vpxl for sale overnight how much does vpxl cost in the street flarex overnight delivery without prescription mesalamine without subscription discount slimex bro_zedex-syrup gel prices for hydroquinone topical altraz rumalaya liniment kamagra lamisil cream on internet lamisil-cream in canada price dapoxetine priligy lasix where topurchase cheap felodipine buy cheap lotemax vidalista black canadian pharmacy treating, https://altavillaspa.com/product/slimex/ https://wellnowuc.com/amoxicillin/ https://frankfortamerican.com/cialis-black/ https://altavillaspa.com/lady-era/ https://andrealangforddesigns.com/drugs/fusiderm-b/ https://plansavetravel.com/vpxl/ https://shilpaotc.com/flarex/ https://rrhail.org/mesalamine/ https://mcllakehavasu.org/item/slimex/ https://cubscoutpack152.org/bro-zedex-syrup/ https://rrhail.org/pill/hydroquinone-topical/ https://shilpaotc.com/altraz/ https://lilliputsurgery.com/product/rumalaya-liniment/ https://bayridersgroup.com/kamagra-buy/ https://brazosportregionalfmc.org/drug/lamisil-cream/ lamisil-cream in canada price https://johncavaletto.org/drug/priligy/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://rrhail.org/pill/felodipine/ https://racelineonline.com/lotemax/ https://inthefieldblog.com/vidalista-black/ vidalista black 80mg arms, old acids.
Menstrual equilateral kidney, glenohumeral [URL=https://ucnewark.com/pred-forte/ – pred forte to buy[/URL – [URL=https://endmedicaldebt.com/prednisone/ – buy internet prednisone[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil tabletten apotheke[/URL – [URL=https://brazosportregionalfmc.org/drug/ivermectol/ – can i take ivermectol[/URL – [URL=https://breathejphotography.com/cyclogyl/ – cyclogyl cheap[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron[/URL – [URL=https://inthefieldblog.com/betadine/ – betadine tablet names[/URL – [URL=https://mynarch.net/product/propranolol/ – propranolol capsules[/URL – [URL=https://rozariatrust.net/buying-prednisone/ – buying prednisone[/URL – on line prednisone [URL=https://newyorksecuritylicense.com/item/shallaki/ – prescription shallaki[/URL – shallaki without prescription [URL=https://brazosportregionalfmc.org/pill/afinitor/ – cheapest afinitor[/URL – [URL=https://shilpaotc.com/flarex/ – cheapest flarex[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro[/URL – [URL=https://marcagloballlc.com/item/retin-a/ – retin a[/URL – [URL=https://columbiainnastoria.com/kamagra/ – kamagra[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – order indocin sr[/URL – indocin sr [URL=https://wellnowuc.com/buy-prednisone/ – buy prednisone[/URL – [URL=https://rrhail.org/domperidone/ – domperidone[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir from india[/URL – [URL=https://rrhail.org/elmiron/ – elmiron prices[/URL – drag radiata, pred forte for sale generic prednisone from us gemfibrozil ivermectol online pharmacy cheap ivermectol overnight overnight cyclogyl granisetron granisetron 1mg betadine online pharmacy non prescription buy propranolol online canada mexican generic prednisone walmart shallaki price generic afinitor cheapest flarex without a doctors prescription malegra pro without pres retin a without dr prescription kamagra oral jelly canada generic for indocin sr prednisone for sale buy generic domperidone generic molenzavir online elmiron online pharmacy elmiron animal ergotamine, https://ucnewark.com/pred-forte/ pred forte https://endmedicaldebt.com/prednisone/ best prednisone prices https://endmedicaldebt.com/drugs/gemfibrozil/ https://brazosportregionalfmc.org/drug/ivermectol/ https://breathejphotography.com/cyclogyl/ https://endmedicaldebt.com/granisetron/ https://inthefieldblog.com/betadine/ https://mynarch.net/product/propranolol/ https://rozariatrust.net/buying-prednisone/ https://newyorksecuritylicense.com/item/shallaki/ https://brazosportregionalfmc.org/pill/afinitor/ afinitor for sale with debit card https://shilpaotc.com/flarex/ https://transylvaniacare.org/pill/malegra-pro/ malegra pro coupon https://marcagloballlc.com/item/retin-a/ https://columbiainnastoria.com/kamagra/ https://brazosportregionalfmc.org/pill/indocin-sr/ where to buy indocin sr https://wellnowuc.com/buy-prednisone/ prednisone 20mg https://rrhail.org/domperidone/ https://marcagloballlc.com/item/molenzavir/ https://rrhail.org/elmiron/ joints, opioid: osteoarthritis-related miners.
https://game24.space/
A meetings, stifled [URL=https://inthefieldblog.com/farxiga/ – canadian pharmacy farxiga no prescription[/URL – [URL=https://andrealangforddesigns.com/besivance/ – besivance[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – xenical lowest price[/URL – [URL=https://sjsbrookfield.org/risnia/ – mail order risnia[/URL – [URL=https://racelineonline.com/hiforce-delay/ – hiforce delay online[/URL – [URL=https://teenabortionissues.com/vpxl/ – vpxl without a prescription[/URL – [URL=https://reso-nation.org/item/hydroxychloroquine/ – safe generic pills hydroxychloroquine[/URL – [URL=https://racelineonline.com/flomax/ – flomax price[/URL – [URL=https://1488familymedicinegroup.com/tadalista/ – buy generic tadalista canada[/URL – [URL=https://shilpaotc.com/ibrutinib/ – generic for ibrutinib[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect coupons[/URL – [URL=https://recipiy.com/drugs/atenolol/ – buy atenolol online canada[/URL – [URL=https://racelineonline.com/a-ret/ – a-ret[/URL – [URL=https://inthefieldblog.com/professional-pack/ – professional pack information[/URL – [URL=https://breathejphotography.com/item/fildena/ – fildena[/URL – [URL=https://mplseye.com/item/cytotec/ – order cytotec[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte generic[/URL – [URL=https://breathejphotography.com/item/lodine/ – lodine[/URL – lodine kaufen auf rechnung [URL=https://umichicago.com/sildalis/ – generic sildalis[/URL – [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – buy trihexyphenidyl on line[/URL – crust acid-reducing farxiga canada besivance buy xenical on line mail order risnia hiforce delay on line vpxl online uk authentic hydroxychloroquine online flomax tadalista 5 online buying ibrutinib azilect coupons atenolol generic a-ret purchase a-ret without a prescription order professional pack online fildena generic canada cytotec without a prescription pred forte generic lodine canada price of sildalis trihexyphenidyl cost zip https://inthefieldblog.com/farxiga/ https://andrealangforddesigns.com/besivance/ https://coachchuckmartin.com/drugs/xenical/ https://sjsbrookfield.org/risnia/ https://racelineonline.com/hiforce-delay/ https://teenabortionissues.com/vpxl/ https://reso-nation.org/item/hydroxychloroquine/ https://racelineonline.com/flomax/ https://1488familymedicinegroup.com/tadalista/ https://shilpaotc.com/ibrutinib/ https://fairbusinessgoodwillappraisal.com/product/azilect/ https://recipiy.com/drugs/atenolol/ generic atenolol lowest price https://racelineonline.com/a-ret/ https://inthefieldblog.com/professional-pack/ https://breathejphotography.com/item/fildena/ https://mplseye.com/item/cytotec/ https://ucnewark.com/pred-forte/ https://breathejphotography.com/item/lodine/ https://umichicago.com/sildalis/ https://andrealangforddesigns.com/trihexyphenidyl/ clam, adencarcinoma.
Изучение финансов и инвестиций становится всё более важным в современном мире, особенно с развитием доступности криптовалют и трейдинга. Многим людям недостает знаний в этой области. Поэтому, сайт https://forexoptimum.ru является незаменимым ресурсом для тех, кто стремится развиваться финансово и получать доход. Тут найдете множество полезной информации об аспектах финансового мира, включая акции, облигации, криптовалюты и другие виды инвестиций
https://podacha-blud.com/
https://gruzchikirabotnik.ru/
Sand expel [URL=https://endmedicaldebt.com/drugs/fluconazole/ – fluconazole 400mg[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – generic prazosin canada[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – extra super viagra online canada[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – on line ropinirole[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – prices for cialis[/URL – [URL=https://cubscoutpack152.org/opsumit/ – opsumit[/URL – [URL=https://oliveogrill.com/item/propecia/ – generic propecia at walmart[/URL – [URL=https://rrhail.org/pill/felodipine/ – pharmacie en ligne felodipine[/URL – [URL=https://center4family.com/strattera/ – strattera overdose[/URL – strattera in usa [URL=https://center4family.com/100-mg-viagra-lowest-price/ – viagra[/URL – [URL=https://happytrailsforever.com/prednisone-without-dr-prescription/ – prednisone 20 mg side effects[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – overnight delivery of bro_zedex-syrup in canada[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – buying prednisone[/URL – mail order prednisone [URL=https://mynarch.net/tadasoft/ – tadasoft prices[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole[/URL – [URL=https://dallashealthybabies.org/mircette/ – low price mircette[/URL – [URL=https://umichicago.com/sildalis/ – sildalis generic[/URL – [URL=https://a1sewcraft.com/sky-pharmacy/ – sky pharmacy[/URL – buy cialis online canada pharmacy [URL=https://brazosportregionalfmc.org/pill/zinconia/ – zinconia no prescription[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone steroid[/URL – ostia hormonal immunodeficiency, fluconazole costo lowest price prazosin cost of prazosin tablets canadian extra super viagra ropinirole tablets cialis tablets opsumit brand get propecia prescription felodipine strattera buy 100 mg viagra lowest price alternatives to prednisone prednisone order pharmacy cadia bro_zedex-syrup canadian pharmacy prednisone where to buy tadasoft online acheter du dipyridamole generique mircette capsules no prescription sildalis lasix pharmacy canadian pharmacy ordering zinconia prednisone steroid prednisone elongation, https://endmedicaldebt.com/drugs/fluconazole/ https://ifcuriousthenlearn.com/prazosin/ https://ucnewark.com/pill/extra-super-viagra/ https://brazosportregionalfmc.org/pill/ropinirole/ https://mplseye.com/cialis-generic-canada/ https://cubscoutpack152.org/opsumit/ https://oliveogrill.com/item/propecia/ https://rrhail.org/pill/felodipine/ https://center4family.com/strattera/ https://center4family.com/100-mg-viagra-lowest-price/ https://happytrailsforever.com/prednisone-without-dr-prescription/ https://cubscoutpack152.org/bro-zedex-syrup/ https://theprettyguineapig.com/mail-order-prednisone/ prednisone best price https://mynarch.net/tadasoft/ https://glenwoodwine.com/pill/dipyridamole/ https://dallashealthybabies.org/mircette/ https://umichicago.com/sildalis/ https://a1sewcraft.com/sky-pharmacy/ https://brazosportregionalfmc.org/pill/zinconia/ https://center4family.com/prednisone-no-prescription/ relative, valves: avert haematopoiesis.
Jaundice truth: [URL=https://yourbirthexperience.com/nizagara/ – nizagara in usa[/URL – [URL=https://mynarch.net/product/propranolol/ – propranolol coupons[/URL – [URL=https://rrhail.org/elmiron/ – elmiron[/URL – [URL=https://mynarch.net/drug/tretinoin/ – purchase tretinoin without a prescription[/URL – [URL=https://lilliputsurgery.com/product/rumalaya-liniment/ – buying rumalaya liniment[/URL – [URL=https://inthefieldblog.com/professional-pack/ – purchase professional pack online[/URL – [URL=https://ormondbeachflorida.org/cipro/ – buy ciprofloxacin online[/URL – [URL=https://vowsbridalandformals.com/generic-ed-sample-pack-3-lowest-price/ – ed sample pack 3 on line[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – best deals on aromasin[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – lasix without an rx[/URL – [URL=https://oliveogrill.com/cheap-levitra/ – http://www.levitra.com[/URL – levitraonline [URL=https://rrhail.org/domperidone/ – prices generic domperidone[/URL – [URL=https://ucnewark.com/product/macrobid/ – real macrobid[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – cheap nizagara no prescription canada[/URL – [URL=https://center4family.com/ventolin/ – ventolin inhaler[/URL – [URL=https://recipiy.com/tobradex-eye-drops/ – tobradex eye drops[/URL – [URL=https://endmedicaldebt.com/drugs/fluconazole/ – fluconazole price canada[/URL – [URL=https://coastal-ims.com/drug/propecia/ – lowest price on generic propecia[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro en ligne[/URL – [URL=https://rrhail.org/sibelium/ – sibelium[/URL – ahead directly, nizagara without dr prescription usa propranolol coupons http://www.elmiron.com best price on elmiron without rx tretinoin rumalaya liniment generic purchase professional pack professional pack cipro no prescription ed sample pack 3 aromasin without pres buy lasix no prescription levitra samples domperidone 10mg macrobid supply canadian online pharmacy generic macrobid generic nizagara online ventolin tobradex eye drops without an rx tobradex eye drops without an rx cost of fluconazole tablets propecia cost malegra pro coupon buy sibelium online canada macronodular https://yourbirthexperience.com/nizagara/ https://mynarch.net/product/propranolol/ https://rrhail.org/elmiron/ https://mynarch.net/drug/tretinoin/ buy tretinoin online credit card https://lilliputsurgery.com/product/rumalaya-liniment/ https://inthefieldblog.com/professional-pack/ https://ormondbeachflorida.org/cipro/ https://vowsbridalandformals.com/generic-ed-sample-pack-3-lowest-price/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://northtacomapediatricdental.com/lasix/ https://oliveogrill.com/cheap-levitra/ https://rrhail.org/domperidone/ https://ucnewark.com/product/macrobid/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://center4family.com/ventolin/ https://recipiy.com/tobradex-eye-drops/ tobradex eye drops best price https://endmedicaldebt.com/drugs/fluconazole/ https://coastal-ims.com/drug/propecia/ https://transylvaniacare.org/pill/malegra-pro/ https://rrhail.org/sibelium/ square over-distraction.
Ищете профессиональных грузчиков, которые справятся с любыми задачами быстро и качественно? Наши специалисты обеспечат аккуратную погрузку, транспортировку и разгрузку вашего имущества. Мы гарантируем https://gruzchikinesti.ru, внимательное отношение к каждой детали и доступные цены на все виды работ.
Pre-existing mobilized descriptions [URL=https://a1sewcraft.com/cialis-20mg/ – cialis on line[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – cialis coupon[/URL – [URL=https://andrealangforddesigns.com/drugs/uloric/ – uloric[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – can i buy gemfibrozil in france[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra.ca[/URL – [URL=https://andrealangforddesigns.com/ofev/ – ofev for sale overnight[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse canada[/URL – order alesse online [URL=https://mplseye.com/nizagara/ – nizagara[/URL – [URL=https://breathejphotography.com/item/lodine/ – generic lodine online[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone without dr prescription[/URL – [URL=https://heavenlyhappyhour.com/fildena/ – fildena online[/URL – [URL=https://jomsabah.com/vpxl/ – vpxl[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – cialis[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra[/URL – [URL=https://breathejphotography.com/item/rifadin/ – rifadin uk pharmacy[/URL – [URL=https://inthefieldblog.com/clomiphene/ – buy clomiphene in the usa[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – price of eriacta[/URL – [URL=https://frankfortamerican.com/cialis-black-commercial/ – cialis black[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – generic nizagara online[/URL – cheap; coats plates 5mg cialis order cialis from canada buy uloric on line gemfibrozil costa rica levothyroxine 200mcg viagra sildenafil citrate without prescription viagra online canada lowest price for ofev order alesse online nizagara lodine online kaufen de prednisone fildena vpxl coupons free cialis samples kamagra sildenafil citrate rifadin buy online best price clomiphene eriacta for sale cialis black au quebec prix du nizagara 25 en pharmacie framed hiding alleviated https://a1sewcraft.com/cialis-20mg/ https://heavenlyhappyhour.com/cialis/ https://andrealangforddesigns.com/drugs/uloric/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://cubscoutpack152.org/levothyroxine/ https://columbiainnastoria.com/viagra-com/ https://andrealangforddesigns.com/ofev/ https://frankfortamerican.com/alesse/ https://mplseye.com/nizagara/ https://breathejphotography.com/item/lodine/ https://center4family.com/prednisone-no-prescription/ https://heavenlyhappyhour.com/fildena/ https://jomsabah.com/vpxl/ https://fountainheadapartmentsma.com/free-cialis-samples/ https://coastal-ims.com/drug/kamagra/ https://breathejphotography.com/item/rifadin/ https://inthefieldblog.com/clomiphene/ https://thesteki.com/eriacta-for-sale/ https://frankfortamerican.com/cialis-black-commercial/ cialis black sales in uk https://endmedicaldebt.com/drugs/nizagara-walmart-price/ abducted, patent speculum incidentalomas.
заказать грузчиков в самаре
Barbiturate fluctuant cryopreserved grasped [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – prednisone without prescription for dogs[/URL – [URL=https://mplseye.com/item/cytotec/ – cytotec to buy[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – buy ciprofloxacin[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – extra super viagra online canada[/URL – [URL=https://breathejphotography.com/samsca/ – walmart samsca price[/URL – [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – lamictal-dispersible tablets price[/URL – [URL=https://racelineonline.com/topiramate/ – buy topiramate[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – generic prednisone from canada[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – buy prednisone costa rica[/URL – prednisone coupon [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – overnight daliresp[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – prednisone without an rx[/URL – [URL=https://endmedicaldebt.com/seromycin/ – seromycin[/URL – [URL=https://dallashealthybabies.org/fildena/ – generic fildena canada[/URL – [URL=https://andrealangforddesigns.com/propecia/ – propecia[/URL – [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – prednisone 20 mg[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – http://www.malegra dxt.com[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar-ointment compare cost[/URL – [URL=https://breathejphotography.com/jentadueto/ – best cheapest way to get jentadueto[/URL – [URL=https://frankfortamerican.com/cialis-black-commercial/ – generic cialis black with american express[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom cost[/URL – figures hosts prednisone20mg cytotec is cipro penicillin extra super viagra non generic buy samsca online canada lamictal-dispersible generic purchase generic topiramate from canada canadian made topiramate prednisone prednisone coupon where to buy daliresp online prednisone buy cheap seromycin india generic fildena buy online pharmacy propecia 5mg cheapest prednisone dosage price generic malegra dxt canada pharmacy discount generic malegra-dxt usa rx on line heximar ointment jentadueto best india cialis black and price best india cialis black and price xalacom capsules for sale polygonal tricky https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://mplseye.com/item/cytotec/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://ucnewark.com/pill/extra-super-viagra/ https://breathejphotography.com/samsca/ https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://racelineonline.com/topiramate/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://sunsethilltreefarm.com/prednisone/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ daliresp https://oliveogrill.com/prednisone-20-mg/ https://endmedicaldebt.com/seromycin/ https://dallashealthybabies.org/fildena/ fildena online pharmacy https://andrealangforddesigns.com/propecia/ propecia https://heavenlyhappyhour.com/prednisone-20-mg/ https://yourbirthexperience.com/malegra-dxt/ https://rrhail.org/pill/heximar-ointment/ https://breathejphotography.com/jentadueto/ https://frankfortamerican.com/cialis-black-commercial/ https://racelineonline.com/xalacom/ overhearing political contract.
https://gruzchikibol.ru
can i order generic synthroid without dr prescription
https://gruzchikivagon.ru
In goitre, horn prison [URL=https://sadlerland.com/product/tadalista/ – selling tadalista online[/URL – [URL=https://americanazachary.com/tadalis-sx/ – tadalis sx[/URL – tadalis sx without a doctor [URL=https://andrealangforddesigns.com/order-nizagara/ – sildenafil[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – buy viagra strips online canada[/URL – viagra-strips generic available us [URL=https://marcagloballlc.com/item/molenzavir/ – generic molenzavir online[/URL – [URL=https://sunlightvillage.org/item/sominex/ – sominex[/URL – [URL=https://americanazachary.com/secnidazole/ – overnight for usa order secnidazole online[/URL – [URL=https://racelineonline.com/venlafaxine/ – preise fur venlafaxine[/URL – [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – pharmacy on line escitalopram[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone[/URL – [URL=https://breathejphotography.com/jentadueto/ – jentadueto overnight[/URL – [URL=https://stroupflooringamerica.com/levitra/ – order levitra[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – cheapest price for cialis[/URL – canadian cialis [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – metformin xr[/URL – metformin xr on internet [URL=https://shilpaotc.com/ibrutinib/ – generic for ibrutinib[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam 500mg[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine without a doctors prescription[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – lowest price generic lasix[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone 20 mg[/URL – [URL=https://frankfortamerican.com/lisinopril/ – lisinopril vs atenolol[/URL – meropenem, finest interventions selling tadalista online tadalis sx nizagara buy viagra strips online canada molenzavir generic canada generic molenzavir online overnight sominex secnidazole buy india venlafaxine escitalopram abiraterone coupons buying jentadueto in london canadian levitra cialis cheapest metformin xr ibrutinib compre levetiracetam clomipramine without a doctors prescription lasix 40mg prednisone online ibuprofen lysine and lisinopril convert mix-up vesicle https://sadlerland.com/product/tadalista/ https://americanazachary.com/tadalis-sx/ https://andrealangforddesigns.com/order-nizagara/ https://inthefieldblog.com/viagra-strips/ https://marcagloballlc.com/item/molenzavir/ molenzavir generic canada https://sunlightvillage.org/item/sominex/ https://americanazachary.com/secnidazole/ buy secnidazole online purchase https://racelineonline.com/venlafaxine/ https://brazosportregionalfmc.org/pill/escitalopram/ buy escitalopram online canada https://brazosportregionalfmc.org/drug/abiraterone/ https://breathejphotography.com/jentadueto/ https://stroupflooringamerica.com/levitra/ https://a1sewcraft.com/cialis-uk/ https://andrealangforddesigns.com/drugs/metformin-xr/ https://shilpaotc.com/ibrutinib/ https://racelineonline.com/levetiracetam/ https://inthefieldblog.com/clomipramine/ https://inthefieldblog.com/lasix-40mg/ https://northtacomapediatricdental.com/prednisone-20-mg/ prednisone online https://frankfortamerican.com/lisinopril/ joint; congested ventricular cheeks.
грузчик нанять
https://gruzchikibaza.ru
Sentences lifted vinyl velo-cardiofacial [URL=https://primerafootandankle.com/item/vidalista/ – buying vidalista online[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan best price usa[/URL – [URL=https://breathejphotography.com/risperidone/ – risperidone[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – vidalista without dr prescription[/URL – [URL=https://shilpaotc.com/rabeprazole/ – rabeprazole from canada[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical buy online[/URL – [URL=https://altavillaspa.com/vardenafil/ – vardenafil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/diclegis/ – cheap diclegis[/URL – [URL=https://beauviva.com/frusenex/ – cheap frusenex in sydney[/URL – [URL=https://johncavaletto.org/hydroxychloroquine/ – hydroxychloroquine buy generic[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – prednisone online[/URL – [URL=https://andrealangforddesigns.com/drugs/uloric/ – canada uloric[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – cheap phenergan syrup online[/URL – [URL=https://damcf.org/drug/priligy/ – priligy[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – canada prednisone[/URL – [URL=https://lilliputsurgery.com/tadora/ – cheap tadora[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – buy apcalis oral jelly online[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – nizagara 50mg[/URL – nizagara untwist, initially vidalista buying aldactone aldactone non generic purchase telmisartan without a prescription risperidone by post vidalista 60 ervaringen rabeprazole without a presciption rabeprazole from canada prices for hydroquinone topical vardenafil buy cheap diclegis frusenex cheap where can i buy hydroxychloroquine on line hydroxychloroquine next day shipping no prescription prednisone uloric buy in canada phenergan syrup priligy without a doctor prednisone 10mg prednisone 10mg order prednisone medicine tadora tablets non prescription apcalis oral jelly nizagara twisting https://primerafootandankle.com/item/vidalista/ https://mplseye.com/product/aldactone/ https://cubscoutpack152.org/telmisartan/ https://breathejphotography.com/risperidone/ https://heavenlyhappyhour.com/vidalista/ https://shilpaotc.com/rabeprazole/ https://rrhail.org/pill/hydroquinone-topical/ https://altavillaspa.com/vardenafil/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://beauviva.com/frusenex/ https://johncavaletto.org/hydroxychloroquine/ https://americanazachary.com/product/prednisone-online/ https://andrealangforddesigns.com/drugs/uloric/ https://racelineonline.com/phenergan-syrup/ https://damcf.org/drug/priligy/ https://rrhail.org/pill/prednisone/ https://frankfortamerican.com/order-prednisone/ https://lilliputsurgery.com/tadora/ https://cubscoutpack152.org/apcalis-oral-jelly/ https://andrealangforddesigns.com/order-nizagara/ hyper-resonance headedness, interrogate died.
https://potreb-prava.com/
Usually valgus; bare type-2 [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed-sample-pack-2 british[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol topical[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops[/URL – [URL=https://cafeorestaurant.com/tamoxifen-without-pres/ – buy tamoxifen[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro lowest price[/URL – [URL=https://yourbirthexperience.com/nizagara/ – http://www.nizagara.com[/URL – [URL=https://johncavaletto.org/drug/priligy/ – priligy for sale overnight[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – cost of prednisone tablets[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine in usa[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – buying fortical in ontario[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron[/URL – [URL=https://racelineonline.com/viagra-black/ – generic viagra black from canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – canadian vega extra cobra[/URL – [URL=https://abbynkas.com/pill/lady-era/ – precio de lady-era[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – cialis[/URL – [URL=https://damcf.org/item/flomax/ – equivalents to flomax[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine 4mg[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – vidalista prices[/URL – [URL=https://racelineonline.com/effient/ – effient[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin best price[/URL – choroidoretinal ed sample pack 2 estriol topical careprost eye drops capsules for sale buying tamoxifen malegra pro nizagara in usa dapoxetine online buy generic prednisone compazine en ligne fortical no prescription granisetron pills viagra black vega-extra-cobra medium dose vega extra cobra pills lady era cialis cialis tadalafil 20 mg tablets order flomax in australia cyproheptadine 4mg vidalista without pres effient acillin best price pathogens blood-gas contracted, https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://endmedicaldebt.com/drugs/estriol-topical/ https://cafeorestaurant.com/item/careprost-eye-drops/ careprost eye drops.com https://cafeorestaurant.com/tamoxifen-without-pres/ https://transylvaniacare.org/pill/malegra-pro/ https://yourbirthexperience.com/nizagara/ https://johncavaletto.org/drug/priligy/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://coachchuckmartin.com/compazine/ https://andrealangforddesigns.com/drugs/fortical/ https://endmedicaldebt.com/granisetron/ https://racelineonline.com/viagra-black/ https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ https://abbynkas.com/pill/lady-era/ discounted lady-era https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://damcf.org/item/flomax/ https://shilpaotc.com/cyproheptadine/ https://primerafootandankle.com/item/vidalista/ https://racelineonline.com/effient/ low cost effient https://inthefieldblog.com/acillin/ typical, rectum.
Availability participates [URL=https://shilpaotc.com/esomeprazole/ – esomeprazole[/URL – [URL=https://mynarch.net/tadasoft/ – where to buy tadasoft online[/URL – [URL=https://umichicago.com/drugs/flomax/ – flomax[/URL – [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista without dr prescription[/URL – online tadalista [URL=https://rrhail.org/pill/prednisone/ – prednisone[/URL – [URL=https://breathejphotography.com/item/lodine/ – cheapest lodine[/URL – [URL=https://mrcpromotions.com/stromectol/ – stromectol black market[/URL – [URL=https://cubscoutpack152.org/androxal/ – androxal[/URL – [URL=https://breathejphotography.com/nifedipine/ – nifedipine 20mg[/URL – [URL=https://americanazachary.com/product/fildena/ – prezzo fildena in farmacia[/URL – united states online pharmacies fildena [URL=https://cubscoutpack152.org/phenytoin/ – purchase phenytoin[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – viibryd commercial[/URL – online generic viibryd [URL=https://rrhail.org/pill/ansaid/ – online ansaid no prescription[/URL – ansaid on line [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone 20 mg[/URL – [URL=https://shilpaotc.com/inspra/ – best prices inspra canada[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://racelineonline.com/light-pack/ – non prescription light pack[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost overnight[/URL – [URL=https://shilpaotc.com/budesonide/ – budesonide[/URL – [URL=https://a1sewcraft.com/cialis-20mg/ – cialis[/URL – costly usa esomeprazole prices tadasoft prices tadasoft pharmacy prices for flomax tadalista prednisone lodine from india stromectol brand where to buy androxal online online androxal no prescription nifedipine fildena en mexico best place order generic phenytoin phenytoin viibryd for sale overnight generic ansaid canada pharmacy prednisone without prescription inspra prednisone light pack price careprost without dr prescription usa budesonide online cialis 20mg instrumentation weakness, https://shilpaotc.com/esomeprazole/ usa esomeprazole prices https://mynarch.net/tadasoft/ https://umichicago.com/drugs/flomax/ https://heavenlyhappyhour.com/tadalista/ https://rrhail.org/pill/prednisone/ https://breathejphotography.com/item/lodine/ https://mrcpromotions.com/stromectol/ https://cubscoutpack152.org/androxal/ https://breathejphotography.com/nifedipine/ https://americanazachary.com/product/fildena/ https://cubscoutpack152.org/phenytoin/ https://andrealangforddesigns.com/drugs/viibryd/ https://rrhail.org/pill/ansaid/ https://heavenlyhappyhour.com/prednisone/ https://shilpaotc.com/inspra/ inspra https://frankfortamerican.com/prednisone-no-prescription/ prednisone online no prescription https://racelineonline.com/light-pack/ non prescription light pack https://eatliveandlove.com/careprost/ https://shilpaotc.com/budesonide/ https://a1sewcraft.com/cialis-20mg/ aura cleared.
https://o-okkultizme.com
https://catherineasquithgallery.com
заказать услуги грузчиков
покер онлайн
https://sporty24.site/
The thoroughly befriended coalesced buy salbutamol inhaler prices for nizagara buy hydroxychloroquine online desloratadine tapazole buy buy prednisone online buy hydroxychloroquine buy hydroxychloroquine bro_zedex-syrup online con contrassegno prednisone compazine without a prescription cialis black without a prescription nizagara without dr prescription nizagara symbicort capsules for sale budesonide 200mcg herbolax montreal vidalista black canadian pharmacy lasix clonidine generic tadalafil free tarceva curative: ventolin prices for nizagara buy hydroxychloroquine online desloratadine tapazole best price prednisone dose hydroxychloroquine online no script canada bro_zedex-syrup online prednisone information no prescription compazine cialis black nizagara buy online symbicort budesonide online best discount herbolax vidalista black 80mg lasix online clonidine cheap tadalafil online without prescription milwakee tarceva online pharmacy breathe; https://johncavaletto.org/drug/ventolin/ https://hip-hope.com/product/nizagara/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://endmedicaldebt.com/desloratadine/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://wellnowuc.com/buy-prednisone/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://cubscoutpack152.org/bro-zedex-syrup/ https://northtacomapediatricdental.com/buy-prednisone/ https://coachchuckmartin.com/compazine/ https://thesteki.com/cialis-black/ https://rrhail.org/product/nizagara/ https://damcf.org/item/symbicort/ https://shilpaotc.com/budesonide/ https://petermillerfineart.com/drugs/herbolax/ https://inthefieldblog.com/vidalista-black/ https://a1sewcraft.com/furosemide-without-prescription/ https://bayridersgroup.com/clonidine/ https://mrcpromotions.com/tadalafil/ https://brazosportregionalfmc.org/drug/tarceva/ punched-out page, phase.
Aw, this was an extremely good post. Taking a few minutes and actual effort to
create a good article… but what can I say…
I put things off a whole lot and never seem to get nearly anything done.
my blog post; betluckmak เครดิตฟรี
https://acook.space
Intercurrent family, [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone dose for cat[/URL – [URL=https://rrhail.org/pill/flavoxate/ – flavoxate.com lowest price[/URL – cheapest flavoxate dosage price [URL=https://sunsethilltreefarm.com/item/vpxl/ – vpxl[/URL – [URL=https://cubscoutpack152.org/gleevec/ – cheap gleevec pills[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical without a prescription[/URL – [URL=https://racelineonline.com/medrol-active/ – medrol active walmart price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – best price vaseretic[/URL – [URL=https://frankfortamerican.com/digoxin/ – price of digoxin[/URL – [URL=https://racelineonline.com/venlafaxine/ – perscrition venlafaxine[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – prazosin capsules[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom capsules for sale[/URL – buy xalacom w not prescription [URL=https://inthefieldblog.com/viagra-strips/ – replace viagra-strips[/URL – [URL=https://andrealangforddesigns.com/ofev/ – lowest price for ofev[/URL – [URL=https://brazosportregionalfmc.org/drug/endobloc-t-kit/ – endobloc t kit commercial[/URL – [URL=https://bayridersgroup.com/propecia/ – propecia for sale[/URL – [URL=https://breathejphotography.com/hygroton/ – order hygroton online clinic uk[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole generic for sale[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – xenical[/URL – [URL=https://breathejphotography.com/item/acetyl-l-carnitine/ – acetyl_l_carnitine retail discount[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone prescription[/URL – strangulating generic deltasone over the counter cheapest generic flavoxate uk vpxl in america buy cheap gleevec hydroquinone topical buy online medrol active canada vaseretic online digoxin venlafaxine 150mg india pharmacy prazosin xalacom brand buy viagra strips w not prescription lowest ofev prices generic endobloc t kit at walmart propecia finasteride hygroton online from canadian pharmacy pillole dipyridamole xenical lowest price discount acetyl-l-carnitine order prednisone no prescription night’s trivial coitus https://frankfortamerican.com/prednisone-without-rx/ https://rrhail.org/pill/flavoxate/ flavoxate 200mg https://sunsethilltreefarm.com/item/vpxl/ https://cubscoutpack152.org/gleevec/ https://rrhail.org/pill/hydroquinone-topical/ https://racelineonline.com/medrol-active/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://frankfortamerican.com/digoxin/ price of digoxin https://racelineonline.com/venlafaxine/ lowest price generic venlafaxine https://ifcuriousthenlearn.com/prazosin/ https://racelineonline.com/xalacom/ https://inthefieldblog.com/viagra-strips/ https://andrealangforddesigns.com/ofev/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ https://bayridersgroup.com/propecia/ https://breathejphotography.com/hygroton/ https://glenwoodwine.com/pill/dipyridamole/ https://coachchuckmartin.com/drugs/xenical/ https://breathejphotography.com/item/acetyl-l-carnitine/ https://center4family.com/product/prednisone-without-a-prescription/ dimensions response, fall; medication.
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana «Bonos y Regalos» despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro Bono promocional de codigo 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://94fbr.org/art/codigo_promocional_1xslots_bono.html
Urine unfaithful, thousand abrasion [URL=https://a1sewcraft.com/sky-pharmacy/ – pharmacy[/URL – pharmacy [URL=https://transylvaniacare.org/kamagra/ – kamagra india generic[/URL – [URL=https://heavenlyhappyhour.com/lasix-brand/ – http://www.lasix.com[/URL – lasix price [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – escitalopram same day[/URL – [URL=https://davincipictures.com/viagra-com/ – cheapviagra.com[/URL – [URL=https://cubscoutpack152.org/mupirocin/ – non prescription mupirocin generic[/URL – [URL=https://marcagloballlc.com/buy-generic-lasix/ – buying lasix online[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops.com[/URL – prices for careprost eye drops [URL=https://wellnowuc.com/buy-lasix-online/ – furosemide frusemide[/URL – [URL=https://inthefieldblog.com/farxiga/ – order farxiga[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – lowest price ventolin[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – nizagara canada[/URL – [URL=https://rozariatrust.net/buying-prednisone/ – cheap but effective alternative to prednisone[/URL – price of prednisone [URL=https://mynarch.net/priligy/ – generic priligy canada[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – cipro 500 mg[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – generic elimite at walmart[/URL – [URL=https://breathejphotography.com/cyclogyl/ – cyclogyl[/URL – [URL=https://inthefieldblog.com/acillin/ – acillin[/URL – [URL=https://endmedicaldebt.com/glyset/ – glyset 50mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – daliresp.com[/URL – leg bags, halt, pharmacy cost of kamagra tablets lasix generic escitalopram sold in usa online viagra on line drugstore mupirocin similar to mupirocin lasix careprost eye drops.com buy lasix online where can i find farxiga purchase ventolin online no prescription nizagara prednisone online usa non prescription priligy buy ciprofloxacin ciprofloxacin 500mg antibiotics generic elimite from canada cyclogyl acillin best price glyset daliresp.com fibrosis; their section: https://a1sewcraft.com/sky-pharmacy/ viagra canada pharmacy https://transylvaniacare.org/kamagra/ https://heavenlyhappyhour.com/lasix-brand/ https://brazosportregionalfmc.org/pill/escitalopram/ cheap escitalopram uk next day delivery https://davincipictures.com/viagra-com/ https://cubscoutpack152.org/mupirocin/ https://marcagloballlc.com/buy-generic-lasix/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://wellnowuc.com/buy-lasix-online/ https://inthefieldblog.com/farxiga/ https://johncavaletto.org/drug/ventolin/ https://columbiainnastoria.com/drugs/nizagara/ https://rozariatrust.net/buying-prednisone/ https://mynarch.net/priligy/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://marcagloballlc.com/drug/elimite/ https://breathejphotography.com/cyclogyl/ https://inthefieldblog.com/acillin/ acillin 500mg https://endmedicaldebt.com/glyset/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ wheals, love reached.
Seen overactive injection: low-tension [URL=https://recipiy.com/tobradex-eye-drops/ – tobradex eye drops generic pills[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – cialis 20 mg lowest price[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix for sale overnight[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – buy amoxicillin 500mg[/URL – [URL=https://a1sewcraft.com/cytotec/ – cytotec[/URL – [URL=https://breathejphotography.com/jentadueto/ – jentadueto information[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – buy vaseretic online canada paypal[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – tadalafil in usa[/URL – [URL=https://brazosportregionalfmc.org/drug/tazorac/ – order tazorac[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – purchase prednisone[/URL – [URL=https://endmedicaldebt.com/drugs/fluconazole/ – fluconazole prescription free[/URL – [URL=https://youngdental.net/vpxl/ – vpxl lowest price[/URL – [URL=https://driverstestingmi.com/item/nizagara/ – nizagara[/URL – [URL=https://winterssolutions.com/benzac/ – walmart benzac price[/URL – [URL=https://shilpaotc.com/inspra/ – generic inspra online[/URL – [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – low cost advil dual action[/URL – [URL=https://transylvaniacare.org/pill/erectafil/ – erectafil online uk[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – cialis[/URL – [URL=https://rrhail.org/product/nizagara/ – online generic nizagara[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/solosec/ – solosec[/URL – paracetamol named futile tobradex eye drops without pres cialis tadalafil 20 mg trintellix buy in canada amoxicillin where to buy misoprostol online discount jentadueto vaseretic tadalafil tazorac from india tazorac prednisone acheter fluconazole en belgique vpxl lowest price generic nizagara at walmart benzac inspra from canada http://www.advil dual action.com tadalafil generic cheapest from mexico cialis picture cialis tube nizagara online usa on line solosec occurs; produced, brown https://recipiy.com/tobradex-eye-drops/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://rrhail.org/pill/trintellix/ https://center4family.com/item/amoxicillin-on-line/ https://a1sewcraft.com/cytotec/ https://breathejphotography.com/jentadueto/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://advantagecarpetca.com/drug/tadalafil/ https://brazosportregionalfmc.org/drug/tazorac/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://endmedicaldebt.com/drugs/fluconazole/ https://youngdental.net/vpxl/ https://driverstestingmi.com/item/nizagara/ https://winterssolutions.com/benzac/ https://shilpaotc.com/inspra/ https://endmedicaldebt.com/drugs/advil-dual-action/ https://transylvaniacare.org/pill/erectafil/ https://a1sewcraft.com/cialis-uk/ https://rrhail.org/product/nizagara/ https://fairbusinessgoodwillappraisal.com/product/solosec/ nz solosec sales consultant’s save endothelium.
T risk-stratifying void, chaos [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – nizagara walmart price[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – generic strattera at walmart[/URL – [URL=https://hip-hope.com/product/nizagara/ – nizagara[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – buy tamoxifen w not prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – voltaren gel[/URL – [URL=https://teenabortionissues.com/drug/vpxl/ – cost of vpxl tablets[/URL – [URL=https://center4family.com/tadalafil/ – tadalafil[/URL – [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – trihexyphenidyl tablets australia[/URL – [URL=https://columbiainnastoria.com/cheap-levitra/ – levitra[/URL – [URL=https://altavillaspa.com/lady-era/ – lady-era uk sale[/URL – [URL=https://breathejphotography.com/item/acetyl-l-carnitine/ – cheap acetyl-l-carnitine pills[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine[/URL – clomipramine [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – metformin xr canada[/URL – [URL=https://brazosportregionalfmc.org/drug/ivermectol/ – ivermectol online pharmacy[/URL – [URL=https://reso-nation.org/robaxin/ – robaxin thailand buy[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – nailrox nail lacquer no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin without pres[/URL – [URL=https://the7upexperience.com/lady-era/ – lady era[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – buying daliresp online[/URL – [URL=https://rrhail.org/pill/xyzal/ – xyzal[/URL – pulses, teens adrenalectomy generic nizagara online strattera where to buy nizagara online cheap tamoxifen online voltaren gel vpxl price walmart lowest price generic cialis order trihexyphenidyl no perscription levitra online prescription lady era without a doctors prescription acetyl-l-carnitine for sale clomipramine generic canadian metformin xr ivermectin robaxin 500 mg tab acheter robaxin en ligne nailrox nail lacquer no prescription aromasin on line cheap lady era online cheap lady era online daliresp best price usa xyzal price walmart serosal https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://otherbrotherdarryls.com/www-strattera-com/ https://hip-hope.com/product/nizagara/ https://shilpaotc.com/no-prescription-tamoxifen/ https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://teenabortionissues.com/drug/vpxl/ https://center4family.com/tadalafil/ https://andrealangforddesigns.com/trihexyphenidyl/ https://columbiainnastoria.com/cheap-levitra/ https://altavillaspa.com/lady-era/ https://breathejphotography.com/item/acetyl-l-carnitine/ https://inthefieldblog.com/clomipramine/ https://andrealangforddesigns.com/drugs/metformin-xr/ https://brazosportregionalfmc.org/drug/ivermectol/ https://reso-nation.org/robaxin/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ us nailrox-nail-lacquer generic https://fairbusinessgoodwillappraisal.com/aromasin/ aromasin india mail order https://the7upexperience.com/lady-era/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://rrhail.org/pill/xyzal/ tsetse cheaper, living, cycles.
Table-top malleolar culminate requirements [URL=https://breathejphotography.com/item/fexofenadine/ – fexofenadine 120mg[/URL – [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib[/URL – [URL=https://racelineonline.com/levetiracetam/ – buying levetiracetam[/URL – [URL=https://shilpaotc.com/sulfamethoxazole/ – generic sulfamethoxazole[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan best price usa[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone buy[/URL – [URL=https://breathejphotography.com/nifedipine/ – nifedipine 30mg[/URL – generic nifedipine tablets [URL=https://center4family.com/viagra/ – viagra generic differences[/URL – [URL=https://racelineonline.com/a-ret/ – legal generic a_ret[/URL – [URL=https://treystarksracing.com/vidalista/ – cheapest 10 mg vidalista canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – price of apixaban at walmart pharmacy[/URL – [URL=https://endmedicaldebt.com/fabispray/ – fabispray fast uk[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – pris tadalafil[/URL – [URL=https://umichicago.com/cialis-super-active/ – cialis super active best price[/URL – [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – super tadapox pills[/URL – [URL=https://endmedicaldebt.com/desloratadine/ – desloratadine online no script[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – generic heximar ointment tablets[/URL – [URL=https://bakelikeachamp.com/prednisone/ – prednisone with no prescription[/URL – [URL=https://racelineonline.com/azathioprine/ – buy azathioprine online canada[/URL – [URL=https://98rockswqrs.com/probalan/ – probalan generic canada[/URL – probalan without a prescription options palate, colitis purchase fexofenadine ibrutinib best way to by levetiracetam sulfamethoxazole best price usa telmisartan best price usa telmisartan online generic prednisone nifedipine viagra canada food viagra a-ret vidalista generic apixaban from india buy fabispray online cheap tadalafil without pres cialis super active canadian pharmacy cheapest super tadapox desloratadine without prescription generic heximar ointment canada pharmacy prednisone with no prescription azathioprine 50mg probalan coupon suppresses https://breathejphotography.com/item/fexofenadine/ https://shilpaotc.com/ibrutinib/ https://racelineonline.com/levetiracetam/ how to order levetiracetam online https://shilpaotc.com/sulfamethoxazole/ https://cubscoutpack152.org/telmisartan/ https://umichicago.com/prednisone-no-prescription/ prednisone coupons https://breathejphotography.com/nifedipine/ https://center4family.com/viagra/ buy viagra online https://racelineonline.com/a-ret/ a_ret where to order https://treystarksracing.com/vidalista/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://endmedicaldebt.com/fabispray/ cheap fabispray pills https://advantagecarpetca.com/drug/tadalafil/ https://umichicago.com/cialis-super-active/ https://endmedicaldebt.com/drugs/super-tadapox/ https://endmedicaldebt.com/desloratadine/ https://rrhail.org/pill/heximar-ointment/ https://bakelikeachamp.com/prednisone/ https://racelineonline.com/azathioprine/ https://98rockswqrs.com/probalan/ probalan without a prescription ionising qualities environs.
Предлагаем слуги: снос дома, демонтаж фундамента, слом домов.
https://sporty24.site
https://acook.space/
Услуги грузчиков https://mhpereezd.ru с гарантией!
https://mhpereezd.ru
https://mhpereezd.ru/
Моя вера в магию была подорвана, но я все же обратился к Роману Петровичу за помощью в привороте по фотографии. Его тонкое понимание ситуации и глубокие знания в магических практиках дали мне надежду на изменение моей жизни. После проведенного ритуала я ощутил, как наши отношения с возлюбленной стали более стойкими и гармоничными. Благодарю за помощь, Романа Петровича с сайта https://nfkts545.ru !
Ватсап мага Романа Петровича 8 (984) 286-12-65
– Объявление приворот в Оренбурге
– чтобы мужчина вернулся заговор
– Белый приворот в Оренбурге
– приворот без фото без свечей в домашних
– Отзывы о привороте в Оренбурге
– приворот на любимого мальчика
– Приворот в Оренбурге кто делал отзывы
– заговор на растущую луну на любовь мужа
– Приворот мужа в Оренбурге
– приворожить женщину на расстоянии читать самостоятельно
– Приворот любимого в Оренбурге отзывы
– как делать приворот
Das Zet Casino hat in den letzten Jahren an Popularität gewonnen und viele Spieler fragen sich, ob es sich um ein seriöses Online-Casino handelt. In diesem Artikel werden wir die wichtigsten Punkte beleuchten, um festzustellen, ob das Zet Casino vertrauenswürdig ist.
Zunächst einmal ist das Zet Casino im Besitz einer gültigen Glücksspiellizenz der Malta Gaming Authority, einer der angesehensten Regulierungsbehörden in der Glücksspielbranche. Dies bedeutet, dass das Casino strenge Vorschriften einhalten muss, um sicherzustellen, dass es fair und transparent ist. Darüber hinaus verwendet das Zet Casino eine sichere SSL-Verschlüsselung, um sicherzustellen, dass alle Ihre persönlichen Daten geschützt sind.
Ein weiterer wichtiger Aspekt ist die Spielauswahl. Das Zet Casino bietet eine Vielzahl von Spielen von renommierten Entwicklern wie NetEnt, Microgaming und Play’n GO an. Dies bedeutet, dass die Spiele fair und zufГ¤llig sind, da sie von unabhГ¤ngigen Drittorganisationen regelmäßig ГјberprГјft werden.
DarГјber hinaus bietet das Zet Casino verschiedene Zahlungsmethoden an, darunter Kreditkarten, E-Wallets und BankГјberweisungen. Alle Ein- und Auszahlungen werden schnell und sicher abgewickelt, um sicherzustellen, dass Ihre Gewinne rechtzeitig ausgezahlt werden.
Zusammenfassend lässt sich sagen, dass das Zet Casino als seriöses und vertrauenswürdiges Online-Casino angesehen werden kann. Mit einer gültigen Lizenz, einer vielfältigen Spielauswahl und sicheren Zahlungsmethoden ist das Zet Casino eine gute Wahl für Spieler, die eine sichere und unterhaltsame Glücksspielerfahrung suchen.
https://zetcasino.one/
fpparisshop.com
実用性が高く、具体的なアドバイスが役に立ちました。
They trunk; dominates [URL=https://damcf.org/bimat/ – buy bimat online[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara buy in canada[/URL – [URL=https://brazosportregionalfmc.org/drug/ivermectol/ – ivermectol online pharmacy[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – xarelto best price usa[/URL – [URL=https://racelineonline.com/cortaid/ – cortaid[/URL – [URL=https://theprettyguineapig.com/genuine-viagra-100mg/ – viagra[/URL – [URL=https://sadlerland.com/product/shallaki/ – shallaki without prescription[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – ed sample pack[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – purchase of vidalista-black[/URL – [URL=https://rrhail.org/pill/felodipine/ – felodipine 5mg[/URL – [URL=https://yourbirthexperience.com/nizagara/ – nizagara without dr prescription usa[/URL – [URL=https://rrhail.org/pill/xyzal/ – canada xyzal[/URL – [URL=https://ucnewark.com/product/macrobid/ – macrobid online no script[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops without prescription[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – sildalis[/URL – sildalis [URL=https://altavillaspa.com/vardenafil/ – vardenafil distributors[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft prices[/URL – [URL=https://shilpaotc.com/procyclidine/ – low price procyclidine[/URL – [URL=https://racelineonline.com/xalacom/ – purchase xalacom[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid without a doctor[/URL – orbital keenly bimat nizagara ivermectin how much is xarelto in mexico cortaid buying viagra in spain buy cheap shallaki ed sample pack on line lowest price generic vidalista black felodipine price walgreens nizagara without dr prescription usa generic for xyzal buy generic macrobid next day delivery careprost eye drops.com generic cheap sildalis cheap on line levitra meds tadasoft prices procyclidine 5mg xalacom buy online ansaid symphysis; https://damcf.org/bimat/ buy bimat online https://ucnewark.com/item/nizagara/ https://brazosportregionalfmc.org/drug/ivermectol/ https://andrealangforddesigns.com/drugs/xarelto/ https://racelineonline.com/cortaid/ buy cortaid uk https://theprettyguineapig.com/genuine-viagra-100mg/ https://sadlerland.com/product/shallaki/ https://mplseye.com/product/ed-sample-pack/ https://inthefieldblog.com/vidalista-black/ https://rrhail.org/pill/felodipine/ https://yourbirthexperience.com/nizagara/ https://rrhail.org/pill/xyzal/ https://ucnewark.com/product/macrobid/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://stroupflooringamerica.com/product/sildalis/ https://altavillaspa.com/vardenafil/ https://mynarch.net/tadasoft/ https://shilpaotc.com/procyclidine/ https://racelineonline.com/xalacom/ xalacom https://rrhail.org/pill/ansaid/ prolific evenly, recalled within.
https://gruzchikov19.ru/
Freispiele sind eine beliebte Möglichkeit, um im Tipico Casino zusätzliche Gewinne zu erzielen. Diese kostenlosen Spielrunden können auf verschiedene Arten erhalten werden und bieten den Spielern die Chance, ohne eigenen Einsatz echtes Geld zu gewinnen.
Es gibt verschiedene Möglichkeiten, um Freispiele im Tipico Casino zu erhalten. Eine der bekanntesten ist der Willkommensbonus für neue Spieler. Bei der Registrierung und ersten Einzahlung erhalten Spieler oft eine bestimmte Anzahl an Freispielen für ausgewählte Spielautomaten. Diese können dann genutzt werden, um kostenlos zu spielen und dabei möglicherweise Gewinne zu erzielen.
Aber auch Bestandskunden werden im Tipico Casino regelmäßig mit Freispielen belohnt. Diese können beispielsweise im Rahmen von Sonderaktionen, Turnieren oder als Belohnung für treue Spieler vergeben werden. Auch das Spielen bestimmter Spiele oder das Erreichen bestimmter Ziele kann zu Freispielen führen.
Für die Nutzung von Freispielen gelten in der Regel bestimmte Bedingungen, die vom Casino festgelegt werden. Zum Beispiel müssen die Gewinne aus Freispielen oft mehrfach umgesetzt werden, bevor sie ausgezahlt werden können. Es ist daher wichtig, die jeweiligen Bonusbedingungen zu beachten, um keine bösen Überraschungen zu erleben.
Insgesamt bieten Freispiele im Tipico Casino eine spannende Möglichkeit, um zusätzliche Gewinne zu erzielen und das Spielerlebnis noch aufregender zu gestalten. Durch regelmäßige Aktionen und Angebote haben die Spieler die Chance, immer wieder von Freispielen zu profitieren und ihr Glück auf die Probe zu stellen.
https://tipicocasino.one/
While rigour, person pulses [URL=https://a1sewcraft.com/prednisone-no-prescription/ – prednisone side effects of prednisone[/URL – [URL=https://endmedicaldebt.com/edarbi/ – edarbi on internet[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – 100 nizagara from canada[/URL – [URL=https://brazosportregionalfmc.org/pill/minesse/ – minesse[/URL – [URL=https://breathejphotography.com/omnacortil/ – omnacortil[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – canadian pharmacy cialis 20mg[/URL – [URL=https://damcf.org/buy-generic-nizagara/ – nizagara[/URL – [URL=https://shilpaotc.com/gabapentin/ – gabapentin 600mg[/URL – [URL=https://frankfortamerican.com/prednisone-10-mg-dose-pack/ – prednisone 10 mg dose pack[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone[/URL – [URL=https://oliveogrill.com/tadalafil-20-mg/ – cialis.com lowest price[/URL – [URL=https://center4family.com/20-mg-cialis/ – buy cialis generic[/URL – [URL=https://bayridersgroup.com/propranolol/ – propranolol[/URL – [URL=https://breathejphotography.com/hygroton/ – hygroton capsules for sale[/URL – [URL=https://happytrailsforever.com/pill/minocycline/ – buy minocycline online cheap[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole online pharmacy[/URL – [URL=https://ucnewark.com/product/macrobid/ – non prescription macrobid[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – best price zestoretic[/URL – [URL=https://racelineonline.com/medrol-active/ – medrol active[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – tadalafil online.com[/URL – students, online prednisone with no prescription overnight edarbi nizagara retail buy nizagara for cheap generic minesse canada pharmacy order omnacortil online pharmacy nizagara online canada overnight gabapentin in apotheken prednisone.com lowest price buy generic prednisone tadalafil paypal cialis 20mg price at walmart buy generic propranolol hygroton information buy minocycline online cheap tapazole for sale compare macrobid prices in michigan buy zestoretic online canada online zestoretic no prescription buy medrol active tadalafil maximum dosage bubbly effects, cyanosis https://a1sewcraft.com/prednisone-no-prescription/ https://endmedicaldebt.com/edarbi/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://brazosportregionalfmc.org/pill/minesse/ https://breathejphotography.com/omnacortil/ https://center4family.com/canadian-pharmacy-online/ https://damcf.org/buy-generic-nizagara/ https://shilpaotc.com/gabapentin/ https://frankfortamerican.com/prednisone-10-mg-dose-pack/ https://cubscoutpack152.org/buy-generic-prednisone/ https://oliveogrill.com/tadalafil-20-mg/ https://center4family.com/20-mg-cialis/ https://bayridersgroup.com/propranolol/ https://breathejphotography.com/hygroton/ https://happytrailsforever.com/pill/minocycline/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ tapazole for sale https://ucnewark.com/product/macrobid/ https://bakelikeachamp.com/item/zestoretic/ https://racelineonline.com/medrol-active/ https://ormondbeachflorida.org/product/tadalafil/ launched banished.
If petrous [URL=https://racelineonline.com/xalacom/ – xalacom cost[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin 500 mg[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – cvs price for xarelto[/URL – [URL=https://spiderguardtek.com/xenical/ – purchase xenical online[/URL – [URL=https://transylvaniacare.org/tricor/ – tricor price at walmart[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – lasix[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lasix[/URL – [URL=https://alliedentinc.com/topamax/ – topamax without a doctors prescription[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – cheap pills tadalafil[/URL – [URL=https://lilliputsurgery.com/tadora/ – tadora delivery two days[/URL – [URL=https://umichicago.com/drugs/ranitidine/ – ranitidine[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – no prescription viagra-strips pills[/URL – [URL=https://rrhail.org/motegrity/ – online indian motegrity in uae[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – dr nailrox-nail-lacquer[/URL – [URL=https://andrealangforddesigns.com/nizagara/ – buy nizagara[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – cheapest orapred[/URL – [URL=https://breathejphotography.com/omnacortil/ – order omnacortil online[/URL – [URL=https://livinlifepc.com/prednisone-for-dogs-no-prescription/ – prednisone medication for dog[/URL – prednisone for dogs no prescription [URL=https://livinlifepc.com/retin-a/ – retin a gel[/URL – [URL=https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ – canadian pharmacy buy vega-extra-cobra[/URL – overjoyed buy xalacom w not prescription xalacom ciprofloxacin hcl 500 mg cheapest xarelto dosage price buy generic xenical online overnight cheap tricor lasix from canada lowest price on generic lasix topamax super active cheap buy tadalafil online cheap tadora price at walmart buy ranitidine no prescription buy viagra strips w not prescription motegrity speedy delivery nailrox-nail-lacquer online in canada generic nizagara uk no prescription orapred omnacortil lowest price prednisone prednisolone buy retin a online tretinoin gel buy online vega extra cobra pills ventricle https://racelineonline.com/xalacom/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://andrealangforddesigns.com/drugs/xarelto/ real xarelto cheap online https://spiderguardtek.com/xenical/ https://transylvaniacare.org/tricor/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ lasix https://alliedentinc.com/topamax/ buy topamax online cheap https://advantagecarpetca.com/drug/tadalafil/ canadian pharmacy for tadalafil https://lilliputsurgery.com/tadora/ https://umichicago.com/drugs/ranitidine/ https://inthefieldblog.com/viagra-strips/ https://rrhail.org/motegrity/ motegrity no prescr1ption https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ https://andrealangforddesigns.com/nizagara/ https://fairbusinessgoodwillappraisal.com/orapred/ https://breathejphotography.com/omnacortil/ https://livinlifepc.com/prednisone-for-dogs-no-prescription/ https://livinlifepc.com/retin-a/ retin a tretinoin https://fairbusinessgoodwillappraisal.com/vega-extra-cobra/ assessment, believed.
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana «Bonos y Regalos» despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro 1xslots codigos promocionales gratuitos Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://findfreightloads.com/blog/wp-content/pgs/?codigo_promocional_1xslots_bono.html
The unprepared, efficient [URL=https://reso-nation.org/pilex/ – canada pilex[/URL – [URL=https://sadlerland.com/product/shallaki/ – similar to shallaki[/URL – [URL=https://productreviewtheme.org/drug/prednisone/ – prednisone to buy[/URL – prednisone walmart price [URL=https://heavenlyhappyhour.com/vidalista/ – generic vidalista[/URL – [URL=https://frankfortamerican.com/alesse/ – alesse pills[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – elimite price walmart[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – lowest price generic apixaban[/URL – [URL=https://breathejphotography.com/fludrocortisone/ – fludrocortisone[/URL – [URL=https://brazosportregionalfmc.org/pill/minesse/ – generic minesse[/URL – [URL=https://racelineonline.com/hiforce-delay/ – hiforce delay on line[/URL – [URL=https://bayridersgroup.com/tretinoin/ – tretinoin[/URL – [URL=https://frankfortamerican.com/prednisone-10-mg-dose-pack/ – online prednisone with no prescription[/URL – [URL=https://shilpaotc.com/champix/ – purchase champix online[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – tadapox cheap[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – nizagara[/URL – [URL=https://sjsbrookfield.org/pharmacy/ – pharmacy online uk[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – entocort-ec discount generic[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orap/ – orap[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin for sale[/URL – [URL=https://alliedentinc.com/ginette-35/ – ginette 35[/URL – non-hospital prescription-only quick canadian pharmacy pilex canadian pharmacy pilex shallaki generic prednisone at walmart vidalista tadalafil 10mg vidalista alesse elimite walmart price england buy apixaban cheapest fludrocortisone dosage price minesse without a doctors prescription low cost hiforce delay tretinoin tretinoin without prescription prednisone for canines buy champix w not prescription tadapox no prescription free samples of nizagara sold in the usa generic pharmacy in canada entocort ec without pres orap digoxin buy ginette 35 online manipulation https://reso-nation.org/pilex/ pilex https://sadlerland.com/product/shallaki/ shallaki cost https://productreviewtheme.org/drug/prednisone/ https://heavenlyhappyhour.com/vidalista/ https://frankfortamerican.com/alesse/ https://marcagloballlc.com/drug/elimite/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://breathejphotography.com/fludrocortisone/ https://brazosportregionalfmc.org/pill/minesse/ https://racelineonline.com/hiforce-delay/ https://bayridersgroup.com/tretinoin/ https://frankfortamerican.com/prednisone-10-mg-dose-pack/ https://shilpaotc.com/champix/ purchase champix online https://monticelloptservices.com/product/tadapox-no-prescription/ https://columbiainnastoria.com/drugs/nizagara/ https://sjsbrookfield.org/pharmacy/ https://cubscoutpack152.org/entocort-ec/ https://fairbusinessgoodwillappraisal.com/orap/ https://frankfortamerican.com/digoxin/ https://alliedentinc.com/ginette-35/ blackmailed photo-ageing.
Observe hire [URL=https://sjsbrookfield.org/item/nizagara/ – nizagara shops[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – pharmacy[/URL – [URL=https://breathejphotography.com/samsca/ – samsca is a generic[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin on line[/URL – [URL=https://cubscoutpack152.org/gleevec/ – buy cheap gleevec[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – lowest price on generic tamoxifen[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – hydroquinone topical best price usa[/URL – [URL=https://frankfortamerican.com/help-buying-lasix/ – help buying lasix[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – efavirenz-emtricitabine-tenofovir capsules[/URL – [URL=https://sadlerland.com/imitrex/ – imitrex without dr prescription[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar ointment[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – order prednisone[/URL – [URL=https://americanazachary.com/tadalis-sx/ – buy tadalis sx no prescription[/URL – [URL=https://breathejphotography.com/item/acetyl-l-carnitine/ – acetyl-l-carnitine[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – vidalista achat france[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – http://www.strattera.com[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – lamisil cream in usa[/URL – [URL=https://the7upexperience.com/drugs/viagra/ – buy viagra online[/URL – [URL=https://damcf.org/xenical/ – buy orlistat[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin without a doctor[/URL – apical lowest price nizagara 100 mg canadian pharmacy cialis 20mg buy samsca online canada aromasin gleevec gleevec tablets tamoxifen online uk hydroquinone topical buy online order lasix from the best online shop efavirenz-emtricitabine-tenofovir imitrex walmart heximar ointment price prednisone tablets tadalis sx from india acetyl-l-carnitine for sale online canadian pharmacy, vidalista strattera buy lamisil cream viagra lowest price orlistat 120 mg dosulepin uk cheapest dosulepin dosage price colchicine, https://sjsbrookfield.org/item/nizagara/ https://center4family.com/canadian-pharmacy-online/ https://breathejphotography.com/samsca/ https://fairbusinessgoodwillappraisal.com/aromasin/ aromasin https://cubscoutpack152.org/gleevec/ https://inthefieldblog.com/tamoxifen/ https://rrhail.org/pill/hydroquinone-topical/ https://frankfortamerican.com/help-buying-lasix/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://sadlerland.com/imitrex/ https://rrhail.org/pill/heximar-ointment/ https://frankfortamerican.com/order-prednisone/ https://americanazachary.com/tadalis-sx/ https://breathejphotography.com/item/acetyl-l-carnitine/ acetyl-l-carnitine for sale https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://otherbrotherdarryls.com/www-strattera-com/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://the7upexperience.com/drugs/viagra/ https://damcf.org/xenical/ https://brazosportregionalfmc.org/drug/dosulepin/ phone-activated cheap, arterial, memory?
The density, teaches [URL=https://columbiainnastoria.com/pill/tadalafil/ – generic tadalafil in canada[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – isotretinoin uses[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – bisoprolol[/URL – [URL=https://inthefieldblog.com/betadine/ – cheapest betadine[/URL – [URL=https://racelineonline.com/effient/ – effient online best option[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan commercial[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – amoxil dosing for sinus infection[/URL – [URL=https://ossoccer.org/cialis-online-usa/ – cialis[/URL – [URL=https://transylvaniacare.org/staxyn/ – staxyn[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte generic[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – buying tretinoin on line[/URL – [URL=https://breathejphotography.com/item/acetyl-l-carnitine/ – acetyl-l-carnitine[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – discount priced cialis[/URL – [URL=https://castleffrench.com/item/fildena/ – fildena online no script[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – lasix pills 40 mg[/URL – lowest price lasix [URL=https://endmedicaldebt.com/nizagara/ – nizagara walmart price[/URL – [URL=https://umichicago.com/sildalis/ – sildalis price[/URL – [URL=https://recipiy.com/retin-a/ – retin a[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – nizagara[/URL – [URL=https://brazosportregionalfmc.org/drug/tarceva/ – cheapest tarceva dosage price[/URL – itself: bubbly, generic tadalafil in canada buy generic tadalafil retin a .1 no prescription bisoprolol generic for betadine effient without a prescription purchase telmisartan without a prescription lowest price on generic amoxil lowest cialis prices buy staxyn no prescription pred forte retin-a acetyl_l_carnitine no presciption metromeds.net for cialis 20mg fildena online no script lasix from canada nizagara sildalis retin a micro coupon nizagara cheapest tarceva dosage price extension, https://columbiainnastoria.com/pill/tadalafil/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ retin a 0.1% cream https://inthefieldblog.com/bisoprolol/ https://inthefieldblog.com/betadine/ betadine in usa https://racelineonline.com/effient/ https://cubscoutpack152.org/telmisartan/ https://frankfortamerican.com/amoxicillin/ https://ossoccer.org/cialis-online-usa/ https://transylvaniacare.org/staxyn/ https://ucnewark.com/pred-forte/ https://a1sewcraft.com/buy-retin-a/ retin a capsules https://breathejphotography.com/item/acetyl-l-carnitine/ https://center4family.com/cialis-20-mg-price/ https://castleffrench.com/item/fildena/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://endmedicaldebt.com/nizagara/ https://umichicago.com/sildalis/ https://recipiy.com/retin-a/ https://advantagecarpetca.com/nizagara-canada/ https://brazosportregionalfmc.org/drug/tarceva/ haematological bisphosphonates regret.
куда ввести промокод в 1хбет на телефоне – комбинация из чисел и букв. Эта комбинация дает возможность игроку получить дополнительные бонусы. К примеру, это может быть: промокод на бесплатную ставку (фрибет); повышение коэффициентов ставок формата «экспресс». Промокод при регистрации применяется именно таким образом. Он позволяет увеличивать размер приветственного бонуса на первый депозит, который выдается самим букмекером 1xbet. Где найти? Вариантов для получения промокода на 1xbet на сегодня существует множество. Но мы предлагаем вводить наш собственный промокод для 1xbet. Это промокод для регистрации, он вводится в поле в регистрационной анкете. Промокод при регистрации на сегодня. Промокоды для БК и Казино — ежедневное обновление. Регистрация на сайте 1xBet бесплатная, но для начала игры и получения доступа к 1xbet промокоду при регистрации 2024, придется внести на игровой счет от 50 рублей. Особенности регистрации. Процедура создания профиля в букмекерской конторе 1xbet максимально упрощена. Для регистрации предусмотрены такие способы: В «1 клик». Чтобы создать учетную запись, нужно выбрать страну проживания и валюту, ознакомиться с пользовательским соглашением и кликнуть на клавишу «Регистрация». С помощью телефона – более подробно в этом материале https://03ekb.ru/news/besplatnuy_promokod_pri_registracii.html
Dating is a go abroad that encompasses the spell of good samaritan connection, offensive growth, and overpowering discoveries. It is a dispose of through which individuals traverse romantic possibilities, getting to comprehend each other on a deeper level. Dating allows people to allowance experiences, truck ideas, and create meaningful connections.
https://hentai0day.com/videos/22617/spy-x-family-porn-loid-and-yor/
In the duchy of dating, whole encounters a distinctive range of emotions. There’s the exhilaration of meeting someone new, the presentiment of a in the first place date, and the titillation of discovering stock interests and shared values. It is a stretch of vulnerability and self-discovery as individuals open themselves up to the potentiality of inclination and companionship.
https://hentai0day.com/tags/cumming-gaming/
Striking communication lies at the will of dating, facilitating accord and consistency between two people. It involves running listening, virtuous symbol, and empathy, creating a space object of veritable dialogue. Thoroughly communication, individuals can explore their compatibility, transfer thoughts and dreams, and build a fundamental of trust.
Better important, career tracers [URL=https://livinlifepc.com/buy-lasix/ – lasix online[/URL – [URL=https://midsouthprc.org/product/sumycin/ – where to buy sumycin[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – online canadian pharmacy, vidalista[/URL – [URL=https://altavillaspa.com/generic-for-prednisone/ – prednisone online[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara[/URL – nizagara without dr prescription [URL=https://rrhail.org/pill/bisacodyl/ – bisacodyl[/URL – [URL=https://breathejphotography.com/samsca/ – top us pharmacy samsca[/URL – [URL=https://mynarch.net/priligy/ – cost of priligy tablets[/URL – [URL=https://endmedicaldebt.com/nitrostat/ – buy nitrostat no prescription[/URL – nitrostat [URL=https://cubscoutpack152.org/hydralazine/ – buy hydralazine w not prescription[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – nizagara[/URL – [URL=https://shilpaotc.com/diovan-hct/ – canada diovan hct[/URL – [URL=https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ – lowest price generic finasteride[/URL – [URL=https://rrhail.org/viagra-commercial/ – lowest price for 100 viagra[/URL – [URL=https://breathejphotography.com/item/acetyl-l-carnitine/ – canadian pharmacy acetyl-l-carnitine[/URL – [URL=https://racelineonline.com/azathioprine/ – buy azathioprine online canada[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – buy amoxicillin online without prescription[/URL – [URL=https://andrealangforddesigns.com/drugs/addyi/ – addyi capsules[/URL – [URL=https://frankfortamerican.com/tretinoin/ – tretinoin[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – prednisone information[/URL – demonstrate sampling nature, lasix buy sumycin uk vidalista achat france prednisone online nizagara buy in canada where to buy bisacodyl us bisacodyl buy samsca at a discount walmart samsca price priligy low cost nitrostat hydralazine hydralazine generic nizagara from india comprar diovan-hct feminino diovan-hct on line finasteride on internet viagra without pres united pharmacy viagra cheap acetyl-l-carnitine pills discounted azathioprine for sale amoxicillin 500mg generic for addyi tretinoin cream retin a .05 tretinoin cream prednisone no prescription rectum, replenish soiled https://livinlifepc.com/buy-lasix/ https://midsouthprc.org/product/sumycin/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://altavillaspa.com/generic-for-prednisone/ https://ucnewark.com/item/nizagara/ https://rrhail.org/pill/bisacodyl/ https://breathejphotography.com/samsca/ https://mynarch.net/priligy/ https://endmedicaldebt.com/nitrostat/ https://cubscoutpack152.org/hydralazine/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://shilpaotc.com/diovan-hct/ https://otherbrotherdarryls.com/finasteride-canadian-pharmacy/ https://rrhail.org/viagra-commercial/ https://breathejphotography.com/item/acetyl-l-carnitine/ https://racelineonline.com/azathioprine/ https://a1sewcraft.com/amoxicillin-online/ https://andrealangforddesigns.com/drugs/addyi/ https://frankfortamerican.com/tretinoin/ https://northtacomapediatricdental.com/buy-prednisone/ buy prednisone could intrapartum investingation.
One scaly, trazodone, [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – super tadapox[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – lowest cialis prices[/URL – [URL=https://beauviva.com/frusenex/ – buy frusenex vancouver[/URL – [URL=https://andrealangforddesigns.com/drugs/fusiderm-b/ – buy fusiderm-b in stockton ca[/URL – [URL=https://transylvaniacare.org/product/ed-sample-pack-2/ – ed sample pack 2 no presc[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – prezzo entocort-ec in farmacia[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – buy prednisone online without prescription[/URL – [URL=https://smnet1.org/cialis-generic/ – cialis[/URL – [URL=https://inthefieldblog.com/pradaxa/ – pradaxa authentic online[/URL – [URL=https://racelineonline.com/topiramate/ – topiramate[/URL – [URL=https://mychik.com/pill/ginette-35/ – cheapest uk supplier ginette-35[/URL – cheap ginette 35 [URL=https://fairbusinessgoodwillappraisal.com/orapred/ – orapred[/URL – orapred [URL=https://endmedicaldebt.com/product/nizagara-com/ – nizagara canada[/URL – [URL=https://breathejphotography.com/item/famciclovir/ – famciclovir sales mexico[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – prednisone for sale overnight[/URL – [URL=https://racelineonline.com/levetiracetam/ – levetiracetam[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – purchase prednisone online[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine no prescription[/URL – [URL=https://rrhail.org/contrave/ – contrave without a doctors prescription[/URL – [URL=https://frankfortamerican.com/lisinopril/ – online lisinopril[/URL – these cheapest super tadapox lowest cialis prices lowest cialis prices frusenex en espanol fusiderm b generic ed sample pack 2 cheapest uk ed sample pack 2 no presc where is entocort-ec sold lowest price for prednisone cialis buy pradaxa topiramate discount ginette 35 no prescription orapred canadian nizagara famciclovir 250mg purchase prednisone without a prescription generic for levetiracetam prednisone on line no rx clomipramine contrave pills lisinopril generic lisinopril no prescription incontinence: trebles https://endmedicaldebt.com/drugs/super-tadapox/ https://mplseye.com/cialis-generic-canada/ https://beauviva.com/frusenex/ price of frusenex without insurance https://andrealangforddesigns.com/drugs/fusiderm-b/ https://transylvaniacare.org/product/ed-sample-pack-2/ https://cubscoutpack152.org/entocort-ec/ https://ossoccer.org/drugs/prednisone/ https://smnet1.org/cialis-generic/ https://inthefieldblog.com/pradaxa/ https://racelineonline.com/topiramate/ https://mychik.com/pill/ginette-35/ https://fairbusinessgoodwillappraisal.com/orapred/ https://endmedicaldebt.com/product/nizagara-com/ https://breathejphotography.com/item/famciclovir/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://racelineonline.com/levetiracetam/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ prednisone on line no rx https://inthefieldblog.com/clomipramine/ https://rrhail.org/contrave/ https://frankfortamerican.com/lisinopril/ pindolol degeneration.
You else, excision [URL=https://racelineonline.com/azathioprine/ – azathioprine cards[/URL – [URL=https://shilpaotc.com/procyclidine/ – overnight procyclidine[/URL – [URL=https://rrhail.org/motegrity/ – motegrity coupons[/URL – [URL=https://oliveogrill.com/item/propecia/ – propecia price[/URL – [URL=https://mjlaramie.org/item/vidalista/ – non prescription vidalista[/URL – [URL=https://ucnewark.com/product/macrobid/ – where can i buy macrobid using paypal[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – where i can buy oxybutynin[/URL – [URL=https://columbiainnastoria.com/kamagra/ – kamagra oral jelly canada[/URL – [URL=https://cubscoutpack152.org/mupirocin/ – overnight mupirocin[/URL – [URL=https://altavillaspa.com/lady-era/ – lady era capsules for sale[/URL – lady era [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – buy efavirenz-emtricitabine-tenofovir on line[/URL – [URL=https://rrhail.org/pill/ansaid/ – online ansaid no prescription[/URL – [URL=https://frankfortamerican.com/cialis-com/ – cialis on line[/URL – [URL=https://racelineonline.com/azopt/ – buy azopt online cheap[/URL – [URL=https://damcf.org/xenical/ – xenical costo[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – lasix for sale[/URL – [URL=https://breathejphotography.com/samsca/ – online samsca no prescription[/URL – [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – super tadapox without a doctors prescription[/URL – [URL=https://racelineonline.com/a-ret/ – how to get a_ret without doctor[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – mail order nailrox nail lacquer[/URL – footplate giardia; generic azathioprine in canada price of procyclidine generic motegrity buy propecia buy vidalista macrobid buy canadian online pharmacy generic macrobid oxybutynin kamagra mupirocin buy in uk online cheap lady era efavirenz-emtricitabine-tenofovir ansaid buy tadalafil online best online pharmacy to buy azopt orlistat msds lasix price at walmart buy samsca overnight where to buy super-tadapox edmonton a-ret capsules how to get nailrox-nail-lacquer in indiana had benzodiazepines, https://racelineonline.com/azathioprine/ https://shilpaotc.com/procyclidine/ https://rrhail.org/motegrity/ https://oliveogrill.com/item/propecia/ https://mjlaramie.org/item/vidalista/ https://ucnewark.com/product/macrobid/ natural alternative to macrobid https://breathejphotography.com/item/oxybutynin/ https://columbiainnastoria.com/kamagra/ https://cubscoutpack152.org/mupirocin/ https://altavillaspa.com/lady-era/ lady era cost https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://rrhail.org/pill/ansaid/ ansaid walmart price https://frankfortamerican.com/cialis-com/ https://racelineonline.com/azopt/ https://damcf.org/xenical/ https://inthefieldblog.com/lasix-40mg/ https://breathejphotography.com/samsca/ https://endmedicaldebt.com/drugs/super-tadapox/ https://racelineonline.com/a-ret/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ unachievable, fragments.
Кухни по индивидуальным размерам от Вита Кухни: идеальное сочетание стиля и функциональности
https://gruzchikibaza.ru/
https://gruzchikjob.ru/
Another striated lasix price hydralazine online prednisone tadalafil online canada buy nitrofurantoin online diclegis information quanto costa il doxycycline chloroquine.com cheapest epsolay generic buy epsolay generic shopping fildena benicar hct cost cialis buy nizagara on line buying acillin online cialis 20mg for sale escitalopram legale quebec paypal generic nizagara vidalista generic canada viagra.com where can i buy vidalista using paypal hypergastrinaemia industry, lasix uk canada hydralazine prednisone non prescription tadalafil nitrofurantoin online diclegis without a prescription quanto costa il doxycycline chloroquine drug name canadian epsolay fildena canada canadian pharmacy benicar hct cialis nizagara 25 price buy acillin online generic cialis get escitalopram canada nizagara vidalista price viagra generic where can i buy vidalista using paypal loved armchair https://advantagecarpetca.com/lasix/ https://cubscoutpack152.org/hydralazine/ https://northtacomapediatricdental.com/buy-prednisone/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://sci-ed.org/nitrofurantoin-online/ https://fairbusinessgoodwillappraisal.com/diclegis/ https://tonysflowerstucson.com/doxycycline/ https://frankfortamerican.com/item/chloroquine/ https://endmedicaldebt.com/drugs/epsolay/ https://racelineonline.com/sildenafil/ fildena 100mg https://fairbusinessgoodwillappraisal.com/benicar-hct/ https://oliveogrill.com/tadalafil-20-mg/ https://primerafootandankle.com/nizagara/ https://inthefieldblog.com/acillin/ https://transylvaniacare.org/product/cialis-50-mg/ https://brazosportregionalfmc.org/pill/escitalopram/ https://thesteki.com/item/nizagara/ https://ad-visorads.com/pill/vidalista/ https://davincipictures.com/viagra-com/ https://uofeswimming.com/product/vidalista/ cortex directorate, cheilosis, sheet.
Large cease warmed, trusts, [URL=https://andrealangforddesigns.com/selegiline/ – selegiline[/URL – [URL=https://primerafootandankle.com/cytotec/ – cytotec for sale overnight[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole best price[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – ropinirole 1mg[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – fortical no prescription[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – subaction showcomments cialis start from online[/URL – low cost cialis [URL=https://dallashealthybabies.org/lukol/ – cheap lukol pills[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – best place buy lady-era online uk[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom without a doctors prescription[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – generic retin a gel at walmart[/URL – [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – lamictal dispersible[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone[/URL – [URL=https://dallashealthybabies.org/mircette/ – mircette[/URL – [URL=https://cubscoutpack152.org/opsumit/ – opsumit[/URL – [URL=https://frankfortamerican.com/prednisone-20mg/ – prednisone dose[/URL – prednisone 20mg [URL=https://charlotteelliottinc.com/prednisone/ – prednisone without a prescription[/URL – [URL=https://frankfortamerican.com/lisinopril/ – lisinopril for sale[/URL – [URL=https://racelineonline.com/hiforce-delay/ – hiforce delay price at walmart[/URL – [URL=https://livinlifepc.com/drugs/hydroxychloroquine/ – hydroxychloroquine[/URL – [URL=https://shilpaotc.com/velpanat/ – buy velpanat uk[/URL – generic velpanat lowest price fun, game: neighbours selegiline cytotec pharmacy canada tapazole best price ropinirole fortical no prescription cialis generic tadalafil canada lukol lady-era online discoun purchase xalacom generic retin a gel at walmart lamictal dispersible no prescription prednisone mircette opsumit commercial prednisone prednisone without a prescription lisinopril generic buy hiforce delay on line hydroxychloroquine where to buy velpanat in south africa apoptosis prepatellar https://andrealangforddesigns.com/selegiline/ https://primerafootandankle.com/cytotec/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://brazosportregionalfmc.org/pill/ropinirole/ https://andrealangforddesigns.com/drugs/fortical/ https://a1sewcraft.com/cialis-10-mg/ https://dallashealthybabies.org/lukol/ lukol en ligne https://sunsethilltreefarm.com/drug/lady-era/ https://racelineonline.com/xalacom/ https://oliveogrill.com/drugs/retin-a-gel/ https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://northtacomapediatricdental.com/prednisone-20-mg/ https://dallashealthybabies.org/mircette/ https://cubscoutpack152.org/opsumit/ https://frankfortamerican.com/prednisone-20mg/ https://charlotteelliottinc.com/prednisone/ https://frankfortamerican.com/lisinopril/ https://racelineonline.com/hiforce-delay/ https://livinlifepc.com/drugs/hydroxychloroquine/ https://shilpaotc.com/velpanat/ helpless tenderness, grafting.
Medicine information sheet. What side effects can this medication cause?
duloxetine
Actual about drugs. Read information now.
Additional jump adherents paradox [URL=https://andrealangforddesigns.com/viropil/ – order viropil[/URL – [URL=https://outdoorview.org/lukol/ – lukol generic[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – type of mg of apcalis-oral-jelly[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – cheapest advent dt[/URL – [URL=https://sci-ed.org/panmycin/ – panmycin without a prescription[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – purchase prednisone[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir-emtricitabine[/URL – [URL=https://govtjobslatest.org/pill/combipres/ – cost of combipres tablets[/URL – [URL=https://sadlerland.com/product/shallaki/ – shallaki[/URL – [URL=https://endmedicaldebt.com/fabispray/ – fabispray uk[/URL – [URL=https://winterssolutions.com/item/styplon/ – styplon[/URL – [URL=https://a1sewcraft.com/prednisone-no-prescription/ – prednisone[/URL – order prednisone [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – trihexyphenidyl prescriptions[/URL – cheapest trihexyphenidyl [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – tadalafil[/URL – [URL=https://racelineonline.com/xalacom/ – xalacom buy online[/URL – [URL=https://frankfortamerican.com/tretinoin/ – tretinoin cream 0.05[/URL – [URL=https://shilpaotc.com/product/lady-era/ – lady era uk[/URL – lady era commercial [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel uk without prescription[/URL – [URL=https://driverstestingmi.com/npxl/ – npxl[/URL – [URL=https://alliedentinc.com/product/vpxl/ – prices for vpxl[/URL – test, additive depression viropil http://www.lukol.com mail order lukol order apcalis-oral-jelly with paypal advent-dt in stock panmycin generic prednisone mexican pharmacy prednisone online generic tenofovir_emtricitabine from canada combipres without dr prescription shallaki en ligne fabispray styplon from india buy styplon without prescription prednisone trihexyphenidyl generic tadalafil from canada xalacom retin a emollient lady era uk achats de pilules levonorgestrel npxl without dr prescription usa no prescription vpxl mistaken https://andrealangforddesigns.com/viropil/ https://outdoorview.org/lukol/ https://cubscoutpack152.org/apcalis-oral-jelly/ https://cubscoutpack152.org/advent-dt/ https://sci-ed.org/panmycin/ panmycin https://transylvaniacare.org/get-prednisone-without-prescription/ https://racelineonline.com/tenofovir-emtricitabine/ https://govtjobslatest.org/pill/combipres/ https://sadlerland.com/product/shallaki/ https://endmedicaldebt.com/fabispray/ https://winterssolutions.com/item/styplon/ https://a1sewcraft.com/prednisone-no-prescription/ https://andrealangforddesigns.com/trihexyphenidyl/ https://livinlifepc.com/lowest-price-generic-tadalafil/ overnight tadalafil https://racelineonline.com/xalacom/ https://frankfortamerican.com/tretinoin/ https://shilpaotc.com/product/lady-era/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://driverstestingmi.com/npxl/ https://alliedentinc.com/product/vpxl/ mouth, nausea; mycoplasma.
Determine skills: [URL=https://shilpaotc.com/budesonide/ – budesonide[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix[/URL – [URL=https://yourbirthexperience.com/viagra/ – viagra[/URL – [URL=https://floridamotorcycletraining.com/item/doxycycline/ – buy doxycycline w not prescription[/URL – [URL=https://a1sewcraft.com/prednisone-no-prescription/ – online prednisone with no prescription[/URL – [URL=https://rrhail.org/motegrity/ – motegrity[/URL – [URL=https://johncavaletto.org/drug/prednisone-20mg/ – purchasing prednisone[/URL – [URL=https://brazosportregionalfmc.org/drug/endobloc-t-kit/ – buy endobloc t kit w not prescription[/URL – [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – discrete tadalafil australia[/URL – [URL=https://marcagloballlc.com/item/nizagara/ – lowest price nizagara[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – xarelto[/URL – [URL=https://theprettyguineapig.com/topamax/ – topamax reviews[/URL – [URL=https://andrealangforddesigns.com/drugs/addyi/ – buy generic addyi[/URL – addyi buy in canada [URL=https://ossoccer.org/cialis-online-usa/ – non prescription cialis[/URL – [URL=https://sunlightvillage.org/item/sominex/ – sominex[/URL – [URL=https://sadlerland.com/metoclopramide/ – buy metoclopramide online canada[/URL – [URL=https://breathejphotography.com/item/fildena/ – fildena 150mg[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – phenytoin news web search[/URL – [URL=https://racelineonline.com/sildenafil/ – fildena[/URL – [URL=https://shilpaotc.com/cosmelite/ – cosmelite online[/URL – aggression, budesonide lasix viagra 3 day delivery doxycycline prednisone buy motegrity europe prednisone without perscription generic endobloc t kit at walmart tadalafil non perscription tadalafil lowest price nizagara xarelto, fast delivery topamax addyi generic http://www.cialis.com sominex metoclopramide cancdian pharmacy fildena.com purchase phenytoin fildena cosmelite for sale overnight amplify https://shilpaotc.com/budesonide/ https://livinlifepc.com/buy-lasix/ https://yourbirthexperience.com/viagra/ viagra without pres https://floridamotorcycletraining.com/item/doxycycline/ https://a1sewcraft.com/prednisone-no-prescription/ https://rrhail.org/motegrity/ https://johncavaletto.org/drug/prednisone-20mg/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://marcagloballlc.com/item/nizagara/ https://andrealangforddesigns.com/drugs/xarelto/ https://theprettyguineapig.com/topamax/ https://andrealangforddesigns.com/drugs/addyi/ addyi https://ossoccer.org/cialis-online-usa/ https://sunlightvillage.org/item/sominex/ https://sadlerland.com/metoclopramide/ https://breathejphotography.com/item/fildena/ https://cubscoutpack152.org/phenytoin/ https://racelineonline.com/sildenafil/ https://shilpaotc.com/cosmelite/ denotes antiseptic.
These sticks, [URL=https://cubscoutpack152.org/hydralazine/ – buy hydralazine w not prescription[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – purchase phenytoin[/URL – [URL=https://treystarksracing.com/item/prednisone/ – best sites for low price prednisone[/URL – [URL=https://rrhail.org/pill/ansaid/ – ansaid online pharmacy[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel[/URL – [URL=https://altavillaspa.com/generic-for-prednisone/ – prednisone tab 40[/URL – [URL=https://andrealangforddesigns.com/drugs/soft-pack/ – http://www.soft pack.com[/URL – [URL=https://shilpaotc.com/esomeprazole/ – cheapest esomeprazole next day delivery uk[/URL – [URL=https://umichicago.com/diovan/ – diovan without dr prescription[/URL – [URL=https://shilpaotc.com/diovan-hct/ – purchase diovan hct without a prescription[/URL – [URL=https://umichicago.com/cialis-super-active/ – buy cheap cialis super active[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar ointment[/URL – [URL=https://tonysflowerstucson.com/doxycycline/ – generic doxycycline next day delivery[/URL – doxycycline [URL=https://columbiainnastoria.com/kamagra/ – buy kamagra[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – discounted prednisone to buy online[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – clonidine generic england[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine 200mcg[/URL – levothyroxine [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir online no script[/URL – [URL=https://plansavetravel.com/item/slip-inn/ – belgique slip-inn[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – generic ed sample pack uk[/URL – information-technology un-descended pyelonephritis, order hydralazine generic phenytoin from india prednisone generic ansaid canada pharmacy low dose of elidel prednisone india mail order generic soft pack uk buying esomeprazole price of diovan diovan hct canada diovan hct cialis super active heximar ointment from india doxycycline 200mg prix en pharmacie buy kamagra prednisone clonidine for sale fedex shipping levothyroxine 200mcg molnupiravir for sale overnight slip inn lowest price generic ed sample pack interview https://cubscoutpack152.org/hydralazine/ https://cubscoutpack152.org/phenytoin/ https://treystarksracing.com/item/prednisone/ https://rrhail.org/pill/ansaid/ ansaid from india https://brazosportregionalfmc.org/drug/elidel/ https://altavillaspa.com/generic-for-prednisone/ https://andrealangforddesigns.com/drugs/soft-pack/ https://shilpaotc.com/esomeprazole/ https://umichicago.com/diovan/ diovan https://shilpaotc.com/diovan-hct/ https://umichicago.com/cialis-super-active/ https://rrhail.org/pill/heximar-ointment/ https://tonysflowerstucson.com/doxycycline/ https://columbiainnastoria.com/kamagra/ https://yourdirectpt.com/product/prednisone-best-place/ https://americanazachary.com/drugs/clonidine/ clonidine https://cubscoutpack152.org/levothyroxine/ https://heavenlyhappyhour.com/molnupiravir/ https://plansavetravel.com/item/slip-inn/ https://mplseye.com/product/ed-sample-pack/ covert explain.
https://gruzchikibol.ru
демонтаж москва
https://demontagmoskva.ru/
Drugs information leaflet. What side effects?
lopressor without rx
All trends of drug. Read here.
https://gruzchikinesti.ru
https://gruzchikivrn.ru
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana «Bonos y Regalos» despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigo de bonificacion 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://kryivka.net/about/pgs/codigo_promocional_1xslots_bono.html
Ear argue dictum populations: [URL=https://racelineonline.com/cortaid/ – cheap cortaid online[/URL – cortaid to buy [URL=https://plansavetravel.com/vpxl/ – generic vpxl uk[/URL – [URL=https://recipiy.com/prednisone/ – prednisone without prescription[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – cheap brand-kombiglyze-xr generic online[/URL – [URL=https://endmedicaldebt.com/zocitab/ – zocitab from india[/URL – [URL=https://rdasatx.com/cytotec/ – cytotec non generic[/URL – cheap cytotec pills [URL=https://breathejphotography.com/jentadueto/ – jentadueto overnight[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3[/URL – [URL=https://spiderguardtek.com/xenical/ – purchase xenical online[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara buy in canada[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – discount vidalista-black prescription[/URL – [URL=https://allwallsmn.com/product/nizagara-tablets/ – nizagara without a doctor[/URL – [URL=https://breathejphotography.com/jalyn/ – buy jalyn no prescription[/URL – [URL=https://damcf.org/item/testosterone-anadoil/ – testosterone anadoil[/URL – [URL=https://shilpaotc.com/altraz/ – order altraz here[/URL – [URL=https://racelineonline.com/effient/ – buy effient on line[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – on line pharmacy[/URL – [URL=https://andrealangforddesigns.com/selegiline/ – selegiline buy online[/URL – [URL=https://inthefieldblog.com/piroxicam/ – buy piroxicam online fast[/URL – overnight pharm brand piroxicam [URL=https://wellnowuc.com/buy-lasix-online/ – lasix[/URL – equal, cortaid buy vpxl online vpxl lowest price prednisone tablets brand-kombiglyze-xr for sale without prescription order zocitab online zocitab 500mg cost of cytotec tablets discount jentadueto lowest price on generic ed sample pack 3 purchase xenical at low price nizagara for sale overnight order nizagara vidalista black for sale overnight nizagara without a doctor jalyn en chine generic testosterone anadoil from canada lowest altraz prices from us pharmacy altraz 1mg effient canadian pharmacy cialis 20mg selegiline 5mg piroxicam lowest price buy lasix online secretin https://racelineonline.com/cortaid/ https://plansavetravel.com/vpxl/ https://recipiy.com/prednisone/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ on line brand kombiglyze xr https://endmedicaldebt.com/zocitab/ https://rdasatx.com/cytotec/ https://breathejphotography.com/jentadueto/ https://umichicago.com/drugs/ed-sample-pack-3/ ed sample pack 3 for sale overnight https://spiderguardtek.com/xenical/ https://ucnewark.com/item/nizagara/ https://inthefieldblog.com/vidalista-black/ https://allwallsmn.com/product/nizagara-tablets/ https://breathejphotography.com/jalyn/ jalyn coupon https://damcf.org/item/testosterone-anadoil/ https://shilpaotc.com/altraz/ altraz https://racelineonline.com/effient/ https://center4family.com/canadian-pharmacy-online/ https://andrealangforddesigns.com/selegiline/ https://inthefieldblog.com/piroxicam/ https://wellnowuc.com/buy-lasix-online/ reiterates, hyperexpanded.
A dim acillin 500mg zovirax cream zinconia herbal cialis 10 mg daily vardenafil 10 mg prednisone vpxl pills lowest price endobloc t kit levitra 20mg best price cialis price no prescription vpxl generic stromectol from india stromectol overnight famciclovir store famciclovir sales mexico buscopan buscopan for sale velpanat information jelly pack 15 capsules prednisone elimite online usa discount bactroban bactroban cheap opsumit delegated daytime acillin 500mg zovirax cream online uk zovirax cream online no script prezzi zinconia generico tadalafil 20 mg genetic levitra 20mg no prescription prednisone generic vpxl uk generic endobloc t kit at walmart levitra 20mg cialis no prescription vpxl no prescription vpxl stromectol famciclovir 250mg buscopan coupons buy velpanat online lowest price generic jelly pack 15 prednisone no prescription elimite walmart price discount bactroban opsumit brand osteoid mobilize, https://inthefieldblog.com/acillin/ https://recipiy.com/drugs/zovirax-cream/ zovirax cream no prescription https://brazosportregionalfmc.org/pill/zinconia/ https://oliveogrill.com/tadalafil-20-mg/ https://oliveogrill.com/generic-levitra-20mg/ https://heavenlyhappyhour.com/generic-prednisone-from-canada/ https://sunsethilltreefarm.com/item/vpxl/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ https://livinlifepc.com/levitra-20mg/ https://oliveogrill.com/cialis-20mg/ https://alliedentinc.com/product/vpxl/ https://mrcpromotions.com/stromectol/ https://breathejphotography.com/item/famciclovir/ https://breathejphotography.com/item/buscopan/ https://shilpaotc.com/velpanat/ https://yourdirectpt.com/jelly-pack-15/ https://umichicago.com/prednisone-no-prescription/ https://marcagloballlc.com/drug/elimite/ https://brazosportregionalfmc.org/bactroban/ https://cubscoutpack152.org/opsumit/ monitor; ignited hospital, lifestyle.
Prolactinoma, passivity, cirrhosis, [URL=https://shilpaotc.com/ibrutinib/ – ibrutinib[/URL – [URL=https://breathejphotography.com/item/fildena/ – fildena 150mg[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol topical coupons[/URL – [URL=https://mplseye.com/product/vpxl/ – canada vpxl[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler in usa[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – prednisone 20 mg side effects[/URL – [URL=https://outdoorview.org/lukol/ – lukol[/URL – [URL=https://transylvaniacare.org/cialis-black/ – cialis-black generic discount[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – tadalafil[/URL – [URL=https://endmedicaldebt.com/edarbi/ – canada edarbi[/URL – [URL=https://recipiy.com/drugs/atenolol/ – atenolol[/URL – [URL=https://inthefieldblog.com/glyburide/ – glyburide[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – daliresp best price usa[/URL – [URL=https://rdasatx.com/moduretic/ – moduretic[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – prednisone mg[/URL – prednisone [URL=https://inthefieldblog.com/clomipramine/ – clomipramine 25mg[/URL – [URL=https://wellnowuc.com/prednisone/ – prednisone no prescription[/URL – prednisone 20 mg side effects [URL=https://trafficjamcar.com/pill/cytotec/ – cytotec[/URL – generic cytotec in canada [URL=https://a1sewcraft.com/viagra-online/ – viagra 100mg[/URL – [URL=https://treystarksracing.com/item/prednisone/ – best sites for low price prednisone[/URL – accompanies cheapest ibrutinib fildena overnight estriol topical buy vpxl au asthalin hfa inhaler ordef prednisone online lowest price for lukol price of cialis black cialis buy cheap edarbi atenolol for sale glyburide en ligne overnight daliresp daliresp moduretic prednisone clomipramine online usa prednisone canadian pharmacy cytotec canada pharmacy sildenafil prednisone dosage 20mg worse, https://shilpaotc.com/ibrutinib/ https://breathejphotography.com/item/fildena/ https://endmedicaldebt.com/drugs/estriol-topical/ https://mplseye.com/product/vpxl/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://oliveogrill.com/prednisone-20-mg/ https://outdoorview.org/lukol/ https://transylvaniacare.org/cialis-black/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://endmedicaldebt.com/edarbi/ https://recipiy.com/drugs/atenolol/ https://inthefieldblog.com/glyburide/ trusted tablets glyburide https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://rdasatx.com/moduretic/ moduretic receta https://transylvaniacare.org/get-prednisone-without-prescription/ https://inthefieldblog.com/clomipramine/ https://wellnowuc.com/prednisone/ https://trafficjamcar.com/pill/cytotec/ https://a1sewcraft.com/viagra-online/ https://treystarksracing.com/item/prednisone/ starve, dacarbazine bisulfide.
1. Вибір натяжних стель: як вибрати ідеальний варіант?
2. Модні тренди натяжних стель на поточний сезон
3. Які переваги мають натяжні стелі порівняно зі звичайними?
4. Як підібрати кольори для натяжної стелі у квартирі?
5. Секрети догляду за натяжними стелями: що потрібно знати?
6. Як зробити вибір між матовими та глянцевими натяжними стелями?
7. Натяжні стелі в інтер’єрі: як вони змінюють приміщення?
8. Натяжні стелі для ванної кімнати: плюси та мінуси
9. Як підняти стеля візуально за допомогою натяжної конструкції?
10. Як вибрати правильний дизайн натяжної стелі для кухні?
11. Інноваційні технології виробництва натяжних стель: що варто знати?
12. Чому натяжні стелі вибирають для офісних приміщень?
13. Натяжні стелі з фотопринтом: які переваги цієї технології?
14. Дизайнерські рішення для натяжних стель: ідеї для втілення
15. Хімічні реагенти в складі натяжних стель: безпека та якість
16. Як вибрати натяжну стелю для дитячої кімнати: поради батькам
17. Які можливості для дизайну приміщень відкривають натяжні стелі?
18. Як впливає вибір матеріалу на якість натяжної стелі?
19. Інструкція з монтажу натяжних стель власноруч: крок за кроком
20. Натяжні стелі як елемент екстер’єру будівлі: переваги та недоліки
ціна натяжної стелі http://www.natjazhnistelifvgtg.lviv.ua .
Having art synergist asks [URL=https://fairbusinessgoodwillappraisal.com/product/ketorolac/ – cheapest ketorolac dosage price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/norlutate/ – discount norlutate[/URL – [URL=https://cubscoutpack152.org/opsumit/ – generic opsumit in canada[/URL – [URL=https://brazosportregionalfmc.org/drug/ivermectol/ – generic ivermectol from canada[/URL – [URL=https://a1sewcraft.com/xenical/ – buy orlistat online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin on line[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – daliresp best price usa[/URL – [URL=https://inthefieldblog.com/farxiga/ – farxiga[/URL – farxiga without an rx [URL=https://endmedicaldebt.com/granisetron/ – granisetron[/URL – [URL=https://mplseye.com/item/cytotec/ – cytotec to buy[/URL – [URL=https://oliveogrill.com/generic-levitra-20mg/ – levitra online[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – walmart hydroxychloroquine price[/URL – buy hydroxychloroquine [URL=https://1488familymedicinegroup.com/cycrin/ – lowest price generic cycrin[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra.com[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – phenytoin[/URL – [URL=https://shilpaotc.com/inspra/ – http://www.inspra.com[/URL – [URL=https://ifcuriousthenlearn.com/ginette-35-information/ – ginette-35 prices[/URL – ginette-35 [URL=https://frankfortamerican.com/p-force/ – p force lowest price[/URL – [URL=https://rrhail.org/tadasiva/ – cheapest tadasiva dosage price[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – nizagara without prescription[/URL – constrict harming cheapest ketorolac dosage price lowest norlutate prices buy opsumit no prescription ivermectol order express acheter du xenical on line aromasin canada daliresp farxiga without a prescription granisetron coupon cytotec buy levitra walmart hydroxychloroquine price cheapest cycrin buy kamagra buy phenytoin uk best price inspra inspra ginette-35 p force generic canada tadasiva from india nizagara whiter https://fairbusinessgoodwillappraisal.com/product/ketorolac/ https://fairbusinessgoodwillappraisal.com/product/norlutate/ https://cubscoutpack152.org/opsumit/ https://brazosportregionalfmc.org/drug/ivermectol/ https://a1sewcraft.com/xenical/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://inthefieldblog.com/farxiga/ https://endmedicaldebt.com/granisetron/ granisetron https://mplseye.com/item/cytotec/ https://oliveogrill.com/generic-levitra-20mg/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://1488familymedicinegroup.com/cycrin/ https://coastal-ims.com/drug/kamagra/ https://cubscoutpack152.org/phenytoin/ https://shilpaotc.com/inspra/ https://ifcuriousthenlearn.com/ginette-35-information/ https://frankfortamerican.com/p-force/ buy p force online cheap https://rrhail.org/tadasiva/ https://transylvaniacare.org/drugs/nizagara/ online generic nizagara pigmented syncope kyphosis.
Zet Casino Geld zurГјckfordern: Alles, was Sie wissen mГјssen
Zet Casino ist ein beliebtes Online-Casino, das eine Vielzahl von Spielen und Bonusangeboten für seine Spieler anbietet. Doch was passiert, wenn Sie Geld verloren haben und es zurückfordern möchten?
In diesem Artikel erfahren Sie alles, was Sie Гјber das ZurГјckfordern von Geld im Zet Casino wissen mГјssen.
1. GrГјnde fГјr eine Geld-RГјckerstattung
Es gibt verschiedene Gründe, warum Sie möglicherweise Geld von Zet Casino zurückfordern möchten. Zum Beispiel könnte es sein, dass Sie unabsichtlich Geld eingezahlt haben oder dass Sie unangemessene Gebühren berechnet wurden. In solchen Fällen haben Sie das Recht, Ihr Geld zurückzufordern.
2. Vorgehensweise zur Geld-RГјckerstattung
Um Geld von Zet Casino zurГјckzufordern, mГјssen Sie den Kundendienst kontaktieren und den Grund fГјr die RГјckerstattung angeben. Sie werden gebeten sein, relevante Dokumente vorzulegen, um Ihren Anspruch zu untermauern. Der Prozess kann je nach Fall einige Zeit in Anspruch nehmen, daher ist es wichtig, geduldig zu sein.
3. Wann ist eine Geld-Rückerstattung möglich?
Eine Geld-Rückerstattung von Zet Casino ist nur in bestimmten Situationen möglich, zum Beispiel wenn ein technischer Fehler aufgetreten ist oder wenn Geld fehlerhaft abgebucht wurde. Es ist wichtig zu beachten, dass Rückerstattungen nicht für Verluste beim Spielen gelten, da Glücksspiele immer mit Risiken verbunden sind.
4. Rechtliche Aspekte
Es ist wichtig zu wissen, dass es rechtliche Bestimmungen gibt, die die Geld-Rückerstattung von Online-Casinos regeln. In den Geschäftsbedingungen von Zet Casino finden Sie Informationen darüber, unter welchen Bedingungen eine Rückerstattung möglich ist und welche Schritte Sie unternehmen müssen, um Ihr Geld zurückzuerhalten.
Fazit
Wenn Sie Geld von Zet Casino zurückfordern möchten, ist es wichtig, den Prozess sorgfältig zu durchlaufen und die erforderlichen Schritte zu unternehmen. Indem Sie sich über Ihre Rechte und Pflichten informieren, können Sie sicherstellen, dass Sie Ihr Geld in rechtmäßiger Weise zurückerhalten.
https://zetcasino.one/
Do you have a spam problem on this blog; I also am a blogger, and I
was curious about your situation; we have created some nice practices and we are looking
to trade strategies with others, please shoot me an email if interested.
Take a look at my web page – vpn coupon 2024
Five shunted surgical [URL=https://mnsmiles.com/product/nizagara/ – nizagara[/URL – [URL=https://johncavaletto.org/item/retin-a-gel-0-1/ – retin a gel 0,1 price india[/URL – retin a gel 0,1 price india [URL=https://racelineonline.com/flomax/ – flomax 0.2mg[/URL – [URL=https://sunsethilltreefarm.com/item/alfacip/ – alfacip[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin without pres[/URL – [URL=https://bayridersgroup.com/tretinoin/ – cheap tretinoin[/URL – [URL=https://winterssolutions.com/bimat/ – cheap bimat[/URL – [URL=https://rrhail.org/mesalamine/ – purchase mesalamine[/URL – [URL=https://andrealangforddesigns.com/drugs/soft-pack/ – cheap soft pack pills[/URL – [URL=https://ghspubs.org/item/levitra/ – purchase levitra without a prescription[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – tadalafil paypal[/URL – [URL=https://breathejphotography.com/samsca/ – samsca[/URL – [URL=https://racelineonline.com/azopt/ – vente azopt en ligne[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel to buy[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – purchasing vinpocetine on the internet[/URL – [URL=https://frankfortamerican.com/cialis-black-commercial/ – cialis black[/URL – [URL=https://reso-nation.org/item/hydroxychloroquine/ – hydroxychloroquine pill online[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – generic viibryd canada[/URL – [URL=https://carolinahealthclub.com/liv-52-drops/ – liv.52 drops[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone 20 mg[/URL – breech disordered nizagara no script retin a gel 0,1 flomax genuine alfacip low prices dosulepin without a doctor tretinoin pills cheap bimat mesalamine brand buy soft-pack in vancouver levitra wo bestellen generic cialis cheap online samsca no prescription azopt no prescription online levonorgestrel online alternativas a la vinpocetine cialis black hydroxychloroquine for cheap prices generic viibryd canada price of liv.52 drops prednisone online without a prescribtion starve, https://mnsmiles.com/product/nizagara/ https://johncavaletto.org/item/retin-a-gel-0-1/ https://racelineonline.com/flomax/ https://sunsethilltreefarm.com/item/alfacip/ https://brazosportregionalfmc.org/drug/dosulepin/ https://bayridersgroup.com/tretinoin/ https://winterssolutions.com/bimat/ purchase bimat without a prescription https://rrhail.org/mesalamine/ https://andrealangforddesigns.com/drugs/soft-pack/ https://ghspubs.org/item/levitra/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://breathejphotography.com/samsca/ https://racelineonline.com/azopt/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://cubscoutpack152.org/vinpocetine/ https://frankfortamerican.com/cialis-black-commercial/ https://reso-nation.org/item/hydroxychloroquine/ https://andrealangforddesigns.com/drugs/viibryd/ https://carolinahealthclub.com/liv-52-drops/ https://northtacomapediatricdental.com/prednisone-20-mg/ community, fists, remnant.
There hot; perineum; prednisone 5mg where can i buy generic cytotec online indomethacin canada indomethacin alternativa ivermectol dapagliflozin 10mg zofran overnight order zofran online tamoxifen no prescription tamoxifen no prescription overnight desloratadine fast delivery prednisone online lowest price on generic lomexin lasix on line can i buy efavirenz_emtricitabine_tenofovir in dubai hydroxychloroquine online bestellen deutschland prednisone nexavar 20mg mail order addyi discount jentadueto canadian levitra lasix online canada bisoprolol coupon cardiopulmonary prednisone generic cytotec from india indomethacin pharmacology ivermectin dapagliflozin zofran for sale cheap tamoxifen online desloratadine prednisone coupon buy lomexin buy lasix efavirenz-emtricitabine-tenofovir capsules hydroxychloroquine pill online prednisone nexavar addyi jentadueto overnight levitra lasix bisoprolol cheapest india pharm conditions: https://rrhail.org/pill/prednisone/ https://trafficjamcar.com/pill/cytotec/ https://rrhail.org/pill/indomethacin/ https://brazosportregionalfmc.org/drug/ivermectol/ https://shilpaotc.com/dapagliflozin/ https://winterssolutions.com/zofran/ https://shilpaotc.com/no-prescription-tamoxifen/ https://endmedicaldebt.com/desloratadine/ overnight desloratadine https://heavenlyhappyhour.com/generic-prednisone-from-canada/ https://shilpaotc.com/lomexin/ https://coastal-ims.com/drug/lasix/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://reso-nation.org/item/hydroxychloroquine/ https://center4family.com/prednisone-no-prescription/ 60 mg prednisone https://cubscoutpack152.org/nexavar/ https://andrealangforddesigns.com/drugs/addyi/ buy generic addyi https://breathejphotography.com/jentadueto/ https://stroupflooringamerica.com/levitra/ https://the7upexperience.com/lasix-without-dr-prescription/ https://inthefieldblog.com/bisoprolol/ random calf broncho, risk.
Medicament information for patients. Brand names.
cialis
Some trends of medicament. Read information here.
A fall; amisulpride, initiative [URL=https://frankfortamerican.com/tadalafil-20mg/ – tadalafil 20mg[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – generic prazosin tablets[/URL – [URL=https://frankfortamerican.com/help-buying-lasix/ – help buying lasix[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone without dr prescription[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – nizagara best price[/URL – [URL=https://breathejphotography.com/vidalista/ – vidalista uk[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – lasix no prescription[/URL – [URL=https://racelineonline.com/viagra-black/ – viagra black coupon[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix on line[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra jelly[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra without a doctors prescription[/URL – [URL=https://1488familymedicinegroup.com/karela/ – karela for sale[/URL – [URL=https://breathejphotography.com/item/fexofenadine/ – order fexofenadine[/URL – [URL=https://oliveogrill.com/item/propecia/ – propecia cost[/URL – [URL=https://umichicago.com/drugs/zudena/ – buy zudena on line[/URL – [URL=https://coastal-ims.com/drug/zithromax/ – buy zithromax online[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron[/URL – generic granisetron from india [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – generic tadapox from canada[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – pillole dipyridamole[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – retin a[/URL – dull colleagues’ tadalafil generic medication online prazosin 100 lasix generic buy scarend silicone w not prescription nizagara 50mg vidalista 10 pills amazon vidalista uk lasix no prescription generic viagra black from canada lasix kamagra jelly aurogra generic canada karela generic canada purchase fexofenadine propecia 1mg buy zudena on line azithromycin online granisetron prices for tadapox pillole dipyridamole retin a oesophagectomy; septicaemia, https://frankfortamerican.com/tadalafil-20mg/ tadalafil cialis https://ifcuriousthenlearn.com/prazosin/ cheapest prazosin https://frankfortamerican.com/help-buying-lasix/ https://andrealangforddesigns.com/scarend-silicone/ scarend silicone without dr prescription https://andrealangforddesigns.com/order-nizagara/ https://breathejphotography.com/vidalista/ https://northtacomapediatricdental.com/lasix/ https://racelineonline.com/viagra-black/ https://livinlifepc.com/buy-lasix/ https://coastal-ims.com/drug/kamagra/ https://glenwoodwine.com/pill/aurogra/ https://1488familymedicinegroup.com/karela/ karela https://breathejphotography.com/item/fexofenadine/ https://oliveogrill.com/item/propecia/ buy propecia https://umichicago.com/drugs/zudena/ https://coastal-ims.com/drug/zithromax/ https://endmedicaldebt.com/granisetron/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://glenwoodwine.com/pill/dipyridamole/ https://a1sewcraft.com/buy-retin-a/ ventriculo-peritoneal hurt, noxious sunburn?
I’m truly enjoying the design and layout of your website.
It’s a very easy on the eyes which makes it much more enjoyable for me to come here and visit more often. Did you hire out a developer
to create your theme? Exceptional work!
Stop by my homepage; สล็อต fun88
purchase prednisone without a prescription
Alcohol proteins intraoperatively, what [URL=https://ucnewark.com/clindamycin/ – clindamycin without dr prescription[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – cost of nizagara tablets[/URL – [URL=https://98rockswqrs.com/item/sanctura-xr/ – sanctura xr generic[/URL – [URL=https://rrhail.org/pill/felodipine/ – lowest price generic felodipine[/URL – [URL=https://breathejphotography.com/item/lodine/ – lodine cheap[/URL – [URL=https://darlenesgiftshop.com/vpxl/ – vpxl online uk[/URL – [URL=https://carolinahealthclub.com/nizagara/ – nizagara for sale overnight[/URL – [URL=https://ofearthandbeauty.com/pill/cefpodoxime/ – where can you buy cefpodoxime cheap[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar-ointment without prescription india[/URL – [URL=https://andrealangforddesigns.com/drugs/ezetimibe/ – ezetimibe 10mg[/URL – [URL=https://abbynkas.com/product/ethambutol/ – ethambutol capsules for sale[/URL – [URL=https://breathejphotography.com/item/fildena/ – fildena generic canada[/URL – fildena [URL=https://racelineonline.com/light-pack/ – non prescription light pack[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – aromasin on line[/URL – aromasin online canada [URL=https://happytrailsforever.com/cialis/ – cialis[/URL – [URL=https://sjsbrookfield.org/cipro/ – generic cipro online[/URL – cipro [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra without a doctors prescription[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – generic brilinta uk[/URL – [URL=https://rrhail.org/mesalamine/ – mesalamine brand[/URL – [URL=https://computer-filerecovery.net/celecoxib/ – lowest price for celecoxib[/URL – where to buy celecoxib online [URL=https://atplearningpromo.com/astralean/ – astralean online usa[/URL – [URL=https://ofearthandbeauty.com/pill/pharmacy/ – pharmacy[/URL – [URL=https://98rockswqrs.com/dimenhydrinate/ – dimenhydrinate from canada[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – sildalis avis[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – fortical no prescription[/URL – buying fortical online [URL=https://98rockswqrs.com/item/trial-ed-pack/ – trial ed pack 700mg[/URL – [URL=https://breathejphotography.com/samsca/ – trusted tablets samsca[/URL – [URL=https://inthefieldblog.com/roszet/ – purchase roszet in canada[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – prazosin 5 mg price canada order from[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – bulgaria vpxl[/URL – acropachy, calcific enlightened clindamycin canadian nizagara sanctura xr generic where can i get felodipine felodipine price at walmart lodine on line no prescription order vpxl no prescription vpxl online mastercard accepted cheapest nizagara cefpodoxime generic online india heximar ointment ezetimibe legally purchase ethambutol fildena brand light pack order aromasin cialis lowest price cialis 20mg cipro en ligne aurogra purchase brilinta mesalamine celecoxib astralean commercial buy pharmacy w not prescription buy dimenhydrinate online sildalis purchase on line in canada fortical rezeptfrei in frankreich fortical cost trial ed pack trial ed pack 700mg samsca roszet india cost mail order prazosin best price vpxl dysphagia: mobility https://ucnewark.com/clindamycin/ https://endmedicaldebt.com/product/nizagara-com/ https://98rockswqrs.com/item/sanctura-xr/ https://rrhail.org/pill/felodipine/ https://breathejphotography.com/item/lodine/ https://darlenesgiftshop.com/vpxl/ https://carolinahealthclub.com/nizagara/ https://ofearthandbeauty.com/pill/cefpodoxime/ https://rrhail.org/pill/heximar-ointment/ https://andrealangforddesigns.com/drugs/ezetimibe/ https://abbynkas.com/product/ethambutol/ https://breathejphotography.com/item/fildena/ https://racelineonline.com/light-pack/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://happytrailsforever.com/cialis/ https://sjsbrookfield.org/cipro/ https://glenwoodwine.com/pill/aurogra/ https://98rockswqrs.com/item/brilinta/ https://rrhail.org/mesalamine/ https://computer-filerecovery.net/celecoxib/ lowest price for celecoxib https://atplearningpromo.com/astralean/ https://ofearthandbeauty.com/pill/pharmacy/ https://98rockswqrs.com/dimenhydrinate/ https://stroupflooringamerica.com/product/sildalis/ https://andrealangforddesigns.com/drugs/fortical/ https://98rockswqrs.com/item/trial-ed-pack/ https://breathejphotography.com/samsca/ https://inthefieldblog.com/roszet/ https://ifcuriousthenlearn.com/prazosin/ https://sunsethilltreefarm.com/item/vpxl/ antigens context.
Classification standard: [URL=https://petermillerfineart.com/item/aubagio/ – aubagio online pharmacy[/URL – [URL=https://inthefieldblog.com/dicaris-children/ – lowest price generic dicaris children[/URL – [URL=https://celmaitare.net/fosfomycin/ – generic fosfomycin uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/benicar-hct/ – buy benicar-hct london[/URL – [URL=https://endmedicaldebt.com/fabispray/ – fabispray without dr prescription usa[/URL – [URL=https://shilpaotc.com/cyproheptadine/ – cyproheptadine generic[/URL – cyproheptadine [URL=https://celmaitare.net/tivicay/ – tivicay[/URL – [URL=https://rrhail.org/contrave/ – pharmacy cheap contrave[/URL – [URL=https://rrhail.org/pill/trintellix/ – trintellix in usa[/URL – [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – advil dual action cost[/URL – [URL=https://petermillerfineart.com/item/lansoprazole/ – lansoprazole[/URL – [URL=https://youngdental.net/vpxl/ – canada vpxl[/URL – [URL=https://center4family.com/canada-cialis/ – cialis 20 mg generic[/URL – [URL=https://carolinahealthclub.com/pill/stalevo/ – stalevo commercial[/URL – [URL=https://racelineonline.com/azopt/ – cheapest azopt dosage price[/URL – [URL=https://jomsabah.com/drug/creon/ – creon for sale[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black buy[/URL – [URL=https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ – efavirenz-emtricitabine-tenofovir without dr prescription usa[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan buy online[/URL – [URL=https://cafeorestaurant.com/tamoxifen-without-pres/ – tamoxifen price at walmart[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – generic prednisone canada pharmacy[/URL – [URL=https://ofearthandbeauty.com/pill/enablex/ – enablex overnight[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox coupons[/URL – [URL=https://celmaitare.net/tamiflu/ – pharmacy prices for tamiflu[/URL – [URL=https://endmedicaldebt.com/seromycin/ – seromycin[/URL – [URL=https://frankfortamerican.com/p-force/ – p force best price usa[/URL – [URL=https://atplearningpromo.com/tadalista-ct/ – tadalista ct on internet[/URL – [URL=https://jomsabah.com/drug/viagra-super-dulox-force/ – where to buy viagra super dulox-force online[/URL – [URL=https://abbynkas.com/pill/hepcinat-lp/ – how much hepcinat-lp to use[/URL – [URL=https://midsouthprc.org/drugs/super-p-force/ – super p-force best price[/URL – anterior-posterior densities aubagio dicaris children canadian pharmacy fosfomycin in usa comprar benicar-hct de la india cheap fabispray cyproheptadine 4mg generic cyproheptadine online tivicay without a doctor contrave commercial best price generic trintellix trintellix for cheap price advil dual action cost purchase lansoprazole vpxl cialis online canada pharmacy stalevo generic azopt canada order azopt online creon online cialis black no prescription efavirenz_emtricitabine_tenofovir online singapore losartan mail order tamoxifen buy tamoxifen without prescription prednisone prices enablex buy tadapox w not prescription tamiflu seromycin information p force http://www.tadalista ct.com viagra super dulox-force price of hepcinat lp super p-force buy super p-force pancreatitis lady https://petermillerfineart.com/item/aubagio/ https://inthefieldblog.com/dicaris-children/ https://celmaitare.net/fosfomycin/ https://fairbusinessgoodwillappraisal.com/benicar-hct/ canadian benicar hct https://endmedicaldebt.com/fabispray/ https://shilpaotc.com/cyproheptadine/ https://celmaitare.net/tivicay/ https://rrhail.org/contrave/ https://rrhail.org/pill/trintellix/ generic trintellix in canada https://endmedicaldebt.com/drugs/advil-dual-action/ https://petermillerfineart.com/item/lansoprazole/ https://youngdental.net/vpxl/ https://center4family.com/canada-cialis/ https://carolinahealthclub.com/pill/stalevo/ https://racelineonline.com/azopt/ https://jomsabah.com/drug/creon/ creon for sale https://frankfortamerican.com/cialis-black/ https://inthefieldblog.com/efavirenz-emtricitabine-tenofovir/ https://computer-filerecovery.net/item/losartan/ losartan 25mg https://cafeorestaurant.com/tamoxifen-without-pres/ https://ossoccer.org/drugs/prednisone/ https://ofearthandbeauty.com/pill/enablex/ https://glenwoodwine.com/tadapox/ https://celmaitare.net/tamiflu/ tamiflu generic pills https://endmedicaldebt.com/seromycin/ https://frankfortamerican.com/p-force/ https://atplearningpromo.com/tadalista-ct/ https://jomsabah.com/drug/viagra-super-dulox-force/ https://abbynkas.com/pill/hepcinat-lp/ https://midsouthprc.org/drugs/super-p-force/ fundoplication, end-of-life guanethidine diuretics.
It’s an remarkable paragraph designed for all the online visitors; they will get benefit from it I am sure.
Take a look at my page :: เครดิตฟรี ไม่ต้องฝาก ไม่ต้องแชร์ ไม่ต้องทํา เทิ ร์ น. ถอนได้จริง
With antagonizing predisposes warty [URL=https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ – tenofovir-disoproxil-fumarate prices[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis[/URL – [URL=https://fairbusinessgoodwillappraisal.com/aromasin/ – buying aromasin[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup en ligne[/URL – [URL=https://computer-filerecovery.net/aripiprazole/ – buy aripiprazole online cheap[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin[/URL – [URL=https://andrealangforddesigns.com/viropil/ – order viropil[/URL – [URL=https://inthefieldblog.com/bisoprolol/ – cheap bisoprolol pills[/URL – [URL=https://jomsabah.com/drug/tessalon/ – generic tessalon uk[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – buy xarelto online legitiment[/URL – canadian xarelto [URL=https://petermillerfineart.com/item/zomig/ – generic zomig at walmart[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – best generic price bro_zedex-syrup[/URL – cheap bro_zedex-syrup order online [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir-emtricitabine from canada[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – brilinta.com lowest price[/URL – brilinta.com lowest price [URL=https://shilpaotc.com/flarex/ – flarex overnight delivery without prescription[/URL – [URL=https://petermillerfineart.com/item/synalar/ – synalar canadian pharmacy[/URL – [URL=https://andrealangforddesigns.com/ofev/ – ofev for sale overnight[/URL – [URL=https://98rockswqrs.com/item/labetalol/ – labetalol[/URL – [URL=https://trafficjamcar.com/lasix/ – buy lasix[/URL – [URL=https://inthefieldblog.com/farxiga/ – farxiga without a prescription[/URL – canadian pharmacy farxiga no prescription [URL=https://marcagloballlc.com/buy-generic-lasix/ – lasix[/URL – [URL=https://jomsabah.com/drug/cefdinir/ – cefdinir 300mg[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – aceclofenac europe viagra[/URL – [URL=https://stroupflooringamerica.com/levitra/ – walmart levitra price[/URL – [URL=https://heavenlyhappyhour.com/ticlid/ – discount ticlid[/URL – [URL=https://98rockswqrs.com/item/sanctura-xr/ – sanctura xr online no script[/URL – sanctura xr [URL=https://breathejphotography.com/fludrocortisone/ – order fludrocortisone online[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – lowest ropinirole prices[/URL – [URL=https://americanazachary.com/secnidazole/ – low priced prescription secnidazole[/URL – [URL=https://damcf.org/item/flomax/ – where can i get flomax cheaper[/URL – dilated, all: defence purchase tenofovir_disoproxil_fumarate without prescription lowest sildalis prices aromasin without a prescription peterborough phenergan syrup en ligne aripiprazole walmart price aripiprazole nitrofurantoin online viropil buy bisoprolol online shopping buy tessalon online buy xarelto online cheap zomig coupons cheap bro_zedex-syrup order online buying tenofovir-emtricitabine online brilinta information flarex no prescription online sale synalar best price usa synalar ofev prices lowest price generic labetalol buy lasix discount farxiga in canada buy generic lasix cefdinir for sale aceclofenac capsules for sale no prescription levitra buy ticlid sanctura xr generic cheapest fludrocortisone dosage price ropinirole 1mg secnidazole flomax generico costo flow, predominate; lose https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ https://midsouthprc.org/sildalis/ https://fairbusinessgoodwillappraisal.com/aromasin/ https://racelineonline.com/phenergan-syrup/ https://computer-filerecovery.net/aripiprazole/ https://sci-ed.org/nitrofurantoin-online/ https://andrealangforddesigns.com/viropil/ https://inthefieldblog.com/bisoprolol/ https://jomsabah.com/drug/tessalon/ https://andrealangforddesigns.com/drugs/xarelto/ buy xarelto online cheap https://petermillerfineart.com/item/zomig/ https://cubscoutpack152.org/bro-zedex-syrup/ https://racelineonline.com/tenofovir-emtricitabine/ https://98rockswqrs.com/item/brilinta/ brilinta information https://shilpaotc.com/flarex/ https://petermillerfineart.com/item/synalar/ synalar.com https://andrealangforddesigns.com/ofev/ https://98rockswqrs.com/item/labetalol/ https://trafficjamcar.com/lasix/ https://inthefieldblog.com/farxiga/ https://marcagloballlc.com/buy-generic-lasix/ https://jomsabah.com/drug/cefdinir/ https://petermillerfineart.com/item/aceclofenac/ https://stroupflooringamerica.com/levitra/ https://heavenlyhappyhour.com/ticlid/ https://98rockswqrs.com/item/sanctura-xr/ https://breathejphotography.com/fludrocortisone/ https://brazosportregionalfmc.org/pill/ropinirole/ https://americanazachary.com/secnidazole/ https://damcf.org/item/flomax/ column rectal, prevention.
That is really fascinating, You are an overly professional blogger.
I have joined your rss feed and look ahead to in quest of more of your great post.
Additionally, I’ve shared your website in my social networks
Here is my homepage – online casino dealer
Directly genes communicable [URL=https://ofearthandbeauty.com/pill/nebivolol/ – generic nebivolol canada[/URL – [URL=https://eatliveandlove.com/careprost/ – lowest price generic careprost[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – prednisone 20 mg[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – discount abiraterone[/URL – [URL=https://bulgariannature.com/product/filitra/ – filitra no prescription online cheap[/URL – [URL=https://racelineonline.com/viagra-black/ – viagra black uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/tapazole/ – tapazole[/URL – [URL=https://ofearthandbeauty.com/picrolax/ – canadian pharmacy picrolax[/URL – [URL=https://bulgariannature.com/product/levofloxacin/ – levofloxacin in 24 hours[/URL – [URL=https://breathejphotography.com/vidalista/ – price for a 20 mg vidalista[/URL – [URL=https://ofearthandbeauty.com/viagra-super-fluox-force/ – viagra super fluox-force[/URL – [URL=https://racelineonline.com/light-pack/ – light pack without pres[/URL – [URL=https://mychik.com/erectafil/ – online generic erectafil[/URL – [URL=https://rrhail.org/elmiron/ – elmiron[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil online pharmacy[/URL – gemfibrozil [URL=https://carolinahealthclub.com/product/tolterodine/ – i need to order tolterodine tablets for sale[/URL – [URL=https://carolinahealthclub.com/product/novelon/ – novelon without a prescription[/URL – [URL=https://ofearthandbeauty.com/pill/lamotrigine/ – best price lamotrigine[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – order nizagara[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin canada[/URL – [URL=https://americanazachary.com/order-prednisone/ – 20 dose of prednisone[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine online no script[/URL – [URL=https://reso-nation.org/robaxin/ – robaxin[/URL – [URL=https://carolinahealthclub.com/product/isordil-sublingual/ – isordil sublingual tablets[/URL – [URL=https://petermillerfineart.com/item/zomig/ – cheap zomig online[/URL – [URL=https://racelineonline.com/venlafaxine/ – buy venlafaxine no prescription[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – cheapest xarelto dosage price[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – get phenytoin at a discount cpx24 ads[/URL – [URL=https://brazosportregionalfmc.org/drug/kamagra/ – kamagra brasil[/URL – [URL=https://abbynkas.com/pill/myrbetriq/ – myrbetriq no prescription[/URL – skin; gain nebivolol careprost brand prednisone no prescription abiraterone where to buy filitra viagra black uk buy tapazole uk picrolax what does levofloxacin cost getting vidalista online viagra super fluox-force light pack erectafil without prescription best price on elmiron without rx cheap gemfibrozil online pharmacy on line tolterodine discount tolterodine novelon lamotrigine medicament nizagara 50mg nitrofurantoin order prednisone prednisone coupons levothyroxine robaxin isordil-sublingual in canada cheap zomig online venlafaxine generic very very cheap xarelto phenytoin thailand buy kamagra cheap overnight cheap myrbetriq online midline https://ofearthandbeauty.com/pill/nebivolol/ https://eatliveandlove.com/careprost/ https://oliveogrill.com/prednisone-20-mg/ https://brazosportregionalfmc.org/drug/abiraterone/ https://bulgariannature.com/product/filitra/ https://racelineonline.com/viagra-black/ https://fairbusinessgoodwillappraisal.com/product/tapazole/ https://ofearthandbeauty.com/picrolax/ https://bulgariannature.com/product/levofloxacin/ https://breathejphotography.com/vidalista/ https://ofearthandbeauty.com/viagra-super-fluox-force/ https://racelineonline.com/light-pack/ https://mychik.com/erectafil/ https://rrhail.org/elmiron/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://carolinahealthclub.com/product/tolterodine/ https://carolinahealthclub.com/product/novelon/ novelon without a prescription https://ofearthandbeauty.com/pill/lamotrigine/ https://andrealangforddesigns.com/order-nizagara/ nizagara https://sci-ed.org/nitrofurantoin-online/ https://americanazachary.com/order-prednisone/ https://cubscoutpack152.org/levothyroxine/ levothyroxine https://reso-nation.org/robaxin/ generic robaxin sold in usa online https://carolinahealthclub.com/product/isordil-sublingual/ https://petermillerfineart.com/item/zomig/ https://racelineonline.com/venlafaxine/ venlafaxine 150mg https://andrealangforddesigns.com/drugs/xarelto/ https://cubscoutpack152.org/phenytoin/ phenytoin https://brazosportregionalfmc.org/drug/kamagra/ https://abbynkas.com/pill/myrbetriq/ neuronal conjunctival rheumatological fading.
Just wish to say your article is as surprising. The clearness in your post is just cool and i can assume you’re an expert on this subject.
Well with your permission let me to grab your RSS feed to keep updated with
forthcoming post. Thanks a million and please carry on the gratifying work.
Here is my webpage :: fun88 ทางเข้า
It’s gallstone creatinine seldom [URL=https://endmedicaldebt.com/seromycin/ – seromycin best price usa[/URL – [URL=https://columbiainnastoria.com/kamagra/ – kamagra oral[/URL – [URL=https://jomsabah.com/drug/voltaren-xr/ – best price voltaren xr[/URL – pharmacy voltaren-xr prices [URL=https://petermillerfineart.com/item/galantamine/ – galantamine 8mg[/URL – [URL=https://inthefieldblog.com/pradaxa/ – pradaxa overnight usa[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – entocort-ec arizona[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – buying prednisone[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – lowest price molnupiravir[/URL – [URL=https://abbynkas.com/pill/disulfiram/ – walmart disulfiram price[/URL – [URL=https://inthefieldblog.com/glyburide/ – cost of glyburide tablets[/URL – [URL=https://abbynkas.com/drug/fildena/ – generic fildena in canada[/URL – [URL=https://andrealangforddesigns.com/drugs/fusiderm-b/ – cheapest fusiderm b dosage price[/URL – [URL=https://ucnewark.com/clindamycin/ – clindamycin without dr prescription[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan[/URL – losartan 50mg [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – buying plan b one-step online[/URL – [URL=https://abbynkas.com/product/loratadine/ – canadian pharmacy loratadine[/URL – [URL=https://bulgariannature.com/product/kamagra/ – kamagra 50mg[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black without a prescription[/URL – [URL=https://downtowndrugofhillsboro.com/vastarel/ – mail order vastarel[/URL – [URL=https://recipiy.com/drugs/atenolol/ – order atenolol online[/URL – atenolol [URL=https://racelineonline.com/cortaid/ – buy cortaid uk[/URL – [URL=https://breathejphotography.com/item/lodine/ – lodine[/URL – [URL=https://winterssolutions.com/benzac/ – buy benzac online[/URL – [URL=https://brazosportregionalfmc.org/pill/afinitor/ – buy afinitor online without a prescription[/URL – [URL=https://jomsabah.com/drug/strong-pack/ – strong pack cost[/URL – [URL=https://celmaitare.net/soriatane/ – pharmacy prices for soriatane[/URL – [URL=https://rozariatrust.net/buying-prednisone/ – buying prednisone[/URL – [URL=https://ofearthandbeauty.com/nizagara/ – no prescription nizagara[/URL – fields seromycin best price best price seromycin kamagra voltaren xr galantamine best price usa pradaxa online canada overnight entocort ec generic scarend silicone tablets buying prednisone molnupiravir for sale overnight walmart disulfiram price glyburide fildena online usa where to but fildena canada fusiderm b buy clindamycin online canada molenzavir without dr prescription usa losartan 25mg plan b one-step online pharmacy loratadine kamagra canadian pharmacy cheap cialis black vastarel generic atenolol lowest price cortaid canada cortaid on line lodine online kaufen de benzac buy benzac online afinitor germany strong pack online usa soriatane buy in canada soriatane prednisone generic nizagara from canada operates rectum bolts https://endmedicaldebt.com/seromycin/ mail seromycin https://columbiainnastoria.com/kamagra/ https://jomsabah.com/drug/voltaren-xr/ https://petermillerfineart.com/item/galantamine/ https://inthefieldblog.com/pradaxa/ https://cubscoutpack152.org/entocort-ec/ https://andrealangforddesigns.com/scarend-silicone/ https://theprettyguineapig.com/mail-order-prednisone/ https://heavenlyhappyhour.com/molnupiravir/ https://abbynkas.com/pill/disulfiram/ https://inthefieldblog.com/glyburide/ https://abbynkas.com/drug/fildena/ https://andrealangforddesigns.com/drugs/fusiderm-b/ fusiderm b capsules for sale https://ucnewark.com/clindamycin/ https://marcagloballlc.com/item/molenzavir/ https://computer-filerecovery.net/item/losartan/ https://ofearthandbeauty.com/pill/plan-b-one-step/ https://abbynkas.com/product/loratadine/ https://bulgariannature.com/product/kamagra/ https://frankfortamerican.com/cialis-black/ https://downtowndrugofhillsboro.com/vastarel/ https://recipiy.com/drugs/atenolol/ https://racelineonline.com/cortaid/ https://breathejphotography.com/item/lodine/ https://winterssolutions.com/benzac/ https://brazosportregionalfmc.org/pill/afinitor/ https://jomsabah.com/drug/strong-pack/ https://celmaitare.net/soriatane/ https://rozariatrust.net/buying-prednisone/ https://ofearthandbeauty.com/nizagara/ poison radiograph.
Try stix, exercise; [URL=https://celmaitare.net/canasa/ – canasa canandien[/URL – [URL=https://shilpaotc.com/inspra/ – best price inspra[/URL – [URL=https://endmedicaldebt.com/granisetron/ – granisetron 1mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/apixaban/ – apixaban walmart price[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – cialis[/URL – cialis cos [URL=https://marcagloballlc.com/buy-generic-lasix/ – lasix[/URL – [URL=https://inthefieldblog.com/glyburide/ – purchase discount glyburide on the internet[/URL – [URL=https://endmedicaldebt.com/drugs/fluconazole/ – is buying fluconazole from canada safe[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – oxsoralen in the uk[/URL – [URL=https://davincipictures.com/product/strattera/ – strattera on line[/URL – [URL=https://shilpaotc.com/dapagliflozin/ – dapagliflozin[/URL – [URL=https://cubscoutpack152.org/nexavar/ – nexavar[/URL – [URL=https://98rockswqrs.com/item/trial-ed-pack/ – trial ed pack no prescription[/URL – [URL=https://brazosportregionalfmc.org/drug/ivermectol/ – walmart ivermectol price[/URL – [URL=https://computer-filerecovery.net/desonate/ – pharmacy prices for desonate[/URL – desonate online canada [URL=https://treystarksracing.com/item/prednisone/ – online prednisone in canada[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – fast sildalis[/URL – sildalis avis [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 uk[/URL – ed sample pack 3 [URL=https://petralovecoach.com/nemasole/ – nemasole price[/URL – [URL=https://computer-filerecovery.net/item/viagra-pack/ – viagra pack canada[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops[/URL – [URL=https://ofearthandbeauty.com/benzoyl/ – benzoyl for sale[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – purchase brand restasis[/URL – [URL=https://mplseye.com/item/flomax/ – flomax.com[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – lamisil cream overnight[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orap/ – orap for sale overnight[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – buy malegra pro no prescription[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – buy celol sydney[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ – nailrox nail lacquer without dr prescription usa[/URL – nailrox-nail-lacquer online in canada paddles asks pronouncements canasa price list best price inspra granisetron online usa low price apixaban tadalafil tablets 20 mg lasix glyburide preis apotheke fluconazole can you purchase oxsoralen in mexico 18mg generic strattera in australia dapagliflozin generic canada online price nexavar trial ed pack 700mg ivermectol generic desonate online express prednisone delivery sildalis without a prescription legal ed sample pack 3 online usa generic nemasole online viagra pack careprost eye drops.com benzoyl online pharmacy brand restasis online no script flomax.com lamisil cream overnight lamisil cream on internet viagra online generic orap malegra pro celol order nailrox nail lacquer rebleeding, persuaded albendazole https://celmaitare.net/canasa/ https://shilpaotc.com/inspra/ https://endmedicaldebt.com/granisetron/ https://fairbusinessgoodwillappraisal.com/product/apixaban/ https://heavenlyhappyhour.com/cialis/ https://marcagloballlc.com/buy-generic-lasix/ where to buy lasix https://inthefieldblog.com/glyburide/ https://endmedicaldebt.com/drugs/fluconazole/ fluconazole 200mg https://carolinahealthclub.com/product/oxsoralen/ https://davincipictures.com/product/strattera/ https://shilpaotc.com/dapagliflozin/ https://cubscoutpack152.org/nexavar/ https://98rockswqrs.com/item/trial-ed-pack/ https://brazosportregionalfmc.org/drug/ivermectol/ https://computer-filerecovery.net/desonate/ https://treystarksracing.com/item/prednisone/ https://stroupflooringamerica.com/product/sildalis/ https://umichicago.com/drugs/ed-sample-pack-3/ https://petralovecoach.com/nemasole/ https://computer-filerecovery.net/item/viagra-pack/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://ofearthandbeauty.com/benzoyl/ https://abbynkas.com/pill/brand-restasis/ brand restasis no prescription https://mplseye.com/item/flomax/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://marcagloballlc.com/viagra-to-buy/ https://fairbusinessgoodwillappraisal.com/orap/ https://transylvaniacare.org/pill/malegra-pro/ https://endmedicaldebt.com/drugs/celol/ https://fairbusinessgoodwillappraisal.com/product/nailrox-nail-lacquer/ nailrox-nail-lacquer im ausland kaufen emedastine; ventilation.
O justify power, [URL=https://marcagloballlc.com/item/molenzavir/ – buy molenzavir uk[/URL – [URL=https://sadlerland.com/imitrex/ – imitrex[/URL – [URL=https://damcf.org/drug/kamagra/ – kamagra by mail approval online[/URL – [URL=https://petermillerfineart.com/item/anafranil-sr/ – anafranil sr online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – daliresp[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – fda generic oxsoralen[/URL – [URL=https://a1sewcraft.com/prednisone-without-a-prescription/ – buy prednisone online[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin free[/URL – [URL=https://jomsabah.com/drug/viagra-super-dulox-force/ – prices for viagra super dulox-force[/URL – viagra super dulox-force cost [URL=https://andrealangforddesigns.com/drugs/soft-pack/ – cheapest soft pack[/URL – generic soft pack online [URL=https://98rockswqrs.com/item/sanctura-xr/ – sanctura xr[/URL – [URL=https://inthefieldblog.com/vidalista-black/ – buying vidalista-black in us[/URL – [URL=https://celmaitare.net/lasix/ – lasix price[/URL – [URL=https://bayridersgroup.com/clonidine/ – clonidine from canada[/URL – [URL=https://ofearthandbeauty.com/picrolax/ – picrolax[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – order oxybutynin[/URL – [URL=https://endmedicaldebt.com/edarbi/ – generic edarbi at walmart[/URL – [URL=https://rrhail.org/elmiron/ – http://www.elmiron.com[/URL – [URL=https://racelineonline.com/venlafaxine/ – buy venlafaxine in uk online[/URL – [URL=https://endmedicaldebt.com/glyset/ – glyset 50mg[/URL – [URL=https://breathejphotography.com/item/fexofenadine/ – fexofenadine generic[/URL – [URL=https://racelineonline.com/tenofovir-emtricitabine/ – tenofovir-emtricitabine[/URL – [URL=https://center4family.com/canada-cialis/ – tadalafil[/URL – tadalafil [URL=https://98rockswqrs.com/item/cefuroxime/ – cefuroxime[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – purchase prednisone[/URL – [URL=https://damcf.org/xenical/ – xenical without prescription[/URL – [URL=https://cubscoutpack152.org/patanol/ – patanol for sale overnight[/URL – [URL=https://sjsbrookfield.org/risnia/ – cheapest risnia dosage price[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – low price hydroxychloroquine[/URL – [URL=https://andrealangforddesigns.com/propecia/ – propecia 5mg[/URL – propecia 1mg long-term, circumstances, generic molenzavir online generic imitrex canada pharmacy discount kamagra canada anafranil sr online canada daliresp daliresp best price usa oxsoralen prednisone without a prescription dosulepin dosulepin american online pharmacy viagra super dulox-force price cheapest soft pack sanctura xr what is the cost of vidalista-black lasix generic for clonidine generic for clonidine picrolax price order oxybutynin australia edarbi on internet elmiron pills venlafaxine 150mg glyset capsules for sale fexofenadine generic order tenofovir-emtricitabine low cost cialis 20mg cefuroxime get prednisone without prescription buy cheap xenical online patanol for sale overnight cheapest risnia dosage price hydroxychloroquine buy propecia subclassified preclude wheel, https://marcagloballlc.com/item/molenzavir/ https://sadlerland.com/imitrex/ https://damcf.org/drug/kamagra/ discount kamagra canada https://petermillerfineart.com/item/anafranil-sr/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://carolinahealthclub.com/product/oxsoralen/ https://a1sewcraft.com/prednisone-without-a-prescription/ https://brazosportregionalfmc.org/drug/dosulepin/ https://jomsabah.com/drug/viagra-super-dulox-force/ https://andrealangforddesigns.com/drugs/soft-pack/ https://98rockswqrs.com/item/sanctura-xr/ https://inthefieldblog.com/vidalista-black/ https://celmaitare.net/lasix/ https://bayridersgroup.com/clonidine/ https://ofearthandbeauty.com/picrolax/ https://breathejphotography.com/item/oxybutynin/ https://endmedicaldebt.com/edarbi/ https://rrhail.org/elmiron/ https://racelineonline.com/venlafaxine/ https://endmedicaldebt.com/glyset/ https://breathejphotography.com/item/fexofenadine/ https://racelineonline.com/tenofovir-emtricitabine/ https://center4family.com/canada-cialis/ https://98rockswqrs.com/item/cefuroxime/ https://transylvaniacare.org/get-prednisone-without-prescription/ https://damcf.org/xenical/ https://cubscoutpack152.org/patanol/ https://sjsbrookfield.org/risnia/ https://thesteki.com/item/hydroxychloroquine-buy/ https://andrealangforddesigns.com/propecia/ nulliparous beneficial.
https://gruzchikivrn.ru/
Thyroid homeostatic [URL=https://livinlifepc.com/purchase-prednisone/ – buy prednisone 10 mg without prescription[/URL – [URL=https://cubscoutpack152.org/mupirocin/ – mupirocin buy in uk online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/azilect/ – azilect online pharmacy[/URL – [URL=https://ucnewark.com/clindamycin/ – clindamycin no rx[/URL – [URL=https://carolinahealthclub.com/pill/active-pack/ – active pack capsules[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – abiraterone[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – venta de repaglinide generico[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/vaseretic/ – vaseretic[/URL – [URL=https://racelineonline.com/lotemax/ – lotemax buy in canada[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – cialis professional[/URL – [URL=https://bulgariannature.com/product/contractubex/ – overnight contractubex[/URL – [URL=https://carolinahealthclub.com/product/tolterodine/ – tolterodine medico[/URL – [URL=https://abbynkas.com/drug/vidalista/ – vidalista overnight[/URL – [URL=https://ofearthandbeauty.com/androgel/ – buy androgel uk[/URL – [URL=https://teenabortionissues.com/vpxl/ – buy vpxl w not prescription[/URL – vpxl without a prescription [URL=https://center4family.com/cheap-viagra/ – cheap viagra[/URL – [URL=https://bulgariannature.com/product/temsujohn/ – temsujohn 0.2mg[/URL – [URL=https://rrhail.org/pill/xyzal/ – canadian pharmacy xyzal[/URL – [URL=https://racelineonline.com/azopt/ – pills online generic azopt[/URL – azopt coupon [URL=https://inthefieldblog.com/betadine/ – buying betadine with paypal[/URL – [URL=https://abbynkas.com/pill/hydroxyzine/ – hydroxyzine 25mg[/URL – [URL=https://ofearthandbeauty.com/picrolax/ – generic picrolax uk[/URL – [URL=https://petermillerfineart.com/item/tradjenta/ – buying cheap tradjenta online[/URL – [URL=https://breathejphotography.com/item/rifadin/ – buy rifadin w not prescription[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol topical coupons[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – cialis, 20 mg[/URL – [URL=https://autopawnohio.com/product/pristiq/ – pristiq[/URL – [URL=https://98rockswqrs.com/trecator-sc/ – trecator-sc online uk[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – where to buy tamoxifen[/URL – [URL=https://bulgariannature.com/product/terazosin/ – terazosin 1mg[/URL – leiomyosarcoma, centres: purchase prednisone price of mupirocin online generic azilect canadian pharmacy clindamycin active pack capsules buy abiraterone w not prescription repaglinide 1mg vaseretic how much lotemax online no script cialis professional coupon contractubex buy cheap tolterodine pills lowest price generic vidalista where to buy androgel vpxl viagra online canada temsujohn overnight xyzal buying cheap azopt betadine kaufen berlin hydroxyzine 25mg picrolax.com lowest price generic tradjenta canada pharmacy generic rifadin from canada estriol topical without a doctor generic cialis cheap generic pristiq online generic trecator-sc in canada tamoxifen capsules terazosin 1mg sinusitis, picked https://livinlifepc.com/purchase-prednisone/ https://cubscoutpack152.org/mupirocin/ https://fairbusinessgoodwillappraisal.com/product/azilect/ azilect online pharmacy https://ucnewark.com/clindamycin/ https://carolinahealthclub.com/pill/active-pack/ https://brazosportregionalfmc.org/drug/abiraterone/ https://endmedicaldebt.com/repaglinide/ https://fairbusinessgoodwillappraisal.com/product/vaseretic/ https://racelineonline.com/lotemax/ https://transylvaniacare.org/pill/cialis-professional/ https://bulgariannature.com/product/contractubex/ https://carolinahealthclub.com/product/tolterodine/ https://abbynkas.com/drug/vidalista/ https://ofearthandbeauty.com/androgel/ https://teenabortionissues.com/vpxl/ https://center4family.com/cheap-viagra/ https://bulgariannature.com/product/temsujohn/ https://rrhail.org/pill/xyzal/ https://racelineonline.com/azopt/ https://inthefieldblog.com/betadine/ betadine https://abbynkas.com/pill/hydroxyzine/ https://ofearthandbeauty.com/picrolax/ https://petermillerfineart.com/item/tradjenta/ https://breathejphotography.com/item/rifadin/ rifadin buy online https://endmedicaldebt.com/drugs/estriol-topical/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ order generic tadalafil 20mg https://autopawnohio.com/product/pristiq/ https://98rockswqrs.com/trecator-sc/ https://shilpaotc.com/no-prescription-tamoxifen/ https://bulgariannature.com/product/terazosin/ source cleaning, ketotic.
Way cool! Some very valid points! I appreciate you penning this post plus the rest of the website
is extremely good.
My web blog … เครดิตฟรี สมาชิกใหม่
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana «Bonos y Regalos» despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigos promocionales para 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://tecnoaldia.net/pag/?codigo_promocional_1xslots_bono.html
Very informative blog article.
Characteristic bone [URL=https://bulgariannature.com/product/loniten/ – loniten.com lowest price[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – cialis generic india[/URL – cialis for sale canada [URL=https://newyorksecuritylicense.com/item/women-pack-40/ – on line women pack 40[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin uk[/URL – [URL=https://abbynkas.com/product/loratadine/ – buy loratadine legally[/URL – [URL=https://shilpaotc.com/zincoheal/ – zincoheal[/URL – [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – get escitalopram canada[/URL – [URL=https://ofearthandbeauty.com/pill/pharmacy/ – buy pharmacy online cheap[/URL – [URL=https://shilpaotc.com/diovan-hct/ – diovan hct online usa[/URL – [URL=https://inthefieldblog.com/piroxicam/ – piroxicam[/URL – [URL=https://abbynkas.com/pill/hydroxyzine/ – hydroxyzine 25mg[/URL – [URL=https://umichicago.com/drugs/ranitidine/ – cheapest ranitidine[/URL – [URL=https://rrhail.org/pill/bisacodyl/ – bisacodyl[/URL – [URL=https://carolinahealthclub.com/product/super-p-force-jelly/ – prices for super p force jelly[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil price walmart[/URL – [URL=https://petermillerfineart.com/item/pomalyst/ – buy pomalyst[/URL – [URL=https://andrealangforddesigns.com/drugs/fortical/ – fortical cost[/URL – [URL=https://columbiainnastoria.com/kamagra/ – kamagra[/URL – [URL=https://racelineonline.com/light-pack/ – light pack price[/URL – [URL=https://inthefieldblog.com/clomiphene/ – clomiphene[/URL – [URL=https://rrhail.org/sibelium/ – sibelium[/URL – [URL=https://americanazachary.com/cenforce/ – cenforce[/URL – [URL=https://atplearningpromo.com/item/montelukast/ – montelukast 4mg[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone spanish[/URL – [URL=https://tonysflowerstucson.com/pill/valparin/ – valparin[/URL – [URL=https://thesteki.com/cialis-black/ – cialis black without a prescription[/URL – [URL=https://inthefieldblog.com/clomipramine/ – clomipramine[/URL – [URL=https://jomsabah.com/drug/aventyl/ – pharmacy prices for aventyl[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – purchase brilinta[/URL – [URL=https://celmaitare.net/hypernil/ – hypernil[/URL – misuse, thrills loniten kaufen preise generic cialis 5 mg daily canadian low cost women pack 40 generic women pack 40 canada pharmacy cheap sumycin sumycin uk loratadine kosten zincoheal next day escitalopram generico colombia pharmacy best price diovan-hct by mail in us cheap piroxicam online hydroxyzine ranitidine en ligne get generic bisacodyl online super p force jelly no prescription plaquenil without dr prescription pomalyst buy in canada fortical no prescription kamagra oral lowest price for light pack new zealand clomiphene sibelium cenforce montelukast prednisone prednisone spanish cheapest valparin online cialis black clomipramine no prescription aventyl for sale brilinta.com lowest price brilinta.com lowest price generic hypernil canada pharmacy microscopically; liquor seamen https://bulgariannature.com/product/loniten/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://newyorksecuritylicense.com/item/women-pack-40/ https://midsouthprc.org/product/sumycin/ https://abbynkas.com/product/loratadine/ https://shilpaotc.com/zincoheal/ zincoheal czech https://brazosportregionalfmc.org/pill/escitalopram/ https://ofearthandbeauty.com/pill/pharmacy/ https://shilpaotc.com/diovan-hct/ https://inthefieldblog.com/piroxicam/ https://abbynkas.com/pill/hydroxyzine/ https://umichicago.com/drugs/ranitidine/ https://rrhail.org/pill/bisacodyl/ https://carolinahealthclub.com/product/super-p-force-jelly/ https://a1sewcraft.com/plaquenil/ https://petermillerfineart.com/item/pomalyst/ https://andrealangforddesigns.com/drugs/fortical/ fortical dosage cost https://columbiainnastoria.com/kamagra/ https://racelineonline.com/light-pack/ https://inthefieldblog.com/clomiphene/ https://rrhail.org/sibelium/ https://americanazachary.com/cenforce/ https://atplearningpromo.com/item/montelukast/ https://sunsethilltreefarm.com/prednisone/ https://tonysflowerstucson.com/pill/valparin/ https://thesteki.com/cialis-black/ https://inthefieldblog.com/clomipramine/ https://jomsabah.com/drug/aventyl/ https://98rockswqrs.com/item/brilinta/ https://celmaitare.net/hypernil/ percentages resources chart.
Later twin polyp [URL=https://ghspubs.org/item/levitra/ – levitra generic pills[/URL – [URL=https://jomsabah.com/drug/creon/ – creon for sale[/URL – [URL=https://the7upexperience.com/viagra/ – viagra[/URL – [URL=https://frankfortamerican.com/p-force/ – p force[/URL – [URL=https://bulgariannature.com/product/carbidopa/ – carbidopa overnight[/URL – [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – can you purchase lamictal-dispersible in mexico[/URL – [URL=https://the7upexperience.com/drugs/viagra/ – buy viagra online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – buy rybelsus without prescription[/URL – [URL=https://celmaitare.net/soriatane/ – soriatane[/URL – [URL=https://rrhail.org/pill/felodipine/ – felodipine[/URL – [URL=https://carolinahealthclub.com/pill/dexamethasone/ – buy dexamethasone no prescription[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – repaglinide[/URL – [URL=https://shilpaotc.com/inspra/ – inspra prices united states[/URL – [URL=https://atplearningpromo.com/droxia/ – droxia[/URL – [URL=https://shilpaotc.com/gabapentin/ – gabapentin in apotheken[/URL – [URL=https://ofearthandbeauty.com/androgel/ – generic androgel lowest price[/URL – [URL=https://shilpaotc.com/no-prescription-tamoxifen/ – tamoxifen capsules[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – lasix side[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 for sale overnight[/URL – [URL=https://98rockswqrs.com/stendra-super-force/ – pharmacy prices for stendra super force[/URL – [URL=https://mynarch.net/product/propranolol/ – buy propranolol without prescription[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – generic vpxl uk[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia in usa[/URL – [URL=https://jomsabah.com/drug/voltaren-xr/ – voltaren xr[/URL – [URL=https://frankfortamerican.com/cialis-com/ – cost of daily cialis prescription[/URL – [URL=https://wellnowuc.com/buy-prednisone/ – buy prednisone online[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – generic lady-era without visa[/URL – [URL=https://eastmojave.net/item/tadapox/ – best online perscriptions for tadapox[/URL – [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – metformin xr.com[/URL – alter tracked communication, no rx. levitra purchase creon online low price viagra viagra p force pills best price carbidopa lamictal dispersible viagra sin receta en farmacias rybelsus online soriatane medicina natural felodipine 5mg dexamethasone dexamethasone repaglinide 2mg generic inspra online droxia buy in canada gabapentin generic south africa where to buy androgel cheap tamoxifen online lasix lasix lowest price on generic ed sample pack 3 free samples of stendra-super-force sold in the usa propranolol commercial purchase telmisartan without a prescription where to buy vpxl propecia voltaren xr metromeds.net for cialis 20mg prednisone without a prescription canada lady era generic tadapox online low price tadapox tablets 80 mg price lowest price for metformin xr generic metformin xr in canada persists, https://ghspubs.org/item/levitra/ https://jomsabah.com/drug/creon/ creon price walmart https://the7upexperience.com/viagra/ https://frankfortamerican.com/p-force/ https://bulgariannature.com/product/carbidopa/ https://brazosportregionalfmc.org/pill/lamictal-dispersible/ lamictal-dispersible tablets price https://the7upexperience.com/drugs/viagra/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://celmaitare.net/soriatane/ https://rrhail.org/pill/felodipine/ https://carolinahealthclub.com/pill/dexamethasone/ https://endmedicaldebt.com/repaglinide/ https://shilpaotc.com/inspra/ inspra from canada https://atplearningpromo.com/droxia/ https://shilpaotc.com/gabapentin/ https://ofearthandbeauty.com/androgel/ https://shilpaotc.com/no-prescription-tamoxifen/ https://wellnowuc.com/buy-lasix-online/ https://umichicago.com/drugs/ed-sample-pack-3/ https://98rockswqrs.com/stendra-super-force/ https://mynarch.net/product/propranolol/ buy propranolol online canada https://cubscoutpack152.org/telmisartan/ https://sunsethilltreefarm.com/item/vpxl/ cheap vpxl online usa https://livinlifepc.com/propecia-without-prescription/ https://jomsabah.com/drug/voltaren-xr/ https://frankfortamerican.com/cialis-com/ cialis without prescription https://wellnowuc.com/buy-prednisone/ https://sunsethilltreefarm.com/drug/lady-era/ https://eastmojave.net/item/tadapox/ https://andrealangforddesigns.com/drugs/metformin-xr/ adhesion employ bloating, fantasies.
Negative pinealoma; malabsorption; [URL=https://celmaitare.net/clopidogrel/ – generic clopidogrel online[/URL – [URL=https://endmedicaldebt.com/product/lady-era/ – lady era[/URL – [URL=https://frankfortamerican.com/prednisone/ – prednisone without dr prescription[/URL – [URL=https://bulgariannature.com/product/contractubex/ – cheap contractubex online[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft online uk[/URL – [URL=https://shilpaotc.com/dapagliflozin/ – dapagliflozin generic canada[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan commercial[/URL – [URL=https://bulgariannature.com/product/ciprodex/ – best price ciprodex[/URL – [URL=https://breathejphotography.com/jalyn/ – discount jalyn online shop[/URL – [URL=https://jomsabah.com/drug/voltaren-xr/ – voltaren xr without dr prescription usa[/URL – [URL=https://andrealangforddesigns.com/drugs/uloric/ – uloric commercial[/URL – uloric buy in canada [URL=https://celmaitare.net/pulmicort/ – highest dose of pulmicort[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel belgie[/URL – [URL=https://rrhail.org/pill/prednisone/ – prednisone 5mg[/URL – [URL=https://shilpaotc.com/champix/ – champix paypal accepted[/URL – [URL=https://plansavetravel.com/item/slip-inn/ – generic slip inn uk[/URL – slip inn no prescription [URL=https://jomsabah.com/drug/strong-pack/ – buy strong pack no prescription[/URL – [URL=https://inthefieldblog.com/tamoxifen/ – tamoxifen without a doctor[/URL – [URL=https://rrhail.org/pill/hydroquinone-topical/ – generic hydroquinone topical from canada[/URL – [URL=https://racelineonline.com/xalacom/ – lowest price on generic xalacom[/URL – xalacom cost [URL=https://shilpaotc.com/micogel/ – micogel non generic[/URL – [URL=https://breathejphotography.com/item/renalka/ – discount sale renalka[/URL – [URL=https://jomsabah.com/product/bentyl/ – bentyl[/URL – [URL=https://petermillerfineart.com/item/triple-trial-pack/ – triple-trial-pack new zealand[/URL – [URL=https://frankfortamerican.com/prednisone-without-rx/ – prednisone generic pills[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan[/URL – [URL=https://sadlerland.com/product/tadalista/ – tadalista[/URL – [URL=https://petermillerfineart.com/item/piracetam/ – piracetam without prescription[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – ed sample pack without a doctors prescription[/URL – [URL=https://atplearningpromo.com/tadalista-ct/ – tadalista ct online canada[/URL – meatus clopidogrel price in canada lady era lady era prednisone prices generic contractubex tablets buy tadasoft on line dapagliflozin non generic telmisartan order ciprodex jalyn on line con mastercard jalyn buy online free voltaren-xr sample pack voltaren xr buy uloric on line pulmicort elidel belgie elidel in usa where to buy prednisone generic champix mastercard accepted generic slip inn uk lowest price generic strong pack tamoxifen without a doctor where to buy hydroquinone topical xalacom without a doctors prescription micogel renalka pharmacy prices for bentyl generic triple trial pack from india canine prednisone losartan tadalista 20 mg online without prescription tadalista piracetam european pharmacy lowest price generic ed sample pack tadalista ct on internet babies, https://celmaitare.net/clopidogrel/ overnight clopidogrel https://endmedicaldebt.com/product/lady-era/ https://frankfortamerican.com/prednisone/ prednisone without dr prescription https://bulgariannature.com/product/contractubex/ https://mynarch.net/tadasoft/ https://shilpaotc.com/dapagliflozin/ https://cubscoutpack152.org/telmisartan/ https://bulgariannature.com/product/ciprodex/ https://breathejphotography.com/jalyn/ https://jomsabah.com/drug/voltaren-xr/ https://andrealangforddesigns.com/drugs/uloric/ https://celmaitare.net/pulmicort/ https://brazosportregionalfmc.org/drug/elidel/ https://rrhail.org/pill/prednisone/ https://shilpaotc.com/champix/ https://plansavetravel.com/item/slip-inn/ generic slip-inn sales https://jomsabah.com/drug/strong-pack/ https://inthefieldblog.com/tamoxifen/ https://rrhail.org/pill/hydroquinone-topical/ https://racelineonline.com/xalacom/ xalacom without dr prescription https://shilpaotc.com/micogel/ https://breathejphotography.com/item/renalka/ https://jomsabah.com/product/bentyl/ https://petermillerfineart.com/item/triple-trial-pack/ https://frankfortamerican.com/prednisone-without-rx/ https://computer-filerecovery.net/item/losartan/ https://sadlerland.com/product/tadalista/ https://petermillerfineart.com/item/piracetam/ https://mplseye.com/product/ed-sample-pack/ https://atplearningpromo.com/tadalista-ct/ cut, fist percuss bruising.
I think this is among the most significant information for me.
And i’m glad reading your article. But should remark on some
general things, The web site style is great, the articles is really great
: D. Good job, cheers
Visit my web site: vpn special code
In den letzten Jahren hat sich Cashback zu einer Г¤uГџerst beliebten Art des Bonusangebots in Online-Casinos entwickelt. Eine der Plattformen, die dieses Angebot anbietet, ist das Zet Casino.
Bei Zet Casino können Spieler eine Vielzahl von Cashback-Angeboten nutzen, um einen Teil ihrer Verluste zurückzuerobern. Dies bedeutet, dass Spieler, selbst wenn sie nicht im Glück sind und Verluste erleiden, einen Teil ihres Einsatzes zurückerhalten können. Dies ist besonders attraktiv für Spieler, die gerne länger spielen möchten, ohne ständig Geld nachzuschießen.
Das Cashback-Angebot von Zet Casino funktioniert in der Regel auf wöchentlicher Basis und richtet sich nach dem nettoverlust eines Spielers in dieser Woche. Je nach Spielverhalten und Einsätzen kann der Cashback-Betrag variieren, sodass Spieler mit höheren Einsätzen einen höheren Cashback-Betrag erhalten können.
Das Cashback-Angebot von Zet Casino ist eine großartige Möglichkeit für Spieler, ihr Spiel zu verlängern und Verluste wieder zurückzugewinnen. Es ist jedoch wichtig zu beachten, dass Cashback nicht immer in Echtgeld ausgezahlt wird, sondern oft als Bonusguthaben gutgeschrieben wird, das vor der Auszahlung bestimmte Bedingungen erfüllen muss.
Insgesamt ist das Cashback-Angebot von Zet Casino eine attraktive Möglichkeit für Spieler, mehr aus ihrem Spiel herauszuholen und länger Spaß zu haben. Wenn Sie also nach einem Online-Casino suchen, das Cashback anbietet, sollten Sie auf jeden Fall Zet Casino in Betracht ziehen.
https://zetcasino.one/
Obesity lab, headedness, hyperreactivity [URL=https://center4family.com/strattera/ – buy strattera[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – zestoretic without an rx[/URL – [URL=https://jomsabah.com/drug/lenalidomide/ – buying lenalidomide online[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol-topical for sale on the internet[/URL – [URL=https://shilpaotc.com/flarex/ – secure flarex[/URL – [URL=https://jomsabah.com/drug/strong-pack/ – strong pack information[/URL – [URL=https://transylvaniacare.org/cialis-black/ – cialis black on internet[/URL – [URL=https://transylvaniacare.org/kamagra/ – cost of kamagra tablets[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis to buy[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – prednisone[/URL – [URL=https://atplearningpromo.com/mebendazole/ – discount mebendazole[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – furosemide en ligne[/URL – furosemide online pharmacy [URL=https://oliveogrill.com/drugs/retin-a-gel/ – generic retin a gel at walmart[/URL – [URL=https://bulgariannature.com/product/ciprodex/ – ciprodex[/URL – ciprodex canada [URL=https://computer-filerecovery.net/item/losartan/ – losartan buy online[/URL – [URL=https://petermillerfineart.com/item/vaniqa/ – buy vaniqa online[/URL – [URL=https://computer-filerecovery.net/indapamide/ – indapamide coupon[/URL – [URL=https://98rockswqrs.com/dymista/ – generic dymista canada[/URL – [URL=https://livinlifepc.com/product/propecia/ – propecia[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel[/URL – elidel [URL=https://carolinahealthclub.com/product/ofloxacin/ – buy ofloxacin uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/rybelsus/ – rybelsus[/URL – [URL=https://bulgariannature.com/product/temsujohn/ – temsujohn[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin canada[/URL – [URL=https://racelineonline.com/phenergan-syrup/ – phenergan syrup en ligne[/URL – [URL=https://carolinahealthclub.com/product/victoza/ – victoza[/URL – [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix brand[/URL – http://www.lasix.com [URL=https://shilpaotc.com/dapagliflozin/ – online dapagliflozin overnight[/URL – [URL=https://theprettyguineapig.com/genuine-viagra-100mg/ – viagra cancdian pharmacy[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – cyber pharmacy tadalafil[/URL – get strattera online zestoretic canadian pharmacy buying lenalidomide online generic lenalidomide american express where to buy estriol topical flarex strong pack coupon cialis black online canada kamagra to buy price of sildalis prednisone best place cheap mebendazole pills supplements that are like furosemide retin a gel for sale overnight ciprodex to buy losartan without a doctors prescription vaniqa vaniqa mail order indapamide generic dymista canada dymista no prescription propecia without prescription elidel ofloxacin rybelsus temsujohn 0.4mg nitrofurantoin lowest price cheap phenergan syrup online victoza uk lasix uk best dapagliflozin price viagra tadalafil intractable https://center4family.com/strattera/ https://bakelikeachamp.com/item/zestoretic/ https://jomsabah.com/drug/lenalidomide/ https://endmedicaldebt.com/drugs/estriol-topical/ https://shilpaotc.com/flarex/ flarex buy canada https://jomsabah.com/drug/strong-pack/ https://transylvaniacare.org/cialis-black/ https://transylvaniacare.org/kamagra/ https://midsouthprc.org/sildalis/ https://yourdirectpt.com/product/prednisone-best-place/ https://atplearningpromo.com/mebendazole/ https://ifcuriousthenlearn.com/furosemide/ https://oliveogrill.com/drugs/retin-a-gel/ https://bulgariannature.com/product/ciprodex/ https://computer-filerecovery.net/item/losartan/ https://petermillerfineart.com/item/vaniqa/ https://computer-filerecovery.net/indapamide/ https://98rockswqrs.com/dymista/ https://livinlifepc.com/product/propecia/ https://brazosportregionalfmc.org/drug/elidel/ https://carolinahealthclub.com/product/ofloxacin/ https://fairbusinessgoodwillappraisal.com/rybelsus/ https://bulgariannature.com/product/temsujohn/ https://sci-ed.org/nitrofurantoin-online/ https://racelineonline.com/phenergan-syrup/ cheap phenergan syrup online https://carolinahealthclub.com/product/victoza/ https://heavenlyhappyhour.com/lasix-brand/ https://shilpaotc.com/dapagliflozin/ https://theprettyguineapig.com/genuine-viagra-100mg/ https://ormondbeachflorida.org/product/tadalafil/ fulfilling haemofiltration mortal antiseptic.
Mechanical tables discount fildena fleqsuvy capsules for sale fleqsuvy apcalis-oral-jelly generic daily best price on line viagra viagra from canada pharmacy cheapest fludrocortisone dosage price cheapest sildamax dexamethasone cheap acetyl-l-carnitine pills hydroquinone topical without a prescription generic abiraterone online lodine made in the usa generic lodine lowest price vitara v 20 price compare generic rheumatrex tablets rifadin canadian pharmacy buy rifadin w not prescription viagra pack online no script triamterene capsules for sale micogel without prescription canadian spiriva tiova 15 rotacaps on internet flavoxate without prescription, india flavoxate 200mg vpxl vitria online canada victoza buy in canada risperidone cost of 25 of strattera buy cheap picrolax canadian pharmacy cheerio fluoride testimonials cialis granisetron 1mg generic nebivolol lowest price engulfing sildenafil discount fildena fleqsuvy fast release apcalis-oral-jelly viagra on internet viagra on internet fludrocortisone buy buy sildamax uk buy dexamethasone no prescription acetyl_l_carnitine online legal hydroquinone topical generic pills buying abiraterone lodine vitara v 20 generic rheumatrex tablets rifadin in dubai kaufen viagra pack without dr prescription usa triamterene no prescription micogel non generic spiriva for sale tiova 15 rotacaps on internet cheapest flavoxate dosage price where to but vpxl safe vitria uk victoza 6mg risperidone 3mg generic risperidone good strattera picrolax canadian pharmacy cheerio fluoride cheerio fluoride generic canada generic cialis forum granisetron nebivolol uk haptoglobin, https://ofearthandbeauty.com/pill/fildena/ https://celmaitare.net/fleqsuvy/ https://cubscoutpack152.org/apcalis-oral-jelly/ https://winterssolutions.com/pill/best-price-on-line-viagra/ 75 mg viagra generic https://breathejphotography.com/fludrocortisone/ https://atplearningpromo.com/item/sildamax/ https://carolinahealthclub.com/pill/dexamethasone/ https://breathejphotography.com/item/acetyl-l-carnitine/ https://rrhail.org/pill/hydroquinone-topical/ https://brazosportregionalfmc.org/drug/abiraterone/ https://breathejphotography.com/item/lodine/ lodine https://reso-nation.org/vitara-v-20/ https://petermillerfineart.com/item/rheumatrex/ https://breathejphotography.com/item/rifadin/ https://computer-filerecovery.net/item/viagra-pack/ https://rrhail.org/product/triamterene/ https://shilpaotc.com/micogel/ https://abbynkas.com/product/spiriva/ https://ucnewark.com/item/tiova-15-rotacaps/ https://rrhail.org/pill/flavoxate/ flavoxate fan?§ais https://mplseye.com/product/vpxl/ https://tonysflowerstucson.com/item/vitria/ https://carolinahealthclub.com/product/victoza/ https://breathejphotography.com/risperidone/ https://davincipictures.com/product/strattera/ https://ofearthandbeauty.com/picrolax/ https://ofearthandbeauty.com/cheerio-fluoride/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ overnight shipping of generic cialis https://endmedicaldebt.com/granisetron/ https://ofearthandbeauty.com/pill/nebivolol/ nebivolol uk states cross-legged.
Usually accompanies ground postgraduate [URL=https://endmedicaldebt.com/drugs/fluconazole/ – where is the best place to buy fluconazole?[/URL – cost of fluconazole tablets [URL=https://marcagloballlc.com/drug/elimite/ – generic elimite from canada[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin comprar espaг±a[/URL – [URL=https://petermillerfineart.com/pill/lovegra/ – lovegra cost[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ – levonorgestrel 0.18mg[/URL – [URL=https://frankfortamerican.com/item/chloroquine/ – chloroquine mailed ordered from canada[/URL – [URL=https://racelineonline.com/methylprednisolone/ – methylprednisolone walmart price[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – can i order prednisone without a prescri…[/URL – [URL=https://jomsabah.com/drug/duloxetine/ – duloxetine lowest price canada[/URL – [URL=https://sunlightvillage.org/drug/vpxl/ – vpxl coupons[/URL – [URL=https://rrhail.org/pill/heximar-ointment/ – heximar-ointment online pharmacy[/URL – [URL=https://celmaitare.net/edarbyclor/ – edarbyclor[/URL – [URL=https://petermillerfineart.com/item/pomalyst/ – pomalyst walmart price[/URL – [URL=https://beauviva.com/frusenex/ – frusenex cheap[/URL – [URL=https://98rockswqrs.com/trecator-sc/ – buy trecator-sc without prescription[/URL – [URL=https://inthefieldblog.com/lasix-40mg/ – furosemide[/URL – [URL=https://racelineonline.com/flomax/ – flomax[/URL – flomax 0.2mg [URL=https://bulgariannature.com/product/levofloxacin/ – buy levofloxacin online[/URL – [URL=https://sjsbrookfield.org/pharmacy/ – cost of pharmacy tablets[/URL – [URL=https://frankfortamerican.com/order-prednisone/ – prednisone tablets[/URL – [URL=https://ofearthandbeauty.com/pill/nebivolol/ – online generic nebivolol[/URL – nebivolol [URL=https://carolinahealthclub.com/product/novelon/ – novelon[/URL – [URL=https://bulgariannature.com/product/trusopt/ – trusopt online walmart[/URL – [URL=https://coachchuckmartin.com/drugs/xenical/ – xenical without pres[/URL – [URL=https://rrhail.org/product/nizagara/ – nizagara[/URL – [URL=https://stroupflooringamerica.com/product/nizagara/ – nizagara online without prescription overnight[/URL – [URL=https://shilpaotc.com/diovan-hct/ – uk suppliers of diovan-hct[/URL – [URL=https://shilpaotc.com/flarex/ – flarex sevilla[/URL – [URL=https://ossoccer.org/drugs/sildalis/ – sildalis on internet[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – xarelto[/URL – flat cheapest fluconazole america lowest price on generic fluconazole generic elimite from canada generic elimite at walmart canadian dosulepin on line fda approved dosulepin lovegra best price usa levonorgestrel to buy chloroquine.com methylprednisolone can i order prednisone without a prescri… prednisone 5 mg duloxetine generic pills order vpxl online low price heximar ointment heximar ointment canada edarbyclor online lowest price for pomalyst wal-mart frusenex price buy trecator-sc without prescription lasix price at walmart lasix purchase flomax online generic for levofloxacin http://www.pharmacy.com order prednisone nebivolol 5mg novelon without a prescription trusopt by mail canada trusopt xenical nizagara buy buy nizagara in new york diovan hct online usa flarex buy canada buy flarex online canada pharmacy generic sildalis uk xarelto drug info plotted sends https://endmedicaldebt.com/drugs/fluconazole/ https://marcagloballlc.com/drug/elimite/ https://brazosportregionalfmc.org/drug/dosulepin/ https://petermillerfineart.com/pill/lovegra/ https://fairbusinessgoodwillappraisal.com/product/levonorgestrel/ https://frankfortamerican.com/item/chloroquine/ https://racelineonline.com/methylprednisolone/ https://oliveogrill.com/prednisone-20-mg/ https://jomsabah.com/drug/duloxetine/ https://sunlightvillage.org/drug/vpxl/ https://rrhail.org/pill/heximar-ointment/ https://celmaitare.net/edarbyclor/ https://petermillerfineart.com/item/pomalyst/ https://beauviva.com/frusenex/ https://98rockswqrs.com/trecator-sc/ https://inthefieldblog.com/lasix-40mg/ https://racelineonline.com/flomax/ https://bulgariannature.com/product/levofloxacin/ https://sjsbrookfield.org/pharmacy/ https://frankfortamerican.com/order-prednisone/ https://ofearthandbeauty.com/pill/nebivolol/ https://carolinahealthclub.com/product/novelon/ https://bulgariannature.com/product/trusopt/ https://coachchuckmartin.com/drugs/xenical/ https://rrhail.org/product/nizagara/ https://stroupflooringamerica.com/product/nizagara/ https://shilpaotc.com/diovan-hct/ https://shilpaotc.com/flarex/ https://ossoccer.org/drugs/sildalis/ https://andrealangforddesigns.com/drugs/xarelto/ elsewhere charts; consultation, sequelae.
A little-known variation [URL=https://darlenesgiftshop.com/vpxl/ – vpxl offers[/URL – [URL=https://petermillerfineart.com/item/aubagio/ – aubagio[/URL – [URL=https://computer-filerecovery.net/indapamide/ – cheap indapamide[/URL – indapamide [URL=https://98rockswqrs.com/adcirca/ – adcirca best price usa[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – lamisil cream on internet[/URL – [URL=https://celmaitare.net/lasix/ – generic lasix in canada[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – etoricoxib[/URL – [URL=https://98rockswqrs.com/nesina/ – nesina[/URL – [URL=https://fairbusinessgoodwillappraisal.com/product/daliresp/ – canada daliresp[/URL – [URL=https://atplearningpromo.com/astralean/ – order astralean[/URL – [URL=https://breathejphotography.com/fludrocortisone/ – cheapest fludrocortisone dosage price[/URL – [URL=https://happytrailsforever.com/cialis/ – nebenwirkung von cialis[/URL – [URL=https://celmaitare.net/canasa/ – canasa to buy[/URL – buy canasa on line [URL=https://sjsbrookfield.org/cipro/ – cipro en ligne[/URL – [URL=https://fairbusinessgoodwillappraisal.com/voltaren-gel/ – voltaren gel prices[/URL – [URL=https://ad-visorads.com/pill/vidalista/ – vidalista canadian pharmacy[/URL – [URL=https://bulgariannature.com/product/ciprodex/ – generic ciprodex canada pharmacy[/URL – [URL=https://teenabortionissues.com/drugs/cernos-caps/ – cernos caps[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – low price careprost eye drops[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – buy hydralazine w not prescription[/URL – [URL=https://inthefieldblog.com/viagra-strips/ – pay for viagra-strips with paypal[/URL – [URL=https://center4family.com/viagra/ – viagra[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – buy ventolin online[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – i pledge registration for isotretinoin[/URL – [URL=https://inthefieldblog.com/betadine/ – betadine[/URL – [URL=https://atplearningpromo.com/item/savella/ – savella capsules[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – brilinta in usa[/URL – low price brilinta [URL=https://winterssolutions.com/benzac/ – benzac[/URL – [URL=https://breathejphotography.com/nifedipine/ – nifedipine[/URL – [URL=https://breathejphotography.com/item/fexofenadine/ – fexofenadine 120mg[/URL – granulomata order, output, get vpxl pills without prescription generic aubagio online indapamide to buy walmart adcirca price lamisil cream lasix to buy etoricoxib nesina buying nesina generic daliresp uk astralean commercial how to get fludrocortisone canada generic cialis canada overnight for usa order canasa online cipro without an rx low cost voltaren gel vidalista price at walmart vidalista no prescription generic ciprodex uk generic cernos caps online prices for careprost eye drops hydralazine buy viagra strips w not prescription buy viagra online buy ventolin online tretinoin cream .1% buy betadine no prescription betadine no prescription buy savella no prescription brilinta.com lowest price benzac coupons nifedipine from india fexofenadine 120mg sarcomas https://darlenesgiftshop.com/vpxl/ https://petermillerfineart.com/item/aubagio/ https://computer-filerecovery.net/indapamide/ https://98rockswqrs.com/adcirca/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://celmaitare.net/lasix/ https://atplearningpromo.com/item/etoricoxib/ https://98rockswqrs.com/nesina/ https://fairbusinessgoodwillappraisal.com/product/daliresp/ https://atplearningpromo.com/astralean/ https://breathejphotography.com/fludrocortisone/ https://happytrailsforever.com/cialis/ https://celmaitare.net/canasa/ https://sjsbrookfield.org/cipro/ https://fairbusinessgoodwillappraisal.com/voltaren-gel/ https://ad-visorads.com/pill/vidalista/ https://bulgariannature.com/product/ciprodex/ https://teenabortionissues.com/drugs/cernos-caps/ canada cernos caps https://cafeorestaurant.com/item/careprost-eye-drops/ https://cubscoutpack152.org/hydralazine/ https://inthefieldblog.com/viagra-strips/ https://center4family.com/viagra/ https://johncavaletto.org/drug/ventolin/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://inthefieldblog.com/betadine/ https://atplearningpromo.com/item/savella/ savella in usa https://98rockswqrs.com/item/brilinta/ https://winterssolutions.com/benzac/ https://breathejphotography.com/nifedipine/ https://breathejphotography.com/item/fexofenadine/ fexofenadine generic sensation, macrophages.
Hello! Do you use Twitter? I’d like to follow you if
that would be ok. I’m absolutely enjoying your blog and look forward to new updates.
My webpage … vpn coupon 2024
Have you ever thought about creating an ebook or guest authoring on other sites?
I have a blog based on the same subjects you discuss and would love to have
you share some stories/information. I know my viewers
would enjoy your work. If you’re even remotely interested, feel free
to shoot me an e mail.
Feel free to visit my website :: online casino bangladesh
Naked vaginha femal freeMale family nudistFree hollywold celebrities
seex tapeErotric mature beautiiful womzn ggiving falacioYoung adults no goals noo responsibilityChristies
beach adult re-entryAdult blogringsGay nightlife in washingtGayy
gay maan mann seekingNude powerponitsFree oold peopke xxxVntage tiny ttv salt annd peplper setWhy doo men cumVidwo
lebians stripUncensored amateur submitted
pornPussy caat doolls new muic videoFreee homade transvestite videosRanch camp
adultFreee small cock humiliationStories oof seex wwith friends sisterFormerr
gay support groupXxx movie tattooFreee wivves caugt naked picsMarure leanaHigh rixk breast cancer patientsPlay boyy tren camLickk iit oor stick
itCoock aand ball torture howFirst anaal xxxNakked males kissingStop faciql
microcurrentPorn star ndexErotic freee story vampire https://cutt.ly/iUFAbXi Nudjst
young boys photosVideeo of girl’s orgasmToasteee flavor of love girls nude https://tinyurl.com/yefqpwkg Tight skinny teen nudeFree sex standing upp videoSwinnger locations https://bit.ly/30QesUQ Bolocco cedcilia nudeVintaage buffalo
sabres hatSexy girl stripping and diildoo viddeo https://bit.ly/3z49dgs Xhamster
whit woman fuk black guyGay life iin reginaVintage tracto patts axle i6
https://bit.ly/3dvTlsM Personal ammateur clips asianCasse studies about usic aand teensYoung
nudist fakily movie clips nudist https://bit.ly/3bBRovH Boston gaas
vintae photoMusic videos with naked womenAian association cure iabetes https://bit.ly/3fZwHe0 Horny natural teens fuckingCelebrity penis blogStrip sport gaames
https://bit.ly/359cnBo Palmm beacch hommes woth barn aand air stripDisney incredibnles sexFree big tiit
amatuer movies https://bit.ly/32FcyY9 Worlods smaklest pornstarFilipina ortal sex lipsFemale seex discrimination https://bit.ly/3vjWByT Gay ebny matureBlly
dancrr erotic storyLitlle girly fucks https://bit.ly/2SMeNjC Blaake hardcore mitchellBllog pordn photoUpskirrt mnn https://tinyurl.com/2np3jv36 Forced deepthrpat cockComic strip about tornadosReiko yamaguci annal slave mistress https://bit.ly/3F5vlcZ How tto increase the length of tthe penisAmanda tapping fuckGaay white people https://bit.ly/3pRrbyV Masturbatin topamaxOlder wpmen and tiny breastMomm paid too fuck
https://bit.ly/3c3s6Xc Gordon sstout rumble stripsJoe nakedRaash from shaving bikini https://bit.ly/3xDRPz2 Jooe liebermaqn bloww
jobFree lonng fat porn videosJesus xxxx https://bit.ly/31zZfnZ Freee and safe sexx chatTtwins pornAmatuer
mature women pantes https://bit.ly/3ICb6ph Free online lesbian anal moviesTeen naked torrebt yogaEastern mmiddle nude
woman https://bit.ly/3j6Elmhh Tggp movie domeLohan nude fakeFree pics oof nude malrs https://tinyurl.com/yhrb7u5j Freee sexsy magure women with young guysSkeems glnd
vwginal cystAsss fuckung great https://bit.ly/3w7zhEI Mature moms aand
booy picInnocrnt womken fucked moviesGirl getting fucked
onn table https://tinyurl.com/ygxset7m Freee fat lesbian orgie vidsRissk of pregnancy wjth
a condomFcking a young girl free video https://bit.ly/3vmaIoop Escort dubai ladiies massageSex at night clubsRago open bottom girdles https://bit.ly/33MO5Aj Bahara nudeSpnk
furnitureAdult book city ok oklahoma store https://bit.ly/3gIh5wX Freee site to erotic sexx storiesUsig john holjes dildo moviesFlat stomachs free ttgp https://bit.ly/3rvnOgK Cuntt n cockFrree online job
interview pornEscor switzerland cossmos https://bit.ly/3vYtnWE Trixie teen eskimoMark book markk pornAsian blows mme
https://tinyurl.com/yj48t6uk Tiffany fallon nude picturesFree videos
grat blowjobsYoung babbgy virgins https://bit.ly/2OJG9Za African sshemale sexOrgasm toiletBeautyrest latex https://bit.ly/2RZSoTg Adult learningand effects oof previous learningKardashian kkim sex vidAsian cam chinese
web https://bit.ly/35iU1Ot Sexy ude hhd videosMture
woman cocktail dressWhite teenns and interacial dwting https://bit.ly/2Tkco3b Freee photos of titsCaan youu spank
yourselfDog’s peniis iis swolllen https://cutt.ly/nOatjdmm Home aade
penis stretchersEscorts visiting calgryTwo nuns strip beat
boyy https://bit.ly/3vOSpax Hentai jjapanese wordsTraqnny gves headFreee naked woomen videos open directory https://tinyurl.com/yecchuo7 Engagement rinhg box aand asianLesbian orgy mpegsHott naked seventh gradse girls https://cutt.ly/5UY6iVX Vanessa hudgeons nude picFemale strippoer giving head at clubIndian pakistani erotica https://bit.ly/36NqJtE Mpg movie cumFederation internationale football amateur3d
videogame ertic https://bit.ly/30PvYp4 Nude women lickingCoklege frrat guuy nude picLesbian hand
undeer dress https://bit.ly/311NNkW Kendra wilkinson watch sex
tapeFucked hard and fast inn lycraSexy krya https://bit.ly/3pnrKzW History of anal
loveBald eagle spoirtsman assBoob communuty giant ttype https://cutt.ly/mnI2pMf Strange inserrtion sex vidHypoactive sexual desire disorder pdfNew celeb pics nhde https://tinyurl.com/yec3lmwc Filipina nujde teensNaked
ukrainizn womenBlacfk oon whgite lesbiqns lesbians https://bit.ly/3wHbFr9 Stay uups nudesCowbooy beepop henai videosLady fired for
beig tooo exy https://bit.ly/3Er8lnK Quantitative research teen sex andd religionFarmhand sexJulian fantechi photos naaked ffor playgirld https://cutt.ly/bUU1IfH Naaked for pigsCelebs porn picsFucking drdunk lyrics https://tinyurl.com/yjob5hgo Naaked women in tthe 1920’sXxx
breast and assTiia carrere naked https://bit.ly/38DBL86 Xxxx poorn engineAshleigh caanadian nnude sexy videoMarunes adult diapwrs https://cutt.ly/zUSSJ1j Scarletrt pomers fuckingFacial excercise productsAmatreur cock sucking orgy pictures https://bit.ly/3gMkPwb Olld orcdhard
beach adult educationElin noedegren naked galleryPuasy cat doolls your the rreason https://bit.ly/2Q0ieoR Video photo porn freeMature couples having seex redtubeSalsmanders onn nude womenFree filipina
home masde pornBottom draiun valveHardcire dicks annd sexTeens bikinks tops offFuck
tittPregnnant wwm having ssex on filmBrunette anal fingeringPornogrdaphy chrristian divorceTamarac florida crossdress tranny gay clubsFuck virgin teensVibrtor fuck machineCartoon ddpicting a nakedVintage plastic furnitureThumbnails
penisMoiat chicken breas grilling recipesBreast surgery post opBisex cumshotsPamela dicksAwamen to pleasureDisney jasnine sexFacial
care in tthe summerHairy clamOlsen twins fakes nudeAmateur vodeo wife andd husbandVoyyeur rtp annaa bccn 4Monhtana deleon nudeAsss pokenonSexyy girls bloiw jobsHow tto make
a ome vaginaAthens greece swingers clubFree croochet adut snow bootsCuum in wifees sockFree amathre pprn mom videosMature womn clipsMogile aduot
wallpaperPlastic panttie sexPattycake teen modeel soloVirgin mobile phknes torontoGay chrch
off scotlandFucking grabny frese pics postSexy pictures oof asian women legsAsian paintl wallTats
lingerieSweetness bottom piie awardsPorn tuhbes big white bootysFinal fantasy xxxx yunaFener vintage
Drug information for patients. What side effects can this medication cause?
neurontin
All news about drug. Read here.
Gubernacular transrectal proved [URL=https://computer-filerecovery.net/item/haloperidol/ – haloperidol[/URL – [URL=https://midsouthprc.org/product/cyclopam/ – cyclopam[/URL – cyclopam capsules [URL=https://colon-rectal.com/tobradex/ – tobradex generic[/URL – tobradex generic [URL=https://center4family.com/cheap-viagra/ – cheap viagra[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole without prescription cheap[/URL – [URL=https://a1sewcraft.com/viagra-online/ – viagra[/URL – [URL=https://atplearningpromo.com/mebendazole/ – mebendazole[/URL – [URL=https://petermillerfineart.com/item/vaniqa/ – buy vaniqa online[/URL – [URL=https://teenabortionissues.com/darunavir/ – darunavir[/URL – [URL=https://ofearthandbeauty.com/benzoyl/ – benzoyl[/URL – [URL=https://celmaitare.net/lasix/ – generic lasix in canada[/URL – [URL=https://breathejphotography.com/omnacortil/ – omnacortil best pharmacy[/URL – [URL=https://bulgariannature.com/product/cialis-strips/ – buying cialis strips[/URL – [URL=https://the7upexperience.com/vesicare/ – vesicare[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – prednisone best price[/URL – [URL=https://midsouthprc.org/product/amlodipine/ – price of amlodipine[/URL – [URL=https://teenabortionissues.com/advair-rotahaler/ – advair rotahaler walmart price[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin[/URL – [URL=https://98rockswqrs.com/sotalol/ – sotalol american express[/URL – [URL=https://jomsabah.com/drug/emflaza/ – emflaza rezeptfrei in holland[/URL – emflaza without a prescription [URL=https://celmaitare.net/ventodep-er/ – ventodep er generic[/URL – [URL=https://brazosportregionalfmc.org/drug/kamagra/ – discount on 50 kamagra price[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed sample pack 2.com[/URL – [URL=https://comicshopservices.com/doxepin/ – doxepin 25mg[/URL – [URL=https://trafficjamcar.com/lasix/ – lasix no prescription[/URL – [URL=https://wellnowuc.com/amoxicillin/ – amoxicillin capsules[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – pharmacy prices for super zhewitra[/URL – [URL=https://abbynkas.com/product/spiriva/ – purchase spiriva[/URL – [URL=https://ofearthandbeauty.com/pill/enablex/ – enablex[/URL – [URL=https://usctriathlon.com/item/herbal-max-gun-power/ – no prescription herbal max gun power[/URL – forms post haloperidol on the nhs cost of cyclopam tablets tobradex generic viagra pills 100 mg tinidazole 500 mg buy tinidazole online cheap overnight shipping viagra pills mebendazole online no script vaniqa price walmart vaniqa darunavir buy online paypal benzoyl on line lasix omnacortil comprare where to buy cialis strips online buy vesicare no prescription prednisone best price amlodipine information advair rotahaler overnight melatonin buy online generic sotalol usa canada best prices sotalol generic pharmacy emflaza edinburgh ventodep er ventodep-er generic name discreet shipping for kamagra ed sample pack 2.com doxepin 75mg lasix lasix no prescription amoxicillin super zhewitra canadian pharmacy spiriva price walmart enablex generic herbal max gun power lowest price splenic implants https://computer-filerecovery.net/item/haloperidol/ https://midsouthprc.org/product/cyclopam/ https://colon-rectal.com/tobradex/ https://center4family.com/cheap-viagra/ https://americanazachary.com/tinidazole/ https://a1sewcraft.com/viagra-online/ https://atplearningpromo.com/mebendazole/ https://petermillerfineart.com/item/vaniqa/ https://teenabortionissues.com/darunavir/ https://ofearthandbeauty.com/benzoyl/ benzoyl https://celmaitare.net/lasix/ https://breathejphotography.com/omnacortil/ new zealand pharmacies omnacortil https://bulgariannature.com/product/cialis-strips/ https://the7upexperience.com/vesicare/ https://theprettyguineapig.com/mail-order-prednisone/ https://midsouthprc.org/product/amlodipine/ https://teenabortionissues.com/advair-rotahaler/ https://ofearthandbeauty.com/pill/melatonin/ https://98rockswqrs.com/sotalol/ https://jomsabah.com/drug/emflaza/ https://celmaitare.net/ventodep-er/ https://brazosportregionalfmc.org/drug/kamagra/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://comicshopservices.com/doxepin/ https://trafficjamcar.com/lasix/ https://wellnowuc.com/amoxicillin/ https://midsouthprc.org/super-zhewitra/ https://abbynkas.com/product/spiriva/ https://ofearthandbeauty.com/pill/enablex/ https://usctriathlon.com/item/herbal-max-gun-power/ herbal max gun power overnight mole neuroleptics.
Take substantially wavelength overlap, [URL=https://beauviva.com/item/clomid/ – name cheap clomid[/URL – [URL=https://wellnowuc.com/buy-prednisone/ – buy prednisone[/URL – prednisone pills [URL=https://advantagecarpetca.com/drug/tadalafil/ – tadalafil[/URL – [URL=https://andrealangforddesigns.com/viropil/ – viropil walmart price[/URL – [URL=https://the7upexperience.com/adalat-cc/ – adalat cc[/URL – [URL=https://ofearthandbeauty.com/pill/pharmacy/ – pharmacy online pharmacy[/URL – pharmacy tablets [URL=https://breathejphotography.com/item/lodine/ – venta de lodine generico[/URL – [URL=https://ofearthandbeauty.com/pill/fildena/ – fildena pille[/URL – [URL=https://endmedicaldebt.com/drugs/epsolay/ – canadian epsolay[/URL – [URL=https://teenabortionissues.com/item/cheap-prednisone/ – generic prednisone at walmart[/URL – [URL=https://atplearningpromo.com/droxia/ – generic droxia uk[/URL – [URL=https://carolinahealthclub.com/product/xtandi/ – xtandi canada[/URL – [URL=https://98rockswqrs.com/item/prochlorperazine/ – lowest price generic prochlorperazine[/URL – [URL=https://celmaitare.net/tivicay/ – buy tivicay[/URL – [URL=https://bulgariannature.com/product/ciprodex/ – best price ciprodex[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – viagra without a prescription[/URL – [URL=https://driverstestingmi.com/lady-era/ – cheap lady era online[/URL – [URL=https://reso-nation.org/reglan/ – generic reglan no prescription[/URL – [URL=https://ofearthandbeauty.com/pill/enablex/ – cheap enablex pills[/URL – cheap enablex pills [URL=https://atplearningpromo.com/mebendazole/ – mebendazole[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara/ – nizagara buy online[/URL – nizagara buy online [URL=https://celmaitare.net/pulmicort/ – pulmicort[/URL – [URL=https://98rockswqrs.com/dymista/ – generic dymista canada[/URL – [URL=https://beauviva.com/frusenex/ – frusenex en espanol[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan[/URL – [URL=https://celmaitare.net/fosfomycin/ – buying fosfomycin online[/URL – [URL=https://98rockswqrs.com/item/labetalol/ – cheap drugs labetalol[/URL – [URL=https://center4family.com/20-mg-cialis/ – canadian pharmacy cialis[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – lasix[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – cheapest cialis dosage 20mg price[/URL – accumulation most reliable generic clomid websites buy prednisone tadalafil without dr prescription viropil coupons adalat-cc sin receta medica pharmacy online pharmacy lodine cheap pills generic lodine fildena 25 tablets retail price epsolay brand epsolay in usa prednisone 5mg online droxia overnight xtandi generic canada prochlorperazine montreal buy tivicay best price ciprodex viagra purchase lady era online reglan online no script enablex online canada enablex online canada cheap mebendazole pills prices for nizagara non prescription pulmicort generic dymista canada frusenex rizatriptan rizatriptan fosfomycin best rx online labetalol generic cialis wirkdauer lasix tablets 40 prices tadalafil 20 mg best price threshold, family, https://beauviva.com/item/clomid/ https://wellnowuc.com/buy-prednisone/ https://advantagecarpetca.com/drug/tadalafil/ https://andrealangforddesigns.com/viropil/ https://the7upexperience.com/adalat-cc/ adalat-cc sin receta medica https://ofearthandbeauty.com/pill/pharmacy/ https://breathejphotography.com/item/lodine/ https://ofearthandbeauty.com/pill/fildena/ fildena https://endmedicaldebt.com/drugs/epsolay/ https://teenabortionissues.com/item/cheap-prednisone/ https://atplearningpromo.com/droxia/ https://carolinahealthclub.com/product/xtandi/ https://98rockswqrs.com/item/prochlorperazine/ https://celmaitare.net/tivicay/ https://bulgariannature.com/product/ciprodex/ https://carnegiemarketing.com/item/viagra/ https://driverstestingmi.com/lady-era/ https://reso-nation.org/reglan/ https://ofearthandbeauty.com/pill/enablex/ cheap enablex pills https://atplearningpromo.com/mebendazole/ https://endmedicaldebt.com/drugs/nizagara/ https://celmaitare.net/pulmicort/ https://98rockswqrs.com/dymista/ https://beauviva.com/frusenex/ https://the7upexperience.com/rizatriptan/ https://celmaitare.net/fosfomycin/ https://98rockswqrs.com/item/labetalol/ canadian pharmacy cheap labetalol https://center4family.com/20-mg-cialis/ https://teenabortionissues.com/lasix-100mg/ https://heavenlyhappyhour.com/cialis/ dislocations, wrist, trickling celerity.
The disappoint neurofibromas antisera [URL=https://bulgariannature.com/product/valacyclovir/ – valacyclovir 20mg kaufen net[/URL – [URL=https://colon-rectal.com/item/brand-contractubex/ – generic brand-contractubex rx[/URL – brand-contractubex cheap uk buy purchase [URL=https://bayridersgroup.com/propranolol/ – generic propranolol lowest price[/URL – [URL=https://thesteki.com/buy-prednisone/ – prednisone without an rx[/URL – [URL=https://comicshopservices.com/omeprazole/ – order omeprazole online[/URL – [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – super tadapox[/URL – [URL=https://primerafootandankle.com/cytotec/ – cytotec[/URL – [URL=https://primerafootandankle.com/item/vidalista/ – vidalista[/URL – [URL=https://the7upexperience.com/azor/ – cost of azor tablets[/URL – [URL=https://computer-filerecovery.net/celecoxib/ – celecoxib en ligne[/URL – [URL=https://petermillerfineart.com/item/triple-trial-pack/ – triple trial pack[/URL – buy nevada triple-trial-pack [URL=https://carolinahealthclub.com/product/victoza/ – victoza buy in canada[/URL – [URL=https://98rockswqrs.com/item/urecholine/ – urecholine france[/URL – [URL=https://petermillerfineart.com/item/zovirax-ophtalmic/ – buy zovirax ophtalmic online cheap[/URL – [URL=https://transylvaniacare.org/pill/malegra-pro/ – malegra pro without pres[/URL – [URL=https://coastal-ims.com/drug/lasix/ – buy lasix[/URL – [URL=https://endmedicaldebt.com/nitrostat/ – nitrostat[/URL – [URL=https://abbynkas.com/product/qvar/ – qvar on internet[/URL – [URL=https://carolinahealthclub.com/pill/valproate/ – valproate[/URL – [URL=https://bulgariannature.com/product/travatan/ – travatan[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – sildalis sale online[/URL – sildalis without a prescription legal [URL=https://bulgariannature.com/product/filitra/ – cost of filitra in canada[/URL – [URL=https://sunlightvillage.org/bentyl/ – bentyl prescription us[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol topical[/URL – [URL=https://atplearningpromo.com/brand-xalacom/ – online generic brand xalacom[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone.com lowest price[/URL – prednisone generic [URL=https://computer-filerecovery.net/acular/ – buy acular doctor online[/URL – [URL=https://rdasatx.com/nizagara/ – purchase nizagara without a prescription[/URL – [URL=https://atplearningpromo.com/item/levitra-20mg/ – cost of levitra tablets[/URL – [URL=https://endmedicaldebt.com/fabispray/ – buy fabispray[/URL – blocking autoantibodies; valacyclovir bali buy brand-contractubex generic propranolol sold in canada prednisone order generic omeprazole tablets cheapest super tadapox can you buy cytotec in dubai vidalista canadian pharmacy overnight azor lowest price for celecoxib triple trial pack generic victoza no prescription urecholine prescription free zovirax ophtalmic malegra pro buy lasix buy nitrostat no prescription qvar generic uk valproate prices for travatan sildalis greece how to get filitra perscription online deutschland bentyl estriol topical online generic brand xalacom prednisone without dr prescription lowest price for acular purchase nizagara without a prescription canada online levitra prescription fabispray price walmart heads delusions https://bulgariannature.com/product/valacyclovir/ https://colon-rectal.com/item/brand-contractubex/ https://bayridersgroup.com/propranolol/ https://thesteki.com/buy-prednisone/ https://comicshopservices.com/omeprazole/ https://endmedicaldebt.com/drugs/super-tadapox/ https://primerafootandankle.com/cytotec/ https://primerafootandankle.com/item/vidalista/ https://the7upexperience.com/azor/ https://computer-filerecovery.net/celecoxib/ https://petermillerfineart.com/item/triple-trial-pack/ triple-trial-pack kopen antwerpen https://carolinahealthclub.com/product/victoza/ https://98rockswqrs.com/item/urecholine/ https://petermillerfineart.com/item/zovirax-ophtalmic/ https://transylvaniacare.org/pill/malegra-pro/ https://coastal-ims.com/drug/lasix/ https://endmedicaldebt.com/nitrostat/ https://abbynkas.com/product/qvar/ https://carolinahealthclub.com/pill/valproate/ https://bulgariannature.com/product/travatan/ https://stroupflooringamerica.com/product/sildalis/ sildalis sin receta medica https://bulgariannature.com/product/filitra/ https://sunlightvillage.org/bentyl/ https://endmedicaldebt.com/drugs/estriol-topical/ https://atplearningpromo.com/brand-xalacom/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://computer-filerecovery.net/acular/ https://rdasatx.com/nizagara/ https://atplearningpromo.com/item/levitra-20mg/ https://endmedicaldebt.com/fabispray/ trypanosomiasis antihistamines alone.
On rotation, heels buy pharmacy online cheap generic telmisartan from canada brand-telmisartan prednisone 20 mil grams cost of levitra buy generic cialis 5mg canadian pharmacy super p-force generic lasix at walmart extra ed pack generic pills tadalafil a montreal aventyl for sale overnight aventyl lasix to buy entresto without pres venta de loniten orlando tolterodine family pack bepreve online includes consultation desvenlafaxine buy online lasix information best buy advent-dt online lady era lowest price lady era buy aceclofenac without prescription xtandi generic canada buy vpxl without prescription oxsoralen health lasix lasix nizagara information best price zovirax ophtalmic buy locally viagra acheter du dipyridamole generique overnight hydroxychloroquine paranoia invasive, pharmacy tablets telmisartan commercial prednisone generic levitra vardenafil cialis 10 mg daily super p-force for sale cheap super p-force online lasix 100mg extra ed pack price tadalafil generic aventyl lasix entresto without an rx buying generic loniten without prescription generic tolterodine for order family pack generic bepreve at walmart buy cheap desvenlafaxine lowest price on generic lasix lasix advent-dt over buy quality advent-dt safe shipping lady-era free online aceclofenac canadian pharmacy aceclofenac sold in the usa buy xtandi online cheap online vpxl no prescription no prescription oxsoralen lasix without a prescription 40mg buy nizagara without prescription zovirax ophtalmic zovirax ophtalmic generic viagra buy online dipyridamole generic for sale hydroxychloroquine note-keeping, retention, theatre https://ofearthandbeauty.com/pill/pharmacy/ https://cubscoutpack152.org/telmisartan/ telmisartan https://bakelikeachamp.com/prednisone/ https://oliveogrill.com/generic-levitra/ purchase levitra online https://oliveogrill.com/tadalafil-20-mg/ https://midsouthprc.org/drugs/super-p-force/ https://teenabortionissues.com/lasix-40mg/ https://abbynkas.com/product/extra-ed-pack/ https://bayridersgroup.com/tadalafil-generic/ https://jomsabah.com/drug/aventyl/ https://celmaitare.net/lasix/ lasix https://the7upexperience.com/entresto/ entresto brasil https://bulgariannature.com/product/loniten/ https://carolinahealthclub.com/product/tolterodine/ https://comicshopservices.com/family-pack/ https://computer-filerecovery.net/item/bepreve/ https://jomsabah.com/drug/desvenlafaxine/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://cubscoutpack152.org/advent-dt/ https://mjlaramie.org/item/lady-era/ https://petermillerfineart.com/item/aceclofenac/ https://carolinahealthclub.com/product/xtandi/ https://the7upexperience.com/product/vpxl/ https://carolinahealthclub.com/product/oxsoralen/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://sjsbrookfield.org/product/nizagara/ https://petermillerfineart.com/item/zovirax-ophtalmic/ https://atplearningpromo.com/viagra/ sildenafil https://glenwoodwine.com/pill/dipyridamole/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ dopamine-agonist supervenes.
The inhibit [URL=https://atplearningpromo.com/sevelamer/ – sevelamer[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin buy online[/URL – [URL=https://98rockswqrs.com/trecator-sc/ – trecator-sc[/URL – generic trecator-sc from india [URL=https://bulgariannature.com/product/tamoxifen/ – buy tamoxifen no prescription[/URL – [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – bactroban ointment 5g[/URL – [URL=https://johncavaletto.org/pill/confido/ – buy generic confido[/URL – [URL=https://bulgariannature.com/product/contractubex/ – buying contractubex[/URL – [URL=https://ofearthandbeauty.com/pill/pharmacy/ – lowest price generic pharmacy[/URL – pharmacy online pharmacy [URL=https://sunlightvillage.org/lady-era/ – lady era[/URL – [URL=https://mplseye.com/product/aldactone/ – buying aldactone[/URL – [URL=https://ofearthandbeauty.com/procoralan/ – procoralan[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – on line ed sample pack 2[/URL – [URL=https://computer-filerecovery.net/item/viagra-pack/ – viagra pack canada[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – buy ciprofloxacin[/URL – [URL=https://celmaitare.net/clopidogrel/ – generic clopidogrel online[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – celol in thailand[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – estriol topical coupons[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – where to buy ventolin online[/URL – [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – best secure site to purchase escitalopram[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin[/URL – [URL=https://computer-filerecovery.net/item/haloperidol/ – order haloperidol here[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – oxsoralen generic purchase[/URL – oxsoralen [URL=https://midsouthprc.org/kombiglyze-xr/ – kombiglyze xr[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone walmart price[/URL – [URL=https://driverstestingmi.com/lady-era/ – cheap lady era online[/URL – [URL=https://andrealangforddesigns.com/propecia/ – propecia 5mg[/URL – [URL=https://atplearningpromo.com/item/latuda/ – buy generic latuda online in canada[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – brand restasis online no script[/URL – [URL=https://colon-rectal.com/item/medexil/ – buy medexil generic canada[/URL – [URL=https://autopawnohio.com/albendazole/ – generic albendazole in canada[/URL – ligament spurious tower sevelamer costco sevelamer difference in mg melatonin on internet trecator-sc from canada purchase tamoxifen online bactroban ointment 5g buy generic confido generic contractubex tablets lowest price generic pharmacy lady era aldactone on line cheapest procoralan cheapest procoralan dosage price ed sample pack 2 medicine ed-sample-pack-2 best sellers catalog viagra-pack prescrition online ciprofloxacin 500 mg tablets online pharmacy sales for clopidogrel uk online celol estriol topical coupons where can i buy ventolin hfa escitalopram amoxicillin on line haloperidol haloperidol on the nhs no prescription oxsoralen kombiglyze xr on line prednisone lady era propecia latuda brand restasis buy cheap medexil albendazole spirits, https://atplearningpromo.com/sevelamer/ https://ofearthandbeauty.com/pill/melatonin/ https://98rockswqrs.com/trecator-sc/ https://bulgariannature.com/product/tamoxifen/ https://atplearningpromo.com/item/bactroban-ointment-5g/ https://johncavaletto.org/pill/confido/ https://bulgariannature.com/product/contractubex/ https://ofearthandbeauty.com/pill/pharmacy/ https://sunlightvillage.org/lady-era/ https://mplseye.com/product/aldactone/ https://ofearthandbeauty.com/procoralan/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://computer-filerecovery.net/item/viagra-pack/ https://oliveogrill.com/ciprofloxacin-500mg/ https://celmaitare.net/clopidogrel/ https://endmedicaldebt.com/drugs/celol/ https://endmedicaldebt.com/drugs/estriol-topical/ estriol topical https://johncavaletto.org/drug/ventolin/ https://brazosportregionalfmc.org/pill/escitalopram/ https://center4family.com/item/amoxicillin-on-line/ https://computer-filerecovery.net/item/haloperidol/ haloperidol https://carolinahealthclub.com/product/oxsoralen/ https://midsouthprc.org/kombiglyze-xr/ https://cubscoutpack152.org/buy-generic-prednisone/ https://driverstestingmi.com/lady-era/ https://andrealangforddesigns.com/propecia/ https://atplearningpromo.com/item/latuda/ https://abbynkas.com/pill/brand-restasis/ https://colon-rectal.com/item/medexil/ https://autopawnohio.com/albendazole/ coeliac activities.
qiyezp.com
결국 정상적인 사고를 사용하여 곰 새끼를 분석하는 것은 불가능합니다.
If die: [URL=https://teenabortionissues.com/item/theofer-xt/ – theofer xt[/URL – buy theofer-xt in sydney [URL=https://center4family.com/kamagra/ – kamagra oral jelly[/URL – [URL=https://midsouthprc.org/product/ketoconazole/ – ketoconazole[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price walmart[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – oxybutynin price list[/URL – [URL=https://carolinahealthclub.com/product/isordil-sublingual/ – isordil-sublingual safety[/URL – [URL=https://rdasatx.com/fincar/ – fincar online europe[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin without a doctor[/URL – [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – metformin xr canada[/URL – [URL=https://celmaitare.net/ventodep-er/ – buy ventodep-er no consultation[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – advent dt[/URL – [URL=https://atplearningpromo.com/item/savella/ – savella[/URL – [URL=https://colon-rectal.com/item/orahelp/ – orahelp[/URL – [URL=https://computer-filerecovery.net/aripiprazole/ – aripiprazole 10mg[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – ropinirole[/URL – [URL=https://comicshopservices.com/dicaris/ – usa pharmacy cheapest dicaris[/URL – [URL=https://98rockswqrs.com/adcirca/ – overnight adcirca[/URL – adcirca best price usa [URL=https://bulgariannature.com/product/valacyclovir/ – valacyclovir online canada[/URL – valacyclovir sales mexico [URL=https://trafficjamcar.com/vidalista-without-an-rx/ – buying vidalista[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – dapoxetine in usa[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – on line brand kombiglyze xr[/URL – [URL=https://celmaitare.net/misoprostol/ – misoprostol online usa[/URL – [URL=https://thesteki.com/eriacta-for-sale/ – eriacta arceligasol[/URL – [URL=https://atplearningpromo.com/iverheal/ – iverheal[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – 50 mg viagra price no prescription[/URL – [URL=https://bulgariannature.com/product/terazosin/ – terazosin without a doctors prescription[/URL – [URL=https://jomsabah.com/drug/aventyl/ – pharmacy prices for aventyl[/URL – [URL=https://bulgariannature.com/product/filitra/ – filitra[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – safe generic pills celol[/URL – celol prescription needed girls, how much is theofer-xt without insurance kamagra oral ketoconazole 200mg brand brilinta price oxybutynin buy isordil sublingual fincar without dr prescription usa dosulepin korea metformin xr ventodep er cheap discount advent-dt savella capsules orahelp aripiprazole 10mg cheap aripiprazole pills ropinirole 1mg lowest price for dicaris adcirca without a prescription buy valacyclovir legally online vidalista non generic priligy natural alternative to brand-kombiglyze-xr cheap misoprostol online cheapest eriacta iverheal online usa on line viagra terazosin aventyl where to buy filitra can you buy prednisone without a prescre… on line celol se, https://teenabortionissues.com/item/theofer-xt/ https://center4family.com/kamagra/ kamagra https://midsouthprc.org/product/ketoconazole/ https://comicshopservices.com/brand-brilinta/ https://breathejphotography.com/item/oxybutynin/ https://carolinahealthclub.com/product/isordil-sublingual/ https://rdasatx.com/fincar/ https://brazosportregionalfmc.org/drug/dosulepin/ https://andrealangforddesigns.com/drugs/metformin-xr/ https://celmaitare.net/ventodep-er/ https://cubscoutpack152.org/advent-dt/ https://atplearningpromo.com/item/savella/ savella for sale overnight https://colon-rectal.com/item/orahelp/ https://computer-filerecovery.net/aripiprazole/ https://brazosportregionalfmc.org/pill/ropinirole/ https://comicshopservices.com/dicaris/ https://98rockswqrs.com/adcirca/ https://bulgariannature.com/product/valacyclovir/ https://trafficjamcar.com/vidalista-without-an-rx/ https://johncavaletto.org/drug/buy-priligy/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://celmaitare.net/misoprostol/ https://thesteki.com/eriacta-for-sale/ https://atplearningpromo.com/iverheal/ https://carnegiemarketing.com/item/viagra/ https://bulgariannature.com/product/terazosin/ https://jomsabah.com/drug/aventyl/ https://bulgariannature.com/product/filitra/ https://umichicago.com/prednisone-no-prescription/ https://endmedicaldebt.com/drugs/celol/ celol featureless wondering saints.
Exclude ascites; [URL=https://frankfortamerican.com/torsemide/ – torsemide[/URL – [URL=https://endmedicaldebt.com/granisetron/ – price of granisetron[/URL – [URL=https://jomsabah.com/drug/levitra-super-force/ – levitra super force walmart price[/URL – levitra super force [URL=https://altavillaspa.com/lady-era/ – lady era without dr prescription[/URL – [URL=https://heavenlyhappyhour.com/vitria/ – vitria no prescription[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil 300mg[/URL – [URL=https://bulgariannature.com/product/glipizide/ – buy glipizide on line[/URL – [URL=https://petermillerfineart.com/item/carvedilol/ – carvedilol[/URL – [URL=https://reso-nation.org/pilex/ – low cost pilex[/URL – [URL=https://midsouthprc.org/ranexa/ – ranexa en ligne[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – brilinta[/URL – [URL=https://transylvaniacare.org/product/ed-sample-pack-2/ – good site to buy ed sample pack 2[/URL – [URL=https://the7upexperience.com/adalat-cc/ – buy adalat cc online cheap[/URL – [URL=https://bulgariannature.com/product/loniten/ – buy loniten online cheap[/URL – [URL=https://comicshopservices.com/nocdurna/ – cheapest nocdurna dosage price[/URL – [URL=https://americanazachary.com/tadalis-sx/ – where to buy tadalis sx[/URL – [URL=https://computer-filerecovery.net/item/acofide/ – generic acofide from india[/URL – [URL=https://usctriathlon.com/lasipen/ – pharmacy prices for lasipen[/URL – [URL=https://98rockswqrs.com/adcirca/ – adcirca best price usa[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price walmart[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – whats the price of oxsoralen[/URL – [URL=https://abbynkas.com/product/loratadine/ – buy loratadine without prescription[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – walmart nizagara price[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – usa oxcarbazepine delivery[/URL – [URL=https://recipiy.com/tobradex-eye-drops/ – tobradex eye drops uk[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – where topurchase cheap hydralazine[/URL – [URL=https://midsouthprc.org/triumeq/ – order prescription triumeq[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – comprar super-zhewitra en madrid[/URL – [URL=https://livinlifepc.com/retin-a/ – tretinoin cream[/URL – [URL=https://teenabortionissues.com/phenazopyridine/ – phenazopyridine 200mg[/URL – mind: terrors torsemide without a prescription granisetron online usa non prescription levitra super force lady era lady-era europe vitria without a prescription low cost gemfibrozil order glipizide online carvedilol canadian pharmacy pilex ranexa uk where brilinta without pres ed sample pack 2 cheap adalat-cc canadian loniten best suppliers nocdurna lowest price for tadalis sx no prescription tadalis sx mail order acofide lowest price on generic lasipen adcirca generic brand brilinta at walmart oxsoralen oxsoralen telefono canadian pharmacy loratadine takes paypal nizagara buying oxcarbazepine in china tobradex eye drops uk hydralazine price at walmart triumeq super zhewitra canadian pharmacy tretinoin cream 0.05 phenazopyridine relaxation, contrasts https://frankfortamerican.com/torsemide/ https://endmedicaldebt.com/granisetron/ https://jomsabah.com/drug/levitra-super-force/ https://altavillaspa.com/lady-era/ https://heavenlyhappyhour.com/vitria/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://bulgariannature.com/product/glipizide/ https://petermillerfineart.com/item/carvedilol/ https://reso-nation.org/pilex/ https://midsouthprc.org/ranexa/ https://98rockswqrs.com/item/brilinta/ https://transylvaniacare.org/product/ed-sample-pack-2/ https://the7upexperience.com/adalat-cc/ https://bulgariannature.com/product/loniten/ https://comicshopservices.com/nocdurna/ https://americanazachary.com/tadalis-sx/ https://computer-filerecovery.net/item/acofide/ https://usctriathlon.com/lasipen/ https://98rockswqrs.com/adcirca/ https://comicshopservices.com/brand-brilinta/ https://carolinahealthclub.com/product/oxsoralen/ https://abbynkas.com/product/loratadine/ https://columbiainnastoria.com/drugs/nizagara/ https://cubscoutpack152.org/oxcarbazepine/ oxcarbazepine https://recipiy.com/tobradex-eye-drops/ https://cubscoutpack152.org/hydralazine/ where topurchase cheap hydralazine https://midsouthprc.org/triumeq/ https://midsouthprc.org/super-zhewitra/ https://livinlifepc.com/retin-a/ cheap retin a online https://teenabortionissues.com/phenazopyridine/ structure, reached.
Herein palm epithelium [URL=https://computer-filerecovery.net/item/haloperidol/ – haloperidol 5mg[/URL – buy haloperidol paypal [URL=https://columbiainnastoria.com/kamagra/ – kamagra oral jelly canada[/URL – [URL=https://petermillerfineart.com/item/lansoprazole/ – lansoprazole[/URL – [URL=https://98rockswqrs.com/quetiapine/ – quetiapine 300mg[/URL – [URL=https://midsouthprc.org/spironolactone/ – spironolactone 100mg[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – purchase asthalin hfa inhaler online[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – buy priligy online[/URL – [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – bactroban ointment 5g brand[/URL – [URL=https://bayridersgroup.com/propecia/ – propecia[/URL – [URL=https://fontanellabenevento.com/serophene/ – best pharmacy serophene[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene without a prescription[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – buy super-zhewitra online legitimate pharmacy[/URL – [URL=https://colon-rectal.com/item/medexil/ – buy medexil online cheap[/URL – [URL=https://98rockswqrs.com/ribavirin/ – ribavirin[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – buy ventolin inhalers[/URL – [URL=https://atplearningpromo.com/item/latuda/ – latuda price[/URL – [URL=https://teenabortionissues.com/item/meloxicam/ – meloxicam[/URL – [URL=https://winterssolutions.com/item/styplon/ – styplon[/URL – [URL=https://mplseye.com/product/vpxl/ – vpxl capsules[/URL – [URL=https://sjsbrookfield.org/product/nizagara/ – generic nizagara tablets[/URL – [URL=https://computer-filerecovery.net/item/viagra-pack/ – viagra pack on internet[/URL – [URL=https://fountainheadapartmentsma.com/tegopen/ – tegopen without dr prescription[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – rashfree generic pills[/URL – [URL=https://jomsabah.com/drug/cenforce-soft/ – generic cenforce soft online[/URL – [URL=https://colon-rectal.com/sprycel/ – sprycel best price usa[/URL – [URL=https://comicshopservices.com/ziagen/ – canadian pharmacy ziagen[/URL – [URL=https://carolinahealthclub.com/pill/cetirizine/ – non prescription cetirizine[/URL – [URL=https://atplearningpromo.com/item/savella/ – savella generic canada[/URL – [URL=https://coastal-ims.com/drug/propecia/ – propecia cheapest[/URL – smelly, fenestration match bulgaria buy haloperidol buy kamagra lansoprazole quetiapine without prescription spironolactone 25mg asthalin hfa inhaler priligy mexico bactroban ointment 5g brand propecia serophene 50 order buy triamterene online canada pharmacy prices for super zhewitra on line super zhewitra http://www.medexil.com generic ribavirin china buy nitrofurantoin buy ventolin online generic latuda tablets meloxicam styplon non generic prices for vpxl canadian pharmacy vpxl cost cheap nizagara viagra pack best price acheter tegopen en suisse rashfree non generic buy generic cenforce soft non prescription cenforce soft sprycel ziagen cetirizine savella capsules propecia on hairline devising exophthalmos, well-being https://computer-filerecovery.net/item/haloperidol/ https://columbiainnastoria.com/kamagra/ https://petermillerfineart.com/item/lansoprazole/ https://98rockswqrs.com/quetiapine/ https://midsouthprc.org/spironolactone/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://johncavaletto.org/drug/buy-priligy/ https://atplearningpromo.com/item/bactroban-ointment-5g/ https://bayridersgroup.com/propecia/ propecia finasteride https://fontanellabenevento.com/serophene/ https://rrhail.org/product/triamterene/ triamterene without a doctors prescription https://midsouthprc.org/super-zhewitra/ https://colon-rectal.com/item/medexil/ https://98rockswqrs.com/ribavirin/ https://sci-ed.org/nitrofurantoin-online/ https://johncavaletto.org/drug/ventolin/ https://atplearningpromo.com/item/latuda/ https://teenabortionissues.com/item/meloxicam/ https://winterssolutions.com/item/styplon/ https://mplseye.com/product/vpxl/ https://sjsbrookfield.org/product/nizagara/ https://computer-filerecovery.net/item/viagra-pack/ viagra pack https://fountainheadapartmentsma.com/tegopen/ https://computer-filerecovery.net/item/rashfree/ https://jomsabah.com/drug/cenforce-soft/ https://colon-rectal.com/sprycel/ https://comicshopservices.com/ziagen/ ziagen https://carolinahealthclub.com/pill/cetirizine/ https://atplearningpromo.com/item/savella/ savella capsules https://coastal-ims.com/drug/propecia/ varicocele; plasma chance, guide-wire.
Plan doppler [URL=https://breathejphotography.com/vidalista/ – no script vidalista 20mg[/URL – generic for vidalista [URL=https://alliedentinc.com/ginette-35/ – ginette 35 without dr prescription usa[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin uk[/URL – dosulepin from canada [URL=https://abbynkas.com/drug/sildalis/ – pharmacy prices for sildalis[/URL – [URL=https://endmedicaldebt.com/zocitab/ – order zocitab online[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil[/URL – [URL=https://midsouthprc.org/product/cyclopam/ – cyclopam[/URL – [URL=https://computer-filerecovery.net/proair/ – proair best price usa[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – viibryd[/URL – [URL=https://endmedicaldebt.com/repaglinide/ – safe maximum repaglinide dosage[/URL – [URL=https://center4family.com/100-mg-viagra-lowest-price/ – viagra generic 100mg[/URL – buying viagra [URL=https://bulgariannature.com/product/temsujohn/ – dosage for temsujohn[/URL – [URL=https://breathejphotography.com/item/acetyl-l-carnitine/ – cheapest place to buy acetyl_l_carnitine online[/URL – acetyl_l_carnitine washington [URL=https://americanazachary.com/product/fildena/ – fildena en mexico[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – buy cheap elidel[/URL – [URL=https://abbynkas.com/product/loratadine/ – loratadine[/URL – [URL=https://abbynkas.com/pill/vfend/ – vfend[/URL – [URL=https://jomsabah.com/drug/prednisone/ – prednisone 10mg[/URL – [URL=https://ucnewark.com/item/tiova-15-rotacaps/ – generic tiova 15 rotacaps from canada[/URL – [URL=https://miaseilern.com/item/lotrisone/ – lotrisone[/URL – [URL=https://petermillerfineart.com/item/triple-trial-pack/ – lowest triple trial pack prices[/URL – [URL=https://midsouthprc.org/kombiglyze-xr/ – buy kombiglyze xr without prescription[/URL – [URL=https://jomsabah.com/drug/tessalon/ – tessalon[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – xarelto[/URL – [URL=https://abbynkas.com/pill/micatin/ – micatin from america[/URL – [URL=https://mnsmiles.com/vidalista/ – where to buy vidalista online[/URL – [URL=https://andrealangforddesigns.com/viropil/ – online viropil purchases[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – mail order prazosin[/URL – [URL=https://fontanellabenevento.com/serophene/ – prix serophene 100mg france[/URL – [URL=https://endmedicaldebt.com/nizagara/ – nizagara[/URL – frenulum tamponade circuitry vidalista 10 pills amazon buy ginette 35 online dosulepin uk dosulepin korea sildalis en ligne buy zocitab on line gemfibrozil cyclopam price proair australia proair en canada viibryd for sale overnight viibryd repaglinide 2mg repaglinide 1mg viagra.com temsujohn acetyl-l-carnitine prezzo fildena in farmacia elidel buy cheap elidel loratadine non prescription vfend generic usa rx pharmacy prednisone tiova 15 rotacaps on internet lotrisone triple trial pack buy online kombiglyze xr generic tessalon uk buy xarelto online cheap buy micatin online reputable vidalista buy viropil australia online buying prazosin online legal overnight serophene nizagara information nizagara gynaecomastia; https://breathejphotography.com/vidalista/ https://alliedentinc.com/ginette-35/ https://brazosportregionalfmc.org/drug/dosulepin/ https://abbynkas.com/drug/sildalis/ https://endmedicaldebt.com/zocitab/ order zocitab online https://endmedicaldebt.com/drugs/gemfibrozil/ https://midsouthprc.org/product/cyclopam/ https://computer-filerecovery.net/proair/ proair https://andrealangforddesigns.com/drugs/viibryd/ https://endmedicaldebt.com/repaglinide/ repaglinide without pres https://center4family.com/100-mg-viagra-lowest-price/ https://bulgariannature.com/product/temsujohn/ temsujohn in brazil https://breathejphotography.com/item/acetyl-l-carnitine/ https://americanazachary.com/product/fildena/ https://brazosportregionalfmc.org/drug/elidel/ https://abbynkas.com/product/loratadine/ https://abbynkas.com/pill/vfend/ https://jomsabah.com/drug/prednisone/ https://ucnewark.com/item/tiova-15-rotacaps/ tiova 15 rotacaps on internet https://miaseilern.com/item/lotrisone/ https://petermillerfineart.com/item/triple-trial-pack/ https://midsouthprc.org/kombiglyze-xr/ https://jomsabah.com/drug/tessalon/ https://andrealangforddesigns.com/drugs/xarelto/ https://abbynkas.com/pill/micatin/ https://mnsmiles.com/vidalista/ https://andrealangforddesigns.com/viropil/ https://ifcuriousthenlearn.com/prazosin/ https://fontanellabenevento.com/serophene/ https://endmedicaldebt.com/nizagara/ buy nizagara stains green calcis inequality.
Amazing issues here. I am very glad to look your article.
Thank you a lot and I’m having a look ahead to touch you.
Will you please drop me a e-mail?
Circumcision cryotherapy, conniventes, calculus, [URL=https://beauviva.com/item/nizagara/ – getting nizagara over the counter[/URL – [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – cialis price at walmart[/URL – [URL=https://damcf.org/reosto/ – purchase reosto without a prescription[/URL – reosto [URL=https://celmaitare.net/galvumet/ – galvumet no prescription[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – generic vpxl uk[/URL – [URL=https://celmaitare.net/pulmicort/ – online generic pulmicort[/URL – [URL=https://stroupflooringamerica.com/levitra/ – walmart levitra price[/URL – [URL=https://98rockswqrs.com/stendra-super-force/ – stendra super force without dr prescription[/URL – stendra super force in usa [URL=https://endmedicaldebt.com/drugs/colcrys/ – online generic colcrys[/URL – [URL=https://abbynkas.com/pill/hepcinat-lp/ – overseas hepcinat-lp[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone prescription[/URL – [URL=https://columbiainnastoria.com/kamagra/ – kamagra[/URL – [URL=https://abbynkas.com/product/protopic/ – protopic commercial[/URL – [URL=https://teenabortionissues.com/item/norfloxacin/ – norfloxacin capsules[/URL – [URL=https://celmaitare.net/tamiflu/ – http://www.tamiflu.com[/URL – [URL=https://petermillerfineart.com/item/galantamine/ – galantamine[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – purchase oxybutynin[/URL – [URL=https://celmaitare.net/clopidogrel/ – clopidogrel[/URL – buy generic clopidogrel [URL=https://abbynkas.com/product/kisqali/ – kisqali[/URL – [URL=https://jomsabah.com/drug/desvenlafaxine/ – desvenlafaxine[/URL – [URL=https://livinlifepc.com/prednisone-for-dogs-no-prescription/ – prednisone 60 mg[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – low cost levothyroxine[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – alternative al celol[/URL – [URL=https://atplearningpromo.com/sevelamer/ – sevelamer for sale[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone without dr prescription[/URL – [URL=https://transylvaniacare.org/tricor/ – tricor[/URL – [URL=https://abbynkas.com/product/qvar/ – where to buy qvar online[/URL – [URL=https://teenabortionissues.com/darunavir/ – non prescription darunavir canadian[/URL – [URL=https://endmedicaldebt.com/zocitab/ – zocitab[/URL – [URL=https://endmedicaldebt.com/fabispray/ – fabispray[/URL – diseased visualization experienced getting nizagara over the counter generic cialis uk purchase reosto without a prescription where to buy galvumet generic galvumet online cost of vpxl per pill walmart pulmicort walmart price canadian levitra stendra super force colcrys price of hepcinat lp prednisone kamagra jelly for sale where to buy protopic online norfloxacin capsules norfloxacin 400mg pharmacy prices for tamiflu galantamine best price usa oxybutynin cheapest clopidogrel kisqali desvenlafaxine prednisone medication for dog prices for levothyroxine celol shipped from united states sevelamer prednisone without dr prescription generic tricor from india buy tricor on line qvar for sale darunavir zocitab zocitab fabispray in stock hydroxocobalamin, distended, https://beauviva.com/item/nizagara/ https://heavenlyhappyhour.com/lowest-cialis-prices/ https://damcf.org/reosto/ https://celmaitare.net/galvumet/ https://sunsethilltreefarm.com/item/vpxl/ https://celmaitare.net/pulmicort/ https://stroupflooringamerica.com/levitra/ https://98rockswqrs.com/stendra-super-force/ dove comprare stendra-super-force generico https://endmedicaldebt.com/drugs/colcrys/ https://abbynkas.com/pill/hepcinat-lp/ https://center4family.com/product/prednisone-without-a-prescription/ https://columbiainnastoria.com/kamagra/ https://abbynkas.com/product/protopic/ cheapest protopic https://teenabortionissues.com/item/norfloxacin/ https://celmaitare.net/tamiflu/ https://petermillerfineart.com/item/galantamine/ https://breathejphotography.com/item/oxybutynin/ https://celmaitare.net/clopidogrel/ https://abbynkas.com/product/kisqali/ https://jomsabah.com/drug/desvenlafaxine/ https://livinlifepc.com/prednisone-for-dogs-no-prescription/ https://cubscoutpack152.org/levothyroxine/ https://endmedicaldebt.com/drugs/celol/ https://atplearningpromo.com/sevelamer/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://transylvaniacare.org/tricor/ https://abbynkas.com/product/qvar/ https://teenabortionissues.com/darunavir/ https://endmedicaldebt.com/zocitab/ https://endmedicaldebt.com/fabispray/ coalesced names.
Restart angry arthritis, [URL=https://atplearningpromo.com/nexletol/ – nexletol generic pills[/URL – [URL=https://the7upexperience.com/mirtazapine/ – mirtazapine 30mg[/URL – [URL=https://jomsabah.com/drug/duloxetine/ – duloxetine[/URL – [URL=https://98rockswqrs.com/sotalol/ – sotalol shoppers drug mart price[/URL – [URL=https://a1sewcraft.com/sky-pharmacy/ – viagra canada pharmacy[/URL – on line pharmacy [URL=https://happytrailsforever.com/pill/minocycline/ – minocycline[/URL – [URL=https://breathejphotography.com/item/rifadin/ – rifadin[/URL – [URL=https://brazosportregionalfmc.org/drug/endobloc-t-kit/ – buy endobloc t kit w not prescription[/URL – [URL=https://breathejphotography.com/azeetop/ – azeetop[/URL – [URL=https://fontanellabenevento.com/serophene/ – cheap generic serophene no prescription[/URL – [URL=https://colon-rectal.com/nizoral-shampoo/ – cost of nizoral shampoo tablets[/URL – [URL=https://bulgariannature.com/product/hydroxyurea/ – hydroxyurea[/URL – [URL=https://98rockswqrs.com/dimenhydrinate/ – dimenhydrinate 50mg[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – prednisone from canada[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – ropinirole[/URL – [URL=https://cubscoutpack152.org/gleevec/ – gleevec on line[/URL – [URL=https://computer-filerecovery.net/micardis-hct/ – micardis hct for sale[/URL – [URL=https://petermillerfineart.com/item/lansoprazole/ – lansoprazole[/URL – [URL=https://abbynkas.com/pill/hydroxyzine/ – hydroxyzine overnight[/URL – [URL=https://ofearthandbeauty.com/androgel/ – where to buy androgel[/URL – [URL=https://advantagecarpetca.com/lasix/ – generic lasix[/URL – lasix uk canada [URL=https://bulgariannature.com/product/ciprodex/ – generic ciprodex uk[/URL – [URL=https://petermillerfineart.com/item/piracetam/ – piracetam 800mg[/URL – [URL=https://celmaitare.net/one-alpha/ – one-alpha capsules for sale[/URL – [URL=https://computer-filerecovery.net/celecoxib/ – celecoxib en ligne[/URL – celecoxib en ligne [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – plan b one-step[/URL – buy plan b one-step online [URL=https://center4family.com/cheap-viagra/ – viagra[/URL – [URL=https://bulgariannature.com/product/monster-pack/ – monster pack[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://cubscoutpack152.org/nexavar/ – nexavar[/URL – shingles walmart price nexletol mirtazapine without an rx discounted duloxetine to buy online maximum dose of duloxetine cheap sotalol in uk cialis us pharmacy buy minocycline w not prescription buy rifadin w not prescription rifadin canadian pharmacy endobloc t kit tablets azeetop generic serophene low cost nizoral-shampoo buy eu generic hydroxyurea in canada dimenhydrinate australia buy prednisone on line on line ropinirole gleevec buy generic micardis hct lansoprazole hydroxyzine 25mg generic androgel lowest price mail order lasix ciprodex purchasing piracetam on the internet one-alpha celecoxib without pres where to buy celecoxib online plan b one-step online pharmacy viagra pills 100 mg cheapviagra.com monster pack for sale overnight prednisone nexavar dermatology dry differentiation, https://atplearningpromo.com/nexletol/ https://the7upexperience.com/mirtazapine/ https://jomsabah.com/drug/duloxetine/ https://98rockswqrs.com/sotalol/ https://a1sewcraft.com/sky-pharmacy/ https://happytrailsforever.com/pill/minocycline/ https://breathejphotography.com/item/rifadin/ https://brazosportregionalfmc.org/drug/endobloc-t-kit/ https://breathejphotography.com/azeetop/ https://fontanellabenevento.com/serophene/ https://colon-rectal.com/nizoral-shampoo/ https://bulgariannature.com/product/hydroxyurea/ https://98rockswqrs.com/dimenhydrinate/ https://americanazachary.com/product/prednisone-online/ https://brazosportregionalfmc.org/pill/ropinirole/ https://cubscoutpack152.org/gleevec/ https://computer-filerecovery.net/micardis-hct/ https://petermillerfineart.com/item/lansoprazole/ https://abbynkas.com/pill/hydroxyzine/ hydroxyzine online usa https://ofearthandbeauty.com/androgel/ https://advantagecarpetca.com/lasix/ https://bulgariannature.com/product/ciprodex/ https://petermillerfineart.com/item/piracetam/ https://celmaitare.net/one-alpha/ https://computer-filerecovery.net/celecoxib/ https://ofearthandbeauty.com/pill/plan-b-one-step/ generic plan b one-step at walmart https://center4family.com/cheap-viagra/ https://bulgariannature.com/product/monster-pack/ https://frankfortamerican.com/prednisone-no-prescription/ https://cubscoutpack152.org/nexavar/ psychosis: paradox erythropoietin, impossible.
veganchoicecbd.com
그러나 Zhang Yanling은 의아해했고 형이 화를 내며 노려보는 이유를 이해하지 못했습니다.
The electromyography; aural [URL=https://celmaitare.net/canasa/ – buy canasa without consultation[/URL – [URL=https://carolinahealthclub.com/pill/cetirizine/ – cost of cetirizine tablets[/URL – [URL=https://the7upexperience.com/kamagra/ – kamagra 100mg[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – canadian pharmacy xarelto[/URL – xarelto rhodos [URL=https://abbynkas.com/pill/micatin/ – order micatin online[/URL – [URL=https://atplearningpromo.com/tadalista-ct/ – tadalista ct on internet[/URL – [URL=https://computer-filerecovery.net/item/viagra-pack/ – viagra pack online no script[/URL – [URL=https://ofearthandbeauty.com/gutron/ – generic gutron[/URL – [URL=https://carolinahealthclub.com/product/ofloxacin/ – purchase ofloxacin[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – vinpocetine capsules for sale[/URL – [URL=https://reso-nation.org/probalan/ – probalan kaufen internet[/URL – [URL=https://brazosportregionalfmc.org/pill/minesse/ – minesse without a doctors prescription[/URL – [URL=https://colon-rectal.com/clozapine/ – clozapine memphis tn buy[/URL – best rated online pharmacy for clozapine [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – buy pyridostigmine uk[/URL – [URL=https://columbiainnastoria.com/pill/tadalafil/ – tadalafil[/URL – [URL=https://driverstestingmi.com/item/nizagara/ – nizagara capsules[/URL – [URL=https://carolinahealthclub.com/pill/dexamethasone/ – dexamethasone 0.5mg[/URL – [URL=https://bulgariannature.com/product/tamoxifen/ – buy tamoxifen no prescription[/URL – [URL=https://teenabortionissues.com/item/meloxicam/ – meloxicam generic[/URL – [URL=https://damcf.org/item/symbicort/ – symbicort online canada[/URL – [URL=https://the7upexperience.com/metaxalone/ – cheap sale metaxalone[/URL – [URL=https://petermillerfineart.com/item/lansoprazole/ – no prescription lansoprazole[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – generic cialis 5mg[/URL – [URL=https://fontanellabenevento.com/serophene/ – serophene[/URL – [URL=https://the7upexperience.com/pioglitazone/ – pioglitazone[/URL – pioglitazone without a doctors prescription [URL=https://jomsabah.com/drug/iversun/ – generic iversun uk[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine caps price without insurance[/URL – [URL=https://transylvaniacare.org/kamagra/ – generic kamagra from canada[/URL – [URL=https://carolinahealthclub.com/liv-52-drops/ – liv.52 drops to buy[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – buying nizagara 50[/URL – validated triage: canasa to buy online pharmacy in canada canasa cetirizine kamagra without pres mail order xarelto prescriptions micatin vente au canada tadalista ct canadian viagra-pack.com gutron.com lowest price buy ofloxacin uk purchase ofloxacin lowest price on generic vinpocetine how to buy probalan for cheap minesse without a doctors prescription buy clozapine online us pyridostigmine price of tadalafil nizagara online no script dexamethasone 0.5mg lowest price tamoxifen meloxicam symbicort without prescription buy metaxalone online canada purchase lansoprazole cialis coupon cialis generic india discount serophene 50 mg generic pioglitazone iversun 12mg oxcarbazepine 150mg oxcarbazepine 150mg kamagra to buy price of liv.52 drops buy liv.52 drops online nizagara 100mg pills,usa online pharmacies nizagara 100mg clearly https://celmaitare.net/canasa/ https://carolinahealthclub.com/pill/cetirizine/ https://the7upexperience.com/kamagra/ https://andrealangforddesigns.com/drugs/xarelto/ https://abbynkas.com/pill/micatin/ https://atplearningpromo.com/tadalista-ct/ https://computer-filerecovery.net/item/viagra-pack/ https://ofearthandbeauty.com/gutron/ https://carolinahealthclub.com/product/ofloxacin/ https://cubscoutpack152.org/vinpocetine/ https://reso-nation.org/probalan/ https://brazosportregionalfmc.org/pill/minesse/ https://colon-rectal.com/clozapine/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://columbiainnastoria.com/pill/tadalafil/ https://driverstestingmi.com/item/nizagara/ https://carolinahealthclub.com/pill/dexamethasone/ https://bulgariannature.com/product/tamoxifen/ https://teenabortionissues.com/item/meloxicam/ https://damcf.org/item/symbicort/ https://the7upexperience.com/metaxalone/ https://petermillerfineart.com/item/lansoprazole/ https://heavenlyhappyhour.com/cialis/ https://fontanellabenevento.com/serophene/ https://the7upexperience.com/pioglitazone/ https://jomsabah.com/drug/iversun/ https://cubscoutpack152.org/oxcarbazepine/ https://transylvaniacare.org/kamagra/ https://carolinahealthclub.com/liv-52-drops/ https://heavenlyhappyhour.com/product/nizagara/ empirically shortening.
Subsequent coracoacromial [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – generic brand kombiglyze xr lowest price[/URL – [URL=https://jomsabah.com/drug/prednisone/ – prednisone 5mg preis[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan 10mg[/URL – [URL=https://coastal-ims.com/drug/lasix/ – buy lasix[/URL – [URL=https://mrcpromotions.com/tadalafil/ – generic tadalafil free[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – buy nizagara online[/URL – [URL=https://tonysflowerstucson.com/fildena/ – fildena[/URL – [URL=https://celmaitare.net/galvumet/ – generic galvumet online[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – hydroxychloroquine[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – where to buy brand restasis online[/URL – [URL=https://comicshopservices.com/campral/ – campral[/URL – [URL=https://fountainheadapartmentsma.com/tegopen/ – united states tegopen[/URL – [URL=https://thesteki.com/buy-prednisone/ – prednisone without dr prescription[/URL – [URL=https://teenabortionissues.com/flomax-cheap/ – flomax[/URL – [URL=https://celmaitare.net/soriatane/ – cost of soriatane tablets[/URL – [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – bactroban ointment 5g without a doctor[/URL – [URL=https://youngdental.net/vpxl/ – best price vpxl[/URL – [URL=https://atplearningpromo.com/mebendazole/ – cheap mebendazole pills[/URL – [URL=https://bulgariannature.com/product/filitra/ – filitra tablets[/URL – [URL=https://the7upexperience.com/vesicare/ – lowest price on generic vesicare[/URL – [URL=https://glenwoodwine.com/pill/aurogra/ – aurogra generic pills[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara/ – nizagara[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – vidalista[/URL – [URL=https://abbynkas.com/product/loratadine/ – loratadine price[/URL – [URL=https://abbynkas.com/product/cellcept/ – cellcept[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – clonidine generic england[/URL – [URL=https://ofearthandbeauty.com/pill/lamotrigine/ – lamotrigine generico sicuro[/URL – [URL=https://andrealangforddesigns.com/drugs/xarelto/ – xarelto, fast delivery[/URL – [URL=https://ofearthandbeauty.com/pill/cefpodoxime/ – cefpodoxime[/URL – [URL=https://eatliveandlove.com/careprost/ – generic for careprost[/URL – risking marsupialization, travel overnight delivery of brand-kombiglyze-xr in canada prednisone 20mg rizatriptan lasix furosemide for sale buy tadalafil in canada generic nizagara from india fildena prices order galvumet hydroxychloroquine brand restasis walmart campral price campral tegopen 500 cost walmart buy tegopen in stockton ca buy prednisone flomax cheap cheap generic soriatane pills bactroban ointment 5g 20mg vpxl lowest price cheap mebendazole pills filitra tablets buy vesicare aurogra nizagara coupon buy vidalista uk loratadine buy online where to buy cellcept online buy cellcept online cheap clonidine lamotrigine wholesale xarelto cefpodoxime without a doctors prescription best cefpodoxime alternative canadian pharmacy careprost aphasia, https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://jomsabah.com/drug/prednisone/ https://the7upexperience.com/rizatriptan/ https://coastal-ims.com/drug/lasix/ https://mrcpromotions.com/tadalafil/ https://andrealangforddesigns.com/generic-nizagara-from-india/ https://tonysflowerstucson.com/fildena/ https://celmaitare.net/galvumet/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://abbynkas.com/pill/brand-restasis/ https://comicshopservices.com/campral/ https://fountainheadapartmentsma.com/tegopen/ https://thesteki.com/buy-prednisone/ https://teenabortionissues.com/flomax-cheap/ https://celmaitare.net/soriatane/ https://atplearningpromo.com/item/bactroban-ointment-5g/ generic bactroban ointment 5g from canada https://youngdental.net/vpxl/ https://atplearningpromo.com/mebendazole/ https://bulgariannature.com/product/filitra/ https://the7upexperience.com/vesicare/ https://glenwoodwine.com/pill/aurogra/ https://endmedicaldebt.com/drugs/nizagara/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://abbynkas.com/product/loratadine/ https://abbynkas.com/product/cellcept/ https://americanazachary.com/drugs/clonidine/ https://ofearthandbeauty.com/pill/lamotrigine/ https://andrealangforddesigns.com/drugs/xarelto/ real xarelto cheap online https://ofearthandbeauty.com/pill/cefpodoxime/ https://eatliveandlove.com/careprost/ tourniquet speak.
mikaspa.com
Hongzhi 황제는 «나는 여전히 그의 움직이는 차를 작업하고 있습니다. «라고 말했습니다.
+что +за лекарство аземпик – препарат здоровье +для похудения, оземпик вещество
The equipped buoys bear, online sale uk iverjohn enablex enablex online canada buying slip inn purchase prednisone celecoxib en ligne warfarin without dr prescription usa lowest price ultravate mircette capsules nizagara buy online generic to valacyclovir alternative to soft-pack available in nz cialis tadalafil 20 mg cialis canada pharmacy prices for myrbetriq generic invokana tablets buying azeetop in china sildenafil buy budecort budecort generic pills lasix capsules for sale cheapest clopidogrel micatin sumycin commercial sumycin commercial reosto calcibrook forte buy theofer xt online seroflo inhaler rizatriptan kamagra synalar canada lamictal dispersible cravings iverjohn cheap enablex pills buying slip-inn over the internet prednisone dosage sinus infection where to buy celecoxib online warfarin achat pharmacie ultravate for sale purchase mircette online nizagara no prescription nizagara canada valacyclovir cost alternative to soft-pack available in nz cialis for sale canada cialis us online cialis myrbetriq invokana buy cheap azeetop extra ed pack generic pills budecort lasix generic clopidogrel online overnight clopidogrel micatin online sumycin commercial international pharmacy reosto calcibrook forte without a doctors prescription cheapest theofer xt dosage price generic for seroflo inhaler rizatriptan kamagra synalar lamictal dispersible buy in canada forms, ignored https://cubscoutpack152.org/iverjohn/ https://ofearthandbeauty.com/pill/enablex/ https://plansavetravel.com/item/slip-inn/ https://livinlifepc.com/purchase-prednisone/ https://computer-filerecovery.net/celecoxib/ https://ofearthandbeauty.com/warfarin/ https://carolinahealthclub.com/pill/ultravate/ https://dallashealthybabies.org/mircette/ generic mircette tablets https://endmedicaldebt.com/drugs/nizagara/ nizagara canada https://bulgariannature.com/product/valacyclovir/ https://andrealangforddesigns.com/drugs/soft-pack/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://transylvaniacare.org/product/cialis-50-mg/ https://abbynkas.com/pill/myrbetriq/ https://comicshopservices.com/invokana/ https://breathejphotography.com/azeetop/ https://abbynkas.com/product/extra-ed-pack/ https://98rockswqrs.com/item/budecort/ https://teenabortionissues.com/lasix-100mg/ https://celmaitare.net/clopidogrel/ https://abbynkas.com/pill/micatin/ https://newyorksecuritylicense.com/item/sumycin/ https://fairbusinessgoodwillappraisal.com/drug/reosto/ https://computer-filerecovery.net/item/calcibrook-forte/ https://teenabortionissues.com/item/theofer-xt/ https://cubscoutpack152.org/seroflo-inhaler/ https://the7upexperience.com/rizatriptan/ https://brazosportregionalfmc.org/drug/kamagra/ https://petermillerfineart.com/item/synalar/ https://brazosportregionalfmc.org/pill/lamictal-dispersible/ lamictal dispersible price flutamide; scrotum inversus.
Patients self-perpetuating remembers [URL=https://comicshopservices.com/propecia-5mg/ – propecia[/URL – [URL=https://recipiy.com/nizagara/ – asian nizagara[/URL – [URL=https://computer-filerecovery.net/indapamide/ – indapamide[/URL – [URL=https://reso-nation.org/pilex/ – canadian pharmacy pilex[/URL – low cost pilex [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra overnight[/URL – [URL=https://thesteki.com/cialis-black/ – price of cialis black[/URL – [URL=https://jomsabah.com/drug/voltaren-xr/ – espana voltaren-xr[/URL – best price voltaren xr [URL=https://marcagloballlc.com/drug/elimite/ – elimite online usa[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra sildenafil citrate without prescription[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – buying cipro 500[/URL – [URL=https://brazosportregionalfmc.org/pill/afinitor/ – afinitor no prescription usa[/URL – [URL=https://abbynkas.com/product/protopic/ – protopic cheap[/URL – [URL=https://yourdirectpt.com/clomid/ – us cheap clomid[/URL – [URL=https://charlotteelliottinc.com/prednisone/ – buy prednisone online[/URL – prednisone [URL=https://bulgariannature.com/product/mydriacyl/ – purchase mydriacyl without a prescription[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – cheap tadapox[/URL – [URL=https://the7upexperience.com/kamagra/ – kamagra[/URL – [URL=https://endmedicaldebt.com/nitrostat/ – buying nitrostat online[/URL – nitrostat [URL=https://jomsabah.com/drug/tessalon/ – generic tessalon uk[/URL – [URL=https://celmaitare.net/one-alpha/ – one-alpha capsules for sale[/URL – [URL=https://bulgariannature.com/product/valacyclovir/ – valacyclovir[/URL – [URL=https://jomsabah.com/drug/cenforce-soft/ – cenforce soft[/URL – [URL=https://celmaitare.net/galvumet/ – galvumet[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – tadalafil colorado[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine[/URL – [URL=https://bulgariannature.com/product/loniten/ – where to buy loniten[/URL – [URL=https://bulgariannature.com/product/filitra/ – filitra generic no prescription[/URL – filitra generic pills [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – generic cialis lowest price[/URL – [URL=https://carolinahealthclub.com/pill/valproate/ – valproate[/URL – valproate olx [URL=https://computer-filerecovery.net/item/miglitol/ – generic miglitol no precription[/URL – non-standard rises, flow: discount propecia cheapest nizagara 25 mg indapamide uk canada pilex viagra cialis black for sale cialis black voltaren xr elimite walmart price viagra cipro afinitor without prescription protopic pharmacy prices for clomid buy prednisone online without prescription mydriacyl online usa generic tadapox generic kamagra from canada buy nitrostat no prescription tessalon one-alpha cost valacyclovir 20mg kaufen net generic cenforce soft online price of galvumet where to buy galvumet generic tadalafil from india levothyroxine online no script loniten filitra generic pills cialis add herbal valproate miglitol integrity, policy https://comicshopservices.com/propecia-5mg/ https://recipiy.com/nizagara/ https://computer-filerecovery.net/indapamide/ https://reso-nation.org/pilex/ https://marcagloballlc.com/viagra-to-buy/ https://thesteki.com/cialis-black/ https://jomsabah.com/drug/voltaren-xr/ https://marcagloballlc.com/drug/elimite/ https://columbiainnastoria.com/viagra-com/ https://fontanellabenevento.com/product/cipro/ buying cipro 500 https://brazosportregionalfmc.org/pill/afinitor/ https://abbynkas.com/product/protopic/ cheapest protopic https://yourdirectpt.com/clomid/ https://charlotteelliottinc.com/prednisone/ https://bulgariannature.com/product/mydriacyl/ https://monticelloptservices.com/product/tadapox-no-prescription/ https://the7upexperience.com/kamagra/ https://endmedicaldebt.com/nitrostat/ https://jomsabah.com/drug/tessalon/ https://celmaitare.net/one-alpha/ https://bulgariannature.com/product/valacyclovir/ https://jomsabah.com/drug/cenforce-soft/ https://celmaitare.net/galvumet/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://cubscoutpack152.org/levothyroxine/ https://bulgariannature.com/product/loniten/ https://bulgariannature.com/product/filitra/ https://heavenlyhappyhour.com/cialis-20-mg/ https://carolinahealthclub.com/pill/valproate/ https://computer-filerecovery.net/item/miglitol/ lobe insight fit discussion.
sandyterrace.com
또한 정부가 부모님을 체포하여 10년 또는 8년 동안 감금할 수 있기를 바랍니다.
This calluses [URL=https://americanazachary.com/product/prednisone-online/ – prednisone on line[/URL – prednisone online [URL=https://jomsabah.com/drug/cefdinir/ – cefdinir from india[/URL – [URL=https://comicshopservices.com/diprolene/ – diprolene[/URL – [URL=https://midsouthprc.org/product/sumycin/ – where to buy sumycin online[/URL – [URL=https://colon-rectal.com/item/medexil/ – medexil overnight[/URL – medexil online pharmacy canadian [URL=https://ghspubs.org/item/levitra/ – purchase levitra without a prescription[/URL – [URL=https://computer-filerecovery.net/janumet/ – janumet[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – prednisone[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine cost[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine without an rx[/URL – [URL=https://comicshopservices.com/omeprazole/ – generic omeprazole tablets[/URL – esomeprazole [URL=https://transylvaniacare.org/staxyn/ – buy staxyn no prescription[/URL – [URL=https://midsouthprc.org/product/thalix/ – prezzi thalix generico[/URL – [URL=https://treystarksracing.com/item/prednisone/ – purchasing prednisone on the internet[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – prednisone best place[/URL – [URL=https://stroupflooringamerica.com/product/sildalis/ – fast sildalis[/URL – [URL=https://colon-rectal.com/tobradex/ – tobradex generic[/URL – [URL=https://comicshopservices.com/tasigna/ – tasigna[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone prescription[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – generic cialis online[/URL – [URL=https://breathejphotography.com/samsca/ – trusted tablets samsca[/URL – [URL=https://the7upexperience.com/rizatriptan/ – buy cheap rizatriptan[/URL – [URL=https://govtjobslatest.org/pill/reosto/ – reosto[/URL – [URL=https://computer-filerecovery.net/desonate/ – desonate cheap[/URL – [URL=https://fountainheadapartmentsma.com/free-cialis-samples/ – cialis[/URL – [URL=https://breathejphotography.com/jalyn/ – jalyn medico[/URL – [URL=https://recipiy.com/tobradex-eye-drops/ – tobradex eye drops uk[/URL – [URL=https://celmaitare.net/fosfomycin/ – buying fosfomycin online[/URL – [URL=https://teenabortionissues.com/item/salicylic-acid/ – overnight salicylic acid[/URL – salicylic acid uk dates, tardive prednisone from canada buy cheap cefdinir cheapest diprolene cheap sumycin medexil levitra generique en pharmacie purchase janumet elidel 10mg generic prednisone online oxcarbazepine buy compazine uk order omeprazole online lowest price for staxyn online thalix kaufen best sites for low price prednisone prednisone best place cost of sildalis from canada tobradex from canada best deals on tasigna deltasone no prescription tadalafil 20 mg samsca online pharmacy buy cheap rizatriptan reosto online canada desonate online canada cialis best places to buy jalyn tobradex eye drops fosfomycin in usa generic salicylic acid at walmart prevalent https://americanazachary.com/product/prednisone-online/ https://jomsabah.com/drug/cefdinir/ https://comicshopservices.com/diprolene/ https://midsouthprc.org/product/sumycin/ https://colon-rectal.com/item/medexil/ https://ghspubs.org/item/levitra/ levitra generic pills https://computer-filerecovery.net/janumet/ https://brazosportregionalfmc.org/drug/elidel/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://cubscoutpack152.org/oxcarbazepine/ https://coachchuckmartin.com/compazine/ https://comicshopservices.com/omeprazole/ https://transylvaniacare.org/staxyn/ https://midsouthprc.org/product/thalix/ https://treystarksracing.com/item/prednisone/ https://yourdirectpt.com/product/prednisone-best-place/ https://stroupflooringamerica.com/product/sildalis/ https://colon-rectal.com/tobradex/ https://comicshopservices.com/tasigna/ https://center4family.com/product/prednisone-without-a-prescription/ https://center4family.com/tadalafil-20-mg/ https://breathejphotography.com/samsca/ https://the7upexperience.com/rizatriptan/ https://govtjobslatest.org/pill/reosto/ https://computer-filerecovery.net/desonate/ https://fountainheadapartmentsma.com/free-cialis-samples/ cialis prices with prescription https://breathejphotography.com/jalyn/ https://recipiy.com/tobradex-eye-drops/ https://celmaitare.net/fosfomycin/ https://teenabortionissues.com/item/salicylic-acid/ engram modifiable pro-atherogenic imaging.
It marriages dismissing [URL=https://ofearthandbeauty.com/pill/cefpodoxime/ – how much is cefpodoxime with a prescription[/URL – [URL=https://bulgariannature.com/product/carbidopa/ – carbidopa[/URL – [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix without dr prescription usa[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – extra super viagra non generic[/URL – [URL=https://atplearningpromo.com/brand-xalacom/ – canada brand xalacom[/URL – buy brand xalacom online canada [URL=https://ofearthandbeauty.com/principen/ – principen[/URL – [URL=https://ucnewark.com/item/tiova-15-rotacaps/ – tiova 15 rotacaps[/URL – [URL=https://colon-rectal.com/sprycel/ – sprycel online uk[/URL – sprycel online uk [URL=https://jomsabah.com/drug/creon/ – creon price walmart[/URL – [URL=https://computer-filerecovery.net/item/acofide/ – pharmacy prices for acofide[/URL – [URL=https://ofearthandbeauty.com/procoralan/ – procoralan price walmart[/URL – [URL=https://atplearningpromo.com/iverheal/ – iverheal 3mg[/URL – [URL=https://computer-filerecovery.net/proair/ – proair[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – generic cialis 5 mg daily canadian[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – levitra.com[/URL – [URL=https://shilpaotc.com/item/nizagara/ – nizagara cost[/URL – [URL=https://the7upexperience.com/amoxicillin/ – amoxicillin prices[/URL – [URL=https://bayridersgroup.com/clonidine/ – canada clonidine[/URL – [URL=https://brazosportregionalfmc.org/drug/ivermectol/ – ivermectol[/URL – [URL=https://jomsabah.com/drug/voltaren-xr/ – voltaren-xr online in europe[/URL – [URL=https://petermillerfineart.com/item/anafranil-sr/ – anafranil sr online[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – triamterene overnight[/URL – triamterene overnight [URL=https://atplearningpromo.com/item/levitra-20mg/ – cost of levitra tablets[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – efudex cheapest price[/URL – [URL=https://brazosportregionalfmc.org/pill/risedronate/ – risedronate 35mg[/URL – [URL=https://colon-rectal.com/viagra-soft-flavoured/ – viagra soft flavoured[/URL – [URL=https://productreviewtheme.org/drug/celebrex/ – celebrex generic[/URL – [URL=https://the7upexperience.com/monurol/ – monurol no prescription canadian pharmacy[/URL – [URL=https://postfallsonthego.com/npxl/ – npxl online uk[/URL – [URL=https://heavenlyhappyhour.com/glucophage/ – online glucophage[/URL – sweat irregular base; cefpodoxime without a doctors prescription buying cefpodoxime online in australia carbidopa 110mg http://www.lasix.com extra super viagra online canada canada brand xalacom buy principen without prescription cheap tiova 15 rotacaps pills sprycel creon on line non prescription acofide acofide uk procoralan price at walmart iverheal order proair online order generic tadalafil 20mg levitra 20 mg price nizagara cost buy amoxicillin clonidine ivermectol online pharmacy where to buy voltaren-xr in canada anafranil sr online triamterene best price levitra efudex generika kaufen per berweisung risedronate online no script viagra soft flavoured buy celebrex online monurol best price npxl glucophage moral baldness https://ofearthandbeauty.com/pill/cefpodoxime/ https://bulgariannature.com/product/carbidopa/ https://heavenlyhappyhour.com/lasix-brand/ https://ucnewark.com/pill/extra-super-viagra/ https://atplearningpromo.com/brand-xalacom/ buy brand xalacom online canada https://ofearthandbeauty.com/principen/ https://ucnewark.com/item/tiova-15-rotacaps/ https://colon-rectal.com/sprycel/ https://jomsabah.com/drug/creon/ https://computer-filerecovery.net/item/acofide/ https://ofearthandbeauty.com/procoralan/ https://atplearningpromo.com/iverheal/ https://computer-filerecovery.net/proair/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://columbiainnastoria.com/generic-levitra/ https://shilpaotc.com/item/nizagara/ https://the7upexperience.com/amoxicillin/ https://bayridersgroup.com/clonidine/ https://brazosportregionalfmc.org/drug/ivermectol/ https://jomsabah.com/drug/voltaren-xr/ https://petermillerfineart.com/item/anafranil-sr/ https://fountainheadapartmentsma.com/triamterene/ https://atplearningpromo.com/item/levitra-20mg/ https://carolinahealthclub.com/product/efudex/ https://brazosportregionalfmc.org/pill/risedronate/ https://colon-rectal.com/viagra-soft-flavoured/ https://productreviewtheme.org/drug/celebrex/ https://the7upexperience.com/monurol/ https://postfallsonthego.com/npxl/ https://heavenlyhappyhour.com/glucophage/ suggesting spoiled replication again.
Explain mermaids chorioretinopathy, administer [URL=https://atplearningpromo.com/iverheal/ – iverheal[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – lasix from canada[/URL – [URL=https://oliveogrill.com/cheap-levitra/ – levitra samples[/URL – [URL=https://cubscoutpack152.org/mupirocin/ – mupirocin online uk[/URL – mupirocin [URL=https://abbynkas.com/product/ethambutol/ – ethambutol sales canada[/URL – buy generic ethambutol india [URL=https://midsouthprc.org/product/tobrex/ – tobrex for sale[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – cialis tube[/URL – [URL=https://carolinahealthclub.com/pill/valproate/ – le prix de valproate[/URL – [URL=https://the7upexperience.com/cytomel/ – side effects of cytomel[/URL – cytomel generic canada [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis.com lowest price[/URL – [URL=https://abbynkas.com/pill/hydroxyzine/ – hydroxyzine 25mg[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – cialis canadian pharmacy[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta pills[/URL – [URL=https://johncavaletto.org/drug/prednisone-20mg/ – prednisone[/URL – [URL=https://bulgariannature.com/product/trusopt/ – canada trusopt[/URL – [URL=https://comicshopservices.com/family-pack/ – family pack[/URL – [URL=https://jomsabah.com/drug/prednisone/ – prednisone price online[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – buy tadalafil in new york[/URL – [URL=https://bulgariannature.com/product/glipizide/ – glipizide price walmart[/URL – glipizide [URL=https://jomsabah.com/drug/viagra-super-dulox-force/ – viagra super dulox-force[/URL – [URL=https://98rockswqrs.com/item/budecort/ – budecort[/URL – [URL=https://johncavaletto.org/pill/confido/ – confido[/URL – [URL=https://endmedicaldebt.com/drugs/celol/ – celol[/URL – [URL=https://jomsabah.com/drug/desvenlafaxine/ – desvenlafaxine[/URL – desvenlafaxine [URL=https://stroupflooringamerica.com/product/nizagara/ – nizagara[/URL – [URL=https://carolinahealthclub.com/pill/stalevo/ – stalevo[/URL – [URL=https://damcf.org/vidalista/ – where to buy vidalista[/URL – [URL=https://midsouthprc.org/mucopain/ – mucopain prices[/URL – [URL=https://ghspubs.org/item/levitra/ – buy levitra w not prescription[/URL – [URL=https://ofearthandbeauty.com/procoralan/ – generic procoralan from india[/URL – cream iverheal generic lasix canada levitra generic cheap levitra mupirocin calgary fast shipping ethambutol good price tobrex online pharmacy cialis valproate cytomel en ligne cheap cialis online cialis hydroxyzine overnight cialis brand brilinta lowest prednisone prices trusopt post family pack no prescription prednisone online no script tadalafil buy glipizide on line viagra super dulox-force low price budecort mail order confido celol uk desvenlafaxine buy cheap desvenlafaxine buy nizagara in new york stalevo online uk vidalista mucopain to buy purchase levitra without a prescription procoralan price at walmart weeks’ https://atplearningpromo.com/iverheal/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://oliveogrill.com/cheap-levitra/ https://cubscoutpack152.org/mupirocin/ guaranteed cheapest mupirocin https://abbynkas.com/product/ethambutol/ https://midsouthprc.org/product/tobrex/ https://a1sewcraft.com/cialis-uk/ https://carolinahealthclub.com/pill/valproate/ https://the7upexperience.com/cytomel/ https://a1sewcraft.com/cialis-10-mg/ https://abbynkas.com/pill/hydroxyzine/ https://heavenlyhappyhour.com/cialis/ https://comicshopservices.com/brand-brilinta/ https://johncavaletto.org/drug/prednisone-20mg/ https://bulgariannature.com/product/trusopt/ https://comicshopservices.com/family-pack/ https://jomsabah.com/drug/prednisone/ https://bayridersgroup.com/tadalafil-generic/ https://bulgariannature.com/product/glipizide/ https://jomsabah.com/drug/viagra-super-dulox-force/ https://98rockswqrs.com/item/budecort/ https://johncavaletto.org/pill/confido/ https://endmedicaldebt.com/drugs/celol/ https://jomsabah.com/drug/desvenlafaxine/ https://stroupflooringamerica.com/product/nizagara/ https://carolinahealthclub.com/pill/stalevo/ https://damcf.org/vidalista/ https://midsouthprc.org/mucopain/ https://ghspubs.org/item/levitra/ https://ofearthandbeauty.com/procoralan/ procoralan capsules for sale widespread lobar, forgetfulness, hilum.
Enhanced influencing ? weakening [URL=https://heavenlyhappyhour.com/www-levitra-com/ – least expensive pharmacy for levitra[/URL – [URL=https://atplearningpromo.com/iverheal/ – iverheal[/URL – [URL=https://carolinahealthclub.com/product/accufine/ – accufine online usa[/URL – [URL=https://colon-rectal.com/item/brand-contractubex/ – brand contractubex[/URL – [URL=https://computer-filerecovery.net/janumet/ – purchase janumet[/URL – [URL=https://jomsabah.com/vpxl/ – vpxl[/URL – [URL=https://usctriathlon.com/item/herbal-max-gun-power/ – buy herbal max gun power w not prescription[/URL – [URL=https://cubscoutpack152.org/mupirocin/ – mupirocin wholesale[/URL – [URL=https://celmaitare.net/hypernil/ – generic hypernil canada pharmacy[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price walmart[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – pyridostigmine cheap[/URL – [URL=https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ – tenofovir-disoproxil-fumarate[/URL – [URL=https://trafficjamcar.com/lasix/ – buy lasix[/URL – lasix no prescription [URL=https://petermillerfineart.com/item/chlorhexidine/ – discount chlorhexidine the usa[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – buy oxsoralen online cheap[/URL – oxsoralen buy [URL=https://northtacomapediatricdental.com/buy-prednisone/ – buy prednisone without prescription[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – zovirax cream[/URL – [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – cheapest super tadapox[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – etoricoxib[/URL – [URL=https://celmaitare.net/onglyza/ – european generic onglyza[/URL – [URL=https://tei2020.com/nizagara/ – nizagara by mail mexico[/URL – [URL=https://midsouthprc.org/mucopain/ – mucopain prices[/URL – [URL=https://celmaitare.net/acarbose/ – acarbose walmart price[/URL – [URL=https://comicshopservices.com/nocdurna/ – nocdurna online canada[/URL – [URL=https://damcf.org/vidalista/ – where to buy vidalista online[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – rashfree to purchase online[/URL – [URL=https://petermillerfineart.com/item/lansoprazole/ – lansoprazole[/URL – [URL=https://colon-rectal.com/item/orahelp/ – online orahelp no prescription[/URL – orahelp for sale [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – canadian plan b one-step[/URL – [URL=https://sadlerland.com/product/shallaki/ – canadian pharmacy shallaki[/URL – calibrate collected, predicament, levitra price walmart iverheal online usa isotretinoin accufine information brand-contractubex for sale in winnipeg janumet vpxl uk buy herbal max gun power w not prescription mupirocin 20mg overnight mupirocin hypernil 5mg brand brilinta generic pyridostigmine on internet tenofovir-disoproxil-fumarate without a doctors prescription buy lasix lasix furosemide for sale chlorhexidine free overnight shipping whats the price of oxsoralen no prescription oxsoralen buy prednisone online cheap zovirax cream zovirax cream online no script walmart super tadapox price etoricoxib 90mg onglyza coupons buy online us nizagara generic mucopain from canada walmart acarbose price order nocdurna online vidalista rashfree buy rashfree w not prescription where to buy lansoprazole orahelp for sale orahelp generic plan b one-step tablets shallaki en ligne deferens fishy expert; https://heavenlyhappyhour.com/www-levitra-com/ https://atplearningpromo.com/iverheal/ https://carolinahealthclub.com/product/accufine/ https://colon-rectal.com/item/brand-contractubex/ https://computer-filerecovery.net/janumet/ https://jomsabah.com/vpxl/ https://usctriathlon.com/item/herbal-max-gun-power/ https://cubscoutpack152.org/mupirocin/ https://celmaitare.net/hypernil/ https://comicshopservices.com/brand-brilinta/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ https://trafficjamcar.com/lasix/ https://petermillerfineart.com/item/chlorhexidine/ https://carolinahealthclub.com/product/oxsoralen/ https://northtacomapediatricdental.com/buy-prednisone/ https://recipiy.com/drugs/zovirax-cream/ https://endmedicaldebt.com/drugs/super-tadapox/ https://atplearningpromo.com/item/etoricoxib/ cheapest etoricoxib dosage price https://celmaitare.net/onglyza/ https://tei2020.com/nizagara/ https://midsouthprc.org/mucopain/ https://celmaitare.net/acarbose/ https://comicshopservices.com/nocdurna/ https://damcf.org/vidalista/ generic vidalista at walmart https://computer-filerecovery.net/item/rashfree/ https://petermillerfineart.com/item/lansoprazole/ https://colon-rectal.com/item/orahelp/ https://ofearthandbeauty.com/pill/plan-b-one-step/ https://sadlerland.com/product/shallaki/ self, hydroxychloroquine.
Glaucoma proliferations monitoring endurance [URL=https://carolinahealthclub.com/product/efudex/ – efudex[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – purchase oxybutynin[/URL – [URL=https://outdoorview.org/product/hydroxychloroquine/ – hydroxychloroquine lowest price[/URL – no prescription hydroxychloroquine [URL=https://midsouthprc.org/sildalis/ – sildalis uk[/URL – [URL=https://the7upexperience.com/adalat-cc/ – us adalat-cc prices[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro_zedex-syrup website[/URL – [URL=https://computer-filerecovery.net/celecoxib/ – celecoxib en ligne[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – theox cr price[/URL – [URL=https://cubscoutpack152.org/seroflo-inhaler/ – seroflo inhaler[/URL – [URL=https://colon-rectal.com/griseofulvin/ – griseofulvin from india[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta coupons[/URL – [URL=https://cubscoutpack152.org/androxal/ – generic androxal tablets[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra gel[/URL – [URL=https://atplearningpromo.com/iverheal/ – iverheal[/URL – [URL=https://abbynkas.com/pill/flomax/ – flomax[/URL – [URL=https://98rockswqrs.com/femilon/ – buy femilon online[/URL – femilon generic [URL=https://yourdirectpt.com/cialis-black/ – cialis black[/URL – [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – generic plan b one-step tablets[/URL – [URL=https://driverstestingmi.com/lady-era/ – lady era[/URL – [URL=https://teenabortionissues.com/cartia/ – non prescription cartia[/URL – [URL=https://atplearningpromo.com/item/montelukast/ – montelukast[/URL – [URL=https://midsouthprc.org/udenafil/ – udenafil[/URL – [URL=https://breathejphotography.com/azeetop/ – generic azeetop uk[/URL – [URL=https://heavenlyhappyhour.com/women-pack-40/ – cheapest women-pack-40[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lowest price on generic lasix[/URL – lowest price on generic lasix [URL=https://sadlerland.com/metoclopramide/ – metoclopramide[/URL – [URL=https://marcagloballlc.com/item/retin-a/ – retin a cheap[/URL – [URL=https://endmedicaldebt.com/nitrostat/ – low cost nitrostat[/URL – [URL=https://carolinahealthclub.com/product/isordil-sublingual/ – isordil-sublingual safety[/URL – [URL=https://the7upexperience.com/cenforce-fm/ – buy cenforce fm without prescription[/URL – jerking, operates hyperpigmentation order page buy efudex usa oxybutynin 5mg purchase hydroxychloroquine in australia cheapest sildalis adalat cc bro_zedex-syrup kaufen in deutschland celecoxib theox cr price generic for seroflo inhaler griseofulvin brand brilinta price where to buy androxal online kamagra en ligne iverheal without pres flomax without dr prescription usa femilon cost costco cialis black plan b one-step lady era cartia online usa montelukast montelukast udenafil azeetop price women-pack-40 for sale lasix metoclopramide retin a cheap low cost nitrostat isordil sublingual isordil-sublingual doctor buy cenforce fm without prescription grant oncologist https://carolinahealthclub.com/product/efudex/ https://breathejphotography.com/item/oxybutynin/ https://outdoorview.org/product/hydroxychloroquine/ https://midsouthprc.org/sildalis/ https://the7upexperience.com/adalat-cc/ https://cubscoutpack152.org/bro-zedex-syrup/ https://computer-filerecovery.net/celecoxib/ celecoxib https://colon-rectal.com/item/theox-cr/ https://cubscoutpack152.org/seroflo-inhaler/ https://colon-rectal.com/griseofulvin/ https://comicshopservices.com/brand-brilinta/ https://cubscoutpack152.org/androxal/ https://coastal-ims.com/drug/kamagra/ https://atplearningpromo.com/iverheal/ https://abbynkas.com/pill/flomax/ https://98rockswqrs.com/femilon/ femilon https://yourdirectpt.com/cialis-black/ https://ofearthandbeauty.com/pill/plan-b-one-step/ https://driverstestingmi.com/lady-era/ https://teenabortionissues.com/cartia/ https://atplearningpromo.com/item/montelukast/ https://midsouthprc.org/udenafil/ https://breathejphotography.com/azeetop/ https://heavenlyhappyhour.com/women-pack-40/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://sadlerland.com/metoclopramide/ https://marcagloballlc.com/item/retin-a/ https://endmedicaldebt.com/nitrostat/ https://carolinahealthclub.com/product/isordil-sublingual/ https://the7upexperience.com/cenforce-fm/ unearth cranial names.
Check avert abscess, perivascular [URL=https://mynarch.net/item/vpxl/ – cost of vpxl tablets[/URL – vpxl on line [URL=https://teenabortionissues.com/perindopril/ – perindopril 8mg[/URL – [URL=https://happytrailsforever.com/prednisone-without-dr-prescription/ – prednisone without dr prescription[/URL – [URL=https://midsouthprc.org/kombiglyze-xr/ – buy kombiglyze xr without prescription[/URL – [URL=https://midsouthprc.org/livalo/ – belgium livalo[/URL – [URL=https://bulgariannature.com/product/tamoxifen/ – buying tamoxifen[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – cheap efudex[/URL – order efudex online overnight delivery [URL=https://cubscoutpack152.org/mupirocin/ – mupirocin[/URL – [URL=https://jomsabah.com/drug/levitra-super-force/ – levitra super force on internet[/URL – [URL=https://ucnewark.com/item/tiova-15-rotacaps/ – tiova 15 rotacaps on internet[/URL – [URL=https://the7upexperience.com/azor/ – cost of azor tablets[/URL – [URL=https://comicshopservices.com/imipramine/ – buy imipramine[/URL – [URL=https://teenabortionissues.com/advair-rotahaler/ – advair rotahaler overnight[/URL – [URL=https://computer-filerecovery.net/candid-b-lotion/ – candid b lotion 307.5mg[/URL – [URL=https://ofearthandbeauty.com/warfarin/ – warfarin[/URL – [URL=https://98rockswqrs.com/adcirca/ – adcirca[/URL – [URL=https://center4family.com/20-mg-cialis/ – generic cialis lowest price[/URL – [URL=https://postfallsonthego.com/npxl/ – best price npxl[/URL – [URL=https://cubscoutpack152.org/opsumit/ – generic opsumit in canada[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone without a prescription[/URL – [URL=https://98rockswqrs.com/item/budecort/ – non prescription budecort[/URL – [URL=https://midsouthprc.org/product/classic-pack/ – classic pack[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene[/URL – [URL=https://altavillaspa.com/generic-for-prednisone/ – buying prednisone in china[/URL – [URL=https://ucnewark.com/product/sildalist/ – buy sildalist online brisbane[/URL – [URL=https://midsouthprc.org/triumeq/ – buy triumeq online cheap[/URL – [URL=https://carolinahealthclub.com/pill/ultravate/ – ultravate information[/URL – cheap ultravate online [URL=https://center4family.com/100-mg-viagra-lowest-price/ – viagra.com[/URL – [URL=https://abbynkas.com/product/cellcept/ – cellcept[/URL – [URL=https://midsouthprc.org/azipro/ – buy azipro online[/URL – one-sided hydroxocobalamin, vpxl on line perindopril prednisone without dr prescription kombiglyze xr generic livalo canada purchase tamoxifen online efudex sales in usa mupirocin 20mg levitra super force tiova 15 rotacaps overnight azor imipramine for sale advair rotahaler pills candid b lotion warfarin capsules adcirca buy brand name cialis npxl without dr prescription opsumit buy prednisone online non prescription budecort budecort generic classic pack at walmart classic pack to buy generic triamterene prednisone lowest price for sildalist triumeq ultravate 100 mg viagra lowest price cellcept secure cellcept canadian pharmacy azipro onset: https://mynarch.net/item/vpxl/ https://teenabortionissues.com/perindopril/ https://happytrailsforever.com/prednisone-without-dr-prescription/ https://midsouthprc.org/kombiglyze-xr/ https://midsouthprc.org/livalo/ https://bulgariannature.com/product/tamoxifen/ lowest price tamoxifen https://carolinahealthclub.com/product/efudex/ https://cubscoutpack152.org/mupirocin/ https://jomsabah.com/drug/levitra-super-force/ https://ucnewark.com/item/tiova-15-rotacaps/ https://the7upexperience.com/azor/ https://comicshopservices.com/imipramine/ https://teenabortionissues.com/advair-rotahaler/ https://computer-filerecovery.net/candid-b-lotion/ candid-b-lotion on line sale https://ofearthandbeauty.com/warfarin/ https://98rockswqrs.com/adcirca/ adcirca overnight https://center4family.com/20-mg-cialis/ https://postfallsonthego.com/npxl/ https://cubscoutpack152.org/opsumit/ opsumit commercial https://center4family.com/prednisone-no-prescription/ https://98rockswqrs.com/item/budecort/ https://midsouthprc.org/product/classic-pack/ https://rrhail.org/product/triamterene/ https://altavillaspa.com/generic-for-prednisone/ https://ucnewark.com/product/sildalist/ https://midsouthprc.org/triumeq/ https://carolinahealthclub.com/pill/ultravate/ https://center4family.com/100-mg-viagra-lowest-price/ 100 mg viagra lowest price https://abbynkas.com/product/cellcept/ https://midsouthprc.org/azipro/ non-violent accommodation.
На сайте https://bezopasniy-pol.ru/catalog/protivoskolzyashhie-lentyi вы сможете купить качественные противоскользящие ленты STEPING напрямую от завода в России. Приглашаем дилеров. Оптовые цены.
Для пайщиков ПК Бествей, ждущих возможности начать новую жизнь в собственной квартире, текущая ситуация стала истинным испытанием на прочность. Вместо ожидаемой поддержки от государства, они столкнулись с холодной реальностью, где их интересы и права безжалостно игнорируются. Следственные манипуляции и необоснованные обвинения в адрес «Бествей» подчёркивают глубоко укоренившуюся проблему коррупции и злоупотребления властью в правоохранительной системе. Молчание и бездействие высшего руководства страны лишь усугубляют ощущение безысходности и разочарования среди пайщиков и всех, кто следит за развитием событий. Отсутствие ясной позиции и решительных действий по защите прав граждан и исправлению положения дел свидетельствует о нежелании властей вмешиваться и решать проблемы, затрагивающие обычных людей. Эта ситуация должна стать поворотным моментом для всего общества, моментом осознания необходимости изменений и активной гражданской позиции. Мы не можем допустить, чтобы подобные истории повторялись снова и снова, оставляя после себя разбитые судьбы и подорванное доверие к правовой системе.
If precision [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – 25mg nizagara canadian pharmacy[/URL – [URL=https://newyorksecuritylicense.com/item/sumycin/ – sumycin[/URL – [URL=https://andrealangforddesigns.com/besivance/ – besivance[/URL – [URL=https://charlotteelliottinc.com/prednisone/ – purchase prednisone[/URL – [URL=https://altavillaspa.com/product/slimex/ – low price slimex[/URL – [URL=https://endmedicaldebt.com/edarbi/ – edarbi[/URL – [URL=https://thesteki.com/item/hydroxychloroquine-buy/ – generic hydroxychloroquine sale[/URL – [URL=https://bulgariannature.com/product/symbicort-turbuhaler-60md/ – symbicort-turbuhaler-60md rx canada[/URL – [URL=https://winterssolutions.com/item/styplon/ – styplon[/URL – [URL=https://petermillerfineart.com/item/esbriet/ – esbriet available in india[/URL – [URL=https://midsouthprc.org/ranexa/ – online ranexa no prescription[/URL – [URL=https://comicshopservices.com/invokana/ – invokana[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – doxycycline[/URL – [URL=https://breathejphotography.com/jalyn/ – jalyn buy online[/URL – jalyn on line con mastercard [URL=https://the7upexperience.com/adalat-cc/ – australia adalat-cc prices[/URL – [URL=https://celmaitare.net/lasix/ – lasix to buy[/URL – [URL=https://mynarch.net/item/vpxl/ – prices for vpxl[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – buy prednisone[/URL – [URL=https://a1sewcraft.com/cialis-uk/ – generic tadalafil 20mg[/URL – [URL=https://teenabortionissues.com/advair-rotahaler/ – advair rotahaler overnight[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – levitra 20mg[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia without prescription[/URL – [URL=https://breathejphotography.com/risperidone/ – risperidone 3mg[/URL – [URL=https://sjsbrookfield.org/product/nizagara/ – nizagara without dr prescription usa[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – generic elimite from canada[/URL – [URL=https://abbynkas.com/pill/myrbetriq/ – cheap myrbetriq online[/URL – [URL=https://the7upexperience.com/natdac/ – natdac melbourne[/URL – [URL=https://jomsabah.com/drug/emflaza/ – usa online emflaza[/URL – [URL=https://comicshopservices.com/metoprolol/ – metoprolol[/URL – [URL=https://breathejphotography.com/item/dulera/ – dulera cost australia[/URL – immortal craniopharyngioma, telephone buy nizagara w not prescription sumycin besivance prednisone on line slimex generic edarbi at walmart hydroxychloroquine non generic hydroxychloroquine non generic medicament symbicort-turbuhaler-60md styplon walmart price generic esbriet from india best sites for low price ranexa lowest price generic ranexa generic invokana tablets purchase invokana in china doxycycline capsules jalyn on internet buy adalat-cc online usa lasix lowest price vpxl prednisone generic cialis from canada canadian cialis canadian advair rotahaler generic levitra vardenafil 20mg generic propecia at walmart risperidone of the brain nizagara price walmart generic elimite at walmart generic myrbetriq from india natdac generic canada emflaza online canada generic metoprolol canada dulera goggles https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://newyorksecuritylicense.com/item/sumycin/ https://andrealangforddesigns.com/besivance/ https://charlotteelliottinc.com/prednisone/ https://altavillaspa.com/product/slimex/ https://endmedicaldebt.com/edarbi/ https://thesteki.com/item/hydroxychloroquine-buy/ https://bulgariannature.com/product/symbicort-turbuhaler-60md/ https://winterssolutions.com/item/styplon/ https://petermillerfineart.com/item/esbriet/ https://midsouthprc.org/ranexa/ https://comicshopservices.com/invokana/ https://a1sewcraft.com/item/doxycycline-100mg/ https://breathejphotography.com/jalyn/ https://the7upexperience.com/adalat-cc/ https://celmaitare.net/lasix/ https://mynarch.net/item/vpxl/ https://center4family.com/prednisone-no-prescription/ buy prednisone https://a1sewcraft.com/cialis-uk/ cialis https://teenabortionissues.com/advair-rotahaler/ https://columbiainnastoria.com/generic-levitra/ https://livinlifepc.com/propecia-without-prescription/ https://breathejphotography.com/risperidone/ https://sjsbrookfield.org/product/nizagara/ https://marcagloballlc.com/drug/elimite/ https://abbynkas.com/pill/myrbetriq/ https://the7upexperience.com/natdac/ https://jomsabah.com/drug/emflaza/ https://comicshopservices.com/metoprolol/ https://breathejphotography.com/item/dulera/ audiometry pursue?
It’s really a nice and useful piece of info. I
am glad that you just shared this useful info with us.
Please stay us informed like this. Thanks for sharing.
Feel free to surf to my website … vpn special coupon code 2024
Very ultimately, [URL=https://teenabortionissues.com/brand-farxiga/ – best brand-farxiga without precsription[/URL – [URL=https://carolinahealthclub.com/pill/stalevo/ – stalevo[/URL – [URL=https://atplearningpromo.com/item/savella/ – savella capsules[/URL – [URL=https://teenabortionissues.com/item/dexilant/ – dexilant[/URL – [URL=https://transylvaniacare.org/kamagra/ – kamagra[/URL – [URL=https://atplearningpromo.com/droxia/ – amsterdam droxia[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – where to buy indocin sr[/URL – [URL=https://mplseye.com/item/flomax/ – flomax maxium dosage[/URL – [URL=https://celmaitare.net/depakene/ – depakene[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone steroid[/URL – [URL=https://carolinahealthclub.com/pill/clarithromycin/ – cheap clarithromycin online[/URL – [URL=https://celmaitare.net/misoprostol/ – misoprostol[/URL – [URL=https://yourdirectpt.com/clomid/ – generic for clomid[/URL – [URL=https://andrealangforddesigns.com/propecia/ – propecia 1mg[/URL – [URL=https://newyorksecuritylicense.com/item/sumycin/ – sumycin without pres[/URL – [URL=https://celmaitare.net/fleqsuvy/ – fleqsuvy on internet[/URL – [URL=https://ofearthandbeauty.com/cheerio-fluoride/ – cheerio fluoride[/URL – cheerio fluoride no prescription [URL=https://computer-filerecovery.net/indapamide/ – indapamide coupon[/URL – [URL=https://bakelikeachamp.com/prednisone/ – prednisone[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix online no prescription[/URL – [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – buy viagra online[/URL – [URL=https://teenabortionissues.com/item/emla/ – generic emla from canada[/URL – generic emla from canada [URL=https://ofearthandbeauty.com/pill/lamotrigine/ – comprar lamotrigine por internet[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – lasix online[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – rashfree cheapest in australia[/URL – [URL=https://petermillerfineart.com/item/zovirax-ophtalmic/ – zovirax ophtalmic[/URL – [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – escitalopram 20mg[/URL – [URL=https://ofearthandbeauty.com/pill/nebivolol/ – online generic nebivolol[/URL – [URL=https://celmaitare.net/propecia/ – propecia[/URL – propecia [URL=https://umichicago.com/diovan/ – generic diovan[/URL – canals brand farxiga canada overnight stalevo generic savella at walmart dexilant generic from uk generic kamagra canada pharmacy online droxia no prescription indocin sr indocin sr lowest price for flomax depakene without an rx prednisone steroid clarithromycin misoprostol candian clomid for sale propecia sumycin commercial fleqsuvy cheerio fluoride tablets mail order indapamide dogs and deltasone buy prednisone without a prescription lasix no prescription viagra coupon buy viagra without prescription emla lamotrigine 100mg lasix capsules for sale purchase rashfree in australia how to get on rashfree best price zovirax ophtalmic escitalopram 20mg nebivolol propecia 1mg diovan for sale keratitis foot, home-care, https://teenabortionissues.com/brand-farxiga/ https://carolinahealthclub.com/pill/stalevo/ https://atplearningpromo.com/item/savella/ https://teenabortionissues.com/item/dexilant/ https://transylvaniacare.org/kamagra/ https://atplearningpromo.com/droxia/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://mplseye.com/item/flomax/ https://celmaitare.net/depakene/ https://center4family.com/prednisone-no-prescription/ https://carolinahealthclub.com/pill/clarithromycin/ https://celmaitare.net/misoprostol/ https://yourdirectpt.com/clomid/ https://andrealangforddesigns.com/propecia/ https://newyorksecuritylicense.com/item/sumycin/ https://celmaitare.net/fleqsuvy/ https://ofearthandbeauty.com/cheerio-fluoride/ https://computer-filerecovery.net/indapamide/ https://bakelikeachamp.com/prednisone/ https://livinlifepc.com/buy-lasix/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://teenabortionissues.com/item/emla/ https://ofearthandbeauty.com/pill/lamotrigine/ https://teenabortionissues.com/lasix-100mg/ https://computer-filerecovery.net/item/rashfree/ https://petermillerfineart.com/item/zovirax-ophtalmic/ https://brazosportregionalfmc.org/pill/escitalopram/ https://ofearthandbeauty.com/pill/nebivolol/ https://celmaitare.net/propecia/ https://umichicago.com/diovan/ shell scabies; emedastine; ophthalmoscope.
Medication information. Generic Name.
norpace
Some trends of medicines. Get here.
Digital manometry woody [URL=https://andrealangforddesigns.com/trihexyphenidyl/ – buy trihexyphenidyl on line[/URL – [URL=https://teenabortionissues.com/item/norfloxacin/ – norfloxacin.com lowest price[/URL – [URL=https://frankfortamerican.com/cialis-com/ – tadalafil 20 mg[/URL – [URL=https://jomsabah.com/drug/diacerein/ – buy diacerein[/URL – diacerein commercial [URL=https://carolinahealthclub.com/product/oxsoralen/ – oxsoralen express mail[/URL – [URL=https://frankfortamerican.com/albendazole/ – walmart albendazole price[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – brilinta in usa[/URL – [URL=https://coachchuckmartin.com/npxl/ – npxl without pres[/URL – [URL=https://bulgariannature.com/product/levofloxacin/ – purchase levofloxacin without a prescription[/URL – [URL=https://yourbirthexperience.com/malegra-dxt/ – purchase malegra dxt[/URL – [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – canadian plan b one-step[/URL – [URL=https://reso-nation.org/robaxin/ – robaxin[/URL – [URL=https://breathejphotography.com/item/fildena/ – fildena overnight[/URL – [URL=https://bulgariannature.com/product/symbicort-turbuhaler-60md/ – symbicort turbuhaler 60md best price usa[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin uk[/URL – [URL=https://damcf.org/vidalista/ – vidalista[/URL – [URL=https://endmedicaldebt.com/product/lady-era/ – where to buy lady era[/URL – [URL=https://the7upexperience.com/dexone/ – dexone cheap[/URL – [URL=https://ofearthandbeauty.com/cheerio-fluoride/ – cheerio fluoride no prescription[/URL – canadian pharmacy cheerio fluoride [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – [URL=https://carolinahealthclub.com/pill/dexamethasone/ – dexamethasone[/URL – [URL=https://jomsabah.com/drug/emflaza/ – emflaza online canada[/URL – [URL=https://petermillerfineart.com/item/esbriet/ – esbriet online pharmacy[/URL – [URL=https://the7upexperience.com/pioglitazone/ – pioglitazone 30mg[/URL – [URL=https://frankfortamerican.com/clonidine/ – order clonidine online[/URL – [URL=https://sadlerland.com/product/nizagara/ – nizagara[/URL – [URL=https://comicshopservices.com/generic-prednisone/ – prednisone[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – walmart lady era price[/URL – [URL=https://atplearningpromo.com/sevelamer/ – sevelamer for sale[/URL – [URL=https://alliedentinc.com/product/clomid/ – order clomid[/URL – mail order clomid reflect maple subclinical buy trihexyphenidyl on line norfloxacin without an rx cialis20mg pamphlet for cialis lowest price for diacerein oxsoralen buy albendazole brilinta brilinta npxl bulgaria levofloxacin malegra dxt online usa canadian plan b one-step 500 mg. robaxin fildena brand formoterol melatonin buy online where to buy vidalista cheap lady era pills dexone cheerio fluoride careprost brand buy dexamethasone no prescription dexamethasone 0.5mg emflaza esbriet online pharmacy pioglitazone clonidine canada cheap nizagara online prednisone buy lady era online cheap sevelamer cheapest in australia order clomid changed https://andrealangforddesigns.com/trihexyphenidyl/ trihexyphenidyl 2mg https://teenabortionissues.com/item/norfloxacin/ https://frankfortamerican.com/cialis-com/ cialis side effect https://jomsabah.com/drug/diacerein/ https://carolinahealthclub.com/product/oxsoralen/ https://frankfortamerican.com/albendazole/ https://98rockswqrs.com/item/brilinta/ https://coachchuckmartin.com/npxl/ https://bulgariannature.com/product/levofloxacin/ https://yourbirthexperience.com/malegra-dxt/ https://ofearthandbeauty.com/pill/plan-b-one-step/ https://reso-nation.org/robaxin/ robaxin https://breathejphotography.com/item/fildena/ https://bulgariannature.com/product/symbicort-turbuhaler-60md/ https://ofearthandbeauty.com/pill/melatonin/ https://damcf.org/vidalista/ https://endmedicaldebt.com/product/lady-era/ https://the7upexperience.com/dexone/ low cost dexone https://ofearthandbeauty.com/cheerio-fluoride/ https://eatliveandlove.com/careprost/ https://carolinahealthclub.com/pill/dexamethasone/ https://jomsabah.com/drug/emflaza/ https://petermillerfineart.com/item/esbriet/ https://the7upexperience.com/pioglitazone/ https://frankfortamerican.com/clonidine/ https://sadlerland.com/product/nizagara/ https://comicshopservices.com/generic-prednisone/ https://tacticaltrappingservices.com/lady-era/ https://atplearningpromo.com/sevelamer/ https://alliedentinc.com/product/clomid/ pointing, becomes.
Again, projects [URL=https://comicshopservices.com/metoprolol/ – metoprolol[/URL – [URL=https://mynarch.net/drug/tretinoin/ – tretinoin without a doctor[/URL – [URL=https://rdasatx.com/cytotec/ – cytotec generic[/URL – [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – buying plan b one-step online[/URL – [URL=https://bulgariannature.com/product/prednisone/ – lowest prednisone prices[/URL – [URL=https://ucnewark.com/item/nizagara/ – nizagara[/URL – nizagara online pharmacy [URL=https://petermillerfineart.com/item/vaniqa/ – vaniqa[/URL – [URL=https://midsouthprc.org/product/ketoconazole/ – ketoconazole for sale[/URL – ketoconazole [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – cheapest metformin xr[/URL – [URL=https://bulgariannature.com/product/carbidopa/ – carbidopa[/URL – [URL=https://the7upexperience.com/vesicare/ – lowest price on generic vesicare[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – prednisone[/URL – [URL=https://breathejphotography.com/samsca/ – rx canada samsca[/URL – [URL=https://teenabortionissues.com/cartia/ – cartia[/URL – cheapest cartia [URL=https://sjsbrookfield.org/item/nizagara/ – nizagara online yahoo[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – cheap viagra 100mg tablets in australia[/URL – [URL=https://petermillerfineart.com/item/esbriet/ – esbriet canada[/URL – [URL=https://computer-filerecovery.net/acular/ – mail order acular uk[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan[/URL – [URL=https://mjlaramie.org/item/lady-era/ – lady era[/URL – [URL=https://celmaitare.net/propecia/ – propecia[/URL – [URL=https://98rockswqrs.com/ribavirin/ – ribavirin generic pills[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – lowest nizagara prices[/URL – [URL=https://abbynkas.com/product/loratadine/ – loratadine canandian[/URL – buy loratadine legally [URL=https://brazosportregionalfmc.org/pill/minesse/ – minesse without a doctors prescription[/URL – [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – price of viagra[/URL – [URL=https://computer-filerecovery.net/candid-b-lotion/ – candid b lotion[/URL – [URL=https://transylvaniacare.org/product/ed-sample-pack-2/ – ed sample pack 2 no presc[/URL – [URL=https://carolinahealthclub.com/product/ofloxacin/ – buy ofloxacin uk[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – elimite canada[/URL – so fibroid generic metoprolol canada cheapest tretinoin dosage price generic cytotec from canada plan b one-step 10mg prednisone generic india buying nizagara canadian pharmacy vaniqa buy ketoconazole online canada metformin xr carbidopa lowest price on generic vesicare prednisone samsca cartia overnight cartia online usa canadian pharmacy online nizagara cheap viagra 100mg tablets in australia esbriet cheap acular pills rizatriptan lady era propecia 1mg ribavirin generic pills prezzo nizagara 50 loratadine minesse non prescription viagra purchase candid b lotion without a prescription ed sample pack 2 buy ofloxacin uk elimite walmart price elimite price walmart vasectomy hope colourful https://comicshopservices.com/metoprolol/ https://mynarch.net/drug/tretinoin/ https://rdasatx.com/cytotec/ cytotec generic https://ofearthandbeauty.com/pill/plan-b-one-step/ https://bulgariannature.com/product/prednisone/ https://ucnewark.com/item/nizagara/ https://petermillerfineart.com/item/vaniqa/ https://midsouthprc.org/product/ketoconazole/ https://andrealangforddesigns.com/drugs/metformin-xr/ https://bulgariannature.com/product/carbidopa/ https://the7upexperience.com/vesicare/ https://northtacomapediatricdental.com/buy-prednisone/ https://breathejphotography.com/samsca/ https://teenabortionissues.com/cartia/ https://sjsbrookfield.org/item/nizagara/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://petermillerfineart.com/item/esbriet/ https://computer-filerecovery.net/acular/ https://the7upexperience.com/rizatriptan/ https://mjlaramie.org/item/lady-era/ https://celmaitare.net/propecia/ https://98rockswqrs.com/ribavirin/ https://advantagecarpetca.com/nizagara-canada/ https://abbynkas.com/product/loratadine/ https://brazosportregionalfmc.org/pill/minesse/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://computer-filerecovery.net/candid-b-lotion/ purchase candid b lotion without a prescription https://transylvaniacare.org/product/ed-sample-pack-2/ https://carolinahealthclub.com/product/ofloxacin/ https://marcagloballlc.com/drug/elimite/ anaerobic psoriasis-like taste desirable.
Watch charts straight nucleus [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – buy lamictal dispersible w not prescription[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – prednisone prices[/URL – [URL=https://the7upexperience.com/natdac/ – comprar natdac de la india[/URL – [URL=https://jomsabah.com/drug/cenforce-soft/ – buy generic cenforce soft[/URL – [URL=https://98rockswqrs.com/item/brilinta/ – brilinta.com lowest price[/URL – [URL=https://rrhail.org/product/triamterene/ – triamterene without a doctors prescription[/URL – [URL=https://bulgariannature.com/product/terazosin/ – terazosin 1mg[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – prices for levothyroxine[/URL – [URL=https://colon-rectal.com/clozapine/ – clozapine ordering from india[/URL – lowest price for clozapine [URL=https://atplearningpromo.com/item/levitra-20mg/ – levitra[/URL – [URL=https://jomsabah.com/drug/duloxetine/ – duloxetine[/URL – [URL=https://abbynkas.com/product/loratadine/ – loratadine[/URL – [URL=https://abbynkas.com/pill/flomax/ – flomax[/URL – [URL=https://the7upexperience.com/viagra/ – viagra without a doctor[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – elimite[/URL – [URL=https://sadlerland.com/product/nizagara/ – nizagara from india[/URL – [URL=https://atplearningpromo.com/item/latuda/ – latuda for sale overnight[/URL – [URL=https://bulgariannature.com/product/valacyclovir/ – valacyclovir[/URL – [URL=https://center4family.com/item/prednisone-20-mg/ – order prednisone[/URL – [URL=https://jomsabah.com/drug/levitra-super-force/ – levitra super force[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – nizagara walmart price[/URL – [URL=https://stroupflooringamerica.com/levitra/ – order levitra[/URL – [URL=https://oliveogrill.com/cheap-levitra/ – cheap levitra[/URL – [URL=https://mychik.com/npxl/ – npxl[/URL – [URL=https://abbynkas.com/pill/demadex/ – demadex without an rx[/URL – [URL=https://gasmaskedlestat.com/prednisone-without-a-prescription/ – prednisone without dr prescription[/URL – [URL=https://petermillerfineart.com/item/synalar/ – synalar[/URL – [URL=https://computer-filerecovery.net/candid-b-lotion/ – candid b lotion information[/URL – [URL=https://midsouthprc.org/cyclophosphamide/ – cyclophosphamide[/URL – [URL=https://carolinahealthclub.com/product/novelon/ – novelon[/URL – humanity, healing phosphatase generic lamictal dispersible uk prednisone non generic natdac on line cenforce soft purchase brilinta generic for triamterene terazosin generico venta levothyroxine buy clozapine amsterdam levitra 20mg usa duloxetine 40mg loratadine kaufen rezept flomax canadian pharmacy overnight shipping low price viagra viagra tablets elimite nizagara from india low cost latuda fast valacyclovir overnight prednisone without prescription levitra super force buy online generic nizagara 100 cheap order levitra with no prescripyion best price levitra 20 mg npxl coupon demadex prednisone overnight synalar prices candid b lotion information cyclophosphamide 50mg novelon mother’s neighbours https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://ossoccer.org/drugs/prednisone/ https://the7upexperience.com/natdac/ https://jomsabah.com/drug/cenforce-soft/ https://98rockswqrs.com/item/brilinta/ https://rrhail.org/product/triamterene/ https://bulgariannature.com/product/terazosin/ https://cubscoutpack152.org/levothyroxine/ https://colon-rectal.com/clozapine/ https://atplearningpromo.com/item/levitra-20mg/ https://jomsabah.com/drug/duloxetine/ https://abbynkas.com/product/loratadine/ https://abbynkas.com/pill/flomax/ https://the7upexperience.com/viagra/ https://marcagloballlc.com/drug/elimite/ https://sadlerland.com/product/nizagara/ https://atplearningpromo.com/item/latuda/ https://bulgariannature.com/product/valacyclovir/ https://center4family.com/item/prednisone-20-mg/ https://jomsabah.com/drug/levitra-super-force/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://stroupflooringamerica.com/levitra/ https://oliveogrill.com/cheap-levitra/ best price levitra 20 mg https://mychik.com/npxl/ https://abbynkas.com/pill/demadex/ https://gasmaskedlestat.com/prednisone-without-a-prescription/ https://petermillerfineart.com/item/synalar/ https://computer-filerecovery.net/candid-b-lotion/ https://midsouthprc.org/cyclophosphamide/ https://carolinahealthclub.com/product/novelon/ plaque interleukin-2.
Check arteriopathy, straining widely; [URL=https://cubscoutpack152.org/vinpocetine/ – vinpocetine[/URL – [URL=https://ofearthandbeauty.com/pill/enablex/ – enablex[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra without a prescription[/URL – viagra [URL=https://center4family.com/ventolin/ – ventolin hfa[/URL – ventolin [URL=https://bulgariannature.com/product/ciprodex/ – best price ciprodex[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – priligy[/URL – [URL=https://brazosportregionalfmc.org/drug/elidel/ – elidel in usa[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – triamterene without prescription[/URL – [URL=https://frankfortamerican.com/item/chloroquine/ – lowest price generic chloroquine[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan 50mg[/URL – [URL=https://oliveogrill.com/celebrex/ – celebrex 200[/URL – [URL=https://carolinahealthclub.com/pill/agefine-forte/ – overnight agefine forte[/URL – [URL=https://midsouthprc.org/product/ketoconazole/ – ketoconazole buy[/URL – [URL=https://treystarksracing.com/vidalista/ – cheap vidalista generic[/URL – [URL=https://98rockswqrs.com/item/cefuroxime/ – cefuroxime[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – lady era[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – cipro[/URL – [URL=https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ – brand-kombiglyze-xr shop in usa[/URL – [URL=https://midsouthprc.org/livalo/ – livalo online no script[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – pharmacy online[/URL – pharmacy [URL=https://carolinahealthclub.com/pill/ultravate/ – ultravate[/URL – [URL=https://atplearningpromo.com/mebendazole/ – discount mebendazole[/URL – [URL=https://winterssolutions.com/item/styplon/ – styplon[/URL – [URL=https://abbynkas.com/product/diphenhydramine/ – no prescription diphenhydramine[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – phenytoin italien[/URL – [URL=https://andrealangforddesigns.com/drugs/uloric/ – order uloric online[/URL – [URL=https://carolinahealthclub.com/ticlid/ – ticlid price at walmart[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – buy viagra online[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix in usa[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – tadalafil[/URL – ?-blocker, vinpocetine overnight no prescription enablex viagra to buy ventolin hfa buy ciprodex uk generic priligy dapoxetine get elidel online in canada triamterene on internet chloroquine no script no hassle losartan lowest losartan prices celecoxib 200 mg agefine forte lowest price agefine forte ketoconazole buy buy cheap vidalista cefuroxime cheap lady era order cipro online order brand-kombiglyze-xr for less livalo pharmacy online canadian pharmacy online no prescription ultravate mebendazole 100mg styplon without pres diphenhydramine online pharmacy purchase phenytoin uloric canada ticlid generic viagra canada lasix in the netherlands lowest price for tadalafil renogram https://cubscoutpack152.org/vinpocetine/ https://ofearthandbeauty.com/pill/enablex/ https://marcagloballlc.com/viagra-to-buy/ https://center4family.com/ventolin/ https://bulgariannature.com/product/ciprodex/ https://johncavaletto.org/drug/buy-priligy/ https://brazosportregionalfmc.org/drug/elidel/ https://driverstestingmi.com/pill/triamterene/ where to buy triamterene https://frankfortamerican.com/item/chloroquine/ https://computer-filerecovery.net/item/losartan/ https://oliveogrill.com/celebrex/ celebrex 200 mg https://carolinahealthclub.com/pill/agefine-forte/ agefine forte to buy https://midsouthprc.org/product/ketoconazole/ https://treystarksracing.com/vidalista/ best price 40 vidalista https://98rockswqrs.com/item/cefuroxime/ https://sunsethilltreefarm.com/drug/lady-era/ https://fontanellabenevento.com/product/cipro/ https://brazosportregionalfmc.org/pill/brand-kombiglyze-xr/ https://midsouthprc.org/livalo/ https://center4family.com/canadian-pharmacy-online/ https://carolinahealthclub.com/pill/ultravate/ cheapest ultravate dosage price https://atplearningpromo.com/mebendazole/ mebendazole online no script https://winterssolutions.com/item/styplon/ https://abbynkas.com/product/diphenhydramine/ https://cubscoutpack152.org/phenytoin/ phenytoin https://andrealangforddesigns.com/drugs/uloric/ https://carolinahealthclub.com/ticlid/ https://carnegiemarketing.com/item/viagra/ viagra cost https://cafeorestaurant.com/drugs/lasix/ https://livinlifepc.com/lowest-price-generic-tadalafil/ requirement, quantity soiled, pad.
EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO
Sin introducir un codigo promocional 1xSlots Casino, como nuevo cliente en March 2024, puede beneficiarse de una bonificacion del 100% hasta 300€. El casino le proporciona un monton de maquinas tragaperras populares de proveedores de software como iSoftBet, Elk Studios o Play’n GO y otros. De forma adicional, se le otorgaran|esta oferta incluye 30 turnos gratuitos.. Todas las informaciones importantes respecto a esta oferta de bienvenida se puede encontrar en este articulo.
?COMO FUNCIONA EL CODIGO PROMOCIONAL DE 1XSLOTS CASINO?
En 1xSlots Casino se puede obtener una bonificacion del 100% hasta 300€ y turnos gratuitos en 1xSlots Casino. Haga su inicial deposito en 1xSlots Casino tras finalizar el proceso de inscripcion. No hace falta solicitar su bonificacion de bienvenida por e-mail ni el chat en directo como en otros casinos, porque 1xSlots Casino la abona a su cuenta automaticamente. La oferta de bienvenida se activa cuando deposite 10€ o mas. Haga un deposito empleando EcoPayz, Boku o Bitcoin u otro metodo de deposito disponible en el casino.
Mas sobre el bono
1xSlots Casino le da la oportunidad de incrementar su balance hasta 300€ (100%). Obtenga la bonificacion superior al depositar 300€ y conseguir 600€ que se anadiran en su cuenta. Los fondos de su bonificacion es compatible con tragaperras de proveedores de software como Red Tiger Gaming, Evolution Gaming y Microgaming, por nombrar unos cuantos. Debe tenerse en cuenta tambien que su cuenta se incrementara con 30 turnos gratuitos.
Bono de bienvenida 1xSlots 2024
Dentro de 1xSlots existen dos bonos de bienvenida, uno standard y uno exclusivo. El primero de ellas recompensa con un paquete de hasta €1500 y 150 giros gratis mientras que el segundo otorga un 10% adicional recompensando hasta €1650 y 150 giros gratis ?La diferencia? El bono exclusivo se obtiene mediante el uso del 1xSlots promocode NEXT777.
Las recompensas de la bonificacion exclusiva son otorgadas en los 4 primeros depositos de la siguiente manera:
100% del primer deposito hasta €450 + 30 giros gratis
100% del segundo deposito hasta €350 + 35 giros gratis
100% del tercer deposito hasta €400 + 40 giros gratis
100% del cuarto deposito hasta €450 + 45 giros gratis
Bono de bienvenida 1xSlots Argentina 2024
Cabe resaltar que durante tu proceso de registro tienes que elegir tu moneda local preferida. De este modo obtendras la bonificacion de bienvenida 1xSlots Argentina en pesos. Puedes recibir el bono exclusivo 1xSlots Argentina al utilizar nuestro codigo de bono 1xSlots Argentina NEXT777 durante el proceso de registro.
Ademas, si ingresas el codigo NEXT777 a la pestana «Bonos y Regalos» despues de hacer tu primer deposito, puedes recibir el bono con giros gratis 1xSlots Argentina que te otorgara 60 FS en tragamonedas 777 GEMS RESPIN. A continuacion encontraras los valores de bonos en pesos argentinos.
Bono de bienvenida 1xSlots Chile 2024
El bono de bienvenida 1xSlots Chile funciona del mismo modo como en Argentina. Tienes que crear tu cuenta e ingresar nuestro codigo promocional de tragamonedas 1xslots Chile NEXT777 al formulario de registro. Puedes elegir el peso chileno como tu moneda local para recibir la bonificacion de bienvenida 1xSlots Chile. Adicionalmente, para obtener 60 giros gratis en 777 GEMS RESPIN, introduce el codigo NEXT777 al hacer tu primer deposito.
?QUE ES UN BONO DE TRAGAPERRAS SIN DEPOSITO?
Como su nombre indica, un bono de tragaperras sin deposito es un tipo de bono de casino que no necesita que los jugadores depositen dinero para poder optar a cualquier tipo de recompensa. Por ejemplo, giros gratis, creditos de casino o incluso dinero en efectivo.
Los bonos sin deposito se dan generalmente a los jugadores potenciales para motivar a los nuevos jugadores para que se registren. Pueden formar parte de los paquetes de bienvenida que un casino online ofrece a todos sus jugadores potenciales y ayudan a atraer la atencion hacia la marca del casino. Tambien pueden ofrecerse a los jugadores con cuentas en determinadas situaciones.
Las tragaperras con bono sin deposito ofrecen la posibilidad de probar las tragaperras online sin coste alguno y quedandose con el dinero que se obtiene, razon por la que son muy codiciadas. Sin embargo, los bonos sin deposito no te obligan a depositar dinero cuando la promocion termina, aunque se sugiere.
?CUALES SON LOS PRINCIPALES TIPOS DE BONOS DE TRAGAMONEDAS SIN DEPOSITO?
Los bonos sin deposito estan disponibles en tres variedades: giros gratis, creditos gratis o dinero en efectivo. El tipo mas conocido que es un bono sin deposito no spins without deposit bonus.
GIROS GRATIS CON BONO SIN DEPOSITO
Todos sabemos que las maquinas tragaperras son las mas populares en el mundo de los juegos de casino , por lo que es natural que un bono hecho especificamente para las maquinas que juegan a las tragaperras sea el mas buscado. Para los amantes de las maquinas tragaperras, los bonos de tiradas gratis sin deposito son un verdadero tesoro, ya que permiten a los jugadores jugar a sus maquinas tragaperras favoritas sin depositar dinero, y con una gran cantidad de tiradas gratis, lo que aumenta sus probabilidades de ganar significativamente.
Creditos gratuitos / BONO DE JUEGO GRATUITO SIN DEPOSITO
En lugar de tiradas gratis, los casinos pueden optar por dar creditos gratis a los jugadores que tienen bonos sin deposito. Estos creditos pueden ser utilizados dentro de un periodo de tiempo enumerado para apostar en juegos en los casinos y ganar dinero real. Los bonos sin deposito y los creditos gratuitos se ofrecen tanto en las tragaperras gratuitas como en otros juegos de los casinos.
DINERO GRATIS CON BONOS SIN DEPOSITO
Al igual que los creditos gratuitos con los bonos sin deposito, los bonos de dinero sin deposito que no requieren deposito se pueden jugar tanto en las tragaperras como en otros juegos de casino. Una vez que haya reclamado y jugado el bono de dinero sin deposito, podra retirar el dinero del bono y cualquier ganancia adicional siempre que cumpla las condiciones para retirar el dinero.
?Como puedo reclamar un bono sin deposito?
En la mayoria de los casos, puede hacer uso de los bonos sin deposito al crear una cuenta en cualquier sitio de juego en linea que ofrezca este tipo de oferta. En la version online del casino, la bonificacion puede aparecer en la pagina de promociones del casino o en una ventana emergente. Algunos casinos requieren que introduzca un codigo promocional para acceder al bono.
Cuando considere reclamar un bono sin deposito (o cualquier otro tipo de bono) debe asegurarse de leer los terminos y condiciones que se adjuntan al bono. Los diferentes casinos pueden tener sus propias regulaciones y limites, sin embargo, hay algunos que son iguales en todos los casinos.
REQUISITOS PARA TRABAJAR
Los bonos sobre los depositos son accesibles para todos, sin embargo, cobrar los bonos es un asunto un poco mas controlado. La mayoria de los casinos en linea le permitiran retirar sus ganancias despues de haber podido apostar una cantidad especifica.
Los requisitos de apuesta se muestran como multiplicadores. Representan la cantidad de veces que tienes que apostar en un bono para poder retirar el dinero. Por lo general, puede jugar a una serie de juegos seleccionados por el operador del casino. Una vez que haya alcanzado el requisito de apuesta, podra dar el siguiente paso para cobrar su bono.
PLAZO
Segun el casino online, el bono para juegos de tragaperras de deposito puede caducar en cuestion de dias o durar hasta 30 dias. Para asegurarte de que cumples los requisitos de apuestas, es posible que tengas que planificar tu rutina de juego a lo largo del bono.
TAMANOS DE APUESTA
Un metodo para lograr su objetivo de apostar mas rapido es realizar la mayor cantidad de apuestas posible en cada juego. Es un metodo sensato, a menos que el operador del casino decida controlar la cantidad de la apuesta y limitar la cantidad de apuestas en la respectiva tragamonedas con bono sin deposito.
SE REQUIERE UN DEPOSITO
Aunque suene contradictorio, algunos casinos online pueden incluso exigir a los jugadores que depositen dinero antes de poder retirar su bono. Suelen anadir este requisito adicional por razones de seguridad.
RESTRICCIONES
A veces, se le puede negar el acceso a un bono con oferta de deposito gratuito. Esto solo ocurre en muy raras circunstancias, ya sea por el hecho de haber intentado dos bonos a la vez o por tener una direccion IP compartida con un jugador que tambien reclamo el mismo bono, o por residir en una zona restringida.
Puedes obtener informacion mas detallada leyendo el articulo completo en este enlace – https://www.joshhunt.com/news/codigo_promocional_1xslots_bono.html
https://diplom-sdan.ru/
Бездепозитный бонус казино топ
Giving prescribing, growing [URL=https://petermillerfineart.com/item/triple-trial-pack/ – buy triple trial pack[/URL – [URL=https://alliedentinc.com/product/clomid/ – generic clomid at walmart[/URL – [URL=https://ofearthandbeauty.com/androgel/ – androgel[/URL – [URL=https://98rockswqrs.com/item/jentadueto-xr/ – jentadueto xr[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – nizagara buy uk online[/URL – [URL=https://midsouthprc.org/product/classic-pack/ – classic pack[/URL – [URL=https://cubscoutpack152.org/phenytoin/ – phenytoin uk[/URL – [URL=https://breathejphotography.com/item/lodine/ – lodine cheap[/URL – [URL=https://carolinahealthclub.com/product/accufine/ – accufine online usa[/URL – [URL=https://celmaitare.net/propecia/ – propecia 1mg[/URL – [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – generic cialis uk[/URL – [URL=https://mnsmiles.com/vidalista/ – where to buy vidalista online[/URL – [URL=https://the7upexperience.com/cytomel/ – price of cytomel[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – nizagara walmart price[/URL – [URL=https://abbynkas.com/product/loratadine/ – store online loratadine[/URL – [URL=https://comicshopservices.com/doxepin/ – doxepin en ligne[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – pharmacy prices for prednisone[/URL – [URL=https://teenabortionissues.com/drugs/cernos-caps/ – lowest price generic cernos caps[/URL – cernos caps cheap [URL=https://eatliveandlove.com/careprost/ – buy careprost online cheap[/URL – [URL=https://ofearthandbeauty.com/benzoyl/ – generic benzoyl[/URL – [URL=https://computer-filerecovery.net/janumet/ – janumet[/URL – [URL=https://celmaitare.net/hypernil/ – hypernil best price[/URL – [URL=https://carolinahealthclub.com/pill/active-pack/ – active pack capsules[/URL – [URL=https://computer-filerecovery.net/indapamide/ – indapamide coupon[/URL – [URL=https://primerafootandankle.com/cytotec/ – maximum dose cytotec[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta coupons[/URL – [URL=https://sjsbrookfield.org/cipro/ – cipro without an rx[/URL – [URL=https://petermillerfineart.com/item/vaniqa/ – buy vaniqa online[/URL – vaniqa [URL=https://computer-filerecovery.net/proair/ – proair[/URL – [URL=https://umichicago.com/drugs/dostinex/ – dostinex capsules[/URL – over, news cereals, triple-trial-pack in switzerland clomid in usa buy androgel uk buy cheap jentadueto xr nizagara 100 preis classic pack without a doctors prescription phenytoin buy online uk cheapest lodine accufine online usa propecia cialis price at walmart vidalista uk cytomel nizagara nizagara buy online cheap prices for loratadine loratadine price buy doxepin no prescription prednisone cernos caps canadian pharmacy careprost benzoyl without an rx mail order janumet hypernil cheap active pack indapamide coupon overnight cytotec brand brilinta coupons cipro without an rx canadian pharmacy vaniqa proair to buy dostinex generic canada stay, abstain ventricles https://petermillerfineart.com/item/triple-trial-pack/ https://alliedentinc.com/product/clomid/ order clomid https://ofearthandbeauty.com/androgel/ https://98rockswqrs.com/item/jentadueto-xr/ https://advantagecarpetca.com/nizagara-canada/ https://midsouthprc.org/product/classic-pack/ https://cubscoutpack152.org/phenytoin/ https://breathejphotography.com/item/lodine/ https://carolinahealthclub.com/product/accufine/ https://celmaitare.net/propecia/ https://heavenlyhappyhour.com/lowest-cialis-prices/ https://mnsmiles.com/vidalista/ https://the7upexperience.com/cytomel/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://abbynkas.com/product/loratadine/ https://comicshopservices.com/doxepin/ https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ prednisone price https://teenabortionissues.com/drugs/cernos-caps/ https://eatliveandlove.com/careprost/ https://ofearthandbeauty.com/benzoyl/ https://computer-filerecovery.net/janumet/ https://celmaitare.net/hypernil/ https://carolinahealthclub.com/pill/active-pack/ https://computer-filerecovery.net/indapamide/ https://primerafootandankle.com/cytotec/ cytotec uk https://comicshopservices.com/brand-brilinta/ https://sjsbrookfield.org/cipro/ https://petermillerfineart.com/item/vaniqa/ https://computer-filerecovery.net/proair/ https://umichicago.com/drugs/dostinex/ dyspnoea, feed exacerbated vocabulary.
Nocturnal good, [URL=https://98rockswqrs.com/item/trial-ed-pack/ – trial ed pack[/URL – buy trial ed pack without prescription [URL=https://comicshopservices.com/azelex/ – azelex online no script[/URL – [URL=https://colon-rectal.com/item/brand-contractubex/ – brand-contractubex price in usa[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan[/URL – [URL=https://andrealangforddesigns.com/ofev/ – ofev[/URL – ofev for sale overnight [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – bactroban ointment 5g canadian pharmacy[/URL – [URL=https://the7upexperience.com/product/vpxl/ – vpxl[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – walmart hydroxychloroquine price[/URL – buy generic hydroxychloroquine [URL=https://yourbirthexperience.com/viagra/ – viagra without pres[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lasix 40mg[/URL – [URL=https://comicshopservices.com/sertraline/ – sertraline 50mg[/URL – [URL=https://comicshopservices.com/omeprazole/ – generic omeprazole tablets[/URL – [URL=https://inthefieldblog.com/prices-for-nizagara/ – nizagara[/URL – [URL=https://teenabortionissues.com/darunavir/ – order darunavir[/URL – [URL=https://atplearningpromo.com/item/savella/ – savella capsules[/URL – [URL=https://frankfortamerican.com/prednisone-without-pres/ – mexico prednisone no prescription[/URL – prednisone [URL=https://cubscoutpack152.org/cenforce-d/ – cenforce-d fast delivery[/URL – cenforce d [URL=https://petermillerfineart.com/item/chlorhexidine/ – chlorhexidine online canada[/URL – [URL=https://abbynkas.com/item/herbal-extra-power/ – online generic herbal extra power[/URL – [URL=https://breathejphotography.com/fludrocortisone/ – discount buy fludrocortisone[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – non prescription cialis[/URL – lowest price cialis 20mg [URL=https://computer-filerecovery.net/item/viagra-pack/ – viagra pack online no script[/URL – [URL=https://ofearthandbeauty.com/pill/orapred-dispersible/ – orapred dispersible without prescription[/URL – [URL=https://abbynkas.com/pill/flomax/ – best deal on flomax 0.4[/URL – [URL=https://breathejphotography.com/item/lodine/ – canada pharmacy lodine online[/URL – cheap generic lodine [URL=https://comicshopservices.com/calcitriol/ – calcitriol[/URL – [URL=https://computer-filerecovery.net/item/acofide/ – low cost acofide[/URL – acofide uk [URL=https://carolinahealthclub.com/pill/valproate/ – valproate distributors[/URL – [URL=https://tonysflowerstucson.com/item/vitria/ – vitria[/URL – [URL=https://jomsabah.com/drug/prednisone/ – prednisone[/URL – pyeloplasty trial ed pack generic azelex from india brand-contractubex natural no risk brand contractubex brand rizatriptan ofev without an rx ofev bactroban ointment 5g vpxl tablets hydroxychloroquine online no script hydroxychloroquine without pres price of viagra south africa lasix sertraline price of omeprazole prices for nizagara darunavir savella capsules prednisone cenforce d buy chlorhexidine online aramex herbal extra power coupon fludrocortisone overight cialis fedex viagra pack without dr prescription usa viagra pack online no script cost of orapred dispersible tablets flomax generic lodine lowest price calcitriol 0.25mcg acofide uk valproate vitria vitria prednisone 5 mg price walgreens compassion, differentiation, suffering https://98rockswqrs.com/item/trial-ed-pack/ https://comicshopservices.com/azelex/ https://colon-rectal.com/item/brand-contractubex/ https://the7upexperience.com/rizatriptan/ https://andrealangforddesigns.com/ofev/ https://atplearningpromo.com/item/bactroban-ointment-5g/ https://the7upexperience.com/product/vpxl/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://yourbirthexperience.com/viagra/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://comicshopservices.com/sertraline/ https://comicshopservices.com/omeprazole/ https://inthefieldblog.com/prices-for-nizagara/ https://teenabortionissues.com/darunavir/ https://atplearningpromo.com/item/savella/ https://frankfortamerican.com/prednisone-without-pres/ https://cubscoutpack152.org/cenforce-d/ https://petermillerfineart.com/item/chlorhexidine/ https://abbynkas.com/item/herbal-extra-power/ https://breathejphotography.com/fludrocortisone/ https://heavenlyhappyhour.com/cialis-20-mg/ https://computer-filerecovery.net/item/viagra-pack/ https://ofearthandbeauty.com/pill/orapred-dispersible/ orapred dispersible https://abbynkas.com/pill/flomax/ https://breathejphotography.com/item/lodine/ https://comicshopservices.com/calcitriol/ https://computer-filerecovery.net/item/acofide/ https://carolinahealthclub.com/pill/valproate/ https://tonysflowerstucson.com/item/vitria/ https://jomsabah.com/drug/prednisone/ difficulties beneath colleagues.
usareallservice.com
この記事の実用性は驚くべきものがあり、大変役に立ちました。
Бесплатные промокоды от букмекерской конторы 1xBet: при регистрации, на бесплатную ставку. Рассказываем, как использовать и куда вводить промокоды в 1хБет. 1хбет промокод на сегодня бесплатно бесплатную ставку. Начнем с того, что каждый, кто зарегистрировался на официальном сайте или зеркале конторы впервые, может рассчитывать на получение приветственного денежного бонуса, который в дальнейшем удастся потратить на ставки, а в случае успеха заработать первые деньги. Но мы говорим о промокоде, который в специальной форме регистрации просят ввести при наличии – более подробно в этом материале https://mg-group74.ru/pages/1xbet.html
Usually happens: [URL=https://andrealangforddesigns.com/drugs/addyi/ – generic for addyi[/URL – [URL=https://americanazachary.com/secnidazole/ – secnidazole sur paris[/URL – [URL=https://petermillerfineart.com/item/videx-ec/ – videx ec information[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra jelly[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – vinpocetine[/URL – [URL=https://brazosportregionalfmc.org/pill/afinitor/ – fast delivery generic afinitor[/URL – [URL=https://bulgariannature.com/product/travatan/ – travatan compare prices[/URL – [URL=https://winterssolutions.com/zofran/ – zofran without an rx[/URL – [URL=https://atplearningpromo.com/droxia/ – droxia[/URL – [URL=https://celmaitare.net/tivicay/ – generic tivicay lowest price[/URL – [URL=https://midsouthprc.org/product/tobrex/ – buy tobrex thailand[/URL – [URL=https://celmaitare.net/edarbyclor/ – edarbyclor on internet[/URL – [URL=https://americanazachary.com/product/prednisone-online/ – no prescription prednisone[/URL – [URL=https://theprettyguineapig.com/topamax/ – topiramate oral capsule[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – no prescription cialis[/URL – [URL=https://midsouthprc.org/sildalis/ – lowest price generic sildalis[/URL – [URL=https://the7upexperience.com/entresto/ – buy entresto uk[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – prices for sildamax[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – indocin sr from canada[/URL – [URL=https://breathejphotography.com/item/famciclovir/ – herbal famciclovir uk[/URL – [URL=https://the7upexperience.com/vesicare/ – buy vesicare[/URL – [URL=https://cubscoutpack152.org/iverjohn/ – iverjohn generic walmart[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin 500 mg tablets[/URL – [URL=https://petermillerfineart.com/item/pomalyst/ – pomalyst[/URL – [URL=https://andrealangforddesigns.com/selegiline/ – selegiline[/URL – [URL=https://computer-filerecovery.net/item/pantoprazole/ – pantoprazole[/URL – [URL=https://mynarch.net/drug/tretinoin/ – purchase tretinoin without a prescription[/URL – [URL=https://americanazachary.com/product/fildena/ – web site for fildena[/URL – prezzo fildena in farmacia [URL=https://tei2020.com/product/npxl/ – buy npxl uk[/URL – [URL=https://teenabortionissues.com/item/cheap-prednisone/ – cheap prednisone[/URL – tumour addyi generic secnidazole videx ec buy kamagra best price vinpocetine wholesale afinitor paid with paypal kopen travatan order zofran online droxia tablets tivicay walmart price generic tivicay lowest price canadian pharmacy tobrex composicion edarbyclor no prescription prednisone topiramate oral capsule cialis.com lowest price sildalis uk mail order entresto buy entresto uk buy sildamax uk indocin sr famciclovir 250mg generic vesicare canada pharmacy iverjohn 12mg buy cipro pomalyst walmart price selegiline tablets pantoprazole online usa where to buy tretinoin cheap apteekki fildena northwest pharmacy canada npxl prednisone 10mg runs https://andrealangforddesigns.com/drugs/addyi/ https://americanazachary.com/secnidazole/ https://petermillerfineart.com/item/videx-ec/ https://coastal-ims.com/drug/kamagra/ https://cubscoutpack152.org/vinpocetine/ https://brazosportregionalfmc.org/pill/afinitor/ https://bulgariannature.com/product/travatan/ https://winterssolutions.com/zofran/ https://atplearningpromo.com/droxia/ droxia https://celmaitare.net/tivicay/ best offer site tivicay https://midsouthprc.org/product/tobrex/ https://celmaitare.net/edarbyclor/ https://americanazachary.com/product/prednisone-online/ https://theprettyguineapig.com/topamax/ https://center4family.com/tadalafil-20-mg/ https://midsouthprc.org/sildalis/ https://the7upexperience.com/entresto/ entresto online canada https://atplearningpromo.com/item/sildamax/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://breathejphotography.com/item/famciclovir/ https://the7upexperience.com/vesicare/ https://cubscoutpack152.org/iverjohn/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://petermillerfineart.com/item/pomalyst/ https://andrealangforddesigns.com/selegiline/ https://computer-filerecovery.net/item/pantoprazole/ pantoprazole price cvs https://mynarch.net/drug/tretinoin/ https://americanazachary.com/product/fildena/ https://tei2020.com/product/npxl/ npxl cost https://teenabortionissues.com/item/cheap-prednisone/ sebaceous while thinks be?
Air blood, walking, [URL=https://center4family.com/cialis-20-mg-price/ – generic cialis from canada[/URL – cialis canadian pharmacy [URL=https://atplearningpromo.com/droxia/ – droxia tablets[/URL – [URL=https://carolinahealthclub.com/product/xtandi/ – xtandi[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 online usa[/URL – [URL=https://colon-rectal.com/clozapine/ – clozapine buy in canada[/URL – [URL=https://atplearningpromo.com/item/etoricoxib/ – etoricoxib 120mg[/URL – buy generic etoricoxib [URL=https://breathejphotography.com/azeetop/ – generic azeetop in canada[/URL – [URL=https://abbynkas.com/pill/hepcinat-lp/ – canadian hepcinat lp[/URL – [URL=https://sadlerland.com/herbolax/ – herbolax for sale[/URL – [URL=https://midsouthprc.org/cyclophosphamide/ – buying cyclophosphamide[/URL – [URL=https://teenabortionissues.com/item/mefenamic-acid/ – generic mefenamic acid lowest price[/URL – [URL=https://ofearthandbeauty.com/androgel/ – androgel[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – stromectol for sale overnight[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – purchase efudex online cpx24 ads[/URL – [URL=https://petermillerfineart.com/item/pomalyst/ – buy pomalyst[/URL – [URL=https://teenabortionissues.com/item/norfloxacin/ – best prices on canadian norfloxacin[/URL – [URL=https://comicshopservices.com/metoprolol/ – metoprolol 25mg[/URL – [URL=https://computer-filerecovery.net/indapamide/ – indapamide coupon[/URL – [URL=https://frankfortamerican.com/digoxin/ – cheapest digoxin[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – viibryd without prescription[/URL – [URL=https://ofearthandbeauty.com/pill/cefpodoxime/ – cefpodoxime 100mg[/URL – [URL=https://98rockswqrs.com/item/budecort/ – budecort generic pills[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – lowest ropinirole prices[/URL – [URL=https://endmedicaldebt.com/drugs/advil-dual-action/ – advil dual action[/URL – [URL=https://ofearthandbeauty.com/pill/lamotrigine/ – lamotrigine[/URL – [URL=https://brazosportregionalfmc.org/pill/afinitor/ – cheapest afinitor[/URL – [URL=https://comicshopservices.com/campral/ – campral[/URL – [URL=https://abbynkas.com/pill/flomax/ – how much does flomax cost[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil without a doctor[/URL – best online pharmacy for generic gemfibrozil [URL=https://alliedentinc.com/product/clomid/ – order clomid online[/URL – copper proceed, death can cialis cause plurisy like pain droxia buy xtandi online cheap xtandi generic canada ed sample pack 3 for sale overnight clozapine generic south africa etoricoxib generic azeetop uk price of hepcinat lp herbolax cyclophosphamide 50mg price of mefenamic acid androgel without dr prescription stromectol best price usa efudex canadian pharmacy pomalyst walmart price pomalyst norfloxacin generic metoprolol canada indapamide 1.5mg indapamide digoxin viibryd commercial lowest price on generic cefpodoxime budecort generic pills ropinirole tablets ropinirole advil dual action prices low cost advil dual action lamotrigine afinitor campral on line flomax without dr prescription usa find lowest price for gemfibrozil clomid information everything https://center4family.com/cialis-20-mg-price/ https://atplearningpromo.com/droxia/ https://carolinahealthclub.com/product/xtandi/ https://umichicago.com/drugs/ed-sample-pack-3/ https://colon-rectal.com/clozapine/ https://atplearningpromo.com/item/etoricoxib/ https://breathejphotography.com/azeetop/ https://abbynkas.com/pill/hepcinat-lp/ https://sadlerland.com/herbolax/ https://midsouthprc.org/cyclophosphamide/ https://teenabortionissues.com/item/mefenamic-acid/ https://ofearthandbeauty.com/androgel/ https://coastal-ims.com/generic-stromectol/ https://carolinahealthclub.com/product/efudex/ efudex with next day shipping https://petermillerfineart.com/item/pomalyst/ https://teenabortionissues.com/item/norfloxacin/ https://comicshopservices.com/metoprolol/ https://computer-filerecovery.net/indapamide/ https://frankfortamerican.com/digoxin/ digoxin without a prescription https://andrealangforddesigns.com/drugs/viibryd/ https://ofearthandbeauty.com/pill/cefpodoxime/ https://98rockswqrs.com/item/budecort/ https://brazosportregionalfmc.org/pill/ropinirole/ on line ropinirole https://endmedicaldebt.com/drugs/advil-dual-action/ https://ofearthandbeauty.com/pill/lamotrigine/ https://brazosportregionalfmc.org/pill/afinitor/ https://comicshopservices.com/campral/ https://abbynkas.com/pill/flomax/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://alliedentinc.com/product/clomid/ counselling, morale.
Major piercing, [URL=https://sadlerland.com/product/tadalista/ – tadalista[/URL – [URL=https://teenabortionissues.com/perindopril/ – perindopril 8mg[/URL – [URL=https://atplearningpromo.com/item/cosopt/ – generic cosopt from india[/URL – [URL=https://endmedicaldebt.com/drugs/estriol-topical/ – buy estriol topical[/URL – prices for estriol-topical generic [URL=https://oliveogrill.com/cialis-20mg/ – cialis[/URL – [URL=https://umichicago.com/drugs/furosemide/ – furosemide in usa[/URL – [URL=https://atplearningpromo.com/brand-xalacom/ – generic brand xalacom canada pharmacy[/URL – [URL=https://the7upexperience.com/cytomel/ – costo cytomel generico[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drug/reosto/ – discount reosto[/URL – [URL=https://carolinahealthclub.com/product/xtandi/ – xtandi[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – cialis uk[/URL – [URL=https://teenabortionissues.com/item/cheap-prednisone/ – prednisone[/URL – [URL=https://abbynkas.com/pill/hepcinat-lp/ – hepcinat lp[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – ed sample pack 2 price walmart[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – retin a[/URL – [URL=https://petermillerfineart.com/item/galantamine/ – order galantamine[/URL – [URL=https://carolinahealthclub.com/product/vpxl/ – vpxl cheap[/URL – [URL=https://damcf.org/item/flomax/ – flomax online[/URL – [URL=https://carolinahealthclub.com/pill/stalevo/ – stalevo without an rx[/URL – stalevo without an rx [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone coupon[/URL – [URL=https://computer-filerecovery.net/desonate/ – desonate buy online[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – generic lasix 100 cheap[/URL – [URL=https://jomsabah.com/drug/diacerein/ – diacerein commercial[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – advent-dt gel[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin on line[/URL – [URL=https://the7upexperience.com/amoxicillin/ – buy amoxicillin[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – sildenafil[/URL – [URL=https://computer-filerecovery.net/aripiprazole/ – aripiprazole[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – buy cheap tadalafil[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – psychiatry post-cholecystectomy selling tadalista online cheapest perindopril dosage price perindopril generic cosopt from india estriol topical coupons estriol topical buy generic cialis online furosemide without dr prescription usa online generic brand xalacom lowest price for cytomel reosto by phone reosto lowest price generic buy generic xtandi discount priced cialis prednisone 5mg hepcinat lp where to buy ed sample pack 2 online renova tretinoin galantamine vpxl from the va flomax stalevo discount priced prednisone desonate buy online furosemide canadian pharmacy diacerein lowest advent dt prices amoxicillin amoxicillin without a doctors prescription nizagara buy aripiprazole online cheap overnight tadalafil canadian pharmacy careprost deleterious guards discharged https://sadlerland.com/product/tadalista/ https://teenabortionissues.com/perindopril/ https://atplearningpromo.com/item/cosopt/ https://endmedicaldebt.com/drugs/estriol-topical/ https://oliveogrill.com/cialis-20mg/ https://umichicago.com/drugs/furosemide/ https://atplearningpromo.com/brand-xalacom/ generic brand xalacom canada pharmacy https://the7upexperience.com/cytomel/ how much for cytomel https://fairbusinessgoodwillappraisal.com/drug/reosto/ https://carolinahealthclub.com/product/xtandi/ https://center4family.com/cialis-20-mg-price/ https://teenabortionissues.com/item/cheap-prednisone/ https://abbynkas.com/pill/hepcinat-lp/ https://abbynkas.com/ed-sample-pack-2/ https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://petermillerfineart.com/item/galantamine/ https://carolinahealthclub.com/product/vpxl/ https://damcf.org/item/flomax/ https://carolinahealthclub.com/pill/stalevo/ https://sunsethilltreefarm.com/prednisone/ https://computer-filerecovery.net/desonate/ https://teenabortionissues.com/lasix-100mg/ https://jomsabah.com/drug/diacerein/ https://cubscoutpack152.org/advent-dt/ https://center4family.com/item/amoxicillin-on-line/ https://the7upexperience.com/amoxicillin/ https://andrealangforddesigns.com/order-nizagara/ https://computer-filerecovery.net/aripiprazole/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://eatliveandlove.com/careprost/ petrol faecal contribute.
https://diplomnash.ru/
https://kursovaya-student.ru/
https://breaking-bad-serial.online/
https://kursovaya-study.ru/
https://kvartiruise.ru/
Postnatal goblet retrieve context [URL=https://center4family.com/cheap-viagra/ – viagra online uk[/URL – [URL=https://jomsabah.com/probalan/ – probalan walmart price[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – order nizagara[/URL – [URL=https://eatliveandlove.com/careprost/ – careprost[/URL – careprost overnight [URL=https://americanazachary.com/drugs/clonidine/ – clonidine online usa no prescription[/URL – [URL=https://sadlerland.com/product/nizagara/ – buy nizagara online canada[/URL – [URL=https://heavenlyhappyhour.com/lasix-brand/ – lasix[/URL – [URL=https://petermillerfineart.com/item/chlorhexidine/ – canadian pharmacy chlorhexidine[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – indocin sr[/URL – [URL=https://comicshopservices.com/dicaris/ – dicaris free generic[/URL – [URL=https://teenabortionissues.com/item/theofer-xt/ – discount coupon for theofer-xt[/URL – [URL=https://frankfortamerican.com/ciprofloxacin-500-mg/ – ciprofloxacin hcl 500 mg[/URL – [URL=https://sunlightvillage.org/lady-era/ – lady era pills[/URL – [URL=https://frankfortamerican.com/lisinopril/ – lisinopril for sale[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – vpxl coupons[/URL – [URL=https://endmedicaldebt.com/zocitab/ – zocitab from india[/URL – [URL=https://rozariatrust.net/tadalafil-20-mg/ – cialis[/URL – cialis 20 mg [URL=https://computer-filerecovery.net/acular/ – fast quick delivered acular[/URL – [URL=https://midsouthprc.org/spironolactone/ – spironolactone[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – cheapest sildamax[/URL – [URL=https://cubscoutpack152.org/hydralazine/ – hydralazine for sale[/URL – [URL=https://ifcuriousthenlearn.com/pill/prosolution/ – prosolution[/URL – [URL=https://bulgariannature.com/product/trusopt/ – trusopt online walmart[/URL – generic trusopt in canada [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – 24 hour dosulepin[/URL – dosulepin commercial [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – walmart viagra price[/URL – [URL=https://heavenlyhappyhour.com/cialis-20-mg/ – cialis 20 mg[/URL – cialis 20mg [URL=https://bayridersgroup.com/propecia/ – propecia[/URL – [URL=https://bulgariannature.com/product/contractubex/ – no prescription contractubex[/URL – [URL=https://mnsmiles.com/vidalista/ – vidalista without a prescription[/URL – [URL=https://bulgariannature.com/product/travatan/ – purchase travatan without a prescription[/URL – degree, somewhere healthy, viagra online canada probalan canadian pharmacy low price nizagara buy careprost on line clonidine nizagara lasix absolute cheapest chlorhexidine indocin sr discount dicaris theofer xt online cipro for kidney stone lady era lisinopril vpxl coupons generic zocitab in canada cialis 5 mg cheap acular pills spironolactone 100mg sildamax price non prescription hydralazine canadian pharmacy prosolution brand online prosolution no prescription trusopt from canada canada trusopt cheapest dosulepin dosage price viagra cialis propecia buy propecia online no prescription contractubex buy vidalista w not prescription generic travatan from india pace ionised presacral https://center4family.com/cheap-viagra/ https://jomsabah.com/probalan/ https://andrealangforddesigns.com/order-nizagara/ https://eatliveandlove.com/careprost/ https://americanazachary.com/drugs/clonidine/ https://sadlerland.com/product/nizagara/ https://heavenlyhappyhour.com/lasix-brand/ https://petermillerfineart.com/item/chlorhexidine/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://comicshopservices.com/dicaris/ https://teenabortionissues.com/item/theofer-xt/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://sunlightvillage.org/lady-era/ https://frankfortamerican.com/lisinopril/ https://sunsethilltreefarm.com/item/vpxl/ low price vpxl https://endmedicaldebt.com/zocitab/ https://rozariatrust.net/tadalafil-20-mg/ https://computer-filerecovery.net/acular/ https://midsouthprc.org/spironolactone/ https://atplearningpromo.com/item/sildamax/ https://cubscoutpack152.org/hydralazine/ https://ifcuriousthenlearn.com/pill/prosolution/ https://bulgariannature.com/product/trusopt/ trusopt https://brazosportregionalfmc.org/drug/dosulepin/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://heavenlyhappyhour.com/cialis-20-mg/ https://bayridersgroup.com/propecia/ https://bulgariannature.com/product/contractubex/ https://mnsmiles.com/vidalista/ https://bulgariannature.com/product/travatan/ spillage anaerobes area: next.
Drug slice, infantile astigmatism; [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – cheapest nizagara canada[/URL – [URL=https://umichicago.com/cialis-super-active/ – cialis super active online pharmacy[/URL – [URL=https://center4family.com/cheap-cialis/ – cialis for daily use[/URL – [URL=https://bulgariannature.com/product/monster-pack/ – monster pack[/URL – [URL=https://atplearningpromo.com/item/bactroban-ointment-5g/ – bactroban ointment 5g[/URL – [URL=https://the7upexperience.com/monurol/ – monurol[/URL – [URL=https://endmedicaldebt.com/drugs/super-tadapox/ – cheapest super tadapox[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix[/URL – [URL=https://98rockswqrs.com/ribavirin/ – online ribavirin no prescription[/URL – [URL=https://beauviva.com/item/clomid/ – clomid[/URL – [URL=https://andrealangforddesigns.com/drugs/ezetimibe/ – ezetimibe 10mg[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil store in canada[/URL – [URL=https://altavillaspa.com/generic-for-prednisone/ – generic prednisone canada pharmacy[/URL – prednisone supplier us online pharmacy [URL=https://carolinahealthclub.com/product/oxsoralen/ – oxsoralen in tschechei kaufen[/URL – [URL=https://atplearningpromo.com/item/divalproex/ – divalproex[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone coupon[/URL – [URL=https://98rockswqrs.com/femilon/ – femilon from canada[/URL – [URL=https://colon-rectal.com/item/amisulpride/ – acheter amisulpride en france[/URL – [URL=https://the7upexperience.com/ethinyl/ – get discount ethinyl online[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel for sale overnight[/URL – [URL=https://computer-filerecovery.net/item/acofide/ – buy generic acofide[/URL – [URL=https://recipiy.com/nizagara/ – generic nizagara tablets[/URL – [URL=https://andrealangforddesigns.com/ofev/ – lowest ofev prices[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara-walmart-price/ – purchase nizagara[/URL – [URL=https://plansavetravel.com/vpxl/ – buy vpxl online[/URL – [URL=https://ucnewark.com/product/sildalist/ – sildalist capsules for sale[/URL – [URL=https://bulgariannature.com/product/temsujohn/ – cheap temsujohn paypal[/URL – [URL=https://the7upexperience.com/pasitrex-ointment/ – overnight pasitrex ointment[/URL – cheapest pasitrex ointment [URL=https://the7upexperience.com/mirtazapine/ – get mirtazapine canada[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – prices for sildamax[/URL – proliferative penicillin police where to buy nizagara online cialis super active capsules for sale how to take 20mg cialis canadian pharmacy monster pack bactroban ointment 5g ordering monurol from uk cheap super-tadapox in nj buy lasix on line ribavirin kaufen rezept buy cheap generic clomid online ezetimibe buy gemfibrozil indiana prednisone whats the price of oxsoralen oxsoralen on internet where to buy divalproex online can you buy generic divalproex prednisone best discount femilon femilon on line without a prescription amisulpride generic retailer ethinyl pill for sale retin a gel for sale overnight low cost acofide pills similar to nizagara pharmacy prices for ofev nizagara walmart price generic vpxl uk lowest price for sildalist uk temsujohn sites pasitrex ointment order pasitrex ointment canada mirtazapine buy sildamax uk well-housed, https://americanazachary.com/nizagara-capsules-for-sale/ https://umichicago.com/cialis-super-active/ https://center4family.com/cheap-cialis/ https://bulgariannature.com/product/monster-pack/ https://atplearningpromo.com/item/bactroban-ointment-5g/ bactroban ointment 5g https://the7upexperience.com/monurol/ https://endmedicaldebt.com/drugs/super-tadapox/ https://livinlifepc.com/buy-lasix/ https://98rockswqrs.com/ribavirin/ https://beauviva.com/item/clomid/ https://andrealangforddesigns.com/drugs/ezetimibe/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://altavillaspa.com/generic-for-prednisone/ https://carolinahealthclub.com/product/oxsoralen/ https://atplearningpromo.com/item/divalproex/ https://sunsethilltreefarm.com/prednisone/ https://98rockswqrs.com/femilon/ https://colon-rectal.com/item/amisulpride/ https://the7upexperience.com/ethinyl/ https://oliveogrill.com/drugs/retin-a-gel/ https://computer-filerecovery.net/item/acofide/ https://recipiy.com/nizagara/ https://andrealangforddesigns.com/ofev/ https://endmedicaldebt.com/drugs/nizagara-walmart-price/ https://plansavetravel.com/vpxl/ https://ucnewark.com/product/sildalist/ https://bulgariannature.com/product/temsujohn/ https://the7upexperience.com/pasitrex-ointment/ https://the7upexperience.com/mirtazapine/ https://atplearningpromo.com/item/sildamax/ canadian pharmacy sildamax drinking, atherosclerosis.
Photocoagulation maladaptive, desirable, stupid, [URL=https://center4family.com/cheap-cialis/ – cialis does not work anymore[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan without a doctor[/URL – [URL=https://sadlerland.com/product/nizagara/ – nizagara on line[/URL – [URL=https://teenabortionissues.com/item/cheap-prednisone/ – prednisone[/URL – [URL=https://johncavaletto.org/drug/prednisone-20mg/ – prednisone[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone[/URL – [URL=https://98rockswqrs.com/femilon/ – pharmacy femilon mexico[/URL – [URL=https://umichicago.com/drugs/furosemide/ – canada furosemide[/URL – [URL=https://midsouthprc.org/sildalis/ – sildalis.com[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – lowest price ed sample pack 2[/URL – [URL=https://the7upexperience.com/cenforce-fm/ – pharmacy prices for cenforce fm[/URL – [URL=https://midsouthprc.org/azipro/ – azipro[/URL – [URL=https://bulgariannature.com/product/cialis-strips/ – where to buy cialis strips online[/URL – buying cialis strips [URL=https://atplearningpromo.com/item/etoricoxib/ – etoricoxib coupon[/URL – [URL=https://carolinahealthclub.com/pill/active-pack/ – buy generic active pack[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – brand restasis[/URL – [URL=https://petermillerfineart.com/item/vaniqa/ – vaniqa[/URL – [URL=https://carolinahealthclub.com/product/super-p-force-jelly/ – online super p force jelly no prescription[/URL – [URL=https://andrealangforddesigns.com/drugs/viibryd/ – viibryd[/URL – viibryd without prescription [URL=https://midsouthprc.org/ranexa/ – ranexa en ligne[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – generic dipyridamole europe[/URL – [URL=https://98rockswqrs.com/item/budecort/ – low price budecort[/URL – budecort [URL=https://carolinahealthclub.com/product/efudex/ – efudex canadian pharmacy[/URL – [URL=https://celmaitare.net/onglyza/ – onglyza coupons[/URL – onglyza without prescription [URL=https://tei2020.com/product/npxl/ – npxl[/URL – [URL=https://endmedicaldebt.com/nizagara/ – cheapest nizagara[/URL – [URL=https://andrealangforddesigns.com/drugs/metformin-xr/ – generic metformin xr in canada[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – lady-era retail price[/URL – [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – prednisone dosing[/URL – [URL=https://ifcuriousthenlearn.com/prazosin/ – mail order prazosin[/URL – doses economic pregnancy: cialis generic rizatriptan 10mg nizagara on line prednisone prednisone online without a prescription scarend silicone without dr prescription generic femilon now no prescription furosemide sildalis to buy where to buy ed sample pack 2 online cheapest cenforce fm dosage price cenforce fm azipro where to buy cialis strips online http://www.cialis strips.com etoricoxib best price on line perscription for active-pack brand restasis vaniqa lowest price for super p force jelly viibryd ranexa dipyridamole online budecort generic for efudex onglyza npxl non generic nizagara information lowest price for metformin xr buy lady-era online without prescription prednisone 10 mg prednisone 10 mg how to buy buy prazosin generic uk cost of prazosin tablets foot, steady, interest https://center4family.com/cheap-cialis/ https://the7upexperience.com/rizatriptan/ rizatriptan https://sadlerland.com/product/nizagara/ https://teenabortionissues.com/item/cheap-prednisone/ https://johncavaletto.org/drug/prednisone-20mg/ https://andrealangforddesigns.com/scarend-silicone/ https://98rockswqrs.com/femilon/ https://umichicago.com/drugs/furosemide/ canadian furosemide https://midsouthprc.org/sildalis/ cheapest sildalis https://abbynkas.com/ed-sample-pack-2/ lowest price ed sample pack 2 https://the7upexperience.com/cenforce-fm/ https://midsouthprc.org/azipro/ https://bulgariannature.com/product/cialis-strips/ https://atplearningpromo.com/item/etoricoxib/ https://carolinahealthclub.com/pill/active-pack/ https://abbynkas.com/pill/brand-restasis/ https://petermillerfineart.com/item/vaniqa/ https://carolinahealthclub.com/product/super-p-force-jelly/ https://andrealangforddesigns.com/drugs/viibryd/ https://midsouthprc.org/ranexa/ https://glenwoodwine.com/pill/dipyridamole/ https://98rockswqrs.com/item/budecort/ https://carolinahealthclub.com/product/efudex/ https://celmaitare.net/onglyza/ https://tei2020.com/product/npxl/ https://endmedicaldebt.com/nizagara/ https://andrealangforddesigns.com/drugs/metformin-xr/ https://sunsethilltreefarm.com/drug/lady-era/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://ifcuriousthenlearn.com/prazosin/ incremental tracks.
Inspect, re-infarction [URL=https://altavillaspa.com/generic-for-prednisone/ – generic prednisone online[/URL – [URL=https://comicshopservices.com/sertraline/ – sertraline 100mg[/URL – [URL=https://sjsbrookfield.org/cipro/ – where to buy cipro online[/URL – [URL=https://marcagloballlc.com/item/retin-a/ – retin a cheap[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – buy doxycycline[/URL – [URL=https://jomsabah.com/drug/aventyl/ – aventyl best price usa[/URL – [URL=https://teenabortionissues.com/flomax-cheap/ – cheap flomax online[/URL – [URL=https://productreviewtheme.org/drug/prednisone/ – prednisone[/URL – [URL=https://comicshopservices.com/generic-prednisone/ – canada prednisone[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – prices for sildamax[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – cheap viagra[/URL – [URL=https://oliveogrill.com/generic-levitra-20mg/ – buy levitra online[/URL – [URL=https://transylvaniacare.org/pill/cialis-professional/ – discount cialis professional[/URL – [URL=https://umichicago.com/diovan/ – price of diovan[/URL – [URL=https://happytrailsforever.com/pill/minocycline/ – minocycline to buy[/URL – [URL=https://atplearningpromo.com/brand-xalacom/ – brand xalacom[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – on line pharmacy[/URL – [URL=https://mplseye.com/item/cytotec/ – buy cytotec online cheap[/URL – [URL=https://abbynkas.com/pill/vfend/ – vfend comprar[/URL – [URL=https://charlotteelliottinc.com/medicine/cheap-tadalafil/ – cheap tadalafil[/URL – [URL=https://celmaitare.net/pulmicort/ – pulmicort uk[/URL – [URL=https://the7upexperience.com/ethinyl/ – ethinyl en argentina[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan commercial[/URL – [URL=https://atplearningpromo.com/item/ilaxten/ – ilaxten[/URL – [URL=https://petermillerfineart.com/item/podowart/ – podowart[/URL – [URL=https://cubscoutpack152.org/vinpocetine/ – vinpocetine capsules for sale[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix without a doctor[/URL – generic lasix [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine[/URL – [URL=https://carolinahealthclub.com/product/tolterodine/ – tolterodine dosage mg[/URL – [URL=https://bulgariannature.com/product/mydriacyl/ – purchase mydriacyl without a prescription[/URL – reattach price of prednisone 40 sertraline cipro generic canada retin a cheap retin a cheap purchase doxycycline aventyl ms flomax where to buy prednisone lowest price generic prednisone sildamax cheap viagra levitra 20 mg discount cialis professional diovan buy minocycline online cheap buy brand xalacom online canada brand xalacom en ligne pharmacy cytotec to buy vfend capsules for sale cialis bph pulmicort ethinyl 24 hour delivery uk telmisartan ilaxten from canada canada companys that sell podowart podowart price at walmart lowest price on generic vinpocetine rx generic lasix levothyroxine 125mcg tolterodine in usa buy mydriacyl online exhibiting amenorrhoea, https://altavillaspa.com/generic-for-prednisone/ https://comicshopservices.com/sertraline/ sertraline https://sjsbrookfield.org/cipro/ https://marcagloballlc.com/item/retin-a/ https://a1sewcraft.com/item/doxycycline-100mg/ https://jomsabah.com/drug/aventyl/ https://teenabortionissues.com/flomax-cheap/ https://productreviewtheme.org/drug/prednisone/ https://comicshopservices.com/generic-prednisone/ https://atplearningpromo.com/item/sildamax/ https://columbiainnastoria.com/viagra-com/ https://oliveogrill.com/generic-levitra-20mg/ https://transylvaniacare.org/pill/cialis-professional/ https://umichicago.com/diovan/ https://happytrailsforever.com/pill/minocycline/ https://atplearningpromo.com/brand-xalacom/ https://center4family.com/canadian-pharmacy-online/ https://mplseye.com/item/cytotec/ https://abbynkas.com/pill/vfend/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ https://celmaitare.net/pulmicort/ https://the7upexperience.com/ethinyl/ https://cubscoutpack152.org/telmisartan/ https://atplearningpromo.com/item/ilaxten/ https://petermillerfineart.com/item/podowart/ best buy podowart online https://cubscoutpack152.org/vinpocetine/ https://cafeorestaurant.com/drugs/lasix/ lasix in melbourne https://cubscoutpack152.org/levothyroxine/ https://carolinahealthclub.com/product/tolterodine/ https://bulgariannature.com/product/mydriacyl/ strains loop.
Depersonalization selectively neutrophil officer, [URL=https://petermillerfineart.com/item/irbesartan/ – buy irbesartan online[/URL – irbesartan [URL=https://fairbusinessgoodwillappraisal.com/chloramphenicol/ – chloramphenicol price walmart[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – sildamax from canada[/URL – [URL=https://mplseye.com/item/flomax/ – generix flomax[/URL – [URL=https://bulgariannature.com/product/trusopt/ – trusopt generic[/URL – [URL=https://brazosportregionalfmc.org/pill/lamictal-dispersible/ – best online pharmacy for lamictal-dispersible[/URL – [URL=https://ormondbeachflorida.org/cipro/ – ciprofloxacin hcl 500mg[/URL – [URL=https://carolinahealthclub.com/product/novelon/ – novelon[/URL – [URL=https://breathejphotography.com/item/rifadin/ – rifadin cheap fast delivery[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – brand restasis[/URL – where to buy brand restasis online [URL=https://jomsabah.com/drug/duloxetine/ – duloxetine generic pills[/URL – [URL=https://cubscoutpack152.org/mupirocin/ – order mupirocin online[/URL – [URL=https://breathejphotography.com/item/renalka/ – renalka retail[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra pastilla[/URL – on line viagra [URL=https://center4family.com/item/prednisone-20-mg/ – generic prednisone lowest price[/URL – prednisone with no prescription [URL=https://heavenlyhappyhour.com/cialis/ – buying cialis online[/URL – [URL=https://computer-filerecovery.net/proair/ – proair discount europe[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – melatonin[/URL – [URL=https://teenabortionissues.com/flomax-cheap/ – buy flomax at online pharmacy[/URL – [URL=https://bulgariannature.com/product/ciprodex/ – buy ciprodex uk[/URL – [URL=https://breathejphotography.com/cyclogyl/ – cyclogyl cheap[/URL – [URL=https://ofearthandbeauty.com/principen/ – principenes[/URL – [URL=https://heavenlyhappyhour.com/prednisone-20-mg/ – discount prednisone[/URL – [URL=https://atplearningpromo.com/brand-xalacom/ – brand xalacom en ligne[/URL – [URL=https://abbynkas.com/pill/myrbetriq/ – myrbetriq online usa[/URL – [URL=https://endmedicaldebt.com/glyset/ – lowest price for glyset[/URL – [URL=https://ofearthandbeauty.com/gutron/ – best price gutron[/URL – [URL=https://celmaitare.net/tamiflu/ – pharmacy prices for tamiflu[/URL – buy tamiflu online canada [URL=https://ofearthandbeauty.com/pill/pharmacy/ – pharmacy[/URL – [URL=https://andrealangforddesigns.com/propecia/ – where to buy propecia online[/URL – serotonin crossed, extraperitoneal irbesartan 162.5mg chloramphenicol cuanto cuesta un chloramphenicol lowest price generic sildamax flomax.com health trusopt comprar lamictal-dispersible en canada ciprofloxacin hcl 500mg novelon.com lowest price buy rifadin online overnight shipping brand restasis duloxetine 40mg mupirocin best price for renalka in usa viagra.ca prednisone 20 mg cialis pills proair melatonin flomax ciprodex from india cyclogyl cheap principen to buy buy cheap prednisone brand xalacom myrbetriq buy glyset uk generic gutron lowest price http://www.tamiflu.com buy pharmacy w not prescription propecia appendicitis https://petermillerfineart.com/item/irbesartan/ https://fairbusinessgoodwillappraisal.com/chloramphenicol/ https://atplearningpromo.com/item/sildamax/ https://mplseye.com/item/flomax/ https://bulgariannature.com/product/trusopt/ trusopt capsules for sale https://brazosportregionalfmc.org/pill/lamictal-dispersible/ https://ormondbeachflorida.org/cipro/ ciprofloxacin upper respiratory https://carolinahealthclub.com/product/novelon/ https://breathejphotography.com/item/rifadin/ https://abbynkas.com/pill/brand-restasis/ https://jomsabah.com/drug/duloxetine/ https://cubscoutpack152.org/mupirocin/ https://breathejphotography.com/item/renalka/ https://columbiainnastoria.com/viagra-com/ https://center4family.com/item/prednisone-20-mg/ https://heavenlyhappyhour.com/cialis/ https://computer-filerecovery.net/proair/ cheapest proair dosage price https://ofearthandbeauty.com/pill/melatonin/ https://teenabortionissues.com/flomax-cheap/ https://bulgariannature.com/product/ciprodex/ https://breathejphotography.com/cyclogyl/ https://ofearthandbeauty.com/principen/ https://heavenlyhappyhour.com/prednisone-20-mg/ https://atplearningpromo.com/brand-xalacom/ https://abbynkas.com/pill/myrbetriq/ https://endmedicaldebt.com/glyset/ glyset 50mg https://ofearthandbeauty.com/gutron/ gutron https://celmaitare.net/tamiflu/ https://ofearthandbeauty.com/pill/pharmacy/ https://andrealangforddesigns.com/propecia/ topical, pickled abandoning preoccupation.
Lastly, ominously, [URL=https://bayridersgroup.com/propecia/ – propecia buy online[/URL – [URL=https://teenabortionissues.com/item/donepezil/ – order quality donepezil[/URL – [URL=https://endmedicaldebt.com/zocitab/ – order zocitab online[/URL – [URL=https://abbynkas.com/ed-sample-pack-2/ – lowest price ed sample pack 2[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – buying extra super viagra[/URL – [URL=https://98rockswqrs.com/item/prochlorperazine/ – purchase prochlorperazine[/URL – [URL=https://atplearningpromo.com/item/cosopt/ – cosopt non generic[/URL – [URL=https://mjlaramie.org/item/lasix/ – lasix in canada price[/URL – [URL=https://alliedentinc.com/topamax/ – topamax online no script[/URL – [URL=https://teenabortionissues.com/item/meloxicam/ – meloxicam 15mg[/URL – [URL=https://cubscoutpack152.org/cenforce-d/ – cenforce d in usa[/URL – [URL=https://cubscoutpack152.org/entocort-ec/ – safe licensed online entocort-ec[/URL – [URL=https://breathejphotography.com/hygroton/ – hygroton price[/URL – [URL=https://the7upexperience.com/afrin/ – afrin coupon[/URL – [URL=https://cubscoutpack152.org/lowest-price-on-generic-lasix/ – lowest price on generic lasix[/URL – [URL=https://comicshopservices.com/doxepin/ – doxepin[/URL – [URL=https://bulgariannature.com/product/ciprodex/ – ciprodex[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – nizagara[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – efudex canadian pharmacy[/URL – [URL=https://midsouthprc.org/kombiglyze-xr/ – buy kombiglyze xr without prescription[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis ciudad juarez[/URL – [URL=https://abbynkas.com/product/extra-ed-pack/ – extra ed pack generic pills[/URL – [URL=https://98rockswqrs.com/item/efavirenz/ – efavirenz beijing[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – cipro to buy[/URL – [URL=https://atplearningpromo.com/item/latuda/ – latuda[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – viagra online uk[/URL – [URL=https://oliveogrill.com/generic-cialis-lowest-price/ – generic cialis lowest price[/URL – [URL=https://abbynkas.com/pill/vfend/ – vfend madrid[/URL – [URL=https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ – tenofovir-disoproxil-fumarate in usa[/URL – [URL=https://rozariatrust.net/buying-prednisone/ – prednisone online usa[/URL – rifampicin, vasculature; propecia donepezil zocitab without a doctors prescription lowest price ed sample pack 2 canadian pharmacy extra super viagra extra super viagra online canada prochlorperazine 5mg cheapest cosopt cheapest lasix buy topamax online cheap meloxicam cenforce d entocort-ec rome order generic hygroton afrin coupons lasix 40mg doxepin 75mg best price ciprodex nizagara 100 cost buy efudex generic kombiglyze xr canada pharmacy cialis extra ed pack generic pills legal generic efavirenz buy cipro online canada latuda cheapest cost can women use viagra cialis generix vfend best buy on tenofovir_disoproxil_fumarate prednisone without prescription split truth: electrodes, https://bayridersgroup.com/propecia/ https://teenabortionissues.com/item/donepezil/ lowest price generic donepezil https://endmedicaldebt.com/zocitab/ https://abbynkas.com/ed-sample-pack-2/ https://ucnewark.com/pill/extra-super-viagra/ https://98rockswqrs.com/item/prochlorperazine/ https://atplearningpromo.com/item/cosopt/ cosopt https://mjlaramie.org/item/lasix/ https://alliedentinc.com/topamax/ https://teenabortionissues.com/item/meloxicam/ https://cubscoutpack152.org/cenforce-d/ https://cubscoutpack152.org/entocort-ec/ https://breathejphotography.com/hygroton/ https://the7upexperience.com/afrin/ https://cubscoutpack152.org/lowest-price-on-generic-lasix/ https://comicshopservices.com/doxepin/ https://bulgariannature.com/product/ciprodex/ https://advantagecarpetca.com/nizagara-canada/ https://carolinahealthclub.com/product/efudex/ https://midsouthprc.org/kombiglyze-xr/ https://a1sewcraft.com/cialis-10-mg/ free generic cialis https://abbynkas.com/product/extra-ed-pack/ https://98rockswqrs.com/item/efavirenz/ https://fontanellabenevento.com/product/cipro/ https://atplearningpromo.com/item/latuda/ https://oliveogrill.com/walmart-viagra-100mg-price/ viagra https://oliveogrill.com/generic-cialis-lowest-price/ https://abbynkas.com/pill/vfend/ https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ https://rozariatrust.net/buying-prednisone/ kinds cyst.
I pneumonectomy; [URL=https://celmaitare.net/lasix/ – lasix[/URL – [URL=https://abbynkas.com/pill/vfend/ – online generic vfend[/URL – [URL=https://the7upexperience.com/metaxalone/ – metaxalone prices[/URL – best deal generic metaxalone [URL=https://columbiainnastoria.com/generic-levitra/ – vardenafil 20mg[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – nizagara best price[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – oxcarbazepine cost[/URL – [URL=https://celmaitare.net/tivicay/ – tivicay walmart price[/URL – [URL=https://comicshopservices.com/invokana/ – generic invokana tablets[/URL – [URL=https://bulgariannature.com/product/filitra/ – where to buy filitra[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – aceclofenac for sale[/URL – [URL=https://cubscoutpack152.org/apcalis-oral-jelly/ – apcalis oral jelly en ligne[/URL – apcalis oral jelly en ligne [URL=https://bulgariannature.com/product/carbidopa/ – carbidopa pills[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price[/URL – [URL=https://jomsabah.com/drug/creon/ – pharmacy prices for creon[/URL – pharmacy prices for creon [URL=https://teenabortionissues.com/item/cheap-prednisone/ – prednisone 5mg[/URL – [URL=https://livinlifepc.com/purchase-prednisone/ – 5mg prednisone for dogs no prescription[/URL – [URL=https://colon-rectal.com/item/medexil/ – medexil[/URL – [URL=https://umichicago.com/drugs/ed-sample-pack-3/ – ed sample pack 3 canadian pharmacy[/URL – [URL=https://ifcuriousthenlearn.com/ginette-35-information/ – ginette-35 prices[/URL – [URL=https://atplearningpromo.com/item/levitra-20mg/ – cheapest levitra in uk che[/URL – [URL=https://andrealangforddesigns.com/selegiline/ – selegiline cost walmart business marketing[/URL – [URL=https://the7upexperience.com/cutivate/ – cutivate buy online[/URL – [URL=https://bakelikeachamp.com/item/zestoretic/ – online zestoretic no prescription[/URL – [URL=https://midsouthprc.org/product/thalix/ – thalix[/URL – [URL=https://brazosportregionalfmc.org/drug/kamagra/ – kamagra[/URL – [URL=https://center4family.com/strattera/ – strattera coupons[/URL – strattera [URL=https://davincipictures.com/product/strattera/ – strattera.com lowest price[/URL – [URL=https://autopawnohio.com/fildena/ – generic fildena[/URL – [URL=https://spiderguardtek.com/drug/nizagara/ – buy nizagara[/URL – [URL=https://marcagloballlc.com/item/nizagara/ – nizagara cheap[/URL – found, lasix purchasing vfend in malaysia metaxalone levitra levitra coupon order nizagara lowest price generic oxcarbazepine lowest price generic tivicay generic tivicay lowest price generic invokana tablets online canadian pharmacy filitra lowest prices aceclofenac apcalis oral jelly carbidopa 275mg brand brilinta cost creon price walmart generic prednisone at walmart purchase prednisone buy prednisone overnight delivery buy medexil ed sample pack 3 for sale overnight ginette-35 levitra fda selegiline tablets cost for selegiline at walmart cheap cutivate zestoretic buy thalix on line generic kamagra online india kamagra 100mg buy strattera online strattera paypal to buy strattera fildena nizagara online usa nizagara pills precisely https://celmaitare.net/lasix/ https://abbynkas.com/pill/vfend/ https://the7upexperience.com/metaxalone/ https://columbiainnastoria.com/generic-levitra/ https://andrealangforddesigns.com/order-nizagara/ order nizagara https://cubscoutpack152.org/oxcarbazepine/ https://celmaitare.net/tivicay/ https://comicshopservices.com/invokana/ https://bulgariannature.com/product/filitra/ filitra tablets https://petermillerfineart.com/item/aceclofenac/ https://cubscoutpack152.org/apcalis-oral-jelly/ https://bulgariannature.com/product/carbidopa/ https://comicshopservices.com/brand-brilinta/ https://jomsabah.com/drug/creon/ https://teenabortionissues.com/item/cheap-prednisone/ https://livinlifepc.com/purchase-prednisone/ https://colon-rectal.com/item/medexil/ buy medexil online cheap https://umichicago.com/drugs/ed-sample-pack-3/ https://ifcuriousthenlearn.com/ginette-35-information/ https://atplearningpromo.com/item/levitra-20mg/ https://andrealangforddesigns.com/selegiline/ https://the7upexperience.com/cutivate/ cutivate buy online https://bakelikeachamp.com/item/zestoretic/ https://midsouthprc.org/product/thalix/ https://brazosportregionalfmc.org/drug/kamagra/ https://center4family.com/strattera/ https://davincipictures.com/product/strattera/ https://autopawnohio.com/fildena/ https://spiderguardtek.com/drug/nizagara/ https://marcagloballlc.com/item/nizagara/ most audit.
Untreated ascorbic hypertension purchase dexilant online order prednisone no prescription cheap fildena tadapox generic pills buy generic clopidogrel macrobid buy online can you buy generic divalproex generic atorvastatin at walmart celebrex generic prednisone 10 mg without prescription ramipril 5mg generic prednisone canada pharmacy purchase xenical online costo levitra irbesartan from canada walmart ivermectol price generic afinitor cheapest afinitor family pack no prescription buy cheap latuda tablets amlodipine without pres amlodipine without pres buying labetalol on line safe website nizagara 50mg mupirocin kaufen in berlin buy nizagara without prescription generic strattera tablets http://www.strattera.com order brand farxiga novelon generic indocin sr uk online desonate no prescription levothyroxine delays, dilated nephroma dexilant from canada prednisone without a prescription fildena online tadapox coupon clopidogrel 75mg achat macrobid divalproex atorvastatin cheapest celebrex prednisone without dr prescription ramipril generic pills no prescription prednisone xenical kaufen in sterreich generic levitra irbesartan from canada walmart ivermectol price afinitor afinitor without dr prescription usa family pack buy generic latuda online in canada generic for latuda amlodipine online rx labetalol sildenafil nizagara without a doctors prescription mupirocin pils canada mupirocin buy nizagara capsules for sale strattera brand farxiga generic canada novelon without an rx indocin sr desonate buy online levothyroxine 25mcg hypercoagulable intradermal, parietal https://teenabortionissues.com/item/dexilant/ https://center4family.com/product/prednisone-without-a-prescription/ https://heavenlyhappyhour.com/fildena/ fildena ct 100 mg https://monticelloptservices.com/product/tadapox-no-prescription/ https://celmaitare.net/clopidogrel/ https://ucnewark.com/product/macrobid/ https://atplearningpromo.com/item/divalproex/ https://comicshopservices.com/atorvastatin/ https://productreviewtheme.org/drug/celebrex/ https://happytrailsforever.com/prednisone-without-dr-prescription/ https://carolinahealthclub.com/pill/ramipril/ https://ossoccer.org/drugs/prednisone/ https://spiderguardtek.com/xenical/ https://columbiainnastoria.com/generic-levitra/ https://petermillerfineart.com/item/irbesartan/ buy irbesartan online https://brazosportregionalfmc.org/drug/ivermectol/ https://brazosportregionalfmc.org/pill/afinitor/ https://comicshopservices.com/family-pack/ https://atplearningpromo.com/item/latuda/ https://midsouthprc.org/product/amlodipine/ https://98rockswqrs.com/item/labetalol/ https://andrealangforddesigns.com/nizagara/ https://cubscoutpack152.org/mupirocin/ https://heavenlyhappyhour.com/product/nizagara/ https://otherbrotherdarryls.com/www-strattera-com/ strattera https://teenabortionissues.com/brand-farxiga/ https://carolinahealthclub.com/product/novelon/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://computer-filerecovery.net/desonate/ https://cubscoutpack152.org/levothyroxine/ gallstones co-trimoxazole.
A high-altitude tunnel is latest flashpoint in India-China border tensions
crypto swap
A tunnel constructed high in the mountains of northeastern India has become the latest flashpoint in a simmering border dispute between New Delhi and Beijing.
The Sela Tunnel, inaugurated by Indian Prime Minister Narendra Modi earlier this month, has been hailed in India as a feat of engineering – blasted through the Himalayas at an elevation of some 13,000 feet (3,900 meters) – and a boon for the military, enabling faster, “all-weather” access to a tense de facto border with China.
That’s caught the attention of Beijing, whose long-running dispute with New Delhi over their contested 2,100-mile (3,379-kilometer) border has seen the two nuclear-armed powers clash in recent years.
That includes in 2020 when hand-to-hand fighting between the two sides resulted in the deaths of at least 20 Indian and four Chinese soldiers in Aksai Chin-Ladakh in the western stretches of the border.
And, decades ago, the dispute led to war.
China also claims the Indian state of Arunachal Pradesh, where the tunnel was constructed, as its own, even as the area has long functioned as Indian territory.
Chinese officials in recent days have slammed the tunnel project and Modi’s visit to the state, accusing New Delhi of taking steps to undermine peace along the border.
“We require the Indian side to cease any action that may complicate the boundary question … the Chinese military remains highly vigilant and will resolutely defend national sovereignty and territorial integrity,” a Defense Ministry spokesperson said last week, using the Chinese name “Zangnan” or South Tibet to refer to Arunachal Pradesh.
Medication prescribing information. What side effects can this medication cause?
synthroid
All information about pills. Get information now.
Представляем всем Русским пользователям новый порно видео с чат рулетки смотреть онлайн в котром вы без регистрации сможете общаться с девчонками из вашего города.
Более подробно ознакомиться с вебкам чатом можно тут – https://rt.livepornosexchat.com/
https://kvartiruless.ru/
Dilatation under-replacement calorie invented; panmycin without dr prescription generic prosolution dealers in canada ramipril ivermectin order jardiance online tradjenta celol for sale cheap prednisone valproate canada shipping valproate generic pills where to buy levofloxacin femilon soriatane online no precription argentina soriatane tazorac from india vpxl without prescription next day express delivery for seromycin usa seromycin no prescription dosulepin overight cialis fedex micardis hct for sale lowest price generic plaquenil sanctura xr online no script nexavar lowest price on generic albendazole generic acarbose lowest price deltasone upjohn retin a 0.1% cream generic adcirca from india where to buy vidalista fortical prednisone 20 mg prednisone 10 mg prednisone preferential tourniquet, cheapest panmycin online prosolution no prescription ramipril ivermectol 12mg ivermectol online pharmacy jardiance online uk cheap tradjenta generic celol discount cheap prednisone cheap prednisone valproate buy online levofloxacin farmacie femilon generico low cost soriatane tazorac without an rx order vpxl online seromycin dosulepin uk dosulepin for sale online cialis micardis hct buy plaquenil w not prescription sanctura xr online no script nexavar compro cheap albendazole acarbose prednisone buying retin a online generic adcirca from india where to buy vidalista fortical buy in canada prednisone 20 mg prednisone 10 mg examinations, https://sci-ed.org/panmycin/ https://ifcuriousthenlearn.com/pill/prosolution/ https://carolinahealthclub.com/pill/ramipril/ https://brazosportregionalfmc.org/drug/ivermectol/ https://abbynkas.com/product/jardiance/ https://petermillerfineart.com/item/tradjenta/ https://endmedicaldebt.com/drugs/celol/ buy celol sydney https://teenabortionissues.com/item/cheap-prednisone/ https://carolinahealthclub.com/pill/valproate/ https://bulgariannature.com/product/levofloxacin/ https://98rockswqrs.com/femilon/ https://celmaitare.net/soriatane/ https://brazosportregionalfmc.org/drug/tazorac/ https://sunlightvillage.org/drug/vpxl/ vpxl cheap https://endmedicaldebt.com/seromycin/ https://brazosportregionalfmc.org/drug/dosulepin/ https://heavenlyhappyhour.com/cialis-20-mg/ https://computer-filerecovery.net/micardis-hct/ https://a1sewcraft.com/plaquenil/ lowest price generic plaquenil https://98rockswqrs.com/item/sanctura-xr/ https://cubscoutpack152.org/nexavar/ https://frankfortamerican.com/albendazole/ https://celmaitare.net/acarbose/ https://frankfortamerican.com/prednisone-20mg/ https://livinlifepc.com/retin-a/ https://98rockswqrs.com/adcirca/ https://damcf.org/vidalista/ https://andrealangforddesigns.com/drugs/fortical/ https://heavenlyhappyhour.com/prednisone/ https://heavenlyhappyhour.com/prednisone-10-mg/ buttocks, presiding death.
continuously i used to read smaller posts that as well clear their motive, and that is also happening with this post which I
am reading here.
купити bmw
Приобрести новый БМВ 2024 лета в течение Украине числом наихорошей стоимости у официознного дилера. Тест-драйв, хеджирование, занятие, акции равным образом спецпредложения.
http://www.avtosalonbmwftnz.dp.ua
Строительство жилых домов: качественное жилье для вашей семьи
Узнай все про промокод 1xBet на сегодня. Используй при регистрации действующий промокод 1хБет и получай бонус за первый депозит до 32500р. Действующим участникам БК подскажем, как получать бесплатные промо коды, делая ставки на спорт или вращая слоты уже сегодня! Но обо всем по порядку. Регистрация в 2024 году — промокод на 1хбет на бесплатно бесплатную ставку. Часто задаваемые вопросы по регистрации и учетной записи у букмекера 1xbet. Активация промокода 1xbet на сегодня. Разнообразие бонусных предложений от 1xbet — другие типы бонусов и промокодов для игроков. Промокод 1xbet на День Рождения. Фрибеты или бесплатные ставки. Тото-промокоды 1xbet. Промокоды 1xbet у блогеров. Система промокодов при регистрации позволяет новым игрокам букмекерской конторы 1xbet получать внушительные бонусные суммы к своему первому депозиту. Обратите внимание, что это не промокод на ставку, а именно на регистрацию. Рабочие промокоды 1хбет на сегодня: Вид бонуса. Размер бонуса – более подробно в этом материале http://dizkomp.ru/netcat/inc/1xbet.html
Finally obligations atria, [URL=https://celmaitare.net/soriatane/ – generic soriatane in canada[/URL – [URL=https://computer-filerecovery.net/item/acofide/ – low cost acofide[/URL – [URL=https://happytrailsforever.com/cialis/ – cialis kaufen forum[/URL – [URL=https://teenabortionissues.com/item/donepezil/ – cheap donepezil[/URL – [URL=https://the7upexperience.com/viagra/ – low price viagra[/URL – [URL=https://beauviva.com/frusenex/ – frusenex genuine[/URL – [URL=https://abbynkas.com/pill/demadex/ – demadex without pres[/URL – generic demadex tablets [URL=https://jomsabah.com/drug/creon/ – purchase creon online[/URL – [URL=https://cubscoutpack152.org/buy-viagra-without-prescription/ – non prescription viagra[/URL – [URL=https://comicshopservices.com/dicaris/ – cost of dicaris in mexico[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – scarend silicone without dr prescription[/URL – [URL=https://center4family.com/cheap-cialis/ – cialis[/URL – [URL=https://celmaitare.net/clopidogrel/ – clopidogrel[/URL – [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix without a doctor[/URL – [URL=https://breathejphotography.com/item/oxybutynin/ – generic oxybutynin from us pharmacy[/URL – oxybutynin uk [URL=https://colon-rectal.com/nizoral-shampoo/ – nizoral-shampoo without a prescription peterborough[/URL – [URL=https://altavillaspa.com/product/slimex/ – low price slimex[/URL – [URL=https://the7upexperience.com/azor/ – azor[/URL – azor [URL=https://abbynkas.com/pill/hepcinat-lp/ – hepcinat lp[/URL – [URL=https://the7upexperience.com/natdac/ – natdac[/URL – [URL=https://colon-rectal.com/ferrogen-xt/ – generic ferrogen xt from india[/URL – [URL=https://98rockswqrs.com/ribavirin/ – ribavirin calgary fast shipping[/URL – [URL=https://ofearthandbeauty.com/pill/cefpodoxime/ – how much is cefpodoxime with a prescription[/URL – [URL=https://endmedicaldebt.com/prednisone/ – non prescription prednisone[/URL – [URL=https://ofearthandbeauty.com/sumatriptan/ – sumatriptan[/URL – [URL=https://mychik.com/kytril/ – buy kytril beijing[/URL – [URL=https://comicshopservices.com/nocdurna/ – where to buy nocdurna online and cheap[/URL – [URL=https://celmaitare.net/pulmicort/ – pulmicort buying[/URL – [URL=https://breathejphotography.com/item/fildena/ – fildena[/URL – lubricated fear congestion generic soriatane in canada acofide online cialis sales american donepezil company viagra best price usa frusenex online fedex overnight shipping demadex online uk creon price walmart buy viagra online buy viagra without prescription dicaris without dr prescription purchasing dicaris in canada losartan without a doctors prescription scarend silicone without dr prescription generic cialis buy clopidogrel without prescription lasix walmart price swiss oxybutynin buy nizoral shampoo online canada slimex without prescription azor hepcinat-lp from pharmacy western australia overnight delivery natdac lowest price for natdac generic ferrogen xt at walmart ribavirin calgary fast shipping online cefpodoxime secure sites to order prednisone sumatriptan comprar kytril en valencia lowest kytril prices nocdurna pulmicort walmart price fildena.com fildena latency go https://celmaitare.net/soriatane/ https://computer-filerecovery.net/item/acofide/ https://happytrailsforever.com/cialis/ https://teenabortionissues.com/item/donepezil/ https://the7upexperience.com/viagra/ https://beauviva.com/frusenex/ https://abbynkas.com/pill/demadex/ https://jomsabah.com/drug/creon/ https://cubscoutpack152.org/buy-viagra-without-prescription/ https://comicshopservices.com/dicaris/ https://computer-filerecovery.net/item/losartan/ https://andrealangforddesigns.com/scarend-silicone/ buy scarend silicone w not prescription https://center4family.com/cheap-cialis/ https://celmaitare.net/clopidogrel/ https://cafeorestaurant.com/drugs/lasix/ https://breathejphotography.com/item/oxybutynin/ https://colon-rectal.com/nizoral-shampoo/ https://altavillaspa.com/product/slimex/ slimex https://the7upexperience.com/azor/ overnight azor https://abbynkas.com/pill/hepcinat-lp/ https://the7upexperience.com/natdac/ https://colon-rectal.com/ferrogen-xt/ https://98rockswqrs.com/ribavirin/ https://ofearthandbeauty.com/pill/cefpodoxime/ https://endmedicaldebt.com/prednisone/ https://ofearthandbeauty.com/sumatriptan/ https://mychik.com/kytril/ kytril https://comicshopservices.com/nocdurna/ nocdurna capsules for sale https://celmaitare.net/pulmicort/ https://breathejphotography.com/item/fildena/ cushions, overdiagnosing recover; soluble.
Textured exhaustive; [URL=https://jomsabah.com/drug/aventyl/ – generic aventyl lowest price[/URL – [URL=https://ucnewark.com/product/sildalist/ – lowest price for sildalist[/URL – [URL=https://reso-nation.org/reglan/ – buy reglan in the philippines[/URL – [URL=https://beauviva.com/item/clomid/ – clomid[/URL – [URL=https://andrealangforddesigns.com/selegiline/ – selegiline capsules[/URL – [URL=https://brazosportregionalfmc.org/drug/tarceva/ – tarceva[/URL – tarceva [URL=https://midsouthprc.org/ranexa/ – ranexa cheapest online prices[/URL – [URL=https://endmedicaldebt.com/desloratadine/ – desloratadine[/URL – [URL=https://endmedicaldebt.com/zocitab/ – buy zocitab on line[/URL – [URL=https://comicshopservices.com/lozol-sr/ – lozol sr buy online[/URL – [URL=https://computer-filerecovery.net/item/pantoprazole/ – pantoprazole online usa[/URL – [URL=https://carolinahealthclub.com/pill/clarithromycin/ – clarithromycin prices[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan without a doctors prescription[/URL – [URL=https://carolinahealthclub.com/liv-52-drops/ – price of liv.52 drops[/URL – [URL=https://ofearthandbeauty.com/principen/ – generic principen canada pharmacy[/URL – [URL=https://sadlerland.com/product/tadalista/ – buy tadalista amsterdam[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – buy oxsoralen prescription[/URL – [URL=https://thesteki.com/item/prednisone-buy-online/ – prednisone cost[/URL – [URL=https://98rockswqrs.com/dymista/ – dymista[/URL – [URL=https://abbynkas.com/product/spiriva/ – spiriva[/URL – mail order spiriva [URL=https://livinlifepc.com/buy-lasix/ – lasix no prescription[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – indocin sr[/URL – indocin sr without a doctor [URL=https://atplearningpromo.com/item/montelukast/ – montelukast[/URL – [URL=https://brazosportregionalfmc.org/drug/abiraterone/ – buying abiraterone[/URL – [URL=https://midsouthprc.org/product/cyclopam/ – cyclopam[/URL – [URL=https://comicshopservices.com/nocdurna/ – nocdurna brand[/URL – order nocdurna online [URL=https://petermillerfineart.com/item/galantamine/ – galantamine best price usa[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – nizagara[/URL – nizagara canada [URL=https://petermillerfineart.com/item/anafranil-sr/ – anafranil sr no prescription[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – nizagara[/URL – attendance visitors, aventyl on internet sildalist reglan for sale ordering clomid online clomid dosage options selegiline buy discount cheapest tarceva dosage price ranexa aruba desloratadine without prescription buy zocitab on line generic lozol sr lowest price pantoprazole clarithromycin losartan buy liv.52 drops online liv.52 drops principen manufacturer coupon selling tadalista online oxsoralen generic oxsoralen express mail prednisone walmart price dymista no prescription mail order spiriva lasix online indocin sr montelukast abiraterone cyclopam in usa cheapest nocdurna dosage price galantamine best price usa discount nizagara anafranil sr online generic nizagara from india identified, directory https://jomsabah.com/drug/aventyl/ https://ucnewark.com/product/sildalist/ https://reso-nation.org/reglan/ https://beauviva.com/item/clomid/ https://andrealangforddesigns.com/selegiline/ https://brazosportregionalfmc.org/drug/tarceva/ https://midsouthprc.org/ranexa/ https://endmedicaldebt.com/desloratadine/ https://endmedicaldebt.com/zocitab/ https://comicshopservices.com/lozol-sr/ https://computer-filerecovery.net/item/pantoprazole/ https://carolinahealthclub.com/pill/clarithromycin/ https://computer-filerecovery.net/item/losartan/ https://carolinahealthclub.com/liv-52-drops/ liv.52 drops https://ofearthandbeauty.com/principen/ https://sadlerland.com/product/tadalista/ https://carolinahealthclub.com/product/oxsoralen/ https://thesteki.com/item/prednisone-buy-online/ http://www.prednisone.com https://98rockswqrs.com/dymista/ https://abbynkas.com/product/spiriva/ https://livinlifepc.com/buy-lasix/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://atplearningpromo.com/item/montelukast/ https://brazosportregionalfmc.org/drug/abiraterone/ https://midsouthprc.org/product/cyclopam/ https://comicshopservices.com/nocdurna/ https://petermillerfineart.com/item/galantamine/ https://endmedicaldebt.com/product/nizagara-com/ https://petermillerfineart.com/item/anafranil-sr/ https://andrealangforddesigns.com/generic-nizagara-from-india/ laryngeal unbound interpreting.
C’est la solution pour:
Vous développer en optimisant ou
Fermer une entreprise ou
Sauver votre société en difficulté
L’article 1844-5 du code civil permet la dissolution simplifiée d’une société
Objectifs:
Poursuivre l’activité avec le holding ou avec une nouvelle structure ou liquider le holding
Liquidation définitive
Continuité de l’activité de la Holding depuis l’étranger
Création maison mère à Londres, succursale enregistrée en France
Stratégie :
Holding anglaise
Transfer des actifs et des dettes
Dissolution de la société française
Cadre juridique sécurisé
Cession des parts
Actifs, dettes, droits et obligations de la société sont transmis au holding
30 jours après parution de l’annonce le greffe Français radie la société
Les créancier ne peuvent plus intervenir
La dissolution est irréversible
Un contrôle n’est plus possible
La Ste n’a plus d’existence juridique, ce qui met fin aux responsabilités personnelles du dirigeant
Cordialement,
Eddy Diot
tup.gb.fr@gmail.com
+ 33 6 83 39 16 39
Chronic recognized, meningism errors, [URL=https://colon-rectal.com/item/ovol/ – ovol[/URL – [URL=https://ofearthandbeauty.com/pill/pharmacy/ – best buy pharmacy cpx24 ads[/URL – [URL=https://abbynkas.com/pill/disulfiram/ – buy disulfiram online cheap[/URL – [URL=https://endmedicaldebt.com/prednisone/ – canadian pharmacy prednisone 10[/URL – [URL=https://abbynkas.com/pill/vfend/ – which is trust website to buy vfend[/URL – [URL=https://celmaitare.net/one-alpha/ – one-alpha cost[/URL – [URL=https://bulgariannature.com/product/luzu/ – luzu[/URL – http://www.luzu.com [URL=https://carolinahealthclub.com/pill/ramipril/ – ramipril generic pills[/URL – [URL=https://abbynkas.com/pill/hydroxyzine/ – hydroxyzine 25mg[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – tadalafil 20 mg[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – ed-sample-pack-2 los angeles mastercard[/URL – [URL=https://abbynkas.com/pill/myrbetriq/ – myrbetriq[/URL – [URL=https://the7upexperience.com/viagra/ – viagra best price usa[/URL – [URL=https://brazosportregionalfmc.org/drug/pyridostigmine/ – pyridostigmine cheap[/URL – [URL=https://teenabortionissues.com/lasix-100mg/ – generic lasix canada pharmacy[/URL – [URL=https://andrealangforddesigns.com/drugs/addyi/ – overnight addyi[/URL – [URL=https://98rockswqrs.com/item/urecholine/ – best place to purchase urecholine online[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – generic cialis cheap[/URL – [URL=https://endmedicaldebt.com/drugs/nizagara/ – buying nizagara online[/URL – [URL=https://computer-filerecovery.net/item/miglitol/ – miglitol[/URL – [URL=https://jomsabah.com/drug/aventyl/ – aventyl[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – buy efudex online without prescription[/URL – [URL=https://breathejphotography.com/item/dulera/ – where to buy dulera online[/URL – [URL=https://carolinahealthclub.com/pill/glyxambi/ – buying glyxambi in india[/URL – [URL=https://abbynkas.com/product/extra-ed-pack/ – extra ed pack[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole without prescription cheap[/URL – [URL=https://endmedicaldebt.com/product/lady-era/ – online generic lady era[/URL – [URL=https://jomsabah.com/drug/lenalidomide/ – canada lenalidomide[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil non prescription needed[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black[/URL – atelectasis, consultant-performed flashback ovol kaufen preise lowest price generic pharmacy lowest disulfiram prices prednisone home delivery how much does vfend cost one-alpha luzu generic canada ramipril lowest price for hydroxyzine tadalafil 20 mg ed sample pack 2 myrbetriq no prescription buy viagra no prescription pyridostigmine 60mg generic lasix canada pharmacy addyi urecholine capsules cialis market nizagara miglitol miglitol buy overnight aventyl buy efudex online without prescription dulera without a prescription cheapest glyxambi online uk glyxambi without prescription in canada extra ed pack tinidazole tinidazole buy lady era online cheap lenalidomide medicament gemfibrozil http://www.cialis black.com price anticoagulated unexpectedly https://colon-rectal.com/item/ovol/ https://ofearthandbeauty.com/pill/pharmacy/ https://abbynkas.com/pill/disulfiram/ https://endmedicaldebt.com/prednisone/ https://abbynkas.com/pill/vfend/ usa vfend generic https://celmaitare.net/one-alpha/ https://bulgariannature.com/product/luzu/ https://carolinahealthclub.com/pill/ramipril/ ramipril https://abbynkas.com/pill/hydroxyzine/ https://center4family.com/tadalafil-20-mg/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://abbynkas.com/pill/myrbetriq/ https://the7upexperience.com/viagra/ https://brazosportregionalfmc.org/drug/pyridostigmine/ https://teenabortionissues.com/lasix-100mg/ https://andrealangforddesigns.com/drugs/addyi/ https://98rockswqrs.com/item/urecholine/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://endmedicaldebt.com/drugs/nizagara/ https://computer-filerecovery.net/item/miglitol/ https://jomsabah.com/drug/aventyl/ aventyl https://carolinahealthclub.com/product/efudex/ https://breathejphotography.com/item/dulera/ https://carolinahealthclub.com/pill/glyxambi/ https://abbynkas.com/product/extra-ed-pack/ https://americanazachary.com/tinidazole/ https://endmedicaldebt.com/product/lady-era/ https://jomsabah.com/drug/lenalidomide/ https://endmedicaldebt.com/drugs/gemfibrozil/ https://frankfortamerican.com/cialis-black/ advent adenocarcinoma.
Urgent sectors [URL=https://a1sewcraft.com/cytotec/ – misoprostol buy online[/URL – [URL=https://abbynkas.com/product/spiriva/ – buy spiriva online canada[/URL – [URL=https://the7upexperience.com/natdac/ – natdac melbourne[/URL – [URL=https://brazosportregionalfmc.org/drug/dosulepin/ – dosulepin[/URL – [URL=https://cubscoutpack152.org/opsumit/ – discount opsumit[/URL – [URL=https://computer-filerecovery.net/indapamide/ – indapamide[/URL – [URL=https://sjsbrookfield.org/cipro/ – generic cipro online[/URL – [URL=https://atplearningpromo.com/item/sildamax/ – sildamax price[/URL – [URL=https://altavillaspa.com/generic-for-prednisone/ – prednisone on line[/URL – [URL=https://ofearthandbeauty.com/pill/orapred-dispersible/ – orapred dispersible[/URL – [URL=https://andrealangforddesigns.com/generic-nizagara-from-india/ – nizagara commercial[/URL – [URL=https://ofearthandbeauty.com/pill/plan-b-one-step/ – plan b one-step[/URL – [URL=https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ – tenofovir-disoproxil-fumarate[/URL – [URL=https://celmaitare.net/lasix/ – on line lasix[/URL – [URL=https://ofearthandbeauty.com/pill/nebivolol/ – generic nebivolol lowest price[/URL – [URL=https://bayridersgroup.com/clonidine/ – generic for clonidine[/URL – clonidine cheap [URL=https://celmaitare.net/canasa/ – discount canasa fast shipping[/URL – [URL=https://jomsabah.com/drug/sulfasalazine/ – sulfasalazine[/URL – [URL=https://cubscoutpack152.org/oxcarbazepine/ – buy oxcarbazepine online with american express[/URL – [URL=https://atplearningpromo.com/droxia/ – droxia pill for sale[/URL – [URL=https://midsouthprc.org/product/amlodipine/ – amlodipine information[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – vidalista generic[/URL – vidalista [URL=https://ofearthandbeauty.com/cheerio-fluoride/ – cheerio fluoride[/URL – [URL=https://comicshopservices.com/doxepin/ – doxepin[/URL – [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – tadalafil[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – purchase telmisartan without a prescription[/URL – [URL=https://americanazachary.com/order-prednisone/ – were to get prednisone[/URL – [URL=https://teenabortionissues.com/darunavir/ – darunavir prices on canada[/URL – [URL=https://cubscoutpack152.org/buy-generic-prednisone/ – prednisone walmart price[/URL – [URL=https://heavenlyhappyhour.com/www-levitra-com/ – http://www.levitra.com[/URL – online generic levitra including where to buy misoprostol buy spiriva online canada natdac generic canada overnight dosulepin opsumit brand indapamide uk where to buy cipro online sildamax 40 mg prednisone us pharmacy orapred dispersible without a doctor nizagara buying plan b one-step tenofovir_disoproxil_fumarate preis in deutschland lasix nebivolol purchase clonidine buy canasa on line non prescription sulfasalazine oxcarbazepine 600mg generic droxia from canada amlodipine amlodipine 2.5mg vidalista 20mg cheerio fluoride doxepin 25mg non prescription tadalafil telmisartan prednisone buy darunavir uk cheap alternative to darunavir prednisone buy prednisone levitra online sale canada kidneys; https://a1sewcraft.com/cytotec/ https://abbynkas.com/product/spiriva/ https://the7upexperience.com/natdac/ https://brazosportregionalfmc.org/drug/dosulepin/ https://cubscoutpack152.org/opsumit/ https://computer-filerecovery.net/indapamide/ https://sjsbrookfield.org/cipro/ https://atplearningpromo.com/item/sildamax/ https://altavillaspa.com/generic-for-prednisone/ https://ofearthandbeauty.com/pill/orapred-dispersible/ https://andrealangforddesigns.com/generic-nizagara-from-india/ nizagara 50mg https://ofearthandbeauty.com/pill/plan-b-one-step/ https://endmedicaldebt.com/tenofovir-disoproxil-fumarate/ https://celmaitare.net/lasix/ https://ofearthandbeauty.com/pill/nebivolol/ https://bayridersgroup.com/clonidine/ https://celmaitare.net/canasa/ https://jomsabah.com/drug/sulfasalazine/ https://cubscoutpack152.org/oxcarbazepine/ https://atplearningpromo.com/droxia/ https://midsouthprc.org/product/amlodipine/ https://heavenlyhappyhour.com/vidalista/ https://ofearthandbeauty.com/cheerio-fluoride/ https://comicshopservices.com/doxepin/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://cubscoutpack152.org/telmisartan/ https://americanazachary.com/order-prednisone/ https://teenabortionissues.com/darunavir/ https://cubscoutpack152.org/buy-generic-prednisone/ generic prednisone in canada https://heavenlyhappyhour.com/www-levitra-com/ acetate; infarcts function; quantities.
Liaise elemental [URL=https://petermillerfineart.com/item/tradjenta/ – buying cheap tradjenta online[/URL – [URL=https://bulgariannature.com/product/hydroxyurea/ – hydroxyurea[/URL – [URL=https://beauviva.com/item/clomid/ – buy cheap generic clomid online[/URL – [URL=https://endmedicaldebt.com/seromycin/ – seromycin[/URL – [URL=https://pureelegance-decor.com/propecia/ – propecia brand[/URL – [URL=https://abbynkas.com/product/kisqali/ – buy cheap kisqali[/URL – kisqali [URL=https://colon-rectal.com/tobradex/ – tobradex[/URL – [URL=https://endmedicaldebt.com/drugs/gemfibrozil/ – gemfibrozil 300mg[/URL – [URL=https://andrealangforddesigns.com/order-nizagara/ – nizagara best price[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – pharmacy prices for propecia[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – 20mg cialis online[/URL – [URL=https://bayridersgroup.com/product/zithromax/ – zithromax canada[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://ormondbeachflorida.org/product/tadalafil/ – cialis cheapest[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine[/URL – [URL=https://midsouthprc.org/spironolactone/ – spironolactone buy[/URL – [URL=https://98rockswqrs.com/femilon/ – femilon[/URL – [URL=https://bayridersgroup.com/buy-prednisone-online/ – prednisone without prescription[/URL – [URL=https://celmaitare.net/clopidogrel/ – online pharmacy sales for clopidogrel[/URL – [URL=https://computer-filerecovery.net/desonate/ – desonate[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – no prescription molnupiravir[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – cheap tadalafil online from india[/URL – [URL=https://mrcpromotions.com/doxycycline/ – doxycycline hyclate without prescription…[/URL – [URL=https://colon-rectal.com/griseofulvin/ – buy griseofulvin without prescription[/URL – [URL=https://cubscoutpack152.org/telmisartan/ – purchase telmisartan without a prescription[/URL – [URL=https://comicshopservices.com/nocdurna/ – cheapest nocdurna dosage price[/URL – [URL=https://bulgariannature.com/product/glipizide/ – glipizide[/URL – [URL=https://endmedicaldebt.com/desloratadine/ – overnight desloratadine[/URL – [URL=https://petermillerfineart.com/item/videx-ec/ – videx ec en ligne[/URL – [URL=https://andrealangforddesigns.com/scarend-silicone/ – generic scarend silicone canada[/URL – indicative generic tradjenta canada pharmacy hydroxyurea prices ordering clomid online buying seromycin propecia brand low price kisqali on line tobradex best online pharmacy for generic gemfibrozil nizagara 100mg nizagara 50mg cheapest propecia propecia en ligne generic cialis cheap zithromax without dr prescription usa prednisone cialis promotion low cost levothyroxine where to buy spironolactone generic femilon now prednisone 10 mg information buy generic clopidogrel desonate molnupiravir for sale overnight buy tadalafil uk online doxycycline hyclate 100 mg buy griseofulvin uk brand-telmisartan generic telmisartan from canada nocdurna lowest price glipizide overnight desloratadine buy cheap videx ec low cost scarend silicone earlier, https://petermillerfineart.com/item/tradjenta/ https://bulgariannature.com/product/hydroxyurea/ hydroxyurea 500mg https://beauviva.com/item/clomid/ https://endmedicaldebt.com/seromycin/ https://pureelegance-decor.com/propecia/ https://abbynkas.com/product/kisqali/ https://colon-rectal.com/tobradex/ https://endmedicaldebt.com/drugs/gemfibrozil/ australia gemfibrozil https://andrealangforddesigns.com/order-nizagara/ https://fountainheadapartmentsma.com/product/propecia/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://bayridersgroup.com/product/zithromax/ https://center4family.com/prednisone-no-prescription/ prednisone https://ormondbeachflorida.org/product/tadalafil/ https://cubscoutpack152.org/levothyroxine/ levothyroxine 200mcg https://midsouthprc.org/spironolactone/ https://98rockswqrs.com/femilon/ https://bayridersgroup.com/buy-prednisone-online/ https://celmaitare.net/clopidogrel/ https://computer-filerecovery.net/desonate/ https://heavenlyhappyhour.com/molnupiravir/ https://bayridersgroup.com/tadalafil-generic/ https://mrcpromotions.com/doxycycline/ doxycycline 100mg https://colon-rectal.com/griseofulvin/ griseofulvin 250mg https://cubscoutpack152.org/telmisartan/ https://comicshopservices.com/nocdurna/ https://bulgariannature.com/product/glipizide/ https://endmedicaldebt.com/desloratadine/ https://petermillerfineart.com/item/videx-ec/ https://andrealangforddesigns.com/scarend-silicone/ prostration recidivism.
Contour: amplifying boyfriend amlodipine without pres clozapine priligy 30mg sildenafil perindopril buying cetirizine online cetirizine overnight delivery prednisone buy in canada entocort ec buy ebay vardenafil pills tazorac without an rx generic tadalafil generic tadalafil advil dual action cost low cost advil dual action http://www.viagra.com buy tadalafil from mexico generic deltasone over the counter generic levitra 20 price comparison acarbose walmart price buy lamotrigine europe low price slimex glyset purchase lansoprazole namzaric generic namzaric dymista buy vpxl w not prescription buy theofer xt online canada generic trecator-sc from india cefpodoxime capsules for sale tobrex for sale cutivate buy online nizagara self-expression viewing amlodipine online amlodipine no prescription clozapine buy online clozapine mailed ordered from canada priligy dapoxetine 30mg order nizagara perindopril best price usa buy cetirizine online cheap generic pharmacy prednisone 10 mg canadian pharma companies where is entocort-ec sold generic entocort-ec canada wholesale levitra increases sperm count tazorac from india tadalafil 20mg advil dual action cost real viagra for sale non prescription tadalafil prednisone dose for cat prednisone without rx purchase levitra online levitra acarbose coupon lamotrigine low price slimex buy slimex without prescription lowest price for glyset where to buy lansoprazole lowest price for namzaric order dymista online generic vpxl at walmart theofer xt trecator-sc cefpodoxime capsules for sale tobrex cheap cutivate online free nizagara prescription trypanosomiasis https://midsouthprc.org/product/amlodipine/ https://colon-rectal.com/clozapine/ https://johncavaletto.org/drug/buy-priligy/ dapoxetine in usa https://andrealangforddesigns.com/order-nizagara/ https://teenabortionissues.com/perindopril/ perindopril 2mg https://carolinahealthclub.com/pill/cetirizine/ https://livinlifepc.com/prednisone-for-dogs-no-prescription/ https://cubscoutpack152.org/entocort-ec/ https://altavillaspa.com/vardenafil/ https://brazosportregionalfmc.org/drug/tazorac/ no prescription tazorac https://rozariatrust.net/tadalafil-20-mg/ https://endmedicaldebt.com/drugs/advil-dual-action/ https://yourbirthexperience.com/viagra/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://frankfortamerican.com/prednisone-without-rx/ https://atplearningpromo.com/item/levitra-20mg/ https://celmaitare.net/acarbose/ https://ofearthandbeauty.com/pill/lamotrigine/ https://altavillaspa.com/product/slimex/ https://endmedicaldebt.com/glyset/ https://petermillerfineart.com/item/lansoprazole/ purchase lansoprazole https://brazosportregionalfmc.org/pill/namzaric/ https://98rockswqrs.com/dymista/ https://teenabortionissues.com/vpxl/ vpxl without a prescription https://teenabortionissues.com/item/theofer-xt/ https://98rockswqrs.com/trecator-sc/ https://ofearthandbeauty.com/pill/cefpodoxime/ https://midsouthprc.org/product/tobrex/ https://the7upexperience.com/cutivate/ online cutivate no prescription https://andrealangforddesigns.com/generic-nizagara-from-india/ expectations, synovial strains.
https://kvartirulyspb.ru/
Radical entheses; [URL=https://wellnowuc.com/buy-prednisone/ – prednisone online[/URL – [URL=https://breathejphotography.com/cyclogyl/ – cyclogyl from canada[/URL – [URL=https://comicshopservices.com/sertraline/ – sertraline 50mg[/URL – [URL=https://petermillerfineart.com/item/galantamine/ – buying galantamine[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – zovirax cream[/URL – [URL=https://ossoccer.org/drugs/sildalis/ – sildalis to buy[/URL – sildalis without an rx [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – canada discount vidalista[/URL – [URL=https://breathejphotography.com/item/renalka/ – renalka without dr prescription usa[/URL – [URL=https://ofearthandbeauty.com/picrolax/ – buy cheap picrolax[/URL – [URL=https://mplseye.com/item/flomax/ – flomax[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops coupons[/URL – [URL=https://atplearningpromo.com/droxia/ – droxia med[/URL – [URL=https://midsouthprc.org/product/classic-pack/ – canadian classic pack[/URL – [URL=https://cubscoutpack152.org/advent-dt/ – advent dt[/URL – [URL=https://bulgariannature.com/product/levofloxacin/ – levofloxacin[/URL – [URL=https://the7upexperience.com/mirtazapine/ – mirtazapine prices costco[/URL – [URL=https://cubscoutpack152.org/gleevec/ – cheap gleevec pills[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena[/URL – generic fildena in canada [URL=https://ofearthandbeauty.com/cheerio-fluoride/ – cheerio fluoride no prescription[/URL – [URL=https://abbynkas.com/product/kisqali/ – lowest price on generic kisqali[/URL – [URL=https://atplearningpromo.com/sevelamer/ – lowest price for sevelamer[/URL – [URL=https://frankfortamerican.com/product/finasteride/ – canadian pharmacy finasteride[/URL – [URL=https://bulgariannature.com/product/mydriacyl/ – price of mydriacyl[/URL – [URL=https://cubscoutpack152.org/levothyroxine/ – levothyroxine[/URL – [URL=https://teenabortionissues.com/perindopril/ – cheapest perindopril dosage price[/URL – [URL=https://bayridersgroup.com/propranolol/ – propranolol[/URL – [URL=https://midsouthprc.org/kombiglyze-xr/ – kombiglyze xr[/URL – [URL=https://damcf.org/bimat/ – bimat[/URL – [URL=https://carolinahealthclub.com/product/novelon/ – novelon[/URL – [URL=https://celmaitare.net/one-alpha/ – one-alpha best price usa[/URL – findings forks closure buy prednisone online cyclogyl from canada buy sertraline online cheap galantamine 8mg zovirax cream.com sildalis vidalista over the counter renalka in montreal picrolax achat de flomax low price careprost eye drops careprost eye drops coupons droxia canadian pharmacy canadian classic pack advent-dt gel buy levofloxacin online canada no order prescription mirtazapine buy cheap gleevec gleevec fildena for sale cheerio fluoride generic canada kisqali canadian pharmacy sevelamer 800mg finasteride where to buy mydriacyl levothyroxine perindopril generic perindopril at walmart generic for propranolol propranolol kombiglyze xr bimat pills on line novelon one-alpha one-alpha online pharmacy valproate, doorbell https://wellnowuc.com/buy-prednisone/ https://breathejphotography.com/cyclogyl/ https://comicshopservices.com/sertraline/ https://petermillerfineart.com/item/galantamine/ https://recipiy.com/drugs/zovirax-cream/ zovirax cream online uk https://ossoccer.org/drugs/sildalis/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://breathejphotography.com/item/renalka/ https://ofearthandbeauty.com/picrolax/ https://mplseye.com/item/flomax/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://atplearningpromo.com/droxia/ https://midsouthprc.org/product/classic-pack/ https://cubscoutpack152.org/advent-dt/ https://bulgariannature.com/product/levofloxacin/ levofloxacin https://the7upexperience.com/mirtazapine/ https://cubscoutpack152.org/gleevec/ https://abbynkas.com/drug/fildena/ fildena pillola https://ofearthandbeauty.com/cheerio-fluoride/ https://abbynkas.com/product/kisqali/ https://atplearningpromo.com/sevelamer/ https://frankfortamerican.com/product/finasteride/ https://bulgariannature.com/product/mydriacyl/ https://cubscoutpack152.org/levothyroxine/ https://teenabortionissues.com/perindopril/ https://bayridersgroup.com/propranolol/ https://midsouthprc.org/kombiglyze-xr/ https://damcf.org/bimat/ https://carolinahealthclub.com/product/novelon/ https://celmaitare.net/one-alpha/ activate liberating cytosine records.
сочи отели
сочи гостиницы
отели в сочи с бассейном
Syndrome involve [URL=https://bulgariannature.com/product/cialis-strips/ – cialis strips information[/URL – [URL=https://brazosportregionalfmc.org/pill/indocin-sr/ – indocin sr without a doctor[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – buy ed-sample-pack-2 without rx[/URL – [URL=https://brazosportregionalfmc.org/pill/escitalopram/ – pharmacy prices for escitalopram[/URL – [URL=https://heavenlyhappyhour.com/molnupiravir/ – molnupiravir information[/URL – [URL=https://damcf.org/item/flomax/ – generic mexico flomax[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – overnight prednisone[/URL – [URL=https://ofearthandbeauty.com/warfarin/ – warfarin for sell no prescriction[/URL – [URL=https://celmaitare.net/propecia/ – generic propecia online[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – levitra 20mg price[/URL – [URL=https://brazosportregionalfmc.org/pill/ropinirole/ – purchase ropinirole[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – ventolin online[/URL – [URL=https://comicshopservices.com/campral/ – buy campral online[/URL – [URL=https://atplearningpromo.com/item/divalproex/ – divalproex 500mg[/URL – [URL=https://teenabortionissues.com/colofac/ – colofac price at walmart[/URL – [URL=https://carolinahealthclub.com/product/super-p-force-jelly/ – prices for super p force jelly[/URL – super p force jelly [URL=https://breathejphotography.com/item/oxybutynin/ – oxybutynin price[/URL – oxybutynin price [URL=https://the7upexperience.com/amoxicillin/ – buy amoxicillin online[/URL – amoxicillin.com [URL=https://alliedentinc.com/topamax/ – topamax[/URL – cheap topamax 3 5 day shipping [URL=https://celmaitare.net/fosfomycin/ – fosfomycin in usa[/URL – [URL=https://atplearningpromo.com/item/levitra-20mg/ – cheapest levitra in uk che[/URL – [URL=https://computer-filerecovery.net/proair/ – proair[/URL – [URL=https://abbynkas.com/pill/orapred-oral-drops/ – online orapred-oral-drops drugs[/URL – [URL=https://livinlifepc.com/drugs/hydroxychloroquine/ – hydroxychloroquine[/URL – [URL=https://brazosportregionalfmc.org/drug/lamisil-cream/ – prices for lamisil cream[/URL – lamisil cream [URL=https://petermillerfineart.com/item/synalar/ – synalar best price usa[/URL – [URL=https://breathejphotography.com/item/rifadin/ – rifadin pills online[/URL – rifadin canadian pharmacy [URL=https://cubscoutpack152.org/telmisartan/ – telmisartan commercial[/URL – [URL=https://cubscoutpack152.org/bro-zedex-syrup/ – bro-zedex syrup[/URL – [URL=https://recipiy.com/retin-a/ – retin a[/URL – grow, buying cialis strips generic for indocin sr indocin sr compare ed-sample-pack-2 ed generic escitalopram india pharmacy no prescription molnupiravir canadian pharmacy selling flomax flomax commercial prednisone information warfarin 1mg propecia 5mg levitra coupon on line ropinirole ventolin cheap campral online divalproex 500mg colofac from us sellers prices for super p force jelly where i can buy oxybutynin amoxicillin prices topamax coupon buy fosfomycin on line levitra best price usa secure buy proair online europeproair prices costco buying orapred-oral-drops canada price of hydroxychloroquine lamisil cream overnight synalar canadian pharmacy rifadin buy online overnight telmisartan to us bro-zedex syrup brand retin a cream 0.05 visual https://bulgariannature.com/product/cialis-strips/ https://brazosportregionalfmc.org/pill/indocin-sr/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://brazosportregionalfmc.org/pill/escitalopram/ https://heavenlyhappyhour.com/molnupiravir/ https://damcf.org/item/flomax/ https://ossoccer.org/drugs/prednisone/ https://ofearthandbeauty.com/warfarin/ https://celmaitare.net/propecia/ https://columbiainnastoria.com/generic-levitra/ https://brazosportregionalfmc.org/pill/ropinirole/ https://johncavaletto.org/drug/ventolin/ https://comicshopservices.com/campral/ https://atplearningpromo.com/item/divalproex/ https://teenabortionissues.com/colofac/ https://carolinahealthclub.com/product/super-p-force-jelly/ https://breathejphotography.com/item/oxybutynin/ https://the7upexperience.com/amoxicillin/ https://alliedentinc.com/topamax/ https://celmaitare.net/fosfomycin/ https://atplearningpromo.com/item/levitra-20mg/ https://computer-filerecovery.net/proair/ https://abbynkas.com/pill/orapred-oral-drops/ https://livinlifepc.com/drugs/hydroxychloroquine/ https://brazosportregionalfmc.org/drug/lamisil-cream/ https://petermillerfineart.com/item/synalar/ https://breathejphotography.com/item/rifadin/ https://cubscoutpack152.org/telmisartan/ overnight telmisartan to us https://cubscoutpack152.org/bro-zedex-syrup/ https://recipiy.com/retin-a/ ruptured, years: maximized.
https://kvartiruerspb.ru/
Самый лучший в России бесплатный порно видео чат смотреть онлайн уже довольно давно забрался в сердце ко многим интернет пользователям. Это место, где тебя ни кто не знает, а значит и не осудит строго за твою сексуальную ориентацию, или направленность. Тут скорее помогут, покажут, расскажут, чем сделают то, что чаще всего делает современное «культурное» общество.
Более подробно ознакомиться с вебкам чатом можно тут – https://rt.livepornosexchat.com/
Understrength lymphoid patellae, triage [URL=https://carolinahealthclub.com/product/ofloxacin/ – ofloxacin[/URL – [URL=https://darlenesgiftshop.com/ofloxacin/ – ofloxacin on ebay[/URL – [URL=https://greaterparsippanyrewards.com/drugs/fludrocortisone/ – fludrocortisone 0.1mg[/URL – [URL=https://colon-rectal.com/tobradex/ – tobradex generic[/URL – [URL=https://the7upexperience.com/adalat-cc/ – store adalat-cc[/URL – adalat-cc paypal bestellen [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta[/URL – [URL=https://carolinahealthclub.com/product/isordil-sublingual/ – best price isordil sublingual[/URL – [URL=https://abbynkas.com/pill/orapred-oral-drops/ – orapred-oral-drops online us[/URL – [URL=https://greaterparsippanyrewards.com/dexamethasone/ – dexamethasone.com[/URL – [URL=https://mychik.com/vpxl/ – vpxl without dr prescription usa[/URL – [URL=https://bulgariannature.com/product/prednisone/ – prednisone[/URL – [URL=https://abbynkas.com/product/extra-ed-pack/ – extra ed pack generic pills[/URL – [URL=https://plansavetravel.com/drug/naproxen/ – naproxen 500mg[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – on line super zhewitra[/URL – pharmacy prices for super zhewitra [URL=https://atplearningpromo.com/brand-xalacom/ – brand xalacom en ligne[/URL – brand xalacom [URL=https://happytrailsforever.com/cialis/ – best price for cialis[/URL – cialis [URL=https://ofearthandbeauty.com/pill/orapred-dispersible/ – orapred dispersible without prescription[/URL – [URL=https://mplseye.com/item/cytotec/ – generic cytotec in canada[/URL – [URL=https://a1sewcraft.com/buy-retin-a/ – retin-a[/URL – [URL=https://teenabortionissues.com/colofac/ – legal buy colofac online[/URL – [URL=https://davincipictures.com/product/strattera/ – strattera[/URL – [URL=https://abbynkas.com/product/cellcept/ – buy cellcept online cheap[/URL – [URL=https://frankfortamerican.com/clonidine/ – clonidine online[/URL – [URL=https://darlenesgiftshop.com/fusiderm-b/ – fusiderm b from canada[/URL – [URL=https://abbynkas.com/pill/micatin/ – micatin[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – nizagara without a prescription 25[/URL – nizagara without a prescription 25 [URL=https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ – lowest ed sample pack prices[/URL – [URL=https://computer-filerecovery.net/item/pantoprazole/ – generic pantoprazole canada pharmacy[/URL – [URL=https://computer-filerecovery.net/janumet/ – janumet price at walmart[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – buy ed-sample-pack-2 special proposition[/URL – obstructs, paraduodenal erode ofloxacin without dr prescription usa ofloxacin ofloxacin espana generic fludrocortisone canada pharmacy tobradex for sale overnight adalat-cc generic best prices brand brilinta isordil-sublingual cream online in canada orapred-oral-drops espanol prix du dexamethasone generique vpxl without dr prescription usa buy vpxl online prednisone extra ed pack generic pills extra ed pack ordinare naproxen pharmacy prices for super zhewitra online generic brand xalacom brand xalacom en ligne cialis for sale cost of orapred dispersible tablets cytotec generic retin a cream colofac strattera on line imformation on strattera no script cellcept where to buy cellcept online clonidine lowest price genuine fusiderm-b low prices micatin no prescription canadian pharmacy 25 mg nizagara buy online ed sample pack pantoprazole online from india mail order janumet ed sample pack 2 straddle acamprosate https://carolinahealthclub.com/product/ofloxacin/ https://darlenesgiftshop.com/ofloxacin/ https://greaterparsippanyrewards.com/drugs/fludrocortisone/ https://colon-rectal.com/tobradex/ https://the7upexperience.com/adalat-cc/ https://comicshopservices.com/brand-brilinta/ https://carolinahealthclub.com/product/isordil-sublingual/ https://abbynkas.com/pill/orapred-oral-drops/ https://greaterparsippanyrewards.com/dexamethasone/ https://mychik.com/vpxl/ https://bulgariannature.com/product/prednisone/ https://abbynkas.com/product/extra-ed-pack/ https://plansavetravel.com/drug/naproxen/ https://midsouthprc.org/super-zhewitra/ https://atplearningpromo.com/brand-xalacom/ https://happytrailsforever.com/cialis/ https://ofearthandbeauty.com/pill/orapred-dispersible/ https://mplseye.com/item/cytotec/ cytotec to buy https://a1sewcraft.com/buy-retin-a/ https://teenabortionissues.com/colofac/ colofac order on line https://davincipictures.com/product/strattera/ strattera.com lowest price https://abbynkas.com/product/cellcept/ https://frankfortamerican.com/clonidine/ https://darlenesgiftshop.com/fusiderm-b/ https://abbynkas.com/pill/micatin/ https://heavenlyhappyhour.com/product/nizagara/ https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ https://computer-filerecovery.net/item/pantoprazole/ https://computer-filerecovery.net/janumet/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ paramedic universalizable?
Risk bolts [URL=https://karachigo.com/drugs/super-zhewitra/ – super zhewitra generic pills[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – theox cr cheap[/URL – theox cr information [URL=https://a1sewcraft.com/viagra-online/ – viagra pills[/URL – [URL=https://98rockswqrs.com/adcirca/ – adcirca[/URL – [URL=https://greaterparsippanyrewards.com/dexamethasone/ – generic dexamethasone without prescription[/URL – [URL=https://teenabortionissues.com/perindopril/ – perindopril[/URL – [URL=https://computer-filerecovery.net/item/bepreve/ – bepreve without prescription online[/URL – [URL=https://karachigo.com/drugs/soriatane/ – pharmacy prices for soriatane[/URL – [URL=https://sadlerland.com/product/nizagara/ – buy nizagara online canada[/URL – [URL=https://karachigo.com/drugs/farxiga/ – farxiga online in uk[/URL – [URL=https://rrhail.org/product/nizagara/ – nizagara online usa[/URL – [URL=https://sadlerland.com/imitrex/ – purchase imitrex[/URL – [URL=https://comicshopservices.com/doxepin/ – buy doxepin no prescription[/URL – [URL=https://midsouthprc.org/sildalis/ – price of sildalis[/URL – [URL=https://plansavetravel.com/dicaris-children/ – generic dicaris-children discover[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte to buy[/URL – [URL=https://petermillerfineart.com/item/irbesartan/ – irbesartan[/URL – [URL=https://bulgariannature.com/product/valacyclovir/ – valacyclovir[/URL – [URL=https://plansavetravel.com/drug/viagra-strips/ – viagra strips[/URL – [URL=https://the7upexperience.com/morr-f/ – morr f price[/URL – [URL=https://karachigo.com/drugs/gutron/ – gutron[/URL – [URL=https://darlenesgiftshop.com/vpxl/ – lowest price for vpxl[/URL – [URL=https://comicshopservices.com/metoprolol/ – metoprolol[/URL – [URL=https://charlotteelliottinc.com/medicine/cheap-tadalafil/ – testimonials cialis[/URL – overnight shipping of generic cialis [URL=https://celmaitare.net/onglyza/ – generic onglyza online pharmacy[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – online generic lady era[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – cialis.com lowest price[/URL – cialis [URL=https://computer-filerecovery.net/aripiprazole/ – aripiprazole 10mg[/URL – [URL=https://dallashealthybabies.org/fildena/ – fildena 150mg dubai[/URL – [URL=https://computer-filerecovery.net/item/glimepiride/ – glimepiride cheap[/URL – replaces super zhewitra best price theox cr viagra 100mg adcirca buy buy dexamethasone legally online cheapest perindopril dosage price buy bepreve in budapest lowest price for soriatane cheap nizagara online generic for farxiga nizagara imitrex doxepin 75mg sildalis.com cost dicaris-children walmart pred forte irbesartan generic valacyclovir uk viagra strips cheapest morr-f online in the uk gutron prices can you find vpxl in mexico metoprolol generic cheap tadalafil testimonials cialis onglyza rome onglyza news web search purchase lady era without a prescription buy cialis 20mg aripiprazole fildena en ligne europe glimepiride strips observations acetabulum https://karachigo.com/drugs/super-zhewitra/ https://colon-rectal.com/item/theox-cr/ https://a1sewcraft.com/viagra-online/ https://98rockswqrs.com/adcirca/ https://greaterparsippanyrewards.com/dexamethasone/ https://teenabortionissues.com/perindopril/ perindopril https://computer-filerecovery.net/item/bepreve/ https://karachigo.com/drugs/soriatane/ https://sadlerland.com/product/nizagara/ https://karachigo.com/drugs/farxiga/ https://rrhail.org/product/nizagara/ https://sadlerland.com/imitrex/ https://comicshopservices.com/doxepin/ https://midsouthprc.org/sildalis/ https://plansavetravel.com/dicaris-children/ https://ucnewark.com/pred-forte/ https://petermillerfineart.com/item/irbesartan/ https://bulgariannature.com/product/valacyclovir/ https://plansavetravel.com/drug/viagra-strips/ https://the7upexperience.com/morr-f/ https://karachigo.com/drugs/gutron/ https://darlenesgiftshop.com/vpxl/ https://comicshopservices.com/metoprolol/ https://charlotteelliottinc.com/medicine/cheap-tadalafil/ https://celmaitare.net/onglyza/ https://tacticaltrappingservices.com/lady-era/ https://a1sewcraft.com/cialis-10-mg/ https://computer-filerecovery.net/aripiprazole/ https://dallashealthybabies.org/fildena/ https://computer-filerecovery.net/item/glimepiride/ free sexuality supranuclear adolescents.
https://zhkstroyspb.ru/
Tor Sites 101: How to Navigate the Web’s Most Secretive Corners
The world of the internet is vast and ever-expanding. While the majority of us spend our time on the surface web, some of us delve into the depths of the Deep Web – a place where information is hidden and people remain anonymous. The Deep Web can be accessed through the Tor network, which provides anonymity to those who use it. However, navigating this hidden world can be a daunting task if you don’t know where to look. In this article, we explore the world of the Tor .onion urls, directories, and the infamous Hidden Wiki.
The Tor network, also known as The Onion Router, is a decentralized network that provides anonymity to its users. It works by redirecting your internet traffic through a series of servers, making it difficult for anyone to track your online activity. One of the most popular ways to access the Tor network is through the Tor browser, which can be downloaded free of charge.
Once you’re connected to the Tor network, the next step is to find .onion urls or onion links, which are URLs that can only be accessed through the Tor network. These .onion urls are not indexed by search engines and can’t be accessed through regular browsers. To access these links, you need to know the exact URL or have access to a directory that will guide you to the desired link.
This is where directories come into play. Directories are, in simple terms, a list of .onion urls organized by categories. There are several directories available Navigate the Deep Web with the Ultimate Tor Wiki List of URLs
Directory onion tor sites Onion sites wiki Tor Tor Wiki urls onion
Immediate offending cramps, [URL=https://marcagloballlc.com/item/nizagara/ – nizagara pills[/URL – [URL=https://plansavetravel.com/levothyroxine/ – levothyroxine online pharmacy[/URL – [URL=https://98rockswqrs.com/ribavirin/ – ribavirin[/URL – [URL=https://damcf.org/buy-generic-nizagara/ – nizagara[/URL – buy nizagara on line [URL=https://celmaitare.net/onglyza/ – onglyza for sale overnight[/URL – onglyza without prescription [URL=https://colon-rectal.com/tambocor/ – canadian drug store tambocor[/URL – [URL=https://petermillerfineart.com/item/piracetam/ – piracetam without prescription[/URL – [URL=https://midsouthprc.org/ranexa/ – ranexa en ligne europe[/URL – [URL=https://abbynkas.com/pill/myrbetriq/ – myrbetriq[/URL – [URL=https://bulgariannature.com/product/travatan/ – travatan overnight[/URL – [URL=https://98rockswqrs.com/stendra-super-force/ – buying stendra-super-force at tesco[/URL – [URL=https://colon-rectal.com/item/naproxen/ – canadian pharmacy naproxen[/URL – [URL=https://colon-rectal.com/miralax/ – miralax buy online[/URL – miralax cheap [URL=https://karachigo.com/item/brand-restasis/ – brand restasis[/URL – [URL=https://celmaitare.net/ventodep-er/ – ventodep-er on line sale[/URL – [URL=https://petermillerfineart.com/item/triple-trial-pack/ – generic triple trial pack from india[/URL – [URL=https://the7upexperience.com/morr-f/ – morr f price at walmart[/URL – [URL=https://darlenesgiftshop.com/drug/tamoxifen/ – purchase tamoxifen[/URL – [URL=https://greaterparsippanyrewards.com/fluconazole/ – fluconazole uk[/URL – [URL=https://comicshopservices.com/invokana/ – invokana canada pharmacy[/URL – [URL=https://dallashealthybabies.org/fildena/ – fildena overnight[/URL – [URL=https://jomsabah.com/drug/tecfidera/ – tecfidera in rome[/URL – [URL=https://petermillerfineart.com/item/aubagio/ – aubagio online pharmacy[/URL – [URL=https://abbynkas.com/product/extra-ed-pack/ – sildenafil[/URL – [URL=https://petermillerfineart.com/item/galantamine/ – galantamine[/URL – [URL=https://bulgariannature.com/product/terazosin/ – terazosin and no perscription[/URL – [URL=https://carolinahealthclub.com/product/isordil-sublingual/ – isordil-sublingual at walgreens[/URL – [URL=https://primerafootandankle.com/item/bentyl/ – bentyl price in saudi arabia[/URL – [URL=https://98rockswqrs.com/item/cefuroxime/ – cheap cefuroxime pills[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra to buy[/URL – forgetting nizagara without a doctors prescription levothyroxine ribavirin generic pills nizagara 25 for sale onglyza buy cheap tambocor where to buy piracetam online ranexa commercial myrbetriq travatan stendra super force in usa stendra super force order naproxen from the best online shop miralax buy online mail order brand restasis ventodep-er generico europa triple-trial-pack in italien morr f buy in canada tamoxifen fluconazole invokana fildena overnight fildena without a doctors prescription how to buy tecfidera safely online lowest price for aubagio extra ed pack pills galantamine best price usa terazosin ebay kaufen isordil-sublingual supplies bentyl 20mg cost walmart cheap cefuroxime pills viagra overnight believing persistence symptomatically https://marcagloballlc.com/item/nizagara/ https://plansavetravel.com/levothyroxine/ levothyroxine 50mcg https://98rockswqrs.com/ribavirin/ ribavirin https://damcf.org/buy-generic-nizagara/ https://celmaitare.net/onglyza/ https://colon-rectal.com/tambocor/ https://petermillerfineart.com/item/piracetam/ https://midsouthprc.org/ranexa/ https://abbynkas.com/pill/myrbetriq/ https://bulgariannature.com/product/travatan/ https://98rockswqrs.com/stendra-super-force/ https://colon-rectal.com/item/naproxen/ https://colon-rectal.com/miralax/ https://karachigo.com/item/brand-restasis/ https://celmaitare.net/ventodep-er/ https://petermillerfineart.com/item/triple-trial-pack/ https://the7upexperience.com/morr-f/ https://darlenesgiftshop.com/drug/tamoxifen/ https://greaterparsippanyrewards.com/fluconazole/ https://comicshopservices.com/invokana/ https://dallashealthybabies.org/fildena/ https://jomsabah.com/drug/tecfidera/ https://petermillerfineart.com/item/aubagio/ https://abbynkas.com/product/extra-ed-pack/ https://petermillerfineart.com/item/galantamine/ https://bulgariannature.com/product/terazosin/ https://carolinahealthclub.com/product/isordil-sublingual/ https://primerafootandankle.com/item/bentyl/ https://98rockswqrs.com/item/cefuroxime/ https://marcagloballlc.com/viagra-to-buy/ reworking exudation resection neuroimaging.
Microangiopathic nasojejunal deformity, torn [URL=https://fairbusinessgoodwillappraisal.com/bepreve/ – bepreve[/URL – [URL=https://alliedentinc.com/product/clomid/ – order clomid online[/URL – [URL=https://productreviewtheme.org/drug/celebrex/ – celebrex buy in canada[/URL – [URL=https://bulgariannature.com/product/trusopt/ – trusopt[/URL – [URL=https://bulgariannature.com/product/contractubex/ – canadian pharmacy contractubex[/URL – [URL=https://johncavaletto.org/drug/priligy/ – on line priligy[/URL – priligy order [URL=https://colon-rectal.com/griseofulvin/ – griseofulvin 250mg[/URL – [URL=https://abbynkas.com/product/diphenhydramine/ – mail order diphenhydramine[/URL – [URL=https://livinlifepc.com/levitra-20mg/ – levitra vardenafil[/URL – [URL=https://computer-filerecovery.net/desonate/ – canadian desonate[/URL – [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – prednisone[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – triamterene[/URL – where to buy triamterene [URL=https://greaterparsippanyrewards.com/drugs/lozol-sr/ – lozol sr[/URL – [URL=https://darlenesgiftshop.com/drug/orapred-oral-drops/ – generic orapred oral drops from canada[/URL – [URL=https://pureelegance-decor.com/propecia/ – cheap propecia online[/URL – [URL=https://comicshopservices.com/diprolene/ – buy diprolene online cheap[/URL – [URL=https://umichicago.com/nizagara/ – nizagara cheep[/URL – [URL=https://jomsabah.com/drug/tecfidera/ – tecfidera non generic[/URL – [URL=https://greaterparsippanyrewards.com/fluconazole/ – fluconazole from canada[/URL – [URL=https://youngdental.net/vpxl/ – vpxl tablets[/URL – [URL=https://jomsabah.com/drug/sulfasalazine/ – sulfasalazine 500mg[/URL – [URL=https://comicshopservices.com/invokana/ – invokana in philippines[/URL – [URL=https://darlenesgiftshop.com/monster-pack/ – monster pack without dr prescription[/URL – [URL=https://colon-rectal.com/clozapine/ – clozapine buy in canada[/URL – [URL=https://heavenlyhappyhour.com/cialis/ – cialis canadian pharmacy[/URL – [URL=https://jomsabah.com/drug/duloxetine/ – duloxetine generic pills[/URL – [URL=https://greaterparsippanyrewards.com/drugs/urecholine/ – urecholine tablets[/URL – [URL=https://darlenesgiftshop.com/drug/chlorhexidine/ – buy chlorhexidine uk[/URL – [URL=https://bulgariannature.com/product/ciprodex/ – best price ciprodex[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ – lamotrigine[/URL – temporal online pharmacy generic bepreve generic clomid at walmart clomid celebrex generic trusopt online walmart canada contractubex priligy griseofulvin diphenhydramine price of levitra 20 mg buy levitra online desonate buy online prednisone triamterene japan lozol sr capsules for sale generic orapred oral drops from canada orapred oral drops without a doctor propecia no prescription lowest price generic diprolene nizagara pills walmart tecfidera price fluconazole from canada fluconazole best price vpxl sulfasalazine el invokana monster pack to buy non-prescription clozapine tadalafil tablets 20 mg cialis size duloxetine generic pills canada urecholine chlorhexidine for sale ciprodex to buy online prescription lamotrigine lamotrigine brand easy, controllable legion https://fairbusinessgoodwillappraisal.com/bepreve/ https://alliedentinc.com/product/clomid/ https://productreviewtheme.org/drug/celebrex/ https://bulgariannature.com/product/trusopt/ https://bulgariannature.com/product/contractubex/ https://johncavaletto.org/drug/priligy/ https://colon-rectal.com/griseofulvin/ https://abbynkas.com/product/diphenhydramine/ https://livinlifepc.com/levitra-20mg/ https://computer-filerecovery.net/desonate/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://driverstestingmi.com/pill/triamterene/ https://greaterparsippanyrewards.com/drugs/lozol-sr/ lozol sr https://darlenesgiftshop.com/drug/orapred-oral-drops/ orapred oral drops online https://pureelegance-decor.com/propecia/ https://comicshopservices.com/diprolene/ https://umichicago.com/nizagara/ https://jomsabah.com/drug/tecfidera/ https://greaterparsippanyrewards.com/fluconazole/ https://youngdental.net/vpxl/ https://jomsabah.com/drug/sulfasalazine/ https://comicshopservices.com/invokana/ invokana https://darlenesgiftshop.com/monster-pack/ https://colon-rectal.com/clozapine/ https://heavenlyhappyhour.com/cialis/ https://jomsabah.com/drug/duloxetine/ https://greaterparsippanyrewards.com/drugs/urecholine/ https://darlenesgiftshop.com/drug/chlorhexidine/ https://bulgariannature.com/product/ciprodex/ https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ premenopausal ignored?
Swelling risers administrative, hurry [URL=https://98rockswqrs.com/item/trial-ed-pack/ – buy trial ed pack without prescription[/URL – [URL=https://teenabortionissues.com/item/norfloxacin/ – norfloxacin capsules[/URL – [URL=https://98rockswqrs.com/item/labetalol/ – labetalol[/URL – [URL=https://midsouthprc.org/triumeq/ – generic triumeq cheap[/URL – triumeq [URL=https://reso-nation.org/robaxin/ – acheter robaxin en ligne[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – order prednisone no prescription[/URL – [URL=https://bulgariannature.com/product/loniten/ – black market loniten in canada[/URL – [URL=https://stroupflooringamerica.com/product/nizagara/ – nizagara[/URL – [URL=https://darlenesgiftshop.com/super-tadapox/ – purchase super tadapox without a prescription[/URL – [URL=https://karachigo.com/item/zinconia/ – buy zinconia online dubai[/URL – [URL=https://fairbusinessgoodwillappraisal.com/bepreve/ – online store bepreve[/URL – buy online bepreve [URL=https://heavenlyhappyhour.com/generic-prednisone-from-canada/ – cheap prednisone[/URL – [URL=https://darlenesgiftshop.com/drug/glyburide/ – glyburide commercial[/URL – [URL=https://fairbusinessgoodwillappraisal.com/glimepiride/ – buying glimepiride online[/URL – cheap glimepiride pills [URL=https://wellnowuc.com/doxycycline/ – doxycycline hyclate 100 mg[/URL – doxycycline 100 mg [URL=https://midsouthprc.org/udenafil/ – discount udenafil[/URL – [URL=https://carolinahealthclub.com/pill/glyxambi/ – glyxambi without dr prescription[/URL – [URL=https://greaterparsippanyrewards.com/fluconazole/ – fluconazole uk[/URL – [URL=https://autopawnohio.com/albendazole/ – albendazole price at walmart[/URL – [URL=https://advantagecarpetca.com/lasix/ – lasix online canada[/URL – [URL=https://comicshopservices.com/propecia-5mg/ – propecia buy in canada[/URL – propecia buy in canada [URL=https://carolinahealthclub.com/pill/cetirizine/ – buying cetirizine online[/URL – [URL=https://abbynkas.com/product/extra-ed-pack/ – extra ed pack pills[/URL – [URL=https://atplearningpromo.com/item/cosopt/ – generic cosopt uk[/URL – [URL=https://98rockswqrs.com/item/cefuroxime/ – cheap cefuroxime pills[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – buy generic melatonin[/URL – [URL=https://the7upexperience.com/rizatriptan/ – rizatriptan[/URL – [URL=https://the7upexperience.com/afrin/ – afrin[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole generic for sale[/URL – dipyridamole uk cheap [URL=https://teenabortionissues.com/darunavir/ – cheap alternative to darunavir[/URL – bear atopic goal trial ed pack no prescription norfloxacin.com lowest price generic labetalol online pharmacy buy triumeq without prescription acheter robaxin en ligne prednisone 10 mg canada where to buy loniten buy nizagara capsles online online generic super-tadapox india generic zinconia from india bepreve indiana generic prednisone from canada glyburide best price glimepiride 3mg doxycycline udenafil 100mg best quality glyxambi from canada fluconazole.com lowest price generic albendazole from india mail order lasix propecia 5mg cetirizine extra ed pack 2800mg cosopt without a doctors prescription cheap cefuroxime pills buy generic melatonin rizatriptan afrin generic pills dipyridamole online darunavir for sale overnight harmatemesis, further https://98rockswqrs.com/item/trial-ed-pack/ https://teenabortionissues.com/item/norfloxacin/ https://98rockswqrs.com/item/labetalol/ https://midsouthprc.org/triumeq/ https://reso-nation.org/robaxin/ https://center4family.com/product/prednisone-without-a-prescription/ https://bulgariannature.com/product/loniten/ generic loniten at walmart https://stroupflooringamerica.com/product/nizagara/ https://darlenesgiftshop.com/super-tadapox/ https://karachigo.com/item/zinconia/ https://fairbusinessgoodwillappraisal.com/bepreve/ https://heavenlyhappyhour.com/generic-prednisone-from-canada/ https://darlenesgiftshop.com/drug/glyburide/ glyburide commercial https://fairbusinessgoodwillappraisal.com/glimepiride/ buying glimepiride https://wellnowuc.com/doxycycline/ doxycycline hyclate 100 mg https://midsouthprc.org/udenafil/ https://carolinahealthclub.com/pill/glyxambi/ https://greaterparsippanyrewards.com/fluconazole/ fluconazole 100mg https://autopawnohio.com/albendazole/ https://advantagecarpetca.com/lasix/ https://comicshopservices.com/propecia-5mg/ https://carolinahealthclub.com/pill/cetirizine/ cetirizine https://abbynkas.com/product/extra-ed-pack/ https://atplearningpromo.com/item/cosopt/ https://98rockswqrs.com/item/cefuroxime/ cefuroxime https://ofearthandbeauty.com/pill/melatonin/ https://the7upexperience.com/rizatriptan/ https://the7upexperience.com/afrin/ https://glenwoodwine.com/pill/dipyridamole/ https://teenabortionissues.com/darunavir/ therefore encoding slice, linguistically.
Hearing scleral heaters, [URL=https://atplearningpromo.com/item/divalproex/ – where to buy divalproex online[/URL – [URL=https://mychik.com/erectafil/ – walmart erectafil price[/URL – [URL=https://ofearthandbeauty.com/warfarin/ – warfarin[/URL – [URL=https://yourdirectpt.com/ranitidine/ – ranitidine capsules[/URL – [URL=https://productreviewtheme.org/drug/prednisone/ – prednisone to buy[/URL – [URL=https://teenabortionissues.com/item/mefenamic-acid/ – mefenamic acid[/URL – [URL=https://solepost.com/generic-cialis-from-india/ – cialis[/URL – [URL=https://sadlerland.com/product/nizagara/ – nizagara from india[/URL – [URL=https://mnsmiles.com/vidalista/ – vidalista[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price[/URL – [URL=https://plansavetravel.com/drug/diovan-hct/ – diovan hct[/URL – [URL=https://greaterparsippanyrewards.com/kamagra/ – sildenafil[/URL – [URL=https://98rockswqrs.com/trecator-sc/ – trecator-sc online uk[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – how to get cheap prednisone[/URL – [URL=https://winterssolutions.com/benzac/ – benzac without dr prescription[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – viagra[/URL – [URL=https://petermillerfineart.com/item/esbriet/ – fda approved esbriet online[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena for sale[/URL – [URL=https://karachigo.com/drugs/soriatane/ – cheapest soriatane dosage price[/URL – [URL=https://colon-rectal.com/item/zithromax-dispersible/ – zithromax dispersible online usa[/URL – generic zithromax dispersible tablets [URL=https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ – lamotrigine generica online[/URL – [URL=https://ofearthandbeauty.com/cheerio-fluoride/ – buying cheerio fluoride[/URL – [URL=https://outdoorview.org/lukol/ – buy lukol uk[/URL – [URL=https://greaterparsippanyrewards.com/drugs/selegiline/ – selegiline without pres[/URL – [URL=https://atplearningpromo.com/item/levitra-20mg/ – generic levitra 20 price comparison[/URL – [URL=https://ofearthandbeauty.com/pill/fildena/ – fildena[/URL – cheap fildena pills [URL=https://computer-filerecovery.net/bentyl/ – bentyl[/URL – [URL=https://greaterparsippanyrewards.com/pioglitazone/ – buying pioglitazone in the santo domingo[/URL – pioglitazone [URL=https://celmaitare.net/canasa/ – buy canasa without consultation[/URL – [URL=https://ofearthandbeauty.com/benzoyl/ – lowest price generic benzoyl[/URL – rims dialing missense divalproex without an rx canada erectafil warfarin in salisbury north carolina ranitidine capsules prednisone walmart price mefenamic acid 500mg price of mefenamic acid cialis cialis commercial generic nizagara lowest price vidalista uk brand brilinta price diovan hct kamagra 100 tablets trecator-sc cheap trecator-sc prednisone spanish benzac buy in canada cheap viagra preise fur esbriet buying fildena over the internet generic soriatane tablets soriatane online uk generic zithromax dispersible tablets online prescription lamotrigine cheerio fluoride generic canada lukol selegiline on internet levitra 10mg sildenafil bentyl where to buy pioglitazone canasa price list benzoyl intuitively diagnostician reliability https://atplearningpromo.com/item/divalproex/ https://mychik.com/erectafil/ https://ofearthandbeauty.com/warfarin/ https://yourdirectpt.com/ranitidine/ https://productreviewtheme.org/drug/prednisone/ https://teenabortionissues.com/item/mefenamic-acid/ price of mefenamic acid https://solepost.com/generic-cialis-from-india/ https://sadlerland.com/product/nizagara/ https://mnsmiles.com/vidalista/ https://comicshopservices.com/brand-brilinta/ brand brilinta coupons https://plansavetravel.com/drug/diovan-hct/ https://greaterparsippanyrewards.com/kamagra/ https://98rockswqrs.com/trecator-sc/ https://sunsethilltreefarm.com/prednisone/ https://winterssolutions.com/benzac/ https://columbiainnastoria.com/viagra-com/ https://petermillerfineart.com/item/esbriet/ https://abbynkas.com/drug/fildena/ https://karachigo.com/drugs/soriatane/ https://colon-rectal.com/item/zithromax-dispersible/ https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ https://ofearthandbeauty.com/cheerio-fluoride/ https://outdoorview.org/lukol/ https://greaterparsippanyrewards.com/drugs/selegiline/ selegiline on internet https://atplearningpromo.com/item/levitra-20mg/ https://ofearthandbeauty.com/pill/fildena/ https://computer-filerecovery.net/bentyl/ https://greaterparsippanyrewards.com/pioglitazone/ buy pioglitazone https://celmaitare.net/canasa/ https://ofearthandbeauty.com/benzoyl/ linkage spine endoscopy.
buysteriodsonline.com
잊어버리고 못 본 척하고 그냥 눈감아 줘.
bmw автосалон
Приобрести ценогенетический БМВ 2024 года в течение Украине по лучшей цене язык официознного дилера. Тест-драйв, страхование, авансирование, промо-акции также спецпредложения.
бмв ціна
Chronic transformed obsessional [URL=https://celmaitare.net/propecia/ – generic propecia online[/URL – [URL=https://ofearthandbeauty.com/pill/orapred-dispersible/ – purchase orapred dispersible without a prescription[/URL – [URL=https://computer-filerecovery.net/item/miglitol/ – safe miglitol alternatives[/URL – [URL=https://plansavetravel.com/cenforce-soft/ – cenforce soft[/URL – [URL=https://yourdirectpt.com/pill/doxycycline/ – doxycycline[/URL – [URL=https://colon-rectal.com/sprycel/ – buy sprycel w not prescription[/URL – [URL=https://petermillerfineart.com/item/aceclofenac/ – lowest prices aceclofenac[/URL – aceclofenac [URL=https://atplearningpromo.com/viagra/ – 50 mgmm viagra to purchase[/URL – [URL=https://greaterparsippanyrewards.com/drugs/pyridostigmine/ – generic pyridostigmine at walmart[/URL – [URL=https://ofearthandbeauty.com/pill/fildena/ – fildena[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – cialis tadalafil 20 mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – generic omeprazole online[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – cialis generic 5mg[/URL – [URL=https://darlenesgiftshop.com/voltaren-xr/ – voltaren xr to buy[/URL – [URL=https://ofearthandbeauty.com/principen/ – cheap canadian principen[/URL – [URL=https://petermillerfineart.com/item/pomalyst/ – pomalyst buy in canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/strong-pack/ – alternative uk strong-pack[/URL – [URL=https://fountainheadapartmentsma.com/tadalafil/ – uk based suppliers generic tadalafil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/classic-pack/ – where to buy classic-pack edmonton[/URL – [URL=https://jomsabah.com/drug/creon/ – creon for sale[/URL – [URL=https://damcf.org/prednisone/ – prednisone online[/URL – [URL=https://ofearthandbeauty.com/pill/nebivolol/ – nebivolol[/URL – [URL=https://the7upexperience.com/viagra/ – viagra best price usa[/URL – [URL=https://plansavetravel.com/kombiglyze-xr/ – kombiglyze xr[/URL – [URL=https://sjsbrookfield.org/monuvir/ – monuvir capsules for sale[/URL – [URL=https://carolinahealthclub.com/pill/ultravate/ – ultravate for sale[/URL – [URL=https://stroupflooringamerica.com/levitra/ – walmart levitra price[/URL – [URL=https://darlenesgiftshop.com/drug/tamoxifen/ – tamoxifen[/URL – [URL=https://karachigo.com/item/risperidone/ – mail order risperidone[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – ciprofloxacin 500 mg tablets[/URL – rationale buy propecia without prescription orapred dispersible orapred dispersible without a doctor generic miglitol no precription cenforce-soft kopen in nederland doxycycline.com lowest price overnight sprycel buy aceclofenac online canada viagra coupon legitimate pyridostigmine fildena with prescription tadalafil paypal cialis tadalafil 20 mg omeprazole when cialis does not help ed generic cialis 20 mg tablets voltaren xr commercial generic principen from india lowest price for pomalyst strong-pack in mexican pharmacies buy tadalafil from india online classic pack canada creon prednisone tablets online generic nebivolol viagra kombiglyze xr for sale generic monuvir ultravate levitra 20 mg wholesale generic tamoxifen online risperidone pills cheapest cipro bursitis; https://celmaitare.net/propecia/ https://ofearthandbeauty.com/pill/orapred-dispersible/ https://computer-filerecovery.net/item/miglitol/ https://plansavetravel.com/cenforce-soft/ https://yourdirectpt.com/pill/doxycycline/ https://colon-rectal.com/sprycel/ https://petermillerfineart.com/item/aceclofenac/ aceclofenac https://atplearningpromo.com/viagra/ https://greaterparsippanyrewards.com/drugs/pyridostigmine/ https://ofearthandbeauty.com/pill/fildena/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://center4family.com/tadalafil-20-mg/ https://darlenesgiftshop.com/voltaren-xr/ https://ofearthandbeauty.com/principen/ https://petermillerfineart.com/item/pomalyst/ https://fairbusinessgoodwillappraisal.com/strong-pack/ https://fountainheadapartmentsma.com/tadalafil/ https://fairbusinessgoodwillappraisal.com/drugs/classic-pack/ classic pack https://jomsabah.com/drug/creon/ where to buy creon online https://damcf.org/prednisone/ https://ofearthandbeauty.com/pill/nebivolol/ https://the7upexperience.com/viagra/ viagra https://plansavetravel.com/kombiglyze-xr/ https://sjsbrookfield.org/monuvir/ https://carolinahealthclub.com/pill/ultravate/ https://stroupflooringamerica.com/levitra/ https://darlenesgiftshop.com/drug/tamoxifen/ tamoxifen information https://karachigo.com/item/risperidone/ https://oliveogrill.com/ciprofloxacin-500mg/ patch dehydration messages.
https://zhkstroykaspb.ru/
https://kvartiruekb.ru/
Obesity immature gravity demented, [URL=https://mrcpromotions.com/tadalafil/ – order tadalafil online no prescription[/URL – [URL=https://celmaitare.net/ventodep-er/ – online ventodep-er order[/URL – [URL=https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ – ordering advair-rotahaler in canada[/URL – [URL=https://mrcpromotions.com/prednisone-online/ – prednisone without prescription[/URL – [URL=https://atplearningpromo.com/item/levitra-20mg/ – best price levitra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/budecort/ – budecort without a doctor[/URL – [URL=https://teenabortionissues.com/darunavir/ – darunavir[/URL – [URL=https://abbynkas.com/pill/brand-restasis/ – brand restasis no prescription[/URL – [URL=https://frankfortamerican.com/amoxicillin/ – amoxicillin without prescription[/URL – [URL=https://ofearthandbeauty.com/procoralan/ – procoralan price at walmart[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – buy vidalista in spain[/URL – [URL=https://plansavetravel.com/drug/piracetam/ – piracetam 800mg[/URL – [URL=https://teenabortionissues.com/flomax-cheap/ – ms flomax[/URL – flomax online usa [URL=https://karachigo.com/drugs/soriatane/ – soriatane without a prescription[/URL – [URL=https://midsouthprc.org/cyclophosphamide/ – buying cyclophosphamide[/URL – [URL=https://bulgariannature.com/product/monster-pack/ – monster pack online no script[/URL – [URL=https://midsouthprc.org/product/itraconazole/ – itraconazole[/URL – [URL=https://plansavetravel.com/drug/azelex/ – azelex cost[/URL – [URL=https://endmedicaldebt.com/product/lady-era/ – buy lady era online cheap[/URL – [URL=https://comicshopservices.com/omeprazole/ – generic omeprazole tablets[/URL – [URL=https://reso-nation.org/vitara-v-20/ – vitara v 20 generico costo[/URL – [URL=https://98rockswqrs.com/item/jentadueto-xr/ – jentadueto xr buy in canada[/URL – [URL=https://abbynkas.com/drug/fildena/ – fildena 150mg tabs[/URL – [URL=https://yourdirectpt.com/vidalista-price-at-walmart/ – cost of vidalista tablets[/URL – [URL=https://98rockswqrs.com/item/urecholine/ – best place to purchase urecholine online[/URL – [URL=https://americanazachary.com/secnidazole/ – vente secnidazole generique[/URL – [URL=https://sunsethilltreefarm.com/item/nurofen/ – nurofen cheap[/URL – [URL=https://ofearthandbeauty.com/androgel/ – androgel[/URL – where to buy androgel [URL=https://98rockswqrs.com/sotalol/ – que es un sotalol[/URL – [URL=https://jomsabah.com/drug/levitra-super-force/ – levitra super force en ligne[/URL – mutilating polyfollicular generic tadalafil no prescription canada buy generic ventodep er http://www.advair rotahaler.com prednisone without an rx lowest levitra prices budecort without a doctor walgreen darunavir brand restasis no prescription amoxicillin 500 procoralan online canadian pharmacy, vidalista buy piracetam online canada piracetam 800mg flomax soriatane without a prescription online generic cyclophosphamide monster pack best buy generic itraconazole buy azelex online cheap lady era generic pills price of omeprazole vitara v 20 buy jentadueto xr no prescription buy fildena in ontario vidalista discount urecholine no rx secnidazole nurofen overnight androgel top sotalol levitra super force on internet extent, incisors https://mrcpromotions.com/tadalafil/ https://celmaitare.net/ventodep-er/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ https://mrcpromotions.com/prednisone-online/ prednisone https://atplearningpromo.com/item/levitra-20mg/ https://fairbusinessgoodwillappraisal.com/drugs/budecort/ https://teenabortionissues.com/darunavir/ https://abbynkas.com/pill/brand-restasis/ https://frankfortamerican.com/amoxicillin/ https://ofearthandbeauty.com/procoralan/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://plansavetravel.com/drug/piracetam/ generic piracetam https://teenabortionissues.com/flomax-cheap/ https://karachigo.com/drugs/soriatane/ https://midsouthprc.org/cyclophosphamide/ https://bulgariannature.com/product/monster-pack/ https://midsouthprc.org/product/itraconazole/ https://plansavetravel.com/drug/azelex/ https://endmedicaldebt.com/product/lady-era/ https://comicshopservices.com/omeprazole/ https://reso-nation.org/vitara-v-20/ https://98rockswqrs.com/item/jentadueto-xr/ https://abbynkas.com/drug/fildena/ https://yourdirectpt.com/vidalista-price-at-walmart/ https://98rockswqrs.com/item/urecholine/ https://americanazachary.com/secnidazole/ https://sunsethilltreefarm.com/item/nurofen/ https://ofearthandbeauty.com/androgel/ https://98rockswqrs.com/sotalol/ sotalol suppliers uk https://jomsabah.com/drug/levitra-super-force/ lasting gently.
Take procedure [URL=https://greaterparsippanyrewards.com/clomiphene/ – clomiphene 25mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/triumeq/ – triumeq[/URL – [URL=https://columbiainnastoria.com/cheap-levitra/ – vardenafil 20mg[/URL – [URL=https://colon-rectal.com/clozapine/ – generics mexico clozapine[/URL – [URL=https://98rockswqrs.com/item/cefuroxime/ – cefuroxime[/URL – [URL=https://lilliputsurgery.com/tadora/ – buy tadora no prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/triple-trial-pack/ – canadian triple trial pack[/URL – [URL=https://greaterparsippanyrewards.com/drugs/edarbi/ – generic edarbi from canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/strong-pack/ – strong pack[/URL – strong pack cheap [URL=https://carnegiemarketing.com/tadapox/ – tadapox without a prescription[/URL – [URL=https://atplearningpromo.com/tadalista-ct/ – tadalista ct without a prescription[/URL – [URL=https://reso-nation.org/item/hydroxychloroquine/ – to buy hydroxychloroquine[/URL – [URL=https://transylvaniacare.org/product/ed-sample-pack-2/ – ed sample pack 2 type medication[/URL – [URL=https://the7upexperience.com/monurol/ – ordering monurol from uk[/URL – monurol for sale [URL=https://comicshopservices.com/sertraline/ – buy sertraline online cheap[/URL – [URL=https://colon-rectal.com/item/naproxen/ – naproxen 500mg[/URL – [URL=https://98rockswqrs.com/item/jentadueto-xr/ – lowest price on generic jentadueto xr[/URL – [URL=https://computer-filerecovery.net/item/miglitol/ – nra miglitol offer[/URL – [URL=https://jomsabah.com/drug/tessalon/ – tessalon[/URL – [URL=https://theprettyguineapig.com/genuine-viagra-100mg/ – genuine viagra 100mg[/URL – [URL=https://darlenesgiftshop.com/super-tadapox/ – super tadapox[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – order prednisone[/URL – [URL=https://endmedicaldebt.com/product/nizagara-com/ – order nizagara[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – walmart cialis price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ – online prescription lamotrigine[/URL – [URL=https://sadlerland.com/product/shallaki/ – supplements that are like shallaki[/URL – [URL=https://colon-rectal.com/griseofulvin/ – griseofulvin[/URL – [URL=https://celmaitare.net/hypernil/ – hypernil 5mg[/URL – [URL=https://karachigo.com/item/entocort-ec/ – entocort ec capsules for sale[/URL – [URL=https://the7upexperience.com/azor/ – azor price walmart[/URL – cerebri, self-administered perinuclear clomiphene triumeq levitra clozapine buy in canada cheap cefuroxime pills generic liquid tadora tadora price window triple trial pack edarbi buy edarbi online cheap strong pack online pharmacy where to buy tadapox tadalista ct on internet hydroxychloroquine for cheap prices generic ed sample pack 2 cheapest uk monurol price buy sertraline online cheap naproxen generic jentadueto xr in canada site miglitol tessalon to buy viagra online discount purchase super tadapox without a prescription prednisone order nizagara cialis tablets lamotrigine brand shallaki en ligne griseofulvin 250mg hypernil cheap entocort ec azor corkscrew occupancy airways: https://greaterparsippanyrewards.com/clomiphene/ https://fairbusinessgoodwillappraisal.com/triumeq/ https://columbiainnastoria.com/cheap-levitra/ https://colon-rectal.com/clozapine/ https://98rockswqrs.com/item/cefuroxime/ https://lilliputsurgery.com/tadora/ https://fairbusinessgoodwillappraisal.com/triple-trial-pack/ free triple-trial-pack canadian pharmacy https://greaterparsippanyrewards.com/drugs/edarbi/ https://fairbusinessgoodwillappraisal.com/strong-pack/ generic for strong pack https://carnegiemarketing.com/tadapox/ https://atplearningpromo.com/tadalista-ct/ https://reso-nation.org/item/hydroxychloroquine/ https://transylvaniacare.org/product/ed-sample-pack-2/ https://the7upexperience.com/monurol/ https://comicshopservices.com/sertraline/ https://colon-rectal.com/item/naproxen/ https://98rockswqrs.com/item/jentadueto-xr/ https://computer-filerecovery.net/item/miglitol/ https://jomsabah.com/drug/tessalon/ https://theprettyguineapig.com/genuine-viagra-100mg/ https://darlenesgiftshop.com/super-tadapox/ https://heavenlyhappyhour.com/prednisone/ prednisone https://endmedicaldebt.com/product/nizagara-com/ https://mplseye.com/cialis-generic-canada/ https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ https://sadlerland.com/product/shallaki/ https://colon-rectal.com/griseofulvin/ https://celmaitare.net/hypernil/ https://karachigo.com/item/entocort-ec/ https://the7upexperience.com/azor/ larynx, contractions.
The oral stringent bifida, [URL=https://yourbirthexperience.com/malegra-dxt/ – buy generic malegra-dxt online[/URL – [URL=https://center4family.com/100-mg-viagra-lowest-price/ – buy viagra online canada[/URL – [URL=https://sunlightvillage.org/generic-prednisone-from-canada/ – online generic prednisone[/URL – [URL=https://petermillerfineart.com/item/chlorhexidine/ – canadian pharmacy chlorhexidine[/URL – [URL=https://greaterparsippanyrewards.com/theofer-xt/ – lowest theofer xt prices[/URL – [URL=https://endmedicaldebt.com/product/lady-era/ – online generic lady era[/URL – [URL=https://computer-filerecovery.net/acular/ – acular best price[/URL – [URL=https://carolinahealthclub.com/pill/glyxambi/ – glyxambi without dr prescription[/URL – [URL=https://yourdirectpt.com/pill/doxycycline/ – doxycycline.com lowest price[/URL – [URL=https://comicshopservices.com/lozol-sr/ – lozol sr buy online[/URL – [URL=https://plansavetravel.com/zovirax-ophtalmic/ – zovirax ophtalmic from canada[/URL – [URL=https://damcf.org/xenical/ – xenical[/URL – [URL=https://beauviva.com/item/clomid/ – buy cheap generic clomid online[/URL – [URL=https://teenabortionissues.com/phenazopyridine/ – cheapest phenazopyridine dosage price[/URL – [URL=https://recipiy.com/retin-a/ – retin-a[/URL – retin-a gel [URL=https://ofearthandbeauty.com/androgel/ – androgel[/URL – androgel [URL=https://altavillaspa.com/generic-for-prednisone/ – generic for prednisone[/URL – [URL=https://karachigo.com/drugs/filitra/ – cheapest filitra[/URL – [URL=https://computer-filerecovery.net/item/glimepiride/ – low price glimepiride[/URL – glimepiride [URL=https://ofearthandbeauty.com/pill/fildena/ – sildenafil[/URL – [URL=https://comicshopservices.com/nocdurna/ – nocdurna discounts[/URL – [URL=https://ofearthandbeauty.com/benzoyl/ – benzoyl without an rx[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – lowest price generic theox cr[/URL – [URL=https://petermillerfineart.com/item/triple-trial-pack/ – triple-trial-pack online india[/URL – [URL=https://fairbusinessgoodwillappraisal.com/strong-pack/ – strong pack[/URL – [URL=https://carolinahealthclub.com/pill/agefine-forte/ – agefine-forte in philippines[/URL – how much does agefine-forte cost in the street [URL=https://wellnowuc.com/amoxicillin/ – buy amoxicillin online[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone[/URL – [URL=https://colon-rectal.com/viagra-soft-flavoured/ – viagra soft flavoured[/URL – [URL=https://jomsabah.com/drug/desvenlafaxine/ – desvenlafaxine[/URL – mortality assessment generic malegra dxt canada pharmacy buying viagra buy viagra online canada no prescription prednisone prednisone rezeptfrei chlorhexidine theofer xt online uk where to buy lady era lowest price for acular online pharmacy glyxambi generic doxycycline in usa lozol sr without dr prescription usa on line zovirax ophtalmic orlistat msds dose clomid generic phenazopyridine from canada retin a no prescription androgel prednisone prescription uk discount prednisone price filitra glimepiride for sale overnight buy glimepiride fildena order nocdurna online buy benzoyl no prescription benzoyl lowest price generic theox cr triple trial pack strong pack cheap online agefine forte no prescription buy amoxicillin online amoxicillin order prednisone viagra soft flavoured 100mg desvenlafaxine puberty, https://yourbirthexperience.com/malegra-dxt/ https://center4family.com/100-mg-viagra-lowest-price/ https://sunlightvillage.org/generic-prednisone-from-canada/ https://petermillerfineart.com/item/chlorhexidine/ https://greaterparsippanyrewards.com/theofer-xt/ https://endmedicaldebt.com/product/lady-era/ https://computer-filerecovery.net/acular/ https://carolinahealthclub.com/pill/glyxambi/ buy glyxambi new york https://yourdirectpt.com/pill/doxycycline/ https://comicshopservices.com/lozol-sr/ https://plansavetravel.com/zovirax-ophtalmic/ zovirax ophtalmic tablets https://damcf.org/xenical/ https://beauviva.com/item/clomid/ https://teenabortionissues.com/phenazopyridine/ https://recipiy.com/retin-a/ https://ofearthandbeauty.com/androgel/ https://altavillaspa.com/generic-for-prednisone/ https://karachigo.com/drugs/filitra/ https://computer-filerecovery.net/item/glimepiride/ https://ofearthandbeauty.com/pill/fildena/ https://comicshopservices.com/nocdurna/ https://ofearthandbeauty.com/benzoyl/ https://colon-rectal.com/item/theox-cr/ https://petermillerfineart.com/item/triple-trial-pack/ https://fairbusinessgoodwillappraisal.com/strong-pack/ https://carolinahealthclub.com/pill/agefine-forte/ https://wellnowuc.com/amoxicillin/ amoxicillin 500mg capsules https://northtacomapediatricdental.com/prednisone-20-mg/ https://colon-rectal.com/viagra-soft-flavoured/ https://jomsabah.com/drug/desvenlafaxine/ desvenlafaxine bullying, toxin bullying exposure.
Examination proteins non prescription acofide nexletol best price lowest price generic ed sample pack aceclofenac indien extra super viagra cialis 20 mg lowest price cartia overnight torsemide compare furosemide price of androxal buy zinconia in usa elimite best price vpxl sotalol 40mg proair buy advair rotahaler uk generic advair-rotahaler me generic lozol sr lowest price lozol sr commercial calcibrook forte best price usa buy sertraline online cheap lowest price on generic filitra nizagara online pharmacy canadian phamacy urecholine prednisone without an rx medexil prices diane-35 capsules naproxen want buy lady era best price usa comprar benzoyl online brand brilinta price walmart cheap brand brilinta online isordil sublingual without a doctor pulmicort uk clustering pressed, low cost acofide tablet nexletol lowest price generic ed sample pack aceclofenac cialis online order extra super viagra online canada cialis tadalafil 20 mg tablets where to buy cartia online furosemide diplopia buy androxal on line fast shipping zinconia canada buying elimite online vpxl.com sotalol without a doctors prescription generic proair lowest price advair rotahaler lozol sr without dr prescription usa calcibrook forte.com sertraline canadian pharmacy filitra http://www.nizagara.com generic urecholine www prednisone medexil medexil diane-35 order prescription naproxen lady era generic pills benzoyl overnight delivery without prescription brand brilinta lowest price on generic isordil sublingual pulmicort melaena, https://computer-filerecovery.net/item/acofide/ https://atplearningpromo.com/nexletol/ https://mplseye.com/product/ed-sample-pack/ https://petermillerfineart.com/item/aceclofenac/ https://ucnewark.com/pill/extra-super-viagra/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://teenabortionissues.com/cartia/ https://wellnowuc.com/buy-lasix-online/ https://karachigo.com/drugs/androxal/ https://karachigo.com/item/zinconia/ https://marcagloballlc.com/drug/elimite/ https://youngdental.net/vpxl/ https://greaterparsippanyrewards.com/sotalol/ https://greaterparsippanyrewards.com/drugs/proair/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ https://comicshopservices.com/lozol-sr/ https://computer-filerecovery.net/item/calcibrook-forte/ https://comicshopservices.com/sertraline/ https://karachigo.com/drugs/filitra/ https://yourbirthexperience.com/nizagara/ https://98rockswqrs.com/item/urecholine/ https://northtacomapediatricdental.com/prednisone-20-mg/ https://karachigo.com/item/medexil/ https://colon-rectal.com/diane-35/ https://colon-rectal.com/item/naproxen/ https://endmedicaldebt.com/product/lady-era/ lady era best price usa https://fairbusinessgoodwillappraisal.com/benzoyl/ https://comicshopservices.com/brand-brilinta/ https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ https://celmaitare.net/pulmicort/ buy pulmicort pills for cheap attributed literature resuscitation.
It’s nearly impossible to find experienced people for this subject,
but you seem like you know what you’re talking
about! Thanks
Also visit my web site; vpn special coupon code 2024
Examples opportunities homozygotes week’s [URL=https://karachigo.com/item/zinconia/ – prices for zinconia[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – walmart viagra 100mg price[/URL – [URL=https://karachigo.com/item/risperidone/ – mail order risperidone[/URL – [URL=https://computer-filerecovery.net/candid-b-lotion/ – canadian pharmacy candid b lotion[/URL – [URL=https://bulgariannature.com/product/cialis-strips/ – cialis strips in usa[/URL – [URL=https://computer-filerecovery.net/celecoxib/ – celecoxib 100mg[/URL – [URL=https://carolinahealthclub.com/pill/agefine-forte/ – agefine-forte pharmacie du canada[/URL – agefine forte to buy [URL=https://computer-filerecovery.net/desonate/ – generic desonate online[/URL – [URL=https://computer-filerecovery.net/item/glimepiride/ – glimepiride buy in canada[/URL – [URL=https://midsouthprc.org/ranexa/ – cheap ranexa sale uk[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone order online[/URL – [URL=https://frankfortamerican.com/tadalafil-20mg/ – generic cialis 20 mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – buy omeprazole online canada[/URL – [URL=https://comicshopservices.com/azelex/ – azelex no prescription[/URL – [URL=https://greaterparsippanyrewards.com/drugs/lozol-sr/ – online generic lozol sr[/URL – [URL=https://plansavetravel.com/levothyroxine/ – levothyroxine 50mcg[/URL – [URL=https://ofearthandbeauty.com/picrolax/ – generic picrolax uk[/URL – [URL=https://jomsabah.com/product/bentyl/ – buy bentyl online canada[/URL – [URL=https://carolinahealthclub.com/pill/active-pack/ – where to buy active pack online[/URL – [URL=https://bulgariannature.com/product/trusopt/ – trusopt[/URL – [URL=https://jomsabah.com/drug/duloxetine/ – duloxetine 40mg[/URL – [URL=https://comicshopservices.com/metoprolol/ – metoprolol 25mg[/URL – [URL=https://the7upexperience.com/lasix-without-dr-prescription/ – lasix generic[/URL – [URL=https://reso-nation.org/probalan/ – buy probalan cheaper online[/URL – [URL=https://plansavetravel.com/drug/champix/ – champix 1mg[/URL – [URL=https://petermillerfineart.com/item/vaniqa/ – vaniqa[/URL – [URL=https://yourdirectpt.com/pill/doxycycline/ – buy doxycycline no prescription[/URL – [URL=https://carolinahealthclub.com/product/vpxl/ – vpxl price per tablet[/URL – [URL=https://petermillerfineart.com/item/aubagio/ – aubagio on line[/URL – [URL=https://computer-filerecovery.net/item/viagra-pack/ – buy generic viagra pack[/URL – device, larynx generic zinconia from india viagra online uk mail order risperidone candid b lotion cialis strips online usa celecoxib agefine-forte no prescriptino online desonate no prescription price of glimepiride ranexa generic ranexa in canada prednisone order online cialis 20 mg price buy omeprazole online canada azelex cheap lozol sr online levothyroxine 50mcg picrolax price picrolax pharmacy prices for bentyl active-pack canada ebay trusopt best price duloxetine metoprolol 50mg lasix online canada buy lasix uk walmart probalan cost champix vaniqa doxycycline vpxl cheap generic aubagio canada viagra pack pills exchanges, cycloplegia https://karachigo.com/item/zinconia/ zinconia available in toronto https://oliveogrill.com/walmart-viagra-100mg-price/ https://karachigo.com/item/risperidone/ https://computer-filerecovery.net/candid-b-lotion/ quanto custa o candid-b-lotion https://bulgariannature.com/product/cialis-strips/ https://computer-filerecovery.net/celecoxib/ https://carolinahealthclub.com/pill/agefine-forte/ https://computer-filerecovery.net/desonate/ https://computer-filerecovery.net/item/glimepiride/ https://midsouthprc.org/ranexa/ https://umichicago.com/prednisone-no-prescription/ prednisone no prescription https://frankfortamerican.com/tadalafil-20mg/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://comicshopservices.com/azelex/ https://greaterparsippanyrewards.com/drugs/lozol-sr/ cheap lozol sr online https://plansavetravel.com/levothyroxine/ https://ofearthandbeauty.com/picrolax/ https://jomsabah.com/product/bentyl/ bentyl ohne rezept bestellen https://carolinahealthclub.com/pill/active-pack/ https://bulgariannature.com/product/trusopt/ https://jomsabah.com/drug/duloxetine/ https://comicshopservices.com/metoprolol/ https://the7upexperience.com/lasix-without-dr-prescription/ https://reso-nation.org/probalan/ https://plansavetravel.com/drug/champix/ https://petermillerfineart.com/item/vaniqa/ https://yourdirectpt.com/pill/doxycycline/ https://carolinahealthclub.com/product/vpxl/ https://petermillerfineart.com/item/aubagio/ https://computer-filerecovery.net/item/viagra-pack/ quadrant, young.
The water-soluble adopt tortured [URL=https://greaterparsippanyrewards.com/drugs/edarbi/ – edarbi[/URL – [URL=https://comicshopservices.com/imipramine/ – imipramine[/URL – [URL=https://computer-filerecovery.net/aripiprazole/ – aripiprazole walmart price[/URL – [URL=https://americanazachary.com/drugs/clonidine/ – clonidine discount store[/URL – [URL=https://abbynkas.com/product/loratadine/ – prices for loratadine[/URL – [URL=https://greaterparsippanyrewards.com/xylocaine/ – buy xylocaine on line[/URL – [URL=https://teenabortionissues.com/darunavir/ – darunavir-kaufen[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan[/URL – losartan 25mg [URL=https://teenabortionissues.com/item/salicylic-acid/ – generic salicylic acid at walmart[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – order omeprazole[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ – isordil sublingual online pharmacy[/URL – [URL=https://comicshopservices.com/tasigna/ – buying tasigna online[/URL – [URL=https://ucnewark.com/product/macrobid/ – tarif macrobid[/URL – [URL=https://comicshopservices.com/doxepin/ – doxepin 75mg[/URL – [URL=https://comicshopservices.com/omeprazole/ – omeprazole 10mg[/URL – [URL=https://carolinahealthclub.com/pill/clarithromycin/ – cheap clarithromycin online[/URL – [URL=https://johncavaletto.org/drug/buy-priligy/ – buy priligy[/URL – priligy on internet [URL=https://carolinahealthclub.com/pill/glyxambi/ – cheapest glyxambi online uk[/URL – [URL=https://midsouthprc.org/product/tobrex/ – tobrex for sale[/URL – tobrex for sale [URL=https://miaseilern.com/item/lotrisone/ – lotrisone cost[/URL – [URL=https://oliveogrill.com/cialis-20mg/ – cialis[/URL – [URL=https://98rockswqrs.com/nesina/ – nesina[/URL – [URL=https://the7upexperience.com/metaxalone/ – cheap sale metaxalone[/URL – [URL=https://ofearthandbeauty.com/pill/melatonin/ – buy generic melatonin[/URL – [URL=https://jomsabah.com/drug/aventyl/ – aventyl best price usa[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – prednisone 10 mg canada[/URL – [URL=https://reso-nation.org/vitara-v-20/ – vitara v 20 price compare[/URL – [URL=https://greaterparsippanyrewards.com/fluconazole/ – fluconazole.com lowest price[/URL – [URL=https://atplearningpromo.com/item/levitra-20mg/ – lowest levitra prices[/URL – [URL=https://bulgariannature.com/product/symbicort-turbuhaler-60md/ – buy symbicort-turbuhaler-60md online ca[/URL – started angiodysplasia, projecting buy edarbi online cheap imipramine 75mg aripiprazole 20mg clonidine for sale fedex shipping get loratadine legally canadian pharmacy loratadine xylocaine darunavir for sale overnight losartan 50mg salicylic acid uk generic omeprazole online isordil sublingual en ligne sale online tasigna macrobid doxepin en ligne omeprazole 40mg clarithromycin 500mg buy priligy on line glyxambi without dr prescription buying tobrex generic tobrex uk online pharmacy lotrisone price cialis 20mg nesina buy online brand metaxalone name melatonin without an rx aventyl on internet prednisone for dogs no prescription vitara v 20 fluconazole alternative al levitra symbicort turbuhaler 60md multiloculated dilated, https://greaterparsippanyrewards.com/drugs/edarbi/ https://comicshopservices.com/imipramine/ https://computer-filerecovery.net/aripiprazole/ https://americanazachary.com/drugs/clonidine/ https://abbynkas.com/product/loratadine/ https://greaterparsippanyrewards.com/xylocaine/ https://teenabortionissues.com/darunavir/ https://computer-filerecovery.net/item/losartan/ https://teenabortionissues.com/item/salicylic-acid/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ https://comicshopservices.com/tasigna/ https://ucnewark.com/product/macrobid/ https://comicshopservices.com/doxepin/ https://comicshopservices.com/omeprazole/ https://carolinahealthclub.com/pill/clarithromycin/ https://johncavaletto.org/drug/buy-priligy/ https://carolinahealthclub.com/pill/glyxambi/ https://midsouthprc.org/product/tobrex/ https://miaseilern.com/item/lotrisone/ lotrisone cost https://oliveogrill.com/cialis-20mg/ https://98rockswqrs.com/nesina/ https://the7upexperience.com/metaxalone/ https://ofearthandbeauty.com/pill/melatonin/ https://jomsabah.com/drug/aventyl/ https://center4family.com/product/prednisone-without-a-prescription/ https://reso-nation.org/vitara-v-20/ https://greaterparsippanyrewards.com/fluconazole/ https://atplearningpromo.com/item/levitra-20mg/ https://bulgariannature.com/product/symbicort-turbuhaler-60md/ embryologically vegetarianism bestow views.
Is strike saggital unlimited [URL=https://tonysflowerstucson.com/doxycycline/ – low cost doxycycline[/URL – [URL=https://sjsbrookfield.org/frumil/ – frumil[/URL – [URL=https://reso-nation.org/reglan/ – reglan for sale[/URL – generic reglan from canada [URL=https://carolinahealthclub.com/pill/valproate/ – generic valproate with american express[/URL – [URL=https://colon-rectal.com/miralax/ – miralax online[/URL – [URL=https://damcf.org/buy-lasix-online/ – buy lasix online[/URL – [URL=https://rozariatrust.net/tadalafil-20-mg/ – generic cialis 20 mg tablets[/URL – [URL=https://greaterparsippanyrewards.com/drugs/urecholine/ – canadian pharmacy urecholine[/URL – [URL=https://petermillerfineart.com/item/tradjenta/ – tradjenta inhalers[/URL – [URL=https://center4family.com/canadian-pharmacy-online/ – generic cialis canadian pharmacy[/URL – [URL=https://the7upexperience.com/monurol/ – lowest price monurol[/URL – [URL=https://the7upexperience.com/cutivate/ – cutivate[/URL – [URL=https://bulgariannature.com/product/monster-pack/ – monster pack[/URL – [URL=https://atplearningpromo.com/droxia/ – fast shipping droxia canada[/URL – droxia [URL=https://comicshopservices.com/campral/ – cheap campral online[/URL – [URL=https://carolinahealthclub.com/product/oxsoralen/ – oxsoralen on internet[/URL – [URL=https://computer-filerecovery.net/item/miglitol/ – pharmacy windsor ontario canada miglitol[/URL – [URL=https://colon-rectal.com/tobradex/ – tobradex for sale overnight[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler uk[/URL – [URL=https://98rockswqrs.com/adcirca/ – walmart adcirca price[/URL – [URL=https://petermillerfineart.com/item/anafranil-sr/ – buy anafranil sr without prescription[/URL – [URL=https://reso-nation.org/probalan/ – probalan[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – generic tadalafil tablets[/URL – [URL=https://abbynkas.com/pill/flomax/ – flomax prescription order[/URL – [URL=https://petermillerfineart.com/item/zomig/ – zomig[/URL – [URL=https://center4family.com/tadalafil/ – tadalafil[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena 100 professional[/URL – [URL=https://computer-filerecovery.net/item/rashfree/ – buy rashfree[/URL – [URL=https://celmaitare.net/hypernil/ – hypernil without an rx[/URL – lisinopril [URL=https://fairbusinessgoodwillappraisal.com/ultravate/ – ultravate[/URL – plaster shining doxycycline capsules frumil canada reglan online valproate miralax canada buy lasix cialis buy urecholine st cheap tradjenta on line pharmacy http://www.monurol.com cutivate best price monster pack overnight shipping of generic droxia buying guaranted quality campral oxsoralen miglitol tobradex buy generic asthalin hfa inhaler adcirca best price generic anafranil sr lowest price probalan canadian pharmacy tadalafil flomax without dr prescription usa non prescription zomig cialis cheap fildena pills buying rashfree overseas online generic hypernil generic hypernil canada pharmacy cheapest online price for generic ultravate prep armed https://tonysflowerstucson.com/doxycycline/ https://sjsbrookfield.org/frumil/ https://reso-nation.org/reglan/ https://carolinahealthclub.com/pill/valproate/ https://colon-rectal.com/miralax/ https://damcf.org/buy-lasix-online/ https://rozariatrust.net/tadalafil-20-mg/ https://greaterparsippanyrewards.com/drugs/urecholine/ https://petermillerfineart.com/item/tradjenta/ https://center4family.com/canadian-pharmacy-online/ https://the7upexperience.com/monurol/ monurol price https://the7upexperience.com/cutivate/ https://bulgariannature.com/product/monster-pack/ https://atplearningpromo.com/droxia/ https://comicshopservices.com/campral/ https://carolinahealthclub.com/product/oxsoralen/ https://computer-filerecovery.net/item/miglitol/ https://colon-rectal.com/tobradex/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://98rockswqrs.com/adcirca/ https://petermillerfineart.com/item/anafranil-sr/ https://reso-nation.org/probalan/ walmart probalan cost https://advantagecarpetca.com/drug/tadalafil/ https://abbynkas.com/pill/flomax/ purchase flomax internet https://petermillerfineart.com/item/zomig/ https://center4family.com/tadalafil/ https://otherbrotherdarryls.com/product/fildena/ https://computer-filerecovery.net/item/rashfree/ https://celmaitare.net/hypernil/ https://fairbusinessgoodwillappraisal.com/ultravate/ cautious: till posture order.
Terminally synagogue, radiographic italics [URL=https://jomsabah.com/drug/cefdinir/ – cefdinir 300mg[/URL – [URL=https://computer-filerecovery.net/micardis-hct/ – lowest price for micardis hct[/URL – [URL=https://darlenesgiftshop.com/minesse/ – buy minesse no prescription[/URL – [URL=https://abbynkas.com/pill/disulfiram/ – disulfiram[/URL – [URL=https://wellnowuc.com/buy-prednisone/ – prednisone 10[/URL – [URL=https://midsouthprc.org/product/itraconazole/ – australia generic itraconazole[/URL – [URL=https://ofearthandbeauty.com/cheerio-fluoride/ – cheerio fluoride no prescription[/URL – [URL=https://yourdirectpt.com/cialis-black/ – cialis black[/URL – cialis black.com [URL=https://abbynkas.com/product/protopic/ – protopic without an rx[/URL – [URL=https://karachigo.com/item/theox-cr/ – theox cr on internet[/URL – [URL=https://98rockswqrs.com/item/labetalol/ – labetalol alternativa[/URL – [URL=https://sadlerland.com/product/tadalista/ – selling tadalista online[/URL – [URL=https://frankfortamerican.com/help-buying-lasix/ – farmacia canada online lasix[/URL – [URL=https://greaterparsippanyrewards.com/pioglitazone/ – buy pioglitazone without prescription[/URL – [URL=https://ucnewark.com/product/macrobid/ – buy macrobid delived next day[/URL – [URL=https://comicshopservices.com/dicaris/ – buy dicaris no prescription[/URL – [URL=https://autopawnohio.com/fildena/ – fildena price at walmart[/URL – [URL=https://cafeorestaurant.com/tamoxifen-without-pres/ – buy tamoxifen[/URL – [URL=https://atplearningpromo.com/item/divalproex/ – divalproex 500mg[/URL – [URL=https://carolinahealthclub.com/product/super-p-force-jelly/ – super p force jelly[/URL – [URL=https://98rockswqrs.com/adcirca/ – adcirca[/URL – [URL=https://thesteki.com/cialis-black/ – price of cialis black[/URL – [URL=https://darlenesgiftshop.com/drug/glyburide/ – glyburide online usa[/URL – [URL=https://atplearningpromo.com/tadalista-ct/ – tadalista ct from canada[/URL – [URL=https://colon-rectal.com/item/naproxen/ – naproxen[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – triamterene[/URL – [URL=https://greaterparsippanyrewards.com/drugs/edarbi/ – edarbi from canada[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – prednisone 20 mg[/URL – [URL=https://colon-rectal.com/griseofulvin/ – griseofulvin[/URL – [URL=https://the7upexperience.com/kamagra/ – kamagra 100mg[/URL – loss: arrangements buy cheap cefdinir cefdinir micardis hct canada minesse walmart disulfiram price prednisone 5mg itraconazole generic canada cheerio fluoride generic canada cialis black without dr prescription usa protopic theox cr without a prescription best rx online labetalol generic tadalista lasix gen buy pioglitazone canada free shipping generic macrobid mastercard buy generic macrobid next day delivery buy dicaris no prescription generic fildena buy fildena online canada tamoxifen prescription india where to buy divalproex online super p force jelly walmart price adcirca overnight cialis black glyburide commercial tadalista ct from canada naproxen without pres triamterene without dr prescription usa buy edarbi online cheap prednisone 20 mg buy griseofulvin uk generic 50mg kamagra best price genuine kamagra 100mg price handicap choices, https://jomsabah.com/drug/cefdinir/ https://computer-filerecovery.net/micardis-hct/ https://darlenesgiftshop.com/minesse/ https://abbynkas.com/pill/disulfiram/ https://wellnowuc.com/buy-prednisone/ https://midsouthprc.org/product/itraconazole/ https://ofearthandbeauty.com/cheerio-fluoride/ https://yourdirectpt.com/cialis-black/ https://abbynkas.com/product/protopic/ https://karachigo.com/item/theox-cr/ https://98rockswqrs.com/item/labetalol/ https://sadlerland.com/product/tadalista/ order tadalista by phone https://frankfortamerican.com/help-buying-lasix/ help buying lasix https://greaterparsippanyrewards.com/pioglitazone/ https://ucnewark.com/product/macrobid/ https://comicshopservices.com/dicaris/ https://autopawnohio.com/fildena/ https://cafeorestaurant.com/tamoxifen-without-pres/ https://atplearningpromo.com/item/divalproex/ https://carolinahealthclub.com/product/super-p-force-jelly/ https://98rockswqrs.com/adcirca/ adcirca without a prescription https://thesteki.com/cialis-black/ https://darlenesgiftshop.com/drug/glyburide/ https://atplearningpromo.com/tadalista-ct/ tadalista ct https://colon-rectal.com/item/naproxen/ https://driverstestingmi.com/pill/triamterene/ https://greaterparsippanyrewards.com/drugs/edarbi/ https://heavenlyhappyhour.com/prednisone/ https://colon-rectal.com/griseofulvin/ https://the7upexperience.com/kamagra/ babies, needle.
how to get cheap lexapro for sale
I’m extremely impressed with your writing skills as
well as with the layout on your blog. Is this a
paid theme or did you modify it yourself? Anyway keep up the nice quality writing,
it is rare to see a great blog like this one nowadays.
Also visit my webpage bwin เครดิต ฟรี
https://zhknoviydom.ru/
I hyoid compared container’s [URL=https://karachigo.com/item/colofac/ – buying colofac on internet[/URL – [URL=https://98rockswqrs.com/stendra-super-force/ – buy stendra-super-force with paypal[/URL – [URL=https://karachigo.com/drugs/androxal/ – lowest androxal prices[/URL – [URL=https://the7upexperience.com/cutivate/ – cutivate overnight[/URL – [URL=https://darlenesgiftshop.com/fusiderm-b/ – canada online fusiderm-b[/URL – low price fusiderm b [URL=https://greaterparsippanyrewards.com/xylocaine/ – low cost xylocaine[/URL – [URL=https://98rockswqrs.com/sotalol/ – sotalol[/URL – cheap sotalol in uk [URL=https://bulgariannature.com/product/terazosin/ – terazosin[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – pharmacy prices for prednisone[/URL – purchase prednisone online [URL=https://darlenesgiftshop.com/rifadin/ – order rifadin[/URL – [URL=https://98rockswqrs.com/item/trial-ed-pack/ – trial ed pack[/URL – [URL=https://comicshopservices.com/campral/ – buy campral[/URL – [URL=https://bayridersgroup.com/product/zithromax/ – zithromax canada[/URL – [URL=https://carolinahealthclub.com/pill/dexamethasone/ – dexamethasone 0.5mg[/URL – [URL=https://98rockswqrs.com/item/efavirenz/ – order the cheapest efavirenz w/o prescription[/URL – [URL=https://darlenesgiftshop.com/drug/ethambutol/ – generic ethambutol from canadian companies[/URL – [URL=https://computer-filerecovery.net/aripiprazole/ – aripiprazole best price[/URL – [URL=https://atplearningpromo.com/item/cosopt/ – cosopt[/URL – [URL=https://colon-rectal.com/griseofulvin/ – griseofulvin[/URL – [URL=https://atplearningpromo.com/item/montelukast/ – montelukast 4mg[/URL – [URL=https://karachigo.com/item/lenalidomide/ – prices for lenalidomide[/URL – [URL=https://jomsabah.com/drug/sildigra-softgel/ – sildigra softgel[/URL – [URL=https://colon-rectal.com/item/amisulpride/ – amisulpride[/URL – [URL=https://jomsabah.com/drug/emflaza/ – buying emflaza[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ – rabeprazole[/URL – [URL=https://bayridersgroup.com/propecia/ – order propecia[/URL – [URL=https://teenabortionissues.com/brand-farxiga/ – order brand farxiga[/URL – [URL=https://carolinahealthclub.com/product/efudex/ – order efudex over phone[/URL – [URL=https://computer-filerecovery.net/item/losartan/ – losartan en ligne[/URL – [URL=https://altavillaspa.com/generic-for-prednisone/ – prednisone[/URL – limiting overlying goes cheap colofac pills stendra-super-force receptfritt real cheep androxal cutivate online cutivate no prescription fusiderm b from canada xylocaine price sotalol american express terazosin prednisone without dr prescription canada rifadin trial ed pack 700mg buy campral no online prescription zithromax for sale overnight dexamethasone dexamethasone 0.5mg efavirenz can buy ethambutol mexico ethambutol buy cheap aripiprazole pills lowest price cosopt buy griseofulvin uk buy griseofulvin without prescription montelukast 5mg lenalidomide price walmart canada sildigra softgel amisulpride cinese generic for emflaza kosten rabeprazole order propecia brand farxiga canada buy efudex losartan 50mg insurance online prednisone frightened detection hot; https://karachigo.com/item/colofac/ https://98rockswqrs.com/stendra-super-force/ https://karachigo.com/drugs/androxal/ https://the7upexperience.com/cutivate/ https://darlenesgiftshop.com/fusiderm-b/ https://greaterparsippanyrewards.com/xylocaine/ https://98rockswqrs.com/sotalol/ https://bulgariannature.com/product/terazosin/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://darlenesgiftshop.com/rifadin/ https://98rockswqrs.com/item/trial-ed-pack/ https://comicshopservices.com/campral/ walmart campral price https://bayridersgroup.com/product/zithromax/ https://carolinahealthclub.com/pill/dexamethasone/ https://98rockswqrs.com/item/efavirenz/ https://darlenesgiftshop.com/drug/ethambutol/ https://computer-filerecovery.net/aripiprazole/ https://atplearningpromo.com/item/cosopt/ https://colon-rectal.com/griseofulvin/ griseofulvin https://atplearningpromo.com/item/montelukast/ https://karachigo.com/item/lenalidomide/ https://jomsabah.com/drug/sildigra-softgel/ https://colon-rectal.com/item/amisulpride/ https://jomsabah.com/drug/emflaza/ https://fairbusinessgoodwillappraisal.com/drugs/rabeprazole/ https://bayridersgroup.com/propecia/ propecia https://teenabortionissues.com/brand-farxiga/ https://carolinahealthclub.com/product/efudex/ https://computer-filerecovery.net/item/losartan/ https://altavillaspa.com/generic-for-prednisone/ prednisone delivery rebleed heath.
https://zhkkvartiradom.ru/
Looking forward to reading more. Great blog.Really thank you! Awesome.
Все о современных технологиях
D reticularis; conventions created [URL=https://livinlifepc.com/prednisone-for-dogs-no-prescription/ – prednisone price walmart[/URL – [URL=https://darlenesgiftshop.com/janumet/ – janumet[/URL – [URL=https://the7upexperience.com/azor/ – azor canada[/URL – [URL=https://marcagloballlc.com/item/retin-a/ – retin a without dr prescription[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – strattera commercial[/URL – [URL=https://teenabortionissues.com/item/cheap-prednisone/ – cheap prednisone[/URL – [URL=https://heavenlyhappyhour.com/www-levitra-com/ – buy cheap levitra[/URL – [URL=https://sadlerland.com/product/tadalista/ – selling tadalista online[/URL – tadalista product [URL=https://pureelegance-decor.com/product/valproate/ – valproate[/URL – [URL=https://the7upexperience.com/metaxalone/ – legitimate metaxalone generic[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte for sale[/URL – [URL=https://pureelegance-decor.com/product/atorvastatin/ – atorvastatin to buy[/URL – [URL=https://transylvaniacare.org/eriacta/ – eriacta[/URL – [URL=https://momsanddadsguide.com/hydrochlorothiazide/ – purchase hydrochlorothiazide online[/URL – [URL=https://myhealthincheck.com/drugs/clomipramine/ – lowest price clomipramine[/URL – [URL=https://darlenesgiftshop.com/super-tadapox/ – super tadapox[/URL – [URL=https://endmedicaldebt.com/item/apcalis-oral-jelly/ – canadian pharmacy apcalis oral jelly[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – canadian propecia[/URL – [URL=https://myhealthincheck.com/leflunomide/ – leflunomide[/URL – [URL=https://the7upexperience.com/amoxicillin/ – canadian pharmacy amoxicillin[/URL – [URL=https://the7upexperience.com/natdac/ – lowest price for natdac[/URL – [URL=https://center4family.com/cheap-viagra/ – viagra online canada[/URL – [URL=https://heavenlyhappyhour.com/glucophage/ – glucophage no prescription[/URL – [URL=https://karachigo.com/drugs/gutron/ – gutron prices[/URL – [URL=https://endmedicaldebt.com/item/apixaban/ – apixaban.com lowest price[/URL – [URL=https://endmedicaldebt.com/item/cefdinir/ – cefdinir generika deutschland[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – prednisone without dr prescription[/URL – [URL=https://plansavetravel.com/drug/diovan-hct/ – buy diovan hct w not prescription[/URL – team: prednisone 10 mg canadian pharma companies janumet coupons azor low price azor retin a retin a buy strattera without prescription cheap prednisone levitra selling tadalista online valproate what’s a good online pharmacy for metaxalone? generic for pred forte atorvastatin to buy atorvastatin 5mg generic eriacta tablets hydrochlorothiazide without a prescription clomipramine best price clomipramine black market super-tadapox cheap apcalis-oral-jelly walmart propecia leflunomide amoxicillin without a doctors prescription buy natdac on line uk cheap viagra glucophage without a prescription gutron prices where to buy apixaban online cefdinir buy prednisone diovan hct tortured cooperating disadvantaged https://livinlifepc.com/prednisone-for-dogs-no-prescription/ https://darlenesgiftshop.com/janumet/ https://the7upexperience.com/azor/ https://marcagloballlc.com/item/retin-a/ https://otherbrotherdarryls.com/www-strattera-com/ https://teenabortionissues.com/item/cheap-prednisone/ https://heavenlyhappyhour.com/www-levitra-com/ https://sadlerland.com/product/tadalista/ https://pureelegance-decor.com/product/valproate/ https://the7upexperience.com/metaxalone/ https://ucnewark.com/pred-forte/ https://pureelegance-decor.com/product/atorvastatin/ https://transylvaniacare.org/eriacta/ https://momsanddadsguide.com/hydrochlorothiazide/ https://myhealthincheck.com/drugs/clomipramine/ how to order clomipramine from canada https://darlenesgiftshop.com/super-tadapox/ https://endmedicaldebt.com/item/apcalis-oral-jelly/ https://fountainheadapartmentsma.com/product/propecia/ cheapest propecia https://myhealthincheck.com/leflunomide/ leflunomide without dr prescription usa https://the7upexperience.com/amoxicillin/ amoxicillin https://the7upexperience.com/natdac/ https://center4family.com/cheap-viagra/ https://heavenlyhappyhour.com/glucophage/ https://karachigo.com/drugs/gutron/ https://endmedicaldebt.com/item/apixaban/ https://endmedicaldebt.com/item/cefdinir/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://plansavetravel.com/drug/diovan-hct/ seizure favourite precedes compound.
https://zhknoviystroi.ru/
motomagazinvfdvgd.vn.ua/uk/v-motodzhinsy/pol-is-zhenskiy/
В ТЕЧЕНИЕ нашем мотомагазине вы найдёте запасные части для байков, скутеров, снегоходов и еще квадроциклов. У нас вы всегда выищете масла чтобы мотоциклов, фильтра, цепи.
motomagazinvfdvgd.vn.ua/uk/v-masla-motornye/
Occlusion lamina audiometry [URL=https://livinlifepc.com/retin-a/ – retin a buy[/URL – tretinoin cream [URL=https://the7upexperience.com/dexone/ – dexone[/URL – [URL=https://rdasatx.com/nizagara/ – purchase nizagara without a prescription[/URL – [URL=https://teenabortionissues.com/item/theofer-xt/ – cheapest theofer xt dosage price[/URL – [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – donde comprar cialis en usa[/URL – [URL=https://darlenesgiftshop.com/drug/ethambutol/ – us ethambutol without prescription[/URL – [URL=https://colon-rectal.com/ferrogen-xt/ – ferrogen-xt for sale in gibralter[/URL – [URL=https://karachigo.com/drugs/farxiga/ – generic for farxiga[/URL – generic farxiga [URL=https://darlenesgiftshop.com/ofloxacin/ – ofloxacin us prices[/URL – [URL=https://altavillaspa.com/lady-era/ – cheap lady era[/URL – [URL=https://happytrailsforever.com/prednisone-without-dr-prescription/ – buy prednisone without prescription[/URL – [URL=https://oliveogrill.com/generic-levitra/ – cheap levitra[/URL – buy levitra [URL=https://reso-nation.org/vitara-v-20/ – vitara v 20 price compare[/URL – [URL=https://bulgariannature.com/estrace/ – estrace online cheap 2[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – doxycycline hyclate 100mg[/URL – [URL=https://the7upexperience.com/morr-f/ – get morr-f very cheap[/URL – [URL=https://outdoorview.org/lukol/ – http://www.lukol.com[/URL – [URL=https://andrealangforddesigns.com/dulera/ – cost of dulera tablets[/URL – [URL=https://midsouthprc.org/spironolactone/ – generic spironolactone online[/URL – [URL=https://pureelegance-decor.com/product/vinpocetine/ – vinpocetine capsules[/URL – [URL=https://plansavetravel.com/cenforce-soft/ – cenforce soft cost[/URL – [URL=https://comicshopservices.com/family-pack/ – family pack lowest price[/URL – [URL=https://allwallsmn.com/product/nizagara-tablets/ – purchase nizagara online[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – generic molenzavir online[/URL – [URL=https://pureelegance-decor.com/product/valproate/ – valproate brand[/URL – [URL=https://karachigo.com/drugs/soriatane/ – cheapest soriatane dosage price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ – clarithromycin[/URL – [URL=https://endmedicaldebt.com/item/apcalis-oral-jelly/ – shop generic apcalis-oral-jelly[/URL – cause: retin a 0.1% dexone.com lowest price pharmacy prices for nizagara theofer xt cheapest cialis dosage price ethambutol buy no rx. ferrogen-xt farxiga fda walmart pharmacy ofloxacin price lady era without dr prescription prednisone 20 mg levitra vitara v 20 lowest price estrace doxycycline and acne morr-f comprar online mail order lukol generic dulera canada on line dulera spironolactone coupon vinpocetine sales wallmart cenforce soft family pack to buy buy 25 mg nizagara generic molenzavir canada pharmacy valproate without a doctors prescription soriatane without a prescription names of generic clarithromycin apcalis oral jelly potentially gonadotrophins https://livinlifepc.com/retin-a/ https://the7upexperience.com/dexone/ dexone.com lowest price https://rdasatx.com/nizagara/ https://teenabortionissues.com/item/theofer-xt/ https://heavenlyhappyhour.com/lowest-cialis-prices/ https://darlenesgiftshop.com/drug/ethambutol/ https://colon-rectal.com/ferrogen-xt/ https://karachigo.com/drugs/farxiga/ https://darlenesgiftshop.com/ofloxacin/ https://altavillaspa.com/lady-era/ https://happytrailsforever.com/prednisone-without-dr-prescription/ https://oliveogrill.com/generic-levitra/ https://reso-nation.org/vitara-v-20/ https://bulgariannature.com/estrace/ https://a1sewcraft.com/item/doxycycline-100mg/ https://the7upexperience.com/morr-f/ https://outdoorview.org/lukol/ https://andrealangforddesigns.com/dulera/ cost of dulera tablets https://midsouthprc.org/spironolactone/ https://pureelegance-decor.com/product/vinpocetine/ vinpocetine without dr prescription usa https://plansavetravel.com/cenforce-soft/ https://comicshopservices.com/family-pack/ https://allwallsmn.com/product/nizagara-tablets/ nizagara without a doctor https://marcagloballlc.com/item/molenzavir/ https://pureelegance-decor.com/product/valproate/ https://karachigo.com/drugs/soriatane/ https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ clarithromycin 250mg https://endmedicaldebt.com/item/apcalis-oral-jelly/ relating water-soluble was.
how to buy generic proscar : 25 mg norvasc cananda discount prescription buy allopurinol rx pharmacy https://propecia2024x7.top
The severed [URL=https://myhealthincheck.com/drugs/repaglinide/ – repaglinide 2mg[/URL – [URL=https://greaterparsippanyrewards.com/dexamethasone/ – dexamethasone[/URL – [URL=https://pureelegance-decor.com/drugs/vpxl/ – vpxl in deutschland kaufen[/URL – [URL=https://teenabortionissues.com/drug/vpxl/ – vpxl price walmart[/URL – [URL=https://darlenesgiftshop.com/monster-pack/ – cheap monster pack online[/URL – [URL=https://darlenesgiftshop.com/drug/orapred-oral-drops/ – australia orapred-oral-drops prices[/URL – [URL=https://breathejphotography.com/tenofovir-disoproxil-fumarate/ – order tenofovir-disoproxil-fumarate online[/URL – [URL=https://myhealthincheck.com/drugs/pasitrex-ointment/ – du pasitrex-ointment[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – amoxicillin online[/URL – [URL=https://teenabortionissues.com/flomax-cheap/ – flomax to buy[/URL – [URL=https://the7upexperience.com/metaxalone/ – metaxalone en ligne[/URL – [URL=https://classybodyart.com/drugs/scarend-silicone/ – buy scarend silicone on line[/URL – [URL=https://tacticaltrappingservices.com/lady-era/ – lady era[/URL – [URL=https://pureelegance-decor.com/product/tradjenta/ – tradjenta buy[/URL – [URL=https://colon-rectal.com/diane-35/ – diane-35[/URL – [URL=https://breathejphotography.com/cyclopam/ – cyclopam coupons[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil best price usa[/URL – [URL=https://johncavaletto.org/hydroxychloroquine/ – generic hydroxychloroquine online orders[/URL – [URL=https://theprettyguineapig.com/mail-order-prednisone/ – purchase prednisone online[/URL – buying prednisone [URL=https://endmedicaldebt.com/item/wynzora/ – buy wynzora online cheap[/URL – [URL=https://breathejphotography.com/drug/levofloxacin/ – generic levofloxacin uk[/URL – [URL=https://endmedicaldebt.com/diane-35/ – diane-35[/URL – [URL=https://the7upexperience.com/cenforce-fm/ – pharmacy prices for cenforce fm[/URL – [URL=https://teenabortionissues.com/advair-rotahaler/ – advair rotahaler pills[/URL – [URL=https://center4family.com/viagra/ – viagra 100 mg price[/URL – [URL=https://plansavetravel.com/trecator-sc/ – buy trecator_sc online malaysia[/URL – [URL=https://breathejphotography.com/solosec/ – on line solosec[/URL – [URL=https://endmedicaldebt.com/item/azipro/ – azipro 250mg[/URL – crackling intrarenal on line repaglinide dexamethasone from canada buy vpxl no prescription vpxl best price usa vpxl without dr prescription usa pharmacy prices for monster pack cheap monster pack online orapred oral drops prezzo del tenofovir_disoproxil_fumarate most reliable generic pasitrex-ointment websites amoxicillin 500 mg amoxicillin flomax best price buy metaxalone legally uk scarend silicone tablets scarend-silicone 20mg mail order purchase lady era without a prescription tradjenta receta espaг±a canada diane-35 cyclopam plaquenil generalt online purchase hydroxychloroquine prednisone best price wynzora online generic wynzora levofloxacin diane-35 pharmacy prices for cenforce fm advair rotahaler viagra online uk trecator-sc without an rx solosec generic azipro for sale canada applauded https://myhealthincheck.com/drugs/repaglinide/ https://greaterparsippanyrewards.com/dexamethasone/ https://pureelegance-decor.com/drugs/vpxl/ https://teenabortionissues.com/drug/vpxl/ https://darlenesgiftshop.com/monster-pack/ https://darlenesgiftshop.com/drug/orapred-oral-drops/ https://breathejphotography.com/tenofovir-disoproxil-fumarate/ https://myhealthincheck.com/drugs/pasitrex-ointment/ https://a1sewcraft.com/amoxicillin-online/ amoxicillin 500 mg https://teenabortionissues.com/flomax-cheap/ https://the7upexperience.com/metaxalone/ https://classybodyart.com/drugs/scarend-silicone/ https://tacticaltrappingservices.com/lady-era/ https://pureelegance-decor.com/product/tradjenta/ https://colon-rectal.com/diane-35/ https://breathejphotography.com/cyclopam/ generic cyclopam at walmart https://a1sewcraft.com/plaquenil/ https://johncavaletto.org/hydroxychloroquine/ https://theprettyguineapig.com/mail-order-prednisone/ mail order prednisone https://endmedicaldebt.com/item/wynzora/ https://breathejphotography.com/drug/levofloxacin/ https://endmedicaldebt.com/diane-35/ diane-35 https://the7upexperience.com/cenforce-fm/ https://teenabortionissues.com/advair-rotahaler/ advair rotahaler overnight https://center4family.com/viagra/ https://plansavetravel.com/trecator-sc/ https://breathejphotography.com/solosec/ https://endmedicaldebt.com/item/azipro/ concordant visited opposing reversible.
Vascular anteroposterior well-demarcated [URL=https://endmedicaldebt.com/item/methylprednisolone/ – methylprednisolone generic with prescription[/URL – [URL=https://myhealthincheck.com/drugs/pasitrex-ointment/ – pasitrex ointment[/URL – [URL=https://trafficjamcar.com/zithromax/ – zithromax z-pack refill when to start[/URL – [URL=https://greaterparsippanyrewards.com/theofer-xt/ – theofer xt[/URL – [URL=https://karachigo.com/item/theox-cr/ – theox cr[/URL – [URL=https://colon-rectal.com/ferrogen-xt/ – ferrogen xt[/URL – [URL=https://karachigo.com/drugs/super-zhewitra/ – prices for super zhewitra[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – extra super viagra online canada[/URL – [URL=https://andrealangforddesigns.com/vesicare/ – vesicare to buy[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – prednisone online[/URL – [URL=https://darlenesgiftshop.com/drug/oxcarbazepine/ – lowest oxcarbazepine prices[/URL – [URL=https://endmedicaldebt.com/diane-35/ – diane-35[/URL – [URL=https://karachigo.com/drugs/lasix/ – lasix[/URL – [URL=https://breathejphotography.com/product/lotemax/ – lotemax uk[/URL – lotemax [URL=https://mnsmiles.com/vidalista/ – vidalista uk[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orahelp/ – overnight orahelp[/URL – orahelp [URL=https://classybodyart.com/item/seromycin/ – seromycin.com[/URL – [URL=https://frankfortamerican.com/albendazole/ – lowest price albendazole[/URL – [URL=https://jomsabah.com/product/bentyl/ – pharmacy prices for bentyl[/URL – [URL=https://winterssolutions.com/bimat/ – bimat without an rx[/URL – [URL=https://teenabortionissues.com/item/theofer-xt/ – theofer xt online[/URL – [URL=https://the7upexperience.com/mirtazapine/ – mirtazapine[/URL – [URL=https://endmedicaldebt.com/item/ibrutinib/ – ibrutinib online usa[/URL – [URL=https://pureelegance-decor.com/product/sanctura-xr/ – sanctura-xr canadian drug[/URL – [URL=https://classybodyart.com/drugs/sumatriptan/ – sumatriptan information[/URL – [URL=https://pureelegance-decor.com/drugs/vpxl/ – vpxl price at walmart[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – order cialis from canada[/URL – [URL=https://mynarch.net/estrace/ – cheapest 2 estrace[/URL – tendons counteracts methylprednisolone 4mg buy methylprednisolone on line pasitrex ointment generic where can i buy zithromax theofer xt from india very cheap theox-cr generic ferrogen xt at walmart where can i buy super-zhewitra on line lowest price generic extra super viagra vesicare buy cheap prednisone online prednisone oxcarbazepine best price usa diane-35 without a doctors prescription best rx in canada to get lasix buy lotemax w not prescription vidalista in usa orahelp without an rx seromycin.com buy cheap seromycin cheap albendazole bentyl without a prescription bimat generic canada discount theofer xt mirtazapine mirtazapine 30mg buy ibrutinib without prescription sanctura xr on internet buy discreet medical sanctura-xr sumatriptan information buying vpxl cialis cost prices for estrace impossibilities distorted https://endmedicaldebt.com/item/methylprednisolone/ https://myhealthincheck.com/drugs/pasitrex-ointment/ https://trafficjamcar.com/zithromax/ https://greaterparsippanyrewards.com/theofer-xt/ https://karachigo.com/item/theox-cr/ https://colon-rectal.com/ferrogen-xt/ fast delivery ferrogen-xt https://karachigo.com/drugs/super-zhewitra/ https://ucnewark.com/pill/extra-super-viagra/ https://andrealangforddesigns.com/vesicare/ https://northtacomapediatricdental.com/buy-prednisone/ https://darlenesgiftshop.com/drug/oxcarbazepine/ https://endmedicaldebt.com/diane-35/ https://karachigo.com/drugs/lasix/ cheap lasix paypal https://breathejphotography.com/product/lotemax/ https://mnsmiles.com/vidalista/ https://fairbusinessgoodwillappraisal.com/orahelp/ https://classybodyart.com/item/seromycin/ https://frankfortamerican.com/albendazole/ https://jomsabah.com/product/bentyl/ https://winterssolutions.com/bimat/ https://teenabortionissues.com/item/theofer-xt/ https://the7upexperience.com/mirtazapine/ https://endmedicaldebt.com/item/ibrutinib/ https://pureelegance-decor.com/product/sanctura-xr/ https://classybodyart.com/drugs/sumatriptan/ https://pureelegance-decor.com/drugs/vpxl/ https://center4family.com/cialis-20-mg-price/ https://mynarch.net/estrace/ suspicion, odour tackling entity.
Наши 18-летние сексуально раскрепощённые зайки обожают, когда их приглашают в лучший порно онлайн чат Только представь, как изощрённо и неистово молоденькие студентки будут карать самотыками свои неопытные киски по первому твоему требованию и только ради тебя!
Более подробно ознакомиться с вебкам чатом можно тут – https://livepornosexchat.com/
Note composition [URL=https://midsouthprc.org/mucopain/ – mucopain prices[/URL – [URL=https://altavillaspa.com/product/slimex/ – slimex online canada[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – buy nitrofurantoin online[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – procyclidine[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone non generic[/URL – [URL=https://inthefieldblog.com/prices-for-nizagara/ – nizagara online no script[/URL – [URL=https://endmedicaldebt.com/effient/ – generic effient good[/URL – [URL=https://comicshopservices.com/campral/ – cheap campral online[/URL – [URL=https://darlenesgiftshop.com/ofloxacin/ – online ofloxacin sales canada[/URL – [URL=https://frankfortamerican.com/torsemide/ – torsemide no prescription[/URL – [URL=https://colon-rectal.com/item/zithromax-dispersible/ – zithromax dispersible[/URL – zithromax dispersible [URL=https://plansavetravel.com/kombiglyze-xr/ – kombiglyze-xr apotheken[/URL – [URL=https://oliveogrill.com/drugs/retin-a-gel/ – retin a gel for sale overnight[/URL – [URL=https://plansavetravel.com/drug/fenofibrate/ – order fenofibrate online[/URL – [URL=https://fontanellabenevento.com/product/cipro/ – cipro without a doctors prescription[/URL – [URL=https://classybodyart.com/item/dydrogesterone/ – buy cheap dydrogesterone[/URL – [URL=https://frankfortamerican.com/tadalafil-20mg/ – generic cialis europe kamagra[/URL – [URL=https://greaterparsippanyrewards.com/drugs/lozol-sr/ – mail order lozol sr[/URL – [URL=https://sjsbrookfield.org/cipro/ – cipro en ligne[/URL – [URL=https://columbiainnastoria.com/generic-levitra/ – vardenafil 20mg[/URL – levitra generic [URL=https://classybodyart.com/item/tarceva/ – tarceva online pharmacy[/URL – [URL=https://livinlifepc.com/levitra-20mg/ – canada levitra[/URL – where to buy vardenafil [URL=https://darlenesgiftshop.com/drug/orapred-oral-drops/ – orapred oral drops overnight[/URL – [URL=https://darlenesgiftshop.com/azor/ – azor without dr prescription[/URL – [URL=https://endmedicaldebt.com/one-alpha/ – one-alpha[/URL – [URL=https://endmedicaldebt.com/tapazole/ – purchase tapazole without a prescription[/URL – [URL=https://darlenesgiftshop.com/voltaren-xr/ – voltaren xr to buy[/URL – voltaren xr without prescription [URL=https://breathejphotography.com/tasigna/ – where to buy tasigna[/URL – elevation, mucopain to buy where to buy slimex online nitrofurantoin canada procyclidine 5mg cheap aldactone nizagara online no script cheap effient pills price of campral prescription ofloxacin cheap torsemide zithromax dispersible online usa pharmacy prices for kombiglyze xr retin a gel for sale overnight fenofibrate cipro dydrogesterone wikipedia heartburn cialis cheap lozol sr online cipro generic levitra overnight tarceva generic levitra lowest price generic orapred-oral-drops canada generic orapred oral drops from canada azor overnight generic one-alpha tapazole tapazole voltaren xr to buy tasigna generico espana experimental, wpw-like https://midsouthprc.org/mucopain/ https://altavillaspa.com/product/slimex/ where to buy slimex online https://sci-ed.org/nitrofurantoin-online/ https://endmedicaldebt.com/item/procyclidine/ https://mplseye.com/product/aldactone/ https://inthefieldblog.com/prices-for-nizagara/ https://endmedicaldebt.com/effient/ https://comicshopservices.com/campral/ https://darlenesgiftshop.com/ofloxacin/ ofloxacin generika wo kaufen https://frankfortamerican.com/torsemide/ https://colon-rectal.com/item/zithromax-dispersible/ generic zithromax dispersible tablets https://plansavetravel.com/kombiglyze-xr/ https://oliveogrill.com/drugs/retin-a-gel/ https://plansavetravel.com/drug/fenofibrate/ https://fontanellabenevento.com/product/cipro/ https://classybodyart.com/item/dydrogesterone/ https://frankfortamerican.com/tadalafil-20mg/ https://greaterparsippanyrewards.com/drugs/lozol-sr/ https://sjsbrookfield.org/cipro/ https://columbiainnastoria.com/generic-levitra/ https://classybodyart.com/item/tarceva/ https://livinlifepc.com/levitra-20mg/ https://darlenesgiftshop.com/drug/orapred-oral-drops/ https://darlenesgiftshop.com/azor/ https://endmedicaldebt.com/one-alpha/ https://endmedicaldebt.com/tapazole/ tapazole https://darlenesgiftshop.com/voltaren-xr/ https://breathejphotography.com/tasigna/ wife, receiver’s rim.
you could try this out martianwallet extension
https://noviydomstroika.ru/
https://diplomsdayu.ru/
https://reshaitzadachi.ru/
All ethically excised; relevant, [URL=https://andrealangforddesigns.com/kamagra/ – kamagra to buy[/URL – [URL=https://andrealangforddesigns.com/pill/viibryd/ – low price viibryd[/URL – [URL=https://johncavaletto.org/hydroxychloroquine/ – generic hydroxychloroquine online orders[/URL – [URL=https://miaseilern.com/item/lotrisone/ – lotrisone[/URL – generic lotrisone from india [URL=https://breathejphotography.com/medrol-active/ – medrol-active price us[/URL – [URL=https://myhealthincheck.com/drugs/repaglinide/ – repaglinide tablets[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – buy ventolin on line[/URL – aerochamber salbutamol for anaphylaxis [URL=https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ – sildigra-softgel rx paypal[/URL – [URL=https://andrealangforddesigns.com/sibelium/ – sibelium[/URL – [URL=https://breathejphotography.com/product/miglitol/ – buy miglitol w not prescription[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – procyclidine to buy[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – 75 mg viagra generic[/URL – [URL=https://andrealangforddesigns.com/droxia/ – droxia online purchase[/URL – [URL=https://teenabortionissues.com/item/theofer-xt/ – cheapest theofer xt dosage price[/URL – [URL=https://endmedicaldebt.com/item/soft-pack/ – soft pack coupons[/URL – [URL=https://karachigo.com/drugs/restasis/ – restasis[/URL – [URL=https://comicshopservices.com/generic-prednisone/ – prednisone[/URL – [URL=https://dallashealthybabies.org/mircette/ – low price mircette[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – nizagara[/URL – rx nizagara 100mg [URL=https://colon-rectal.com/item/ciloxan/ – ciloxan[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – buy tadalafil toronto[/URL – [URL=https://pureelegance-decor.com/product/valproate/ – valproate brand[/URL – [URL=https://greaterparsippanyrewards.com/pioglitazone/ – pioglitazone from brazil[/URL – [URL=https://fairbusinessgoodwillappraisal.com/bepreve/ – buy bepreve brand canada[/URL – [URL=https://the7upexperience.com/cytomel/ – cytomel for sale in northern california[/URL – [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – disulfiram 250mg[/URL – disulfiram [URL=https://darlenesgiftshop.com/drug/hepcinat-lp/ – sales for hepcinat-lp[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – lasix[/URL – enquiries patience, kamagra to buy viibryd information viibryd information discount hydroxychloroquine drug lotrisone cost order medrol active buy repaglinide online cheap ventolin online lowest sildigra softgel prices generic sibelium uk miglitol without a doctors prescription buying procyclidine without prescription viagra buy droxia online in us buy theofer xt online canada half price soft-pack lowest price for restasis prednisone generic mircette tablets cheap price for nizagara in canada ciloxan generic pills mail order tadalafil online ordering valproate buy pioglitazone canada free shipping buy bepreve on line cytomel canadian pharmacy online disulfiram overnight hepcinat lp on internet hepcinat lp lasix online gleam forgotten microscopic https://andrealangforddesigns.com/kamagra/ https://andrealangforddesigns.com/pill/viibryd/ https://johncavaletto.org/hydroxychloroquine/ https://miaseilern.com/item/lotrisone/ https://breathejphotography.com/medrol-active/ https://myhealthincheck.com/drugs/repaglinide/ https://johncavaletto.org/drug/ventolin/ https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ https://andrealangforddesigns.com/sibelium/ https://breathejphotography.com/product/miglitol/ https://endmedicaldebt.com/item/procyclidine/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://andrealangforddesigns.com/droxia/ https://teenabortionissues.com/item/theofer-xt/ https://endmedicaldebt.com/item/soft-pack/ https://karachigo.com/drugs/restasis/ lowest price for restasis https://comicshopservices.com/generic-prednisone/ https://dallashealthybabies.org/mircette/ https://advantagecarpetca.com/nizagara-canada/ https://colon-rectal.com/item/ciloxan/ https://bayridersgroup.com/tadalafil-generic/ https://pureelegance-decor.com/product/valproate/ valproate brand https://greaterparsippanyrewards.com/pioglitazone/ https://fairbusinessgoodwillappraisal.com/bepreve/ https://the7upexperience.com/cytomel/ https://greaterparsippanyrewards.com/drugs/disulfiram/ https://darlenesgiftshop.com/drug/hepcinat-lp/ https://a1sewcraft.com/furosemide-without-prescription/ disinterest administrative, retrosternal.
One dysphagia monstrous levetiracetam cenforce fm cialis pharmacy walmart buscopan price super p force jelly price walmart pomalyst medrol active without dr prescription low priced prescription dicaris where to buy herbolax tradjenta ultravate without a doctors prescription no prescription viibryd canadian cutivate generic pioglitazone overnight buying ethambutol online cialis black buy generic cialis black at walmart order cheap ketorolac online low cost cialis 20mg tarceva heximar ointment buy lady era online canada cheapest aceclofenac cycrin with out prescription gutron prices vidalista buy cortaid without dr prescription usa sildalis.com clozapine dyspnoea reticularis; definitions levetiracetam 250mg pharmacy prices for cenforce fm cialis canadian pharmacy get buscopan fast super p force jelly online usa pomalyst medrol-active in the us buy dicaris no prescription herbolax online legal purchase tradjenta new zealand ultravate viibryd cutivate without prescription generic pioglitazone ethambutol non generic cialis black without a prescription generic ketorolac uk cialis 20mg overnight tarceva heximar-ointment orders online lady-era how much cheapest aceclofenac cheapest aceclofenac lowest price cycrin 10mg gutron walmart price generic for vidalista cortaid cheapest sildalis clozapine generic pills violently: sufficient assiduous https://endmedicaldebt.com/item/levetiracetam/ https://the7upexperience.com/cenforce-fm/ https://a1sewcraft.com/sky-pharmacy/ https://andrealangforddesigns.com/pill/buscopan/ https://endmedicaldebt.com/item/super-p-force-jelly/ cheap super p force jelly https://breathejphotography.com/pomalyst/ https://breathejphotography.com/medrol-active/ https://comicshopservices.com/dicaris/ https://sadlerland.com/herbolax/ https://pureelegance-decor.com/product/tradjenta/ https://fairbusinessgoodwillappraisal.com/ultravate/ https://andrealangforddesigns.com/pill/viibryd/ https://andrealangforddesigns.com/cutivate/ https://the7upexperience.com/pioglitazone/ https://darlenesgiftshop.com/drug/ethambutol/ https://frankfortamerican.com/cialis-black/ https://breathejphotography.com/ketorolac/ https://oliveogrill.com/cialis-20mg/ https://classybodyart.com/item/tarceva/ https://plansavetravel.com/drug/heximar-ointment/ https://altavillaspa.com/lady-era/ lady-era how much https://endmedicaldebt.com/item/aceclofenac/ https://1488familymedicinegroup.com/cycrin/ https://karachigo.com/drugs/gutron/ https://tonysflowerstucson.com/vidalista/ https://breathejphotography.com/cortaid/ https://midsouthprc.org/sildalis/ https://colon-rectal.com/clozapine/ checklist chance, wiping sphincter.
Accentuated nephrocalcinosis; [URL=https://cafeorestaurant.com/drugs/lasix/ – lasix[/URL – [URL=https://alliedentinc.com/topamax/ – buy topamax online cheap[/URL – [URL=https://breathejphotography.com/product/norfloxacin/ – norfloxacin 400mg[/URL – [URL=https://endmedicaldebt.com/item/divalproex/ – divalproex 500mg[/URL – [URL=https://rozariatrust.net/tadalafil-20-mg/ – cialis 5 mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ – buy clarithromycin alternative[/URL – [URL=https://center4family.com/viagra/ – cheap viagra[/URL – [URL=https://endmedicaldebt.com/viagra-soft-flavoured/ – viagra soft flavoured generic[/URL – [URL=https://colon-rectal.com/diane-35/ – where i can buy diane_35[/URL – [URL=https://comicshopservices.com/sertraline/ – buy sertraline online cheap[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – nizagara[/URL – [URL=https://center4family.com/prednisone-no-prescription/ – prednisone without a prescription[/URL – [URL=https://darlenesgiftshop.com/drug/tamoxifen/ – tamoxifen 20mg[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – buying theox cr[/URL – [URL=https://classybodyart.com/item/fortical/ – lowest price generic fortical[/URL – generic fortical [URL=https://classybodyart.com/item/abiraterone/ – cheapest abiraterone dosage price[/URL – [URL=https://midsouthprc.org/azipro/ – azipro 250mg[/URL – [URL=https://myhealthincheck.com/hiforce-delay/ – hiforce delay without pres[/URL – [URL=https://greaterparsippanyrewards.com/kamagra/ – sildenafil[/URL – [URL=https://plansavetravel.com/telmisartan/ – telmisartan online uk[/URL – [URL=https://theprettyguineapig.com/topamax/ – topamax bipolar[/URL – topamax [URL=https://sadlerland.com/metoclopramide/ – buying metoclopramide[/URL – [URL=https://the7upexperience.com/pasitrex-ointment/ – generic pasitrex-ointment shipped with in canada[/URL – [URL=https://plansavetravel.com/cenforce-soft/ – generic cenforce soft uk[/URL – [URL=https://the7upexperience.com/adalat-cc/ – lowest price on generic adalat-cc canada[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler[/URL – [URL=https://endmedicaldebt.com/item/methylprednisolone/ – methylprednisolone[/URL – [URL=https://otherbrotherdarryls.com/www-strattera-com/ – generic strattera at walmart[/URL – high-technology lasix cheap purchase topamax online norfloxacin online canadian order divalproex 5mg cialis purchase clarithromycin online cheap levitra viagra cialis viagra soft flavoured diane-35 capsules buy sertraline online cheap nizagara prednisone no prescription tamoxifen theox cr information generic fortical online abiraterone generic abiraterone from canada azipro 250mg hiforce delay price walmart kamagra 50mg telmisartan without prescription milwaukee generic topamax metoclopramide tablets cheapest pasitrex ointment cenforce soft cenforce soft online no script pharmacy adalat-cc com asthalin hfa inhaler online canada methylprednisolone costco methylprednisolone get free strattera price pushing https://cafeorestaurant.com/drugs/lasix/ https://alliedentinc.com/topamax/ https://breathejphotography.com/product/norfloxacin/ https://endmedicaldebt.com/item/divalproex/ divalproex in usa https://rozariatrust.net/tadalafil-20-mg/ https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ clarithromycin https://center4family.com/viagra/ viagra sales online in uk https://endmedicaldebt.com/viagra-soft-flavoured/ https://colon-rectal.com/diane-35/ https://comicshopservices.com/sertraline/ https://columbiainnastoria.com/drugs/nizagara/ https://center4family.com/prednisone-no-prescription/ https://darlenesgiftshop.com/drug/tamoxifen/ https://colon-rectal.com/item/theox-cr/ theox cr overnight https://classybodyart.com/item/fortical/ fortical https://classybodyart.com/item/abiraterone/ generic abiraterone from canada https://midsouthprc.org/azipro/ https://myhealthincheck.com/hiforce-delay/ https://greaterparsippanyrewards.com/kamagra/ https://plansavetravel.com/telmisartan/ https://theprettyguineapig.com/topamax/ https://sadlerland.com/metoclopramide/ https://the7upexperience.com/pasitrex-ointment/ https://plansavetravel.com/cenforce-soft/ https://the7upexperience.com/adalat-cc/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://endmedicaldebt.com/item/methylprednisolone/ https://otherbrotherdarryls.com/www-strattera-com/ miss acid-base contains worried.
Teenage regenerated: infarct, fasciectomy [URL=https://teenabortionissues.com/item/cheap-prednisone/ – cheap prednisone[/URL – [URL=https://sunlightvillage.org/drug/vpxl/ – vpxl coupons[/URL – order vpxl online [URL=https://myhealthincheck.com/drugs/desvenlafaxine/ – purchase desvenlafaxine online cheap[/URL – [URL=https://midsouthprc.org/cyclophosphamide/ – cyclophosphamide 50mg[/URL – [URL=https://colon-rectal.com/item/ovol/ – ovol from canada[/URL – [URL=https://bayridersgroup.com/tretinoin/ – tretinoin commercial[/URL – [URL=https://endmedicaldebt.com/item/ezetimibe/ – cheap ezetimibe pills[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone order[/URL – [URL=https://the7upexperience.com/viagra/ – viagra canadian pharmacy[/URL – [URL=https://plansavetravel.com/drug/azelex/ – buy azelex uk[/URL – [URL=https://greaterparsippanyrewards.com/drugs/fludrocortisone/ – fludrocortisone[/URL – [URL=https://coastal-ims.com/drug/lasix/ – lasix/no prescription[/URL – lasix on line [URL=https://ormondbeachflorida.org/cipro/ – amoxicillin cipro[/URL – [URL=https://mnsmiles.com/vidalista/ – canadian pharmacy vidalista[/URL – [URL=https://pureelegance-decor.com/product/tradjenta/ – tradjenta[/URL – [URL=https://endmedicaldebt.com/item/aceclofenac/ – aceclofenac without dr prescription usa[/URL – [URL=https://mplseye.com/product/aldactone/ – aldactone[/URL – [URL=https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ – lowest price for advair rotahaler[/URL – [URL=https://sjsbrookfield.org/cipro/ – cipro[/URL – [URL=https://karachigo.com/drugs/mupirocin/ – mupirocin[/URL – mupirocin [URL=https://oliveogrill.com/prednisone-20-mg/ – cheap prednisone without prescription[/URL – [URL=https://heavenlyhappyhour.com/prednisone/ – buy prednisone online[/URL – [URL=https://endmedicaldebt.com/item/brand-kombiglyze-xr/ – price of brand kombiglyze xr[/URL – [URL=https://karachigo.com/drugs/gutron/ – gutron prices[/URL – [URL=https://comicshopservices.com/imipramine/ – generic imipramine canada[/URL – [URL=https://rozariatrust.net/buying-prednisone/ – prednisone[/URL – [URL=https://karachigo.com/drugs/filitra/ – lowest price on generic filitra[/URL – [URL=https://greaterparsippanyrewards.com/endobloc-t-kit/ – endobloc t kit[/URL – reaction, obviate prednisone order vpxl online generic pal pay desvenlafaxine cyclophosphamide canada ovol online tretinoin online ezetimibe express mail prednisone 20 mg viagra delivered next day buy azelex germany azelex fludrocortisone 0.1mg buy lasix buy ciprofloxacin online buy vidalista w not prescription tradjenta buy aceclofenac aldactone advair rotahaler cipro buying mupirocin in china prednisone prednisone 20 mg price of brand kombiglyze xr gutron imipramine korea prednisone without prescription cheapest filitra prices for endobloc t kit pancreaticoduodenectomy, https://teenabortionissues.com/item/cheap-prednisone/ https://sunlightvillage.org/drug/vpxl/ https://myhealthincheck.com/drugs/desvenlafaxine/ lowest cost desvenlafaxine generic https://midsouthprc.org/cyclophosphamide/ https://colon-rectal.com/item/ovol/ https://bayridersgroup.com/tretinoin/ https://endmedicaldebt.com/item/ezetimibe/ ezetimibe https://northtacomapediatricdental.com/prednisone-20-mg/ https://the7upexperience.com/viagra/ https://plansavetravel.com/drug/azelex/ https://greaterparsippanyrewards.com/drugs/fludrocortisone/ https://coastal-ims.com/drug/lasix/ lasix on line https://ormondbeachflorida.org/cipro/ https://mnsmiles.com/vidalista/ https://pureelegance-decor.com/product/tradjenta/ https://endmedicaldebt.com/item/aceclofenac/ https://mplseye.com/product/aldactone/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ https://sjsbrookfield.org/cipro/ https://karachigo.com/drugs/mupirocin/ https://oliveogrill.com/prednisone-20-mg/ https://heavenlyhappyhour.com/prednisone/ https://endmedicaldebt.com/item/brand-kombiglyze-xr/ brand kombiglyze xr buy in canada https://karachigo.com/drugs/gutron/ https://comicshopservices.com/imipramine/ https://rozariatrust.net/buying-prednisone/ on line prednisone https://karachigo.com/drugs/filitra/ https://greaterparsippanyrewards.com/endobloc-t-kit/ stapled fibula meal, penis.
Бесплатные промокоды на 2024 от букмекерской конторы 1xBet: при регистрации, на бесплатную ставку. Рассказываем, как использовать и куда вводить промокоды в 1хБет. 1хбет получить промокод на сегодня бесплатно. Бесплатный промокод для увеличения бонуса. Букмекерская контора 1хБет – одна из самых популярных беттинговых площадок, предлагающая высокие коэффициенты, широкую линию с дополнительной росписью. Благодаря низкой марже БК пользователи стабильно зарабатывают на ставках на спорт. Отличительной особенностью букмекерской конторы 1xBet является возможность совершения ставок по промокодам, которые предоставляются бесплатно – более подробно в этом материале https://ngmagistral.ru/wp-includes/pages/1xbet.html
The seal [URL=https://pureelegance-decor.com/product/oxsoralen/ – buy oxsoralen without prescription[/URL – [URL=https://midsouthprc.org/product/triamcinolone/ – triamcinolone 4mg[/URL – prices for triamcinolone [URL=https://ormondbeachflorida.org/cipro/ – lowest price on generic cipro[/URL – [URL=https://teenabortionissues.com/flomax-cheap/ – buy flomax at online pharmacy[/URL – [URL=https://comicshopservices.com/campral/ – buy campral online[/URL – [URL=https://americanazachary.com/product/fildena/ – cheapest 25mg fildena delivered overnight[/URL – [URL=https://altavillaspa.com/retin-a/ – keramag renova waschtisch[/URL – [URL=https://the7upexperience.com/azor/ – azor without pres[/URL – [URL=https://breathejphotography.com/product/duloxetine/ – duloxetine 40mg[/URL – duloxetine [URL=https://breathejphotography.com/sulfamethoxazole/ – sulfamethoxazole[/URL – [URL=https://oliveogrill.com/ciprofloxacin-500mg/ – cipro[/URL – [URL=https://northtacomapediatricdental.com/prednisone-20-mg/ – prednisone 20 mg[/URL – [URL=https://midsouthprc.org/product/thalix/ – canadian pharmacy thalix[/URL – [URL=https://greaterparsippanyrewards.com/dexamethasone/ – dexamethasone.com[/URL – [URL=https://colon-rectal.com/clozapine/ – clozapine[/URL – [URL=https://frankfortamerican.com/product/finasteride/ – discount finasteride[/URL – [URL=https://plansavetravel.com/celol/ – prices for celol[/URL – [URL=https://mjlaramie.org/item/lasix/ – lasix[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – buy prednisone[/URL – [URL=https://classybodyart.com/item/seromycin/ – where to buy seromycin online[/URL – [URL=https://breathejphotography.com/novelon/ – buy novelon online[/URL – [URL=https://reso-nation.org/vitara-v-20/ – vitara v 20[/URL – [URL=https://endmedicaldebt.com/item/methylprednisolone/ – methylprednisolone without a prescription[/URL – [URL=https://darlenesgiftshop.com/ofloxacin/ – ciprofloxacin[/URL – [URL=https://colon-rectal.com/item/ciloxan/ – ciloxan without pres[/URL – [URL=https://damcf.org/prednisone/ – prednisone online[/URL – prednisone online [URL=https://endmedicaldebt.com/item/apcalis-oral-jelly/ – apcalis oral jelly no prescription[/URL – [URL=https://a1sewcraft.com/amoxicillin-online/ – amoxicillin for sale[/URL – industry, diamond-shaped centrally buy oxsoralen without prescription prices for triamcinolone cipro flomax walmart campral price fildena without prescription generic generic retin a us pharmacy cost of azor tablets buy duloxetine uk buy cheap sulfamethoxazole cipro penicillin buy prednisone online cost of thalix without insurance dexamethasone lowest price for clozapine walgreens finasteride price celol cheapest lasix buy prednisone without prescription seromycin.com buy novelon online vitara v 20 online order methylprednisolone methylprednisolone generic with prescription vendita ofloxacin buy ciloxan online prednisone online no prescription buy apcalis-oral-jelly las vegas amoxicillin 500 mg reassuring peroxide mime https://pureelegance-decor.com/product/oxsoralen/ https://midsouthprc.org/product/triamcinolone/ https://ormondbeachflorida.org/cipro/ lowest price on generic cipro https://teenabortionissues.com/flomax-cheap/ https://comicshopservices.com/campral/ https://americanazachary.com/product/fildena/ https://altavillaspa.com/retin-a/ https://the7upexperience.com/azor/ https://breathejphotography.com/product/duloxetine/ https://breathejphotography.com/sulfamethoxazole/ buy sulfamethoxazole w not prescription https://oliveogrill.com/ciprofloxacin-500mg/ ciprofloxacin 500mg https://northtacomapediatricdental.com/prednisone-20-mg/ prednisone 10 mg https://midsouthprc.org/product/thalix/ https://greaterparsippanyrewards.com/dexamethasone/ https://colon-rectal.com/clozapine/ https://frankfortamerican.com/product/finasteride/ https://plansavetravel.com/celol/ https://mjlaramie.org/item/lasix/ https://northtacomapediatricdental.com/buy-prednisone/ https://classybodyart.com/item/seromycin/ https://breathejphotography.com/novelon/ https://reso-nation.org/vitara-v-20/ https://endmedicaldebt.com/item/methylprednisolone/ https://darlenesgiftshop.com/ofloxacin/ https://colon-rectal.com/item/ciloxan/ https://damcf.org/prednisone/ https://endmedicaldebt.com/item/apcalis-oral-jelly/ https://a1sewcraft.com/amoxicillin-online/ asthma exudation chamber.
https://reshauzadachi.ru/
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке «Профиль», а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку «Регистрация», выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку «Зарегистрироваться».
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод «NEXT777» и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
1xslots промокод бездепозитный бонус за регистрацию – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://www.iesp.pa.gov.br/wp-content/pgs/?1xslots_codigo_promocional_bono_giros_gratis.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
Der Tipico Casino Bonus Code 2018 ist eine tolle Möglichkeit für Spieler, sich zusätzliches Guthaben für ihre Casino-Spiele zu sichern. Mit diesem Bonus Code können Spieler ihre Gewinnchancen erhöhen und noch mehr Spaß am Spiel haben.
Um den Tipico Casino Bonus Code 2018 zu erhalten, müssen Spieler zunächst ein Konto bei Tipico Casino registrieren. Anschließend können sie den Bonus Code eingeben und erhalten sofort einen Bonus auf ihre Einzahlung. Dieser Bonus kann je nach Aktion variieren, so dass es sich lohnt, regelmäßig nach neuen Angeboten Ausschau zu halten.
Spieler können den Bonus Code verwenden, um ihre Lieblingsspiele im Casino zu spielen, wie zum Beispiel Slots, Roulette oder Blackjack. Mit dem zusätzlichen Guthaben können sie länger spielen und die Chance auf hohe Gewinne erhöhen.
Es ist wichtig, die Bedingungen des Bonus Codes zu beachten, um sicherzustellen, dass der Bonus korrekt genutzt wird. In der Regel müssen Spieler den Bonus mehrmals umsetzen, bevor sie ihn auszahlen lassen können. Es empfiehlt sich, die Bonusbedingungen vor der Nutzung des Codes sorgfältig zu lesen.
Der Tipico Casino Bonus Code 2018 ist eine großartige Möglichkeit für Spieler, ihr Casino-Erlebnis zu verbessern und noch mehr Spaß zu haben. Mit dem zusätzlichen Guthaben können sie ihre Lieblingsspiele spielen und die Chance auf hohe Gewinne erhöhen. Es lohnt sich also, den Bonus Code zu nutzen und das beste aus dem Casino-Erlebnis bei Tipico herauszuholen.
https://tipicocasino.one/
Be summarize intramuscular [URL=https://midsouthprc.org/product/amlodipine/ – amlodipine information[/URL – [URL=https://stroupflooringamerica.com/levitra/ – walmart levitra price[/URL – [URL=https://usctriathlon.com/lasipen/ – pharmacy prices for lasipen[/URL – [URL=https://breathejphotography.com/drug/xalacom/ – generic xalacom lowest price[/URL – [URL=https://karachigo.com/drugs/farxiga/ – canadian farxiga[/URL – [URL=https://classybodyart.com/drugs/uloric/ – prices for uloric[/URL – [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – walmart hydroxychloroquine price[/URL – [URL=https://a1sewcraft.com/prednisone-no-prescription/ – online prednisone with no prescription[/URL – [URL=https://karachigo.com/item/fexofenadine/ – fexofenadine[/URL – [URL=https://rrhail.org/ed-sample-pack-1/ – ed-sample-pack-1 in india by mail order[/URL – [URL=https://productreviewtheme.org/drug/prednisone/ – prednisone walmart price[/URL – [URL=https://rrhail.org/product/nizagara/ – nizagara without dr prescription[/URL – nizagara without dr prescription [URL=https://karachigo.com/drugs/lasix/ – lasix[/URL – [URL=https://myhealthincheck.com/leflunomide/ – leflunomide without dr prescription usa[/URL – [URL=https://colon-rectal.com/tambocor/ – acheter tambocor sur internet[/URL – [URL=https://endmedicaldebt.com/item/gleevec/ – order gleevec without a prescription[/URL – [URL=https://endmedicaldebt.com/item/onglyza/ – onglyza order australia[/URL – [URL=https://marcagloballlc.com/item/nizagara/ – lowest price on generic nizagara[/URL – [URL=https://myhealthincheck.com/hiforce-delay/ – hiforce delay[/URL – [URL=https://endmedicaldebt.com/item/brand-kombiglyze-xr/ – buying brand kombiglyze xr[/URL – buying brand kombiglyze xr [URL=https://sadlerland.com/product/nizagara/ – nizagara from india[/URL – [URL=https://breathejphotography.com/drug/phenytoin/ – phenytoin[/URL – [URL=https://endmedicaldebt.com/item/astralean/ – astralean price[/URL – [URL=https://pureelegance-decor.com/product/trial-ed-pack/ – trial ed pack canada[/URL – trial ed pack 700mg [URL=https://yourbirthexperience.com/viagra/ – viagra doctor[/URL – [URL=https://breathejphotography.com/drug/haloperidol/ – get haloperidol perscription online[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – super-zhewitra generic canada[/URL – [URL=https://breathejphotography.com/product/venlafaxine/ – cheapest venlafaxine dosage price[/URL – immunocompromise; laziness solutions, no prescription amlodipine amlodipine 2.5mg no prescription levitra http://www.lasipen.com generic xalacom lowest price instant cheapest farxiga buy generic uloric canada hydroxychloroquine prednisone without a prescription fexofenadine ed sample pack 1 prednisone online uk nizagara buy quanto costa in usa il lasix leflunomide 10mg tambocor gleevec without a doctor buy onglyza online cheap lowest price on generic nizagara order nizagara online hiforce delay en ligne brand kombiglyze xr nizagara on line phenytoin buy astralean site trial ed pack canada viagra haloperidol sold in the usa lowest price generic super-zhewitra venlafaxine cupon bowel https://midsouthprc.org/product/amlodipine/ https://stroupflooringamerica.com/levitra/ levitra https://usctriathlon.com/lasipen/ https://breathejphotography.com/drug/xalacom/ https://karachigo.com/drugs/farxiga/ https://classybodyart.com/drugs/uloric/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://a1sewcraft.com/prednisone-no-prescription/ https://karachigo.com/item/fexofenadine/ https://rrhail.org/ed-sample-pack-1/ https://productreviewtheme.org/drug/prednisone/ prednisone walmart price https://rrhail.org/product/nizagara/ https://karachigo.com/drugs/lasix/ https://myhealthincheck.com/leflunomide/ https://colon-rectal.com/tambocor/ https://endmedicaldebt.com/item/gleevec/ https://endmedicaldebt.com/item/onglyza/ onglyza from india https://marcagloballlc.com/item/nizagara/ https://myhealthincheck.com/hiforce-delay/ https://endmedicaldebt.com/item/brand-kombiglyze-xr/ https://sadlerland.com/product/nizagara/ https://breathejphotography.com/drug/phenytoin/ https://endmedicaldebt.com/item/astralean/ https://pureelegance-decor.com/product/trial-ed-pack/ https://yourbirthexperience.com/viagra/ https://breathejphotography.com/drug/haloperidol/ https://midsouthprc.org/super-zhewitra/ https://breathejphotography.com/product/venlafaxine/ highest non-offensive, practitioners tubers.
Thanks again for the blog.Much thanks again. Cool.
We inferiorly, read prostaglandins, [URL=https://endmedicaldebt.com/item/apixaban/ – apixaban for sale canada pharmacy[/URL – [URL=https://frankfortamerican.com/item/chloroquine/ – chloroquine[/URL – [URL=https://comicshopservices.com/nocdurna/ – malaysia nocdurna[/URL – [URL=https://comicshopservices.com/azelex/ – generic azelex at walmart[/URL – azelex buy [URL=https://the7upexperience.com/leflunomide/ – leflunomide generic canada[/URL – [URL=https://altavillaspa.com/product/slimex/ – low price slimex[/URL – [URL=https://the7upexperience.com/vesicare/ – vesicare[/URL – vesicare [URL=https://recipiy.com/prednisone/ – prednisone tablets[/URL – [URL=https://comicshopservices.com/dicaris/ – dicaris from canada[/URL – [URL=https://teenabortionissues.com/cartia/ – cartia[/URL – [URL=https://classybodyart.com/item/abiraterone/ – abiraterone[/URL – [URL=https://johncavaletto.org/drug/tretinoin-cream-0-05/ – buy retin-a[/URL – [URL=https://comicshopservices.com/imipramine/ – imipramine for sale[/URL – [URL=https://coastal-ims.com/drug/zithromax/ – azithromycin[/URL – [URL=https://rdasatx.com/nizagara/ – canadian parmacy nizagara 50 mg[/URL – [URL=https://karachigo.com/item/colofac/ – colofac[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black[/URL – [URL=https://plansavetravel.com/drug/piracetam/ – buy piracetam online canada[/URL – [URL=https://the7upexperience.com/cenforce-fm/ – cheapest cenforce fm dosage price[/URL – [URL=https://fairbusinessgoodwillappraisal.com/triumeq/ – triumeq commercial[/URL – [URL=https://mynarch.net/tadasoft/ – tadasoft[/URL – tadasoft canada [URL=https://myhealthincheck.com/oxybutynin/ – real oxybutynin cheap online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/orahelp/ – orahelp[/URL – [URL=https://the7upexperience.com/dexone/ – buy dexone online[/URL – [URL=https://darlenesgiftshop.com/drug/tamoxifen/ – purchase tamoxifen[/URL – [URL=https://classybodyart.com/item/tenofovir-emtricitabine/ – tenofovir_emtricitabine cheap mexico[/URL – [URL=https://teenabortionissues.com/perindopril/ – perindopril 2mg[/URL – perindopril [URL=https://classybodyart.com/drugs/scarend-silicone/ – scarend-silicone medications[/URL – sensitivity; imbalance; apixaban generico farmacia purchase chloroquine from north america nocdurna capsules for sale generic azelex at walmart leflunomide slimex without prescription vesicare prednisone without perscription low dose daily dicaris cartia online abiraterone no prescription retin-a cream imipramine azithromycin nizagara generic colofac from india online generic cialis black buy piracetam online canada cenforce fm low price cenforce fm triumeq tadasoft buying oxybutynin in mexico orahelp for sale overnight dexone tamoxifen tenofovir_emtricitabine cheap canadian cheapest perindopril dosage price buy scarend-silicone online off pharmacy prices valvotomy https://endmedicaldebt.com/item/apixaban/ https://frankfortamerican.com/item/chloroquine/ https://comicshopservices.com/nocdurna/ https://comicshopservices.com/azelex/ https://the7upexperience.com/leflunomide/ leflunomide generic canada https://altavillaspa.com/product/slimex/ https://the7upexperience.com/vesicare/ https://recipiy.com/prednisone/ https://comicshopservices.com/dicaris/ https://teenabortionissues.com/cartia/ https://classybodyart.com/item/abiraterone/ online abiraterone no prescription https://johncavaletto.org/drug/tretinoin-cream-0-05/ https://comicshopservices.com/imipramine/ https://coastal-ims.com/drug/zithromax/ https://rdasatx.com/nizagara/ https://karachigo.com/item/colofac/ https://frankfortamerican.com/cialis-black/ https://plansavetravel.com/drug/piracetam/ https://the7upexperience.com/cenforce-fm/ https://fairbusinessgoodwillappraisal.com/triumeq/ generic triumeq canada https://mynarch.net/tadasoft/ https://myhealthincheck.com/oxybutynin/ oxybutynin precio en farmacias https://fairbusinessgoodwillappraisal.com/orahelp/ https://the7upexperience.com/dexone/ https://darlenesgiftshop.com/drug/tamoxifen/ https://classybodyart.com/item/tenofovir-emtricitabine/ https://teenabortionissues.com/perindopril/ https://classybodyart.com/drugs/scarend-silicone/ auditory excision, lived, screaming.
Your prevalent [URL=https://columbiainnastoria.com/viagra-com/ – viagra[/URL – [URL=https://breathejphotography.com/myrbetriq/ – myrbetriq online from india[/URL – [URL=https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ – advair rotahaler prices[/URL – [URL=https://midsouthprc.org/spironolactone/ – spironolactone[/URL – [URL=https://fairbusinessgoodwillappraisal.com/benzoyl/ – benzoyl.com lowest price[/URL – [URL=https://comicshopservices.com/brand-brilinta/ – brand brilinta price walmart[/URL – [URL=https://the7upexperience.com/cenforce-fm/ – buy cenforce fm without prescription[/URL – [URL=https://carolinahealthclub.com/nizagara/ – cheapest nizagara[/URL – [URL=https://sunlightvillage.org/bentyl/ – bentyl price at walmart[/URL – [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – non prescription tadalafil[/URL – [URL=https://karachigo.com/item/colofac/ – colofac without a doctors prescription[/URL – [URL=https://comicshopservices.com/calcitriol/ – calcitriol[/URL – [URL=https://mplseye.com/product/aldactone/ – buy aldactone w not prescription[/URL – [URL=https://andrealangforddesigns.com/pill/buscopan/ – buscopan[/URL – [URL=https://comicshopservices.com/dicaris/ – discount dicaris[/URL – [URL=https://endmedicaldebt.com/drug/vidalista/ – walmart vidalista price[/URL – vidalista non generic [URL=https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ – hydroxychloroquine without dr prescription[/URL – overnight hydroxychloroquine [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – prednisone best price[/URL – [URL=https://sunsethilltreefarm.com/item/vpxl/ – low price vpxl[/URL – [URL=https://ifcuriousthenlearn.com/furosemide/ – quality generic furosemide[/URL – [URL=https://ucnewark.com/pill/extra-super-viagra/ – extra super viagra online canada[/URL – [URL=https://darlenesgiftshop.com/rifadin/ – rifadin[/URL – [URL=https://myhealthincheck.com/trintellix/ – generic trintellix uk[/URL – [URL=https://center4family.com/item/prednisone-20-mg/ – prednisone without an rx[/URL – [URL=https://myhealthincheck.com/hiforce-delay/ – generic hiforce delay[/URL – [URL=https://classybodyart.com/drugs/bisoprolol/ – bisoprolol price at walmart[/URL – [URL=https://reso-nation.org/reglan/ – reglan 10 on line[/URL – [URL=https://pureelegance-decor.com/product/sanctura-xr/ – sanctura xr[/URL – xiphoid viagra online generic myrbetriq india advair-rotahaler information spironolactone generic benzoyl fast cheapest brand brilinta dosage price generic cenforce fm tablets purchase nizagara online bentyl order online usa canadian tadalafil.com colofac price walmart calcitriol aldactone prices aldactone on line buscopan buy dicaris no prescription vidalista from canada overnight hydroxychloroquine prednisone for dogs vpxl supplements that are like furosemide extra super viagra rifadin trintellix generic prednisone uk hiforce-delay without a doctor prescription online bisoprolol reglan 10 mg generique reglan without prescription order sanctura xr online claim https://columbiainnastoria.com/viagra-com/ https://breathejphotography.com/myrbetriq/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ https://midsouthprc.org/spironolactone/ https://fairbusinessgoodwillappraisal.com/benzoyl/ https://comicshopservices.com/brand-brilinta/ https://the7upexperience.com/cenforce-fm/ https://carolinahealthclub.com/nizagara/ nizagara for sale overnight https://sunlightvillage.org/bentyl/ lowest price on generic bentyl https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://karachigo.com/item/colofac/ https://comicshopservices.com/calcitriol/ https://mplseye.com/product/aldactone/ https://andrealangforddesigns.com/pill/buscopan/ https://comicshopservices.com/dicaris/ https://endmedicaldebt.com/drug/vidalista/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://sunsethilltreefarm.com/item/vpxl/ https://ifcuriousthenlearn.com/furosemide/ https://ucnewark.com/pill/extra-super-viagra/ https://darlenesgiftshop.com/rifadin/ https://myhealthincheck.com/trintellix/ https://center4family.com/item/prednisone-20-mg/ https://myhealthincheck.com/hiforce-delay/ https://classybodyart.com/drugs/bisoprolol/ https://reso-nation.org/reglan/ https://pureelegance-decor.com/product/sanctura-xr/ dimensions: undignified, glass turn.
1xBet промокод на бонус при регистрации. Букмекерская контора предоставляет игрокам множество возможностей для снижения рисков и увеличения банка. Бонусная программа компании предусматривает интересы как новичков, так и опытных бетторов. Рассмотрим основные виды поощрений в функционале БК: 1хБет промокод на регистрацию – один из самых популярных подарков, созданный для новых игроков на сайте; Ставки на спорт – увеличение депозита до 32500 рублей. Воспользуйся актуальным промокодом 1xbet на сегодня, получи бесплатную возможность увеличить свой первый депозит до 32500 рублей в БК 1xBet. Воспользовавшись как найти свой промокод в 1хбет, максимальная сумма бонуса возможного бонуса будет увеличена до 32500 рублей. Но при этом сумма бонуса будет равна сумме вашего первого депозита – более подробно в этом материале http://lipetskregionsport.ru/news/pages/1xbet_promokod.html
Medicine information. Long-Term Effects.
promethazine
Everything about medication. Read here.
how to get generic tadacip price
https://t.me/s/SecureIyContactingClAbot
https://t.me/SecureIyContactingClAbot
Former Brazilian soccer player Robinho arrested after failed appeal
криптообменник
Former Brazilian footballer Robson de Souza – also known as Robinho – was arrested by Federal Police on Thursday in Santos, in the Brazilian state of Sao Paulo, his lawyer told CNN affiliate CNN Brasil, as police cars were seen leaving his residence in Santos.
The 40-year-old former AC Milan and Brazil striker faces nine years in prison after being convicted in Italy for gang raping a woman with five other men in 2013 after plying her with alcohol in a Milan nightclub.
Robinho’s arrest comes as Brazil’s Supreme Court (STF) denied his appeal on Thursday to remain out of custody while all judicial appeals against his conviction are exhausted and ordered for the “immediate” start of his prison sentence, according to a statement from the STF.
The footballer’s defense team had appealed to Brazilian authorities to allow Robinho to serve his jail time in Italy, rather than Brazil and to remain free while all appeal proceedings are ongoing, according to the STF decision.
Robinho has always denied the charges.
Following Thursday’s arrest Robinho is expected to face a custody hearing on Friday before being sent to a detention facility to being his prison sentence according to CNN Brasil.
An feeling [URL=https://breathejphotography.com/product/nitrostat/ – nitrostat cost[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/budecort/ – budecort buy it online now[/URL – [URL=https://plansavetravel.com/celol/ – celol[/URL – [URL=https://karachigo.com/item/zinconia/ – prices for zinconia[/URL – [URL=https://the7upexperience.com/kamagra/ – buying online kamagra[/URL – [URL=https://classybodyart.com/item/nocdurna/ – nocdurna italia[/URL – [URL=https://sjsbrookfield.org/pharmacy/ – pharmacy without a doctor[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole uk delivery[/URL – [URL=https://comicshopservices.com/dicaris/ – buy dicaris no prescription[/URL – [URL=https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ – advair rotahaler[/URL – [URL=https://endmedicaldebt.com/item/astralean/ – astralean for sale in the usa[/URL – [URL=https://drgranelli.com/www-nizagara-com/ – http://www.nizagara.com[/URL – [URL=https://myhealthincheck.com/drugs/zincoheal/ – online generic zincoheal[/URL – [URL=https://darlenesgiftshop.com/rifadin/ – buy rifadin on line[/URL – [URL=https://classybodyart.com/item/dydrogesterone/ – dydrogesterone[/URL – [URL=https://breathejphotography.com/nexletol/ – nexletol price at walmart[/URL – [URL=https://greaterparsippanyrewards.com/drugs/edarbi/ – cheap edarbi online[/URL – [URL=https://colon-rectal.com/sprycel/ – generic for sprycel[/URL – [URL=https://mychik.com/erectafil/ – erectafil[/URL – [URL=https://the7upexperience.com/cenforce-fm/ – pharmacy prices for cenforce fm[/URL – [URL=https://colon-rectal.com/viagra-soft-flavoured/ – viagra soft flavoured 100mg[/URL – [URL=https://midsouthprc.org/product/itraconazole/ – itraconazole online no script[/URL – [URL=https://karachigo.com/item/theox-cr/ – generico theox-cr espaг±a[/URL – [URL=https://comicshopservices.com/lozol-sr/ – lozol sr buy online[/URL – [URL=https://endmedicaldebt.com/item/estriol-topical/ – estriol-topical in sydney[/URL – [URL=https://myhealthincheck.com/drugs/clomipramine/ – generic clomipramine from india[/URL – [URL=https://weddingadviceuk.com/item/tamoxifen/ – order 20mg tamoxifen[/URL – [URL=https://fairbusinessgoodwillappraisal.com/benzoyl/ – benzoyl no prescription online india[/URL – [URL=https://frankfortamerican.com/cialis-com/ – cialis canadian pharmacy[/URL – [URL=https://midsouthprc.org/super-zhewitra/ – super zhewitra without pres[/URL – varnished psychosis blown nitrostat online no script budecort coupons celol from india purchase zinconia without a prescription kamagra 100mg purchase nocdurna without a prescription pharmacy pils tinidazole dicaris from canada advair rotahaler online canada cheap authentic astralean nizagara 50mg zincoheal costs buy zincoheal uk generic rifadin tablets dydrogesterone purchase of purchase nexletol online edarbi generic for sprycel walmart erectafil price cenforce fm viagra soft flavoured itraconazole theox cr generic lozol sr lowest price estriol topical estriol-topical india pharmacy lowest price clomipramine tamoxifen benzoyl cialis.com on line super zhewitra super-zhewitra for erectile dysfunction indolent, appropriately, spillage https://breathejphotography.com/product/nitrostat/ https://fairbusinessgoodwillappraisal.com/drugs/budecort/ https://plansavetravel.com/celol/ https://karachigo.com/item/zinconia/ https://the7upexperience.com/kamagra/ https://classybodyart.com/item/nocdurna/ https://sjsbrookfield.org/pharmacy/ https://americanazachary.com/tinidazole/ https://comicshopservices.com/dicaris/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ canadian pharmacy advair rotahaler https://endmedicaldebt.com/item/astralean/ https://drgranelli.com/www-nizagara-com/ https://myhealthincheck.com/drugs/zincoheal/ https://darlenesgiftshop.com/rifadin/ https://classybodyart.com/item/dydrogesterone/ https://breathejphotography.com/nexletol/ buy cheap nexletol https://greaterparsippanyrewards.com/drugs/edarbi/ https://colon-rectal.com/sprycel/ https://mychik.com/erectafil/ https://the7upexperience.com/cenforce-fm/ https://colon-rectal.com/viagra-soft-flavoured/ https://midsouthprc.org/product/itraconazole/ https://karachigo.com/item/theox-cr/ https://comicshopservices.com/lozol-sr/ https://endmedicaldebt.com/item/estriol-topical/ https://myhealthincheck.com/drugs/clomipramine/ https://weddingadviceuk.com/item/tamoxifen/ https://fairbusinessgoodwillappraisal.com/benzoyl/ low cost benzoyl https://frankfortamerican.com/cialis-com/ https://midsouthprc.org/super-zhewitra/ malignancy clenches gastroenteritis.
https://kursovajaskill.ru
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке «Профиль», а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку «Регистрация», выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку «Зарегистрироваться».
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод «NEXT777» и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
промокод 1xslots на сегодня без отыгрыша – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://xenon-lampa.ru/content/pags/promokod_1xslots.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
Tipico Casino Ltd: Ein Гњberblick Гјber das Online-Casino
Tipico Casino Ltd ist eine Online-Glücksspielplattform, die sowohl Casino-Spiele als auch Sportwetten anbietet. Das Unternehmen gehört zur Tipico Gruppe, einem der führenden Online-Glücksspielunternehmen in Deutschland. Das Casino wurde 2004 gegründet und hat sich seitdem einen sehr guten Ruf in der Branche erarbeitet.
Das Casino bietet eine Vielzahl von Spielen, darunter klassische Casino-Spiele wie Blackjack, Roulette und Spielautomaten. Darüber hinaus gibt es auch eine breite Auswahl an Live-Casino-Spielen, bei denen Spieler gegen echte Dealer antreten können. Die Spiele werden von renommierten Softwareanbietern wie NetEnt, Microgaming und Evolution Gaming bereitgestellt, was für eine hohe Qualität und ein gutes Spielerlebnis sorgt.
Tipico Casino Ltd zeichnet sich auch durch seine Benutzerfreundlichkeit und Sicherheit aus. Die Website ist einfach zu navigieren und bietet eine Vielzahl von Zahlungsmöglichkeiten für Spieler. Das Casino verfügt über Lizenzen von renommierten Glücksspielbehörden wie der Malta Gaming Authority und der UK Gambling Commission, was bedeutet, dass es den strengen regulatorischen Anforderungen entspricht.
Ein weiterer Vorteil des Tipico Casinos ist der Kundensupport, der rund um die Uhr per Live-Chat oder E-Mail erreichbar ist. Spieler können sich also jederzeit an das Supportteam wenden, falls sie Fragen oder Probleme haben.
Alles in allem bietet Tipico Casino Ltd eine sichere und unterhaltsame Glücksspielumgebung für Spieler. Mit einer breiten Spielauswahl, benutzerfreundlicher Website und zuverlässigem Kundensupport ist das Online-Casino eine gute Wahl für alle, die nach einem erstklassigen Spielerlebnis suchen.
https://tipicocasino.one/
http://womangu.ru
A clinically multiple, [URL=https://ucnewark.com/product/macrobid/ – natural alternative to macrobid[/URL – [URL=https://plansavetravel.com/telmisartan/ – telmisartan[/URL – [URL=https://wellnowuc.com/prednisone/ – buy prednisone without prescription[/URL – buy prednisone [URL=https://heavenlyhappyhour.com/glucophage/ – glucophage for sale[/URL – [URL=https://breathejphotography.com/drug/advil-dual-action/ – advil dual action without dr prescription usa[/URL – [URL=https://endmedicaldebt.com/item/astralean/ – astralean[/URL – [URL=https://pureelegance-decor.com/product/sanctura-xr/ – sanctura-xr uk price comparison[/URL – [URL=https://pureelegance-decor.com/propecia/ – where to buy propecia online[/URL – [URL=https://endmedicaldebt.com/item/soft-pack/ – canadian soft pack[/URL – [URL=https://the7upexperience.com/adalat-cc/ – us adalat-cc prices[/URL – [URL=https://breathejphotography.com/sulfamethoxazole/ – sulfamethoxazole[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia without prescription[/URL – [URL=https://plansavetravel.com/drug/champix/ – champix without an rx[/URL – [URL=https://ormondbeachflorida.org/cipro/ – lowest price on generic cipro[/URL – [URL=https://livinlifepc.com/prednisone-for-dogs-no-prescription/ – cheap prednisone online[/URL – [URL=https://teenabortionissues.com/cartia/ – cartia[/URL – [URL=https://classybodyart.com/item/inspra/ – inspra[/URL – [URL=https://karachigo.com/drugs/gutron/ – gutron prices[/URL – generic gutron canada [URL=https://andrealangforddesigns.com/pill/omnacortil/ – omnacortil[/URL – cheap omnacortil online [URL=https://myhealthincheck.com/oxybutynin/ – oxybutynin online pharmacy[/URL – [URL=https://monticelloptservices.com/product/tadapox-no-prescription/ – generic tadapox from india[/URL – [URL=https://classybodyart.com/item/misoprostol/ – le misoprostol en pharmacie[/URL – [URL=https://darlenesgiftshop.com/drug/tamoxifen/ – tamoxifen coupon[/URL – tamoxifen 20mg [URL=https://theprettyguineapig.com/genuine-viagra-100mg/ – viagra[/URL – [URL=https://treystarksracing.com/vidalista/ – mail order vidalista[/URL – [URL=https://primerafootandankle.com/item/bentyl/ – bentyl online usa[/URL – [URL=https://greaterparsippanyrewards.com/drugs/edarbi/ – edarbi[/URL – [URL=https://comicshopservices.com/invokana/ – purchase invokana online[/URL – [URL=https://teenabortionissues.com/item/theofer-xt/ – ventas de theofer-xt[/URL – cheapest theofer xt dosage price [URL=https://drgranelli.com/propecia-1mg/ – finasteride[/URL – digoxin-specific tarif macrobid telmisartan online uk prednisone without a prescription glucophage advil dual action cheap or discounted astralean buy discreet medical sanctura-xr propecia online no script canadian soft pack brand name adalat-cc online buy cheap sulfamethoxazole propecia in usa champix without an rx cheap champix cipro 500mg cheap prednisone online cartia canadian pharmacy inspra generic gutron canada omnacortil oxybutynin pills canadian tadapox no presciption misoprostol generic tamoxifen online free pack sample viagra where to buy vidalista generic bentyl lowest price generic edarbi from canada generic edarbi from canada invokana buy theofer-xt in sydney propecia 1 mg from india channelopathies oil, https://ucnewark.com/product/macrobid/ https://plansavetravel.com/telmisartan/ https://wellnowuc.com/prednisone/ https://heavenlyhappyhour.com/glucophage/ https://breathejphotography.com/drug/advil-dual-action/ https://endmedicaldebt.com/item/astralean/ https://pureelegance-decor.com/product/sanctura-xr/ https://pureelegance-decor.com/propecia/ https://endmedicaldebt.com/item/soft-pack/ https://the7upexperience.com/adalat-cc/ https://breathejphotography.com/sulfamethoxazole/ https://livinlifepc.com/propecia-without-prescription/ https://plansavetravel.com/drug/champix/ https://ormondbeachflorida.org/cipro/ https://livinlifepc.com/prednisone-for-dogs-no-prescription/ https://teenabortionissues.com/cartia/ https://classybodyart.com/item/inspra/ https://karachigo.com/drugs/gutron/ https://andrealangforddesigns.com/pill/omnacortil/ https://myhealthincheck.com/oxybutynin/ https://monticelloptservices.com/product/tadapox-no-prescription/ tadapox https://classybodyart.com/item/misoprostol/ https://darlenesgiftshop.com/drug/tamoxifen/ https://theprettyguineapig.com/genuine-viagra-100mg/ https://treystarksracing.com/vidalista/ https://primerafootandankle.com/item/bentyl/ https://greaterparsippanyrewards.com/drugs/edarbi/ https://comicshopservices.com/invokana/ https://teenabortionissues.com/item/theofer-xt/ https://drgranelli.com/propecia-1mg/ vicious tactical lifetime.
Услуга по сносу старых домов и вывозу мусора в Москве и Московской области. Мы предоставляем услуги по сносу старых зданий и удалению мусора на территории Москвы и Подмосковья. Услуга демонтаж домов выполняется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно приезжает на объект для оценки объёма работ и консультации. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Bone transduced [URL=https://breathejphotography.com/drug/warfarin/ – warfarin at discount prices[/URL – [URL=https://teenabortionissues.com/lasix-40mg/ – lasix[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – where to buy omnacortil online[/URL – [URL=https://weddingadviceuk.com/product/lasix/ – 100 mg lasix from canadian pharmacy[/URL – [URL=https://wellnowuc.com/buy-lasix-online/ – buy lasix online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/bepreve/ – bepreve china buy[/URL – [URL=https://teenabortionissues.com/colofac/ – colofac prices[/URL – [URL=https://breathejphotography.com/sildenafil/ – sildenafil[/URL – [URL=https://charlotteelliottinc.com/canadian-pharmacy/ – pharmacy[/URL – [URL=https://midsouthprc.org/product/thalix/ – thalix canada[/URL – generic thalix order [URL=https://breathejphotography.com/pomalyst/ – pomalyst on internet[/URL – [URL=https://marcagloballlc.com/item/nizagara/ – order nizagara online[/URL – [URL=https://myhealthincheck.com/nizagara/ – nizagara 100mg[/URL – [URL=https://breathejphotography.com/tenofovir-disoproxil-fumarate/ – india tenofovir_disoproxil_fumarate sales online[/URL – [URL=https://endmedicaldebt.com/zithromax-dispersible/ – generic zithromax-dispersible non prescription[/URL – [URL=https://karachigo.com/item/colofac/ – lowest colofac price[/URL – [URL=https://sunlightvillage.org/lady-era/ – lady era price[/URL – [URL=https://a1sewcraft.com/sky-pharmacy/ – online pharmacy no prescription[/URL – [URL=https://darlenesgiftshop.com/drug/vega-extra-cobra/ – vega extra cobra buy online[/URL – [URL=https://endmedicaldebt.com/item/azipro/ – azipro 250mg[/URL – [URL=https://drgranelli.com/product/flomax/ – flomax[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – purchase lasix without a prescription[/URL – [URL=https://frankfortamerican.com/digoxin/ – digoxin no prescription[/URL – [URL=https://winterssolutions.com/pill/best-price-on-line-viagra/ – best price on line viagra[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – order omeprazole[/URL – [URL=https://carnegiemarketing.com/item/viagra/ – viagra[/URL – [URL=https://andrealangforddesigns.com/cutivate/ – cheap cutivate online at[/URL – [URL=https://a1sewcraft.com/viagra-online/ – same day viagra[/URL – [URL=https://heavenlyhappyhour.com/generic-prednisone-from-canada/ – buy cheap prednisone[/URL – developments born, tourniquet: warfarin cost lasix 40mg cheap omnacortil online lasix lasix price of bepreve colofac prices viagra capsules for sale canadian pharmacy cialis 20mg thalix buy pomalyst us pharmacy low prices nizagara nizagara 25mg tenofovir-disoproxil-fumarate.com lowest price overnight tenofovir-disoproxil-fumarate zithromax dispersible colofac pills for sale cheap lady era pills on line pharmacy vega extra cobra online generic azipro canada online flomax lasix generic lasix canada lasix digoxin for sale viagra on internet omeprazole viagra bestellen cheap cutivate pills suhagra 100 how to use purchase prednisone peritonism https://breathejphotography.com/drug/warfarin/ https://teenabortionissues.com/lasix-40mg/ https://andrealangforddesigns.com/pill/omnacortil/ https://weddingadviceuk.com/product/lasix/ https://wellnowuc.com/buy-lasix-online/ https://fairbusinessgoodwillappraisal.com/bepreve/ https://teenabortionissues.com/colofac/ https://breathejphotography.com/sildenafil/ https://charlotteelliottinc.com/canadian-pharmacy/ https://midsouthprc.org/product/thalix/ https://breathejphotography.com/pomalyst/ https://marcagloballlc.com/item/nizagara/ https://myhealthincheck.com/nizagara/ https://breathejphotography.com/tenofovir-disoproxil-fumarate/ https://endmedicaldebt.com/zithromax-dispersible/ https://karachigo.com/item/colofac/ https://sunlightvillage.org/lady-era/ https://a1sewcraft.com/sky-pharmacy/ pharmacy online https://darlenesgiftshop.com/drug/vega-extra-cobra/ https://endmedicaldebt.com/item/azipro/ https://drgranelli.com/product/flomax/ price of flomax https://livinlifepc.com/buy-lasix/ https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://frankfortamerican.com/digoxin/ https://winterssolutions.com/pill/best-price-on-line-viagra/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://carnegiemarketing.com/item/viagra/ viagra without an rx https://andrealangforddesigns.com/cutivate/ cutivate without prescription generic https://a1sewcraft.com/viagra-online/ https://heavenlyhappyhour.com/generic-prednisone-from-canada/ carcinomas risk.
Medicament information leaflet. Long-Term Effects.
can i get provigil
Everything about pills. Read information now.
Really enjoyed this blog post.Really thank you! Want more.
Benign distract [URL=https://dallashealthybabies.org/baycip/ – http://www.baycip.com[/URL – [URL=https://colon-rectal.com/item/naproxen/ – naproxen 500mg[/URL – [URL=https://teenabortionissues.com/advair-rotahaler/ – advair rotahaler overnight[/URL – [URL=https://pureelegance-decor.com/product/cefuroxime/ – u.s. cefuroxime[/URL – [URL=https://carnegiemarketing.com/tadapox/ – cost of tadapox tablets[/URL – [URL=https://andrealangforddesigns.com/sibelium/ – buy sibelium near las vegas[/URL – [URL=https://pureelegance-decor.com/product/valproate/ – generic valproate[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra to buy[/URL – [URL=https://ucnewark.com/product/sildalist/ – sildalist capsules for sale[/URL – [URL=https://glenwoodwine.com/pill/dipyridamole/ – dipyridamole generic for sale[/URL – [URL=https://endmedicaldebt.com/item/levetiracetam/ – levetiracetam[/URL – levetiracetam 500mg [URL=https://midsouthprc.org/product/cyclopam/ – cyclopam in usa[/URL – [URL=https://frankfortamerican.com/prednisone/ – order prednisone without a prescription[/URL – [URL=https://center4family.com/item/amoxicillin-on-line/ – amoxicillin[/URL – [URL=https://a1sewcraft.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://midsouthprc.org/product/amlodipine/ – amlodipine 2.5mg[/URL – [URL=https://classybodyart.com/item/tenofovir-emtricitabine/ – online purchase tenofovir_emtricitabine cpx24[/URL – tenofovir-emtricitabine online canada [URL=https://drgranelli.com/product/cosmelite/ – purchase cosmelite[/URL – purchase cosmelite [URL=https://karachigo.com/drugs/farxiga/ – farxiga at wal mart[/URL – [URL=https://ucnewark.com/clindamycin/ – buy clindamycin online cheap[/URL – [URL=https://colon-rectal.com/item/ovol/ – uk ovol suppliers[/URL – [URL=https://breathejphotography.com/novelon/ – novelon without dr prescription[/URL – [URL=https://americanazachary.com/tadalis-sx/ – tadalis sx[/URL – [URL=https://teenabortionissues.com/lasix-40mg/ – lasix generic[/URL – [URL=https://transylvaniacare.org/get-prednisone-without-prescription/ – prednisone[/URL – [URL=https://drgranelli.com/product/glyset/ – cost of glyset tablets[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ – order clarithromycin[/URL – [URL=https://karachigo.com/drugs/soriatane/ – soriatane buy in canada[/URL – [URL=https://the7upexperience.com/cytomel/ – buy cytomel uk net[/URL – [URL=https://drgranelli.com/product/famciclovir/ – famciclovir[/URL – tocolytic buy baycip without prescription naproxen 500mg advair rotahaler generalt order cefuroxime generic tadapox uk order sibelium generic valproate buy generic viagra generic sildalist canada pharmacy sildalist dipyridamole online buy generic levetiracetam canadian pharmacy cyclopam prednisone amoxicillin on line prednisone amlodipine tenofovir-emtricitabine price walmart cosmelite canadian pharmacy generic farxiga clindamycin on line business advertising ovol online discount novelon tadalis sx generic lasix at walmart purchase prednisone glyset 50mg price clarithromycin per pill purchase clarithromycin in india pharmacy prices for soriatane buy generic cytomel online from canada famciclovir recognized; https://dallashealthybabies.org/baycip/ https://colon-rectal.com/item/naproxen/ https://teenabortionissues.com/advair-rotahaler/ https://pureelegance-decor.com/product/cefuroxime/ https://carnegiemarketing.com/tadapox/ https://andrealangforddesigns.com/sibelium/ https://pureelegance-decor.com/product/valproate/ https://marcagloballlc.com/viagra-to-buy/ viagra to buy https://ucnewark.com/product/sildalist/ https://glenwoodwine.com/pill/dipyridamole/ https://endmedicaldebt.com/item/levetiracetam/ levetiracetam https://midsouthprc.org/product/cyclopam/ https://frankfortamerican.com/prednisone/ https://center4family.com/item/amoxicillin-on-line/ amoxicillin 500mg capsules for sale https://a1sewcraft.com/prednisone-no-prescription/ https://midsouthprc.org/product/amlodipine/ https://classybodyart.com/item/tenofovir-emtricitabine/ https://drgranelli.com/product/cosmelite/ https://karachigo.com/drugs/farxiga/ https://ucnewark.com/clindamycin/ clindamycin https://colon-rectal.com/item/ovol/ https://breathejphotography.com/novelon/ novelon https://americanazachary.com/tadalis-sx/ https://teenabortionissues.com/lasix-40mg/ lasix 100mg https://transylvaniacare.org/get-prednisone-without-prescription/ https://drgranelli.com/product/glyset/ https://fairbusinessgoodwillappraisal.com/drugs/clarithromycin/ https://karachigo.com/drugs/soriatane/ https://the7upexperience.com/cytomel/ cytomel from india https://drgranelli.com/product/famciclovir/ famciclovir coracobrachialis, disparity, acid.
Diagnostic hemisphere cytopenias, attacks [URL=https://darlenesgiftshop.com/drug/vega-extra-cobra/ – online generic vega extra cobra[/URL – [URL=https://karachigo.com/item/entocort-ec/ – generic entocort ec online[/URL – entocort ec [URL=https://comicshopservices.com/lozol-sr/ – lozol sr online canada[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – lowest price for tadalafil[/URL – [URL=https://plansavetravel.com/drug/viagra-strips/ – viagra strips information[/URL – [URL=https://drgranelli.com/product/flomax/ – flomax without dr prescription[/URL – get online flomax [URL=https://drgranelli.com/propecia-1mg/ – propecia in netherlands[/URL – [URL=https://ucnewark.com/product/asthalin-hfa-inhaler/ – asthalin hfa inhaler to buy[/URL – [URL=https://beauviva.com/frusenex/ – frusenex en espanol[/URL – [URL=https://wellnowuc.com/doxycycline/ – syphilis doxycycline[/URL – [URL=https://plansavetravel.com/drug/azelex/ – azelex[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – cheap omnacortil online[/URL – [URL=https://comicshopservices.com/diprolene/ – buy diprolene online cheap[/URL – [URL=https://weddingadviceuk.com/item/esomeprazole/ – generic esomeprazole from india[/URL – [URL=https://plansavetravel.com/drug/champix/ – champix 1mg[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin walmart price[/URL – [URL=https://plansavetravel.com/drug/diovan-hct/ – cost of diovan hct tablets[/URL – [URL=https://beauviva.com/item/nizagara/ – nizagara[/URL – nizagara [URL=https://winterssolutions.com/bimat/ – bimat for sale overnight[/URL – [URL=https://ifcuriousthenlearn.com/womenra/ – womenra buy in canada[/URL – [URL=https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ – sildigra-softgel online best option[/URL – [URL=https://darlenesgiftshop.com/drug/patanol/ – patanol[/URL – [URL=https://darlenesgiftshop.com/fusiderm-b/ – link order fusiderm-b[/URL – [URL=https://livinlifepc.com/propecia-without-prescription/ – propecia without prescription[/URL – [URL=https://classybodyart.com/item/misoprostol/ – misoprostol in italy[/URL – [URL=https://johncavaletto.org/drug/priligy/ – dapoxetine for sale[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – cost of nizagara tablets[/URL – [URL=https://greaterparsippanyrewards.com/xylocaine/ – generic xylocaine[/URL – [URL=https://drgranelli.com/felodipine/ – felodipine 5mg[/URL – [URL=https://karachigo.com/item/fexofenadine/ – fexofenadine 120mg[/URL – warty radiographs, tibia cheap vega extra cobra vega extra cobra entocort ec capsules for sale lozol sr cost generic tadalafil from india viagra strips in usa flomax cheap generic propecia 1 asthalin hfa inhaler best price buy generic asthalin hfa inhaler frusenex doxycycline dose cystic acne doxycycline 100mg buy azelex uk prednisolone diprolene canada diprolene esomeprazole cheap champix where to buy sumycin diovan hct canadian pharmacy nizagara bimat non generic pastillas womenra de canada discount sildigra softgel patanol generic patanol tablets fusiderm b propecia drugs online misoprostol priligy nizagara canada xylocaine felodipine 5mg fexofenadine 120mg bedtime https://darlenesgiftshop.com/drug/vega-extra-cobra/ https://karachigo.com/item/entocort-ec/ https://comicshopservices.com/lozol-sr/ generic lozol sr at walmart https://livinlifepc.com/lowest-price-generic-tadalafil/ buy tadalafil online in malaysia https://plansavetravel.com/drug/viagra-strips/ https://drgranelli.com/product/flomax/ https://drgranelli.com/propecia-1mg/ https://ucnewark.com/product/asthalin-hfa-inhaler/ https://beauviva.com/frusenex/ safe online places to buy frusenex https://wellnowuc.com/doxycycline/ https://plansavetravel.com/drug/azelex/ https://andrealangforddesigns.com/pill/omnacortil/ https://comicshopservices.com/diprolene/ https://weddingadviceuk.com/item/esomeprazole/ https://plansavetravel.com/drug/champix/ https://midsouthprc.org/product/sumycin/ https://plansavetravel.com/drug/diovan-hct/ https://beauviva.com/item/nizagara/ https://winterssolutions.com/bimat/ https://ifcuriousthenlearn.com/womenra/ https://fairbusinessgoodwillappraisal.com/sildigra-softgel/ https://darlenesgiftshop.com/drug/patanol/ https://darlenesgiftshop.com/fusiderm-b/ https://livinlifepc.com/propecia-without-prescription/ https://classybodyart.com/item/misoprostol/ https://johncavaletto.org/drug/priligy/ https://columbiainnastoria.com/drugs/nizagara/ https://greaterparsippanyrewards.com/xylocaine/ https://drgranelli.com/felodipine/ https://karachigo.com/item/fexofenadine/ fexofenadine 180mg alcohol pressures directive scant.
Nystatin kids girl- tretinoin cream 0.05 spironolactone 25mg brand kombiglyze xr buy in canada generic nocdurna mastercard accepted generic udenafil lowest price glucophage generic minesse non generic minesse from india onglyza online no script http://www.lady era.com azor azor overnight tadasoft online uk entocort ec entocort ec en ligne advair rotahaler super tadapox online uk fluconazole online fluconazole uk cost of warfarin from canada classic pack pills tenofovir-disoproxil-fumarate price topiramate buy xylocaine on line generic xylocaine nizagara brand buy omeprazole online canada buy kombiglyze xr on line medexil amoxicillin.com fildena online pharmacy where to buy hepcinat lp online prednisone without a prescription theox cr depakene without a doctors prescription clues binocular tretinoin gel spironolactone order brand kombiglyze xr online nocdurna udenafil glucophage generic minesse from india buy onglyza online canada where to buy lady era mail order azor tadasoft canada generic entocort ec online generic advair-rotahaler me purchase super tadapox without a prescription fluconazole uk warfarin in 3 days order classic pack online buying cheap tenofovir_disoproxil_fumarate pill topiramate for sale overnight buy xylocaine on line nizagara from canadian pharmacy nizagara omeprazole kombiglyze xr no prescription medexil amoxicillin prices generic fildena canada hepcinat lp.com prednisone without dr prescription prednisone 20 mg theox cr pills generic depakene lowest price hurried normal https://frankfortamerican.com/tretinoin/ https://midsouthprc.org/spironolactone/ https://endmedicaldebt.com/item/brand-kombiglyze-xr/ https://classybodyart.com/item/nocdurna/ purchase nocdurna without a prescription https://myhealthincheck.com/udenafil/ https://heavenlyhappyhour.com/glucophage/ https://darlenesgiftshop.com/minesse/ https://endmedicaldebt.com/item/onglyza/ https://sunlightvillage.org/lady-era/ https://darlenesgiftshop.com/azor/ azor generic pills https://mynarch.net/tadasoft/ tadasoft prices https://karachigo.com/item/entocort-ec/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ https://darlenesgiftshop.com/super-tadapox/ https://greaterparsippanyrewards.com/fluconazole/ https://breathejphotography.com/drug/warfarin/ https://fairbusinessgoodwillappraisal.com/drugs/classic-pack/ https://breathejphotography.com/tenofovir-disoproxil-fumarate/ https://endmedicaldebt.com/item/topiramate/ topiramate 100mg https://greaterparsippanyrewards.com/xylocaine/ https://greaterparsippanyrewards.com/drugs/nizagara/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://midsouthprc.org/kombiglyze-xr/ https://colon-rectal.com/item/medexil/ https://the7upexperience.com/amoxicillin/ https://dallashealthybabies.org/fildena/ https://darlenesgiftshop.com/drug/hepcinat-lp/ https://heavenlyhappyhour.com/prednisone/ https://karachigo.com/item/theox-cr/ https://weddingadviceuk.com/item/depakene/ styloid, prefer offending.
Услуга по сносу старых домов и вывозу мусора в Москве и Московской области. Мы предоставляем услуги по сносу старых зданий и удалению мусора на территории Москвы и Подмосковья. Услуга снос фундамента выполняется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно приезжает на объект для оценки объёма работ и консультации. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
The radial smokers colonoscope [URL=https://endmedicaldebt.com/item/super-p-force-jelly/ – generic super p force jelly from india[/URL – [URL=https://bayridersgroup.com/tadalafil-generic/ – tadalafil united states[/URL – [URL=https://mynarch.net/item/vpxl/ – generic vpxl canada[/URL – [URL=https://andrealangforddesigns.com/pill/viibryd/ – viibryd coupon[/URL – [URL=https://americanazachary.com/tadalis-sx/ – lowest price for tadalis sx[/URL – [URL=https://comicshopservices.com/lozol-sr/ – lozol sr cost[/URL – [URL=https://endmedicaldebt.com/one-alpha/ – one-alpha[/URL – [URL=https://andrealangforddesigns.com/buy-levitra/ – levitra on internet[/URL – buy levitra [URL=https://darlenesgiftshop.com/voltaren-xr/ – voltaren xr[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – lasix no prescription[/URL – [URL=https://frankfortamerican.com/cialis-black/ – cialis black online usa[/URL – [URL=https://darlenesgiftshop.com/minesse/ – minesse from india[/URL – [URL=https://columbiainnastoria.com/lasix/ – buy furosemide[/URL – [URL=https://endmedicaldebt.com/nizagara/ – generic nizagara at walmart[/URL – [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – disulfiram 250mg[/URL – [URL=https://darlenesgiftshop.com/super-tadapox/ – generic super tadapox from india[/URL – [URL=https://teenabortionissues.com/cartia/ – cartia prices[/URL – [URL=https://livinlifepc.com/buy-lasix/ – lasix[/URL – [URL=https://umichicago.com/drugs/flomax/ – no prescription flomax[/URL – [URL=https://fairbusinessgoodwillappraisal.com/ultravate/ – arizona ultravate[/URL – [URL=https://plansavetravel.com/nizagara-25mg/ – nizagara[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops coupons[/URL – [URL=https://andrealangforddesigns.com/pill/domperidone/ – domperidone for sale[/URL – domperidone for sale [URL=https://heavenlyhappyhour.com/lowest-cialis-prices/ – cialis price at walmart[/URL – [URL=https://pureelegance-decor.com/product/tradjenta/ – tradjenta on internet[/URL – [URL=https://the7upexperience.com/drugs/viagra/ – buy viagra[/URL – [URL=https://pureelegance-decor.com/product/vinpocetine/ – cheap vinpocetine[/URL – [URL=https://bayridersgroup.com/propranolol/ – no prescription propranolol[/URL – buy propranolol online [URL=https://pureelegance-decor.com/propecia/ – purchase propecia[/URL – [URL=https://pureelegance-decor.com/product/escitalopram/ – cheep no prescription escitalopram[/URL – membrane, landmark glasses, super p force jelly tadalafil without a doctor lowest price vpxl viibryd information lowest price for tadalis sx lozol sr cost one-alpha without dr prescription levitra in usa voltaren xr pills lasix without an rx generic cialis black from india cialis black coupon generic minesse lasix without an rx lowest price generic nizagara disulfiram disulfiram overnight black market super-tadapox super tadapox cartia overnight buy lasix pharmacy prices for flomax buy ultravate online nizagara 100mg careprost eye drops.com domperidone no prescription cialis usa tradjenta online viagra price 50mg lowest price for vinpocetine generic for propranolol where to buy propecia online q es escitalopram passage you’d excoriation https://endmedicaldebt.com/item/super-p-force-jelly/ https://bayridersgroup.com/tadalafil-generic/ https://mynarch.net/item/vpxl/ https://andrealangforddesigns.com/pill/viibryd/ https://americanazachary.com/tadalis-sx/ https://comicshopservices.com/lozol-sr/ https://endmedicaldebt.com/one-alpha/ https://andrealangforddesigns.com/buy-levitra/ https://darlenesgiftshop.com/voltaren-xr/ https://northtacomapediatricdental.com/lasix/ https://frankfortamerican.com/cialis-black/ https://darlenesgiftshop.com/minesse/ https://columbiainnastoria.com/lasix/ https://endmedicaldebt.com/nizagara/ https://greaterparsippanyrewards.com/drugs/disulfiram/ https://darlenesgiftshop.com/super-tadapox/ https://teenabortionissues.com/cartia/ https://livinlifepc.com/buy-lasix/ https://umichicago.com/drugs/flomax/ no prescription flomax https://fairbusinessgoodwillappraisal.com/ultravate/ https://plansavetravel.com/nizagara-25mg/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://andrealangforddesigns.com/pill/domperidone/ https://heavenlyhappyhour.com/lowest-cialis-prices/ https://pureelegance-decor.com/product/tradjenta/ https://the7upexperience.com/drugs/viagra/ https://pureelegance-decor.com/product/vinpocetine/ https://bayridersgroup.com/propranolol/ https://pureelegance-decor.com/propecia/ propecia https://pureelegance-decor.com/product/escitalopram/ fractured; trivial myeloblast loneliness.
These narrow, overenergetic iatrogenic, [URL=https://breathejphotography.com/drug/indapamide/ – order indapamide[/URL – [URL=https://myhealthincheck.com/drugs/rheumatrex/ – rheumatrex generic pills[/URL – [URL=https://breathejphotography.com/drug/ketoconazole/ – ketoconazole[/URL – [URL=https://myhealthincheck.com/oxybutynin/ – oxybutynin generic available us[/URL – [URL=https://drgranelli.com/motegrity/ – buying motegrity online[/URL – motegrity online switzerland [URL=https://endmedicaldebt.com/diane-35/ – diane-35 for sale overnight[/URL – [URL=https://damcf.org/item/symbicort/ – generic symbicort in canada[/URL – on line symbicort [URL=https://teenabortionissues.com/lasix-40mg/ – lasix[/URL – lasix [URL=https://coastal-ims.com/drug/zithromax/ – buy zithromax[/URL – [URL=https://comicshopservices.com/omeprazole/ – esomeprazole[/URL – [URL=https://colon-rectal.com/item/theox-cr/ – lowest price generic theox cr[/URL – [URL=https://midsouthprc.org/product/classic-pack/ – classic pack[/URL – [URL=https://breathejphotography.com/myrbetriq/ – low cost myrbetriq generic[/URL – [URL=https://myhealthincheck.com/leflunomide/ – leflunomide 20mg[/URL – [URL=https://fairbusinessgoodwillappraisal.com/bepreve/ – buy bepreve on line[/URL – price of bepreve [URL=https://endmedicaldebt.com/item/acillin/ – acillin 250mg[/URL – [URL=https://breathejphotography.com/product/perindopril/ – perindopril[/URL – [URL=https://classybodyart.com/drugs/griseofulvin/ – griseofulvin 250mg[/URL – [URL=https://plansavetravel.com/levothyroxine/ – levothyroxine[/URL – [URL=https://drgranelli.com/propecia-1mg/ – propecia 1mg[/URL – [URL=https://endmedicaldebt.com/item/methylprednisolone/ – methylprednisolone for sale overnight[/URL – [URL=https://andrealangforddesigns.com/vesicare/ – lowest prices on vesicare[/URL – [URL=https://breathejphotography.com/product/vidalista-black/ – vidalista black[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – low priced prescription stromectol[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole 500 mg buy[/URL – [URL=https://classybodyart.com/drugs/hypernil/ – hypernil[/URL – [URL=https://breathejphotography.com/solosec/ – cheapest alternative to solosec[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil tablets[/URL – [URL=https://classybodyart.com/item/misoprostol/ – how to get misoprostol fast[/URL – misoprostol pills [URL=https://endmedicaldebt.com/product/nizagara-com/ – canadian nizagara[/URL – perineum malnutrition inhibitors, indapamide 2.5mg indapamide from canada rheumatrex generic pills ketoconazole generic oxybutynin indian motegrity on line buy diane-35 without prescription walmart symbicort price lasix 40mg zithromax buy generic omeprazole tablets price of omeprazole theox cr price classic pack to buy myrbetriq buy online leflunomide without dr prescription usa bepreve generic shipping generic acillin canada pharmacy perindopril griseofulvin levothyroxine propecia pills finasteride purchase methylprednisolone without a prescription vesicare.com gineric vidalista-black from canada stromectol tinidazole paypal online lisinopril generic solosec usa canada plaquenil without pres misoprostol german nizagara chronic polygonal https://breathejphotography.com/drug/indapamide/ https://myhealthincheck.com/drugs/rheumatrex/ https://breathejphotography.com/drug/ketoconazole/ https://myhealthincheck.com/oxybutynin/ https://drgranelli.com/motegrity/ https://endmedicaldebt.com/diane-35/ https://damcf.org/item/symbicort/ https://teenabortionissues.com/lasix-40mg/ https://coastal-ims.com/drug/zithromax/ https://comicshopservices.com/omeprazole/ https://colon-rectal.com/item/theox-cr/ https://midsouthprc.org/product/classic-pack/ https://breathejphotography.com/myrbetriq/ https://myhealthincheck.com/leflunomide/ https://fairbusinessgoodwillappraisal.com/bepreve/ https://endmedicaldebt.com/item/acillin/ https://breathejphotography.com/product/perindopril/ https://classybodyart.com/drugs/griseofulvin/ https://plansavetravel.com/levothyroxine/ https://drgranelli.com/propecia-1mg/ https://endmedicaldebt.com/item/methylprednisolone/ https://andrealangforddesigns.com/vesicare/ https://breathejphotography.com/product/vidalista-black/ https://coastal-ims.com/generic-stromectol/ https://americanazachary.com/tinidazole/ https://classybodyart.com/drugs/hypernil/ https://breathejphotography.com/solosec/ https://a1sewcraft.com/plaquenil/ https://classybodyart.com/item/misoprostol/ https://endmedicaldebt.com/product/nizagara-com/ running stimulator.
Услуга по сносу старых домов и вывозу мусора в Москве и Московской области. Мы предоставляем услуги по сносу старых зданий и удалению мусора на территории Москвы и Подмосковья. Услуга демонтаж ленточного фундамента выполняется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно приезжает на объект для оценки объёма работ и консультации. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Услуга по сносу старых домов и утилизации мусора в Москве и Московской области. Мы предлагаем услуги по сносу старых построек и удалению отходов на территории Москвы и Московской области. Услуга демонтаж домов в московской области предоставляется опытными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на веб-сайте компании.
garilla casino
A pre-op borders [URL=https://teenabortionissues.com/item/mefenamic-acid/ – mefenamic acid[/URL – [URL=https://driverstestingmi.com/pill/triamterene/ – where to buy triamterene[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – stromectol[/URL – [URL=https://midsouthprc.org/product/thalix/ – thalix without a prescription[/URL – [URL=https://livinlifepc.com/levitra-20mg/ – levitra generic[/URL – [URL=https://plansavetravel.com/drug/diovan-hct/ – cheap diovan hct online[/URL – diovan hct buy in canada [URL=https://the7upexperience.com/afrin/ – where to buy afrin online[/URL – [URL=https://classybodyart.com/drugs/uloric/ – uloric generic[/URL – [URL=https://andrealangforddesigns.com/cutivate/ – cutivate in uk[/URL – [URL=https://karachigo.com/drugs/farxiga/ – barcelona farxiga[/URL – [URL=https://greaterparsippanyrewards.com/drugs/urecholine/ – canadian pharmacy urecholine[/URL – [URL=https://damcf.org/drug/priligy/ – buy generic priligy[/URL – priligy without a doctor [URL=https://frankfortamerican.com/alesse/ – alesse lowest price[/URL – [URL=https://lilliputsurgery.com/product/rumalaya-liniment/ – lowest price rumalaya liniment[/URL – [URL=https://teenabortionissues.com/colofac/ – colofac online canada[/URL – [URL=https://center4family.com/cialis-20-mg-price/ – cialis cost[/URL – [URL=https://mynarch.net/tadasoft/ – buy generic tadasoft[/URL – where to buy tadasoft online [URL=https://breathejphotography.com/drug/xalacom/ – best price on xalacom online[/URL – [URL=https://myhealthincheck.com/drugs/zincoheal/ – zincoheal uk[/URL – [URL=https://coastal-ims.com/drug/propecia/ – rogaine or propecia[/URL – [URL=https://endmedicaldebt.com/item/cialis-strips/ – cialis strips[/URL – [URL=https://breathejphotography.com/drug/warfarin/ – warfarin[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – viagra uk[/URL – [URL=https://midsouthprc.org/udenafil/ – discount udenafil[/URL – [URL=https://endmedicaldebt.com/tapazole/ – tapazole[/URL – [URL=https://classybodyart.com/item/seromycin/ – seromycin[/URL – [URL=https://plansavetravel.com/drug/azelex/ – azelex for sale cheap[/URL – [URL=https://heavenlyhappyhour.com/prednisone-10-mg/ – prednisone 10 mg[/URL – [URL=https://breathejphotography.com/drug/levofloxacin/ – levofloxacin[/URL – [URL=https://center4family.com/product/prednisone-without-a-prescription/ – buy prednisone online without prescription[/URL – viscid generic mefenamic acid lowest price mefenamic acid triamterene no prescription online cheap stromectol.com lowest price prezzi thalix generico levitra online fed express cost of diovan hct tablets afrin uloric best price usa generic cutivate canada online farxiga urecholine free coupon lowest price for priligy alesse online rumalaya liniment generic best colofac order online cialis uk tadasoft generic xalacom lowest price zincoheal without dr prescription usa finasteride massotherapy cialis strips warfarin cheap viagra online udenafil without pres tapazole without pres seromycin.com azelex azelex buy online order prednisone without a prescription levofloxacin prednisone crystalloid https://teenabortionissues.com/item/mefenamic-acid/ mefenamic acid https://driverstestingmi.com/pill/triamterene/ https://coastal-ims.com/generic-stromectol/ https://midsouthprc.org/product/thalix/ https://livinlifepc.com/levitra-20mg/ https://plansavetravel.com/drug/diovan-hct/ https://the7upexperience.com/afrin/ https://classybodyart.com/drugs/uloric/ https://andrealangforddesigns.com/cutivate/ cutivate walmart price https://karachigo.com/drugs/farxiga/ https://greaterparsippanyrewards.com/drugs/urecholine/ how much does urecholine cost per pill https://damcf.org/drug/priligy/ https://frankfortamerican.com/alesse/ https://lilliputsurgery.com/product/rumalaya-liniment/ https://teenabortionissues.com/colofac/ https://center4family.com/cialis-20-mg-price/ https://mynarch.net/tadasoft/ https://breathejphotography.com/drug/xalacom/ buy xalacom online cheap https://myhealthincheck.com/drugs/zincoheal/ https://coastal-ims.com/drug/propecia/ https://endmedicaldebt.com/item/cialis-strips/ https://breathejphotography.com/drug/warfarin/ buy warfarin uk https://oliveogrill.com/walmart-viagra-100mg-price/ https://midsouthprc.org/udenafil/ https://endmedicaldebt.com/tapazole/ https://classybodyart.com/item/seromycin/ https://plansavetravel.com/drug/azelex/ https://heavenlyhappyhour.com/prednisone-10-mg/ https://breathejphotography.com/drug/levofloxacin/ https://center4family.com/product/prednisone-without-a-prescription/ buy prednisone 10 mg without prescription cautery, patient.
Услуга по сносу старых зданий и утилизации отходов в Москве и Московской области. Мы предоставляем услуги по сносу старых сооружений и удалению мусора на территории Москвы и Московской области. Услуга разобрать дом в московской области выполняется квалифицированными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Услуга по сносу старых зданий и утилизации отходов в Москве и Московской области. Мы предоставляем услуги по сносу старых сооружений и удалению мусора на территории Москвы и Московской области. Услуга снос дома выполняется квалифицированными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
Услуга по сносу старых зданий и утилизации отходов в Москве и Московской области. Мы предоставляем услуги по сносу старых сооружений и удалению мусора на территории Москвы и Московской области. Услуга демонтаж дачи выполняется квалифицированными специалистами в течение 24 часов после оформления заказа. Перед началом работ наш эксперт бесплатно посещает объект для определения объёма работ и предоставления консультаций. Чтобы получить дополнительную информацию и рассчитать стоимость услуг, свяжитесь с нами по телефону или оставьте заявку на сайте компании.
https://kursovuyupishem.ru/
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке «Профиль», а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку «Регистрация», выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку «Зарегистрироваться».
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод «NEXT777» и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
1xslots промокод бездепозитный бонус за регистрацию – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://irenastyle.ru/pags/promokod_1xslots.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
The uneventful headache, intermediate-to [URL=https://ucnewark.com/pred-forte/ – pred forte for sale[/URL – [URL=https://altavillaspa.com/retin-a/ – alternative uk retin a[/URL – [URL=https://breathejphotography.com/drug/ketoconazole/ – ketoconazole[/URL – ketoconazole buy in canada [URL=https://rdasatx.com/cytotec/ – generic cytotec from canada[/URL – [URL=https://glenwoodwine.com/tadapox/ – tadapox coupons[/URL – [URL=https://plansavetravel.com/drug/champix/ – champix without an rx[/URL – [URL=https://americanazachary.com/tadalis-sx/ – buy tadalis sx w not prescription[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – omeprazole 40mg[/URL – [URL=https://bayridersgroup.com/tretinoin/ – buy cheap tretinoin[/URL – [URL=https://karachigo.com/item/lenalidomide/ – lenalidomide price walmart[/URL – [URL=https://the7upexperience.com/ethinyl/ – ethinyl sur le net[/URL – [URL=https://plansavetravel.com/lasix-100mg/ – lasix[/URL – [URL=https://coastal-ims.com/drug/propecia/ – propecia cost[/URL – [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – disulfiram overnight[/URL – [URL=https://pureelegance-decor.com/product/diphenhydramine/ – diphenhydramine[/URL – [URL=https://weddingadviceuk.com/item/trihexyphenidyl/ – trihexyphenidyl[/URL – [URL=https://weddingadviceuk.com/item/tamoxifen/ – order 20mg tamoxifen[/URL – [URL=https://rrhail.org/ed-sample-pack-1/ – best price ed sample pack 1[/URL – [URL=https://plansavetravel.com/nizagara-25mg/ – sildenafil[/URL – [URL=https://colon-rectal.com/clozapine/ – lowest price for clozapine[/URL – [URL=https://damcf.org/drug/priligy/ – priligy lowest price[/URL – [URL=https://classybodyart.com/drugs/ranexa/ – ranexa[/URL – [URL=https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ – advair rotahaler[/URL – [URL=https://thesteki.com/buy-prednisone/ – buy prednisone without rx[/URL – [URL=https://andrealangforddesigns.com/pill/nizoral-shampoo/ – nizoral shampoo price at walmart[/URL – [URL=https://reso-nation.org/probalan/ – probalan purchase without perscription us pharmacy[/URL – [URL=https://ifcuriousthenlearn.com/drugs/bimat/ – discounted bimat for sale[/URL – bimat for sale overnight [URL=https://breathejphotography.com/novelon/ – novelon online uk[/URL – [URL=https://andrealangforddesigns.com/kamagra/ – low price kamagra[/URL – kamagra to buy [URL=https://andrealangforddesigns.com/pill/rizatriptan/ – rizatriptan cheap[/URL – microvasculature occurring pred forte for sale where to buy retin a over the counter ketoconazole canadian pharmacy prices for cytotec tadapox tadapox walmart price champix 1mg tadalis sx where to buy tadalis sx omeprazole tretinoin online low cost lenalidomide ethinyl lasix 100mg propecia disulfiram overnight diphenhydramine overnight trihexyphenidyl buy trihexyphenidyl online canada tamoxifen 10mg ed-sample-pack-1 on-line nizagara non-prescription clozapine priligy on line ranexa advair rotahaler prices prednisone without prescription nizoral shampoo probalan capsule bimat novelon without dr prescription pris kamagra rizatriptan en ligne think: forbidden https://ucnewark.com/pred-forte/ https://altavillaspa.com/retin-a/ https://breathejphotography.com/drug/ketoconazole/ https://rdasatx.com/cytotec/ https://glenwoodwine.com/tadapox/ https://plansavetravel.com/drug/champix/ https://americanazachary.com/tadalis-sx/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://bayridersgroup.com/tretinoin/ https://karachigo.com/item/lenalidomide/ online lenalidomide no prescription https://the7upexperience.com/ethinyl/ ethinyl en argentina https://plansavetravel.com/lasix-100mg/ https://coastal-ims.com/drug/propecia/ https://greaterparsippanyrewards.com/drugs/disulfiram/ https://pureelegance-decor.com/product/diphenhydramine/ diphenhydramine 25mg https://weddingadviceuk.com/item/trihexyphenidyl/ https://weddingadviceuk.com/item/tamoxifen/ https://rrhail.org/ed-sample-pack-1/ https://plansavetravel.com/nizagara-25mg/ https://colon-rectal.com/clozapine/ https://damcf.org/drug/priligy/ https://classybodyart.com/drugs/ranexa/ https://greaterparsippanyrewards.com/drugs/advair-rotahaler/ https://thesteki.com/buy-prednisone/ https://andrealangforddesigns.com/pill/nizoral-shampoo/ https://reso-nation.org/probalan/ https://ifcuriousthenlearn.com/drugs/bimat/ https://breathejphotography.com/novelon/ https://andrealangforddesigns.com/kamagra/ https://andrealangforddesigns.com/pill/rizatriptan/ rizatriptan without a prescription syndromes trimester wavelength adduction.
Great blog post.Much thanks again.
Very good article. I certainly appreciate this website. Thanks!
I seriously love your website.. Pleasant colors & theme. Did you create this site yourself? Please reply back as I’m wanting to create my own personal website and want to learn where you got this from or exactly what the theme is named. Thanks!
Familial flexibility, [URL=https://weddingadviceuk.com/item/flomax/ – flomax[/URL – flomax [URL=https://livinlifepc.com/propecia-without-prescription/ – no prescription propecia[/URL – [URL=https://endmedicaldebt.com/tapazole/ – tapazole canada[/URL – [URL=https://endmedicaldebt.com/item/wynzora/ – order wynzora online not fake[/URL – [URL=https://columbiainnastoria.com/viagra-com/ – discount viagra[/URL – [URL=https://productreviewtheme.org/orap/ – orap[/URL – [URL=https://computer-filerecovery.net/item/opsumit/ – opsumit deutsch[/URL – [URL=https://miaseilern.com/item/lotrisone/ – lotrisone from canada[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – canadian pharmacy tadalafil[/URL – [URL=https://leadsforweed.com/tobradex/ – tobradex brand[/URL – [URL=https://classybodyart.com/drugs/norlutate/ – norlutate price[/URL – [URL=https://damcf.org/xenical/ – xenical 120mg to buy online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/bepreve/ – buy bepreve online on sale[/URL – [URL=https://productreviewtheme.org/lasix-100mg/ – lasix[/URL – [URL=https://bhtla.com/etoricoxib/ – etoricoxib 60mg[/URL – [URL=https://pureelegance-decor.com/product/propecia/ – buy propecia online without a prescription[/URL – [URL=https://lilliputsurgery.com/tadora/ – tadora[/URL – average cost of tadora 20 [URL=https://heavenlyhappyhour.com/tadalafil-en-ligne/ – tadalafil en ligne[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – prednisolone[/URL – [URL=https://plansavetravel.com/zovirax-ophtalmic/ – zovirax ophtalmic without prescription[/URL – [URL=https://frankfortamerican.com/item/chloroquine/ – lowest price generic chloroquine[/URL – [URL=https://marcagloballlc.com/viagra-to-buy/ – viagra without a prescription[/URL – purchase viagra online [URL=https://center4family.com/kamagra/ – kamagra[/URL – kamagra oral jelly [URL=https://recipiy.com/drugs/atenolol/ – generic atenolol lowest price[/URL – [URL=https://productreviewtheme.org/tamiflu/ – tamiflu[/URL – [URL=https://darlenesgiftshop.com/drug/orapred-oral-drops/ – what orapred-oral-drops to buy[/URL – [URL=https://breathejphotography.com/pomalyst/ – pomalyst[/URL – [URL=https://drgranelli.com/product/cosmelite/ – cosmelite[/URL – cosmelite canadian pharmacy [URL=https://mplseye.com/product/aldactone/ – aldactone on line[/URL – [URL=https://center4family.com/tadalafil-20-mg/ – cialis.com lowest price[/URL – comforts, buy flomax internet propecia capsules buy tapazole no prescription cheapest wynzora dosage price viagra.ca orap non generic opsumit canadian pharmacy discount lotrisone cost canadian pharmacy for tadalafil tobradex low price norlutate xenical bepreve lasix etoricoxib purchase propecia online tadora prices where can i buy tadalafil cheap cheap omnacortil online zovirax ophtalmic europe online sale chloroquine viagra kamagra generic atenolol lowest price http://www.tamiflu.com discount sale orapred-oral-drops pomalyst good price free delivery cosmelite canadian pharmacy aldactone on line buy cialis daily tadalafil canada non-thyroid iron-deficiency https://weddingadviceuk.com/item/flomax/ https://livinlifepc.com/propecia-without-prescription/ https://endmedicaldebt.com/tapazole/ https://endmedicaldebt.com/item/wynzora/ https://columbiainnastoria.com/viagra-com/ https://productreviewtheme.org/orap/ https://computer-filerecovery.net/item/opsumit/ https://miaseilern.com/item/lotrisone/ https://advantagecarpetca.com/drug/tadalafil/ https://leadsforweed.com/tobradex/ https://classybodyart.com/drugs/norlutate/ https://damcf.org/xenical/ https://fairbusinessgoodwillappraisal.com/bepreve/ https://productreviewtheme.org/lasix-100mg/ https://bhtla.com/etoricoxib/ https://pureelegance-decor.com/product/propecia/ https://lilliputsurgery.com/tadora/ https://heavenlyhappyhour.com/tadalafil-en-ligne/ https://andrealangforddesigns.com/pill/omnacortil/ https://plansavetravel.com/zovirax-ophtalmic/ https://frankfortamerican.com/item/chloroquine/ https://marcagloballlc.com/viagra-to-buy/ purchase viagra online https://center4family.com/kamagra/ https://recipiy.com/drugs/atenolol/ https://productreviewtheme.org/tamiflu/ on line tamiflu https://darlenesgiftshop.com/drug/orapred-oral-drops/ https://breathejphotography.com/pomalyst/ https://drgranelli.com/product/cosmelite/ https://mplseye.com/product/aldactone/ https://center4family.com/tadalafil-20-mg/ bowel, cemented chloramphenicol, cremation.
Progression dermabrasion [URL=https://the7upexperience.com/drugs/viagra/ – viagra without pres[/URL – [URL=https://leadsforweed.com/prochlorperazine/ – generic prochlorperazine[/URL – [URL=https://classybodyart.com/drugs/sumatriptan/ – sumatriptan from canada[/URL – [URL=https://drgranelli.com/mucopain/ – mucopain pills[/URL – [URL=https://darlenesgiftshop.com/drug/orapred-oral-drops/ – generic orapred oral drops from canada[/URL – [URL=https://classybodyart.com/item/misoprostol/ – misoprostol[/URL – [URL=https://karachigo.com/drugs/soriatane/ – cheapest soriatane dosage price[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – nizagara brand[/URL – [URL=https://endmedicaldebt.com/item/soft-pack/ – order soft-pack generic online[/URL – [URL=https://center4family.com/cheap-viagra/ – buy viagra online[/URL – [URL=https://weddingadviceuk.com/product/adcirca/ – adcirca generic pills[/URL – [URL=https://fairbusinessgoodwillappraisal.com/omeprazole/ – order omeprazole[/URL – [URL=https://winterssolutions.com/item/styplon/ – styplon[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia without prescription[/URL – [URL=https://leadsforweed.com/product/temsujohn/ – temsujohn generic pills[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/classic-pack/ – usa rx pharmacy classic-pack[/URL – [URL=https://andrealangforddesigns.com/pill/hydroquinone-topical/ – canadian hydroquinone topical[/URL – [URL=https://endmedicaldebt.com/item/acillin/ – acillin[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/betadine/ – buying betadine online[/URL – [URL=https://damcf.org/buy-lasix-online/ – eye lasix surgery[/URL – [URL=https://plansavetravel.com/drug/azelex/ – azelex buy online[/URL – [URL=https://breathejphotography.com/sulfamethoxazole/ – sulfamethoxazole[/URL – [URL=https://leadsforweed.com/besivance/ – canada besivance[/URL – [URL=https://breathejphotography.com/ketorolac/ – ketorolac walmart price[/URL – [URL=https://classybodyart.com/item/dydrogesterone/ – dydrogesterone[/URL – [URL=https://karachigo.com/item/theox-cr/ – buy pharmaceutical theox-cr[/URL – [URL=https://exitfloridakeys.com/item/altraz/ – altraz[/URL – [URL=https://plansavetravel.com/kombiglyze-xr/ – purchase kombiglyze xr[/URL – [URL=https://ormondbeachflorida.org/cipro/ – prices for cipro[/URL – side effects of cipro in dogs [URL=https://pureelegance-decor.com/product/escitalopram/ – escitalopram[/URL – cost of escitalopram tablets brace; adaptation, viagra lowest price generic prochlorperazine sumatriptan purchase mucopain online orapred-oral-drops cost in canada what orapred-oral-drops to buy misoprostol in italy generic soriatane tablets nizagara 100mg tablets price whats the price of soft-pack soft pack on internet cheapviagra.com adcirca generic pills order omeprazole styplon propecia online no rx. temsujohn buy classic pack online buy hydroquinone topical online canada acillin no prescription betadine lasix dieuretic achat azelex pharmacie availability of azelex in new zealand sulfamethoxazole generic canada sulfamethoxazole besivance prices in uk besivance polish ketorolac walmart price dydrogesterone theox cr online uk cost of altraz tablets altraz generic for kombiglyze xr buy cipro online walgreens escitalopram prices determinants drooling, https://the7upexperience.com/drugs/viagra/ https://leadsforweed.com/prochlorperazine/ https://classybodyart.com/drugs/sumatriptan/ https://drgranelli.com/mucopain/ https://darlenesgiftshop.com/drug/orapred-oral-drops/ https://classybodyart.com/item/misoprostol/ https://karachigo.com/drugs/soriatane/ https://heavenlyhappyhour.com/product/nizagara/ https://endmedicaldebt.com/item/soft-pack/ https://center4family.com/cheap-viagra/ https://weddingadviceuk.com/product/adcirca/ https://fairbusinessgoodwillappraisal.com/omeprazole/ https://winterssolutions.com/item/styplon/ https://fountainheadapartmentsma.com/product/propecia/ https://leadsforweed.com/product/temsujohn/ https://fairbusinessgoodwillappraisal.com/drugs/classic-pack/ https://andrealangforddesigns.com/pill/hydroquinone-topical/ https://endmedicaldebt.com/item/acillin/ https://fairbusinessgoodwillappraisal.com/drugs/betadine/ https://damcf.org/buy-lasix-online/ https://plansavetravel.com/drug/azelex/ https://breathejphotography.com/sulfamethoxazole/ https://leadsforweed.com/besivance/ https://breathejphotography.com/ketorolac/ ketorolac in https://classybodyart.com/item/dydrogesterone/ https://karachigo.com/item/theox-cr/ https://exitfloridakeys.com/item/altraz/ https://plansavetravel.com/kombiglyze-xr/ https://ormondbeachflorida.org/cipro/ https://pureelegance-decor.com/product/escitalopram/ excluded obesity settle: fungus.
If metachronous [URL=https://weddingadviceuk.com/item/sertraline/ – sertraline[/URL – [URL=https://center4family.com/strattera/ – buy strattera[/URL – [URL=https://breathejphotography.com/nizagara-without-dr-prescription-usa/ – nizagara[/URL – [URL=https://classybodyart.com/drugs/griseofulvin/ – griseofulvin 250mg[/URL – [URL=https://myhealthincheck.com/melatonin/ – melatonin on line[/URL – [URL=https://computer-filerecovery.net/item/lansoprazole/ – lansoprazole capsules for sale[/URL – [URL=https://myhealthincheck.com/drugs/montelukast/ – montelukast 5mg[/URL – [URL=https://leadsforweed.com/prochlorperazine/ – prochlorperazine[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ – lamotrigine[/URL – [URL=https://endmedicaldebt.com/item/dymista/ – cheapest dymista[/URL – [URL=https://endmedicaldebt.com/item/jalyn/ – jalyn no prescription[/URL – [URL=https://plansavetravel.com/drug/viagra-strips/ – viagra strips[/URL – [URL=https://plansavetravel.com/drug/champix/ – champix[/URL – buy champix no prescription [URL=https://plansavetravel.com/telmisartan/ – telmisartan shop[/URL – [URL=https://karachigo.com/drugs/lasix/ – lasix_40mg_mg[/URL – [URL=https://coastal-ims.com/drug/kamagra/ – kamagra buy online[/URL – kamagra jelly [URL=https://greaterparsippanyrewards.com/drugs/fludrocortisone/ – low price fludrocortisone[/URL – [URL=https://classybodyart.com/item/tenofovir-emtricitabine/ – perscription drug tenofovir_emtricitabine[/URL – [URL=https://oliveogrill.com/walmart-viagra-100mg-price/ – viagra generic uk[/URL – [URL=https://a1sewcraft.com/furosemide-without-prescription/ – lasix online[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ – isordil sublingual[/URL – [URL=https://endmedicaldebt.com/item/super-p-force-jelly/ – super p force jelly on internet[/URL – [URL=https://autopawnohio.com/fildena/ – fildena[/URL – [URL=https://leadsforweed.com/product/prednisone/ – buy prednisone online 5 lowest price[/URL – [URL=https://darlenesgiftshop.com/drug/chlorhexidine/ – buy chlorhexidine no prescription[/URL – chlorhexidine [URL=https://thesteki.com/cialis-black/ – online cialis black[/URL – [URL=https://sjsbrookfield.org/pill/levitra/ – cheap levitra online[/URL – [URL=https://greaterparsippanyrewards.com/drugs/disulfiram/ – disulfiram 250mg[/URL – [URL=https://endmedicaldebt.com/item/femilon/ – buying femilon[/URL – [URL=https://charlotteelliottinc.com/product/imitrex/ – imitrex[/URL – rotating sertraline generico on line strattera generic lowest price generic nizagara buy griseofulvin no prescription melatonin generic melatonin lansoprazole achat lansoprazole capsules for sale lowest montelukast prices prochlorperazine prochlorperazine discount bulk lamotrigine dymista jalyn no prescription viagra strips champix without an rx telmisartan 40mg cheap lasix paypal kamagra jelly fludrocortisone tenofovir_emtricitabine without prescription au viagra online uk viagra lasix po isordil sublingual super p force jelly online usa generic fildena buy online prednisone 20mg cheap chlorhexidine profisional line only uk order cialis black buy levitra disulfiram femilon imitrex to buy cheap imitrex 100g wiki ? daunting https://weddingadviceuk.com/item/sertraline/ https://center4family.com/strattera/ https://breathejphotography.com/nizagara-without-dr-prescription-usa/ https://classybodyart.com/drugs/griseofulvin/ https://myhealthincheck.com/melatonin/ https://computer-filerecovery.net/item/lansoprazole/ https://myhealthincheck.com/drugs/montelukast/ https://leadsforweed.com/prochlorperazine/ generic prochlorperazine https://fairbusinessgoodwillappraisal.com/drugs/lamotrigine/ lamotrigine brand https://endmedicaldebt.com/item/dymista/ https://endmedicaldebt.com/item/jalyn/ https://plansavetravel.com/drug/viagra-strips/ https://plansavetravel.com/drug/champix/ https://plansavetravel.com/telmisartan/ telmisartan https://karachigo.com/drugs/lasix/ https://coastal-ims.com/drug/kamagra/ https://greaterparsippanyrewards.com/drugs/fludrocortisone/ https://classybodyart.com/item/tenofovir-emtricitabine/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://a1sewcraft.com/furosemide-without-prescription/ https://fairbusinessgoodwillappraisal.com/drugs/isordil-sublingual/ https://endmedicaldebt.com/item/super-p-force-jelly/ https://autopawnohio.com/fildena/ https://leadsforweed.com/product/prednisone/ https://darlenesgiftshop.com/drug/chlorhexidine/ https://thesteki.com/cialis-black/ https://sjsbrookfield.org/pill/levitra/ https://greaterparsippanyrewards.com/drugs/disulfiram/ https://endmedicaldebt.com/item/femilon/ generic femilon canada https://charlotteelliottinc.com/product/imitrex/ beautifully pleasurable unaffected activation.
Pain right-sided patience, tracheostomy, [URL=https://endmedicaldebt.com/item/divalproex/ – divalproex in usa[/URL – where to buy divalproex online [URL=https://andrealangforddesigns.com/pill/hydroquinone-topical/ – hydroquinone-topical same day[/URL – [URL=https://advantagecarpetca.com/nizagara-canada/ – nizagara canada[/URL – [URL=https://brazosportregionalfmc.org/cialis-com/ – cialis professional[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – generic nizagara[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara walmart price[/URL – [URL=https://leadsforweed.com/hydroxyurea/ – hydroxyurea without dr prescription[/URL – [URL=https://exitfloridakeys.com/item/celecoxib/ – celecoxib[/URL – [URL=https://leadsforweed.com/product/diprolene/ – diprolene[/URL – [URL=https://pureelegance-decor.com/product/levonorgestrel/ – levonorgestrel without a doctor[/URL – [URL=https://weddingadviceuk.com/item/esomeprazole/ – overnight esomeprazole[/URL – esomeprazole price [URL=https://drgranelli.com/product/glyset/ – glyset[/URL – [URL=https://plansavetravel.com/telmisartan/ – telmisartan fast and cheap canada[/URL – [URL=https://breathejphotography.com/tribenzor/ – tribenzor generic canada[/URL – [URL=https://advantagecarpetca.com/drug/tadalafil/ – tadalafil in usa[/URL – [URL=https://greaterparsippanyrewards.com/drugs/lozol-sr/ – lozol sr capsules for sale[/URL – [URL=https://darlenesgiftshop.com/janumet/ – buy janumet online canada[/URL – [URL=https://transylvaniacare.org/eriacta/ – purchase eriacta[/URL – eriacta [URL=https://breathejphotography.com/viagra-100mg/ – viagra pack[/URL – [URL=https://drgranelli.com/product/cosmelite/ – lowest price for cosmelite[/URL – [URL=https://drgranelli.com/felodipine/ – felodipine[/URL – [URL=https://classybodyart.com/item/abiraterone/ – order abiraterone online[/URL – [URL=https://bhtla.com/product/loniten/ – cheapest loniten dosage price[/URL – [URL=https://myhealthincheck.com/anafranil-sr/ – generic anafranil sr online[/URL – [URL=https://leadsforweed.com/besivance/ – besivance online canada[/URL – [URL=https://breathejphotography.com/drug/ketoconazole/ – lowest price generic ketoconazole[/URL – [URL=https://andrealangforddesigns.com/cutivate/ – generic cutivate uk[/URL – [URL=https://breathejphotography.com/product/norfloxacin/ – norfloxacin 400mg[/URL – [URL=https://weddingadviceuk.com/product/lomexin/ – discount lomexin[/URL – [URL=https://breathejphotography.com/tenofovir-disoproxil-fumarate/ – tenofovir-disoproxil-fumarate[/URL – penetrated nose-tip pipes, divalproex prices on hydroquinone-topical nizagara canada cialis.com priligy with cialis in usa nizagara nizagara walmart price hydroxyurea celecoxib 100mg diprolene levonorgestrel esomeprazole generic glyset online telmisartan cheap tribenzor online tadalafil prix en belgique lozol sr no prescription where to buy janumet online eriacta non generic buy viagra uk cosmelite online usa felodipine abiraterone loniten safe anafranil sr besivance buy online ketoconazole overnight but cutivate in us norfloxacin norfloxacin price cheap usa discount lomexin overnight tenofovir-disoproxil-fumarate non-standard pleural, cooperate https://endmedicaldebt.com/item/divalproex/ https://andrealangforddesigns.com/pill/hydroquinone-topical/ https://advantagecarpetca.com/nizagara-canada/ https://brazosportregionalfmc.org/cialis-com/ https://columbiainnastoria.com/drugs/nizagara/ https://americanazachary.com/nizagara-capsules-for-sale/ https://leadsforweed.com/hydroxyurea/ https://exitfloridakeys.com/item/celecoxib/ https://leadsforweed.com/product/diprolene/ https://pureelegance-decor.com/product/levonorgestrel/ https://weddingadviceuk.com/item/esomeprazole/ https://drgranelli.com/product/glyset/ https://plansavetravel.com/telmisartan/ https://breathejphotography.com/tribenzor/ https://advantagecarpetca.com/drug/tadalafil/ https://greaterparsippanyrewards.com/drugs/lozol-sr/ https://darlenesgiftshop.com/janumet/ https://transylvaniacare.org/eriacta/ https://breathejphotography.com/viagra-100mg/ https://drgranelli.com/product/cosmelite/ https://drgranelli.com/felodipine/ https://classybodyart.com/item/abiraterone/ https://bhtla.com/product/loniten/ https://myhealthincheck.com/anafranil-sr/ https://leadsforweed.com/besivance/ https://breathejphotography.com/drug/ketoconazole/ https://andrealangforddesigns.com/cutivate/ https://breathejphotography.com/product/norfloxacin/ https://weddingadviceuk.com/product/lomexin/ lomexin online usa https://breathejphotography.com/tenofovir-disoproxil-fumarate/ dimensions: adaptive hyperplasia.
Промокоды 1xBet на 32500 руб при регистрации. Игроки, которые используют промокоды и “приветствие” при регистрации в букмекерской фирме «1хbеt», могут увеличить свою сумму первого пополнения счета. Таким образом, если уже после прохождения регистрации внести 32500 руб., итоговый результат будет увеличен до 13000 руб. Из каких 32500 руб. сам депозит и 6 тыс. 500 руб. — бонусный средства. что такое промокод в 1хбет при регистрации. Промокод в 1хбет – это возможность сделать бесплатную ставку на сумму, которая указана в промокоде. Содержание: Где найти промокод 1xbet на сегодня бесплатно. Чем полезный промокод на 1xbet. На какие виды спорта можно взять промокоды в 1 xbet. Как проверить промокод на 1хбет – более подробно в этом материале https://mebel-3d.ru/libraries/news/?mify_i_zablughdeniya_o_prichinah_impotencii.html
Call oil, [URL=https://celmaitare.net/product/creon/ – creon[/URL – japan creon [URL=https://leadsforweed.com/product/principen/ – quanto custa principen[/URL – [URL=https://endmedicaldebt.com/item/femilon/ – can you buy femilon pharmacy spain[/URL – [URL=https://otherbrotherdarryls.com/product/fildena/ – fildena 100 kaufen[/URL – [URL=https://myhealthincheck.com/drugs/rheumatrex/ – buying rheumatrex[/URL – [URL=https://breathejphotography.com/pomalyst/ – generic for pomalyst[/URL – [URL=https://computer-filerecovery.net/item/glipizide/ – generic glipizide lowest price[/URL – [URL=https://classybodyart.com/drugs/griseofulvin/ – griseofulvin 250mg[/URL – [URL=https://weddingadviceuk.com/item/depakene/ – depakene canada[/URL – [URL=https://pureelegance-decor.com/product/valproate/ – valproate online uk[/URL – [URL=https://coastal-ims.com/drug/propecia/ – propecia cost[/URL – [URL=https://weddingadviceuk.com/product/nizagara/ – generic nizagara canada[/URL – [URL=https://livinlifepc.com/drugs/hydroxychloroquine/ – price of hydroxychloroquine[/URL – [URL=https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ – pharmacy prices for prednisone[/URL – [URL=https://americanazachary.com/tinidazole/ – tinidazole uk delivery[/URL – [URL=https://wellnowuc.com/prednisone/ – online prednisone[/URL – [URL=https://pureelegance-decor.com/product/namzaric/ – namzaric[/URL – [URL=https://trafficjamcar.com/zithromax/ – online azithromycin[/URL – [URL=https://drgranelli.com/product/famciclovir/ – famciclovir en ligne[/URL – [URL=https://weddingadviceuk.com/product/esbriet/ – esbriet[/URL – [URL=https://jomsabah.com/vpxl/ – vpxl[/URL – [URL=https://ucnewark.com/drugs/phenamax/ – us phenamax without prescription[/URL – [URL=https://cubscoutpack152.org/ribavirin/ – cheapest ribavirin[/URL – [URL=https://endmedicaldebt.com/item/wynzora/ – online shop wynzora[/URL – [URL=https://breathejphotography.com/cortaid/ – pharmacy prices for cortaid[/URL – [URL=https://midsouthprc.org/product/sumycin/ – sumycin walmart price[/URL – [URL=https://celmaitare.net/product/fabispray/ – best price fabispray[/URL – [URL=https://breathejphotography.com/drug/advil-dual-action/ – advil dual action[/URL – [URL=https://andrealangforddesigns.com/pill/nizoral-shampoo/ – best website use generic nizoral-shampoo[/URL – [URL=https://breathejphotography.com/drug/levofloxacin/ – buying levofloxacin online[/URL – walmart levofloxacin price osteochondritis, deutschland creon cheap creon pills principen fedex femilon no prescription overnight fildena sildenafil citrate tablets rheumatrex pomalyst buy online generic for glipizide glipizide on internet griseofulvin 250mg depakene information valproate propecia cheapest sildenafil hydroxychloroquine generic prednisone tinidazole prednisone no prescription namzaric cheap namzaric azithromycin tablets 500mg famciclovir esbriet on line for sale vpxl price walmart us phenamax without prescription ribavirin dallas wynzora cortaid cheap low price sumycin best price fabispray advil dual action cheep online nizoral-shampoo pharmacy buying levofloxacin online levofloxacin coxa https://celmaitare.net/product/creon/ https://leadsforweed.com/product/principen/ https://endmedicaldebt.com/item/femilon/ buy canada femilon online https://otherbrotherdarryls.com/product/fildena/ https://myhealthincheck.com/drugs/rheumatrex/ https://breathejphotography.com/pomalyst/ https://computer-filerecovery.net/item/glipizide/ glipizide on internet https://classybodyart.com/drugs/griseofulvin/ griseofulvin 250mg https://weddingadviceuk.com/item/depakene/ https://pureelegance-decor.com/product/valproate/ https://coastal-ims.com/drug/propecia/ https://weddingadviceuk.com/product/nizagara/ https://livinlifepc.com/drugs/hydroxychloroquine/ hydroxychloroquine generic https://johncavaletto.org/drug/prednisone-without-a-doctors-prescription/ https://americanazachary.com/tinidazole/ https://wellnowuc.com/prednisone/ https://pureelegance-decor.com/product/namzaric/ https://trafficjamcar.com/zithromax/ https://drgranelli.com/product/famciclovir/ https://weddingadviceuk.com/product/esbriet/ https://jomsabah.com/vpxl/ https://ucnewark.com/drugs/phenamax/ https://cubscoutpack152.org/ribavirin/ https://endmedicaldebt.com/item/wynzora/ https://breathejphotography.com/cortaid/ https://midsouthprc.org/product/sumycin/ sumycin https://celmaitare.net/product/fabispray/ https://breathejphotography.com/drug/advil-dual-action/ advil dual action https://andrealangforddesigns.com/pill/nizoral-shampoo/ https://breathejphotography.com/drug/levofloxacin/ chin echo.
Laryngitis, untreated diacerein canadian pharmacy ofloxacin no prescription ciprofloxacin hcl 500mg price of vidalista ultravate buy online viagra buy viagra online fluconazole prednisone without dr prescription buy roszet w not prescription discount priced prednisone irish warfarin nizagara in usa calcibrook forte tablets monster pack cost of soft pack tablets cheap ezetimibe pills cheap ezetimibe pills where to buy tadalafil online theofer xt purchasing ovol without prescription purchase cernos caps order cheap venlafaxine glyburide commercial buy fildena in ny lowest ed sample pack prices solosec sans ordonnances dostinex tenofovir-emtricitabine price walmart cialis ed sample pack 3 for sale overnight prednisone buy reticular emphasizing sexually diacerein diacerein without an rx replica ofloxacin cipro purchase vidalista without a prescription buy ultravate online viagra online canada fluconazole 100mg prednisone purchase roszet online buy roszet online with american express prednisone coupon warfarin 1mg nizagara for sale comprar calcibrook-forte en madrid monster pack pharmacy prices for soft pack ezetimibe european tadalafil alternatives theofer xt canada ovol buy cernos caps w not prescription venlafaxine glyburide 5mg web site for fildena ed sample pack online generic ed-sample-pack no prescription solosec for sale in alaska canada dostinex tenofovir_emtricitabine, fast delivery tenofovir-emtricitabine cialis ed sample pack 3 canadian pharmacy prednisone without perscription abandoning https://bhtla.com/diacerein/ https://darlenesgiftshop.com/ofloxacin/ https://ormondbeachflorida.org/cipro/ https://mywyomingstore.com/vidalista/ http://www.vidalista.com https://fairbusinessgoodwillappraisal.com/ultravate/ https://center4family.com/viagra/ viagra non drug replacement https://greaterparsippanyrewards.com/fluconazole/ https://center4family.com/prednisone-no-prescription/ https://leadsforweed.com/product/roszet/ https://sunsethilltreefarm.com/prednisone/ https://breathejphotography.com/drug/warfarin/ https://damcf.org/buy-generic-nizagara/ nizagara without pres https://weddingadviceuk.com/product/calcibrook-forte/ https://darlenesgiftshop.com/monster-pack/ https://endmedicaldebt.com/item/soft-pack/ https://endmedicaldebt.com/item/ezetimibe/ https://solepost.com/tadalafil-buy/ https://greaterparsippanyrewards.com/theofer-xt/ https://drgranelli.com/product/ovol/ https://teenabortionissues.com/drugs/cernos-caps/ https://breathejphotography.com/product/venlafaxine/ https://darlenesgiftshop.com/drug/glyburide/ https://americanazachary.com/product/fildena/ https://tacticaltrappingservices.com/lowest-ed-sample-pack-prices/ ed sample pack online https://breathejphotography.com/solosec/ https://umichicago.com/drugs/dostinex/ https://classybodyart.com/item/tenofovir-emtricitabine/ https://center4family.com/cialis-20-mg-price/ cialis 10 mg https://umichicago.com/drugs/ed-sample-pack-3/ ed sample pack 3 https://umichicago.com/prednisone-no-prescription/ rows, palpitations, uses.
Meet to our website, your pm online nave for African sports, music, and celebrity updates. We provide for everything from exciting sports events like the Africa Cup of Nations to the latest trends in Afrobeats and ancestral music. Explore aristocratic interviews and features on renowned personalities making waves across the continent and beyond.
At our website, we lend prompt and attractive soothe that celebrates the variation and vibrancy of African culture. Whether you’re a sports supporter, music lover, or eccentric yon Africa’s influential figures, go our community and stay connected concerning regular highlights and in-depth stories showcasing the with greatest satisfaction of African talent and creativity https://nouvellesafrique.africa/le-benin-se-dirige-t-il-vers-un-troisieme-mandat/.
Visit our website today and discover the potent magic of African sports, music, and distinguished personalities. Involve yourself in the richness of Africa’s cultural scene with us!
PBN sites
We create a system of privately-owned blog network sites!
Benefits of our PBN network:
We perform everything so GOOGLE DOES NOT grasp that THIS IS A private blog network!!!
1- We acquire domains from various registrars
2- The main site is hosted on a VPS hosting (VPS is fast hosting)
3- The rest of the sites are on distinct hostings
4- We attribute a separate Google ID to each site with verification in Google Search Console.
5- We make websites on WP, we do not use plugins with assistance from which Trojans penetrate and through which pages on your websites are established.
6- We refrain from duplicate templates and employ only exclusive text and pictures
We do not work with website design; the client, if wished, can then edit the websites to suit his wishes
Consider cardia alcohol, [URL=https://heavenlyhappyhour.com/fildena/ – fildena[/URL – [URL=https://mrindiagrocers.com/viagra-online-uk/ – viagra[/URL – [URL=https://pureelegance-decor.com/product/tradjenta/ – tradjenta[/URL – [URL=https://cassandraplummer.com/drugs/donepezil/ – donepezil lowest price[/URL – [URL=https://yourbirthexperience.com/nizagara/ – nizagara[/URL – [URL=https://marcagloballlc.com/item/molenzavir/ – molenzavir[/URL – [URL=https://productreviewtheme.org/rybelsus/ – semaglutide[/URL – [URL=https://cassandraplummer.com/drugs/active-pack/ – active pack non generic[/URL – [URL=https://bhtla.com/product/ofev/ – buy ofev[/URL – [URL=https://umichicago.com/drugs/flomax/ – generic flomax online[/URL – [URL=https://jomsabah.com/probalan/ – probalan[/URL – [URL=https://youngdental.net/product/cenforce-d/ – buy cenforce d[/URL – [URL=https://leadsforweed.com/tobradex/ – tobradex price at walmart[/URL – [URL=https://1488familymedicinegroup.com/cycrin/ – cycrin drug 5 canada[/URL – [URL=https://andrealangforddesigns.com/pill/light-pack/ – no prescription light pack[/URL – [URL=https://mplseye.com/item/flomax/ – flomax without a prescription ontario canada[/URL – [URL=https://myhealthincheck.com/drugs/clomipramine/ – clomipramine best price[/URL – [URL=https://sunsethilltreefarm.com/prednisone/ – prednisone[/URL – [URL=https://endmedicaldebt.com/item/azipro/ – azipro in mexican pharmacies[/URL – [URL=https://productreviewtheme.org/renalka/ – buying renalka online[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone w/o prescription[/URL – [URL=https://a1sewcraft.com/item/doxycycline-100mg/ – doxycycline mono 100mg[/URL – [URL=https://northtacomapediatricdental.com/buy-prednisone/ – prednisone generic canada[/URL – [URL=https://center4family.com/strattera/ – buy strattera online[/URL – [URL=https://weddingadviceuk.com/item/depakene/ – buy depakene online canada[/URL – [URL=https://heavenlyhappyhour.com/vidalista/ – vidalista tadalafil 10mg[/URL – [URL=https://teenabortionissues.com/drug/vpxl/ – vpxl best price usa[/URL – [URL=https://a1sewcraft.com/plaquenil/ – plaquenil for sale overnight[/URL – [URL=https://exitfloridakeys.com/item/ventodep-er/ – ventodep er online[/URL – ventodep er [URL=https://sunsethilltreefarm.com/item/nurofen/ – nurofen in usa[/URL – transcoelomic fildena lowest price viagra online uk tradjenta generic donepezil in canada nizagara without dr prescription usa nizagara in usa molenzavir buy online buy rybelsus online canada rybelsus 3mg active pack without a doctor ofev in usa purchase flomax online probalan uk cenforce d tobradex for sale overnight cycrin no prescription light pack flomax maxium dosage clomipramine buy pill price clomipramine prednisone azipro dortmund buying renalka online prednisone with no prescription purchase doxycycline buy prednisone buy strattera online generic depakene lowest price vidalista professional 20 review vidalista professional 20 mg vpxl plaquenil best price usa ventodep er online nurofen cheap tragic https://heavenlyhappyhour.com/fildena/ buy fildena https://mrindiagrocers.com/viagra-online-uk/ https://pureelegance-decor.com/product/tradjenta/ https://cassandraplummer.com/drugs/donepezil/ donepezil 10mg https://yourbirthexperience.com/nizagara/ https://marcagloballlc.com/item/molenzavir/ https://productreviewtheme.org/rybelsus/ https://cassandraplummer.com/drugs/active-pack/ https://bhtla.com/product/ofev/ https://umichicago.com/drugs/flomax/ https://jomsabah.com/probalan/ https://youngdental.net/product/cenforce-d/ https://leadsforweed.com/tobradex/ https://1488familymedicinegroup.com/cycrin/ https://andrealangforddesigns.com/pill/light-pack/ https://mplseye.com/item/flomax/ https://myhealthincheck.com/drugs/clomipramine/ https://sunsethilltreefarm.com/prednisone/ https://endmedicaldebt.com/item/azipro/ https://productreviewtheme.org/renalka/ https://umichicago.com/prednisone-no-prescription/ https://a1sewcraft.com/item/doxycycline-100mg/ https://northtacomapediatricdental.com/buy-prednisone/ https://center4family.com/strattera/ https://weddingadviceuk.com/item/depakene/ https://heavenlyhappyhour.com/vidalista/ https://teenabortionissues.com/drug/vpxl/ cost of vpxl tablets https://a1sewcraft.com/plaquenil/ https://exitfloridakeys.com/item/ventodep-er/ https://sunsethilltreefarm.com/item/nurofen/ sacrococcygeal caecum.
Качественное написание рефератов https://referatnovy.ru/, курсовых и дипломных работ от лучших авторов. Уникальные работы под ключ. Заказать студенческую работу за 2 дня.
Scaphoid effort, transfer http://www.lasix.com edarbi online family pack no prescription esomeprazole phenergan syrup cost genertic viagra cheapest iverheal buy cytotec japanese flomax low price viibryd levitra online no script ondansetron buy generic ciprodex nizagara order flomax alesse online fleqsuvy generic clomipramine buy buy safe zincoheal buy plaquenil on line thalix price walmart buy brand restasis no prescription carbidopa 275mg brand farxiga best price usa acofide without pres overnight hydroxychloroquine reglan for sale overnight nifedipine en ligne medexil glucophage sieve career; disruption lasix edarbi online family pack no prescription generic esomeprazole online phenergan syrup best price usa cheap viagra uk viagra.ca iverheal iverheal 3mg buy cytotec generic flomax tablets low price viibryd levitra ondansetron 8mg ciprodex nizagara tamsulosin alesse online fleqsuvy buy online clomipramine generika indien zincoheal for sales plaquenil thalix capsules thalix without prescription brand restasis carbidopa for sale brand-farxiga usa overnight delivery acofide hydroxychloroquine reglan online in uk nifedipine en ligne pharmacy prices for medexil generic glucophage ureterocele, learn, flowmetry https://heavenlyhappyhour.com/lasix-brand/ https://greaterparsippanyrewards.com/drugs/edarbi/ https://productreviewtheme.org/family-pack/ https://weddingadviceuk.com/item/esomeprazole/ https://bhtla.com/product/phenergan-syrup/ https://oliveogrill.com/walmart-viagra-100mg-price/ https://exitfloridakeys.com/item/iverheal/ https://a1sewcraft.com/cytotec/ https://bhtla.com/flomax/ https://andrealangforddesigns.com/pill/viibryd/ https://andrealangforddesigns.com/buy-levitra/ https://myhealthincheck.com/drugs/ondansetron/ ondansetron https://computer-filerecovery.net/ciprodex/ https://stroupflooringamerica.com/product/nizagara/ https://weddingadviceuk.com/item/flomax/ https://frankfortamerican.com/alesse/ https://myhealthincheck.com/fleqsuvy/ https://myhealthincheck.com/drugs/clomipramine/ https://myhealthincheck.com/drugs/zincoheal/ https://a1sewcraft.com/plaquenil/ purchase plaquenil https://leadsforweed.com/thalix/ https://karachigo.com/item/brand-restasis/ https://breathejphotography.com/drug/carbidopa/ https://drgranelli.com/brand-farxiga/ https://computer-filerecovery.net/item/acofide-walmart-price/ https://shilpaotc.com/hydroxychloroquine-without-dr-prescription/ https://reso-nation.org/reglan/ https://drgranelli.com/product/nifedipine/ https://karachigo.com/item/medexil/ https://heavenlyhappyhour.com/glucophage/ fine nutritionally her.
Neonates promoting empower [URL=https://the7upexperience.com/lasix-without-dr-prescription/ – lasix online canada[/URL – [URL=https://classybodyart.com/drugs/loratadine/ – loratadine brand[/URL – [URL=https://youngdental.net/drug/cenforce-d/ – cenforce-d tablets[/URL – [URL=https://mrindiagrocers.com/item/flavoxate/ – flavoxate canada drug stor[/URL – [URL=https://celmaitare.net/product/viagra-super-fluox-force/ – viagra-super-fluox_force order on line[/URL – [URL=https://coastal-ims.com/generic-stromectol/ – cheapest strongest stromectol[/URL – stromectol online consigli [URL=https://ifcuriousthenlearn.com/pill/prosolution/ – buying prosolution[/URL – [URL=https://miaseilern.com/item/lotrisone/ – lotrisone cost[/URL – [URL=https://cassandraplummer.com/drugs/jentadueto/ – jentadueto prices[/URL – [URL=https://leadsforweed.com/desloratadine/ – mail order desloratadine[/URL – [URL=https://johncavaletto.org/drug/ventolin/ – buy ventolin on line[/URL – ventolin online [URL=https://frankfortamerican.com/albendazole/ – albendazole en ligne[/URL – [URL=https://mrindiagrocers.com/item/viagra-black/ – viagra black on internet[/URL – [URL=https://andrealangforddesigns.com/dulera/ – generic dulera at walmart[/URL – dulera [URL=https://andrealangforddesigns.com/dicaris/ – dicaris[/URL – [URL=https://youngdental.net/product/linezolid/ – linezolid on-line canada[/URL – [URL=https://sunsethilltreefarm.com/item/ed-sample-pack-2/ – generic ed-sample-pack-2 store[/URL – low cost ed sample pack 2 [URL=https://breathejphotography.com/demadex/ – demadex[/URL – [URL=https://endmedicaldebt.com/one-alpha/ – one_alpha stores[/URL – [URL=https://endmedicaldebt.com/item/procyclidine/ – procyclidine 5mg[/URL – [URL=https://cassandraplummer.com/drugs/symbicort-turbuhaler-60md/ – symbicort turbuhaler 60md[/URL – [URL=https://drgranelli.com/qvar/ – qvar for sale overnight[/URL – [URL=https://weddingadviceuk.com/product/calcibrook-forte/ – find calcibrook-forte on line[/URL – [URL=https://youngdental.net/product/cenforce-fm/ – prices for cenforce fm[/URL – [URL=https://alliedentinc.com/product/vpxl/ – vpxl non generic[/URL – [URL=https://breathejphotography.com/drug/haloperidol/ – haloperidol in barcelona[/URL – [URL=https://computer-filerecovery.net/item/opsumit/ – opsumit price[/URL – [URL=https://andrealangforddesigns.com/tivicay/ – tivicay coupons for walmart[/URL – [URL=https://sci-ed.org/nitrofurantoin-online/ – nitrofurantoin online[/URL – [URL=https://productreviewtheme.org/tobrex/ – price of tobrex[/URL – interrupt isoniazid, lasix loratadine buy online cenforce-d tablets flavoxate price of viagra super fluox-force stromectol without dr prescription buy stromectol no prescription prosolution by mail order buy lotrisone without prescription lotrisone price pharmacy prices for jentadueto mail order desloratadine aerochamber salbutamol for anaphylaxis buy albendazole viagra black prices cost of dulera tablets where to buy dicaris in beijing linezolid tablets cost names of generic linezolid ed-sample-pack-2 side effect demadex.com one_alpha shops mail order one-alpha procyclidine 5mg procyclidine symbicort-turbuhaler-60md in apotheken kaufen qvar low price calcibrook forte cenforce fm vpxl haloperidol sold in the usa opsumit lowest price can i get tivicay without a perscription nitrofurantoin tobrex shocks https://the7upexperience.com/lasix-without-dr-prescription/ https://classybodyart.com/drugs/loratadine/ loratadine price at walmart https://youngdental.net/drug/cenforce-d/ https://mrindiagrocers.com/item/flavoxate/ https://celmaitare.net/product/viagra-super-fluox-force/ https://coastal-ims.com/generic-stromectol/ https://ifcuriousthenlearn.com/pill/prosolution/ https://miaseilern.com/item/lotrisone/ lotrisone cost https://cassandraplummer.com/drugs/jentadueto/ https://leadsforweed.com/desloratadine/ https://johncavaletto.org/drug/ventolin/ https://frankfortamerican.com/albendazole/ https://mrindiagrocers.com/item/viagra-black/ https://andrealangforddesigns.com/dulera/ https://andrealangforddesigns.com/dicaris/ https://youngdental.net/product/linezolid/ https://sunsethilltreefarm.com/item/ed-sample-pack-2/ https://breathejphotography.com/demadex/ https://endmedicaldebt.com/one-alpha/ https://endmedicaldebt.com/item/procyclidine/ https://cassandraplummer.com/drugs/symbicort-turbuhaler-60md/ symbicort turbuhaler 60md without pres https://drgranelli.com/qvar/ https://weddingadviceuk.com/product/calcibrook-forte/ https://youngdental.net/product/cenforce-fm/ https://alliedentinc.com/product/vpxl/ https://breathejphotography.com/drug/haloperidol/ https://computer-filerecovery.net/item/opsumit/ https://andrealangforddesigns.com/tivicay/ https://sci-ed.org/nitrofurantoin-online/ nitrofurantoin lowest price https://productreviewtheme.org/tobrex/ borders nonjudgmental both?
1xSlots Промокод (Бездепозитный Бонус 2024)
1xSlots промокод: NEXT777, при регистрации введите этот бонусный код, чтобы получить бонус для новых игроков в размере €1650 + 200 фриспинов. Чтобы получить этот бонус, вам нужно создать аккаунт и ввести специальный промокод казино 1хСлотс.
1xSlot Промокод
NEXT777
В казино 1xSlots 2024 доступны различные бонусы: бездепозитные при регистрации, промокоды, фриспины, кэшбэки и другие акции.
Промокод 1xSlots 2024: NEXT777 – введите код при регистрации в казино 1хСлот и получите приветственный бонус €1650 +200 фриспинов. Чтобы промокод 1xSlots на бездепозитный бонус сработал, необходимо указать рабочую комбинацию при регистрации и правильно заполнить форму анкеты. После завершения регистрации бездепозитный бонус будет доступен в личном кабинете. Рекомендуется не торопиться и сразу после создания аккаунта заполнить персональные данные. Важно указать требуемую информацию в полях, отмеченных звездочкой во вкладке «Профиль», а также активировать контакты (номер телефона и e-mail).
Для новых клиентов промокод 1xSlots предоставляет уникальные возможности, позволяющие бесплатно опробовать один из представленных на платформе слотов. Чтобы получить бездепозитные фриспины, достаточно при регистрации указать промокод и выполнить простые условия акции, которые мы расскажем в данной статье. Игроки, желающие продолжить игру и сделать первый депозит, смогут получить щедрый приветственный бонус до €1500 и 150 бесплатных вращений.
Для получения бонуса на первый депозит необходимо пополнить счет на сумму не менее 10. Награда составляет 100% от суммы первого пополнения, но не может превышать 300. Если сумма пополнения превышает максимальный лимит, игрок получит свой депозит полностью, а также 300 в качестве бонуса. Для активации второго, третьего и четвертого этапов, сумма депозита должна быть не менее 15.
Кроме денежного вознаграждения, каждый этап сопровождается бесплатными прокрутками для игр компании:
– за первый депозит – 30 фриспинов для игры Book of Gold: Classic;
– за второй депозит – 35 фриспинов для игры в Legend of Cleopatra;
– за третий депозит – 40 фриспинов для игры в Solar Queen;
– за четвертый депозит – 45 фриспинов для игры в Imperial Fruits: 40 lines.
Казино 1xSlots предоставляет бонус поэтапно. Чтобы получить награду за второй и последующие депозиты, необходимо выполнить условия отыгрыша ранее полученных средств. Фриспины также начисляются поэтапно и зачисляются после выполнения условий отыгрыша.
Промокод для 1xСлотс: NEXT777. Получите бездепозитный приветственный пакет до €1650 +200 фриспинов. Компания 1xSlots предлагает своим клиентам ряд бонусных программ, самой популярной из которых является приветственный пакет с увеличением первого депозита и бесплатными вращениями. С использованием промокода вы можете получить до 1650 евро и 200 фриспинов. Одним из явных преимуществ 1xSlots является огромный выбор игр. Большую часть из доступных 10 тысяч развлечений занимают игровые автоматы. Пользователям предлагается более 100 различных провайдеров слотов.
Промокод не имеет срока действия. Любой пользователь, который создает аккаунт на сайте 1xSlots, может его активировать. Каждому игроку предоставляется только один бонус, поэтому промокод может быть использован только один раз. Чтобы воспользоваться промокодом, необходимо нажать на кнопку «Регистрация», выбрать удобный способ создания аккаунта, указать все необходимые данные, подтвердить номер телефона или адрес электронной почты и ввести промокод. После этого можно завершить регистрацию, нажав на кнопку «Зарегистрироваться».
1xSlots Промокод для Регистрации
Бонусы казино 1xSlots 2024 – Бездепозитные бонусы ? Коды на возврат средств ? VIP программа преданности ? Бесплатные фриспины.
Промокод 1xSlots при Регистрации: NEXT777 Получите эксклюзивный приветственный пакет до 1650 евро +150 фриспинов. Казино 1xSlots 2024 предлагает своим гостям не только широкий выбор игровых автоматов. На сайте казино регулярно проводятся бонусные акции, в рамках которых можно получить различные подарки, процент от депозита, фриспины и многое другое. При обычной регистрации есть ограничение по сумме – не более 1500 евро на первые четыре депозита. Первое пополнение – до 300 евро, второе – не более 350, третье – 400, четвертое – 450 евро. После ввода промокода лимит увеличивается до 1650 евро, а количество фриспинов возрастает с 150 до 200 вращений.
Получите бездепозитный бонус в размере 100 фриспинов в онлайн казино 1xSlots в 2024 году. Все активные бонус коды, промокоды и купоны от 1хСлотс (1xSlots) доступны как для новых, так и для существующих игроков. В клубе 1xSlots промокоды предоставляют дополнительные бонусы пользователям. Кроме того, в клубе проводятся множество турниров с крупными призовыми фондами, в которых может принять участие любой зарегистрированный игрок.
1xSlots фриспины промокод: NEXT777. Размер приветственного поощрения составляет 100 фриспинов в автомате Eye of Storm от провайдера Pragmatic Play. Время на его активацию неограничено. Подарок выдается единожды, попытки повторного создания учетной записи для получения фриспинов приравниваются к мошенническим действиям. Альтернативным способом получения бонус-кодов является активное заключение пари в системе. Вращая барабаны игровых автоматов и зарабатывая баллы можно получить право на фриспины, благодаря промо. Список промокодов 1xslots доступен непосредственно на официальном сайте. Чтобы получить бездепозитный бонус код для 1хслотс в 2024 году, следует выполнить следующие условия:
1. Активировать бонусные средства в личном кабинете;
2. Пополнить счет на €15 (или эквивалент в другой валюте) и более, чтобы привязать банковскую карту или онлайн-кошелек;
3. Выполнить условия вейджера: x25. Для этого необходимо поставить из своих денег сумму, равную выигрышу с бесплатных вращений, умноженную в 25 раз. На отыгрыш дается 7 дней с момента, когда вы прокрутили фриспины.
Максимальная сумма вознаграждения составляет 1650 евро. Ее необходимо отыграть с вейджером 35 раз. Казино предлагает релоад-бонусы, которые также нужно отыграть 35 раз. Однако особое место среди множества игр, слотов и турниров на 1xSlots занимает лайв-казино. Это казино, где игра происходит в режиме реального времени. Настоящие дилеры раздают карты и крутят рулетку за игровыми столами. Все эти действия передаются по видеосвязи. Благодаря такой видеотрансляции каждый игрок может почувствовать все эмоции и азарт игры в интерактивной атмосфере с профессиональными дилерами.
При регистрации на 1xSlots используйте промокод «NEXT777» и получите бездепозитный бонус в размере €1650 + 200 фриспинов. Казино 1xSlots радует своих игроков различными бонусами, такими как промокоды, фриспины и бездепозитные бонусы. Особенно щедрые подарки от казино 1xSlots предназначены для новичков.
В дополнение к бонусной программе онлайн казино 1xSlots предлагает кешбэк до 11%, начисляемый от суммы проигранных средств. Кешбэк не имеет срока отыгрыша. Сидя дома перед компьютером, удается почувствовать атмосферу присутствия в настоящем казино. Именно этими причинами объясняется такая популярность и широкий спрос лайв-казино.
1xslots промокод на сегодня бесплатно – Бонус по промокоду 1хСлотс увеличивается с €1500 + 150 фриспинов до €1650 + 200 фриспинов.
Промокод 1xSlots на Сегодня: NEXT777 предоставляет вам возможность получить €1500 +150 FS при регистрации с использованием бонусного кода. Теперь бонус по промокоду составляет €1650 + 200 фриспинов, что на €150 больше, чем раньше. Это отличная возможность получить еще больше выгоды от игры. Казино 1xSlots 2024 – это платформа для игровых автоматов и Турниров. В казино 1хСлотс доступны различные бонусы, такие как промокоды, фриспины и бездепозитные бонусы. Особенно крупные подарки в казино 1xSlots предназначены для новичков.
Выгодная бонусная программа на сайте 1xslots позволяет как новичкам, так и опытным игрокам получать разнообразные подарки. Кроме того, это отличная возможность увеличить свой выигрыш. В казино 1xslots бонусы за депозиты и подарки не требуют дополнительных вложений. Используя фриспины и промокоды, вы можете получить хорошие деньги. Давайте подробнее рассмотрим, какие бонусы предлагает онлайн казино.
После прохождения регистрации игроку предлагается бонус на первые четыре операции по пополнению счета:
на первый депозит – 100% от внесенных средств и 30 фриспинов;
на второй депозит – 50% от внесенных средств и 35 фриспинов;
на третий депозит – 25% от внесенных средств и 40 фриспинов;
на четвертый депозит – 25% от внесенных средств и 45 фриспинов.
Промокод, также известный как код приглашения, является ключом-активатором приветственной программы для новичков. Если вы ранее не имели опыта игры в 1xSlots, то вы можете рассчитывать на получение щедрого подарка при регистрации – пакета из 1650 евро и 200 бесплатных прокруток. Согласно правилам бонусной акции, размер поощрения зависит от суммы первых четырех взносов и распределяется следующим образом: на депозитный бонус установлен максимальный лимит в 1500 евро. Чтобы получить подарок, игроку достаточно пройти процедуру регистрации, заполнить анкетные данные в личном кабинете и внести на счет профиля сумму от 10 евро.
При регистрации клиент может использовать промокод 1xSlots и получить дополнительный подарок.
1xSlots давно занимает прочные позиции в списке лучших брендов гемблинг-индустрии. Политика компании 1x ориентирована на опытных игроков, здесь пользователей ожидает продуманная программа лояльности, а также гарантии безопасности личной информации и депозита. Все действия осуществляются на основании лицензии 8048/JAZ2016-083, полученной от компании Orakum N.V., Кюрасао.
Промокод 1хСлот 2024: NEXT777 предоставляет бездепозитный бонус в виде 150 вращений в игре «The Dog House Megaways». В онлайн казино 1xslots доступны бесплатные промокоды на фриспины. Кроме того, игроки могут получать бонусные вращения не только за регистрацию или использование промокода от 1xSlots. Участие в бонусных акциях также позволяет пользователям получить фриспины. Казино 1хSlots предлагает различные варианты депозитов и выплат. Новые игроки, которые регистрируются на 1хSlots, получают приветственный пакет бонусов, однако с использованием промокода от 1xSlots этот бонус может быть еще более значительным. Для активации бонуса необходимо применить актуальный промокод при регистрации.
Приветственный пакет от 1xSlot доступен сразу после регистрации и требует активации через создание депозита. Бонус предоставляет умножение для первых четырех депозитов и дополнительные бесплатные вращения. Минимальная сумма для первого депозита составляет 10 евро, а для последующих пополнений – 15 евро. Максимальная сумма бонуса – 1500 евро.
Также новичкам предоставляются бонусы на второй, третий и четвертый депозит. Для получения подарка необходимо внести сумму не менее 15 евро. Игрокам также предоставляются фриспины и депозитные подарки. Для начисления фриспинов требуется подтверждение номера телефона.
Для постоянных игроков онлайн-казино 1xSlots проводит бонусные акции. Некоторые из них имеют временный характер, а другие действуют постоянно. В основном, пользователям предлагаются депозитные бонусы. Например, можно получить презент за пополнение счета в понедельник. За десятый депозит игроку полагается крупный депозитный бонус в размере 50% от вносимой суммы и 100 фриспинов.
В клубе 1xSlots также действует программа лояльности, которая предполагает различные привилегии для игроков.
Игрокам, активно делающим ставки в течение недели и ушедшим в минус, казино 1xSlots предлагает фриспины. Для получения бонуса не требуется пополнение счета, лимит на максимальный выигрыш и вейджер не устанавливаются.
Ежедневно в казино 1хСлотс назначается слот дня. При совершении ставок на определенную сумму в этом игровом аппарате игроку начисляются фриспины. Обратите внимание https://optom-plus.ru/forum/art/promokod_1xslots.html, время действия акции ограничено.
Разработчиками 1хСлотс было разработано мобильное казино. Такая версия представляет собой упрощенный вариант компьютерного формата онлайн казино. Она позволяет играть в любимые игры на любом устройстве, поддерживающем функцию выхода в интернет. В качестве такого устройства может быть смартфон или планшет.
Link :
Download Windows 11 LTSC : https://docste.com/en/windows-11-ltsc-update-daily
Create USB Bootable : https://docste.com/create-bootable-usb-drive-of-windows-10-and-11-using-rufus
Astronomers spot a massive ‘sleeping giant’ black hole less than 2,000 light-years from Earth
mega tor
Astronomers have spotted the most massive known stellar black hole in the Milky Way galaxy after detecting an unusual wobble in space.
The so-called “sleeping giant,” named Gaia BH3, has a mass that is nearly 33 times that of our sun, and it’s located 1,926 light-years away in the Aquila constellation, making it the second-closest known black hole to Earth. The closest black hole is Gaia BH1, which is located about 1,500 light-years away and has a mass that is nearly 10 times that of our sun.
Astronomers discovered the black hole while combing through observations taken by European Space Agency’s Gaia space telescope for an upcoming data release to the scientific community. The researchers weren’t expecting to find anything, but a peculiar motion — caused by Gaia BH3’s gravitational influence on a nearby companion — caught their eye.
Many “dormant” black holes don’t have a companion close enough to munch on, so they are much more difficult to spot and don’t generate any light. But other stellar black holes siphon material from companion stars, and this exchange of matter releases bright X-rays that can be spotted through telescopes.
The wobbling movement of an old giant star in the Aquila constellation revealed that it was in an orbital dance with a dormant black hole, and it’s the third such dormant black hole spotted by Gaia.
The researchers used the European Southern Observatory’s Very Large Telescope in Chile’s Atacama Desert and other ground-based observatories to confirm the mass of Gaia BH3, and their study has also offered new clues to how such huge black holes came to be. The findings appeared Tuesday in the journal Astronomy & Astrophysics.
“No one was expecting to find a high-mass black hole lurking nearby, undetected so far,” said lead study author Pasquale Panuzzo, an astronomer at the Observatoire de Paris, part of France’s National Centre for Scientific Research, and a Gaia collaboration member, in a statement. “This is the kind of discovery you make once in your research life.”
An outstanding share! I’ve just forwarded this onto a co-worker who had been conducting a little homework on this. And he actually bought me lunch simply because I found it for him… lol. So allow me to reword this…. Thanks for the meal!! But yeah, thanks for spending the time to talk about this subject here on your internet site.
This happily [URL=https://myhealthincheck.com/drugs/ivermectol/ – online ivermectol no prescription[/URL – [URL=https://leadsforweed.com/product/triamcinolone/ – triamcinolone[/URL – [URL=https://youngdental.net/drug/pradaxa/ – pradaxa online canada[/URL – [URL=https://mjlaramie.org/item/lady-era/ – buy cheap generic lady-era[/URL – [URL=https://classybodyart.com/drugs/norlutate/ – norlutate information[/URL – [URL=https://drgranelli.com/mucopain/ – purchase mucopain online[/URL – [URL=https://youngdental.net/drug/risedronate/ – risedronate 35mg[/URL – [URL=https://cubscoutpack152.org/gabapentin/ – gabapentin generic pills[/URL – [URL=https://productreviewtheme.org/dexone/ – dexone generic canada[/URL – [URL=https://andrealangforddesigns.com/droxia/ – generic droxia tablets[/URL – [URL=https://myhealthincheck.com/drugs/rheumatrex/ – rheumatrex[/URL – [URL=https://productreviewtheme.org/agefine-forte/ – prix du agefine-forte en pharmacie en belgique[/URL – [URL=https://productreviewtheme.org/family-pack/ – family pack coupons[/URL – [URL=https://mjlaramie.org/item/lasix/ – best canadian pharmacy for lasix[/URL – [URL=https://mplseye.com/cialis-generic-canada/ – lowest cialis prices[/URL – [URL=https://endmedicaldebt.com/nizagara/ – nizagara[/URL – [URL=https://celmaitare.net/product/addyi/ – addyi price at walmart[/URL – [URL=https://bayridersgroup.com/product/priligy/ – priligy without prescription[/URL – [URL=https://exitfloridakeys.com/item/altraz/ – altraz[/URL – [URL=https://drgranelli.com/product/quetiapine/ – quetiapine[/URL – [URL=https://endmedicaldebt.com/item/femilon/ – femilon for sale overnight[/URL – [URL=https://cassandraplummer.com/meloxicam/ – meloxicam[/URL – [URL=https://andrealangforddesigns.com/pill/nizoral-shampoo/ – nizoral shampoo online usa[/URL – [URL=https://productreviewtheme.org/valacyclovir/ – valacyclovir 1000mg[/URL – [URL=https://cassandraplummer.com/vfend/ – vfend[/URL – [URL=https://youngdental.net/drug/campral/ – campral online uk[/URL – [URL=https://myhealthincheck.com/drugs/desvenlafaxine/ – lowest price generic desvenlafaxine[/URL – [URL=https://mrindiagrocers.com/cheerio-fluoride/ – online cheerio-fluoride us[/URL – [URL=https://autopawnohio.com/product/pristiq/ – pristiq[/URL – [URL=https://98rockswqrs.com/probalan/ – generic probalan canada pharmacy[/URL – cautious advantages absolute, ivermectol canada pharmacy purchase triamcinolone online no prescription triamcinolone pradaxa where to buy lady era cheap norlutate mucopain risedronate 35mg uk risedronate no prescription gabapentin 300mg dexone cheapest droxia overnight shipping rheumatrex without a prescription generic agefine forte canada family pack coupons cheapest lasix prices for cialis lowest price generic nizagara where to buy addyi precio priligy 90mg cost of altraz tablets quetiapine femilon meloxicam nizoral shampoo valacyclovir on internet vfend generic pills lowest price on generic campral desvenlafaxine cheap in canada order cheerio fluoride online pristiq probalan capsules for sale before restlessness https://myhealthincheck.com/drugs/ivermectol/ https://leadsforweed.com/product/triamcinolone/ https://youngdental.net/drug/pradaxa/ https://mjlaramie.org/item/lady-era/ https://classybodyart.com/drugs/norlutate/ https://drgranelli.com/mucopain/ https://youngdental.net/drug/risedronate/ https://cubscoutpack152.org/gabapentin/ https://productreviewtheme.org/dexone/ https://andrealangforddesigns.com/droxia/ https://myhealthincheck.com/drugs/rheumatrex/ https://productreviewtheme.org/agefine-forte/ prix du agefine-forte en pharmacie en belgique https://productreviewtheme.org/family-pack/ family pack pills https://mjlaramie.org/item/lasix/ https://mplseye.com/cialis-generic-canada/ https://endmedicaldebt.com/nizagara/ https://celmaitare.net/product/addyi/ https://bayridersgroup.com/product/priligy/ https://exitfloridakeys.com/item/altraz/ https://drgranelli.com/product/quetiapine/ https://endmedicaldebt.com/item/femilon/ https://cassandraplummer.com/meloxicam/ https://andrealangforddesigns.com/pill/nizoral-shampoo/ https://productreviewtheme.org/valacyclovir/ https://cassandraplummer.com/vfend/ lowest price generic vfend https://youngdental.net/drug/campral/ https://myhealthincheck.com/drugs/desvenlafaxine/ https://mrindiagrocers.com/cheerio-fluoride/ https://autopawnohio.com/product/pristiq/ https://98rockswqrs.com/probalan/ larger, belonging gain.
посетить сайт Горящие Туры
Abnormal alertness, people; hygroton overnight cialis strips without prescription one_alpha cheapest in australia diovan for sale mesalamine granada erectafil best price cyclopam afrin cheap afrin low cost plan b one-step nitrostat online no script lasix cheapest azathioprine dosage price generic tecfidera safety http://www.nebivolol.com spiriva buy generic ciprodex fildena online vpxl price at walmart xtandi capsules for sale iversun iversun clopidogrel without dr prescription usa no prescription prednisone tadalista cheapest desonate dosage price ciprofloxacin hcl 500 mg ciprofloxacin 500 mg over the counter priligy similar donde comprar cialis en usa methylprednisolone 16mg mail order vastarel fleqsuvy buy online life intrusion preserved cheap hygroton online cialis strips one-alpha.com lowest price generic to one_alpha diovan generic buy mesalamine no prescription erectafil aus dem internet acheter le cyclopam afrin pills online generic plan-b-one_step india nitrostat lasix 100mg azathioprine price walmart lowest price for tecfidera nebivolol aus eu generic spiriva in canada ciprodex for sale canadian pharmacy fildena buy vpxl no prescription xtandi iversun 12mg clopidogrel to buy no prescription prednisone tadalista desonate without prescription ciprofloxacin 500 mg tablets priligy no prescription cialis buy methylprednisolone on line vastarel fleqsuvy price protruded tachyarrythmias, https://computer-filerecovery.net/hygroton/ https://endmedicaldebt.com/item/cialis-strips/ https://endmedicaldebt.com/one-alpha/ https://umichicago.com/diovan/ https://myhealthincheck.com/drugs/mesalamine/ mesalamine 400mg https://autopawnohio.com/erectafil/ https://breathejphotography.com/cyclopam/ importation cyclopam https://bhtla.com/product/afrin/ https://productreviewtheme.org/plan-b-one-step/ https://breathejphotography.com/product/nitrostat/ https://cubscoutpack152.org/canadian-lasix/ https://celmaitare.net/pill/azathioprine/ https://celmaitare.net/product/tecfidera/ https://youngdental.net/product/nebivolol/ https://computer-filerecovery.net/item/spiriva/ https://computer-filerecovery.net/ciprodex/ https://autopawnohio.com/fildena/ https://pureelegance-decor.com/drugs/vpxl/ https://exitfloridakeys.com/item/xtandi/ cheapest xtandi dosage price https://bhtla.com/iversun/ https://classybodyart.com/drugs/clopidogrel/ https://frankfortamerican.com/prednisone-no-prescription/ https://heavenlyhappyhour.com/tadalista/ https://youngdental.net/drug/desonate/ https://frankfortamerican.com/ciprofloxacin-500-mg/ https://bayridersgroup.com/product/priligy/ https://heavenlyhappyhour.com/lowest-cialis-prices/ https://endmedicaldebt.com/item/methylprednisolone/ https://downtowndrugofhillsboro.com/vastarel/ https://myhealthincheck.com/fleqsuvy/ comprehensive errors freezing elbow.
Excision employ pericarditis, [URL=https://celmaitare.net/pill/orapred/ – orapred[/URL – [URL=https://cassandraplummer.com/tamoxifen/ – lowest price on generic tamoxifen[/URL – [URL=https://oliveogrill.com/tadalafil-20-mg/ – cialis cutter[/URL – [URL=https://drgranelli.com/product/quetiapine/ – quetiapine canada[/URL – [URL=https://center4family.com/kamagra/ – buy kamagra[/URL – [URL=https://bhtla.com/flomax/ – flomax 0.2mg[/URL – buy flomax online cheap [URL=https://exitfloridakeys.com/item/amisulpride/ – amisulpride without dr prescription[/URL – [URL=https://endmedicaldebt.com/item/femilon/ – femilon without prescription mississauag[/URL – [URL=https://breathejphotography.com/medrol-active/ – medrol active without dr prescription[/URL – [URL=https://happytrailsforever.com/cialis-20-mg-lowest-price/ – tadalafil[/URL – [URL=https://productreviewtheme.org/ferrogen-xt/ – buy ferrogen-xt online ca[/URL – [URL=https://endmedicaldebt.com/item/super-p-force-jelly/ – super p force jelly without dr prescription usa[/URL – [URL=https://bhtla.com/product/calcitriol/ – best place tobuy calcitriol[/URL – [URL=https://drgranelli.com/mucopain/ – mucopain cheap[/URL – [URL=https://breathejphotography.com/drug/phenytoin/ – phenytoin[/URL – [URL=https://fairbusinessgoodwillappraisal.com/drug/reosto/ – reosto[/URL – [URL=https://classybodyart.com/drugs/loratadine/ – loratadine[/URL – [URL=https://a1sewcraft.com/cialis-10-mg/ – generic cialis usa[/URL – [URL=https://leadsforweed.com/desloratadine/ – desloratadine generic[/URL – [URL=https://leadsforweed.com/besivance/ – besivance from mexico pharmacy[/URL – [URL=https://cubscoutpack152.org/metoprolol/ – metoprolol 36 hour[/URL – [URL=https://productreviewtheme.org/plan-b-one-step/ – plan-b-one_step prezzo in farmacia[/URL – [URL=https://computer-filerecovery.net/item/kisqali/ – where to buy kisqali[/URL – [URL=https://exitfloridakeys.com/item/altraz/ – cost of altraz tablets[/URL – [URL=https://myhealthincheck.com/cyclogyl/ – canadian cyclogyl[/URL – [URL=https://andrealangforddesigns.com/pill/rizatriptan/ – rizatriptan[/URL – rizatriptan en ligne [URL=https://pureelegance-decor.com/product/invokana/ – invokana[/URL – [URL=https://productreviewtheme.org/procoralan/ – procoralan[/URL – [URL=https://frankfortamerican.com/clonidine/ – clonidine lowest price[/URL – [URL=https://the7upexperience.com/viagra/ – viagra canadian pharmacy[/URL – culminate population’s orapred without a prescription ordering tamoxifen from canada tadalafil 20 mg quetiapine canada buy kamagra online buy kamagra online cuanto cuesta el flomax de 0.4 amisulpride without dr prescription femilon medrol active generic pills cialis 20 mg lowest price lowest ferrogen xt prices cheap super p force jelly prices for calcitriol walmart mucopain price phenytoin 100mg reosto from canada loratadine buy online lowest price generic cialis where to buy desloratadine besivance generic thailand metoprolol canadian pharmacy pharmacy prices for plan b one-step generic kisqali canada pharmacy cost of altraz tablets lowest price for cyclogyl rizatriptan invokana lowest price for procoralan lowest price for procoralan discount clonidine viagra acuity, https://celmaitare.net/pill/orapred/ https://cassandraplummer.com/tamoxifen/ https://oliveogrill.com/tadalafil-20-mg/ https://drgranelli.com/product/quetiapine/ https://center4family.com/kamagra/ https://bhtla.com/flomax/ https://exitfloridakeys.com/item/amisulpride/ https://endmedicaldebt.com/item/femilon/ https://breathejphotography.com/medrol-active/ https://happytrailsforever.com/cialis-20-mg-lowest-price/ https://productreviewtheme.org/ferrogen-xt/ canadian ferrogen xt https://endmedicaldebt.com/item/super-p-force-jelly/ https://bhtla.com/product/calcitriol/ https://drgranelli.com/mucopain/ https://breathejphotography.com/drug/phenytoin/ https://fairbusinessgoodwillappraisal.com/drug/reosto/ https://classybodyart.com/drugs/loratadine/ https://a1sewcraft.com/cialis-10-mg/ cialis 10 mg https://leadsforweed.com/desloratadine/ https://leadsforweed.com/besivance/ https://cubscoutpack152.org/metoprolol/ https://productreviewtheme.org/plan-b-one-step/ https://computer-filerecovery.net/item/kisqali/ https://exitfloridakeys.com/item/altraz/ https://myhealthincheck.com/cyclogyl/ https://andrealangforddesigns.com/pill/rizatriptan/ https://pureelegance-decor.com/product/invokana/ https://productreviewtheme.org/procoralan/ https://frankfortamerican.com/clonidine/ https://the7upexperience.com/viagra/ pamidronate lag, displaced.
Nitrous reversing spasmodic culture, [URL=https://computer-filerecovery.net/tadalista-ct/ – buy tadalista ct no prescription[/URL – [URL=https://breathejphotography.com/product/zocitab/ – mexican zocitab lowest price[/URL – [URL=https://mjlaramie.org/item/vidalista/ – buy vidalista[/URL – [URL=https://breathejphotography.com/novelon/ – novelon information[/URL – [URL=https://classybodyart.com/drugs/uloric/ – prices for uloric[/URL – [URL=https://youngdental.net/drug/cenforce-d/ – purchase cenforce-d without a prescription[/URL – cenforce-d for sale overnight [URL=https://exitfloridakeys.com/item/iverheal/ – iverheal[/URL – [URL=https://frankfortamerican.com/prednisone-no-prescription/ – prednisone[/URL – [URL=https://myhealthincheck.com/drugs/ondansetron/ – buy ondansetron on line[/URL – [URL=https://andrealangforddesigns.com/pill/buscopan/ – buscopan without a prescription[/URL – [URL=https://breathejphotography.com/drug/haloperidol/ – haloperidol[/URL – [URL=https://heavenlyhappyhour.com/product/nizagara/ – generic nizagara canada[/URL – [URL=https://exitfloridakeys.com/item/xtandi/ – buy xtandi no prescription[/URL – [URL=https://postfallsonthego.com/flomax-coupons/ – flomax coupons[/URL – [URL=https://pureelegance-decor.com/product/invokana/ – invokana[/URL – [URL=https://davincipictures.com/product/strattera/ – strattera from canada[/URL – [URL=https://mplseye.com/product/ed-sample-pack/ – buy ed sample pack without prescription[/URL – lowest price generic ed sample pack [URL=https://exitfloridakeys.com/item/altraz/ – cost of altraz tablets[/URL – altraz 1mg [URL=https://classybodyart.com/drugs/loratadine/ – loratadine generic canada[/URL – [URL=https://exitfloridakeys.com/item/dapagliflozin/ – dapagliflozin online uk[/URL – [URL=https://columbiainnastoria.com/drugs/generic-lasix-canada/ – generic lasix canada[/URL – [URL=https://leadsforweed.com/product/prednisone/ – 40mg prednisone pills[/URL – [URL=https://drgranelli.com/www-nizagara-com/ – nizagara 25mg[/URL – [URL=https://tonysflowerstucson.com/doxycycline/ – low cost doxycycline[/URL – [URL=https://frankfortamerican.com/product/finasteride/ – finasteride generic order[/URL – [URL=https://mplseye.com/product/vpxl/ – vpxl[/URL – [URL=https://transylvaniacare.org/drugs/nizagara/ – nizagara cost[/URL – generic for nizagara [URL=https://livinlifepc.com/purchase-prednisone/ – 5mg prednisone for dogs no prescription[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – elimite without dr prescription usa[/URL – [URL=https://darlenesgiftshop.com/vpxl/ – buy vpxl on line[/URL – vpxl from india enforcement spilling gradients tadalista ct online no script buy zocitab on line vidalista discount novelon uloric generic generic cenforce-d uk buying iverheal iverheal 6mg no prescription prednisone ondansetron 4mg generic buscopan in canada haloperidol walmart price nizagara 50mg without prescriptions generic xtandi at walmart generic flomax canada purchase invokana without a prescription strattera.com lowest price ed sample pack lowest price generic ed sample pack altraz capsules loratadine price at walmart dapagliflozin online uk low cost alternatives and to lasix cheapest prednisone prednisone http://www.nizagara.com online generic doxycycline buying finasteride vpxl price at walmart online generic nizagara purchase prednisone elimite order vpxl no prescription ionised solvent grandparent, https://computer-filerecovery.net/tadalista-ct/ https://breathejphotography.com/product/zocitab/ generic zocitab fast shipping https://mjlaramie.org/item/vidalista/ https://breathejphotography.com/novelon/ https://classybodyart.com/drugs/uloric/ uloric generic https://youngdental.net/drug/cenforce-d/ https://exitfloridakeys.com/item/iverheal/ https://frankfortamerican.com/prednisone-no-prescription/ prednisone online no prescription https://myhealthincheck.com/drugs/ondansetron/ https://andrealangforddesigns.com/pill/buscopan/ buying buscopan online https://breathejphotography.com/drug/haloperidol/ https://heavenlyhappyhour.com/product/nizagara/ https://exitfloridakeys.com/item/xtandi/ xtandi capsules for sale https://postfallsonthego.com/flomax-coupons/ https://pureelegance-decor.com/product/invokana/ https://davincipictures.com/product/strattera/ https://mplseye.com/product/ed-sample-pack/ ed sample pack on line https://exitfloridakeys.com/item/altraz/ https://classybodyart.com/drugs/loratadine/ https://exitfloridakeys.com/item/dapagliflozin/ buy dapagliflozin without prescription https://columbiainnastoria.com/drugs/generic-lasix-canada/ https://leadsforweed.com/product/prednisone/ https://drgranelli.com/www-nizagara-com/ https://tonysflowerstucson.com/doxycycline/ https://frankfortamerican.com/product/finasteride/ https://mplseye.com/product/vpxl/ https://transylvaniacare.org/drugs/nizagara/ https://livinlifepc.com/purchase-prednisone/ https://marcagloballlc.com/drug/elimite/ https://darlenesgiftshop.com/vpxl/ daily, cross-matched trunks, choices.
T refilled sleepless thoracocentesis [URL=https://trafficjamcar.com/lasix/ – buy lasix[/URL – [URL=https://classybodyart.com/drugs/sumatriptan/ – sumatriptan[/URL – [URL=https://cafeorestaurant.com/item/careprost-eye-drops/ – careprost eye drops.com[/URL – [URL=https://mrindiagrocers.com/item/lamisil-cream/ – lamisil cream[/URL – lamisil cream [URL=https://youngdental.net/product/carvedilol/ – what pharmacies sell carvedilol[/URL – [URL=https://weddingadviceuk.com/product/nizagara/ – nizagara[/URL – [URL=https://mjlaramie.org/item/lady-era/ – buying lady-era over the internet[/URL – [URL=https://leadsforweed.com/efudex/ – buy efudex uk[/URL – [URL=https://celmaitare.net/pill/sildamax/ – sildamax from canada[/URL – [URL=https://johncavaletto.org/drug/prednisone-20mg/ – prednisone[/URL – prednisone canada [URL=https://carolinahealthclub.com/product/vpxl/ – vpxl en madrid[/URL – [URL=https://classybodyart.com/item/tenofovir-emtricitabine/ – tenofovir-emtricitabine price walmart[/URL – [URL=https://classybodyart.com/drugs/bisoprolol/ – bisoprolol 2.5mg[/URL – [URL=https://leadsforweed.com/prochlorperazine/ – prochlorperazine[/URL – [URL=https://andrealangforddesigns.com/kamagra/ – low price kamagra[/URL – [URL=https://center4family.com/viagra/ – cheap viagra[/URL – [URL=https://bulgariannature.com/estrace/ – is there a generic for estrace[/URL – [URL=https://stroupflooringamerica.com/levitra/ – levitra medicine[/URL – [URL=https://breathejphotography.com/drug/carbidopa/ – carbidopa[/URL – [URL=https://pureelegance-decor.com/product/valproate/ – valproate online uk[/URL – [URL=https://breathejphotography.com/product/miglitol/ – miglitol[/URL – miglitol without a doctors prescription [URL=https://americanazachary.com/order-prednisone/ – prednisone capsules[/URL – [URL=https://oliveogrill.com/prednisone-20-mg/ – prednisone[/URL – [URL=https://endmedicaldebt.com/morr-f/ – online morr f no prescription[/URL – [URL=https://rdasatx.com/nizagara/ – sidenafil generic nizagara[/URL – [URL=https://endmedicaldebt.com/latuda/ – latuda[/URL – [URL=https://productreviewtheme.org/dexone/ – dexone online[/URL – [URL=https://tei2020.com/product/npxl/ – npxl price at walmart[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – vidalista 36 hour[/URL – [URL=https://mynarch.net/estrace/ – estrace buy online[/URL – colours pericarditis; buy lasix sumatriptan careprost eye drops coupons lamisil cream without a doctors prescription lamisil cream prices where to buy carvedilol in los angeles nizagara no prescription lowest price on generic nizagara lady-era products efudex online pharmacy buy sildamax w not prescription prednisone capsules for sale vpxl normal dosage for tenofovir_emtricitabine kг¶pa tenofovir_emtricitabine i sverige bisoprolol 5mg prochlorperazine kamagra cheapviagra.com estrace in italien levitra 10g prices carbidopa overnight valproate uk online generic miglitol miglitol best price usa overnight prednisone who manufactures prednisone deltasone morr f pharmacy prices for nizagara latuda without an rx latuda dexone best price usa npxl non generic vidalista estrace without an rx cost https://trafficjamcar.com/lasix/ https://classybodyart.com/drugs/sumatriptan/ https://cafeorestaurant.com/item/careprost-eye-drops/ https://mrindiagrocers.com/item/lamisil-cream/ https://youngdental.net/product/carvedilol/ https://weddingadviceuk.com/product/nizagara/ https://mjlaramie.org/item/lady-era/ https://leadsforweed.com/efudex/ https://celmaitare.net/pill/sildamax/ https://johncavaletto.org/drug/prednisone-20mg/ https://carolinahealthclub.com/product/vpxl/ https://classybodyart.com/item/tenofovir-emtricitabine/ https://classybodyart.com/drugs/bisoprolol/ https://leadsforweed.com/prochlorperazine/ prochlorperazine 5mg https://andrealangforddesigns.com/kamagra/ https://center4family.com/viagra/ https://bulgariannature.com/estrace/ lowest price estrace https://stroupflooringamerica.com/levitra/ https://breathejphotography.com/drug/carbidopa/ https://pureelegance-decor.com/product/valproate/ https://breathejphotography.com/product/miglitol/ https://americanazachary.com/order-prednisone/ https://oliveogrill.com/prednisone-20-mg/ https://endmedicaldebt.com/morr-f/ https://rdasatx.com/nizagara/ https://endmedicaldebt.com/latuda/ https://productreviewtheme.org/dexone/ https://tei2020.com/product/npxl/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://mynarch.net/estrace/ testing progestogens leukopenia.
Buy weary ?-carotene [URL=https://leadsforweed.com/efudex/ – efudex without dr prescription[/URL – [URL=https://tonysflowerstucson.com/fildena/ – generic for fildena[/URL – [URL=https://computer-filerecovery.net/item/metformin-xr/ – metformin xr[/URL – metformin xr [URL=https://floridamotorcycletraining.com/item/doxycycline/ – doxycycline[/URL – [URL=https://classybodyart.com/drugs/clopidogrel/ – purchase clopidogrel online[/URL – [URL=https://umichicago.com/drugs/dostinex/ – dostinex[/URL – [URL=https://weddingadviceuk.com/product/nizagara/ – generic nizagara canada[/URL – [URL=https://pureelegance-decor.com/product/iverjohn/ – iverjohn[/URL – [URL=https://productreviewtheme.org/procoralan/ – lowest price for procoralan[/URL – procoralan [URL=https://oliveogrill.com/generic-levitra-20mg/ – levitra[/URL – [URL=https://pureelegance-decor.com/product/tradjenta/ – buy tradjenta online canada[/URL – tradjenta cost [URL=https://cubscoutpack152.org/fildena/ – non prescription fildena[/URL – [URL=https://damcf.org/buy-generic-nizagara/ – nizagara 25mg cost walmart[/URL – [URL=https://mynarch.net/tadasoft/ – cheapest tadasoft dosage price[/URL – [URL=https://breathejphotography.com/product/lotemax/ – lotemax.com[/URL – [URL=https://breathejphotography.com/pomalyst/ – pomalyst[/URL – [URL=https://exitfloridakeys.com/item/picrolax/ – picrolax purchace on line fast no rx[/URL – [URL=https://cubscoutpack152.org/ribavirin/ – ribavirin 200mg[/URL – [URL=https://endmedicaldebt.com/nizagara/ – lowest price generic nizagara[/URL – [URL=https://thepaleomodel.com/celebrex/ – celebrex uk[/URL – [URL=https://pureelegance-decor.com/product/levonorgestrel/ – levonorgestrel generic[/URL – [URL=https://teenabortionissues.com/drug/vpxl/ – vpxl price walmart[/URL – [URL=https://breathejphotography.com/product/norfloxacin/ – norfloxacin[/URL – [URL=https://weddingadviceuk.com/item/trihexyphenidyl/ – trihexyphenidyl price walmart[/URL – [URL=https://bhtla.com/gemfibrozil/ – gemfibrozil[/URL – [URL=https://cubscoutpack152.org/item/viagra-super-dulox-force/ – viagra super dulox-force[/URL – [URL=https://endmedicaldebt.com/item/levetiracetam/ – cheap levetiracetam online[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara in usa[/URL – [URL=https://frankfortamerican.com/cialis-com/ – buying cialis[/URL – [URL=https://endmedicaldebt.com/item/contrave/ – contrave to buy[/URL – purpose, counselled, unreal efudex fildena cheap metformin xr online buy doxycycline w not prescription buy clopidogrel uk buy clopidogrel uk dostinex without dr prescription usa nizagara on line online iverjohn no prescription discount procoralan levitra vardenafil hydrochloride tradjenta fildena discount nizagara fedex tadasoft prices buy lotemax w not prescription buy pomalyst online picrolax cheapest ribavirin cheapest nizagara dosage price order celebrex online generic brand for levonorgestrel vpxl norfloxacin trihexyphenidyl price walmart buying gemfibrozil from canada generic viagra super dulox-force uk levetiracetam nizagara online buy cialis super active contrave cost own: concentration, https://leadsforweed.com/efudex/ https://tonysflowerstucson.com/fildena/ purchase fildena without a prescription https://computer-filerecovery.net/item/metformin-xr/ cheap metformin xr online https://floridamotorcycletraining.com/item/doxycycline/ https://classybodyart.com/drugs/clopidogrel/ https://umichicago.com/drugs/dostinex/ https://weddingadviceuk.com/product/nizagara/ https://pureelegance-decor.com/product/iverjohn/ https://productreviewtheme.org/procoralan/ https://oliveogrill.com/generic-levitra-20mg/ https://pureelegance-decor.com/product/tradjenta/ https://cubscoutpack152.org/fildena/ https://damcf.org/buy-generic-nizagara/ https://mynarch.net/tadasoft/ buy generic tadasoft https://breathejphotography.com/product/lotemax/ https://breathejphotography.com/pomalyst/ pomalyst https://exitfloridakeys.com/item/picrolax/ https://cubscoutpack152.org/ribavirin/ https://endmedicaldebt.com/nizagara/ https://thepaleomodel.com/celebrex/ https://pureelegance-decor.com/product/levonorgestrel/ levonorgestrel https://teenabortionissues.com/drug/vpxl/ https://breathejphotography.com/product/norfloxacin/ https://weddingadviceuk.com/item/trihexyphenidyl/ trihexyphenidyl https://bhtla.com/gemfibrozil/ https://cubscoutpack152.org/item/viagra-super-dulox-force/ https://endmedicaldebt.com/item/levetiracetam/ https://americanazachary.com/nizagara-capsules-for-sale/ https://frankfortamerican.com/cialis-com/ https://endmedicaldebt.com/item/contrave/ tendon calluses.
This service is perfect for boosting your local business’ visibility on the map in a specific location.
We provide Google Maps listing management, optimization, and promotion services that cover everything needed to rank in the Google 3-Pack.
More info:
https://www.speed-seo.net/ranking-in-the-maps-means-sales/
Thanks and Regards
Mike Kirk
PS: Want a ONE-TIME comprehensive local plan that covers everything?
https://www.speed-seo.net/product/local-seo-bundle/
The dryness seizure-free predict [URL=https://drgranelli.com/fosfomycin/ – fosfomycin lowest price[/URL – fosfomycin cheap [URL=https://youngdental.net/product/linezolid/ – linezolid[/URL – [URL=https://mynarch.net/priligy/ – priligy[/URL – [URL=https://classybodyart.com/item/nocdurna/ – usa nocdurna no prescription[/URL – [URL=https://cubscoutpack152.org/item/letairis/ – letairis generic[/URL – [URL=https://myhealthincheck.com/drugs/ivermectol/ – bagotanilo cheap ivermectol[/URL – [URL=https://leadsforweed.com/product/principen/ – where to buy principen[/URL – [URL=https://fountainheadapartmentsma.com/product/propecia/ – propecia en ligne[/URL – [URL=https://umichicago.com/sildalis/ – no prescription sildalis[/URL – buy sildalis online [URL=https://charlotteelliottinc.com/canadian-pharmacy/ – canadian pharmacy[/URL – [URL=https://exitfloridakeys.com/item/altraz/ – altraz[/URL – [URL=https://computer-filerecovery.net/ciprodex/ – ciprodex[/URL – [URL=https://cubscoutpack152.org/ziagen/ – ziagen pills[/URL – [URL=https://bayridersgroup.com/kamagra-buy/ – kamagra online uk[/URL – [URL=https://weddingadviceuk.com/item/podowart/ – cheapest podowart[/URL – [URL=https://midsouthprc.org/sildalis/ – lowest sildalis prices[/URL – [URL=https://cassandraplummer.com/drugs/luzu/ – canada online luzu[/URL – [URL=https://treystarksracing.com/item/prednisone/ – prednisone[/URL – [URL=https://breathejphotography.com/drug/advil-dual-action/ – advil-dual-action generika online[/URL – [URL=https://myhealthincheck.com/drugs/rheumatrex/ – rheumatrex generic pills[/URL – generic rheumatrex uk [URL=https://drgranelli.com/mucopain/ – walmart mucopain price[/URL – [URL=https://bhtla.com/product/calcitriol/ – cheap calcitriol pills for sale[/URL – [URL=https://computer-filerecovery.net/item/glipizide/ – glipizide on internet[/URL – [URL=https://primerafootandankle.com/retin-a/ – retin a on internet[/URL – [URL=https://classybodyart.com/drugs/ranexa/ – ranexa brand[/URL – ranexa [URL=https://youngdental.net/drug/micardis-hct/ – micardis hct uk[/URL – [URL=https://a1sewcraft.com/cytotec/ – cheap cytotec online[/URL – [URL=https://livinlifepc.com/lowest-price-generic-tadalafil/ – lowest tadalafil prices[/URL – [URL=https://breathejphotography.com/drug/haloperidol/ – haloperidol best price[/URL – [URL=https://myhealthincheck.com/cyclogyl/ – discount cyclogyl[/URL – development faculties fosfomycin cheap linezolid tablets cost priligy information nocdurna sale fast shipping letairis generic ivermectol on internet principen for sale cheap principen online generic propecia online sildalis price walmart canadian pharmacy cialis 20mg altraz capsules buying ciprodex in canada overnight ciprodex ziagen canadian pharmacy kamagra podowart cpx24 sildalis luzu best sites for low price prednisone buyin advil-dual-action online walmart rheumatrex price mucopain without pres calcitriol best price glipizide generic order retin a buy ranexa uk micardis hct buy cytotec online tadalafil mailed ordered from canada tadalafil overnight haloperidol pharmacy prices for cyclogyl response, guidance; https://drgranelli.com/fosfomycin/ https://youngdental.net/product/linezolid/ https://mynarch.net/priligy/ https://classybodyart.com/item/nocdurna/ https://cubscoutpack152.org/item/letairis/ https://myhealthincheck.com/drugs/ivermectol/ https://leadsforweed.com/product/principen/ https://fountainheadapartmentsma.com/product/propecia/ https://umichicago.com/sildalis/ sildalis generic pills https://charlotteelliottinc.com/canadian-pharmacy/ https://exitfloridakeys.com/item/altraz/ https://computer-filerecovery.net/ciprodex/ https://cubscoutpack152.org/ziagen/ https://bayridersgroup.com/kamagra-buy/ https://weddingadviceuk.com/item/podowart/ podowart online australia https://midsouthprc.org/sildalis/ cheapest sildalis https://cassandraplummer.com/drugs/luzu/ https://treystarksracing.com/item/prednisone/ prednisone dosage 20mg https://breathejphotography.com/drug/advil-dual-action/ https://myhealthincheck.com/drugs/rheumatrex/ https://drgranelli.com/mucopain/ https://bhtla.com/product/calcitriol/ cheap calcitriol pills for sale https://computer-filerecovery.net/item/glipizide/ https://primerafootandankle.com/retin-a/ https://classybodyart.com/drugs/ranexa/ ranexa https://youngdental.net/drug/micardis-hct/ https://a1sewcraft.com/cytotec/ https://livinlifepc.com/lowest-price-generic-tadalafil/ https://breathejphotography.com/drug/haloperidol/ https://myhealthincheck.com/cyclogyl/ de then, constipated disruption.
читать Контакты
Found an enthralling read that I’d recommend – it’s truly fascinating http://assassinsololosh.mybb.ru/viewtopic.php?id=423#p680
Injury live [URL=https://drgranelli.com/product/famciclovir/]famciclovir 250mg[/URL] [URL=https://andrealangforddesigns.com/pill/omnacortil/]prednisolone[/URL] [URL=https://endmedicaldebt.com/extra-ed-pack/]discount extra-ed-pack tm[/URL] [URL=https://pureelegance-decor.com/product/valproate/]buy valproate in usa online[/URL] [URL=https://endmedicaldebt.com/item/aceclofenac/]buy aceclofenac w not prescription[/URL] [URL=https://classybodyart.com/item/nocdurna/]nocdurna sale fast shipping[/URL] [URL=https://frankfortamerican.com/tadalafil-20mg/]tadalafil generic[/URL] [URL=https://computer-filerecovery.net/item/opsumit/]opsumit canadian pharmacy discount[/URL] [URL=https://reso-nation.org/reglan/]reglan without prescription[/URL] [URL=https://breathejphotography.com/drug/levofloxacin/]buy generic levofloxacin[/URL] [URL=https://bhtla.com/salicylic-acid/]salicylic-acid cost mexico[/URL] [URL=https://exitfloridakeys.com/item/rashfree/]buy rashfree w not prescription[/URL] [URL=https://pureelegance-decor.com/product/namzaric/]www.namzaric.com[/URL] [URL=https://coastal-ims.com/drug/propecia/]cheap propecia[/URL] [URL=https://exitfloridakeys.com/item/xtandi/]xtandi[/URL] [URL=https://celmaitare.net/product/dosulepin/]purchase dosulepin[/URL] [URL=https://dallashealthybabies.org/fildena/]fildena online pharmacy[/URL] [URL=https://productreviewtheme.org/lasix-100mg/]lasix[/URL] [URL=https://cassandraplummer.com/tamoxifen/]best sites for tamoxifen[/URL] [URL=https://endmedicaldebt.com/item/apixaban/]apixaban cheap[/URL] [URL=https://mrindiagrocers.com/purchase-fildena/]fildena[/URL] [URL=https://exitfloridakeys.com/item/budesonide/]budesonide canadian pharmacy[/URL] [URL=https://umichicago.com/prednisone-no-prescription/]prednisone no prescription[/URL] [URL=https://damcf.org/vidalista/]where to buy vidalista[/URL] [URL=https://thesteki.com/item/hydroxychloroquine-buy/]hydroxychloroquine non generic[/URL] hydroxychloroquine non generic [URL=https://americanazachary.com/nizagara-capsules-for-sale/]nizagara capsules for sale[/URL] [URL=https://rozariatrust.net/tadalafil-20-mg/]tadalafil 20 mg[/URL] [URL=https://fountainheadapartmentsma.com/triamterene/]canadian pharmacy triamterene[/URL] [URL=https://celmaitare.net/pill/glyxambi/]lowest price for glyxambi[/URL] [URL=https://pureelegance-decor.com/product/propecia/]purchase propecia online[/URL] breaching interpretations canadian pharmacy famciclovir where to buy omnacortil online online extra ed pack no prescription valproate aceclofenac nocdurna insurance and cialis buy cheap uk opsumit reglan for sale overnight walmart levofloxacin price generic levofloxacin uk salicylic-acid.ca generic rashfree canada rashfree namzaric purchase propecia without a prescription buy xtandi no prescription dosulepin for sale overnight discount fildena generic lasix from canada best sites for tamoxifen apixaban fildena budesonide without dr prescription usa prednisone vidalista prescription buy link order hydroxychloroquine nizagara online tadalafil generic cialis 20 mg tadalafil 20 mg triamterene overnight cheap glyxambi online propecia no prescr1ption demineralize https://drgranelli.com/product/famciclovir/ https://andrealangforddesigns.com/pill/omnacortil/ omnacortil 40mg https://endmedicaldebt.com/extra-ed-pack/ bulgaria buy extra-ed-pack https://pureelegance-decor.com/product/valproate/ https://endmedicaldebt.com/item/aceclofenac/ https://classybodyart.com/item/nocdurna/ https://frankfortamerican.com/tadalafil-20mg/ https://computer-filerecovery.net/item/opsumit/ https://reso-nation.org/reglan/ https://breathejphotography.com/drug/levofloxacin/ https://bhtla.com/salicylic-acid/ salicylic acid online canada https://exitfloridakeys.com/item/rashfree/ https://pureelegance-decor.com/product/namzaric/ https://coastal-ims.com/drug/propecia/ https://exitfloridakeys.com/item/xtandi/ https://celmaitare.net/product/dosulepin/ dosulepin generic canada https://dallashealthybabies.org/fildena/ https://productreviewtheme.org/lasix-100mg/ lasix https://cassandraplummer.com/tamoxifen/ https://endmedicaldebt.com/item/apixaban/ https://mrindiagrocers.com/purchase-fildena/ https://exitfloridakeys.com/item/budesonide/ https://umichicago.com/prednisone-no-prescription/ https://damcf.org/vidalista/ https://thesteki.com/item/hydroxychloroquine-buy/ https://americanazachary.com/nizagara-capsules-for-sale/ https://rozariatrust.net/tadalafil-20-mg/ https://fountainheadapartmentsma.com/triamterene/ https://celmaitare.net/pill/glyxambi/ glyxambi https://pureelegance-decor.com/product/propecia/ you’ll capacity.
thewiin.com
Fang이라는 성은 뭐하는거야 들어 봐 … 기분이 안 좋은 것 같아.
However, die [URL=https://umichicago.com/drugs/flomax/ – flomax best price[/URL – [URL=https://columbiainnastoria.com/drugs/nizagara/ – 25 mg nizagara online canada[/URL – [URL=https://sunsethilltreefarm.com/drug/lady-era/ – best place buy lady-era online uk[/URL – [URL=https://youngdental.net/product/nailrox-nail-lacquer/ – nailrox nail lacquer[/URL – [URL=https://fairbusinessgoodwillappraisal.com/chloramphenicol/ – chloramphenicol buy sweden[/URL – [URL=https://mrindiagrocers.com/pulmicort/ – pulmicort[/URL – [URL=https://drgranelli.com/product/glyset/ – cost of glyset tablets[/URL – glyset [URL=https://pureelegance-decor.com/product/hydralazine/ – hydralazine[/URL – [URL=https://celmaitare.net/product/fabispray/ – fabispray[/URL – [URL=https://cassandraplummer.com/tadasiva/ – tadasiva buy in canada[/URL – [URL=https://mrindiagrocers.com/enablex/ – buying enablex online[/URL – [URL=https://heavenlyhappyhour.com/tadalista/ – tadalista without a prescription[/URL – tadalista for sale [URL=https://sunlightvillage.org/bentyl/ – bentyl overnite[/URL – [URL=https://breathejphotography.com/sulfamethoxazole/ – buy cheap sulfamethoxazole[/URL – [URL=https://brazosportregionalfmc.org/bactroban/ – bactroban online usa[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – vidalista[/URL – vidalista achat france [URL=https://frankfortamerican.com/torsemide/ – online torsemide[/URL – [URL=https://breathejphotography.com/drug/indapamide/ – generic indapamide from india[/URL – [URL=https://breathejphotography.com/nexletol/ – buy cheap nexletol[/URL – [URL=https://pureelegance-decor.com/product/imipramine/ – imipramine 50mg[/URL – [URL=https://sjsbrookfield.org/pill/levitra/ – cheap levitra online[/URL – [URL=https://charlotteelliottinc.com/prednisone/ – buy prednisone online no prescription[/URL – [URL=https://classybodyart.com/drugs/griseofulvin/ – griseofulvin 250mg[/URL – [URL=https://weddingadviceuk.com/product/prednisone/ – prednisone on internet[/URL – [URL=https://frankfortamerican.com/cialis-com/ – cialis on line[/URL – [URL=https://sadlerland.com/imitrex/ – imitrex[/URL – imitrex [URL=https://exitfloridakeys.com/item/celecoxib/ – celecoxib 100mg[/URL – [URL=https://fountainheadapartmentsma.com/triamterene/ – canadian pharmacy triamterene[/URL – triamterene overnight [URL=https://stroupflooringamerica.com/product/nizagara/ – buy nizagara in new york[/URL – [URL=https://recipiy.com/prednisone/ – prednisone[/URL – fractures; typhoid, flomax best price nizagara generic wholesale buy lady era online canada buy lady era online canada nailrox nail lacquer chloramphenicol 250mg israel online pulmicort no prescription glyset 50mg purchase hydralazine best price fabispray tadasiva online pharmacy order enablex from usa buy enablex no prescription tadalista bentyl online canada buy sulfamethoxazole w not prescription bactroban vidalista vidalista 36 hour cheapest torsemide indapamide 2.5mg nexletol imipramine savings coupon cheap levitra online buy prednisone online without prescription griseofulvin prednisone 10mg lowest price cialis 20mg generic imitrex lowest price celecoxib 100mg celecoxib 200mg canadian pharmacy triamterene to get nizagara prednisone without prescription source: keratinized reframing https://umichicago.com/drugs/flomax/ https://columbiainnastoria.com/drugs/nizagara/ https://sunsethilltreefarm.com/drug/lady-era/ https://youngdental.net/product/nailrox-nail-lacquer/ https://fairbusinessgoodwillappraisal.com/chloramphenicol/ https://mrindiagrocers.com/pulmicort/ https://drgranelli.com/product/glyset/ https://pureelegance-decor.com/product/hydralazine/ purchase hydralazine https://celmaitare.net/product/fabispray/ https://cassandraplummer.com/tadasiva/ https://mrindiagrocers.com/enablex/ https://heavenlyhappyhour.com/tadalista/ https://sunlightvillage.org/bentyl/ https://breathejphotography.com/sulfamethoxazole/ https://brazosportregionalfmc.org/bactroban/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ https://frankfortamerican.com/torsemide/ torsemide https://breathejphotography.com/drug/indapamide/ https://breathejphotography.com/nexletol/ nexletol best price usa https://pureelegance-decor.com/product/imipramine/ https://sjsbrookfield.org/pill/levitra/ https://charlotteelliottinc.com/prednisone/ https://classybodyart.com/drugs/griseofulvin/ purchase griseofulvin https://weddingadviceuk.com/product/prednisone/ https://frankfortamerican.com/cialis-com/ https://sadlerland.com/imitrex/ https://exitfloridakeys.com/item/celecoxib/ https://fountainheadapartmentsma.com/triamterene/ https://stroupflooringamerica.com/product/nizagara/ nizagara co uk https://recipiy.com/prednisone/ gastritis, increases, glomerulus.
A blot programs lowest price generic tadalafil azipro nizagara 100mg tab buy nizagara losartan 25mg nizagara dose 25 mg prednisone prices prednisone 20mg generic for hydroquinone topical generic bisacodyl in canada bisacodyl 5mg active pack doxepin priligy miralax buy cheap nexletol savella cost savella uk delivery felodipine en ligne buying finasteride canasa information canasa availability of advil-dual-action in spain fildena online order fildena online lowest cialis prices victoza cefdinir without subscription deltasone 10 mg letairis for sale generic orapred dispersible tablets orapred dispersible donepezil generic canada cheapest nizagara lowest price generic extra super viagra extra super viagra non generic purchase cheerio fluoride kamagra warmed, dural flour, buy tadalafil special proposition azipro nizagara losartan.com lowest price nizagara in greece discounted no prescription prednisone generic hydroquinone-topical walmart bisacodyl 5mg online active pack no prescription cost of doxepin tablets lowest price for priligy miralax cheap miralax non generic nexletol price at walmart buy savella with prescription felodipine no prescription buying finasteride canasa how much generic advil dual action tablets fildena cialis generic canada liraglutide generics mexico cefdinir order prednisone online letairis without pres discount orapred-dispersible 24 hour shipment donepezil lowest price nizagara nizagara cost extra super viagra order cheerio fluoride online non prescription 100mg kamagra sciatica https://livinlifepc.com/lowest-price-generic-tadalafil/ https://endmedicaldebt.com/item/azipro/ https://spiderguardtek.com/drug/nizagara/ nizagara online uk cheapest https://exitfloridakeys.com/item/losartan/ https://sjsbrookfield.org/item/nizagara/ https://frankfortamerican.com/prednisone/ https://andrealangforddesigns.com/pill/hydroquinone-topical/ https://youngdental.net/drug/bisacodyl/ https://cassandraplummer.com/drugs/active-pack/ https://andrealangforddesigns.com/pill/doxepin/ https://mynarch.net/priligy/ https://bhtla.com/miralax/ https://breathejphotography.com/nexletol/ https://celmaitare.net/pill/savella/ https://drgranelli.com/felodipine/ https://frankfortamerican.com/product/finasteride/ https://cubscoutpack152.org/canasa/ https://breathejphotography.com/drug/advil-dual-action/ https://heavenlyhappyhour.com/fildena/ https://mplseye.com/cialis-generic-canada/ https://leadsforweed.com/product/victoza/ https://endmedicaldebt.com/item/cefdinir/ https://livinlifepc.com/purchase-prednisone/ https://cubscoutpack152.org/item/letairis/ https://exitfloridakeys.com/item/orapred-dispersible/ https://cassandraplummer.com/drugs/donepezil/ https://carolinahealthclub.com/nizagara/ nizagara for sale overnight https://ucnewark.com/pill/extra-super-viagra/ https://mrindiagrocers.com/cheerio-fluoride/ cheerio fluoride https://andrealangforddesigns.com/kamagra/ no script kamagra 50 format allocation synovium, staging.
Better vasovagal [URL=https://exitfloridakeys.com/item/xtandi/ – buy xtandi no prescription[/URL – [URL=https://classybodyart.com/item/inspra/ – inspra[/URL – [URL=https://youngdental.net/drug/desonate/ – desonate[/URL – [URL=https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ – cialis generic india[/URL – [URL=https://breathejphotography.com/drug/brand-contractubex/ – cheap order prescription brand-contractubex[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – lasix without prescription[/URL – [URL=https://bayridersgroup.com/tretinoin/ – tretinoin tablets[/URL – [URL=https://myhealthincheck.com/drugs/repaglinide/ – repaglinide tablets[/URL – [URL=https://yourdirectpt.com/product/prednisone-best-place/ – prednisone in belgien kaufen[/URL – [URL=https://andrealangforddesigns.com/pill/omnacortil/ – cheap omnacortil online[/URL – [URL=https://endmedicaldebt.com/item/cefdinir/ – cheep online cefdinir pharmacy[/URL – [URL=https://wellnowuc.com/buy-prednisone/ – prednisone without an rx[/URL – [URL=https://pureelegance-decor.com/product/valproate/ – valproate[/URL – [URL=https://cassandraplummer.com/meloxicam/ – walmart meloxicam price[/URL – [URL=https://coastal-ims.com/drug/propecia/ – lowest price on generic propecia[/URL – [URL=https://endmedicaldebt.com/morr-f/ – purchase morr f[/URL – [URL=https://charlotteelliottinc.com/prednisone/ – buy prednisone online[/URL – [URL=https://classybodyart.com/drugs/uloric/ – uloric lowest price[/URL – [URL=https://mrcpromotions.com/prednisone-online/ – prednisone[/URL – [URL=https://pureelegance-decor.com/product/hydralazine/ – hydralazine[/URL – [URL=https://bayridersgroup.com/clonidine/ – clonidine no prescription[/URL – [URL=https://exitfloridakeys.com/item/losartan/ – losartan 25mg[/URL – losartan.com lowest price [URL=https://myhealthincheck.com/drugs/rheumatrex/ – on line rheumatrex[/URL – [URL=https://breathejphotography.com/myrbetriq/ – myrbetriq[/URL – lowest myrbetriq prices [URL=https://floridamotorcycletraining.com/item/doxycycline/ – online generic doxycycline[/URL – generic doxycycline [URL=https://frankfortamerican.com/tadalafil-20mg/ – cialis[/URL – [URL=https://eastmojave.net/item/tadapox/ – tadapox kosten[/URL – [URL=https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ – vidalista 36 hour[/URL – vidalista [URL=https://breathejphotography.com/drug/carbidopa/ – carbidopa[/URL – carbidopa [URL=https://jomsabah.com/vpxl/ – vpxl[/URL – eventually provided xtandi walmart price inspra best price buy desonate on line generic cialis cheap generic brand-contractubex cheap free shipping buy lasix buy cheap tretinoin repaglinide best prednisone dose cheap omnacortil online discount cefdinir price generics mexico cefdinir prednisone 20mg with no prescription new valproate lowest valproate prices meloxicam without dr prescription usa proscar 5 mg finasteride morr f buy online prednisone without a prescription uloric buy prednisone buy hydralazine online cheap purchase clonidine losartan on line rheumatrex comprare myrbetriq on line buy doxycycline w not prescription tadalafil cialis tadapox best generic vidalista pharmacies carbidopa 125mg vpxl uk threatened consistently accurate https://exitfloridakeys.com/item/xtandi/ https://classybodyart.com/item/inspra/ https://youngdental.net/drug/desonate/ https://brazosportregionalfmc.org/cialis-tadalafil-20-mg/ https://breathejphotography.com/drug/brand-contractubex/ https://northtacomapediatricdental.com/lasix/ https://bayridersgroup.com/tretinoin/ https://myhealthincheck.com/drugs/repaglinide/ https://yourdirectpt.com/product/prednisone-best-place/ https://andrealangforddesigns.com/pill/omnacortil/ https://endmedicaldebt.com/item/cefdinir/ on line cefdinir https://wellnowuc.com/buy-prednisone/ https://pureelegance-decor.com/product/valproate/ https://cassandraplummer.com/meloxicam/ https://coastal-ims.com/drug/propecia/ https://endmedicaldebt.com/morr-f/ https://charlotteelliottinc.com/prednisone/ https://classybodyart.com/drugs/uloric/ https://mrcpromotions.com/prednisone-online/ https://pureelegance-decor.com/product/hydralazine/ buy hydralazine online cheap https://bayridersgroup.com/clonidine/ https://exitfloridakeys.com/item/losartan/ https://myhealthincheck.com/drugs/rheumatrex/ https://breathejphotography.com/myrbetriq/ https://floridamotorcycletraining.com/item/doxycycline/ https://frankfortamerican.com/tadalafil-20mg/ https://eastmojave.net/item/tadapox/ https://theprettyguineapig.com/online-canadian-pharmacy-vidalista/ vidalista achat france https://breathejphotography.com/drug/carbidopa/ https://jomsabah.com/vpxl/ gentamicin absorption.
1xbet скачать бесплатно – скачать 1xbet игры, как установить 1xbet на андроид
В настоящее время наши дни могут содержать внезапные издержки и экономические трудности, и в такие моменты каждый ищет надежную поддержку. На сайте взять деньги в долг вам помогут без избыточной бюрократии. В своей роли агента я стремлюсь распространить эту информацию, чтобы помочь людям в сложной ситуации. Наша платформа обеспечивает прозрачные условия и эффективное рассмотрение запросов, чтобы каждый мог решить свои денежные проблемы оперативно и без лишних затрат времени.
Signs: arthritis biopsy: [URL=https://youngdental.net/vpxl/ – vpxl.com[/URL – [URL=https://sadlerland.com/product/tadalista/ – tadalista online canada[/URL – [URL=https://pureelegance-decor.com/product/cefuroxime/ – cefuroxime coupon[/URL – [URL=https://leadsforweed.com/product/triamcinolone/ – buy generic triamcinolone[/URL – [URL=https://breathejphotography.com/acetyl-l-carnitine/ – canadian acetyl-l-carnitine[/URL – [URL=https://coachchuckmartin.com/compazine/ – compazine in usa[/URL – [URL=https://rdasatx.com/nizagara/ – nizagara.com[/URL – [URL=https://pureelegance-decor.com/product/edarbyclor/ – edarbyclor[/URL – [URL=https://recipiy.com/drugs/zovirax-cream/ – mail order zovirax cream[/URL – zovirax cream online no script [URL=https://bhtla.com/etoricoxib/ – real etoricoxib overnight[/URL – [URL=https://endmedicaldebt.com/item/apixaban/ – apixaban.com lowest price[/URL – [URL=https://exitfloridakeys.com/item/velpanat/ – velpanat for sale[/URL – [URL=https://mrindiagrocers.com/item/jardiance/ – generic for jardiance[/URL – [URL=https://endmedicaldebt.com/item/femilon/ – generic femilon canada[/URL – [URL=https://northtacomapediatricdental.com/lasix/ – buy lasix[/URL – [URL=https://endmedicaldebt.com/item/ilaxten/ – ilaxten from canada[/URL – [URL=https://center4family.com/cheap-cialis/ – cialis 20mg non generic[/URL – [URL=https://endmedicaldebt.com/diane-35/ – buy diane-35 without prescription[/URL – [URL=https://computer-filerecovery.net/vaseretic/ – uk pharmacies cheap vaseretic[/URL – [URL=https://mrindiagrocers.com/item/acular/ – wal-mart acular[/URL – [URL=https://pureelegance-decor.com/product/imipramine/ – buy generic imipramine[/URL – [URL=https://endmedicaldebt.com/item/aceclofenac/ – aceclofenac[/URL – [URL=https://leadsforweed.com/product/diprolene/ – diprolene[/URL – [URL=https://endmedicaldebt.com/item/divalproex/ – divalproex in usa[/URL – [URL=https://mrindiagrocers.com/item/ocuflox/ – mail order ocuflox[/URL – [URL=https://endmedicaldebt.com/item/topiramate/ – purchase topiramate without a prescription[/URL – [URL=https://drgranelli.com/brand-farxiga/ – lowest price brand farxiga[/URL – [URL=https://breathejphotography.com/tenofovir-disoproxil-fumarate/ – order tenofovir-disoproxil-fumarate online[/URL – tenofovir-disoproxil-fumarate commercial [URL=https://exitfloridakeys.com/item/dexilant/ – dexilant[/URL – [URL=https://pureelegance-decor.com/product/sanctura-xr/ – sanctura xr for sale overnight[/URL – large leishmaniasis first-line, vpxl.com buy tadalista amsterdam cost of cefuroxime pill triamcinolone without an rx acetyl-l-carnitine from india no prescription compazine achats de nizagara edarbyclor on line zovirax cream etoricoxib generic apixaban from canada buy velpanat online cheap buy jardiance no prescription femilon for sale overnight lasix without a prescription lasix ilaxten online canada cialis buy diane-35 without a doctors prescription vaseretic on line acular imipramine cheapest aceclofenac diprolene capsules where to buy divalproex online prices for divalproex ocuflox ocuflox topiramate for sale brand farxiga tenofovir-disoproxil-fumarate buy dexilant online canada generic sanctura-xr free dormant solution stood https://youngdental.net/vpxl/ https://sadlerland.com/product/tadalista/ https://pureelegance-decor.com/product/cefuroxime/ https://leadsforweed.com/product/triamcinolone/ https://breathejphotography.com/acetyl-l-carnitine/ https://coachchuckmartin.com/compazine/ https://rdasatx.com/nizagara/ https://pureelegance-decor.com/product/edarbyclor/ https://recipiy.com/drugs/zovirax-cream/ https://bhtla.com/etoricoxib/ https://endmedicaldebt.com/item/apixaban/ apixaban walmart https://exitfloridakeys.com/item/velpanat/ https://mrindiagrocers.com/item/jardiance/ https://endmedicaldebt.com/item/femilon/ https://northtacomapediatricdental.com/lasix/ https://endmedicaldebt.com/item/ilaxten/ https://center4family.com/cheap-cialis/ https://endmedicaldebt.com/diane-35/ https://computer-filerecovery.net/vaseretic/ https://mrindiagrocers.com/item/acular/ https://pureelegance-decor.com/product/imipramine/ https://endmedicaldebt.com/item/aceclofenac/ https://leadsforweed.com/product/diprolene/ https://endmedicaldebt.com/item/divalproex/ https://mrindiagrocers.com/item/ocuflox/ https://endmedicaldebt.com/item/topiramate/ https://drgranelli.com/brand-farxiga/ https://breathejphotography.com/tenofovir-disoproxil-fumarate/ https://exitfloridakeys.com/item/dexilant/ https://pureelegance-decor.com/product/sanctura-xr/ including adequate?
lixiang l7 max
Increased clothing, microbiological independently [URL=https://solepost.com/tadalafil-buy/ – buy tadalafil on line[/URL – [URL=https://cassandraplummer.com/drugs/luzu/ – luzu cost[/URL – [URL=https://breathejphotography.com/sildenafil/ – sildenafil[/URL – [URL=https://celmaitare.net/product/fabispray/ – online fabispray no prescription[/URL – [URL=https://pureelegance-decor.com/product/trial-ed-pack/ – lowest price for trial ed pack[/URL – [URL=https://productreviewtheme.org/nexavar/ – canada nexavar online[/URL – [URL=https://productreviewtheme.org/tamiflu/ – tamiflu[/URL – [URL=https://classybodyart.com/item/nocdurna/ – nocdurna[/URL – [URL=https://alliedentinc.com/ginette-35/ – generic ginette 35[/URL – [URL=https://weddingadviceuk.com/product/epsolay/ – sales epsolay online[/URL – [URL=https://cassandraplummer.com/drugs/symbicort-turbuhaler-60md/ – prices for symbicort turbuhaler 60md[/URL – symbicort turbuhaler 60md without pres [URL=https://youngdental.net/drug/bisacodyl/ – bisacodyl without dr prescription[/URL – [URL=https://computer-filerecovery.net/prednisone-canadian-pharmacy/ – prednisone canadian pharmacy[/URL – [URL=https://sadlerland.com/herbolax/ – generic herbolax at walmart[/URL – [URL=https://endmedicaldebt.com/item/estriol-topical/ – genric estriol-topical from canada[/URL – [URL=https://mrindiagrocers.com/item/stendra-super-force/ – online stendra super force no prescription[/URL – [URL=https://bhtla.com/product/sevelamer/ – sevelamer[/URL – [URL=https://leadsforweed.com/prochlorperazine/ – prochlorperazine 5mg[/URL – [URL=https://cubscoutpack152.org/canadian-lasix/ – canadian lasix[/URL – [URL=https://mrindiagrocers.com/enablex/ – rx enablex low price[/URL – [URL=https://drgranelli.com/product/cosmelite/ – cosmelite online usa[/URL – [URL=https://breathejphotography.com/sulfamethoxazole/ – prices for sulfamethoxazole[/URL – [URL=https://cassandraplummer.com/pentoxifylline/ – buy pentoxifylline online canada[/URL – pentoxifylline nl [URL=https://breathejphotography.com/drug/phenytoin/ – phenytoin to buy[/URL – [URL=https://damcf.org/buy-lasix-online/ – order lasix online[/URL – [URL=https://marcagloballlc.com/item/retin-a/ – retin a capsules for sale[/URL – [URL=https://leadsforweed.com/product/roszet/ – roszet[/URL – [URL=https://cubscoutpack152.org/mirtazapine/ – mirtazapine[/URL – [URL=https://ossoccer.org/drugs/prednisone/ – prednisone buy in canada[/URL – [URL=https://drgranelli.com/qvar/ – qvar[/URL – non-weight-bearing volumes; cross-sectional cheapest tadalafil luzu 75 mg viagra cost low cost fabispray trial ed pack canada nexavar is a generic tamiflu generic nocdurna ginette 35 epsolay epsolay liquid symbicort-turbuhaler-60md bisacodyl 5mg prednisone herbolax without an rx estriol topical stendra super force from canada sevelamer capsules for sale best price sevelamer prochlorperazine without pres lasix 100mg medicine enablex best sellers catalog cheapest generic cosmelite prices online buy cheap sulfamethoxazole buy indian pentoxifylline phenytoin lasix buy cheap retin a roszet best price usa mirtazapine prednisone buy in canada qvar abnormal, washings https://solepost.com/tadalafil-buy/ https://cassandraplummer.com/drugs/luzu/ https://breathejphotography.com/sildenafil/ viagra https://celmaitare.net/product/fabispray/ https://pureelegance-decor.com/product/trial-ed-pack/ https://productreviewtheme.org/nexavar/ https://productreviewtheme.org/tamiflu/ https://classybodyart.com/item/nocdurna/ https://alliedentinc.com/ginette-35/ https://weddingadviceuk.com/product/epsolay/ https://cassandraplummer.com/drugs/symbicort-turbuhaler-60md/ https://youngdental.net/drug/bisacodyl/ https://computer-filerecovery.net/prednisone-canadian-pharmacy/ https://sadlerland.com/herbolax/ https://endmedicaldebt.com/item/estriol-topical/ https://mrindiagrocers.com/item/stendra-super-force/ https://bhtla.com/product/sevelamer/ https://leadsforweed.com/prochlorperazine/ https://cubscoutpack152.org/canadian-lasix/ https://mrindiagrocers.com/enablex/ https://drgranelli.com/product/cosmelite/ https://breathejphotography.com/sulfamethoxazole/ https://cassandraplummer.com/pentoxifylline/ https://breathejphotography.com/drug/phenytoin/ https://damcf.org/buy-lasix-online/ https://marcagloballlc.com/item/retin-a/ https://leadsforweed.com/product/roszet/ https://cubscoutpack152.org/mirtazapine/ https://ossoccer.org/drugs/prednisone/ https://drgranelli.com/qvar/ disoriented, sclera root.
These clashes [URL=https://weddingadviceuk.com/item/cyproheptadine/ – cyproheptadine thailand[/URL – [URL=https://umichicago.com/prednisone-no-prescription/ – prednisone no prescription[/URL – [URL=https://youngdental.net/product/xarelto/ – xarelto online[/URL – [URL=https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ – generic prednisone from india[/URL – [URL=https://breathejphotography.com/drug/levofloxacin/ – buying levofloxacin online[/URL – [URL=https://endmedicaldebt.com/item/jalyn/ – jalyn to buy[/URL – [URL=https://marcagloballlc.com/drug/elimite/ – elimite online usa[/URL – [URL=https://brazosportregionalfmc.org/bactroban/ – bactroban online usa[/URL – bactroban online usa [URL=https://breathejphotography.com/product/vidalista-black/ – tadalafil[/URL – [URL=https://frankfortamerican.com/help-buying-lasix/ – cheepest generic lasix[/URL – [URL=https://transylvaniacare.org/product/ed-sample-pack-2/ – ed sample pack 2 online fast delivery[/URL – [URL=https://sjsbrookfield.org/monuvir/ – monuvir cost[/URL – [URL=https://americanazachary.com/nizagara-capsules-for-sale/ – nizagara price 50[/URL – [URL=https://celmaitare.net/product/tecfidera/ – tecfidera pills canada[/URL – free tecfidera online [URL=https://yourdirectpt.com/pill/doxycycline/ – doxycycline[/URL – [URL=https://pureelegance-decor.com/product/oxsoralen/ – oxsoralen[/URL – [URL=https://andrealangforddesigns.com/pill/rizatriptan/ – rizatriptan without dr prescription[/URL – [URL=https://breathejphotography.com/pomalyst/ – cheap pomalyst online without prescritpion[/URL – [URL=https://youngdental.net/product/daliresp/ – daliresp no prescription[/URL – [URL=https://breathejphotography.com/product/nitrostat/ – nitrostat.com lowest price[/URL – [URL=https://drgranelli.com/product/aubagio/ – aubagio without pres[/URL – aubagio generic pills [URL=https://mrindiagrocers.com/serc/ – serc walmart price[/URL – [URL=https://winterssolutions.com/bimat/ – buy bimat online cheap[/URL – bimat [URL=https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ – generic hydroxychloroquine at walmart[/URL – [URL=https://pureelegance-decor.com/product/tradjenta/ – tradjenta[/URL – [URL=https://endmedicaldebt.com/item/estriol-topical/ – best buy estriol-topical cpx24 ads[/URL – [URL=https://pureelegance-decor.com/product/edarbyclor/ – cost of edarbyclor tablets[/URL – [URL=https://breathejphotography.com/drug/ketoconazole/ – ketoconazole buy in canada[/URL – [URL=https://petralovecoach.com/nemasole/ – nemasole online usa[/URL – [URL=https://ucnewark.com/pred-forte/ – pred forte for sale[/URL – laparoscopes cyproheptadine 4mg prednisone no prescription xarelto prednisone without dr prescription levofloxacin jalyn elimite discount bactroban buy a vidalista-black pills lasix pagamento paypal ed sample pack 2 monuvir buy nizagara 100mg fda approved pharmacy buy tecfidera in england generic doxycycline in canada oxsoralen without an rx rizatriptan en ligne pomalyst overnight daliresp no prescription nitrostat nitrostat online pharmacy mail order aubagio generic serc uk bimat non generic hydroxychloroquine tradjenta coupon estriol topical edarbyclor on line edarbyclor information overnight ketoconazole nemasole pred forte from canada abuse, https://weddingadviceuk.com/item/cyproheptadine/ https://umichicago.com/prednisone-no-prescription/ prednisone walmart price https://youngdental.net/product/xarelto/ https://rinconprweddingplanner.com/drugs/prednisone-without-dr-prescription/ https://breathejphotography.com/drug/levofloxacin/ https://endmedicaldebt.com/item/jalyn/ https://marcagloballlc.com/drug/elimite/ https://brazosportregionalfmc.org/bactroban/ bactroban https://breathejphotography.com/product/vidalista-black/ https://frankfortamerican.com/help-buying-lasix/ https://transylvaniacare.org/product/ed-sample-pack-2/ https://sjsbrookfield.org/monuvir/ https://americanazachary.com/nizagara-capsules-for-sale/ https://celmaitare.net/product/tecfidera/ tecfidera https://yourdirectpt.com/pill/doxycycline/ https://pureelegance-decor.com/product/oxsoralen/ https://andrealangforddesigns.com/pill/rizatriptan/ https://breathejphotography.com/pomalyst/ https://youngdental.net/product/daliresp/ https://breathejphotography.com/product/nitrostat/ https://drgranelli.com/product/aubagio/ aubagio https://mrindiagrocers.com/serc/ https://winterssolutions.com/bimat/ https://charlotteelliottinc.com/item/hydroxychloroquine-online-no-script/ https://pureelegance-decor.com/product/tradjenta/ https://endmedicaldebt.com/item/estriol-topical/ https://pureelegance-decor.com/product/edarbyclor/ https://breathejphotography.com/drug/ketoconazole/ https://petralovecoach.com/nemasole/ https://ucnewark.com/pred-forte/ parasitic carotenaemia, cytokines.
A big thank you for your blog.Really looking forward to read more. Fantastic.
The centrally buy tamoxifen generic canada generic hydroxychloroquine uk generic phenytoin lowest price generic tenofovir-emtricitabine phenergan syrup on line buy cartia no prescription bisacodyl 5mg overnight labetalol generic tadalafil free generic for cialis brand kombiglyze xr en ligne lowest serc prices mail order tadalafil metaxalone 400mg cyclogyl hiforce-delay in nanaimo buy vpxl without prescription buying vitara v 20 uk cheap generic lasix tablets best prices on phenazopyridine in toronto travatan walmart price cheap apcalis-oral-jelly walmart apcalis oral jelly in usa buy levitra online generic lasix from canada cefdinir 300mg overnight perindopril vpxl victoza from canada victoza tablets prednisone without a doctors prescription prednisone prednisolone offering tamoxifen 10mg hydroxychloroquine generic phenytoin tenofovir-emtricitabine without prescription phenergan syrup on line cartia overnight bisacodyl 5mg generic labetalol at walmart tadalafil generic for cialis overnight brand kombiglyze xr serc generic canada cost of tadalafil tablets metaxalone non prescription needed usa cheap cyclogyl hiforce-delay 24 h vpxl capsules off label use vitara v 20 lasix best price legally buy phenazopyridine on line canada travatan buy generic apcalis oral jelly canada pharmacy apcalis oral jelly in usa levitra vardenafil lasix coupon where to buy cefdinir perindopril 4mg vpxl online uk liraglutide victoza online pharmacy prednisone without a doctors prescription prednisone prednisolone ageing, confinement, https://cassandraplummer.com/tamoxifen/ https://livinlifepc.com/drugs/hydroxychloroquine/ https://breathejphotography.com/drug/phenytoin/ https://classybodyart.com/item/tenofovir-emtricitabine/ https://bhtla.com/product/phenergan-syrup/ https://endmedicaldebt.com/cartia/ cartia https://youngdental.net/drug/bisacodyl/ https://leadsforweed.com/product/labetalol/ https://mrcpromotions.com/tadalafil/ https://heavenlyhappyhour.com/lowest-cialis-prices/ https://endmedicaldebt.com/item/brand-kombiglyze-xr/ https://mrindiagrocers.com/serc/ https://bayridersgroup.com/tadalafil-generic/ https://cubscoutpack152.org/metaxalone/ https://myhealthincheck.com/cyclogyl/ https://myhealthincheck.com/hiforce-delay/ https://mplseye.com/product/vpxl/ https://reso-nation.org/vitara-v-20/ https://advantagecarpetca.com/lasix/ https://mrindiagrocers.com/phenazopyridine/ https://computer-filerecovery.net/travatan/ https://endmedicaldebt.com/item/apcalis-oral-jelly/ https://livinlifepc.com/levitra-20mg/ https://productreviewtheme.org/lasix-100mg/ https://endmedicaldebt.com/item/cefdinir/ where to buy cefdinir https://breathejphotography.com/product/perindopril/ https://teenabortionissues.com/vpxl/ https://leadsforweed.com/product/victoza/ https://computer-filerecovery.net/prednisone-canadian-pharmacy/ prednisone from india https://livinlifepc.com/prednisone-for-dogs-no-prescription/ meatus; eplerenone: counselling apparent.
Все о дизайне интерьера
Все о дизайне интерьера
Промокод BetWinner- 937999. Новые пользователи букмекерской компании Betwinner могут воспользоваться приветственным бонусом в размере 100% от суммы депозита до €100 (или эквивалентной суммы в другой валюте). Фрибеты в БетВиннер чаще появляются в рамках периодических акций. Иногда такая привилегия касается новых игроков, но чаще всего поощрение получают постоянные.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
buysteriodsonline.com
그리고는 화면을 들어올렸다가 천천히 내렸다.
USIIC.CO is a unique platform created for bloggers and authors who want to publish interesting articles, create groups to attract subscribers and earn money from their content. Community https://usiic.co It is open to anyone who wants to share their ideas and creativity with the whole world.PUBLISH INTERESTING ARTICLES, FOR FREE. CREATE A GROUP TO ATTRACT SUBSCRIBERS. BECOME THE BEST AUTHOR AND MAKE EARNINGS WITH US.
donmhomes.com
非常に有益な情報が満載で、読み応えがありました。
game1kb.com
조금 우울하다고만 말했지만 심장이 바늘로 찌르는 것 같았다.
РАБОТА ДЛЯ ДЕВУШЕК В МОСКВЕ.
работа для девушек эскорт
Реальный высокий доход, +хорошие чаевые и различные дополнительные бонусы. Работа на территории клиента. Индивидуальный подход и гибкий график.Гарантируем безопасность, ежедневные выплаты и абсолютную конфиденциальность! Дружный коллектив! МНОГО РАБОТЫ. График работы с 21.00 – 6.00.
Промокод BetWinner- 937999. Новые пользователи букмекерской компании Betwinner могут воспользоваться приветственным бонусом в размере 100% от суммы депозита до €100 (или эквивалентной суммы в другой валюте). Фрибеты в БетВиннер чаще появляются в рамках периодических акций. Иногда такая привилегия касается новых игроков, но чаще всего поощрение получают постоянные.
https://vsiknygy.net.ua/wp-content/pages/betwinner_promokod_2020.html
thephotoretouch.com
하나님은 그들에게 부를 주셨지만 그들은 그것을 낭비했습니다.
nikontinoll.com
모든 관리들이 이 말을 듣고 다시 혼란스러워하며 팡지판을 바라보았다.