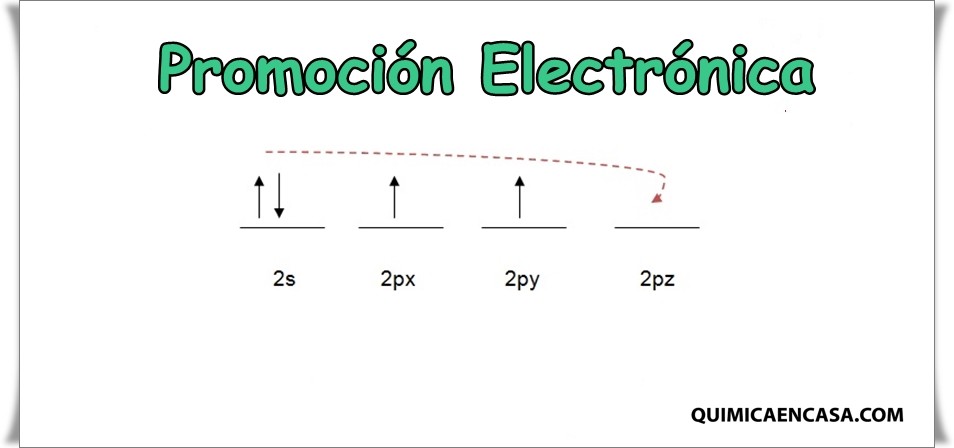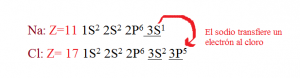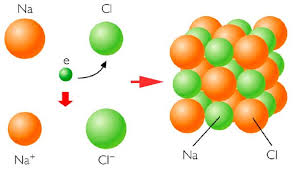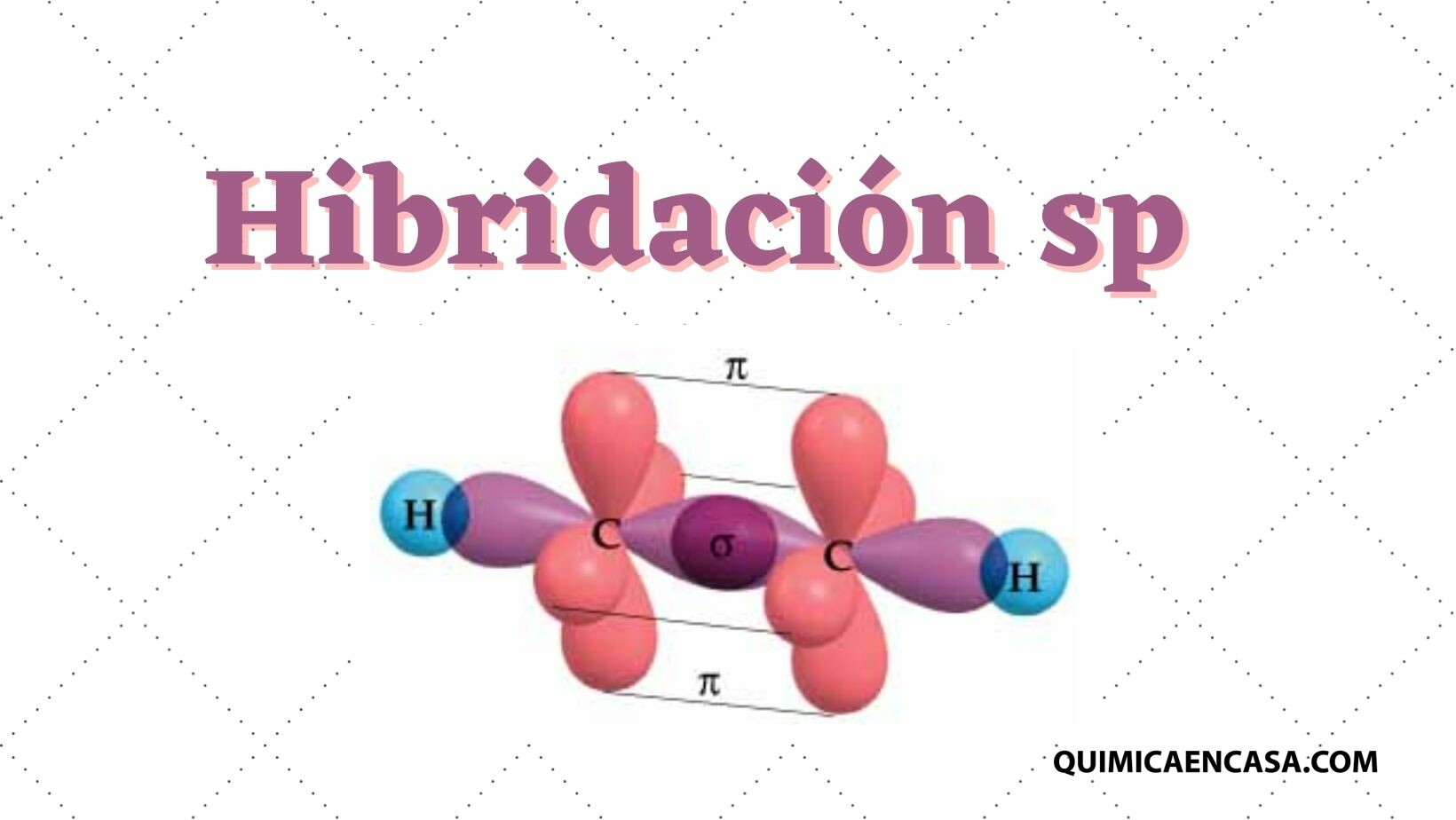
La hibridación sp consiste en la combinación de un orbital atómico s con un orbital p, permitiendo la formación de 2 orbitales sp híbridos, generando una alta repulsión formando ángulos de 180º, dando como resultado una molécula con 2 orbitales p en estado puro y un electrón sin hibridar.
Este tipo de hibridación, al producir enlaces de 180º, toma una forma geométrica del tipo lineal, el cual es común en los compuestos orgánicos alquinos, es decir aquellos que poseen triple enlace carbono-carbono (C≡C). Compuestos como el etino, propino, butino, fluoruro de berilio, entre otros, poseen hibridación sp.Leer más…«Hibridación sp»